Молекулярная биология, 2020, T. 54, № 3, стр. 512-521
Замена гидроксилированного остатка His39 в рибосомном белке uL15 на остаток Ala или Thr нарушает трансляционную активность рибосом человека
Д. Д. Яньшина a, А. В. Гопаненко a, Г. Г. Карпова a, b, А. А. Малыгин a, b, *
a Институт химической биологии и фундаментальной медицины Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
b Новосибирский государственный университет
630090 Новосибирск, Россия
* E-mail: malygin@niboch.nsc.ru
Поступила в редакцию 30.07.2019
После доработки 21.01.2020
Принята к публикации 21.01.2020
Аннотация
Посттрансляционное гидроксилирование встречается у трех рибосомных белков млекопитающих: uS12, uL2 и uL15, ‒ которые расположены соответственно, в малой (S) и большой (L) субчастицах рибосомы вблизи ее важнейших функциональных центров – декодирующего и пептидилтрансферазного. Используя клеточные культуры, продуцирующие белок uL15, меченный 3xFLAG-эпитопом по С-концу (uL153xFLAG), или мутантные формы uL153xFLAG с заменами His39Ala, His39Thr или His40Ala, мы исследовали роль гидроксилированного остатка His39 белка uL15 в поддержании трансляционной активности рибосом. Установлено, что экзогенный uL153xFLAG способен функционально замещать эндогенный uL15 в клетках HEK293, трансфицированных соответствующей ДНК-конструкцией. Вместе с тем в клетках, продуцирующих вышеуказанные мутантные формы uL153xFLAG, трансляционная активность рибосом снижалась примерно на 35% по сравнению с клетками, продуцирующими немутированный белок. С помощью анализа структурной модели рибосомы человека нами сделано предположение о роли гидроксильной группы на His39 в локальной стабилизации структуры рибосомы ‒ через образование водородной связи между этой группой и атомом азота имидазольного кольца His40. Учитывая, что His39 располагается вблизи E-сайта рибосомы, мы полагаем, что такая стабилизация структуры рибосомы обеспечивает поддержание ее трансляционной активности.
ВВЕДЕНИЕ
Известно, что активность рибосомы в процессе биосинтеза белка зависит, прежде всего, от ее структуры, которую формируют рРНК и рибосомные белки [1–4]. Основная часть белков в составе эукариотической рибосомы не содержит посттрансляционных модификаций [5, 6], хотя некоторые рибосомные белки могут быть фосфорилированы [7, 8], метилированы [9] или гидроксилированы [10, 11]. Среди белков, которые подвергаются гидроксилированию, три рибосомных белка: uL2, uL15 и uS12 (до принятия новой номенклатуры рибосомных белков [12] их обозначали как L8, L27A и S23 соответственно [13]). Реакцию гидроксилирования катализируют так называемые рибосомальные оксигеназы, которые обозначают как ROX [12] или RIOX [14]. Оксигеназа RIOX1 (NO66) отвечает за гидроксилирование остатка His216 в белке uL2, оксигеназа RIOX2 (MINA53) – остатка His39 в белке uL15 [10], а оксигеназа OGFOD1 – остатка Pro62 в белке uS12 [11]. Все три белка расположены вблизи функциональных центров рибосомы (см. [13, 15]), из чего можно предполагать важность гидроксилирования этих белков для ее трансляционной активности.
Белок uS12 лежит в декодирующем центре малой (40S) субчастицы рибосомы и участвует в поддержании точности трансляции и определении стоп-кодона [16, 17]. В исследованиях, выполненных на клетках эмбрионов мыши с использованием бицистронных конструкций с различными стоп-кодонами, показано, что, когда белок uS12 гидроксилирован, эффективность терминации трансляции на всех стоп-кодонах ниже, чем в опытах с негидроксилированным белком [11]. Вместе с тем гидроксилирование белка uS12 не оказывало влияния на сборку 40S субчастиц и инициацию трансляции. На основании этих данных было высказано предположение, что гидроксилирование Pro62 в белке uS12 модулирует трансляцию [11].
Белок uL2 расположен в большой (60S) субчастице рибосомы в районе каталитического центра; при этом остаток His216, несущий гидроксильную группу, находится непосредственно вблизи места связывания акцепторного стебля тРНК в Р-участке и контактирует со спиралью Н93 28S рРНК [18]. В предыдущей работе с помощью химического футпринтинга мы показали, что гидроксильная группа на остатке His216 при связывании белка uL2 с 28S рРНК способствует таким конформационным перестройкам в участке связывания, которые делают его структуру похожей на структуру соответствующего участка в зрелых 60S субчастицах [19]. В этой же работе было предсказано расположение гидроксильной группы на остатке His216, при котором белок uL2 стабилизирует структуру 28S рРНК в участке связывания.
В представленной работе исследован вклад гидроксилированого остатка His39 рибосомного белка uL15, расположенного, как и белок uL2, вблизи каталитического центра рибосомы [18], в поддержание ее трансляционной активности. Используя клетки HEK293, трансфицированные плазмидными конструкциями, кодирующими FLAG-меченый белок uL15 или его мутантные формы с заменами в позициях His39 и His40, мы определили, влияют ли такие замены на способность белка встраиваться в 60S субчастицы и на трансляционную активность рибосом. Выявлена важность гидроксилированного остатка His39 и соседнего остатка His40 в белке uL15 для трансляционной активности рибосом in vivo. На основании полученных данных и анализа структуры рибосомы человека сделано предположение о роли гидроксилирования остатка His39 белка uL15 в поддержании функционально активной структуры рибосомы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и оборудование. В работе использовали агарозу, акриламид и N,N ′-метиленбисакрил-амид (“AppliChem”, Германия), пептон, дрожжевой экстракт Type D (“Helicon”, Россия), среду DMEM, фетальную сыворотку крупного рогатого скота (FBS), раствор пенициллина-стрептомицина, ингибитор РНКаз RiboLock, трансфектант Turbofect (“ThermoFisher Scientific”, США), смолу Strata-Clean (“Stratagene”, США), ДНК-полимеразу Phusion, эндонуклеазу рестрикции DpnI (“New England Biolabs”, США), (белок G)-содержащие магнитные частицы (“Dynabeads”, США), моноклональные антитела анти-FLAG M5 и анти-FLAG M2 (“Sigma-Aldrich”, США), а также компетентные клетки Escherichia сoli штамма XL1-Blue и клетки линии HEK293 (ATCC CRL-1573). Для выделения плазмид использовали наборы GeneJET Plasmid Miniprep Kit и GeneJET Plasmid Midiprep Kit (“ThermoFisher Scientific”). Taq ДНК-полимераза (5000 ед./мл) получена в лаборатории биоорганической химии ферментов ИХБФМ СО РАН. Олигодезоксирибонуклеотиды синтезированы в лаборатории медицинской химии ИХБФМ СО РАН. Секвенирование ДНК проведено в Центре коллективного пользования “Геномика” СО РАН на базе ИХБФМ СО РАН. Масс-спектры сняты на MALDI-TOF масс-спектрометре REFLEX III, оснащенном импульсным N2-лазером (337 нм) в Центре масс-спектроскопического анализа ИХБФМ СО РАН. Рибосомные субчастицы из плаценты человека выделяли, как описано ранее [20].
Выделение рибосомных белков для MALDI-TOF масс-спектрометрического анализа. Рибосомные белки экстрагировали из 60S субчастиц уксусной кислотой с последующим осаждением ацетоном [21]. Белки разделяли электрофорезом в 15%-ном полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (SDS) [22]. Гель окрашивали Кумасси бриллиантовым синим R250 и полосу, соответствующую рибосомному белку uL15, вырезали из геля и обрабатывали трипсином, как описано ранее [23]. Продукты трипсинолиза анализировали MALDI-TOF масс-спектрометрией [23]; результаты масс-спектрометрии обрабатывали с помощью программы mMass 5.4 [24] и сервиса Mascot.
Клонирование кДНК рибосомного белка uL15 в плазмиду pcDNA3. кДНК рибосомного белка uL15, несущую на 3′-конце последовательность, кодирующую 3xFLAG-пептид и содержащую сайты узнавания эндонуклеазами рестрикции BamHI и EcoRI, получали с помощью ПЦР в 2 этапа. В качестве матрицы для проведения ПЦР использовали суммарную кДНК человека, полученную, как описано ранее [25]. На первом этапе, используя праймеры F-uL15 и R-FLAGuL15 (табл. 1), получали ПЦР-продукт, соответствующий кодирующей части мРНК рибосомного белка uL15. На втором этапе этот ПЦР-продукт был амплифицирован с использованием праймеров F-uL15 и R-3xFLAGUni (см. табл. 1) для встраивания последовательности, соответствующей 3xFLAG-пептиду. Полученный ПЦР-продукт обрабатывали эндонуклеазами рестрикции BamHI и EcoRI и клонировали в вектор pcDNA3 по этим же сайтам рестрикции. Итоговую плазмиду pcDNA3-uL153xFLAG нарабатывали в клетках E. coli штамма XL1-Blue.
Таблица 1.
Олигодезоксирибонуклеотиды, использованные в работе
| Название | Последовательность |
|---|---|
| F-uL15 | 5'-gggaattcatgccatccagactgaggaagac-3' |
| R-FLAGuL15 | 5'-gatgtcatgatctttataatcaccgtcatggtctttgtagtcagccaccaggacacag-3' |
| R-3xFLAGUni | 5'-ccgaattctcacttgtcgtcatcgtctttgtagtcgatgtcatgatctttataatcaccg-3' |
| uL15(H39A)F | 5'-ggtaatgctggtggtctggctcaccaccggatcaacttcgacaaatac-3' |
| uL15(H39A)R | 5'-gtatttgtcgaagttgatccggtggtgagccagaccaccagcattacc-3' |
| uL15(H40A)F | 5'-ggtaatgctggtggtctgcatgcccaccggatcaacttcgacaaatac-3' |
| uL15(H40A)R | 5'-gtatttgtcgaagttgatccggtgggcatgcagaccaccagcattacc-3' |
| uL15(H39T)F | 5'-ggtaatgctggtggtctgacccaccaccggatcaacttcgacaaatac-3' |
| uL15(H39T)R | 5'-gtatttgtcgaagttgatccggtggtgggtcagaccaccagcattacc-3' |
Получение плазмид pcDNA3-uL15(H39A)3xFLAG, pcDNA3-uL15(H39T)3xFLAG и pcDNA3-uL15(H40A)3xFLAG. Мутации в кДНК рибосомного белка uL15, соответствующие заменам аминокислотных остатков His39 и His40 на Ala, а также замене His39 на Thr, вводили с помощью сайт-направленного мутагенеза [26], используя в качестве матрицы плазмиду pcDNA3-uL153xFLAG, пары праймеров: uL15(H39A)F и uL15(H39A)R, uL15(H40A)F и uL15(H40A)R, uL15(H39T)F и uL15(H39T)R (табл. 1) ‒ и ДНК-полимеразу Phusion.
Трансфекция клеток HEK293 плазмидными конструкциями pcDNA3-uL15(H39A)3xFLAG, pcDNA3-uL15(H39T)3xFLAG и pcDNA3-uL15(H40A)3xFLAG. Клетки HEK293 культивировали в 10-см чашках Петри, содержащих DMEM, 10% FBS и 100 ед./мл пенициллина-стрептомицина, в CO2-инкубаторе (5% CO2) при 37°С. По достижении клетками плотности 50‒60% проводили их трансфекцию плазмидными конструкциями с помощью трансфектанта Turbofect, согласно инструкции производителя. Через 48 ч инкубации клетки промывали ледяным фосфатно-солевым буфером (PBS), содержащим циклогексимид в концентрации 100 мкг/мл, и снимали с чашек Петри.
Анализ встраивания uL153xFLAG в рибосомы. Осажденные клетки лизировали в буфере 20 мМ HEPES-KOH (рН 7.5), содержащем 15 мМ MgCl2, 200 мМ KCl, 1% Тритон-Х100, 2 мМ DTT, 100 мкг/мл циклогексимида и 25 U/мл ингибитора РНКазы RiboLock. Лизат осветляли центрифугированием при 14 000 об./мин в течение 10 мин при 4°С, наслаивали на линейный градиент 7–47%-ной сахарозы в буфере 50 мМ Трис-HCl (рН 7.5), содержащем 50 мМ NH4Cl, 12 мM МgCl2 и 1 мМ DTT, и центрифугировали при 100 000 × g на роторе SW-40 (“Beckman”, США) в течение 4.5 ч при 4°С. После центрифугирования содержимое пробирок фракционировали, регистрируя оптическую плотность при длине волны 260 нм. Для расчета соотношения количества рибосом в полисомах и моносомах (Р/М) профили седиментации оцифровывали в программе OriginPro 9.1 (OriginLab) и вычисляли интегральную оптическую плотность, приходящуюся на пики полисом и монорибосом. Суммарный белок из фракций градиента выделяли связыванием со смолой StrataСlean и после разделения электрофорезом в 15%-ном SDS-ПААГ анализировали с помощью иммуноблотинга, используя антитела против FLAG M5. Эксперимент проводили в трех повторах.
Анализ доли uL153xFLAG-содержащих рибосом. Трансфицированные плазмидой pcDNA3-uL153xFLAG клетки культивировали, снимали и лизировали, как указано выше. Для диссоциации рибосом на субчастицы осветленный лизат обрабатывали пуромицином и 0.5 М KCl, как описано ранее [20]. Субчастицы разделяли центрифугированием в градиенте 10–30% концентрации сахарозы в буфере 50 мМ Трис-HCl (рН 7.5), содержащем 0.5 М KCl, 4 мM МgCl2 и 1 мМ DTT, при 24000 об./мин на роторе SW-40 (“Beckman”) в течение 17.5 ч при 4°С. 60S рибосомные субчастицы из соответствующей фракции градиента осаждали эквивалентным объемом этанола, растворяли в 100 мкл буфера 50 мМ Трис-HCl (рН 7.5), содержащего 100 мМ NaCl и 10 мM МgCl2 (буфер А), и инкубировали с 5 мкл (белок G)-содержащих магнитных частиц с иммобилизованными антителами анти-FLAG M2 в течение 16 ч при 4°С при перемешивании. По окончании инкубации частицы отделяли от супернатанта на магнитном сепараторе, промывали 2 раза 100-мкл аликвотами буфера A, которые затем объединяли с супернатантом. Диссоциацию 60S субчастиц, связавшихся с магнитными частицами, проводили в 1%-ном SDS с последующей фенольной депротеинизацией смеси. Количество РНК в водной фазе определяли спектрофотометрически при 260 нм. Из супернатанта 60S субчастицы, не связавшиеся с магнитными частицами, осаждали эквивалентным объемом этанола, предварительно отобрав 1/10 часть для анализа на отсутствие белка uL153xFLAG иммуноблотингом, как описано выше. Осадок 60S субчастиц растворяли в воде, выделяли РНК и определяли ее количество, как описано выше.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Определение гидроксилирования белка uL15 в рибосомах из плаценты человека
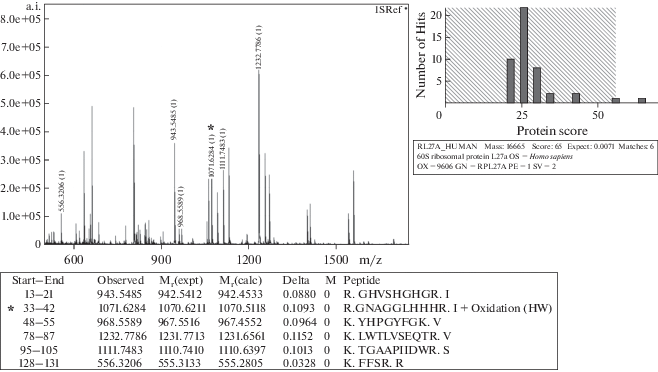
Гидроксилирование рибосомного белка uL15 ранее изучали на культурах клеток млекопитающих [10]. С целью убедиться, что белок uL15 гидроксилирован в рибосомах тканей человека, мы получили препарат 60S субчастиц рибосом из послеродовой плаценты и выделили из него суммарный рибосомный белок, который подвергли электрофорезу в 15%-ном SDS-ПААГ. Полосы белков с молекулярной массой около 17 кДа анализировали с помощью масс-спектрометрии MALDI-TOF. В одной из полос достоверно идентифицирован рибосомный белок uL15 (рис. 1), которому соответствовали 6 пептидов в масс-спектре, причем масса одного из пептидов совпадала с массой пептида 33‒42 с гидроксилированным остатком His39, тогда как соответствующего негидроксилированного пептида не обнаружено. Это доказывает, что белок uL15, присутствующий в рибосомах нормальных тканей человека, гидроксилирован по остатку His39.
Рис. 1.
Идентификация гидроксилированного белка uL15 в 60S субчастицах рибосом из плаценты человека. Слева вверху: MALDI-TOF спектр трипсинового гидролизата полосы геля, содержащей белок uL15. Массы пептидов белка uL15 указаны, гидроксилированный пептид отмечен звездочкой. Внизу: панель, генерированная программой Mascot при анализе масс-спектра, с указанием (столбцы слева направо) обнаруженных пептидов белка uL15, их молекулярных масс: наблюдаемых, экспериментальных, рассчитанных, ‒ разницы между теоретической и экспериментально определенной величиной Мr и первичной структуры каждого пептида. Гидроксилированный пептид отмечен звездочкой. Справа вверху: определение статистической достоверности идентификации белка uL15 (RPL27A, согласно прежней номенклатуре) в программе Mascot. Полученный коэффициент 65 (Protein Score) указывает на высокую достоверность идентификации белка (для коэффициентов выше 59 р-значение меньше 0.05). Number of Hits ‒ число белков с соответствующим коэффициентом, обнаруженных программой для масс-спектра.
Синтез экзогенного FLAG-меченого белка uL15 в трансфицированных клетках HEK293 и определение его активности
С целью проследить за поведением экзогенного рибосомного белка uL15 в трансфицированных клетках на С-конец этого белка добавляли иммуногенный эпитоп 3xFLAG, позволяющий определять меченные им белки с использованием коммерческих антител. Для этого ДНК-фрагмент, кодирующий белок uL15 человека и слитый с ним 3xFLAG-эпитоп, клонировали в вектор pcDNA3 и получали плазмиду pcDNA-uL153xFLAG. Клетки HEK293, трансфицированные плазмидой pcDNA-uL153xFLAG, лизировали, и полученный лизат разделяли центрифугированием в градиенте плотности сахарозы с последующим фракционированием содержимого градиента и определением содержания целевого белка во фракциях 60S субчастиц, рибосом и полисом (рис. 2). Экзогенный рибосомный белок uL153xFLAG обнаружен во всех исследованных фракциях градиента, включая фракции, содержащие 60S субчастицы, 80S рибосомы (моносомы), а также “легкие” (до 3 моносом включительно) и “тяжелые” (более 3 моносом) полисомы (рис. 2). На основании этих данных можно сделать вывод, что 3xFLAG-эпитоп не препятствует встраиванию белка в 60S субчастицы, причем содержащие его субчастицы проявляют активность на всех стадиях трансляции, включая формирование 80S рибосом и их функционирование в составе полисом.
Рис. 2.
Определение содержания экзогенного рибосомного белка uL153xFLAG в транслирующих рибосомах. Вверху: профиль седиментации лизата клеток HEK293, продуцирующих белок uL153xFLAG, в градиенте концентраций сахарозы 10‒45%. Отмечены пики, соответствующие 40S рабосомным субчастицам, 80S рибосомам и полисомам. Пики 60S рибосомных субчастиц и 80S рибосом в этих условиях центрифугирования не разделяются. Внизу: идентификация белка uL153xFLAG в соответствующих фракциях сахарозного градиента с помощью иммуноблотинга с использованием антител против FLAG-эпитопа. Наличие белка uL153xFLAG во фракции, содержащей 40S субчастицы, связано с частичным наложением пиков 40S и 60S субчастиц в данных условиях центрифугирования и с некоторым загрязнением пика 40S субчастиц содержимым из верхних фракций, содержащих большое количество этого белка.
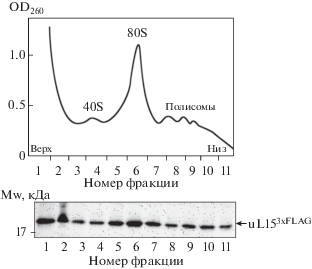
Для оценки доли рибосом, содержащих экзогенный белок uL153xFLAG, в трансфицированных клетках HEK293 в соответствующем препарате 60S рибосомных субчастиц определяли содержание субчастиц, способных и не способных связываться с антителами против FLAG-эпитопа, используя метод иммунопреципитации. Установлено, что доля 3xFLAG-содержащих 60S субчастиц составляет 35 ± 3% от их общего числа в трансфицированных клетках. Таким образом, при выбранных условиях трансфекции клеток HEK293 плазмидой pcDNA-uL153xFLAG примерно треть рибосом содержит экзогенный белок.
Влияние замен His39Ala и His39Thr в белке uL153xFLAG на активность рибосом
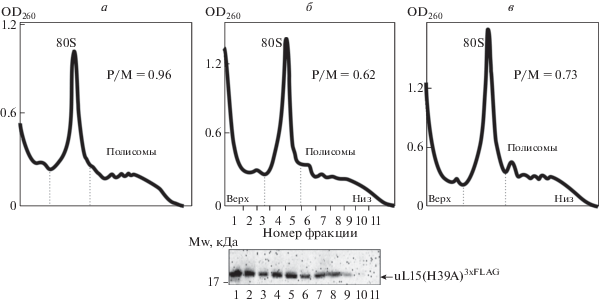
Учитывая, что белок uL15 практически полностью гидроксилирован по остатку His39, как в рибосомах из плаценты человека (см. выше), так и в рибосомах из клеток HeLa [10], мы пришли к заключению, что в клетках НЕК293 этот белок также полностью гидроксилирован по His39. Для выяснения роли гидроксилированного остатка His39 в uL15 в экзогенный белок uL153xFLAG вводили аминокислотные замены His39Ala и His39Thr. В первом случае гидроксилирования мутантного белка не происходило вообще, тогда как во втором случае гидроксильная группа присутствовала на атоме Cβ боковой цепи Thr39. Как и в предыдущем эксперименте, клетки трансфицировали соответствующими плазмидными конструкциями и полученные затем лизаты фракционировали центрифугированием в сахарозном градиенте (рис. 3). По сравнению с клетками, продуцирующими белок uL153xFLAG без мутаций, в лизате клеток, продуцирующих мутантные белки, соотношение интегральной оптической плотности, приходящейся на полисомы, к таковой для моносом (80S рибосомы) было снижено приблизительно на 1/3 (рис. 3). Это означает, что при продуцировании клетками мутантных форм белка uL15 с заменами His39Ala или His39Thr трансляционная активность рибосом сильно снижена. Кроме того, при анализе содержания мутантного белка uL15(H39A)3xFLAG во фракциях соответствующего полисомного профиля выявлено, что его практически нет во фракциях “тяжелых” полисом (рис. 3б) в отличие от белка дикого типа (рис. 2). Таким образом, на основании полученных данных можно сделать вывод о том, что гидроксилированый остаток His39 в рибосомном белке uL15 важен для трансляционной активности рибосом.
Рис. 3.
Сравнение трансляционной активности рибосом в клетках, продуцирующих экзогенный рибосомный белок uL153xFLAG или его мутантные формы с заменами His39Ala и His39Thr. Профили седиментации лизатов клеток HEK293, продуцирующих белки uL153xFLAG (а), uL15(H39A)3xFLAG (б) и uL15(H39Т)3xFLAG (в), в градиенте концентраций сахарозы (10‒45%). На панелях приведено отношение интегральных оптических плотностей областей полисом и моносом (Р/М), отмеченных пунктирными линиями. Относительная ошибка измерений отношения Р/М составляла не более 10%. Под панелью б приведен Вестерн-блот-анализ содержания белка uL15(H39A)3xFLAG в соответствующих фракциях сахарозного градиента с использованием антител против FLAG-эпитопа. Причина наличия 3хFLAG-меченого белка во фракции 40S субчастиц та же, что и на рис. 2.
Анализ расположения гидроксилированного остатка His39 в белке uL15 и его окружения в составе рибосомы человека
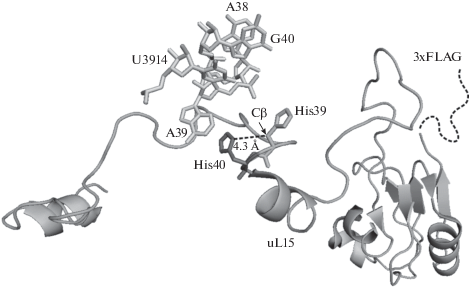
С целью выяснить, как гидроксильная группа на остатке His39 белка uL15 может быть вовлечена в поддержание функционально активной структуры рибосомы, мы проанализировали атомарную структуру рибосомы человека, ранее полученную с помощью криоэлектронной микроскопии (крио-ЭМ) [18]. Следует отметить, что атом кислорода гидроксильной группы остатка His39 отсутствует на этой структуре, по-видимому, из-за недостаточного разрешения крио-ЭМ, поэтому ориентация этой гидроксильной группы неизвестна. На расстоянии 14 Å от остатка His39 располагается акцепторный стебель тРНК в E‑сайте рибосомы. Следовательно, можно ожидать, что структура этой области важна для функциональной активности рибосомы. Расстояния между атомом Cβ остатка His39 и атомами соседних аминокислотных и нуклеотидных остатков превышают 5.5 Å. Из этого следует, что гидроксильная группа на остатке His39, даже с учетом длины связи C–O (1.43 Å), не может формировать водородные связи со своим окружением. Исключение составляет расстояние между атомом Cβ остатка His39 и атомом Nδ соседнего остатка His40, которое равно 4.3 Å. На основании длин связей C–O и N–H (1 Å) можно предположить, что гидроксильная группа на остатке His39 образует водородную связь с атомом азота имидазольного кольца остатка His40 (рис. 4). Действительно, расположение остатка His40 на крио-ЭМ-модели рибосомы позволяет предположить его участие в поддержании структуры 60S субчастицы через стабилизацию положения нуклеотидного остатка А39 28S рРНК, вывернутого из стекинга, формируемого остатками А38 и G40 (рис. 4). Таким образом, водородная связь между остатками His39 и His40 может поддерживать как их конформацию, так и близлежащей области 28S рРНК в рибосоме. Следовательно, остаток His40 в белке uL15 также важен для поддержания функционально активной структуры рибосомы, как и гидроксилированный остаток His39.
Рис. 4.
Расположение остатков His39 и His40 в белке uL15 в составе рибосомы человека. Структура белка и отдельных нуклеотидов 28S рРНК вычленена из структуры 80S рибосомы (PDB Acc. No. 4V6X), разрешенной с помощью крио-ЭМ [18]. Номера нуклеотидов в районе остатков His39 и His40 отмечены. Прямой пунктирной линией обозначено расстояние между атомом Cβ остатка His39 и атомом Nδ остатка His40. Пунктирной кривой изображен С-концевой пептид 3хFLAG в экзогенном белке.
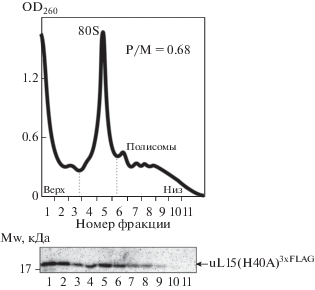
Влияние замены His40Ala в белке uL15 3xFLAG на активность рибосом
С целью проверить предложенную выше гипотезу мы внесли мутацию в плазмиду pcDNA-uL153xFLAG, заменив кодон для His40 на кодон для Ala. При анализе полисомного профиля лизата клеток НЕК293, трансфицированных этой плазмидой (рис. 5), как и в профиле лизата клеток, продуцирующих мутантный белок uL15(H39A)3xFLAG (рис. 3б), выявлен дефицит полисом (по сравнению с полисомным профилем лизата клеток, продуцирующих белок дикого типа). Распределение мутантного белка uL15(H40A)3xFLAG во фракциях сахарозного градиента (рис. 5) также оказалось аналогичным таковому для мутантного белка uL15(H39A)3xFLAG (рис. 3б) ‒ белок uL15(H40A)3xFLAG практически отсутствовал во фракциях “тяжелых” полисом. На основании всех полученных нами данных логично предположить, что остаток His40, как и гидроксилированный His39, в белке uL15 важен для поддержания функционально активной структуры рибосомы. Предполагаемая водородная связь между атомом азота имидазольного кольца остатка His40 и гидроксильной группой His39, скорее всего, стабилизирует конформацию обоих этих остатков и тем самым поддерживает структуру рибосомы вблизи Е-сайта.
Рис. 5.
Определение трансляционной активности рибосом в клетках, продуцирующих экзогенный мутантный рибосомный белок uL15(Н40А)3xFLAG, и идентификация этого белка в транслирующих рибосомах. Обозначения см. на рис. 3. Причина нахождения 3хFLAG-меченого белка во фракции 40S субчастиц та же, что и на рис. 2.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нами показано, что в рибосомах из плаценты человека белок uL15 гидроксилирован по остатку His39. Создана плазмидная конструкция, позволяющая продуцировать в транзиентно трансфицированных клетках HEK293 рибосомный белок uL153xFLAG, и продемонстрировано, что белок встраивается в 60S рибосомные субчастицы, которые участвуют в формировании активных в трансляции 80S рибосом. Установлено, что мутации по остатку His39, лишающие белок uL153xFLAG способности к гидроксилированию, не препятствуют его встраиванию в 60S субчастицы, но снижают уровень полисом в клетках; при этом мутантная форма His39Ala этого белка практически отсутствует в “тяжелых” полисомах. Используя крио-ЭМ структуру рибосомы человека [18] и моделируя на ней расположение гидроксильной группы His39, мы предположили, что гидроксилирование белка uL15 по His39 необходимо для конформационной стабилизации остатков His39 и His40, так как мутация His40Ala имела такой же эффект, что и мутация His39Ala.
Снижение относительного уровня полисом при продуцировании трансфицированными клетками HEK293 мутантных форм белка uL153xFLAG означает, что значительная часть рибосом в этих клетках не может транслировать мРНК так же эффективно, как рибосомы в клетках, продуцирующих немутированный белок. Можно полагать, что частичное снижение эффективности трансляции, а не полное ее блокирование, в клетках с мутантными формами белка uL153xFLAG связано с наличием в клетках пула рибосом с эндогенным белком uL15. Действительно, анализ связывания 60S субчастиц с антителами против FLAG-эпитопа показал, что в транзиентно трансфицированных клетках одновременно присутствуют рибосомы как с эндогенным белком uL15 (65%), так и с экзогенным uL153xFLAG или его мутантными формами (35% для uL153xFLAG). Присутствие uL153xFLAG с мутациями His39Ala и His40Ala в составе “легких” полисом и их практически полное отсутствие в “тяжелых” полисомах можно объяснить тем, что скорость элонгации трансляции на рибосомах, содержащих мутантные формы белка uL153xFLAG, существенно ниже, чем на рибосомах с немутированным uL153xFLAG. Замедление элонгации может быть связано с тем, что мутации, которые предотвращают гидроксилирование аминокислотного остатка в позиции 39 uL153xFLAG, расположенной вблизи участка связывания акцепторного конца тРНК в Е-сайте (см. выше), приводят к нарушению транслокации тРНК и, следовательно, работы пептидилтрансферазного центра рибосомы. Однако не исключены и другие объяснения наблюдаемого эффекта.
Замена остатка Нis39 в белке uL153xFLAG на Thr приводила к такому же снижению трансляционной активности рибосом, как и замена на Ala, несмотря на то, что гидроксильная группа на His39 и гидроксильная группа остатка Thr находятся в одинаковой стереохимической ориентации. По-видимому, имидазольная группа остатка His39 критически важна для позиционирования гидроксильной группы на атоме Cβ, что необходимо для поддержания рибосомы в функционально активной форме.
Предполагаемая роль гидроксилирования остатка His39 белка uL15 в функционировании рибосомы ‒ через стабилизацию конформации остатков His39 и His40 ‒ напоминает высказанную ранее гипотезу об участии гидроксилированного остатка His216 белка uL2 в поддержании структуры 28S рРНК в 60S субчастице [19]. В рибосомном белке uL2 гидроксильная группа на атоме Cβ остатка His216 может формировать водородную связь с атомом азота имидазольного кольца остатка His218, фиксируя тем самым структуру белка в соответствующем регионе и стабилизируя структуру 28S рРНК в участке связывания белка uL2. Известно, что имидазольные группы остатков гистидина могут выступать как в роли доноров, так и в роли акцепторов водородной связи и поэтому часто бывают вовлечены в формирование третичной структуры белков и во взаимодействие с РНК [27]. В аминокислотном остатке His атом Cβ не обладает хиральностью и имидазольная группа может свободно вращаться вокруг связей Cα−Cβ и Cβ−Cγ. Гидроксилированный Cβ становится хиральным, а гидроксильная группа, при формировании водородной связи с соседней имидазольной, жестко фиксирует ее в структуре рибосомы. Следует отметить, что структура белков uL15 и uL2 в районах локализации остатков His39 и His216 разупорядочена [18]. По-видимому, поддержание надлежащей структуры этих районов рядом с активными центрами рибосомы посредством гидроксилирования аминокислотных остатков может быть критически важно для активности всего аппарата трансляции. Примечательно, что в обоих случаях одна гидроксильная группа может стабилизировать положение сразу двух остатков гистидина, что крайне рационально в условиях ограниченного пространства внутри рибосомы.
На основании полученных данных можно заключить, что гидроксилированный остаток His39 рибосомного белка uL15 важен для поддержания трансляционной активности рибосомы и роль гидроксильной группы может быть связана со стабилизацией структуры рибосомы в районе этого остатка. При гипоксии клеток, сопровождающей многие заболевания, уровень гидроксилирования рибосомных белков, в том числе uL15, понижается из-за ингибирования действия оксигеназ [10]. Это может приводить к снижению общего уровня трансляции в клетках или, при существовании специальных компенсаторных механизмов, к изменению уровня экспрессии отдельных генов. Следовательно, дальнейшие исследования необходимы для выявления связи между нарушением гидроксилирования рибосомных белков и изменением уровня экспрессии генов на стадии трансляции.
Работа поддержана Российским фондом фундаментальных исследований (17-04-00528) и частично базовым бюджетным финансированием ИХБФМ СО РАН (проект АААА-А17-117020210022-4) и финансированием по программе 5-100 Минобрнауки.
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Traub P., Nomura M. (1968) Structure and function of E. coli ribosomes. V. Reconstitution of functionally active 30S ribosomal particles from RNA and proteins. Proc. Natl. Acad. Sci. USA. 59, 777–784.
Melnikov S., Ben-Shem A., Garreau de Loubresse N., Jenner L., Yusupova G., Yusupov M. (2012) One core, two shells: bacterial and eukaryotic ribosomes. Nat. Struct. Mol. Biol. 19, 560–567.
Myasnikov A.G., Kundhavai Natchiar S., Nebout M., Hazemann I., Imbert V., Khatter H., Peyron J.F., Klaholz B.P. (2016) Structure-function insights reveal the human ribosome as a cancer target for antibiotics. Nat. Commun. 7, 12856.
Финкельштейн А.В., Разин С.В., Спирин А.С. (2018) Межсубъединичная подвижность рибосомы. Молекуляр. биология. 52, 921–934.
Vladimirov S.N., Ivanov A.V., Karpova G.G., Musolyamov A.K., Egorov T.A., Thiede B., Wittmann-Liebold B., Otto A. (1996) Characterization of the human small-ribosomal-subunit proteins by N-terminal and internal sequencing, and mass spectrometry. Eur. J. Biochem. 239, 144–149.
Odintsova T.I., Muller E.C., Ivanov A.V., Egorov T.A., Bienert R., Vladimirov S.N., Kostka S., Otto A., Wittmann-Liebold B., Karpova G.G. (2003) Characterization and analysis of posttranslational modifications of the human large cytoplasmic ribosomal subunit proteins by mass spectrometry and Edman sequencing. J. Protein Chem. 22, 249–258.
Mazumder B., Sampath P., Seshadri V., Maitra R.K., DiCorleto P.E., Fox P.L. (2003) Regulated release of L13a from the 60S ribosomal subunit as a mechanism of transcript-specific translational control. Cell. 115, 187–198.
Thomas G., Siegmann M., Kubler A.M., Gordon J., Jimenez de Asua L. (1980) Regulation of 40S ribosomal protein S6 phosphorylation in Swiss mouse 3T3 cells. Cell. 19, 1015–1023.
Shirai A., Sadaie M., Shinmyozu K., Nakayama J. (2010) Methylation of ribosomal protein L42 regulates ribosomal function and stress-adapted cell growth. J. Biol. Chem. 285, 22448–22460.
Ge W., Wolf A., Feng T., Ho C.H., Sekirnik R., Zayer A., Granatino N., Cockman M.E., Loenarz C., Loik N.D., Hardy A.P., Claridge T.D.W., Hamed R.B., Chowdhury R., Gong L., Robinson C.V., Trudgian D.C., Jiang M., Mackeen M.M., McCullagh J.S., Gordiyenko Y., Thalhammer A., Yamamoto A., Yang M., Liu-Yi P., Zhang Z., Schmidt-Zachmann M., Kessler B.M., Ratcliffe P.J., Preston G.M., Coleman M.L., Schofield C.J. (2012) Oxygenase-catalyzed ribosome hydroxylation occurs in prokaryotes and humans. Nat. Chem. Biol. 8, 960–962.
Singleton R.S., Liu-Yi P., Formenti F., Ge W., Sekirnik R., Fischer R., Adam J., Pollard P.J., Wolf A., Thalhammer A., Loenarz C., Flashman E., Yamamoto A., Coleman M.L., Kessler B.M., Wappner P., Schofield C.J., Ratcliffe P.J., Cockman M.E. (2014) OGFOD1 catalyzes prolyl hydroxylation of RPS23 and is involved in translation control and stress granule formation. Proc. Natl. Acad. Sci. USA. 111, 4031–4036.
Ban N., Beckmann R., Cate J.H., Dinman J.D., Dragon F., Ellis S.R., Lafontaine D.L., Lindahl L., Liljas A., Lipton J.M., McAlear M.A., Moore P.B., Noller H.F., Ortega J., Panse V.G., Ramakrishnan V., Spahn C.M., Steitz T.A., Tchorzewski M., Tollervey D., Warren A.J., Williamson J.R., Wilson D., Yonath A., Yusupov M. (2014) A new system for naming ribosomal proteins. Curr. Opin. Struct. Biol. 24, 165–169.
Graifer D., Malygin A., Karpova G. (2019) Hydroxy-lation of protein constituents of the human translation system: structural aspects and functional assignments. Future Med. Chem. 11, 357–369.
Brauer K.E., Brockers K., Moneer J., Feuchtinger A., Wollscheid-Lengeling E., Lengeling A., Wolf A. (2018) Phylogenetic and genomic analyses of the ribosomal oxygenases Riox1 (No66) and Riox2 (Mina53) provide new insights into their evolution. BMC Evol. Biol. 18, 96.
Bundred J.R., Hendrix E., Coleman M.L. (2018) The emerging roles of ribosomal histidyl hydroxylases in cell biology, physiology and disease. Cell. Mol. Life Sci. 75, 4093–4105.
Anthony R.A., Liebman S.W. (1995) Alterations in ribosomal protein RPS28 can diversely affect translational accuracy in Saccharomyces cerevisiae. Genetics. 140, 1247–1258.
Sharma D., Cukras A.R., Rogers E.J., Southworth D.R., Green R. (2007) Mutational analysis of S12 protein and implications for the accuracy of decoding by the ribosome. J. Mol. Biol. 374, 1065‒1076.
Anger A.M., Armache J.P., Berninghausen O., Habeck M., Subklewe M., Wilson D.N., Beckmann R. (2013) Structures of the human and Drosophila 80S ribosome. Nature. 497, 80–85.
Yanshina D.D., Bulygin K.N., Malygin A.A., Karpova G.G. (2015) Hydroxylated histidine of human ribosomal protein uL2 is involved in maintaining the local structure of 28S rRNA in the ribosomal peptidyl transferase center. FEBS J. 282, 1554–1566.
Matasova N.B., Myltseva S.V., Zenkova M.A., Graifer D.M., Vladimirov S.N., Karpova G.G. (1991) Isolation of ribosomal subunits containing intact rRNA from human placenta: estimation of functional activity of 80S ribosomes. Anal. Biochem. 198, 219–223.
Sherton C.C., Wool I.G. (1974) The extraction of proteins from eukaryotic ribosomes and ribosomal subunits. Mol. Gen. Genet. 135, 97–112.
Malygin A.A., Shaulo D.D., Karpova G.G. (2000) Proteins S7, S10, S16 and S19 of the human 40S ribosomal subunit are most resistant to dissociation by salt. Biochim. Biophys. Acta. 1494, 213–216.
Gopanenko A.V., Malygin A.A., Karpova G.G. (2015) Exploring human 40S ribosomal proteins binding to the 18S rRNA fragment containing major 3'-terminal domain. Biochim. Biophys. Acta. 1854, 101–109.
Niedermeyer T.H., Strohalm M. (2012) mMass as a software tool for the annotation of cyclic peptide tandem mass spectra. PLoS One. 7, e44913.
Malygin A., Baranovskaya O., Ivanov A., Karpova G. (2003) Expression and purification of human ribosomal proteins S3, S5, S10, S19, and S26. Protein Express. Purif. 28, 57–62.
Laible M., Boonrod K. (2009) Homemade site directed mutagenesis of whole plasmids. J. Vis. Exp. 27, 1135. https://doi.org/10.3791/1135
Deepak R.N., Sankararamakrishnan R. (2016) N–H···N hydrogen bonds involving histidine imidazole nitrogen atoms: a new structural role for histidine residues in proteins. Biochemistry. 55, 3774–3783.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


