Молекулярная биология, 2020, T. 54, № 6, стр. 1037-1045
Синапин рапсового жмыха: выделение, очистка и механизм подавления выработки меланина
Z. T. Yang a, b, D. X. Lu b, E.-K. Hong c, B. Y. Zhang a, d, M. C. Jiang d, Y. J. Yang d, D. J. Zhang a, d, *
a State Key Laboratory of Plateau Ecology and Agriculture, Qinghai University
810016 Xining, P. R. China
b Research Center for High Altitude Medicine, Key Laboratory of Application and Foundation for High Altitude Medicine Research in Qinghai Province (Qinghai-Utah Joint Research Key Lab for High Altitude Medicine),
Qinghai University
810001 Xining, P. R. China
c Medvill Co., Ltd., Medvill Research Institute
08511 Seoul, Korea
d College of Eco-Environmental Engineering, Qinghai University
810016 Xining, P. R. China
* E-mail: djzhang@nwipb.ac.cn
Поступила в редакцию 26.12.2019
После доработки 07.03.2020
Принята к публикации 07.03.2020
Аннотация
Рапс (Brassica campestris L.) – важная масличная культура, культивируемая в Китае. Основным побочным продуктом при получении рапсового масла является жмых, главный активный компонент которого – синапин, обладает биологической активностью. Показано, что синапин способен подавлять активность тирозиназы in vitro и обезвреживать свободные радикалы. Определена активность тирозиназы в меланоцитах А-375 человека, оценена антиоксидантная активность синапина и его влияние на содержание меланина. Синапин дозозависимым образом подавляет активность меланоцитов A-375 человека, ингибирует в них синтез меланина, снижая экспрессию мРНК и факторов TRP-1, TRP-2 и MITF. Показано, что синапин рапсового жмыха подавляет выработку меланина и может использоваться в качестве активного ингредиента отбеливающих средств.
ВВЕДЕНИЕ
Meланин – многофункциональный биополимер, продуцируемый меланоцитами, который поступает в кератиноциты, который определяет темный цвет кожи, глаз и волос [1, 2]. Меланин также защищает клетки от УФ-повреждения, однако избыточный синтез меланина может приводить к появлению хлоазм, сенильных бляшек, веснушек и других нарушений пигментации [3]. В связи с этим разработка и изучение средств, обладающих отбеливающим эффектом, привлекает внимание косметических и фармацевтических фирм. Учитывая проблемы безопасности и эффективности, большой интерес вызывают такие природные соединения, как арбутин, койевая и таниновая кислоты [4]. Биосинтез меланина, подробно описанный Schallreuter и Cooksey [1, 5], регулируется каскадом тирозиназы (TYR) и белками 1 и 2, ассоциированными с TYR (TRP-1 и TRP-2). Критическую роль в синтезе меланина играет сигнальный путь митоген-активированной протеинкиназы (MAPK). Показано, что уровень синтеза можно снизить путем деградации фактора транскрипции, ассоциированного с микрофтальмией (MITF) [8].
Рапс (Brassica campestris L.) – пятая по значимости после риса, кукурузы, пшеницы и сои сельскохозяйственная культура в Китае. Основным побочным продуктом при получении рапсового масла является жмых, который содержит примерно 29% белка и используется в птицеводстве [9]. В состав рапсового жмыха входят несколько фенольных соединений, в том числе свободная фенольная кислота, этерифицированная фенольная кислота и конденсированный танин [10]. Полифенолы рапсового жмыха обладают сильной восстанавливающей активностью, способностью к удалению свободных радикалов и повышению иммунитета у животных [11], а также антиоксидантной активностью in vitro [12]. Главное фенольное соединение рапсового жмыха – синапин (примерно 1.2–2.3%), обладает различными биологическими активностями, включая сильную скавенджерную, противоопухолевую, гепатопротекторную и другие [13].
Изучено влияние синапина на синтез меланина и активность TYR в меланоцитах A-375 человека. Оценена связь между продукцией меланина и окислительным стрессом, описан механизм подавления синтеза меланина в этих клетках. Результаты нашей работы могут предоставить важную информацию для изучения и разработки отбеливающих средств на основе рапсового жмыха.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. Использовали DPPH (2,2-дифенил-1-пикрилгидразил) фирмы “Tokyo Chemical Industry Co., Ltd” (Япония) и ABTS (2,2'-азино-бис(3-этилбензотиазолин)-6-сульфоновая кислота) фирмы “Beijing Solarbio Science & Technology Co., Ltd” (КНР), фетальную сыворотку крупного рогатого скота (“Gibco”, “Thermo Fisher Scientific”, США), биспецифические антитела “Beijing Solarbio Science &Technology Co., Ltd”. ТYR и койевая кислота получены от “Shanghai Byron Biotechnology Co., Ltd” (КНР). Среда культивирования RPMI-1640 предоставлена фирмой “Biological Industries Israel Beit Haemek Ltd.” (Израиль). Линия меланоцитов A-375 человека (ATCC CRL-1619) получена от “Procell Life Science & Technology Co., Ltd” (КНР). Наборы для определения супероксиддисмутазы (SOD), малонового диальдегида (MDA) и глутатиона (GSH) предоставлены “Nanjing Jiancheng Biotechnology Co., Ltd” (КНР), белки MITF, TRP-1 и TRP-2 – фирмой “R&D Systems” (КНР).
Экстракция рапсового жмыха. Рапсовый жмых экстрагировали 75%-ным этанолом (10 раз по 10 мин) при 60°C. Этот процесс повторяли 3 раза. Синапин выделяли с помощью препаративной HPLC (semi-prepared high phase liquid phase”) с использованием колонки Hebea ODS-2 (20 × 250 мм, “Hanbon Sci. & Tech”, КНР). Подвижная фаза состояла из ацетонитрила и 0.05 М дигидрофосфата калия в соотношении 17 : 83 и скорости потока 8 мл/мин. Объем инжекции составлял 4 мл, детекцию проводили на 326 нм. Синапин идентифицировали с помощью жидкостной хроматографии-масс-спектрометрии (LC-MS, “Thermo Fisher Scientific”).
Определение содержания синапина. Содержание синапина определяли с помощью HPLC (LC-20AT, Shimadzu, КНР), используя колонку Platisil ODS (250 × 4.6 мм) при 30°C. Мобильная фаза состояла из ацетонитрила и 0.05 М KH2PO4 в соотношении 17 : 83. Скорость потока – 0.8 мл/мин, объем инжекций – 5 мкл. Синапин определяли при 326 нм. Линейность оценивали по пяти точкам калибровочной кривой синапина. LC-MS проводили в следующих условиях: использовали электрораспыление (ESI+) при положительной ионизации, напряжении на капилляре 2.8 кВ и напряжении конуса образца 20 кВ. Скорость потока распыляющего газа была установлена равной 350 л/ч при температуре десольватации 300°C; скорость потока в конусном газе 50 л/ч, температура ионного потока равна 150°C. Масс-спектрометрическую детекцию проводили в режиме сбора данных MSE (масс-спектрометрияЕ) в интервале масс от 100 до 1500 m/z, при продолжительности метода 30 мин. При диссоциации, активируемой соударением, использовали низкую энергию 6 эВ и градиент высокой энергии 20–40 кэВ, газ – чистый азот.
Определение скавенджерной активности ABTS и DPPH. Антиоксиданты (DPPH (2,2-дифенил-1-пикрилгидразил) и ABTS (2,2'-азино-бис(3-этилбензотиазолин-6-сульфоновая кислота)) определяли в соответствии с [14]. Использовали ABTS в концентрации 7.0 и 2.45 мМ раствор персульфата калия. Эти растворы смешивали в соотношении 1 : 1 (v : v), реакцию проводили в течение 16 ч. Затем смесь разбавляли 95%-ным этанолом и анализировали при 734 нм. В качестве положительного контроля использовали витамин C [15]. Ингибирующую активность синапина анализировали в трех повторностях на длине волны 734 нм. Скавенджерную активность рассчитывали по формуле:
DPPH вызывал появление темно-пурпурной окраски в присутствии свободных радикалов, которая изменялась на светло-желтую при обезвреживании свободных радикалов [14]. Смесь синапина и 2.8 мл DPPH анализировали при 517 нм. Скавенджерную активность синапина рассчитывали по следующей формуле:
Определение активности тирозиназы гриба (TYR). Монофенолазную и дифенолазную активности TYR выражали как скорость окисления тирозина L-DOPA, согласно [16]. Состав реакционной смеси приведен в табл. 1 . Смесь инкубировали при 37°C в течение 10 мин, поглощение измеряли при 475 нм (At1, At2, At3, At4). Активность TYR гриба рассчитывали по следующей формуле:
Taблица 1. Реакционная система для определения активности тирозиназы (TYR)
| Компонент | Объем, мл | |||
|---|---|---|---|---|
| t1 | t2 | t3 | t4 | |
| Tирозин/L-DOPA | 1 | 1 | 1 | 1 |
| Фосфатно-солевой буфер | 3 | 2 | 2 | 1 |
| Образец | – | – | 1 | 1 |
| TYR | – | 1 | – | 1 |
| Общий объем | 4 | 4 | 4 | 4 |
Жизнеспособность клеток. Ингибирование жизнеспособности клеток А-375 под действием синапина определяли методом MTS. Клетки высевали на 96-луночные планшеты с плотностью 5 × 104 кл./мл. После прикрепления (8 ч) клетки обрабатывали синапином в разных концентрациях в течение 48 и 72 ч. Затем добавляли 10 мкл MTS и инкубировали в течение 3 ч. Поглощение измеряли при 490 нм. Степень ингибирования жизнеспособности клеток рассчитывали согласно инструкции к MTS-наборам.
Определение антиоксидантной активности в клетках A-375. Клетки А-375 вносили в 6-луночные планшеты по 1 × 105 клеток в ячейку. После прикрепления клетки обрабатывали синапином в разных концентрациях. В качестве контроля использовали кoйевую кислоту – ингибитор синтеза меланина [11]. Содержание SOD, GSH и MDA определяли в соответствии с инструкциями производителей.
Определение тирозиназной активности в клетках A-375. Клетки высевали в 6-луночные планшеты по 1 × 105 клеток в лунку. Клетки обрабатывали синапином, через 48 ч супернатант удаляли, клетки промывали 3 раза холодным фосфатно-солевым буфером (PBS), в каждую ячейку добавляли 90 мкл 1%-ного Triton X-100. Затем клетки разрушали с помощью замораживания–оттаивания. Добавляли 1%-ный раствор L-DOPA, инкубировали в течение 2 ч при 37°C и определяли поглощение при 490 нм.
Определение содержания меланина в клетках A‑375. Клетки вносили в ячейки 6-луночных культуральных планшетов (по 1 × 105 клеток в лунку). После прикрепления клетки обрабатывали синапином в течение 48 ч, затем собирали и подсчитывали их число в счетчике клеток крови. После центрифугирования при 1000 об./мин в течение 10 мин клетки растворяли в 1 мл смеси 1 М NaOH и 10%-ного диметилсульфоксида (DMSO), инкубируя в течение 1 ч в водяной бане при 90°C, и измеряли поглощение при 450 нм [17]. Содержание меланина в исследуемых пробах выражали в процентах от содержания в контроле. Содержание меланина в каждой группе вычисляли по следующей формуле: содержание меланина в исследуемой группе = = значение OD в группе/число клеток в группе. Содержание меланина в контрольной группе = OD в группе/число клеток в ней. Рассчитывали содержание меланина в одной клетке [15].
Количественная ПЦР в реальном времени. Суммарную РНК из клеток А-375 экстрагировали реагентом тризол. кДНК синтезировали с помощью набора Takara Reverse Transcription Kit согласно инструкции производителя. Затем экспрессию мРНК MITF, TRP-1 и TRP-2 анализировали методом количественной ПЦР в реальном времени (qRT-PCR) с набором Takara в приборе ABI 7500 qRT-PCR (“Bio-Rad”, США). Относительный уровень экспрессии рассчитывали методом 2–ΔΔCt и нормировали по уровню β-актина.
Вестерн-блотинг. Клетки A-375 в 6-луночных планшетах обрабатывали синапином в разных концентрациях в течение 48 ч. Затем клетки лизировали в буфере RIPA в течение 30 мин на льду [18]. Лизаты центрифугировли (10000 об/мин, 20 мин, 4°C) и собирали супернатант. Концентрацию белка определяли с помощью набора BCA Protein Assay Kit (“Beyotime”, КНР), белки разделяли с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия и переносили на поливинилиденфторидные мембраны. Мембраны обрабатывали первичными антителами к MITF, TRP-1 и TRP-2 при 4°C в течение ночи, затем инкубировали с вторичными антителами (“Biyuntian Biotech Institute”, КНР) при комнатной температуре. В качестве контроля использовали β‑актин.
Статистический анализ. Статистический анализ проводили с помощью однофакторного метода ANOVA и теста Дунетта на множественность сравнения. Результаты выражали как среднее ± ± стандартное отклонение (SD). Статистическими значимыми считали *P ≤ 0.05, **P ≤ 0.01.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Содержание синапина
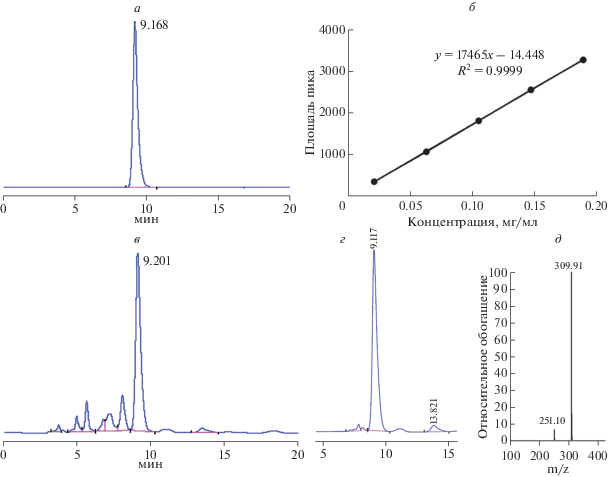
Результаты хроматографического разделения стандартного препарата синапина и экстракта рапсового жмыха с помощью HPLC приведены на рис. 1а, в. Время удержания стандартного материала равно 9.168 мин (рис. 1a), синапина из экстракта рапсового жмыха – 9.201 мин (рис. 1в). Методом LC-MS установлено, что два пика, представленные на рис. 1а, в, содержат одинаковые соединения, что подтверждено повторным анализом (рис. 1д). Очищенный образец, выделенный из рапсового жмыха, проанализировали повторно методом HPLC (рис. 1г). На рис. 1б представлена калибровочная кривая, использованная для определения синапина в линейном диапазоне значений (R2 = 0.9999).
Рис. 1.
Хроматографический анализ синапина (стандартный препарат и экстракт рапсового жмыха). а – HPLC стандарта синапина. в – HPLC синапина из экстракта рапсового жмыха. б – Калибровочная кривая для определения синапина. г, д – HPLC и LC-MS хроматограммы синапина, очищенного из рапсового жмыха соответственно.
Способность синапина обезвреживать радикалы ABTS и DPPH
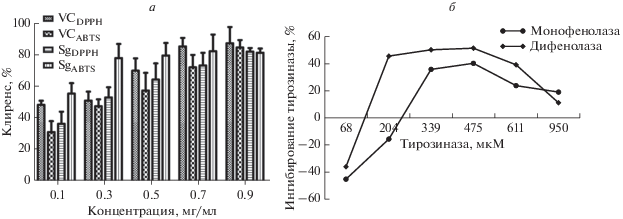
Антиоксидантную активность синапина in vitro определяли по способности обезвреживать свободные радикалы (скавенджерная активность) с использованием DPPH и ABTS. Скавенджерная активность была дозозависимой (рис. 2а). Синапин обладает более высокой скавенджерной активностью в отношении ABTS, чем витамин C, (IC50 = = 67.2 мкг/мл), но более низкой в отношении радикалов DPPH (IC50 = 148 мкг/мл). Значения IC50 рассчитывали, используя программу GraphPad Prism 5.0.
Рис. 2.
Скавенджерная активность и ингибирование тирозиназы (TYR) синапином (VC –витамин С, Sg – синапин). а – Скавенджерная активность синапина и витамина С в отношении свободных радикалов DPPH и ABTS. Скавенджерная активность и синапина, и витамина С была дозозависимой. Активность витамина С в отношении DPPH выше, чем у синапина. Однако активность синапина в отношении ABTS была выше, чем у витамина С. б – Синапин ингибирует активность тирозиназы в отношении тирозина и бифенилтирозина в качестве субстратов. Это ингибирование дозозависимо в определенном диапазоне концентраций.
Влияние синапина на активность тирозиназы гриба
Как показано на рис. 2а, ингибирование TYR и бифенол-TYR синапином возрастает дозозависимым образом при концентрациях синапина менее 475 мкМ и уменьшается при концентрации более 475 мкМ. Эти результаты показывают, что оптимальной является концентрация синапина 475 мкМ.
Влияние синапина на рост клеток
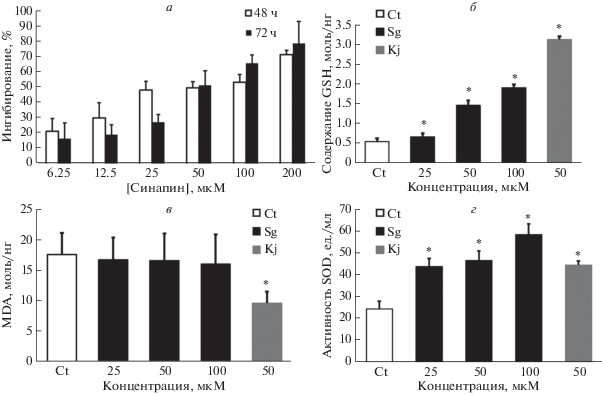
Обработка клеток A-375 синапином в течение 48 и 72 ч приводила к дозозависимому ингибированию роста клеток (рис. 3а). Согласно подсчетом с использованием программы Graphpad Prism 5.0 величина IC50 для синапина равна 49.38 и 52.66 мкМ соответственно. Эти результаты показывают, что после 48 ч обработки степень ингибирования была выше, поэтому клетки обрабатывали синапином в концентрации 25, 50, 100 мкМ в течение 48 ч (*P ≤ 0.05, **P ≤ 0.01).
Рис. 3.
Ингибирование роста и антиоксидантная активность синапина в клетках A-375. а – Дозозависимое ингибирование роста клеток A-375 синапином в течение и 48, и 72 ч. б, в – Содержание GSH, MDA и активность SOD в контрольных клетках меланомы (Ct, контроль), обработанных синапином (Sg) и койевой кислотой (Kj), положительный контроль. б – Обработка синапином в разных концентрациях значительно повышает содержание GSH в клетках меланомы по сравнению с контрольной группой (*P < 0.05, **P < 0.01). в – Содержание MDA снижается при повышении концентрации синапина. г – Активность SOD возрастает (*P <0.05) при обработке синапином. Влияние синапина на содержание GSH и активность SOD в клетках меланомы было дозозависимым.
Антиоксидантная активность синапина в клетках А-375
Как следует из данных, представленных на рис. 3б, синапин дозозависимо повышал содержание GSH в клетках A-375. Синапин, хотя и снижал содержание MDA в клетках (рис. 3в), однако различия между контрольной группой и клетками, обработанными синапином, были незначимыми. Эти результаты выявляют слабую корреляцию между антиоксидантной активностью синапина и содержанием MDA в клетках. Активность SOD в клетках A-375, обработанных синапином, была заметно выше, чем в контроле (рис. 3г) (*P < 0.05).
Влияние синапина на активность TYR в клетках A-375
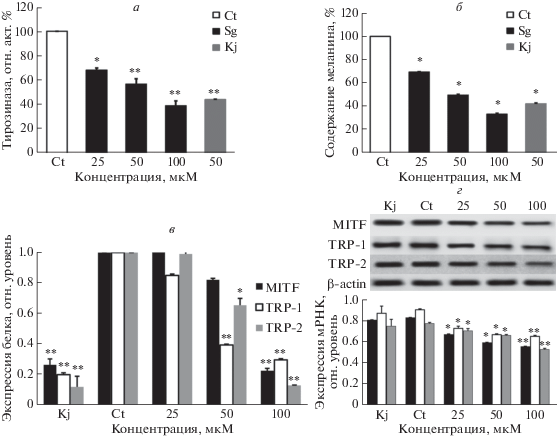
Как следует из рис. 4а, синапин ингибирует активность TYR в клетках A-375. Относительная активность TYR в присутствии 50 мкМ синапина составляла 56.78% от значений в контроле (*P ≤ ≤ 0.05, **P ≤ 0.01). Синапин дозозависимым образом ингибировал активность TYR.
Рис. 4.
Активность тирозиназы, содержание меланина, экспрессия мРНК и белка в клетках А-375, обработанных синапином. а – Влияние синапина в разных концентрациях на активность тирозиназы в клетках A-375. Ct – Контрольная группа; Sg – обработка синапином, Kj – обработка койевой кислотой (положительный контроль). Активность контрольной группы принята за 100% (**P < 0.01). Синапин дозозависимым образом ингибировал активность тирозиназы в клетках A-375, причем значительнее, чем в контроле (*P < 0.05). Ингибиторный эффект синапина в высоких концентрациях был более заметным, чем в положительном контроле (*P <0.05). б – Синапин снижает продукцию меланина в единичных клетках A-375. Уровень меланина в контроле принят за 100% (*P < 0.05, **P < 0.01). в – Экспрессию мРНК детектировали с помощью ПЦР в реальном времени. Данные представлены как средние значения ± SD, вычисленные по результатам трех определений (*P < 0.05, **P < 0.01). г – Верхняя панель. Экспрессия белков MITF, TRP-1 и TRP-2, выявленная с помощью вестерн-блотинга. Экспрессию β-актина использовали в качестве контроля. Нижняя панель. Относительные уровни экспрессии MITF, TRP-1 и TRP-2. Представлены данные, нормированные на число клеток. Приведены средние значения ± SD, вычисленные по результатам трех определений (*P < 0.05, **P < 0.01).
Влияние синапина на содержание меланина в клетках A-375
Влияние синапина на содержание меланина в меланоцитах показано на рис. 4б. Рассчитывали содержание меланина в единичных клетках A-375. Показано, что синапин дозозависимо снижал содержание меланина в клетках A-375 (*P ≤ 0.05, **P ≤ 0.01) в результате подавлениея его синтеза.
Влияние синапина на экспрессию мРНК MITF, TRP-1 и TRP-2
Важную роль в синтезе меланина играет ассоциированный с микроокулярной деформацией фактор транскрипции MITF, который влияет на экспрессию белков TRP-1 и TRP-2. Нами показано, что синапин дозозависимым образом ингибирует экспрессию мРНК MITF, TRP-1 и TRP-2 (*P ≤ 0.05, **P ≤ 0.01) (рис. 4г).
Влияние синапина на экспрессию белков MITF, TRP-1 и TRP-2
Экспрессию белков MITF и родственных TRP-1 и TRP-2 белков в клетках A-375 детектировали с помощью вестерн-блотинга. На диаграмме приведены значения экспрессии белков, рассчитанные на число клеток. Экспрессия MITF, TRP-1 и TRP-2 в клетках A-375, обработанных синапином, была значительно ниже, чем в контрольных клетках (*P ≤ 0.05, **P ≤ 0.01) (рис. 4г).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Различные отбеливающие кожу вещества, такие как койевая кислота и арбутин, широко используются в косметологии и фармацевтике [19]. Однако эти агенты имеют побочное канцерогенное, токсическое и раздражающее кожу действие [20]. В настоящее время в качестве средств для отбеливания кожи внимание привлекают различные природные вещества, включая фенольные соединения [21]. Известно, что эти фенолы и полифенолы ингибируют синтез меланина, подавляя активность TYR [22]. Поэтому перспективным считается поиск потенциальных ингибиторов меланина среди ингибиторов TYR грибов [23]. MITF и подавляемые им белки, родственные TYR (TRP-1, TRP-2) [15], считаются важными факторами синтеза меланина. TYR – ключевой скорость-лимитирующий фермент синтеза меланина. Тирозин может окисляться с образованием DOPA путем гидроксилирования, затем он быстро превращается в DOPA-хинон (DQ) и спонтанно образует пигмент DOPA [24]. Под действием TRP-2 пигменты DOPA таутомеризуются с образованием 5,6-дигидрокси-2-карбоновой кислоты (DHICA), а затем DHICA каталитически окисляется TRP-1 с образованием коричневого пигмента, называемого DHICA-меланин [25]. В нашей работе показано, что синапин может снижать активность TYR, подавляя MITF и белки TRP-1 и TRP-2 (рис. 4г).
Важную роль в ингибировании синтеза меланина играют антиоксиданты [26]. На выработку меланина влияют многие внешние факторы, и его образование тесно связано с окислительными реакциями [27]. В процессе спонтанного окисления L-DOPA образуется большое количество свободных радикалов и ${\text{O}}_{2}^{ - }$ [28]. Эти избыточные свободные радикалы, которые считаются причиной старения и многих болезней, влияют на синтез меланина путем регуляции активности TYR [29]. Согласно ранее полученным результатам, механизм подавления продукции меланина может включать ингибирование пролиферации меланоцитов и связанных с меланином ферментов, ускорение метаболизма меланина, снижение экзогенной стимуляции и повреждение свободными радикалами [30]. Нами показано, что синапин обладает значительной скавенджерной дозозависимой активностью в отношении радикалов DPPH и ABTS (рис. 2а). Синапин способен также ингибировать синтез меланина, путем репарации окислительных повреждений.
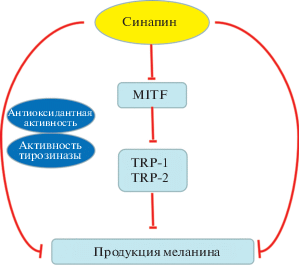
Механизм ингибирования синтеза меланина синапином в меланоцитах А-375 схематически показан на рис. 5. Синапин способен снижать уровень меланина, ингибируя активность TYR и подавляя экспрессию MITF и белков TRP-1 и TRP-2. Эти данные показывают, что синапин из рапсового жмыха может использоваться в качестве потенциального активного ингредиента отбеливающих средств.
Рис. 5.
Механизм ингибирования синтеза меланина синапином рапсового жмыха. Синапин может снижать продукцию меланина и TYR-активность, подавляя экспрессию фактора MITF и ассоциированных с TYR белков (TRP-1 и TRP-2). Антиоксидантный эффект синапина играет важную роль в ингибировании синтеза меланина.
Часть работы выполнена в Research Center for High Altitude Medicine, Key Laboratory of Application and Foundation for High Altitude Medicine Research in Qinghai Province.
Работа получила поддержку Qinghai Province Major Science и Technology Special Programs Grant Number 2017-SF-A8.
Статья не содержит исследований, выполненных с использованием животных.
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
Schallreuter K.U., Kothari S., Chavan B., Spencer J.D. (2008) Regulation of melanogenesis-controversies and new concepts. J. Exp. Dermatol. 17, 395–404.
Chou Y.C., Sheu J.R., Chung C.L., Chen C.Y., Lin F.L., Hu M.J., Kuo Y.H., Hsiao G. (2010) Nuclear-targeted inhibition of NF-κB on MMP-9 production by N-2-(4-bromophenyl) ethyl caffeamide in human monocytic cells. J. Chem. Biol. Interact. 184, 403–412.
Li W.J., Lin Y.C., Wu P.F., Wen Z.H., Liu P.L., Chen C.Y., Wang H.M. (2013) Biofunctional constituents from Liriodendron tulipifera with antioxidants and anti-melanogenic properties. Int. J. Mol. Sci. 14, 1698.
Kai H., Baba M., Okuyama T. (2008) Inhibitory effect of Cucumis sativus on melanin production in melanoma B16 cells by downregulation of tyrosinase expression. J. Med. Plants Stud. 74, 1785–1788.
Cooksey C.J., Garratt P.J., Land E.J., Pavel S., Ramsden C.A., Riley P.A., Smit N.P. (1997) Evidence of the indirect formation of the catecholic intermediate substrate responsible for the autoactivation kinetics of tyrosinase. J. Biol. Chem. 272, 26226–26235.
Manuel S.C., Mario G.C., Renán S.P., Claudia M.P., Mario J.H., Pamela M.R., Alejandro R.A. (2011) Immunopathogenesis of vitiligo autoimmun. J. Autoimmun Rev. 10, 762–765.
Tsukamoto K., Jackson I.J., Urabe K., Montague P.M., Hearing V.J. (1992) A second tyrosinase-related protein, TRP-2, is a melanogenic enzyme termed DOPAchrome tautomerase. EMBO. J. 11, 519–526.
Kim D.S., Hwang E.S., Lee J.E., Kim S.Y., Kwon S.B., Park K.C. (2003) Sphingosine-1-phosphate decreases melanin synthesis via sustained ERK activation and subsequent MITF degradation. J. Cell Sci. 116, 1699.
Kim Y., Lee J. (2017) Effects of hydrolyzed rapeseed cake extract on the quality characteristics of mayonnaise dressing. J. Food Sci. 82, 2847–2856.
Kozlowska H., Naczk M., Shahidi F., Zadernowski R. (1990) Phenolic acids and tannins in rapeseed and canola. J. Canola Rapeseed. 1990, 193–210.
de Lima-Saraiva S.R.G., Oliveira F.G.D.S., Juni-or R.G.O., Araújo C.S., de Oliveira A.P., Pacheco A.G.M., Rolim L.A., Amorim E.L.C., César F.C.S., Almeida J.R.G.D.S. (2017) Chemical analysis and evaluation of antioxidant, antimicrobial, and photoprotective activities of Schinopsis brasiliensis Engl. (Anacardiaceae). Sci. World J. 2017, 1713921. https://doi.org/10.1155/2017/1713921
Zhang L., Gu J., Chen Y., Zhang L. (2013) A study on four antioxidation effects of Lycium Barbarum polysaccharides in vitro. Afr. J. Tradit. Complem. 10, 494–498.
Li H.J., Li J.X., Zhang Z. (2016) Response surface optimization of ultrasonic-assisted extraction of melanin from testae of wild apric. J. Food Sci. 37, 26–33.
Sarah L., Molyneux S.L., Carolyn E. (2009) An investigation of the antioxidant properties and color of glasshouse grown tomatoes. Int. J. Food Sci. Nutr. 55, 537–545.
Zhang Z.P. (2014) Extraction and separation skin-whitening agent from rhizoma Chuanxiong and its application in cosmetics. Guangdong Yao Xue Yuan. 2014, 1–67.
Niu C., Yin L., Aisa H.A. (2018) Novel furocoumarin derivatives stimulate melanogenesis in B16 melanoma cells by up-regulation of MITF and TYR family via Akt/GSK3β/β-catenin signaling pathways. Int. J. Mol. Sci. 19, 746.
Li L.L., Xing R., Deng Y.Y., Xie L.F., Wang L. (2016) Research progress of tyrosinase inhibitors. Shi Ping Gong Ye. 37, 235–239.
Bao J.L., Ding R.B., Zou L.D., Zhang C., Wang K., Liu F., Li P., Chen M.W., Wan J.B., Su H.X., Wang Y.T., He C.W. (2015) Forsythiae fructus inhibits B16 melanoma growth involving MAPKs/Nrf2/HO-1 mediated anti-oxidation and anti-inflammation. Am. J. Chinese Med. 44, 112.
Dudonné S., Vitrac X., Coutière P., Woillez M., Merillon J.M. (2009) Comparative study of antioxidant properties and total phenolic content of 30 plant extracts of undustrial interest using DPPH, ABTS, FRAP, SOD, and ORAC assays. J. Agr. Food Chem. 57, 1768–1774.
Sies H. (1997) Oxidative stress: oxidants and antioxidants. Exp. Physiol. 82, 291–295. https://doi.org/10.1113/expphysiol.1997.sp004024
Peiyuan L.I., Huo L.N., Su W., Lu R.M., Deng C.C., Liu L.Q., Deng Y.K., Guo N.N., Lu C.S., He C.L. (2011) Free radical-scavenging capacity, antioxidant activity and phenolic content of Pouzolzia zeylanica. J. Serb. Chem. Soc. 76, 709–717.
Zhao Q., Yu S.J., Wang Y.P., Yuan Y.J. (2012) Optimization of the extracting process for alkaloids from Dicranostigma leptopodum by response surface analysis and study on its antibacterial activity in vitro. Cao Ye Xue Bao. 21, 206–214.
Broznić D., Jurešić G.Č., Milin Č. (2016) Involvement of α-, γ- and δ-tocopherol isomers from pumpkin (Cucurbita pepo L.) seed oil or oil mixtures in the biphasic DPPH. J. Food Technol. Biotech. 54, 200–210.
Bae J.S., Han M., Yao C., Chung J.H. (2016) Chaetocin inhibits IBMX-induced melanogenesis in B16F10 mouse melanoma cells through activation of ERK. J. Chem-Biol. Interact. 245, 66–71.
Nakajima M., Shinoda I., Fukuwatari Y., Hayasawa H. (1998) Arbutin increases the pigmentation of cultured human melanocytes through mechanisms other than the induction of tyrosinase activity. J. Pigm. Cell Melanomar. 11, 12–17.
Lin J.W., Chiang H.M., Lin Y.C., Wen K.C. (2008) Natural products with skin-whitening effects. J. Food Drug Anal. 16, 1–10.
Pillaiyar T., Manickam M., Jung S.H. (2015) Inhibitors of melanogenesis: a patent review (2009–2014). J. Expert. Opin. Ther. Pat. 25, 775.
Park H.Y., Kosmadaki M., Yaar M., Gilchrest A. (2009) Cellular mechanisms regulating human melanogenesis. J. Cell Mol. Life Sci. 66, 1493–1506.
Zhi Q.Z., Jian J.X., Li M.Z. (2015) Antioxidant activity of three components of wheat leaves:ferulic acid, flavonoids and ascorbic acid. J. Food Sci. Tech. 2015, 7297–7304.
Lin L.C., Chen C.Y., Kuo C.H., Lin Y.S., Hwang B.H., Wang T.K., Kuo Y.H., Wang H.M. (2018) 36H: a novel potent inhibitor for antimelanogenesis. J. Oxid. Med. Cell Longev. 2018, 1–12.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


