Молекулярная биология, 2021, T. 55, № 1, стр. 3-19
Эволюционные аспекты геномного импринтинга
Е. А. Саженова a, *, И. Н. Лебедев a
a Научно-исследовательский институт медицинской генетики, Томский национальный исследовательский медицинский центр Российской академии наук
634050 Томск, Россия
* E-mail: elena.sazhenova@medgenetics.ru
Поступила в редакцию 12.04.2020
После доработки 12.04.2020
Принята к публикации 25.05.2020
Аннотация
Геномный импринтинг – эпигенетический феномен, дифференциально маркирующий материнские и отцовские копии генов в геноме и обеспечивающий их моноаллельную экспрессию в зависимости от родительского происхождения. Импринтинг является эволюционной головоломкой, поскольку несет издержки диплоидизации, отказываясь от ее преимуществ в виде защиты от рецессивных мутаций. Целью настоящего обзора был поиск ответа на вопрос о причинах возникновения геномного импринтинга и его закрепления в эволюции цветковых растений, насекомых, сумчатых и плацентарных млекопитающих.
ВВЕДЕНИЕ
Геном большинства многоклеточных организмов диплоиден. Это позволяет соматическим клеткам иметь две родительские копии генов и дает потенциальную возможность отцовским и материнским локусам быть в равной степени активными в геноме потомка. Геномный импринтинг, демонстрируя функциональную неэквивалентность аллелей, активность которых зависит от их родительского происхождения, представляет яркое исключение из этого правила. Появление импринтинга в эволюции ставит вопрос о том, почему у диплоидного организма развивается процесс подавления экспрессии некоторых генов на одной из гомологичных хромосом и тем самым происходит возврат к функциональной, эпигенетической, но не структурной гаплоидизации этих аллелей.
Геномный импринтинг известен у филогенетически удаленных таксонов – некоторых насекомых и высших растений, а также у сумчатых и плацентарных млекопитающих, включая человека. Термин “импринтинг” (от англ. imprint — отпечаток) в генетическом контексте впервые применила в 1960 г. H. Crouse для описания селективной элиминации отцовской половой хромосомы при дроблении зиготы у мужских особей листовых, или почвенных комариков Sciara [1, 2].
Моноаллельная экспрессия гена обычно невыгодна для диплоидных организмов, поскольку рецессивные мутации не могут компенсироваться функциональным гомологичным локусом. В то же время подавление активности одного из аллелей и стоящая за этим, как правило, гетерохроматинизация участка хромосомы, инактивирует такие потенциально опасные элементы в геноме, как транспозоны и чужеродные последовательности ДНК.
Экспрессия импринтированных генов у растений происходит главным образом в эндосперме и затрагивает более 100 генов, ответственных за развитие и питание зародыша [3]. Геномы млекопитающих также содержат некоторое количество импринтированных генов – от четырех у сумчатого опоссума до более 100 у мыши и человека, при этом примерно 50% импринтированных генов кодируют факторы, вовлеченные в эмбриональное и неонатальное развитие, 20% – связаны с неврологическими процессами, а остальные не связаны с какой-либо очевидной биологической функцией [4]. Таким образом, геномный импринтинг закрепился в двух основных направлениях – в регуляции эмбрионального и неонатального роста и в развитии головного мозга у млекопитающих.
В настоящем обзоре мы попытаемся ответить на вопрос, с какой целью геномный импринтинг возник и закрепился в эволюции у далеко отстоящих таксонов, таких как цветковые растения, насекомые, сумчатые и плацентарные млекопитающие, а также рассмотрим мишени, на которые в первую очередь воздействует импринтинг, обсудим гипотезы о роли импринтинга в эволюции.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ГЕНОМНОГО ИМПРИНТИНГА У РАСТЕНИЙ И ЖИВОТНЫХ
Метилирование ДНК и гистонов, играющее определяющую роль в регуляции геномного импринтинга, удивительно похоже у млекопитающих и покрытосеменных растений. Сходство рисунков метилирования у арабидопсиса, кукурузы и риса предполагает, что регуляция экспрессии импринтированных генов сохранилась на протяжении 150 млн лет эволюции. У растений метилированию подвергаются три мотива геномной ДНК: CpG, CpHpG и CpHpH (где H – любой нуклеотид, кроме G). В этом процессе участвуют белки MET, CMT и DRM. Гены MET1, MET2 и MET3, кодирующие ДНК-метилтрансферазы, специфичны только для растений и поддерживают метилирование ДНК в сайтах CpG, при этом MET1 является ортологом гена DNMT1 поддерживающей ДНК-метилтрансферазы млекопитающих. MET1 взаимодействует с белками VIM, содержащими SET- и RING-ассоциированные домены, для поддержания симметричного метилирования CpG после репликации ДНК [5]. Хромометилаза CMT3 поддерживает метилирование преимущественно в сайтах CpHpG. Мутанты по гену CMT3 арабидопсиса характеризуются гипометилированием в указанных сайтах и повышенной транскрипцией ретротранспозонов, однако фенотипически не отличаются от растений дикого типа [6]. Представители метилтрансфераз DRM (Domains Rearranged Methyl-Transferase) гомологичны ДНК-метилтрансферазе DNMT3 животных, но имеют иную очередность каталитических доменов [7]. Ключевой белок этого семейства – ДНК-метилтрансфераза 2 (DRM2), метилирует цитозин de novo во всех трех возможных сайтах посредством РНК-направляемого метилирования ДНК (RdDM), опосредованного РНК-полимеразой IV (Pol IV), которая индуцирует малые интерферирующие РНК (siРНК). Растения, мутантные по гену DRM2, жизнеспособны и не имеют внешних отличий от растений дикого типа. Показано, что путь RdDM участвует в регуляции импринтинга у Arabidopsis thaliana [8]. Некодирующие малые РНК выполняют важные функции в процессах роста и развития как млекопитающих, так и растений.
У млекопитающих метилирование затрагивает главным образом динуклеотиды CpG, тогда как метилирование CpHpG и асимметричных последовательностей CpHpH в большинстве клеток наблюдается редко. При этом DNMT3 инициирует метилирование de novo, а DNMT1 поддерживает метилирование цитозина в CpG-сайтах в ходе репликации ДНК. У растений количественно преобладает метилирование динуклеотидов CpG, однако и другие последовательности метилируются довольно часто. В частности, в геноме A. thaliana метилированием затронуто около 24% сайтов CpG, 7% CpHpG и лишь 1.7% CpHpH [9, 10]. У гексаплоидной пшеницы примерно 30% всего метилирования приходится на сайты CpHpG. В противоположность этому гипометилирование катализируется ДНК-гликозилазой DEMETER (DME), которая может вырезать метилированный цитозин из ДНК. Этот процесс происходит в центральной женской клетке до слияния со спермием [11].
Метилированное состояние необходимо для подавления экспрессии отцовских аллелей импринтированных генов в эндосперме. У высших растений при гаметогенезе уровень метилирования ДНК в центральном ядре зародышевого мешка оказывается ниже, чем в мужских гаметах пыльцевого зерна. В большинстве случаев в эндосперме активны материнские гипометилированные аллели, в то время как аллели, полученные из спермия, оказываются гиперметилированными и неактивными. Избирательная активация материнских аллелей генов, подвергающихся импринтингу, включает поэтапное деметилирование ДНК в эндосперме путем избирательной репрессии гена MET1 перед последним синцитиальным делением в центральной клетке женского гаметофита и последующую активацию DME на ранних этапах развития эндосперма [12]. Комплекс PRC2 (Polycomb repressive complex 2), консервативный у млекопитающих и растений, вовлечен в подавление экспрессии генов. У цветковых растений импринтированные гены FIS2 и MEDEA (MEA) кодируют субъединицы этого комплекса, обеспечивающего триметилирование гистона H3 по Lys27 (H3K27me3), регулирующего активность импринтированных генов в эндосперме. H3K27me3 – единственная известная модификация гистонов, которая коррелирует с импринтингом у цветковых растений [3]. Мутация PRC2 нарушает импринтированную экспрессию многих генов, большинство из которых активны на отцовском гомологе. Нарушение экспрессии одного из этих генов приводит к потере импринтинга, свидетельствуя о том, что метилирование ДНК первично для распознавания PRC2 и установления импринтинга. В соответствии с этим активность PRC2 обычно коррелирует с метилированием ДНК, в том числе в эндосперме A. thaliana, где PRC2 направлен на транспозоны, ассоциированные с DME-опосредованным деметилированием [8].
Отсутствие экспрессии деметилазы DME влияет на нормальную экспрессию генов MEDEA и FIS2, что приводит к аномальному развитию эндосперма [13]. Нарушения статуса метилирования импринтированных генов у некоторых мутантов или под действием химических агентов вызывают существенные изменения в развитии и морфологии растений. У растений с гомозиготными мутациями, вызывающими глобальное гипометилирование ДНК, при самоопылении происходит прогрессивное накопление фенотипических аномалий в ряду поколений. Причиной этого является эктопическая экспрессия всех новых генов в результате их случайного гипометилирования.
У высших растений импринтированный ген с отцовской экспрессией PHERES1 (PHE1) кодирует фактор транскрипции и способствует росту зародыша [14]. Экспрессия данного гена на материнском гомологе подавляется гистон-метилтрансферазой HEAK27me3 MEDEA, которая ограничивает рост A. thaliana. Специфическое включение определенного варианта гистона Н3 в сперматозоидах A. thaliana может подавлять отцовский аллель в эндосперме или зиготе. Например, мутации в экспрессирующемся по материнской линии гене MEDEA приводят к образованию абортированных семян даже в присутствии унаследованной функциональной отцовской копии [15]. Таким образом, появление геномного импринтинга в эволюции цветковых растений предполагает возможность его связи с возникновением новых репродуктивных стратегий в развитии и питании зародыша [16].
В геноме человека из более 20 тысяч генов импринтированы около 100 [17]. В основном это гены, кодирующие белки, большинство из которых сгруппированы в кластеры под общим внутренним регуляторным контролем центров импринтинга. В каждом из таких кластеров центры импринтинга в cis-положении инициируют выключение транскрипции импринтированных генов через продукцию нетранслируемой РНК, а последующее метилирование ДНК закрепляет это состояние. Импринтированные гены влияют на рост эндосперма и размер семян у цветковых – A. thaliana и сельскохозяйственных растений. Точное количество этих генов на сегодняшний день не определено, неясно и существование кластерной организации импринтированных генов под единым cis-контролем в геноме [18].
“ЖИЗНЕННЫЙ ЦИКЛ” ГЕНОМНОГО ИМПРИНТИНГА В ОНТОГЕНЕЗЕ
Растения. В период цветения из диплоидных клеток растений формируются микро- и мегаспороцисты (2n), которые претерпевают мейоз и образуют гаплоидную фазу развития – микро- и мегаспору (n) (рис. 1). Затем микроспора проходит два митотических деления, в результате чего образуется микрогаметофит, или пыльцевое зерно, содержащее вегетативную клетку (n) и две мужские гаметы (n, n). Гаплоидная мегаспора в результате трех последовательных митотических делений образует мегагаметофит (эмбриональный мешок), содержащий восемь гаплоидных клеток, две из которых формируют центральную клетку. В результате мегагаметафит имеет две женские гаметы – центральную клетку (2n) и яйцеклетку (n), а в дополнение к ним клетки-синергиды, которые участвуют в процессе оплодотворения. При оплодотворении пыльцевое зерно попадает на рыльце пестика, вегетативная клетка прорастает в виде пыльцевой трубки и доставляет два сперматозоида в зародышевый мешок. Один сперматозоид оплодотворяет гаплоидную яйцеклетку, а другой соединяется с двумя полярными ядрами центральной клетки эмбрионального мешка. Оплодотворенная центральная клетка впоследствии развивается в триплоидный эндосперм (3n), а оплодотворенная яйцеклетка образует диплоидный зародыш (2n). Этот процесс известен как двойное оплодотворение, описанное впервые Сергеем Гавриловичем Навашиным в 1898 году.
Рис. 1.
“Жизненный цикл” геномного импринтинга у цветковых растений. 1а – микроспороциста (2n), 2а – микроспора (n), 3а – пыльцевое зерно, состоящее из вегетативной и двух мужских гамет (все n). 1б – мегаспороциста, 2б – мегаспора, 3б – семиядерный зародышевый мешок с центральной клеткой (2n) и яйцеклеткой (n), 5, 6 – семя (э – эндосперм (3n), з – зародыш (2n)), 7 – проросток; черные сегменты на хромосомах – выключенные (не экспрессирующиеся) аллели, белые сегменты – экспрессирующиеся аллели.
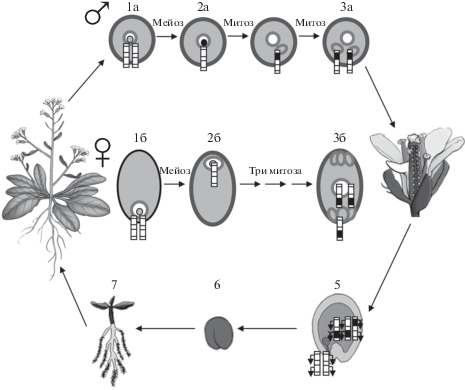
При прорастании семени эпигенетические метки геномного импринтинга у эмбриона стираются и остаются только в эндосперме, который необходим для роста и питания зародыша и не участвует в формировании следующего поколения (рис. 1). Очевидно, что родительский импринтинг должен быть установлен во время развития гаметофита и регулировать экспрессию аллельных генов в ходе раннего развития эмбриона и эндосперма. И действительно, геномный импринтинг вновь восстанавливается в период микро- и мегаспорогенеза, на стадии формирования пыльцевого зерна и 7‑ядерного зародышевого мешка, во время двух митотических делений при развитии пыльцевого зерна и трех последовательных митотических делений в период формировании восьмиядерного гаплоидного мегагаметофита [8].
Животные (млекопитающие). В онтогенезе млекопитающих в зародышевых примордиальных половых клетках происходит практически полное деметилирование ДНК (рис. 2). В результате такого события как импринтированные, так и неимпринтированные гены становятся гипометилированными. Тем не менее, ДНК не подвергается полному деметилированию, и средний индекс метилирования в мужских и женских примордиальных половых клетках остается на уровне 7.8 и 6.0% соответственно. В зрелых гаметах происходит de novo метилирование и установление рисунка метилирования в импринтированных генах согласно полу родителя. В то же время примерно 10% CpG-динуклеотидов остаются неметилированными [19]. Другая волна эпигенетического репрограммирования генома происходит сразу же после оплодотворения. В это время материнский и отцовский геном подвергаются деметилированию, за исключением импринтированных генов. Материнский геном пассивно деметилируется в течение нескольких клеточных делений. Деметилирование мужского генома происходит активно во время первых делений дробления [20]. Рисунки метилирования импринтированных генов сохраняются на всем протяжении онтогенеза во всех соматических клетках, за исключением некоторых импринтированных генов, статус метилирования которых может быть полиморфным в различные периоды онтогенеза. На сегодняшний день известен тканеспецифичный импринтинг таких генов человека, как KCNQ1OT1 (11p15.5), UBE3A (15q11), SNURF-SNRPN (15q11), IGF2R (6q25.3), GRB10 (7p21), MEST (7q32.2) и ряда других [21]. Так, ген IGF2R (OMIM 147280) человека моноаллельно экспрессируется во всех тканях с одного аллеля, выбор которого является случайным, кроме мозга, где зафиксирована его биаллельная экспрессия [22]. В то же время, у мышей этот ген экспрессируется моноаллельно только с материнского гомолога во всех тканях. Этот пример показывает не только тканеспецифичный, но и эволюционный эпигенетический полиморфизм импринтинга. Ген WT1 (11p13), ассоциированный с развитием опухоли Вильмса (OMIM 607102), имеет импринтированную моноаллельную экспрессию только отцовского гомолога в фибробластах и лимфоцитах, моноаллельную материнскую – в плаценте и мозге, биаллельную экспрессию в других органах (сердце, легкое, печень и кишечник) [23].
Рис. 2.
“Жизненный цикл” геномного импринтинга у млекопитающих (черные сегменты на хромосомах – выключенные (не экспрессирующиеся) аллели, белые сегменты – экспрессирующиеся аллели).
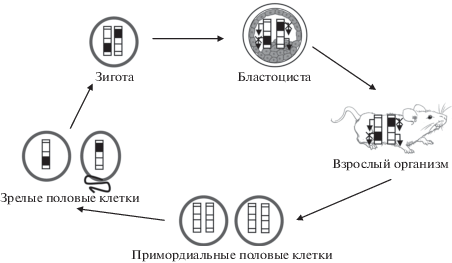
Таким образом, молекулярные механизмы регуляции экспрессии импринтированных генов у растений и животных в целом сходны, и осуществляются они через аллель-специфичное метилирование, ковалентные модификации белков хроматина, активность регуляторных некодирующих РНК. В то же время у млекопитающих экспрессия импринтированных генов обнаруживается в эмбриональных и внезародышевых тканях, а также во всех соматических клетках взрослого организма, в отличие от растений, у которых геномный импринтинг ограничен, по всей видимости, преимущественно эндоспермом – тканью, питающей развивающийся зародыш растения.
ГЕНОМНЫЙ ИМПРИНТИНГ В ЦАРСТВЕ РАСТЕНИЙ
В царстве растений геномный импринтинг обнаружен только у покрытосеменных, или цветковых. Впервые импринтинг был описан в локусе R, кодирующем пигмент эндосперма кукурузы Zea mays, который экспрессируется только с материнского гомолога [24]. Первые импринтированные гены, обнаруженные у A. thaliana, – это МЕА и FIS2, которые останавливают пролиферацию эндосперма и необходимы для его нормального развития, хотя выполняют важные функции и в женском гаметофите. У A. thaliana и кукурузы (Z. mays) выявлены импринтированные гены, экспрессирующиеся как с отцовского, так и с материнского гомологов [25].
Семя цветковых растений состоит из трех основных компонентов: оболочки, зародыша и эндосперма, который поддерживает эмбриогенез. Рост и развитие семян требуют взаимодействия и координации отдельных генетических программ, которые регулируют развитие каждого компонента семени. Центральную роль среди этих компонентов играет эндосперм, который окружает зародыш и обеспечивает его питательными веществами, необходимыми для нормального развития. Поскольку геномный импринтинг делает родительские геномы функционально неэквивалентными, он предотвращает развитие партеногенетического эмбриона, усиливая вклад обоих родительских геномов. У цветковых растений и млекопитающих в развивающемся зародыше формируются ткани, которые обеспечивают поступление питательных веществ от матери. У млекопитающих это внезародышевые ткани (в частности, трофобласт, а затем и плацента), а у цветковых растений – эндосперм. Примечательно, что трофобласт образуется при дроблении самой зиготы, тогда как эндосперм возникает отдельно от зиготы при слиянии двух гаплоидных материнских ядер (m) с ядром второго сперматозоида (p) (2m : 1p). Таким образом, в эволюции растений импринтинг мог стать механизмом обеспечения оплодотворения центральной клетки и предотвращения партеногенетического развития эндосперма [26].
Механизмы импринтинга также могут служить барьером для межвидовой гибридизации, возможно, в качестве индикатора, который определяет необходимую дозу родительского гена. Если скрестить диплоидное (женская линия, диплоидный эмбриональный мешок) и тетраплоидное (отцовская линия, диплоидный гаметофит) растение, то в эндосперме будут преобладать отцовские хромосомы (2m : 2p, в отличие от нормального распределения – 2m : 1p), что приведет к разрастанию эндосперма и, как следствие, к крупному семени. При скрещивании тетраплоидного растения (женская линия, тетраплоидный эмбриональный мешок) с диплоидным (отцовская линия, гаплоидный гаметофит) (4m : 1p) деление клеток эндосперма замедляется, в результате чего образуются мелкие семена с небольшим эндоспермом [27]. Ген ADMETOS A. thaliana отвечает за абортацию семян с несбалансированным эндоспермом, когда нарушается нормальное соотношение 2m : 1p. При скрещивании растений с различным числом хромосом геномный импринтинг выполняет функцию репродуктивного барьера. Летальность семян также рассматривается как результат скрещивания растений с различным внутривидовым уровнем плоидности. Для получения жизнеспособных семян эндосперм кукурузы должен содержать материнский и отцовский геномы в соотношении 2 : 1, а изменение этой дозы нарушает переход от митотического деления клеток эндосперма к эндоредупликации. Однако даже когда растения с различным уровнем плоидности остаются жизнеспособными, синцитиальное деление эндосперма изменяется в зависимости от того, наследуются ли избыточные геномы от мужского или женского родителя. Избыток материнского генома связан с ранним развитием эндосперма, а отцовского – с его недоразвитием или отсутствием. Так, Mimulus – род травянистых растений, состоящий из нескольких недавно разошедшихся в эволюции видов, представляет интересную систему для изучения эффектов гибридного эндосперма. M. guttatus и M. nudatus относятся к самоопыляемым видам, а также легко скрещиваются между собой. Однако при этом из-за отсутствия или замедленной пролиферации эндосперма образуются плоские или сморщенные гибридные семена [28].
Комплекс FIS-PRC2 играет центральную роль в регуляции развития эндосперма и зародыша. Этот комплекс поддерживает баланс между родительскими геномами и сдерживает развитие генетического конфликта, подавляя эндосперматогенез при отсутствии опыления, а в случае оплодотворения контролирует нормальное развитие зародыша и эндосперма. Так, мутации генов данного комплекса вызывают неконтролируемую пролиферацию центральной клетки и развитие семенной кожуры при отсутствии оплодотворения, приводя к формированию семяподобных структур с диплоидным эндоспермом, которые со временем абортируются [29]. Другие импринтированные гены включают гены биосинтеза ауксинов. Специфичные для эндосперма гены юкки, необходимые для биосинтеза ауксина, в растениях риса, кукурузы, арабидопсиса и родственных видов экспрессируются только с отцовского аллеля [30]. Ген ауксина YUC1 необходим для нормальной пролиферации эндосперма. Растения с мутациями в этом гене имеют более мелкие семена со сниженным числом клеток эндосперма.
Женский гаметофит контролирует развитие зародыша и эндосперма, подавляя их развитие в отсутствие фертилизации через импринтинг. Каким же образом происходит развитие апомиктических покрытосеменных растений, у которых зародыши возникают без мейоза и оплодотворения? В большинстве случаев при апомиксисе изменяется только способ образования зародыша, а эндосперм образуется так же, как и при половом размножении.
Таким образом, геномный импринтинг у высших растений служит, по всей видимости, барьером для полиплоидизации и межвидовой гибридизации, поддерживая баланс между родительскими геномами, и связан с развитием эндосперма как ткани, обеспечивающей питание зародыша, а женский гаметофит контролирует развитие зародыша и эндосперма, подавляя их развитие в отсутствие фертилизации.
ГЕНОМНЫЙ ИМПРИНТИНГ В ЦАРСТВЕ ЖИВОТНЫХ
У листовых, или почвенных комариков Sciara coprophila описан хромосомный импринтинг – в ходе эмбриогенеза у отцовских особей происходит программируемое элиминирование половых хромосом отцовского происхождения [2]. Ключевую роль в этом процессе играет контролирующий элемент, расположенный в прицентромерном гетерохроматине короткого плеча X-хромосомы. У мучнистого, или цитрусового червеца Planococcus citri самец и самка развиваются из оплодотворенной яйцеклетки, при этом они характеризуются половым диморфизмом – фенотипически самки похожи на имаго, а самцы на двукрылых комариков. Это обусловлено тем, что самцы, в отличие от самок, гаплоидны. В ходе онтогенеза у них происходит избирательная элиминация всего отцовского генома посредством его гетерохроматинизации. В период первых дроблений зиготического ядра будущие мужские и женские особи одинаковы, однако на 7–8-й стадии дробления при отсутствии дифференцировки клеток у мужских особей происходит избирательная инактивация и превращение всего мужского генома в гетерохроматин. Таким образом, поведение мужских и женских хромосом зависит от их родительского происхождения [31].
Геномный импринтинг характерен для двух инфраклассов млекопитающих – Metatherians (сумчатые, такие как опоссум и валлаби, имеющие элементарную плаценту) и Eutherians (истинные плацентарные, такие как человек и мышь) [32]. У Monotremata (яйцекладущие млекопитающие, такие как утконос и ехидна) импринтированные гены не обнаружены [33].
Ранние млекопитающие произошли от рептилий около 245 млн лет назад во время позднего пермского и раннего триасового периодов. Яйцекладущие млекопитающие отделились от плацентарных около 166 млн лет назад, а разделение на плацентарных и сумчатых произошло между 125 и 148 млн лет назад. Таким образом, геномный импринтинг у млекопитающих возник в эволюции примерно 150 млн лет назад.
По репродуктивной стратегии плацентарные и сумчатые млекопитающие отличаются от остальных многоклеточных животных:
− виды, перешедшие на живорождение, получили преимущества, необходимые для выживания потомства в неблагоприятных условиях – плод находится в организме самки и защищен от холода и хищников, в то время как оставленное без присмотра яйцо представляет легкую добычу;
− зародыш может непосредственно влиять на объем материнских ресурсов, используемых для его собственного роста. Большинство беспозвоночных и позвоночных используют репродуктивную стратегию, связанную с откладыванием яиц, в этом случае эмбрионы не способны прямо влиять на материнские ресурсы;
− экспрессия импринтированных генов у плацентарных и сумчатых млекопитающих делает их полностью зависимыми от полового воспроизведения, запрещая возможность партеногенеза, когда женская гамета развивается в новую диплоидную особь без оплодотворения мужской гаметой, т.е. при половом размножении невозможно обойтись без отцовского генома.
Следует отметить, что развитие плаценты связано с эволюцией постзиготической репродуктивной изоляции, и оно характерно не только для млекопитающих. Так, у живородящих онихофор (Onychophora grube) осуществляется взаимодействие между системами циркуляции плода и матери. У гидроидной медузы (Crossota millsae) оплодотворенные яйцеклетки развиваются в яичниках, эмбрионы, размер которых достиг 6 мм, открепляются от материнского тела. Однако при этом они уплывают не сразу, а держатся под материнским куполом, питаясь за счет ее ресурсов. Это пример вынашивания, живорождения и выкармливания молоди за счет материнских запасов. У мшанок (Bugula flabellata и B. neritina) развивающиеся эмбрионы находятся в специальных выводковых камерах, где они сначала питаются клетками и тканями эмбриональной оболочки, поглощая их за счет фагоцитоза, пиноцитоза и активного трансмембранного транспорта. На последующих этапах развития эмбриона стенка эмбриофора разрастается, и через нее эмбрионы также получают от материнского организма питательные вещества. У сальпы, или талиацеи (Thaliacea, класс оболочников) все виды без исключения вынашивают эмбрионы бесполого поколения в материнском теле. Кроме сальпы есть еще ортонектиды и дициемиды – эндопаразиты беспозвоночных животных, которые характеризуются внутриутробным развитием с питанием за счет материнских ресурсов и живорождением. У всех трематод бесполое поколение (редии) развивается внутри материнской спороцисты, питаясь материнскими ресурсами. У рыбы-молота (Eusphyra blochii) имеется подобие плаценты, которая формируется в результате близкого расположения эмбриональных и родительских тканей, тесно контактирующих либо по всей поверхности оболочек эмбриона, либо с наиболее выступающими частями. Невозможно обойти стороной и яркий пример того, как большинство самцов отряда иглообразные (Syngnathiformes), представителем которых является морской конек (Hippocampus), вынашивают потомство. У большинства представителей этого отряда на брюшке самцов появляется кожная складка, куда самка мечет икру, после чего из кожной складки образуется хорошо снабжающаяся кровью сумка с плацентоподобной структурой, в которой развиваются эмбрионы [34]. Тем не менее, импринтированные гены у морских коньков не выявлены. Таким образом, живорождение, появившееся параллельно и независимо в разных группах животных, привело к образованию различных способов внутриутробного питания эмбрионов, среди которых плацентотрофия оказалась “выгодной” для большого количества животных. Но наибольшее структурное разнообразие плацента получила именно у плацентарных.
В эволюции млекопитающих первыми импринтированными генами стали Ins, Mest, Peg10, Igf2, Igf2r и H19 [17]. Интересно, что все они – бывшие вирусные гены, которые геном млекопитающих смог подчинить себе. Такие гены обнаружены и в геноме валлаби – представителя инфракласса сумчатых млекопитающих. Это консервативные гены, сохранившие свою моноаллельную экспрессию на протяжении всей эволюции млекопитающих, в том числе и у человека (кроме IGF2R). В то же время эпигенетический статус некоторых импринтированных генов изменился. Так, у человека известны 63 гена с отцовской и 34 – с материнской экспрессией, тогда как в геноме мыши имеется 50 генов с отцовской и 62 с материнской экспрессией. Шесть генов, импринтированных у мыши, у человека имеют биаллельную экспрессию, а два локуса, наоборот, импринтированы только у человека. Функции этих генов разнообразны (табл. 1). Таким образом, в эволюции животных импринтированный характер генной экспрессии возник и закрепился у сумчатых и плацентарных млекопитающих, по всей вероятности, с развитием плаценты и живорождения. В то же время полиморфный характер экспрессии импринтированных генов у разных видов плацентарных млекопитающих может свидетельствовать о том, что геномный импринтинг в эволюции не полностью устоялся и находится в процессе развития.
Таблица 1.
Импринтированные гены человека и мыши с полиморфным эпигенетическим статусом
| Локализация человек (мышь) |
Ген человек (мышь) |
Эпигенетический статус | Функция* | |
|---|---|---|---|---|
| человек | мышь | |||
| 7q21.3 (6 A1) |
PON3 (Pon3) | Не импринт | Импринт | Гидролиз лактонов и ингибирование окисления липопротеинов низкой плотности, замедление возникновения и прогрессирования атеросклероза |
| PON2 (Pon2) | Не импринт | Импринт | Защита клеток от окислительного стресса | |
| ASB4 (Asb4) | Не импринт | Импринт | Участие в убиквитинопосредованном распаде белка в протеасомах | |
| 11p15 (7 F5) |
ASCL2 (Ascl2) | Не импринт | Импринт | Активация транскрипции, участие в определении нейрональных предшественников в периферической и центральной нервной системе |
| 11p15.4 (7 E3) |
AMPD3 (Ampd3) | Не импринт | Импринт | Катализ гидролитического дезаминирования аденозинмонофосфата в инозинмонофосфат в катаболическом пути аденилата |
| 11q13.4 (7 F5) |
DHCR7 (Dhcr7) | Не импринт | Импринт | Участие в синтезе холестерина |
| 12q21 (10 C3) |
DCN (Dcn) |
Не импринт | Импринт | Компонент соединительной ткани, связывается с фибриллами коллагена и играет роль в сборке матрикса |
| 18q11 (18A2-B2) |
IMPACT (Impact) | Не импринт | Импринт | Участие в нейрогенезе |
| Xq13 (X D) |
XIST (Xist) |
Не импринт | Импринт | Кодирующий РНК ген – главный эффектор инактивации Х-хромосомы |
| TSIX (Tsix) |
Не импринт | Импринт | Ген, кодирующий РНК, антисмысловую к Xist РНК. | |
| 13q14 (14 D2) |
RB1 (Rb1) |
Импринт | Не импринт | Опухолевый супрессор, участие в регуляции транскрипции |
| 20q13 (2 H3) |
L3MBTL (L3mbtl) | Импринт | Не импринт | Белок-регулятор группы Polycomb, участвует в ремоделировании хроматина, тем самым подавляя экспрессию генов |
Примечание: Импринт – импринтированный ген; Не импринт – не импринтированный ген. * Информация согласно базе данных GeneCards [http://www.genecards.org].
ГЕНОМНЫЙ ИМПРИНТИНГ В РЕГУЛЯЦИИ ЭМБРИОНАЛЬНОГО И ПОСТНАТАЛЬНОГО РАЗВИТИЯ ЧЕЛОВЕКА
Большинство импринтированных генов участвуют в эмбриональном развитии сумчатых и плацентарных млекопитающих, в том числе и человека. Они контролируют клеточную пролиферацию и дифференцировку плацентарных тканей, метаболизм некоторых гормонов и ростовых факторов [26].
В начале 80-х годов прошлого столетия J. McGrath и D. Solter, а также независимо от них M.A. Surani и соавт. провели эксперименты по трансплантации пронуклеусов у мышей, впервые доказав функциональную неэквивалентность мужского и женского геномов [35, 36]. Как гиногенетические (диплоидный геном, содержащий только хромосомы матери), так и андрогенетические (диплоидный геном, содержащий только хромосомы отца) зиготы оказались неспособны к дальнейшему нормальному развитию. В первом случае (при гиногении) происходило формирование только эмбриона, который останавливался в своем развитии на стадии четырех–пяти сомитов; во втором случае (при андрогении) развивались исключительно внезародышевые структуры, что приводило к разрастанию трофобласта при отсутствии эмбриона. И только эмбрионы, имеющие один отцовский и один материнский пронуклеус, нормально развивались и давали жизнеспособное и фертильное потомство. На основании этих экспериментов выдвинута гипотеза, согласно которой в материнском геноме экспрессируются импринтированные гены, жизненно важные для развития самого эмбриона, в то время как отцовский геном обеспечивает экспрессию генов, необходимых для развития внезародышевых структур и питания эмбриона.
Моноаллельная экспрессия импринтированного гена предполагает, что для проявления патологического фенотипа достаточно мутации в одном из аллелей. Спектр таких мутаций сводится к четырем основным типам:
− генные мутации, инактивирующие единственный экспрессирующийся аллель;
− CNV (Copy number variation – вариации числа копий повторов ДНК), содержащие импринтированные гены; как правило, это микроделеции или микродупликации участков хромосом с локализованными в них импринтированными генами;
− полные и сегментные однородительские дисомии (ОРД) хромосом, изменяющие баланс дозы генов материнского и отцовского происхождения в геноме;
− эпимутации – наследуемые и ненаследуемые изменения экспрессии гена, не связанные с нарушением его нуклеотидной последовательности, а обусловленные эпигенетическими модификациями ДНК или белков хроматина.
Мутации этих типов регистрируются как в пренатальном, так и в постнатальном развитии человека. Однако в постнатальном периоде преобладают CNV (53%), тогда как в пренатальном периоде отбор направлен на эпимутации в импринтированных генах (65%) (табл. 2), т.е. отбор действует преимущественно против регуляторных и потенциально обратимых эпигенетических модификаций, но не структурных нарушений, таких как делеции, ОРД или точечные мутации. Решающее значение для развития и функционирования плаценты во время беременности имеют импринтированные гены, поддерживающие баланс между материнскими ресурсами и потребностями эмбриона [38]. Эпимутации связаны, в первую очередь, с аномалиями дифференциального метилирования импринтированных генов – гиперметилированием активного аллеля, что приводит к подавлению экспрессии гена на обоих гомологах и гипометилированию неактивного локуса, формирующего экспрессию двойной дозы гена. Глобальное гипометилирование материнских импринтированных аллелей показано при биродительском полном пузырном заносе у человека. Функционально такой эпигенетический статус материнского генома эквивалентен наследованию обоих хромосомных наборов от отца, как при классическом полном пузырном заносе [39].
Таблица 2.
Спектр и частота мутаций импринтированных генов в пре- и постнатальном периоде развития человека
| Тип мутаций | Период развития | |
|---|---|---|
| пренатальный, %* | постнатальный, %** | |
| Однородительские дисомии | 14 | 17 |
| CNV | 18 | 53 |
| Точковые мутации в импринтированных генах | 3 | 5 |
| Эпимутации импринтированных генов | 65 | 25 |
| Всего: | 100 | 100 |
* Результаты анализа 162 случаев (из 8246) нарушений геномного импринтинга в пренатальном периоде развития (анализ 43 статей по запросу “imprinted gene mutations in spontaneous abortions”, “uniparental disomy in spontaneous abortions”, “SNP micro-array analysis of spontaneous abortion”, “microarray analysis and next-generation sequencing of spontaneous abortions” в поисковой базе данных PubMed от 08.04.2020); ** по данным обзора Grafodatskaya и соавт. [37].
Эпимутации как отдельных импринтированных генов, так и мультилокусные дефекты метилирования описаны при остановке эмбрионального развития. Так, эпимутации одновременно в двух импринтированных аллелях – в центре импринтинга KCNQ1OT1 и гене PLAGL1 – обнаружены нами при изучении статуса метилирования импринтированных локусов во внезародышевых тканях (цитотрофобласт хориона и внезародышевая мезодерма) спонтанных абортусов I триместра беременности (в 2.3% случаев) [40, 41]. Позднее свидетельства нарушений функционального статуса импринтированных локусов генома у спонтанных абортусов получены и в других исследованиях как при анализе экспрессии, так и при изучении характера метилирования импринтированных генов. Так, Diplas и соавт. [42] при внутриутробной задержке роста плода обнаружили повышенную экспрессию импринтированных генов PHLDA2, ILK2, NNAT, CCDC86 и PEG10, тогда как PLAGL1, DHCR24, ZNF331, CDKAL1 имели, напротив, сниженную экспрессию. Показано также гипометилирование генов DLK1, H19 и SNRPN.
Doria и соавт. [43] обнаружили повышение экспрессии гена PHLDA2 и снижение экспрессии PEG10 у спонтанных абортусов по сравнению с контролем (ткани плода в III триместре беременности). Pliushch и соавт. [44] при анализе плодных тканей выявили множественное гиперметилирование импринтированных генов у 4% (2 из 55) спонтанных абортусов и в 18% (10 из 57) случаев мертворождений. Проведен анализ генов H19, LIT1, PEG3 и SNRPN, экспрессирующихся с отцовского гомолога, и двух генов – MEG3 и NESP55, экспрессирующихся в норме с материнской хромосомы. Zechner и соавт. [45] в выборке спонтанных абортусов показали гиперметилирование генов INS, TRPM5, PWCR1, GABRA5 с отцовской экспрессией и только одного гена, H19, экспрессирующегося на материнском гомологе.
По нашим данным, в плацентарных тканях (цитотрофобласт хориона и внезародышевая мезодерма) спонтанных абортусов I триместра беременности с нормальным кариотипом частота эпимутаций составила 5%. Среди эпимутаций преобладало постзиготическое гипометилирование импринтированных генов на хромосомах материнского происхождения, составившее 4.2% [46]. У каждого зародыша выявлены множественные эпимутации, затрагивающие одновременно от четырех до 12 импринтированных генов. Эпимутации были представлены гипометилированием таких импринтированных генов, как GRB10, CPA4, PHLDA2, ZNF215, экспрессирующихся в норме с материнского гомолога, и PEG10, PLAGL1, WT1, HTR2A, DLK1, GABRB3, KCNQ1, функционирующих только на отцовской хромосоме.
На сегодняшний день известно о 13 болезнях геномного импринтинга (табл. 3), проявляющихся, как правило, нарушением роста, физического и интеллектуального развития, обмена веществ и дифференцировки центральной нервной системы [47]. Болезни геномного импринтинга обусловлены преимущественно нарушением конкретных импринтированных локусов. При этом в одной и той же импринтированной области могут возникать разнонаправленные эпимутации, которые приведут к формированию клинической картины различных заболеваний. Например, гипометилирование центра импринтинга H19 (11p15.5) на хромосоме материнского происхождения объясняет до 30–60% случаев синдрома Рассела–Сильвера, тогда как гиперметилирование этого региона на хромосоме отцовского происхождения отмечено в 5% случаев синдрома Видеманна–Беквита [48].
Таблица 3.
Болезни геномного импринтинга в постнатальном периоде развития человека
| Синдром | OMIM | Регион |
|---|---|---|
| Транзиторный неонатальный сахарный диабет | 601 410 | 6q24 |
| Бирка–Барела | 612 292 | 8q24.3 |
| Рассела–Сильвера | 180 860 | 11p15.5, 7p11.2–p13, 7q31 |
| Видеманна–Беквита | 130 650 | 11p15.5 |
| IMAGe | 614 732 | 11p15.4 |
| Прадера–Вилли | 176 270 | 15q11–q13 |
| Шaaф–Янга (Прадера–Вилли-подобный синдром) | 615 547 | |
| Ангельмана | 608 636 | |
| Дупликации 15q11–q13 | 608 636 | |
| Тeмпла | 616 222 | 14q32 |
| Кагами–Огата | 608 149 | |
| Псевдогипопаратиреоз типа 1А | 103 580 | 20q13.3 |
| Псевдогипопаратиреоз 1В | 603 233 |
Таким образом, нарушения экспрессии импринтированных генов встречаются как в пренатальном, так и в постнатальном периоде развития человека. В структуре причин нарушений геномного импринтинга у живорожденных индивидов преобладают CNV, а в пренатальном периоде развития – эпимутации в импринтированных генах. Приведенные данные доказывают участие импринтированных генов в регуляции эмбрионального развития.
ГЕНОМНЫЙ ИМПРИНТИНГ В НЕОНАТАЛЬНОМ РОСТЕ И РАЗВИТИИ МОЗГА
Геномный импринтинг в эволюции шел не только по пути участия в регуляции развития плаценты, но и формирования головного мозга под влиянием плаценты и давления отбора, регулирующего материнство [49]. Формирующийся мозг является одной из мишеней, на которую действует геномный импринтинг. Это впервые показали E.B. Keverne и соавт. в 1996 г. [50], изучавшие гиногенетические и андрогенетические дисомные химерные клетки мыши в мозге. Первые из них были распределены по всей коре, стриатуму и гиппокампу, в то время как андрогенетические клетки обнаружены преимущественно в гипоталамусе, что указывало на различную роль генетической информации, передаваемой по материнской и отцовской линии, в различных областях мозга [51].
Импринтированные гены служат центрами контроля функций мозга, обеспечивают регуляцию и стабильный транскрипционный контроль развития нервной системы и поведения. Многочисленные данные свидетельствуют о том, что геномный импринтинг вовлечен в ключевые процессы развития нервной системы, включая экспансию, миграцию и дифференцировку нейрональных предшественников и поляризацию клеток [49]. И действительно, для нейрональной дифференцировки требуется индукция многих факторов транскрипции, чтобы активировать нейроспецифичные программы транскрипции. Импринтированные гены играют важную роль в этом процессе. В развивающемся мозжечке транскрипция гена Zac1/Plagl1, экспрессирующегося с отцовского аллеля, ограничивается желудочковой зоной и наружным гранулярным слоем специфических долек, где она способствует дифференцировке ГАМК-ергических интернейронов и клеток Гольджи [52]. Экспрессирующийся в норме с отцовского гомолога ген Dio3 защищает развивающийся мозжечок от преждевременной стимуляции тиреоидным гормоном, который контролирует образование гранулярных клеток во внешнем зародышевом слое, их миграцию во внутренний слой мозжечка и ветвление дендритов клеток Пуркинье [53]. Соответственно, делеции Dio3 приводят к исчезновению внешнего слоя и нарушению опорно-двигательного аппарата.
В развивающемся мозге миграция нейронов в нужные участки имеет большое значение для установления надлежащей идентичности и функциональной связи. Этот этап дифференцировки также опосредован клеточными процессами, которые зависят от геномного импринтинга. Полимеризация актина, которая имеет решающее значение для подвижности клеток в кортикальной пластинке, активируется, в том числе, импринтированным геном CDKN1C с материнской экспрессией [54]. Тангенциальная миграция дифференцирующихся ГАМК-ергических интернейронов из базального переднего мозга в кору головного мозга требует повышенной транскрипционной активности комплекса DLX2-NDN [55]. Соответственно, кортикальная ГАМК-ергическая система нарушается при делеции гена NDN на отцовском гомологе. Отсутствие экспрессии этого гена приводит к нарушению развития нервной системы при синдроме Прадера–Вилли [56].
Важное значение для миграции нейронов имеет также нейрональная активность. В частности, экспрессирующийся в норме с материнского аллеля KCNK9 контролирует потенциалы покоя и нейрональную возбудимость, а мутации, передаваемые по материнской линии, блокируют миграцию нейронов и задерживают созревание дендритов, вызывая развитие синдрома Бирка–Барела [57]. В результате у больных с данным синдромом наблюдается умственная отсталость (от умеренной до тяжелой), гиперактивность и проблемы с питанием в младенческом возрасте.
Внимание к эволюционному ремоделированию мозга в связи с геномным импринтингом усилилось после открытия импринтированных генов, связанных с апоптозом [49]. В развивающейся нервной системе апоптоз служит для контроля общего нейронного пула и согласованной работы пре- и постсинаптических нейронов. Апоптоз регулируется внутренними и внешними стимулами, сдвигающими баланс между проапоптотическими (запускают апоптоз) и антиапоптотическими (подавляют апоптоз) белками. В проапоптотическом состоянии проницаемость митохондриальных мембран увеличивается, что приводит к высвобожению цитохромов, активации каспазы и последующей гибели клеток. Как правило, импринтированные гены, экспрессирующиеся только с отцовского гомолога, являются антиапоптотическими, тогда как с материнской хромосомы экспрессируются проапоптотические гены [58]. Так, ген Blcap, импринтированный у мыши и человека, имеет моноаллельную материнскую экспрессию в мозге и биаллельную – в плаценте. Этот ген относится к проапоптопическим, так как является опухолевым супрессором, который ограничивает пролиферацию клеток и стимулирует апоптоз. Белок BLCAP отсутствует во многих типах опухолей человека [59, 60]. Экспрессируемый с материнского гомолога MEG3 также может играть проапоптотическую роль в головном мозге, подавляя формирование опухолей гипофиза через транскрипционную активацию p53 [61].
Ген UBE3A (убиквитинзависимая лигаза Е3) импринтирован в клетках мыши и человека, в клетках Пуркинье мозжечка и в нейронах гиппокампа он экспрессируется исключительно с материнского аллеля [62]. Убиквитинлигаза Е3 участвует в деградации белков в клетках, удаляя тем самым поврежденные или ненужные белки и помогая поддерживать нормальную функцию клеток. Убиквитинируя P53, UBE3A может играть также антиапоптотическую роль [63], а его делеция на материнской хромосоме приводит к уменьшению размера мозга. Подавление экспрессии этого гена считается причиной развития синдрома Ангельмана и специфических для этого синдрома признаков – задержки психического развития, эпилепсии, атаксии, частых приступов смеха, стереотипных движений рук, отсутствия речи, сопровождается глубокой умственной отсталостью, аутизмом нарушением сна и судорогами.
Ген PEG3 человека экспрессируется моноаллельно с отцовского гомолога. Он кодирует белок, который участвует в p53-опосредованном апоптозе, действуя как опухолевый супрессор. Гиперметилирование, подавляющее экспрессию Peg3 мыши, индуцирует P53-зависимый апоптоз в переднем мозге, полосатом теле, миндалине и гипоталамусе. У человека ген NDN с отцовской экспрессией предотвращает апоптоз в клетках мозжечковых гранул, блокируя трансактивацию E2F проапоптотических мишеней [58].
Интерес вызывает и то, что одни и те же гены могут быть импринтированы как в развивающемся гипоталамусе, так и в плаценте – двух структурно и функционально различных структурах. Плацента млекопитающих связывает мать и плод через эндокринные сигналы, которые нацелены на материнский гипоталамус, подготавливая женщину к родам, лактации и материнству. Изучение мышей, несущих мутацию в импринтированном гене Peg3, позволило получить ответ на некоторые вопросы о том, как функционирует гипоталамус плода, который в ходе пренатального развития вырабатывает плацентарные гормоны, определяющие хорошую заботу матери о потомстве [38]. Делеция этого гена только в клетках гипоталамуса самки, либо только в плаценте имела функционально схожие последствия – нарушение заботы самки о потомстве. Таким образом, по-видимому, действие этого гена эволюционно коадаптировано в гипоталамусе матери и плаценте. Известны также импринтированные гены Necdin, Peg1/Mest и Magel2 со схожей с Peg3 нейроэндокринной функцией, связанной с успешным материнством [64]. Отсутствие экспрессии одного из этих генов приводит к снижению уровня окситоцина в нейронах мыши, как и при гиперметилировании Peg3, поскольку эти гены в норме участвуют в синтезе гормонов, важных для родов и заботы о потомстве [65]. Кроме того, продукты генов Peg3 и Necdin взаимодействуют с Hif1a и Arnt. Arnt кодирует белок HLH-PAS, который связывается с Sim1, участвуя тем самым в развитии окситоцинергических нейронов гипоталамуса [66]. Любопытно, что Hif1a и Arnt также вовлечены в развитие плаценты, они участвуют в дифференцировке гигантских клеток, которые продуцируют гормоны плаценты, регулирующие материнское поведение. Импринтированный ген Phlda2 экспрессируется с материнского гомолога в плаценте, а его продукт воздействует на мозг матери через такие гормоны, как плацентарные лактогены [67, 68].
Импринтированный ген GRB10 в эмбриональном головном и спинном мозге человека экспрессируется только с отцовского аллеля, а в плаценте – только с материнского [69]. Во всех остальных тканях плода экспрессия гена GRB10 имеет биаллельный характер. Предполагается, что экспрессия GRB10 в плаценте может быть эволюционно важной для контроля роста плода. Продукт гена принадлежит к адаптерным белкам, которые взаимодействуют с рядом рецепторов тирозинкиназ и сигнальных молекул, с рецепторами инсулина и инсулиноподобного фактора роста. Избыточная экспрессия некоторых изоформ белка GRB10 ингибирует активность тирозинкиназы и таким образом подавляет рост клеток. Действительно, потеря экспрессии материнского аллеля в эмбриогенезе приводит к значительному росту плода и плаценты, что нарушает правильное распределение материнских ресурсов, требуемых для этого процесса. В то же время нарушение моноаллельной экспрессии Grb10 в мозге мышей приводит к повышенному социальному доминированию, особенно по сравнению с другими аспектами социального поведения, что подтверждается увеличением аллогруминга у самцов с дефицитом Grb10 [70, 71]. Противоположная моноаллельная экспрессия в плаценте по сравнению с мозгом поддерживает гипотезу о том, что импринтинг GRB10 мог эволюционировать, чтобы дифференцировать плейотропные эффекты этого гена в пренатальном росте и поведении млекопитающих.
Важно отметить, что гипоталамус плода и плацента развиваются в период, критически значимый для формирования плацентарного кровоснабжения, обеспечивая тем самым питание плода и выработку гормонов плаценты, которые регулируют гипоталамус матери. Таким образом, плацента участвует в развитии гипоталамуса плода, а гипоталамус матери предоставляет ресурсы для этого. Интересно, что плацентарные стволовые клетки могут дифференцироваться в нейроны [72]. Такая связь коадаптации плаценты и материнского мозга гарантирует, что потомство, которое имело “хорошее” материнское воспитание, будет хорошо обеспечено и генетически предрасположено к формированию гипоталамуса, который определит заботу матери о ее потомстве и в следующем поколении [73].
В ходе эволюции мозг млекопитающих подвергся значительному росту по сравнению с мозгом других позвоночных, и это продолжается, достигая пика у больших обезьян и гоминид. Неокортекс (новая кора) – это наиболее развивающаяся в эволюции кора головного мозга. Она располагается в верхнем слое полушарий мозга и отвечает за высшие нервные функции – сенсорное восприятие, выполнение моторных команд, осознанное мышление и, у людей, речь. Неокортекс в основном развивается после рождения, когда все млекопитающие находятся в тесной связи с их матерями и социальными группами. Он содержит клетки двух основных типов: пирамидные нейроны (~80%) и ГАМК-ергические интернейроны (~20%). ГАМК-ергические нейроны являются неотъемлемой частью развития цитоархитектуры неокортекса. На ранних стадиях эмбрионального развития они деполяризуют основные нейроны, увеличивая содержание внутриклеточного кальция, необходимого для роста нейронов и их дифференцировки [74]. Импринтированный и экспрессирующийся только на отцовском гомологе ген Necdin действует как супрессор роста постмитотических нейронов. Гипометилирование этого гена у мышей приводит к уменьшению популяции клеток неокортекса (ГАМК-ергических нейронов) и предрасположенности к судорогам.
Таким образом, эволюция геномного импринтинга проходила одновременно по пути участия в развитии мозга и регуляции плаценты, в формировании головного мозга под влиянием плаценты и давлении отбора, регулирующего материнство.
ГИПОТЕЗЫ ВОЗНИКНОВЕНИЯ ГЕНОМНОГО ИМПРИНТИНГА В ЭВОЛЮЦИИ
В эволюции геномный импринтинг возник у некоторых насекомых, но закрепился он у сумчатых и плацентарных млекопитающих, а также у покрытосеменных, или цветковых растений. Результатом геномного импринтинга стала гаплоидизация локусов, играющих ключевую роль в обеспечении нормального эмбрионального развития посредством влияния на уровень экспрессии генов, контролирующих рост эмбриона, пролиферацию и дифференцировку клеток, другие процессы внутриутробного развития плода, плаценты, ЦНС и метаболизма у животных [49], а также в регуляции развития семян с участием эндосперма у покрытосеменных растений. В любом случае, для нормального развития организма необходимы оба родительских генома.
Появление геномного импринтинга в эволюции объясняется несколькими гипотезами. Одна из них предполагает, что импринтинг развился в качестве защиты от партеногенеза и связанных с ним нарушений развития, чтобы избежать высокой частоты гомозиготизации вредных рецессивных мутаций [75]. Кроме того, согласно гипотезе “замедленной бомбы” геномный импринтинг, возможно, появился, чтобы сохранить ооциты от летальной тератомы яичников, формирующейся при партеногенезе [76]. Еще одна гипотеза – “трофобластная защита” – предполагает, что материнский геном находится в условиях повышенного риска, поскольку мать анатомически приспособлена к внутриутробному воспроизведению. И этот риск возникает, если спонтанная активация яйцеклетки может привести к полному эмбриональному развитию. Таким образом, предполагается, что импринтинг либо подавляет в материнском геноме экспрессию генов, стимулирующих развитие плаценты, либо активирует гены, лимитирующие этот процесс. Следовательно, после того как произошло оплодотворение, гены, необходимые для формирования плаценты, должны экспрессироваться только с отцовского генома [77].
Для объяснения адаптивного преимущества импринтинга в эволюции плацентарных млекопитающих предложены еще несколько гипотез. Одна гипотеза, “оборонительная”, объясняет роль геномного импринтинга с точки зрения защиты генома хозяина от проникновения в него чужеродных генетических элементов. Согласно этой гипотезе, импринтинг, в частности метилирование ДНК – это защитный механизм, обеспечивающий инактивацию паразитических ДНК, таких как транспозоны и провирусная ДНК [78]. Уникальная особенность плаценты млекопитающих – наличие трофобласта. Импринтированный ген PEG10 с отцовской экспрессией играет существенную роль в дифференцировке клеток трофобласта в спонгиотрофобластном и лабиринтном слоях. Если это так, то “одомашнивание” PEG10 было критическим событием в появлении современных плацентарных живородящих организмов [79, 80]. Ген Peg10, необходимый для развития плаценты, был позаимствован путем горизонтального переноса сумчатыми млекопитающими у ретротранспозона Sushi-ichi, относящегося к семейству Ty3/gypsy и имеющего длинные концевые повторы (LTR, long terminal repeat). Делеция этого гена приводит к ранней эмбриональной летальности у мышей в связи с отсутствием в плаценте спонгиотрофобластных и лабиринтных слоев [81]. Еще один импринтированный ген Peg11 (также известный как Rtl1) – это одомашненный ретротранспозон семейства Ty3/gypsy. Нокаут данного гена приводит к фетальной летальности у мышей [82], обусловленной тяжелыми дефектами капилляров в лабиринтном слое плаценты.
Однако наиболее популярна гипотеза, которая предполагает, что геномный импринтинг возник в ответ на ситуацию “конфликта полов” или коадаптацию отцовского и материнского геномов в регуляции роста плода [83]. Увеличение плаценты и массы плода может обеспечить преимущественное размножение потомков по линии отца, но при этом истощит ресурсы матери. Однако если рост плаценты и плода находится под материнским контролем, то она сможет обеспечить воспроизводство большего числа потомков. Эта ситуация возникает в силу противоположных интересов материнского и отцовского геномов и стоящих за ними стратегий репродуктивного поведения самок и самцов млекопитающих. Отсюда можно предположить, что мать будет выключать (импринтировать) гены, способствующие росту плаценты и плода, тогда как отец будет подавлять экспрессию генов, препятствующую этому росту. Поэтому, отцовские импринтируемые экспрессируемые аллели, как правило, стимулируют рост эмбриона, максимизируя конкурентоспособность индивидуального потомка, имеющего конкретный отцовский геном. Материнские импринтированные гены, наоборот, подавляют рост плода, чтобы распределить материнские ресурсы между как можно большим числом потомков, которые могут иметь разные отцовские геномы. Эта гипотеза успешно объясняет экспрессию в плаценте генов, стимулирующих рост (IGF2, INS, PEG1/MEST и KCNQ1OT1), только на отцовских гомологах и экспрессию только на материнских гомологах ингибиторов роста (H19, GNAS, CDKN1C, KCNQ1OT1 и GRB10/MEG1) [81].
Гипотеза “конфликта полов” хорошо объясняет особенность взаимозависимой экспрессии импринтированных генов Igf2 и Igf2r у мыши [38]. Igf2 стимулирует рост эмбриона и экспрессируется только с отцовского аллеля. Этот ген увеличивает поступление питательных веществ от матери эмбриону. Крупные эмбрионы имеют больше шансов на выживание (что удовлетворяет интересам отца), однако для матери крупный эмбрион может оказаться слишком дорогим. Поэтому ей выгодно ограничить поступление питательных веществ к конкретному эмбриону, оставив часть своих ресурсов другим эмбрионам от других отцов. Этим объясняется отсутствие экспрессии Igf2 с материнского аллеля. Igf2r подавляет рост эмбриона и экспрессируется только с материнского аллеля. Связывание Igf2r с Igf2 приводит к деградации обоих белков, поэтому Igf2r действует как антагонист Igf2. Таким образом, импринтированные гены Igf2 и Igf2r служат оружием в войне отцов и матерей за ресурсы, которые мать может предоставить эмбриону.
Импринтированную экспрессию генов растений трудно объяснить с позиции “конфликта полов”. Так, импринтированный ген Meg1 кукурузы способствует дифференцировке клеток, переносящих питательные вещества эндосперма, и, следовательно, питанию развивающегося семени [82]. Увеличение дозы Meg1 приводит к увеличению эмбрионов и эндосперма. Таким образом, Meg1 – это именно тот тип гена, у которого, по прогнозам, должен быть метилирован материнский аллель, но, вопреки ожиданиям, он экспрессируется. Сходным образом двойная экспрессия импринтированного и в норме экспрессирующегося с материнского аллеля гена AtFH5 у A. thaliana, может вызвать чрезмерный рост эндосперма, участвующего в передаче зародышу материнских ресурсов [83].
ЗАКЛЮЧЕНИЕ
Эволюция геномного импринтинга шла в направлении регуляции эмбрионального и неонатального роста, а также развития головного мозга и закрепилась у сумчатых и плацентарных млекопитающих, а также у цветковых растений. С первым направлением связано развитие плаценты, а значит и возникновение такой потенциально рискованной стратегии, как живорождение, поэтому любые проблемы в развитии представляют угрозу не только для будущего поколения, но и для самой матери. В ходе эволюции был выработан жесткий контроль над регуляцией дозы генов путем их моноаллельной экспрессии, т.е. через геномный импринтинг. Второе направление неотъемлемо связано с развитием неокортекса, который отвечает за высшие нервные функции – сенсорное восприятие, выполнение моторных команд, осознанное мышление, речь. Существование гипоталамо-плацентарной коадаптации и важность импринтированных генов, которые представлены в этих структурах, обеспечивает успешное протекание беременности, а значит, пренатальное развитие, заботу о потомстве и интеллектуальное развитие ребенка.
Исследование выполнено при финансовой поддержке гранта РФФИ в рамках научного проекта № 19-14-50333.
Настоящая статья не содержит каких-либо исследований, выполненных с использованием биологических материалов.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Crouse H.V. (1960) The controlling element in sex chromosome behavior in Sciara. Genetics. 45(10), 1429–1443.
Singh P.B., Belyakin S.N. (2018) L Chromosome behaviour and chromosomal imprinting in Sciara coprophila. Genes (Basel). 9(9), E440.
Rodrigues J.A., Zilberman D. (2015) Evolution and function of genomic imprinting in plants. Genes. 29(24), 2517–2531.
Renfree M.B., Hore T.A., Shaw G. (2009) Evolution of genomic imprinting: insights from marsupials and monotremes. Annu. Rev. Genomics Hum. Genet. 10, 241–262.
Woo H.R., Dittmer T.A., Richards E.J. (2008) Three SRA-domain methylcytosine-binding proteins cooperate to maintain global CpG methylation and epigenetic silencing in Arabidopsis. PLoS Genet. 4(8), e1000156.
Lindroth A.M., Cao X., Jackson J.P. (2001) Requirement of CHROMOMETHYLASE 3 for maintenance of CpXpG methylation. Science. 292(5524), 2077–2080.
Cao X., Jacobsen S.E. (2002) Role of the Arabidopsis DRM methyltransferases in de novo DNA methylation and gene silencing. Curr. Biol. 12 (13), 1138–1144.
Han Q., Bartels A., Cheng X., Meyer A., An Y.C., Hsieh T.F., Xiao W. (2019) Epigenetics regulates reproductive development in plants. Plants (Basel). 8(12), e564.
Cokus S.J., Feng S., Zhang X. (2008) Shotgun bisulphite sequencing of the Arabidopsis genome reveals DNA methylation patterning. Nature. 452(7184), 215–219.
Геращенков Г.А., Ясыбаева Г.Р., Рожнова Н.А., Чемерис А.В. (2016) Механизмы геномного импринтинга у цветковых растений. Изв. Уфимского научного центра РАН. 3, 42–52.
Ibarra C.A., Feng X., Schoft V.K., Hsieh T.F., Uzawa R., Rodrigues J.A., Zemach A., Chumak N., Machlicova A., Nishimura T., Rojas D., Fischer R.L., Tamaru H., Zilberman D. (2012) Active DNA demethylation in plant companion cells reinforces transposon methylation in gametes. Science. 337(6100), 1360–1364.
Jullien P., Susaki D., Yelagandula R. (2012) DNA methylation dynamics during sexual reproduction in Arabidopsis thaliana. Curr. Biol. 22(19), 1825–1830.
Kohler C., Wolff P., Spillane C. (2012) Epigenetic mechanisms underlying genomic imprinting in plants. Annu. Rev. Plant Biol. 63, 331–352.
Batista R.A., Moreno-Romero J., Qiu Y., van Boven J., Santos-González J., Figueiredo D.D., Köhler C. (2019) The MADS-box transcription factor PHERES1 controls imprinting in the endosperm by binding to domesticated transposons. Elife. 2(8), e50541.
Schmidt A., Wöhrmann H.J., Raissig M.T., Arand J., Gheyselinck J., Gagliardini V., Heichinger C., Walter J., Grossniklaus U. (2013) The Polycomb group protein MEDEA and the DNA methyltransferase MET1 interact to repress autonomous endosperm development in Arabidopsis. Plant J. 73(5), 776–787.
Wolf J.B., Brandvain Y. (2014) Gene interactions in the evolution of genomic imprinting. Heredity (Edinb). 12(10), e1038.
http://igc.otago.ac.nz – каталог импринтированных генов и родительских эффектов у человека и животных.
Gehring M., Satyaki P.R. (2017) Endosperm and imprinting, inextricably linked. Plant Physiol. 173(1), 143–154.
Тихонов А.В., Ефимова О.А., Пендина А.А., Баранов В.С. (2017) Эпигенетическое репрограммирование ДНК в гаметах и доимплантационных эмбрионах человека. Мед. генетика. 16(5), 17–25.
Thamban T., Agarwaal V., Khosla S. (2020) Role of genomic imprinting in mammalian development. J. Biosci. 45, e 20.
Саженова Е.А., Лебедев И.Н. (2019) Эпигенетический мозаицизм при болезнях геномного импринтинга. Генетика. 55(10), 1137–1150
Baran Y., Subramaniam M., Biton A. (2015) The landscape of genomic imprinting across diverse adult human tissues. Genome Res. 25(7), 927–936.
Nishiwaki K., Niikawa N., Ishikawa M. (1997) Polymorphic and tissue-specific imprinting of the human Wilms tumor gene WT1. Jpn. J. Hum. Genet. 42(1), 205–211.
Kermicle J.L. (1970) Dependence of the R-mottled aleurone phenotype in maize on mode of sexual transmission. Genetics. 66, 69–85.
Tuteja R.1., McKeown P.C., Ryan P., Morgan C.C., Donoghue M.T., Downing T., O’Connell M.J., Spillane C. (2019) Paternally expressed imprinted genes under positive Darwinian selection in Arabidopsis thaliana. Mol. Biol. Evol. 36(6), 1239–1253.
Ferguson-Smith A.C., Bourc’his D. (2018) The discovery and importance of genomic imprinting. Elife. 7, e42368.
Gehring M. (2019) Epigenetic dynamics during flowering plant reproduction: evidence for reprogramming? New Phytol. 224(1), 91–96.
Oneal E., Willis J.H., Franks R.G. (2016) Disruption of endosperm development is a major cause of hybrid seed inviability between Mimulus guttatus and Mimulus nudatus. New Phytol. 210(3), 1107–1120.
Kradolfer D., Wolff P., Jiang H., Siretskiy A., Kohler C. (2013) An imprinted gene underlies postzygotic reproductive isolation in Arabidopsis thaliana. Dev. Cell. 26, 525–535.
Klosinska M., Picard C.L., Gehring M. (2016) Conserved imprinting associated with unique epigenetic signatures in the Arabidopsis genus. Nat. Plants. 2, e16145.
Filia A.G., Fenn-Moltu G., Ross L. (2019) No evidence for an intragenomic arms race under paternal genome elimination in Planococcus mealybugs. J. Evol. Biol. 32(5), 491–504.
Das R.I., Hampton D.D., Jirtle R.L. (2009) Imprinting evolution and human health. Mamm. Genome. 20(9–10), 563–572.
Wolf J.B., Brandvain Y. (2014) Gene interactions in the evolution of genomic imprinting. Heredity (Edinb). 12(10), e1038.
Ostrovsky A.N., Lidgard S., Gordon D.P., Schwaha T., Genikhovich G., Ereskovsky A.V. (2016) Matrotrophy and placentation in invertebrates: a new paradigm. Biol. Rev. Camb. Philos. Soc. 91(3), 673–711.
McGrath J., Solter D. (1983) Nuclear transplantation in the mouse embryo by microsurgery and cell fusion. Science. 220, 1300–1303.
Surani M.A., Barton S.C., Norris M.L. (1984) Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis. Nature. 308, 548–550.
Grafodatskaya D., Choufani S., Basran R. (2017) An update on molecular diagnostic testing of human imprinting disorders. J. Pediatr. Genet. 6(1), 3–17.
Cassidy F.C., Charalambous M. (2018) Genomic imprinting, growth and maternal-fetal interactions. J. Exp. Biol. 221, jeb164517.
Hemida R., van Doorn H., Fisher R. (2016) A novel genetic mutation in a patient with recurrent biparental complete hydatidiform mole: a brief report. Int. J. Gynecol. Cancer. 26(7), 1351–1353.
Саженова Е.А., Лебедев И.Н. (2008) Эпимутации центра импринтинга KCNQ1OT1 хромосомы 11 при ранней эмбриональной гибели у человека. Генетика. 44(12), 1609–1616.
Саженова Е.А., Лебедев И.Н. (2010) Эпимутации импринтированного гена PLAGL1 при привычном невынашивании беременности. Мед. генетика. 9(11), 34–39.
Diplas A.I., Lambertini L., Lee M.J. (2009) Differential expression of imprinted genes in normal and IUGR human placentas. Epigenetics. 4(4), 235–240.
Doria S., Sousa M., Fernandes S., Ramalho C., Brandao O., Matias A., Barros A., Carvalho F. (2010) Gene expression pattern of IGF2, PHLDA2, PEG10 and CDKN1C imprinted genes in spontaneous miscarriages or fetal deaths. Epigenetics. 5(5), 444–450.
Pliushch G., Schneider E., Weise D., El Hajj N., Tresch A., Seidmann L., Coerdt W., Müller A.M., Zechner U., Haaf T. (2010) Extreme methylation values of imprinted genes in human abortions and stillbirths. Am. J. Pathol. 176(3), 1084–1090.
Zechner U., Pliushch G., Schneider E., El Hajj N, Tresch A., Shufaro Y., Seidmann L., Coerdt W., Müller A.M., Haaf T. (2010) Quantitative methylation analysis of developmentally important genes in human pregnancy losses after ART and spontaneous conception. Mol. Hum. Reprod. 16(9), 704–713.
Саженова Е.А., Никитина Т.В., Скрябин Н.А., Минайчева Л.И., Иванова Т.В., Немцева Т.Н., Юрьев С.Ю., Евтушенко И.Д., Лебедев И.Н. (2017) Эпигенетический статус импринтированных генов в плаценте при привычном невынашивании беременности. Генетика. 53(3), 364–377
Monk D., Mackay D.J., Eggermann T., Maher E.R., Riccio A. (2019) Genomic imprinting disorders: lessons on how genome, epigenome and environment interact. Nat. Rev. Genet. 20(4), 235–248.
Delaval K., Wagschal A., Feil R. (2006) Epigenetic deregulation of imprinting in congenital diseases of aberrant growth. Bioessays. 28(5), 453–459.
Tucci V., Isles A.R., Kelsey G., Ferguson-Smith A.C. (2019) Genomic imprinting and physiological processes in mammals. Cell. 176(5), 952–965.
Keverne E.B., Martel F.L., Nevison C.M. (1996) Primate brain evolution: genetic and functional considerations. Proc. Biol. Sci. 263(1371), 689–696.
Keverne E.B. (2001) Genomic imprinting and the maternal brain. Prog Brain Res. 133, 279–285.
Chung S.H., Marzban H., Aldinger K., Dixit R., Millen K., Schuurmans C., Hawkes R. (2011) Zac1 plays a key role in the development of specific neuronal subsets in the mouse cerebellum. Neural. Dev. 6, e25.
Peeters R.P., Hernandez A., Ng L., Ma M., Sharlin D.S., Pandey M., Simonds W.F., St Germain D.L., Forrest D. (2013) Cerebellar abnormalities in mice lacking type 3 deiodinase and partial reversal of phenotype by deletion of thyroid hormone receptor α1. Endocrinology. 154(1), 550–561.
McNamara G.I., Davis B.A., Browne M., Humby T., Dalley J.W., Xia J., John R.M., Isles A.R. (2018) Dopaminergic and behavioural changes in a loss-of-imprinting model of Cdkn1c. Genes Brain Behav. 17(2), 149–157.
Kuwajima T., Nishimura I., Yoshikawa K. (2006) Necdin promotes GABAergic neuron differentiation in cooperation with Dlx homeodomain proteins. J. Neurosci. 26(20), 5383–5392.
Cassidy S.B., Schwartz S., Miller J.L., Driscoll D.J. (2012) Prader–Willi syndrome. Genet. Med. 14(1), 10–26.
Soellner L., Begemann M., Mackay D.J., Grønskov K., Tumer Z., Maher E.R., Temple I.K., Monk D., Riccio A., Linglart A., Netchine I., Eggermann T. (2017) Recent advances in imprinting disorders. Clin. Genet. 91, 3–13.
Perez J.D, Rubinstein N.D., Dulac C. (2016) New perspectives on genomic imprinting, an essential and multifaceted mode of epigenetic control in the developing and adult brain. Annu. Rev. Neurosci. 39, 347–384.
Schulz R., McCole R.B., Woodfine K., Wood A.J., Chahal M., Monk D., Moore G.E., Oakey R.J. (2009) Transcript- and tissue-specific imprinting of a tumour suppressor gene. Hum. Mol. Genet. 18(1), 118–127.
Thamban T., Sowpati D.T., Pai V., Nithianandam V., Abe T., Shioi G., Mishra R.K., Khosla S. (2019) The putative neuronatin imprint control region is an enhancer that also regulates the Blcap gene. Epigenomics. 11(3), 251–266.
Zhou Y., Zhang X., Klibanski A. (2012) MEG3 noncoding RNA: a tumor suppressor. J. Mol. Endocrinol. 48(3), R45–R53.
Lopez S.J., Segal D.J., La Salle J.M. (2019) UBE3A: An E3 ubiquitin ligase with genome-wide impact in neurodevelopmental disease. Front. Mol. Neurosci. 11, e476.
Mishra A., Jana N.R. (2008) Regulation of turnover of tumor suppressor p53 and cell growth by E6-AP, a ubiquitin protein ligase mutated in Angelman mental retardation syndrome. Cell Mol. Life Sci. 65(4), 656–666.
Chiavegatto S., Sauce B., Ambar G., Cheverud J.M., Peripato A.C. (2012) Hypothalamic expression of Peg3 gene is associated with maternal care differences between SM/J and LG/J mouse strains. Brain Behav. 2(4), 365–376.
neson J., Stayner C., Hazlett J., Slobbe L. (2012) Somatic reactivation of expression of the silent maternal Mest allele and acquisition of normal reproductive behavior in a colony of Peg1/Mest mutant mice. J. Reprod. 58(4), 490–500
Keverne E.B. (2011) Epigenetics and brain evolution. Epigenomics. 3(2), 183–191.
Tunster S.J., Creeth H.D., John R.M. (2016) The imprinted Phlda2 gene modulates a major endocrine compartment of the placenta to regulate placental demands for maternal resources. Dev. Biol. 409(1), 251–260.
Creeth H.D., McNamara G.I., Tunster S.J., Boque-Sastre R., Allen B., Sumption L., Eddy J.B., Isles A.R., John R.M. (2018) Maternal care boosted by paternal imprinting in mammals. PLoS Biol. 16(7), e2006599.
Monk D., Arnaud P., Frost J., Hills F.A., Stanier P., Feil R., Moore G.E. (2009) Reciprocal imprinting of human GRB10 in placental trophoblast and brain: evolutionary conservation of reversed allelic expression. Hum. Mol. Genet. 15(18), 3066–3074.
Garfield A.S., Cowley M., Smith F.M., Moorwood K., Stewart-Cox J.E., Gilroy K., Baker S., Xia J., Dalley J.W., Hurst L.D., Wilkinson L.S., Isles A.R., Ward A. (2011) Distinct physiological and behavioural functions for parental alleles of imprinted Grb10. Nature. 469(7331), 534–538.
Rienecker K.D., Chavasse A.T., Moorwood K., Ward A., Isles A.R. (2020) Detailed analysis of paternal knockout Grb10 mice suggests effects on stability of social behavior, rather than social dominance. Genes Brain Behav. 19(1), e12571.
Portmann-Lanz C.B., Schoeberlein A., Portmann R., Mohr S., Rollini P., Sager R., Surbek D.V. (2010) Turning placenta into brain: placental mesenchymal stem cells differentiate into neurons and oligodendrocytes. Am. J. Obstet. Gynecol. 202(3), 294.e1–294.e11.
Keverne E.B. (2014) Significance of epigenetics for understanding brain development, brain evolution and behavior. Neuroscience. 4(264), 207–217.
Chen X.Y., Xue Y., Wang H., Zhu S.H., Hao X.M., Chen L. (2013) Modulation of firing activity by endogenous GABAA receptors in the globus pallidus of MPTP-treated parkinsonian mice. Neurosci. Bull. 29(6), 701–707.
Kono T. (2006) Genomic imprinting is a barrier to parthenogenesis in mammals. Cytogenet. Genome Res. 113, 31–35.
Weisstein A.E., Feldman M.W., Spencer H.G. (2002) Evolutionary genetic models of the ovarian time bomb hypothesis for the evolution of genomic imprinting. Genetics. 162, 425–439.
Varmuza S., Mann M. (1994) Genomic imprinting – defusing the ovarian time bomb. Trends. Genet. 10(4), 118–123.
Barlow D.P. (1993) Methylation and imprinting: from host defense to gene regulation. Science. 260, 309–310.
Roberts R.M., Green J.A., Schulz L.C. (2016). The evolution of the placenta. Reproduction. 152, R179–R189.
Ono R.I., Nakamura K., Inoue K., Naruse M., Usami T., Wakisaka-Saito N., Hino T., Suzuki-Migishima R., Ogonuki N., Miki H., Kohda T., Ogura A., Yokoyama M., Kaneko-Ishino T., Ishino F. (2006) Deletion of Peg10, an imprinted gene acquired from a retrotransposon, causes early embryonic lethality. Nat. Genet. 38(1), 101–106.
Henke C., Strissel P.L., Schubert M.T., Mitchell M., Stolt C.C., Faschingbauer F., Beckmann M.W., Strick R. (2015) Selective expression of sense and antisense transcripts of the Sushi-ichi-related retrotransposon-derived family during mouse placentogenesis. Retrovirology. 12, e9.
Kitazawa M., Tamura M., Kaneko-Ishino T., Ishino F. (2017) Severe damage to the placental fetal capillary network causes mid- to late fetal lethality and reduction in placental size in Peg11/Rtl1 KO mice. Genes Cells. 22(2), 174–188.
Haig D., Graham C. (1991) Genomic imprinting and the strange case of the insulin-like growth factor II receptor. Cell. 64, 1045–1046.
Haig D. (2004) Evolutionary conflicts in pregnancy and calcium metabolism – a review. Placenta. 25, 10–15.
Xiong Y., Mei W., Kim E.D., Mukherjee K., Hassanein H., Barbazuk W.B., Sung S., Kolaczkowski B., Kang B.H. (2014) Adaptive expansion of the maize maternally expressed gene (Meg) family involves changes in expression patterns and protein secondary structures of its members. BMC Plant Biol. 14, e204.
Lan Y., Liu X., Fu Y., Huang S. (2018) Arabidopsis class I formins control membrane-originated actin polymerization at pollen tube tips. PLoS Genet. 14(11), e1007789.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


