Молекулярная биология, 2021, T. 55, № 2, стр. 338-345
Экзосомы плазмы крови при наследственных формах болезни Паркинсона
Д. Г. Кулабухова a, b, Л. А. Гараева a, c, А. К. Емельянов a, b, К. А. Сенкевич a, b, Е. В. Грачева d, И. В. Милюхина a, b, d, Е. Ю. Варфоломеева a, c, А. А. Тимофеева b, А. Л. Шварцман a, Т. А. Штам a, c, С. Н. Пчелина a, b, c, d, *
a Петербургский институт ядерной физики им. Б.П. Константинова Научно-исследовательского центра “Курчатовский институт”
188300 Гатчина, Россия
b Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова
197022 Санкт-Петербург, Россия
c Научно-исследовательский центр “Курчатовский институт”
123182 Москва, Россия
d Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
* E-mail: sopchelina@hotmail.com
Поступила в редакцию 07.08.2020
После доработки 07.08.2020
Принята к публикации 10.08.2020
Аннотация
Болезнь Паркинсона (БП) – второе по распространенности нейродегенеративное заболевание, патогенез которого связан с накоплением и агрегацией белка альфа-синуклеина в нейронах черной субстанции головного мозга. Обсуждаются прионные свойства альфа-синуклеина. Предполагается, что экзосомы (микровезикулы размером 40–100 нм) могут играть ключевую роль в транспорте патогенных форм данного белка. Описаны наследственные формы заболевания, из которых наиболее распространена БП, ассоциированная с мутациями в гене глюкоцереброзидазы (GBA-БП) и гене киназы 2, обогащенной лейциновыми повторами (LRRK2-БП). Цель настоящего исследования состояла в определении концентрации и размера экзосом плазмы крови у пациентов с GBA-БП, бессимптомных носителей мутаций в гене GBA, а также влияния мутаций в генах GBA и LRRK2 на уровень альфа-синуклеина экзосом плазмы крови. Экзосомы плазмы крови выделяли двумя методами: последовательным ультрацентрифугированием и химической преципитацией; концентрацию и размер экзосом оценивали с помощью анализа траекторий наночастиц (NTA). Уровень альфа-синуклеина экзосом оценивали методом иммуноферментного анализа. В исследование включены пациенты со спорадической формой болезни Паркинсона (сБП), в том числе с деменцией, пациенты с наследственными формами заболевания (GBA-БП и LRRK2-БП), а также бессимптомные носители мутаций в гене GBA. Показано повышение концентрации внеклеточных везикул плазмы крови пациентов с GBA-БП по сравнению с сБП, бессимптомными носителями мутации GBA и контролем (p = 0.004, 0.019 и 0.0001 соответственно), а также увеличение размера везикул плазмы крови у пациентов с GBA-БП по сравнению с бессимптомными носителями мутаций GBA и контролем (p = 0.009 и 0.0001 соответственно). Различий в концентрации альфа-синуклеина в лизатах экзосом плазмы крови в разных группах не выявлено. Полученные результаты позволяют предположить, что дисфункции лизосомного фермента глюкоцереброзидазы влияют на пул экзосом плазмы крови, а также свидетельствуют об отсутствии корреляции между мутациями в генах LRRK2 или GBA и уровнем альфа-синуклеина в экзосомах плазмы крови человека.
ВВЕДЕНИЕ
Болезнь Паркинсона (БП) – нейродегенеративное заболевание, частота которого составляет 1–2% среди лиц старше 60 лет. Описаны редкие моногенные формы БП. Из аутосомно-доминантных форм наиболее распространена (до 7% среди семейных форм) БП, обусловленная мутациями в гене киназы 2, обогащенной лейциновыми повторами (LRRK2) [1–3]. Мутации в гене глюкоцереброзидазы (GBA) считаются фактором высокого риска развития БП. В гомозиготном состоянии мутации приводят к развитию лизосомной болезни накопления — болезни Гоше. Многочисленные исследования, в том числе выполненные в российской популяции, показали, что у носителей мутаций в гене GBA риск развития БП повышен в 6–8 раз, эти мутации обнаруживаются у 4–5% пациентов с БП [1, 4].
В основе патогенеза БП лежит накопление и агрегация белка альфа-синуклеина в нейронах черной субстанции головного мозга. Альфа-синуклеин обнаружен также в периферических жидкостях организма человека, таких как спинномозговая жидкость (СМЖ), слюна, кровь и ее компоненты и др. Считается, что основной нейротоксический эффект при синуклеинопатиях имеют растворимые, или протофибрилярные формы альфа-синуклеина [5]. На данный момент установлен факт передачи альфа-синуклеина между клетками [6], рассматриваются различные способы переноса патогенных форм этого белка, в том числе в составе экзосом [5, 7]. Экзосомы – внеклеточные везикулы размером около 40–120 нм, секретируемые большинством типов клеток и присутствующие в различных биологических жидкостях (кровь, моча, слюна, СМЖ и др.) [8]. Предполагается, что уровень альфа-синуклеина экзосом периферических жидкостей организма (кровь, СМЖ, слюна) можно рассматривать в качестве потенциального маркера БП [9–11].
Пул экзосом, а также их белковый состав, может меняться при различных заболеваниях, в частности, при нарушении опосредованной лизосомами аутофагии, поскольку предполагается, что экзосомы осуществляют альтернативный лизосомам путь деградации молекул в клетке [12]. Известно, что киназа LRRK2 участвует в опосредуемой шаперонами аутофагии [13]. Мутации в гене LRRK2 могут влиять на белковый состав экзосом [14]. На клеточных линиях, а также на модельных животных показано влияние дисфункций GBA на биогенез лизосом и процесс аутофагии [15].
Недавно мы охарактеризовали особенности пула внеклеточных везикул у пациентов с болезнью Гоше и выявили изменение физических характеристик экзосом при данной патологии [16]. Влияние мутаций в генах GBA и LRRK2 на пул внеклеточных везикул при БП и уровень альфа-синуклеина экзосом плазмы крови не исследован.
В данной работе определены концентрация и размер экзосом плазмы крови у пациентов с GBA-БП и у бессимптомных носителей мутаций в гене GBA (БН-GBA), а также оценен уровень альфа-синуклеина в экзосомах плазмы крови пациентов с БП, включая наследственные формы (мутации в генах LRRK2, GBA), БП с деменцией (БПД) и БН-GBA.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследуемые группы. В исследование вошли 63 пациента с установленным диагнозом БП, включая 15 с БПД, 9 – с GBA-БП (носители мутаций в гене GBA), пять – с LRRK2-БП (носители мутаций в гене LRRK2) и 34 пациента с сБП (табл. 1). Диагноз БП поставлен в соответствии с критериями Общества по изучению расстройств движения и БП от 2015 г. [17]. Пациентов обследовали в Научно-клиническом центре нейродегенеративных заболеваний Института экспериментальной медицины и в консультативно-диагностическом центре Первого Санкт-Петербургского государственного медицинского университета им. И.П. Павлова. Скрининг мутаций L444P, N370S, 84GG в гене GBA и G2019S, R1441T/C в гене LRRK2 проводили с использованием методов ПЦР и рестрикционного анализа или аллельспецифичной ПЦР с зондами TaqMan, описанными ранее [18–22].
Таблица 1.
Характеристики исследуемых групп
| Общие характеристики | сБП N = 34 |
GBA-БП N = 9 |
БН-GBA N = 10 |
LRRK2-БП N = 5 |
БПД N = 15 |
Контроль N = 30 |
|---|---|---|---|---|---|---|
| Пол, мужчины, % | 15 (44.1%) | 4 (44.4%) | 3 (33.3%) | 1 (20%) | 5 (33.3%) | 16 (53.3%) |
| Возраст, лет | 62.1 ± 8.5 | 61.4 ± 11.8 | 54.1 ± 9.8 | 71.2 ± 6.6 | 73.7 ± 8.2 | 63.5 ± 7.8 |
| Возраст начала заболевания, лет | 56.3 ± 7.1 | 55.4 ± 11.7 | – | 65.6 ± 7.0 | 63.5 ± 13.4 | – |
Группа БН-GBA с отсутствием неврологических заболеваний состояла из 9 индивидов и была сформирована при обследовании родственников первой степени пациентов с болезнью Гоше. Мутации в гене GBA в данной выборке подтверждены ранее методом прямого секвенирования.
Контрольная группа, сформированная случайным образом из жителей того же географического региона, что и включенная в анализ группа пациентов с БП, состояла из 30 индивидов. Все члены этой группы проходили обследование у невролога с целью исключения диагноза БП и других нейродегенеративных заболеваний. Проведение исследования одобрено локальными этическими комитетами указанных медицинских учреждений и проведено при подписании информированного согласия пациента.
Выделение фракции внеклеточных везикул. Плазма периферической крови получена путем центрифугирования в течение 20 мин при 3000 об./мин. Внеклеточные микровезикулы выделяли двумя способами. Для оценки уровня альфа-синуклеина в экзосомах плазмы крови внеклеточные везикулы получали методом химической преципитации (ХП) из 200 мкл плазмы крови с использованием набора ExoPrep (“Lonza”, Эстония) в соответствии с инструкцией производителя. Для оценки размера и концентрации экзосом плазмы крови внеклеточные везикулы выделяли методом последовательного ультрацентрифугирования (УЦ). Образцы плазмы крови (в объеме 3 мл каждый) центрифугировали в течение 1 ч при 4°С при 16000 × g, далее супернатант смешивали с раствором PBS в соотношении 1 : 1, центрифугировали в течение 2 ч при 4°С при 100 000 × g, осадок ресуспендировали в растворе PBS и повторно центрифугировали (2 ч при 4°С, 100 000 × g). Полученные образцы внеклеточных везикул плазмы крови ресуспендировали в 100 мкл PBS, замораживали и хранили при –80°С.
Характеристика фракции внеклеточных везикул. Размеры, гомогенность и концентрацию везикул в полученных препаратах оценивали с помощью метода анализа траекторий наночастиц (nano-particle tracking analysis, NTA, “Malvern Instruments”, Великобритания). Количественный анализ экзосомального поверхностного маркера (тетраспанин CD9) на поверхности выделенных внеклеточных везикул проводили с помощью проточной цитометрии с использованием набора Exo-FACS (“Lonza”). Наличие поверхностных маркеров экзосом (CD63, CD81) подтверждено методом вестерн-блотинга. В работе использовали первичные поликлональные антитела кролика к CD63 (1 : 300; ab216130, “Abcam”, Великобритания), CD81 (1 : 300; ab109201, “Abcam”) и вторичные козьи антикроличьи антитела, конъюгированные с пероксидазой хрена (1 : 2500; ab205718, “Abcam”). Вторичные антитела, связанные с соответствующим белком на фрагментах мембраны, идентифицировали с использованием набора Amersham ECL TM PlusSystem (“Amersham”, Великобритания). Прямая визуализация везикул, полученных методом УЦ, проведена методом просвечивающей электронной микроскопии (TEM) с использованием цифровой фотокамеры Morada (“Olympus Inc”, Япония).
Оценка концентрации альфа-синуклеина в препаратах экзосом. Лизис экзосом проводили с использованием набора Total Protein Extraction Kit (“Chemicon” (“Milipore”), США). Концентрацию альфа-синуклеина в лизатах экзосом измеряли методом ИФА с использованием набора SensoLyte Anti-alpha-Synuclein Quantitative ELISA Kit (Human) (“AnaSpec”, США) в соответствии с инструкцией производителя. Концентрацию альфа-синуклеина в образце определяли в трех повторах. Концентрацию альфа-синуклеина в лизатах экзосом плазмы крови определяли в 10 мкл лизата и нормировали по содержанию общего белка. Концентрацию общего белка оценивали с использованием набора Pierce BCA Protein Assay kit (“Thermo Scientific”, США).
Статистическая обработка результатов. Проверку полученных вариационных рядов на соответствие нормальному распределению проводили методом Шапиро–Уилка. Различия между группами оценивали с помощью теста Манна–Уитни. Значения p < 0.05 считали статистически значимыми. Статистический анализ выполняли с использованием программного обеспечения SPSS 12.0. Клинические и экспериментальные данные выражали как среднее значение и стандартная ошибка среднего или медиана (min–max) соответственно.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Группа пациентов с наследственными формами БП была частично описана нами ранее [1]. В настоящем исследовании проведен скрининг мутаций L444P, N370S гена GBA и G2019S, R1441T/C гена LRRK2 в группе из 300 пациентов с БП. Всего обследовано 1050 пациентов. В исследование вошли 9 пациентов с GBA-БП, из которых пять были носителями мутации L444P, четыре – мутации N370S, и пять пациентов с LRRK2-БП (четверо носителей мутации G2019S и один – мутации R1441T/C). Не выявлено носителей мутации 84GG гена GBA. В группе БН-GBA выявлены два носителя мутации L444P, пять –N370S, по одному носителю мутаций G241R и N227S.
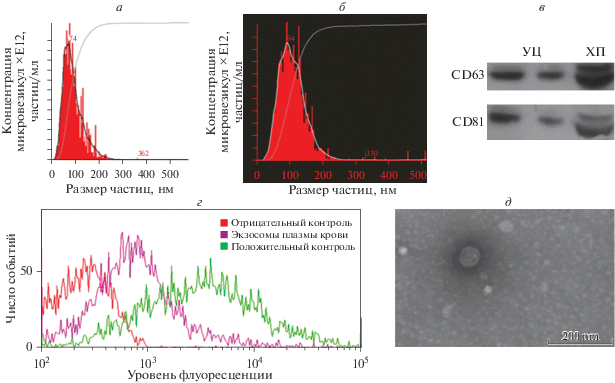
В ходе работы внеклеточные везикулы были выделены из плазмы периферической крови методом ХП и УЦ. Внеклеточные везикулы плазмы крови были охарактеризованы с использованием NTA, TEM. Наличие поверхностных маркеров экзосом (CD9, CD63, CD81) подтверждено с помощью вестерн-блотинга и проточной цитометрии (рис. 1). Средние размеры и концентрация везикул составили: при выделении методом УЦ –123.87 ± 24.5 нм и (18.4 ± 1.4) × 1012 частиц/мл; при выделении методом ХП – 100.38 ± 11.4 нм и (13.73 ± 5.29) × 1012 частиц/мл. На рис. 1а, б приведены примеры распределения частиц по размеру при выделении везикул методами УЦ и ХП. Поверхностный маркер экзосом – тетраспанин CD9 – выявлен методом проточной цитометрии во всех образцах. На рис. 1в приведен пример визуализации поверхностных маркеров экзосом CD63 и CD81 методом вестерн-блотинга во внеклеточных везикулах, выделенных методами УЦ и ХП. На рис. 1г представлена цитограмма экзосом, выделенных методом УЦ. Аналогичные данные получены при выделении методом ХП. Визуализация везикул, полученных методом УЦ, проведена с помощью TEM (рис. 1д). Везикулы имели округлую форму, при микроскопическом исследовании визуализировалась мембрана. Размер везикул, равный примерно 100 нм, а также представленность специфических поверхностных маркеров CD9, CD63 и CD81 позволили подтвердить присутствие экзосом.
Рис. 1.
Характеристика размера и концентрации внеклеточных везикул методом NTA (а – экзосомы, полученные методом УЦ, б – методом ХП), вестерн-блот тетраспанинов CD63 и CD81 в образцах везикул, полученных методами УЦ и ХП (в), количественная оценка поверхностного маркера экзосом, тетраспанина CD9, методом проточной цитометрии (пример экзосом, полученных методом УЦ) (г), визуализация экзосом, полученных методом УЦ, с помощью TEМ (д).
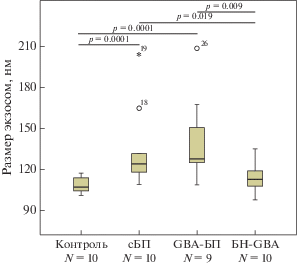
В группах GBA-БП (N = 9), сБП (N = 10), БН-GBA (N = 10) и контроля (N = 10) проведено сопоставление количества и размера экзосом, полученных методом УЦ (рис. 2). Показано, что концентрация экзосом плазмы крови у пациентов с GBA-БП (28.03 (8.89–57.7) × 1012 частиц/мл), сБП (9.8 (2.66–16.47) × 1012 частиц/мл) и в группе БН-GBA (10.4 (1.05–50.8) × 1012 частиц/мл) была выше, чем в контроле (3.05 (1.49–10.37) × 1012 частиц/мл, p = 0.00001, 0.008, 0.02 соответственно). Размер частиц у пациентов с GBA-БП (127.8 (108.6–208.6) нм) и сБП (123.8 (109.0–204.6) нм) был больше, чем в контрольной группе (107.0 (101.0–117.3) нм, p = 0.0001, 0.0001 соответственно) и группе БН-GBA (112.6 (97.3–135.0), p = 0.009 и 0.019 соответственно) (рис. 3). Следует отметить, что концентрация и размер внеклеточных везикул в группе GBA-БП были статистически значимо выше по сравнению с группой БН-GBA (p = 0.019 и 0.009 соответственно).
Рис. 2.
Концентрация экзосом плазмы крови в контрольной группе, у пациентов с GBA-БП и сБП и в группе БН-GBA.
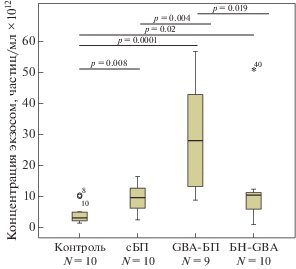
Рис. 3.
Размер экзосом плазмы крови в группе контроля, у пациентов с GBA-БП и сБП и в группе БН-GBA.
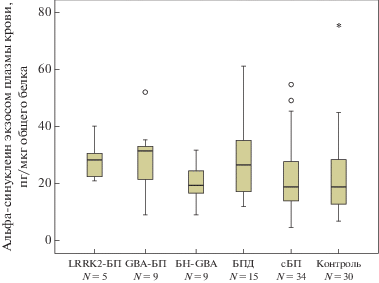
Уровень альфа-синуклеина экзосом плазмы крови оценили в группах пациентов с сБП (N = = 34); GBA-БП (N = 9); LRRK2-БП (N = 5); БПД (N = 15), БН-GBA (N = 10) и у представителей контрольной группы (N = 30). Не выявлено различий в уровне альфа-синуклеина экзосом плазмы крови в этих группах (рис. 4). Также не выявлено влияния типа мутации как в гене GBA, так и в гене LRRK2 на уровень альфа-синуклеина в экзосомах плазмы крови лиц с наследственными формами БП (данные не приведены).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящем исследовании впервые оценена концентрация и размер экзосом, выделенных из плазмы крови пациентов с GBA-БП и БН-GBA. Также определен уровень альфа-синуклеина в лизатах экзосом плазмы крови пациентов с наследственной формой БП (мутации в генах GBA и LRRK2).
Нами впервые показано увеличение количества и размера экзосом в плазме крови пациентов с БП, несущих мутацию в гене GBA. Как показано нами и другими исследователями ранее, при GBA-БП наблюдается снижение активности GBA, а также накопление лизосфинголипидов в крови [12, 15, 19, 23–25]. Известно, что дисфункция GBA приводит к нарушению рециркуляции лизосом в процессе аутофагии [15]. Сохранность функции лизосом необходима для формирования аутолизосомы, в частности, для удаления дефектных белков из клетки. Предполагается, что нарушение эндосомно-лизосомного пути может приводить к повышенной секреции экзосом в составе мультивезикулярных телец [12]. В исследованиях in vitro установлено, что ингибирование функции лизосом увеличивает секрецию внеклеточных везикул клетками [26].
На модельных животных показано, что при подавлении активности GBA селективным ингибитором кондуритол-B-эпоксидом (CBE) увеличивается секреция экзосом клетками головного мозга мыши [27]. Ранее нарушение аутофагии отмечали в первичной культуре макрофагов, полученных от пациентов с болезнью Гоше [28].
Недавно с использованием методов NTA, динамического светорассеяния и криоэлектронной микроскопии мы охарактеризовали пул внеклеточных везикул плазмы крови пациентов с болезнью Гоше [16]. Показано, что в пуле внеклеточных везикул пациентов уровень экзосомальных маркеров (CD9, CD63, CD81, HSP70) выше, чем в контроле, увеличен также размер везикул и изменена их морфология. Большинство везикул имело многослойную мембрану [16]. В сумме полученные нами результаты подтверждают предположение о том, что нарушение метаболизма церамидов может влиять на пул экзосом, секретируемых клетками.
В настоящей работе нами показано, что мутации в генах GBA и LRRK2 не влияют на уровень альфа-синуклеина экзосом плазмы крови при БП. За последние годы проведен ряд исследований, направленных на оценку возможности использования уровня альфа-синуклеина экзосом периферических жидкостей (кровь, СМЖ, слюна) в качестве биомаркера БП. В 2014 году Shi и соавт. показали, что уровень альфа-синуклеина экзосом плазмы крови, содержащих поверхностный маркер L1CAM, у пациентов с БП повышен по сравнению с контрольной группой [9]. Экзосомы получали методом иммунопреципитации с использованием антител к поверхностному маркеру экзосом L1CAM (присутствие этого маркера свидетельствует о нейронном происхождении экзосом [29]). Уровень альфа-синуклеина оценивали с помощью метода Luminex. В 2019 году Han и соавт. определили концентрацию альфа-синуклеина общего пула экзосом плазмы крови и показали, что уровень альфа-синуклеина у пациентов с БП выше, чем в контроле [30]. Экзосомы плазмы крови были получены с помощью последовательного УЦ с последующей очисткой образцов методом ХП. Уровень альфа-синуклеина, как и в нашей работе, оценивали методом ИФА. В 2016 году Stuendl и соавт. показали, что уровень альфа-синуклеина экзосом СМЖ на ранних стадиях БП ниже, чем в контрольной группе [10]. Экзосомы выделяли методом последовательного УЦ, уровень альфа-синуклеина оценивали методом электрохемилюминесценции. В 2019 году Cao и соавт. выявили повышение уровня альфа-синуклеина в экзосомах слюны у пациентов с БП по сравнению с контрольной группой [11]. Экзосомы слюны получены методом ХП, уровень альфа-синуклеина оценен с помощью метода электрохемилюминесценции. В 2018 году Cerry и соавт. обнаружили повышение уровня альфа-синуклеина экзосом плазмы крови у пациентов с БП в сравнении с контрольной группой, а также выявили отрицательную корреляцию уровня альфа-синуклеина в экзосомах плазмы крови с тяжестью БП по шкале Хен-Яра [31]. В каждом исследовании использовали разные методы получения фракции внеклеточных везикул, а также детекции альфа-синуклеина.
На данный момент существует несколько методов выделения экзосом, каждый из которых имеет свои плюсы и минусы. Метод последовательного УЦ позволяет получить фракцию, максимально чистую от внесенных в образец дополнительных примесей, но не позволяет полноценно удалить следы белков и прочих молекул внеклеточной среды биологических жидкостей. Этот метод обычно применяют для выделения экзосом в целях их сокультивирования с клеточными культурами. Считается, однако, что метод последовательного УЦ не следует использовать для выделения фракции внеклеточных везикул без дополнительной очистки при последующей оценке белкового состава экзосом [32]. В нашей работе мы использовали коммерческий набор, принцип работы которого основан на методе ХП экзосом из биологических жидкостей, позволяющем удалить из биологического образца большую часть растворимых белков [32]. Использование этого подхода позволило нам минимизировать содержание альфа-синуклеина плазмы крови в исследуемых образцах.
В отличие от данных, полученных ранее, мы не выявили повышения содержания альфа-синуклеина экзосом плазмы крови при различных формах БП по сравнению с контролем. Подобные различия могут объясняться разнообразием существующих сегодня методов выделения и очистки пула экзосом плазмы крови, а также методов детекции альфа-синуклеина. Интересно отметить, что все исследования по оценке белкового состава экзосом плазмы крови методом масс-спектрометрии (MC/MC) не обнаружили в их составе альфа-синуклеина [26, 33].
Таким образом, нами впервые показано, что мутации в гене GBA влияют на пул экзосом плазмы крови у пациентов с БП. В то же время не выявлено влияния мутаций в генах GBA и LRRK2 на уровень альфа-синуклеина экзосом плазмы крови.
Выражаем благодарность Горшкову Андрею Николаевичу (Научно-исследовательский Институт гриппа им. А.А. Смородинцева) за проведение экспериментов с просвечивающей электронной микроскопией.
Исследование выполнено при поддержке Российского фонда фундаментальных исследований (грант №18-015-00262А (скрининг мутаций в генах GBA и LRRK2 и оценка концентрации альфа-синуклеина в экзосомах плазмы крови); грант №19-315-90059 Аспиранты (характеристика внеклеточных везикул методом проточной цитометрии, вестерн-блотинга), Российского научного фонда (№ 19-15-00315 (характеристика везикул методом NTA в группах бессимптомных носителей мутаций GBA, пациентов с GBA-БП)).
Все процедуры, выполненные в данной работе, соответствуют этическим стандартам институционального комитета по исследовательской этике и хельсинкской декларации 1964 года и ее последующим изменениям или сопоставимым нормам этики. От всех пациентов получено информированное согласие.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Emelyanov A.K., Usenko T.S., Tesson C., Senkevich K.A., Nikolaev M.A., Miliukhina I.V., Kopytova A.E., Timofeeva A.A., Yakimovsky A.F., Lesage S., Brice A., Pchelina S.N. (2018) Mutation analysis of Parkinson’s disease genes in a Russian data set. Neurobiol. Aging. 71, 272.
Пчелина С.Н., Иванова О.Н., Емельянов А.К., Якимовский А.Ф. (2011) Клиническое течение LRRK2-ассоциированной болезни Паркинсона. Ж. неврологии и психиатрии им. С.С. Корсакова. 12(111), 56–62.
Lesage S., Anheim M., Condroyer C., Pollak P., Durif F, Dupuits C., Viallet F., Lohmann E., Corvol JC., Honore A., Rivaud S., Vidailhet M., Durr A., Brice A., French Parkinson’s Disease Genetics Study Group. (2011) Large-scale screening of the Gaucher’s disease-related glucocerebrosidase gene in Europeans with Parkinson’s disease. Hum. Mol. Genet. 20(1), 202–210.
Balestrino R., Schapira A. (2019) Parkinson disease. Eur. J. Neurol. 27, 27–42.
Bieri G., Gitler A.D., Brahic M. (2018) Internalization, axonal transport and release of fibrillar forms of alpha-synuclein. Neurobiol. Dis. 109, 219–225.
Danzer K.M., Krebs S.K., Wolff M., Birk G., Hengerer B. (2009) Seeding induced by alpha-synuclein oligomers provides evidence for spreading of alpha-synuclein pathology. J. Neurochem. 111(1), 192–203.
Шварцман А.Л., Сенкевич К.А., Емельянов А.К., Пчелина С.Н. (2019) Прионные свойства альфа-синуклеина. Молекуляр. биология. 53(3), 380–387.
Greening D., Simpson R. (2018) Understanding extracellular vesicle diversity – current status. Expert. Rev. Proteomics. 15, 887–910.
Shi M., Liu C., Cook T.J., Bullock K.M., Zhao Y., Ginghina C., Li Y., Aro P., Dator R., He C., Hipp M.J., Zabetian C.P., Peskind C.P., Hu S-C., Quinn S.F., Galasko D.R., Banks W.A., Zhang J. (2014) Plasma exosomal α-synuclein is likely CNS-derived and increased in Parkinson’s disease. Acta Neuropathol. 128, 639–650.
Stuendl A., Kunadt M., Kruse N., Bartels C., Moebius W., Danzer K.M., Mollenhauer B., Schneider A. (2016) Induction of α-synuclein aggregate formation by CSF exosomes from patients with Parkinson’s disease and dementia with Lewy bodies. Brain. 139, 481–494.
Cao Z., Wu Y., Liu G., Jiang Y., Wang X., Wang Z., Feng T. (2019) α-Synuclein in salivary extracellular vesicles as a potential biomarker of Parkinson’s disease. Neurosci. Lett. 696, 114–120.
Eitan E., Suire C., Zhang S., Mattson M.P. (2016) Impact of lysosome status on extracellular vesicle content and release. Ageing Res. Rev. 32, 65–74.
Orenstein S.J., Kuo S.H., Tasset I., Arias E., Koga H., Fernandez-Carasa I., Cortes E., Honig L.S., Dauer W., Consiglio A., Raya A., Sulzer D., Cuervo A.M. (2013) Interplay of LRRK2 with chaperone-mediated autophagy. Nat. Neurosci. 16(4), 394–406.
Fraser K.B., Rawlins A.B., Clark R.G., Alcalay R.N., Standaert D.G., Liu N. (2016) Ser(P)-1292 LRRK2 in urinary exosomes is elevated in idiopathic Parkinson’s disease. Mov. Disord. 31(10), 1543–1550.
Magalhaes J., Gegg M.E., Migdalska-Richards A., Doherty M.K., Whitfield P.D., Schapira A.H. (2016) Autophagic lysosome reformation dysfunction in glucocerebrosidase deficient cells: relevance to Parkinson disease. Hum. Mol. Genet. 25, 3432–3445.
Shtam T., Naryzhny S., Kulabukhova D., Garaeva L., Senkevich K., Landa S., Varfolomeeva E., Salogub G., Verlov N., Kopylov A., Zorina E., Kamyshinsky R., Usenko T., Shwartsman A., Zakharova E., Emelyanov A., Pchelina S. (2020) Altered level of plasma exosomes in patients with Gaucher disease. Eur. J. Med. Genet. 63(11), 104038.
Postuma R.B., Berg D., Stern M., Poewe W., Olanow C.W., Oertel W., Obeso J., Marek K., Litvan I., Lang A.E., Halliday G., Goetz C.G., Gasser T., Dubois B., Chan P., Bloem B.R., Adler C.H., Deuschl G. (2015) MDS clinical diagnostic criteria for Parkinson’s disease. Mov. Disord. 30, 1591–1601.
Aharon-Peretz J., Rosenbaum H., Gershoni-Baruch R. (2004) Mutations in the glucocerebrosidase gene and Parkinson’s disease in Ashkenazi jews. N. Engl. J. Med. 351(19), 1972–1977.
Alcalay R.N., Levy O.A., Waters C.C., Fahn S., Ford B., Kuo S-H., Mazzoni P., Pauciulo M.W., Nichols W.C., Gan-Or Z., Rouleau G.A., Chung W.K., Wolf P., Oliva P., Keutzer J., Marder K., Zhang X. (2015) Glucocerebrosidase activity in Parkinson’s disease with and without GBA mutations. Brain. 138(Pt9), 2648–2658.
Pchelina S.N., Yakimovskii A.F., Emelyanov A.K., Ivanova O.N., Schwarzman A.L., Singleton A.B. (2008) Screening for LRRK2 mutations in patients with Parkinson’s disease in Russia: identification of a novel LRRK2 variant. 15(7), 692–696.
Hashad D.I., Abou-Zeid A.A., Achmawy G.A., Allah H.M., Saad M.A. (2011) G2019S mutation of the leucine-rich repeat kinase 2 gene in a cohort of Egyptian patients with Parkinson’s disease. Genet. Test. Mol. Biomarkers. 15(12), 861–866.
Fedick A., Su J., Jalas C., Northrop L., Devkota B., Ekstein J., Treff N.R. (2013) High-throughput carrier screening using TaqMan allelic discrimination. PLoS One. 8(3), e59722.
Pchelina S., Emelyanov A., Baydakova G., Andoskin P., Senkevich K., Nikolaev M., Miliukhina I., Yakimovskii A., Timofeeva A., Fedotova E., Abramycheva N., Usenko T., Kulabukhova D., Lavrinova A., Kopytova A., Garaeva L., Nuzhnyi E., Illarioshkin S., Zakharova E. (2017) Oligomeric α-synuclein and glucocerebrosidase activity levels in GBA-associated Parkinson’s disease. Neurosci. Lett. 636, 70–76.
Guedes L.C., Chan R.B., Gomes M.A., Conceiçao V.A., Machado R.B., Soares T., Xu Y., Gaspar P., Carriço J.A., Alcalay R.N., Ferreira J.J., Outeiro T.F., Miltenberger-Miltenyi G. (2017) Serum lipid alterations in GBA-associated Parkinson’s disease. Parkinsonism Relat. Disord. 44, 58–65.
Pchelina S., Baydakova G., Nikolaev M., Senkevich K., Emelyanov A., Kopytova A., Miliukhina I., Yakimovskii A., Timofeeva A., Berkovich O., Fedotova E., Illarioshkin S., Zakharova E. (2018). Blood lisosphingolipids accumulation in patients with Parkinson’s disease with glucocerebrosidase 1 mutations. Mov. Disord. 33(8), 1325–1330.
Miao Y., Li G., Zhang X., Xu H., Abraham S.N. (2015) A TRP channel senses lysosome neutralization by pathogens to trigger their expulsion. Cell. 161(6), 1306–1319.
Papadopoulos V.E., Nikolopoulou G., Antoniadou I., Karachaliou A., Arianoglou G., Emmanouilidou E., Sardi S.P., Stefanis L., Vekrellis K. (2018) Modulation of β-glucocerebrosidase increases α-synuclein secretion and exosome release in mouse models of Parkinson’s disease. Hum. Mol. Genet. 27(10), 1696–1710.
Aflaki E., Stubblefield B.K., Maniwang E., Lopez G., Moaven N., Goldin E., Marugan J., Patnaik S., Dutra A., Southall N., Zheng W., Tayebi N., Sidransky E. (2016) Macrophage models of Gaucher disease for evaluating disease pathogenesis and candidate drugs. Sci. Transl. Med. 6, 240–273.
Lachenal G., Pernet-Gallay K., Chivet M., Hemming F.G., Belly A., Bodon G., Blot B., Haase G., Goldberg Y., Sadoul R. (2011) Release of exosomes from differentiated neurons and its regulation by synaptic glutamatergic activity. Mol. Cell. Neurosci. 46(2), 409–418.
Han C., Xiong N., Guo X., Huang J., Ma K., Liu L., Xia Y., Shen Y., Li J., Jiang H., Wang L., Guo S., Xu X., Zhang G., Liu J., Cao X., Zhang Z., Lin Zh., Wang T. (2019) Exosomes from patients with Parkinson’s disease are pathological in mice. J. Mol. Med. (Berl.). 97(9), 1329–1344.
Cerri S., Ghezzi C., Sampieri M., Avenali M., Dornini G., Zangaglia R., Minafra B., Blandini F. (2018) The exosomal/total α-synuclein ratio in plasma is associated with glucocerebrosidase activity and correlates with measures of disease severity in PD patients. Front. Cell Neurosci. 12, 125.
de la Torre Gomez C., Goreham R.V., Bech Serra J.J., Nann T., Kussmann M. (2018) “Exosomics” – a review of biophysics, biology and biochemistry of exosomes with a focus on human breast milk. Front. Genet. 9, 92.
Tomlinson P.R., Zheng Y., Fischer R., Heidasch R., Gardiner C., Evetts S., Hu M., Wade-Martins R., Turner M.R., Morris J., Talbot K., Kessler B.M., Tofaris G.K. (2015) Identification of distinct circulating exosomes in Parkinson’s disease. Ann. Clin. Transl. Neurol. 2(4), 353–361.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология