Молекулярная биология, 2021, T. 55, № 3, стр. 355-361
Функции Е3 убиквитин-лигазы Hyd в тканях дрозофилы
Ю. А. Галимова a, *, Н. В. Дорогова b, С. А. Фёдорова b
a Институт молекулярной и клеточной биологии Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
b Институт цитологии и генетики Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: pertseva@ngs.ru
Поступила в редакцию 31.07.2020
После доработки 30.09.2020
Принята к публикации 04.10.2020
Аннотация
Убиквитин-протеасомная система (UPS) – важный регулятор основных клеточных процессов. Компоненты UPS вовлечены в регуляцию клеточного цикла, трансдукцию сигнала, ответ клетки на повреждения ДНК, метаболизм и контроль транскрипции. Ключевую роль в функционировании UPS играют Е3 убиквитин-лигазы – ферменты, которые ковалентно присоединяют убиквитин к белкам-мишеням. Одна из наиболее интересных Е3 лигаз – супрессор опухолевого роста Hyd (hyperplastic discs) дрозофилы, необходима для регуляции пролиферации, роста и дифференцировки клеток. Изучение мутаций hyd в различных тканях дрозофилы показало, что в зависимости от клеточного контекста Hyd может выполнять не только протеолитические функции, связанные с деградацией белков, но и, взаимодействуя с другими белками и/или нуклеиновыми кислотами, выступать в качестве важного регулятора клеточных процессов.
УБИКВИТИНИРОВАНИЕ И РОЛЬ Е3 УБИКВИТИН-ЛИГАЗ
Убиквитин (Ub) – небольшой высококонсервативный белок, состоящий из 76 аминокислотных остатков, присутствует во всех клетках, а убиквитинирование – одна из самых частых посттрансляционных модификаций белков, играет ключевую роль в разнообразных клеточных процессах. Существуют разные типы убиквитиновых модификаций: моноубиквитинирование – присоединение одной молекулы убиквитина к белку путем ковалентного связывания с остатком лизина (Lys) в молекуле субстрата; мультиубиквитинирование (или множественное моноубиквитинирование) – одновременное присоединение убиквитина к нескольким остаткам Lys белка-субстрата; полиубиквитинирование – формирование поли-Ub-цепи, состоящей из нескольких молекул убиквитина, связанных между собой посредством специфических остатков лизина и глицина. В убиквитин-протеасомной системе (UPS – Ubiquitin-Proteasome System) убиквитин модифицирует белковые субстраты, формируя поли-Ub-цепи, которые служат сигналом для протеасомной деградации белка [1]. Однако оказалось, что убиквитин не только регулирует деградацию белков посредством UPS, но и выполняет множество непротеолитических регуляторных функций. Убиквитинирование изменяет поверхность белка-субстрата, что влияет на его активность, стабильность, способность взаимодействовать с другими белками, а также на его внутриклеточную локализацию [2, 3]. Моноубиквитинирование или мультиубиквитинирование необходимы для попадания определенных белков в везикулы на разных стадиях секреторно-эндоцитозного пути. В этом случае убиквитин выступает в роли регулируемого сортировочного сигнала [4]. А в случае полиубиквитинирования различная топология поли-Ub-цепей приводит к связыванию со специфическими белками-адапторами, что, в свою очередь, имеет различные последствия. Возможны по меньшей мере восемь различных типов связей между мономерами убиквитина. Семь из них образуются за счет внутренних остатков лизина в структуре убиквитина, а восьмой осуществляется через N-концевой остаток метионина [5]. К примеру, связывание через Lys48 используется главным образом для направления белка на деградацию, а связывание через Lys63 играет важную роль в репарации ДНК, воспалительной реакции, эндоцитозе и синтезе белка на рибосомах [6].
Связывание убиквитина с белками-субстратами осуществляется путем трех последовательных ферментативных реакций. Сначала убиквитин-активирующий фермент E1 АТР-зависимо активирует убиквитин с формированием высокоэнергетической тиоэфирной связи между карбоксильной группой С-концевого остатка глицина в убиквитине и остатком цистеина в молекуле Е1. Затем активированный убиквитин переносится на специфический остаток цистеина убиквитинсвязывающего фермента Е2 с формированием сходной тиоэфирной связи. На третьем этапе убиквитин-лигаза E3 взаимодействует одновременно с Е2, благодаря Е2-связывающему домену, и с белком-субстратом, благодаря субстратсвязывающему домену. Убиквитин-лигаза Е3 осуществляет перенос активированного убиквитина с Е2 на субстрат с формированием изопептидной связи между ε-аминогруппой субстрата и С-концевой карбоксильной группой убиквитина [7]. Именно на этом этапе происходит распознавание специфичного субстрата, сайта и типа убиквитиновой модификации, поэтому убиквитин-лигазы Е3 играют ключевую роль в каскаде реакций убиквитинирования.
Чтобы использовать весь функциональный потенциал убиквитинирования, в эукариотических клетках существуют сотни убиквитин-лигаз, которые содержат несколько основных типов каталитических доменов и разнообразные субстратсвязывающие домены и регуляторные элементы. Это свойство позволяет убиквитин-лигазам функционировать в разных клеточных контекстах, отвечать на различные клеточные сигналы и стимулировать процессинг разнообразных белковых субстратов. В геноме человека найдено около 1000 Е3 убиквитин-лигаз, которые в зависимости от структуры Е2-связывающего домена делят на три основных класса: RING (Really Interesting New Gene)/ U‑box, HECT (Homologous to E6AP C-Terminus) и RBR (RING between RING) [8]. Каждый из этих классов имеет свой особый белоксвязывающий домен (RING-finger или HECT) для связывания с Е2 и различные домены для взаимодействия с субстратами.
RING-домен устроен по типу цинковых пальцев, он осуществляет перенос убиквитина от Е2 на субстрат за один шаг [9]. Это самое большое семейство Е3 убиквитин-лигаз. У человека насчитывается около 600 представителей данного семейства [9]. Среди них есть белки, осуществляющие свои функции как самостоятельно (например, IAP – inhibitor of apoptosis, предотвращающий апоптоз; Mdm2, катализирующий убиквитинирование p53), так и в составе мультибелковых комплексов (таких как SCF – Skp-Cullin-F-box и APC/C – anaphase-promoting complex/cyclosome), мишенями которых служат циклины и секурины – ингибиторы анафазы [10–13].
Второй класс Е3 лигаз – HECT-лигазы – характеризуется наличием С-концевого домена из ~350 аминокислот, содержащего активный сайт – консервативный остаток цистеина, с помощью которого образуется временная тиоэфирная связь с убиквитином, а затем его перенос на остаток лизина в молекуле целевого белка [14]. В геноме человека обнаружено около 50 генов белков этого семейства. К этому классу относятся белки E6-AP, Huwe1 и Nedd4.
Е3 лигазы третьего класса – RBR – совмещают в себе черты двух первых классов, так как имеют два RING-домена, один из которых функционирует как каркас, а другой содержит каталитический остаток цистеина, образующий промежуточную связь с убиквитином [15]. У человека известно 14 Е3 лигаз класса RBR, из которых наиболее изучен Parkin [15].
Hyd – УНИКАЛЬНЫЙ ЧЛЕН СЕМЕЙСТВА Е3 ЛИГАЗ
Правильное функционирование UPS необходимо для нормального протекания таких жизненно важных процессов, как клеточный цикл и апоптоз. Поэтому в последние годы возрос интерес к изучению компонентов UPS, в частности Е3 убиквитин-лигаз, обеспечивающих специфичность убиквитинирования, в качестве потенциальных мишеней для терапии многих болезней, включая рак. Один из наиболее интересных представителей семейства Е3 убиквитин-лигаз – HECT-убиквитин-лигаза HYD (hyperplastic discs). Первоначально hyd обнаружили у Drosophila melanogaster как температурочувствительную мутацию, которая вызывала разрастание крыловых и гальтерных имагинальных дисков в мутантных личинках, выращенных при рестриктивной температуре, при этом способность дисков к дифференцировке сохранялась [16, 17]. Было показано, что hyd играет ключевую роль в контроле пролиферации соматических клеток в процессе развития дрозофилы, и на этом основании его отнесли к супрессорам опухолевого роста [17].
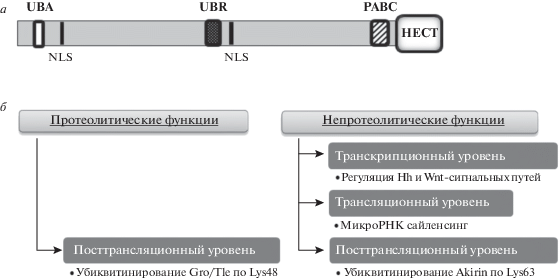
Убиквитин-лигаза Hyd дрозофилы, кодируемая геном hyperplastic discs, относится к HECT-семейству Е3 убиквитин-лигаз. Белок Hyd состоит из 2885 аминокислотных остатков и содержит N-концевой UBA-домен (ubiquitin-associated), необходимый для связывания с убиквитином [18]; два сигнала ядерной локализации NLS; UBR (ubiquitin recognin box) домен по типу цинковых пальцев, отвечающий за распознавание первого типа N-дегронов [19]; С-концевой HECT-домен, обеспечивающий каталитическую активность; и белоксвязывающий домен PABC (poly(A)-binding protein C-terminal) (рис. 1а).
Рис. 1.
Структура (а) и функции (б) белка Hyd. UBA – ubiquitin-associated domain; NLS – nuclear localization signal; UBR – ubiquitin recognin box; HECT – homologous to the E6-AP carboxyl terminus; PABC – poly(A)-binding protein C-terminal.
В структуре HECT-домена выделяются две различные части, связанные между собой гибким линкером. N-концевая часть взаимодействует c убиквитинсвязывающим ферментом E2, а С-концевая часть содержит каталитический остаток цистеина, который принимает убиквитин от Е2. При этом С-концевая часть Hyd имеет уникальные особенности, отличающие ее от HECT-доменов других Е3 лигаз, такие как вставка из четырех аминокислот во второй спирали, которая приводит к удлинению спирали и совершенно новой ориентации предшествующей петли. Эта выступающая петля имеет значение при взаимодействии с Е2-связывающим ферментом, она влияет на специфичность связывания [20].
Еще одна уникальная черта белка Hyd – наличие белоксвязывающего домена PABC, найденного также в белке PABP (poly(A)-binding protein), функция которого связана с трансляцией мРНК. PABC представляет собой небольшой протеолитически стабильный, высококонсервативный участок, который служит для связывания с различными белками, осуществляющими регуляцию трансляции (медиаторами терминации и усиления трансляции, стабилизации и полиаденилирования мРНК) [21]. Домен PABC белка Hyd может связываться с некоторыми партнерами соответствующего PABC-домена белка PABP [21, 22].
Hyd В ТКАНЯХ ДРОЗОФИЛЫ
Еще в ранних исследованиях было показано, что опухолевые супрессоры могут функционировать во многих тканях, но только в некоторых из них мутации этих генов вызывают гиперплазию [23]. Изучение мутаций hyd в соматических тканях дрозофилы выявило интересную особенность этого онкосупрессора. Оказалось, что при сильных мутациях мухи умирают на личиночной стадии или на ранней стадии куколки, а имагинальные диски меньше по размеру или отсутствуют совсем. При слабых мутациях, наоборот, чаще встречаются разросшиеся диски, а особи доживают до поздних стадий куколки или до взрослого состояния [17]. В связи с этим предполагается [17], что роль Hyd в контроле клеточной пролиферации не ограничивается лишь ее терминацией, этот фермент участвует также в ее инициации и поддержании.
Эксперименты по мозаичному анализу на глазных имагинальных дисках дрозофилы показали, что в глазах взрослых особей, содержащих клоны клеток, гомозиготных по мутации hyd, разрастается нормальная ткань дикого типа, окружающая мутантные клоны [24]. При этом сами мутантные клоны во взрослом состоянии не сохраняются. Механизм разрастания, при котором сверхпролиферации подвергаются не сами мутантные клетки, а их окружение, получил название клеточно-неавтономного. Глаза, которые полностью состояли из мутантной ткани, были меньше по размеру. Этот фенотип объясняется тем, что в клонах, мутантных по hyd, происходит эктопическая экспрессия генов hedgehog и dpp, что, в свою очередь, приводит к преждевременной дифференцировке фоторецепторов и распространению волны дифференцировки в окружающие здоровые ткани. Таким образом, когда глаз полностью мутантный, прогрессия морфогенетической борозды ускоряется, и клетки диска раньше прекращают деление.
Также известно, что утрата функции гена hyd приводит к стерильности самцов и самок дрозофилы [17]. На модели сперматогенеза показано, что мутации hyd вызывают многочисленные нарушения клеточного деления и дифференцировки сперматоцитов, к которым приводит несогласованность в развитии событий хромосомного, центросомного, микротрубочкового и цитоплазматического циклов. Однако при этом не происходит гиперплазии ни зародышевой, ни соматической тканей семенников, и особенность гена как онкосупрессора не проявляется [25].
Разное проявление мутаций hyd в разных тканях обусловлено многофункциональностью этого белка: в зависимости от клеточного контекста он может осуществлять не только свои протеолитические функции, связанные с деградацией белков, но и, взаимодействуя с другими белками и/или нуклеиновыми кислотами, выступать в качестве важного регулятора клеточных процессов (рис. 1б).
ПРОТЕОЛИТИЧЕСКИЕ ФУНКЦИИ Hyd
Хотя выявлено более 56 белок-белковых взаимодействий, в которых участвует белок Hyd дрозофилы, доказанным субстратом для убиквитинирования с последующей протеасомной деградацией является только белок Groucho/TLE [26]. У ортолога Hyd, белка UBR5 (Ubiquitin protein ligase E3 component n-recognin 5) человека, который локализуется преимущественно в ядре, известно множество субстратов, включая белки ответа на повреждения ДНК (TopBP1, ATMIN и CHK2) [27–29], регуляторы транскрипции (hPXR, RNF168, CDK9) [27] и трансляции (PAIP2 (PABP2)) [27], протоонкогены β-катенин, E6 папилломавируса человека и с-Myc [27, 28, 30], регуляторы клеточной гибели MOAP1 и XIAP [31, 32], белки с мотивом PAM2 – BUB1, BUB1β, и ATXN2L [26], фактор ангиогенеза AGR2 [33] и глюконеогенеза PEPCK1 [28]. Таким образом, UBR5 млекопитающих вовлечен в регуляцию многих клеточных процессов: транскрипцию, трансляцию, пролиферацию, трансформацию клеток, ответ на повреждения ДНК (рис. 1б).
НЕПРОТЕОЛИТИЧЕСКИЕ ФУНКЦИИ Hyd
В экспериментах на крыловых имагинальных дисках дрозофилы показано, что в Hh-сигнальном пути Hyd регулирует экспрессию генов-мишеней Hh – dpp, ptc, en, col, связываясь непосредственно с промоторами этих генов в различных соотношениях, что делает возможным их дифференцированное регулирование [34]. На определенном промоторе Hyd выступает в роли фактора, присутствие которого влияет на транскрипционную активность Ci (Cubitus interuptus) – главного транскрипционного медиатора Hh-сигнального пути. При этом Hyd физически взаимодействует с Ci. Интересно, что для осуществления этой регуляции необходима Е3 лигазная активность Hyd, но в протеасомной деградации этих субстратов Hyd не участвует [34].
Hyd необходим также для запуска экспрессии генов-мишеней в сигнальном пути Wnt, контролирующем ключевые события в процессе эмбрионального развития и морфогенеза. В отсутствие сигнала Wg репрессор Groucho/TLE связан с энхансерной последовательностью генов-мишеней, и это предотвращает их экспрессию. В ответ на сигнал происходит стабилизация белка-эффектора β‑катенина, который связывается с Groucho/TLE и Hyd, что приводит к убиквитинированию TLE, его дестабилизации и, как следствие, к конформационному изменению всего комплекса белков, связанных с энхансером. Хроматин переходит в деконденсированное состояние, что приводит к активации транскрипции. Экспериментально полученные данные позволили cделать вывод [26], что инактивация Groucho/TLE путем убиквитинирования и последующей протеасомной деградации не является основным механизмом регуляции его репрессорных функций. Предполагается, что присоединение поли-(Ub)-цепей ослабляет связь Groucho/TLE с нуклеосомами, а следовательно, и его способность удерживать хроматин в компактном состоянии [26].
Другой пример непротеолитической функции Hyd – участие в развитии иммунного ответа у дрозофилы. Посредством каталитического HECT-домена Hyd физически взаимодействует с белком Akirin и формирует на нем Lys63-поли-(Ub)-цепи, которые служат для дальнейшего связывания кофактора Akirin с транскрипционным фактором Relish и последующей активации экспрессии Akirin-зависимых генов [35]. Белок UBR5 человека (ортолог Hyd дрозофилы) необходим также для активации транскрипции AKIRIN2-зависимых генов.
Во всех приведенных примерах рассмотрены эволюционно консервативные сигнальные пути. И у млекопитающих, и у дрозофилы Hyd выполняет в них аналогичные функции. Еще один пример консервативного механизма регуляции экспрессии генов с участием UBR5 – генный сайленсинг, опосредованный микроРНК. В этом процессе убиквитин-лигазная активность UBR5 вообще оказалась необязательной. Для нормального функционирования UBR5 в сайленсинге с участием микроРНК необходим домен PABC, посредством которого UBR5 взаимодействует с белками семейства GW182 в комплексе c Argonaute и микроРНК, осуществляющими регуляцию трансляции [36] (рис. 1б).
РОЛЬ Hyd В РАЗВИТИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ ЧЕЛОВЕКА
Hyd, как и все Е3 убиквитин-лигазы, – высококонсервативный белок, имеющий близкого ортолога у млекопитающих – UBR5, также известного, как EDD (E3 identified by Differential Display). Изначально UBR5 был идентифицирован в клетках рака молочной железы при скрининге генов, регулируемых прогестином [37]. В дальнейшем оказалось, что амплификация UBR5 характерна для многих видов рака [38]. Так, при раке молочной железы и раке яичников амплификация локуса UBR5 приводит к сверхэкспрессии мРНК гена UBR5. Недавние исследования показали, что 18% случаев мантийноклеточной лимфомы связаны с несинонимичными заменами в гене UBR5. Большинство из этих мутаций затрагивает консервативный остаток цистеина в HECT-домене белка, что нарушает его лигазную активность [39]. По данным COSMIC (catalogue of somatic mutations in cancer) при раке часто возникают точечные мутации по всей рамке считывания UBR5, а в районе домена HECT/PABC наблюдается тенденция к мутациям со сдвигом рамки считывания, что также, скорее всего, приводит к потере E3 убиквитин-лигазной активности [40]. Это указывает на онкосупрессорную функцию UBR5-опосредованного убиквитинирования [27].
Все большее количество исследований говорит о том, что UBR5 связан с различными аспектами биологии рака, но механизм, посредством которого этот белок вносит вклад в инициацию и прогрессию опухолей, остается невыясненным. Не совсем понятно, к какой группе генов следует отнести UBR5 – к онкогенам или онкосупрессорам. В одних случаях прослеживается четкая связь между амплификацией UBR5, его сверхэкспрессией и химиорезистентностью опухоли и, как следствие, с неблагоприятным исходом болезни [32]. Например, повышенный уровень экспрессии UBR5 при серозном раке яичника коррелирует со сниженной чувствительностью к циспластину, что в совокупности приводит к почти двукратному увеличению риска рецидива и смерти пациентов [41]. В других случаях развитие опухолей обусловлено мутациями потери функции UBR5 [39]. В связи с этим большое значение для изучения роли UBR5 в развитии рака приобретают животные модели, позволяющие модулировать экспрессию UBR5 в различных условиях и в различных клеточных контекстах. Выяснение роли UBR5 и набора субстратов в каждом конкретном случае необходимы для использования UBR5 в качестве мишени при таргетной противоопухолевой терапии.
Работа выполнена при финансовой поддержке программы фундаментальных научных исследований по темам 0310-2019-0005 (Ю.А. Галимова) и 0324-2019-0042-C-01 (Н.В. Дорогова и С.А. Фёдорова).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Finley D. (2009) Recognition and processing of ubiquitin-protein conjugates by the proteasome. Annu. Rev. Biochem. 78, 477–513.
Schnell J.D., Hicke L. (2003) Non-traditional functions of ubiquitin and ubiquitin binding proteins. J. Biol. Chem. 278, 35857–35860.
Mukhopadhyay D., Riezman H. (2007) Proteasome-independent functions of ubiquitin in endocytosis and signaling. Science. 315, 201–205.
Hicke L. (2001) A new ticket for entry into budding vesicles – ubiquitin. Cell. 106, 527–530.
Kirisako T., Kamei K., Murata S., Kato M., Fukumoto H., Kanie M., Sano S., Tokunaga F., Tanaka K., Iwai K. (2006) A ubiquitin ligase complex assembles linear polyubiquitin chains. EMBO J. 25(20), 4877–4887.
Pickart C.M., Fushman D. (2004) Polyubiquitin chains: polymeric protein signals. Curr. Opin. Chem. Biol. 8, 610–616.
Bernassola F., Karin M., Aaron Ciechanover A., Melino G. (2008) The HECT family of E3 ubiquitin ligases: multiple players in cancer development. Cancer Cell. 14, 10–21.
Sun Y. (2006) E3 ubiquitin ligases as cancer targets and biomarkers. Neoplasia. 8, 645–654.
Deshaies R.J., Joazeiro C.A.P. (2009) RING domain E3 ubiquitin ligases. Annu. Rev. Biochem. 78, 399–434.
Yang Y., Fang S., Jensen J.P., Weissman A.M., Ashwell J.D. (2000) Ubiquitin protein ligase activity of IAPs and their degradation in proteasomes in response to apoptotic stimuli. Science. 288, 874–877.
Fang S., Jensen J.P., Ludwig R.L., Vousden K.H., Weissman A.M. (2000) Mdm2 is a RING finger-dependent ubiquitin protein ligase for itself and p53. J. Biol. Chem. 275, 8945–8951.
Deshaies R.J. (1999) SCF and cullin/RING H2-based ubiquitin ligases. Annu. Rev. Cell Dev. Biol. 15, 435–467.
Chang L., Barford D. (2014) Insights into the anaphase-promoting complex: a molecular machine that regulates mitosis. Curr. Opin. Struct. Biol. 29, 1–9.
Scheffner M., Nuber U., Huibregtse J.M. (1995) Protein ubiquitination involving an E1–E2–E3 enzyme ubiquitin thioester cascade. Nature. 373, 81–83.
Wenzel D.M., Lissounov A., Brzovic P.S., Klevit R.E. (2011) UBCH7 reactivity profile reveals parkin and HHARI to be RING/HECT hybrids. Nature. 474, 105–108.
Martin P., Martin A., Shearn A. (1977) Studies of l(3)c43hs1 a polyphasic, temperature-sensitive mutant of Drosophila melanogaster with a variety of imaginal disc defects. Dev. Biol. 55, 213–232.
Mansfield E., Hersperger E., Biggs J., Shearn A. (1994) Genetic and molecular analysis of hyperplastic discs, a gene whose product is required for regulation of cell proliferation in Drosophila melanogaster imaginal discs and germ cells. Dev. Biol. 165, 507–526.
Kozlov G., Nguyen L., Lin T., De Crescenzo G., Park M., Gehring K. (2007) Structural basis of ubiquitin recognition by the ubiquitin-associated (UBA) domain of the ubiquitin ligase EDD. J. Biol. Chem. 282, 35787–35795.
Tasaki T., Mulder L.C., Iwamatsu A., Lee M.J., Davydov I.V., Varshavsky A., Muesing M., Kwon Y.T. (2005) A family of mammalian E3 ubiquitin ligases that contain the UBR box motif and recognize N-degrons. Mol. Cell. Biol. 25, 7120–7136.
Matta-Camacho E., Kozlov G., Menade M., Gehring K. (2012) Structure of the HECT C-lobe of the UBR5 E3 ubiquitin ligase. Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun. 68, 1158–1163.
Deo R.C., Sonenberg N., Burley S.K. (2001) X-ray structure of the human hyperplastic discs protein: an ortholog of the C-terminal domain of poly(A)-binding protein. Proc. Natl. Acad. Sci. USA. 98, 4414–4419.
Lim N.S., Kozlov G., Chang T.C., Groover O., Siddiqui N., Volpon L., De Crescenzo G., Shyu A.B., Gehring K. (2006) Comparative peptide binding studies of the PABC domains from the ubiquitin-protein isopeptide ligase HYD and poly(A)-binding protein. Implications for HYD function. J. Biol. Chem. 281, 14376–14382.
Gateff E. (1994) Tumor suppressor and overgrowth suppressor genes of Drosophila melanogaster: developmental aspects. Int. J. Dev. Biol. 38(4), 565–590.
Lee J.D., Amanai K., Shearn A., Treisman J.E. (2002) The ubiquitin ligase hyperplastic discs negatively regulates hedgehog and decapentaplegic expression by independent mechanisms. Development. 129, 5697–5706.
Pertceva J.A., Dorogova N.V., Bolobolova E.U., Nerusheva O.O., Fedorova S.A., Omelyanchuk L.V. (2010) The role of Drosophila hyperplastic discs gene in spermatogenesis. Cell Biol. Int. 34, 991–996.
Flack J. E., Mieszczanek J., Novcic N., Bienz M. (2017) Wnt-dependent inactivation of the Groucho/ TLE corepressor by the HECT E3 ubiquitin ligase Hyd/UBR5. Mol. Cell. 67, 181–193.
Shearer R.F., Iconomou M., Watts C.K., Saunders D.N. (2015) Functional roles of the E3 ubiquitin ligase UBR5 in cancer. Mol. Cancer Res. 13, 1523–1532.
Scheffner M., Kumar S. (2014) Mammalian HECT ubiquitin-protein ligases: biological and pathophysiological aspects. Biochim. Biophys. Acta. 1843(1), 61–74.
Muñoz-Escobar J., Matta-Camacho E., Kozlov G., Gehring K. (2015) The MLLE domain of the ubiquitin ligase UBR5 binds to its catalytic domain to regulate substrate binding. J. Biol. Chem. 290(37), 22841–22850.
Qiao X., Liu Y., Prada M.L., Mohan A.K., Gupta A., Jaiswal A., Sharma M., Merisaari J., Haikala H.M., Talvinen K., Yetukuri L., Pylvänäinen J.W., Klefström J., Kronqvist P., Meinander A., Aittokallio T., Hietakangas V., Eilers M., Westermarck J. (2020) UBR5 is coamplified with MYC in breast tumors and encodes an ubiquitin ligase that limits MYC-dependent apoptosis. Cancer Res. 80(7), 1414–1427.
Gupta I., Singh K., Varshney N.K., Khan S. (2018) Delineating crosstalk mechanisms of the ubiquitin proteasome system that regulate apoptosis. Front. Cell. Dev. Biol. 6, 11.
Matsuura K., Huang N.J., Cocce K., Zhang L., Kornbluth S. (2017) Downregulation of the proapoptotic protein MOAP-1 by the UBR5 ubiquitin ligase and its role in ovarian cancer resistance to cisplatin. Oncogene. 36(12), 1698–1706.
Wang D., Xu Q., Yuan Q., Jia M., Niu H., Liu X., Zhang J, Young C.Y., Yuan H. (2019) Proteasome inhibition boosts autophagic degradation of ubiquitinated-AGR2 and enhances the antitumor efficiency of bevacizumab. Oncogene. 38, 3458–3474.
Wang G., Tang X., Chen Y., Cao J., Huang Q., Ling X., Ren W., Liu S., Wu Y., Ray L., Lin X. (2014) Hyperplastic discs differentially regulates the transcriptional outputs of Hedgehog signaling. Mech. Dev. 133, 117–125.
Cammarata-Mouchtouris A., Nguyen X.H., Acker A., Bonnay F., Goto A., Orian A., Fauvarque M.O., Boutros M., Reichhart J.M., Matt N. (2020) Hyd ubiquitinates the NF-κB co-factor Akirin to operate an effective immune response in Drosophila. PLoS Pathog. 16(4), e1008458.
Su H., Meng S., Lu Y., Trombly M.I., Chen J., Lin C., Turk A., Wang X. (2011) Mammalian hyperplastic discs homolog EDD regulates miRNA-mediated gene silencing. Mol. Cell. 43(1), 97–109.
Callaghan M.J., Russell A.J., Woollatt E., Sutherland G.R., Sutherland R.L., Watts C.K. (1998) Identification of a human HECT family protein with homology to the Drosophila tumor suppressor gene hyperplastic discs. Oncogene. 17, 3479–3491.
Clancy J.L., Henderson M.J., Russell A.J., Anderson D.W., Bova R.J., Campbell I.G., Choong D.Y., Macdonald G.A., Mann G.J., Nolan T., Brady G., Olopade O.I., Woollatt E., Davies M.J., Segara D., Hacker N.F., Henshall S.M., Sutherland R.L., Watts C.K. (2003) EDD, the human orthologue of the hyperplastic discs tumour suppressor gene, is amplified and overexpressed in cancer. Oncogene. 22, 5070–5081.
Meissner B., Kridel R., Lim R.S., Rogic S., Tse K., Scott D.W., Moore R., Mungall A.J., Marra M.A., Connors J.M., Steidl C., Gascoyne R.D. (2013) The E3 ubiquitin ligase UBR5 is recurrently mutated in mantle cell lymphoma. Blood. 121, 3161–3164.
Forbes S.A., Bhamra G., Bamford S., Dawson E., Kok C., Clements J., Menzies A., Teague J.W., Futreal P.A., Stratton M.R (2008) The catalogue of somatic mutations in cancer (COSMIC). Curr. Protoc. Hum. Genet. Ch. 10, Unit 10-11.
O'Brien P.M., Davies M.J., Scurry J.P., Smith A.N., Barton C.A., Henderson M.J., Saunders D.N., Gloss B.S., Patterson K.I., Clancy J.L., Heinzelmann-Schwarz V.A., Scolyer R.A., Zeng Y., Williams E.D., Scurr L., DeFazio A., Quinn D.I., Watts C.K.W., Hacker N.F., Henshall S.M., Sutherland R.L. (2008) The E3 ubiquitin ligase EDD is an adverse prognostic factor for serous epithelial ovarian cancer and modulates cisplatin resistance in vitro. Br. J. Cancer. 98(6), 1085–1093.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


