Молекулярная биология, 2021, T. 55, № 4, стр. 578-584
Экспрессия рецептора грелина GHS-R1a в головном мозге (мини-обзор)
М. И. Айрапетов a, b, *, С. О. Ереско a, c, А. А. Лебедев a, Е. Р. Бычков a, П. Д. Шабанов a, d
a Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
b Санкт-Петербургский государственный педиатрический медицинский университет
194100 Санкт-Петербург, Россия
c Санкт-Петербургский государственный химико-фармацевтический университет
197022 Санкт-Петербург, Россия
d Военно-медицинская академия им. С.М. Кирова
194044 Санкт-Петербург, Россия
* E-mail: interleukin1b@gmail.com
Поступила в редакцию 06.01.2021
После доработки 24.02.2021
Принята к публикации 25.02.2021
Аннотация
В обзоре представлены данные об экспрессии рецептора грелина GHS-R1a в структурах головного мозга разных модельных объектов (Danio rerio, грызуны, приматы), а также в мозге человека. Локализация GHS-R1a в различных структурах головного мозга указывает на участие рецептора во многих физиологических процессах. На различных моделях показано, что GHS-R1a участвует в регуляции про- и противовоспалительного ответа, апоптоза и пролиферации клеток. Известно, что рецептор грелина играет важную роль в пищевом поведении, а также вовлечен в патогенетические механизмы ожирения, наркомании, алкоголизма. Ведутся исследования с применением различных терапевтических средств (агонистов и антагонистов рецептора), которые могут использоваться в фармакокоррекции указанных патологических состояний. Рассмотрены гипотетические механизмы внутриклеточной сигнализации, реализуемой при участии GHS-R1a, однако полное понимание этих механизмов на данный момент не достигнуто. Грелиновые внутриклеточные пути, по-видимому, специфичны для определенной области мозга и, вероятно, зависят также от метаболического или стрессового статуса организма.
ВВЕДЕНИЕ
Со времени открытия рецептора грелина (GHS-R1a, Growth Hormone Secretagogue Receptor 1a) прошло более 20 лет, однако этот рецептор до сих вызывает повышенный интерес. Каждый год появляются новые данные о физиологических процессах, немаловажную роль в которых играет GHS-R1a. Большое внимание привлекают механизмы пищевого поведения, в которых принимает участие GHS-R1a, а также вклад этого рецептора в различные формы аддиктивного поведения (наркомания, алкоголизм, игровая зависимость и др.) [1–3]. Многочисленные данные свидетельствуют о вовлеченности рецептора в механизмы развития нейродегенеративного процесса при различных патологических состояниях головного мозга, включая болезнь Альцгеймера и болезнь Паркинсона [4, 5]. При этом немаловажно, что грелин выполняет противонейровоспалительную и нейропротекторную роль [6–8]. Кроме того, показано участие грелина и его рецептора в механизмах стресса, приводящего к поведенческим и психопатологическим нарушениям [9, 10].
Представленность рецептора грелина, в различных структурах головного мозга указывает на возможную многофункциональность и самого грелина [11–17].
ГРЕЛИН И ЕГО РЕЦЕПТОР GHS-R1а
Грелин
Грелин – это пептидный гормон, который секретируется в наибольшем количестве клетками желудка млекопитающих. Известны две формы грелина: ацилированная и неацилированная (дезацилгрелин). Ацилированный грелин образуется путем ацетилирования по остатку серина в положении 3 (Ser3) грелин-О-ацилтрансферазой. Присутствие ацильного остатка необходимо для связывания грелина с его рецептором GHS-R1a в центральной нервной системе (ЦНС), дезацилгрелин с GHS-R1a не связывается [18, 19]. Предполагается, что ацетилирование происходит непосредственно перед связыванием ацетилированных форм грелина с GHS-R1a [20]. Дезацилгрелин представляет собой наиболее стабильную и долгоживущую форму грелина, циркулирующую в плазме крови. Неацилированную форму грелина первоначально считали предшественником или продуктом метаболизма ацилированной формы, однако в последнее время дезацилгрелину отводят особую роль в организме [21]. Относительное содержание дезацилгрелина в суммарном пуле грелина достигает 60–90%, тогда как ацилированный грелин составляет до 10% от общего содержания грелина [22]. Кроме того, ацилированный грелин быстро разрушается в образцах плазмы или сыворотки, а его точное количественное определение часто связано с некоторыми методическими трудностями [23, 24].
GHS-R1a
Рецептор к ацилированному грелину (GHS-R1a) впервые описали А.Д. Говард с коллегами в 1996 году. GHS-R1a входит в семейство метаботропных рецепторов, сопряженных с G-белками (GPCR) [25] – универсальных белков с семью трансмембранными доменами, которые регулируют разнообразные внутриклеточные сигналы в ответ на гормоны, нейротрансмиттеры, ионы, фотоны, одоранты и другие раздражители. Рецепторы этого подтипа играют важную роль в клеточных процессах и рассматриваются в качестве привлекательной мишени для разработки лекарственных средств. Рецепторы GPCR нельзя описать как простые бимодальные переключатели типа “включено–выключено”, но их следует рассматривать как высокодинамичные системы, которые существуют во множестве функционально различных конформаций. Более того, лиганды могут регулировать активность рецептора, изменяя его конформацию, и тем самым оказывать влияние на запуск внутриклеточных сигнальных каскадов в том или ином направлении [26].
Белок GHS-R1a крысы состоит из 364 аминокислотных остатков, которые формируют семь трансмембранных доменов. Сравнение полных аминокислотных последовательностей гомологов GHS-R1a крысы, свиньи и человека выявило высокую степень их идентичности (96.1% у крысы и человека). Ген рецептора GHS-R содержит два экзона, один из которых кодирует домены 1–5, а второй – домены 6 и 7. Существование двух типов GHS-R человека и свиньи (типы 1a и 1b) объясняется их происхождением в результате альтернативного сплайсинга пре-мРНК одного гена. Полный белок GHS-R1, состоящий из семи доменов, кодируется мРНК типа 1a, из которой удаляется интрон, локализованный между двумя экзонами гена GHS-R [27].
В головном мозге GHS-R1a локализуется на плазматической мембране нейронов, астроцитов и олигодендроцитов [28–30]. Несмотря на то, что GHS-R1a широко экспрессируется периферическими иммунными клетками (моноциты, макрофаги, Т-клетки), экспрессия GHS-R1a не выявлена на резидентных макрофагах нервной системы (микроглия) [28, 31, 32].
С использованием агонистов и антагонистов GHS-R1a показано, что активация рецептора приводит к изменению многих каскадов внутриклеточных реакций (см. рис. 1). Такие внутриклеточные пути, по-видимому, специфичны для определенной области мозга и, вероятно, зависят от метаболического или стрессового статуса индивида, а также от микроокружения, которое содержит различные сигнальные молекулы [9, 33]. Так, взаимодействие GHS-R1a с лигандом активирует сигнальный путь Gα11/q – фосфолипаза C, что приводит к гидролизу фосфатидилинозитолдифосфата (PIP2) и, как следствие, к высвобождению инозитол-3-фосфата (IP3) и диацилглицерина (DAG). При этом GHS-R1a также связан с сигнальным путем Gαi/o.
Рис. 1.
Сигнальные каскады GHS-R1a в клетках головного мозга. ГОАТ – грелин-О-ацилтрансфераза; АС – аденилатциклаза; PLC – фосфолипаза С; DAG – диацилглицерин; IP3 – инозитол-3-фосфат; PIP2 – фосфатидилинозитдифосфат; DRD – рецептор дофамина; 5HT2c – рецептор серотонина; MRAP2 – вспомогательный белок к рецепторам меланокортина.
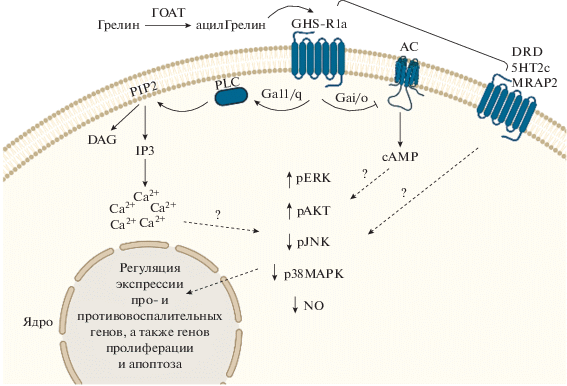
На различных моделях показано, что активация GHS-R1a приводит к повышению уровня фосфорилирования киназ ERK и AKT, тогда как уровень фосфорилирования JNK и p38MAPK преимущественно снижается [2, 8, 20, 30, 34–37]. Активация грелиновой сигнализации приводит к снижению уровня оксида азота [36]. Изменение уровня фосфорилирования различных протеинкиназ приводит и к изменению активности различных факторов транскрипции, которые регулируют экспрессию самых разных генов; грелиновая сигнализация вовлечена в изменение уровня экспрессии про- и противовоспалительных генов, а также генов, связанных с пролиферацией и апоптозом [1, 2, 8, 20, 30, 34–37].
Известно также, что GHS-R1a образует гомо- и гетеродимеры с другими рецепторами, что влияет на активность GHS-R1a [38]. GHS-R1a образует комплекс с рецептором GHS-R1b, который локализуется на мембранах эндоплазматический сети, что приводит к интернализации GHS-R1a и снижению связывания лигандов с ним. Когда экспрессия GHS-R1b превышала экспрессию GHS-R1a, наблюдалось снижение экспрессии GHS-R1a на клеточной поверхности с последующим снижением активности фосфатидилинозитол-специфичной фосфолипазы C (PI-PLC) [38]. GHS-R1a образует гетеродимеры и с другими GPCR-рецепторами [39]. Образование гетеродимеров GHS-R1a с DRD1 (рецептор D1 дофамина) и активация DRD1 приводят к неканонической передаче сигнала по пути Gaq/11. Высказано предположение, что разрушение этих гетеродимеров может быть механизмом развития болезни Альцгеймера [40, 41]. GHS-R1a способен образовывать димеры с DRD2, а также с рецепторами 5HT2c, меланокортина (MC3R, MC4R), соматостатина и окситоцина [42, 43].
В последнее время появляется все больше данных о так называемой лиганднезависимой активности GHS-R1a, т.е. об активном конформационном состоянии рецептора в отсутствие лигандов. Предполагается, что эта активность важна для протекания многих физиологических процессов [44, 45].
Активация 5HT2c в составе димеров 5HT2c/ GHS-R1a приводит к ингибированию вызванной грелином передачи сигналов по пути Gaq/11, тогда как блокирование 5HT2c усиливает передачу сигналов GHS-R1a и вызванной грелином передачи сигналов [46]. Анализ in vitro показывает, что GHS-R1a и MRAP-2 образуют комплексы, которые усиливают вызванную грелином передачу сигналов через Gaq/11 [47]. Последние данные свидетельствуют о том, что экспрессирующийся в печени антимикробный пептид 2 (LEAP2) –эндогенный лиганд GHS-R1a –регулирует передачу внутриклеточных сигналов грелина [48–51].
ЭКСПРЕССИЯ GHS-R1а В ГОЛОВНОМ МОЗГЕ
Экспрессию GHS-R1a изучали в головном мозге разных модельных организмов, таких как Danio rerio, мыши, крысы, приматы, а также человека.
Аквариумная рыбка D. rerio. хорошо зарекомендовала себя в качестве модельного объекта, в том числе, и в нейробиологии. Установлено, что грелин экспрессируется в панкреатических эндокринных клетках D. rerio. C помощью количественной ОТ-ПЦР в реальном времени показано, что zGHS-R1 (вариант, аминокислотная последовательность которого незначительно отличается от GHS-R1a млекопитающих), экспрессируется на высоком уровне в тканях мозга. Экспрессия GHS-R1a выявлена и в мозге таких рыб, как тилапия, черный морской лещ, золотая рыбка и карп. Однако полагают, что было бы неплохо в дальнейшем определить уровень экспрессии zGHS-R1 в различных отделах головного мозга D. rerio [52, 53].
В наибольших концентрациях мРНК GHS-R1a представлена в гипоталамусе (супрахиазматическое ядро, вентромедиальное ядро, паравентрикулярное ядро и др.) и гипофизе крыс и мышей. Высокий уровень мРНК рецептора грелина выявлен также в зубчатой извилине гиппокампа, полях СА1, СА2 и СА3 гиппокампа, а также в ядрах ствола мозга (черная субстанция, вентральная тегментальная область, дорсальное ядро шва, двигательное ядро лицевого нерва, латеральное парабрахиальное ядро, nucleus ambiguus), небольшое количество мРНК обнаружено в пириформной коре мозга мышей и крыс. Имеются сведения об экспрессии мРНК GHS-R1a в ядрах таламуса крысы [11, 12]. мРНК грелина и GHS-R обнаружены и в сенсомоторной коре головного мозга крыс [13], Позднее показали, что GHS-R1a экспрессируется в нескольких регионах миндалевидного тела крысы [14].
Высокие уровни экспрессии мРНК GHS-R1a выявлены в гипофизе и гипоталамусе; умеренные – в таламусе, коре головного мозга, в мосту, продолговатом мозге и обонятельной луковице; низкие – в мозжечке и периферических тканях морской свинки (Cavia porcellus). Распределение экспрессии GHS-R1a в головном мозге морской свинки было почти таким же, как у крыс. При этом распределение GHS-R1a в периферических тканях морских свинок и крыс различалось [54].
Французские исследователи обнаружили мРНК GHS-R1a в гипофизе, гипоталамусе, гиппокампе и коре мозжечка четырех взрослых лемуров (Microcebus murinus) [55].
Нами найдена всего одна работа, в которой анализировали уровень мРНК GHS-R1a у человека. мРНК GHS-R1a выявлена в гипофизе, гипоталамусе и гиппокампе, однако в этой работе сделан вывод, что невозможность обнаружить мРНК GHS-R1a в других областях мозга связана, скорее всего, с ее низкой концентрацией [11].
Представленность GHS-R1a в различных структурах головного мозга (табл. 1), показанная на различных модельных объектах, указывает на участие этого рецептора во многих физиологических и патологических процессах.
Таблица 1.
Экспрессия GHS-R1a в структурах головного мозга
| Отдел головного мозга | Крыса | Мышь | Приматы | Человек | Ссылка |
|---|---|---|---|---|---|
| Пириформная кора | +/– | +/– | ? | ? | [11, 12] |
| Сенсомоторная кора | + | ? | ? | ? | [13] |
| Гиппокамп | + | +/– | + | + | [11, 12, 55] |
| Амигдала | + | ? | ? | ? | [14] |
| Гипоталамус | + | + | + | + | [11, 12, 54, 55] |
| Ядра таламуса | +/– | ? | ? | ? | [11, 12] |
| Средний мозг | + | + | ? | ? | [11, 12] |
| ВТА (вентральная тегментальная область) | + | + | ? | +/– | [11, 12] |
| Черная субстанция | + | + | ? | +/– | [11, 12] |
| Ядра ствола мозга | + | + | ? | ? | [11, 12] |
| Мозжечок | + | ? | + | ? | [51, 52] |
| Гипофиз | + | + | + | + | [54, 55] |
ЗАКЛЮЧЕНИЕ
Полученные на различных модельных объектах с помощью молекулярно-генетических и гистохимических методов данные свидетельствуют о широкой локализации GHS-R1a в различных структурах головного мозга, чем и объясняется вовлеченность рецептора грелина во многие физиологические процессы. Несмотря не некоторые отличия в характере распределения экспрессии рецептора на периферии, наблюдается большое сходство в распределении GHS-R1a в структурах головного мозга модельных организмов, таких как грызуны, приматы, а также у человека. Таким образом, изучение механизмов грелиновой сигнализации на головном мозге грызунов вполне оправдано, учитывая сходство картины распределения экспрессии GHS-R1a в структурах головного мозга. Изучение и понимание механизмов грелиновой сигнализации может открыть новые подходы к фармакокоррекции тех многочисленных патологических состояний нервной системы, немаловажную роль в которых играет GHS-R1a.
Исследование выполнено в рамках Государственного задания по теме “Фармакологический анализ действия нейротропных средств, изучение внутриклеточных мишеней и создание систем направленной доставки” (шифр 0557-2019-0004).
Настоящая статья не содержит описания каких-либо исследований с участием людей или животных в качестве объектов.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Smith R.G., Thorner M.O. (2012) Ghrelin in Health and Disease. New York: Springer Sci. Business Media.
Akalu Y., Molla M.D., Dessie G., Ayelign B. (2020) Physiological effect of ghrelin on body systems. Int. J. Endocrinol. 2020, 1385138. https://doi.org/10.1155/2020/1385138
Shabanov P.D., Airapetov M.I., Sekste E.A., Khok-hlov P.P., Lebedev A.A., Bychkov E.R., Vinogra-dov P.M., Roik R.O., Pavlenko V.P. (2014) Serum unacylated ghrelin concentrations and expression of GHSR mRNA in the rat brain structures after chronic alcoholization and ethanol withdrawal. Eur. Neuropsychopharmacol. 24(S2), 653.
Suda Y., Kuzumaki N., Sone T., Narita M., Tanaka K., Hamada Y., Iwasawa C., Shibasaki M., Maekawa A., Matsuo M., Akamatsu W., Hattori N., Okano H., Narita M. (2018) Down-regulation of ghrelin receptors on dopaminergic neurons in the substantia nigra contributes to Parkinson’s disease-like motor dysfunction. Mol. Brain. 11(1), 6.
Jeon S.G., Hong S.B., Nam Y., Tae J., Yoo A., Song E.J., Kim K.I., Lee D., Park J., Lee S.M., Kim J.I., Moon M. (2019) Ghrelin in Alzheimer’s disease: pathologic roles and therapeutic implications. Ageing Res. Rev. 55, 100945.
Tian J., Guo L., Sui S., Driskill C., Phensy A., Wang Q., Du H. (2019) Disrupted hippocampal growth hormone secretagogue receptor 1α interaction with dopamine receptor D1 plays a role in Alzheimer’s disease. Sci. Translat. Med. 11(505), 1–14.
Buntwal L., Sassi M., Morgan A.H., Andrews Z.B., Davies J.S. (2019) Ghrelin-mediated hippocampal neurogenesis: implications for health and disease. Trends Endocrinol Metab. 30(11), 844–859.
Shi L., Du X., Jiang H., Xie J. (2017) Ghrelin and neurodegenerative disorders-a review. Mol. Neurobiol. 54(2), 1144–1155.
Guo L., Niu M., Yang J., Li L., Liu S., Sun Y., Zhou Z., Zhou Y. (2019) GHS-R1a deficiency alleviates depression-related behaviors after chronic social defeat stress. Front. Neurosci. 13, 364.
Fritz E.M., Singewald N., Bundel D.D. (2020) The good, the bad and the unknown aspects of ghrelin in stress coping and stress-related psychiatric disorders. Front. Synaptic Neurosci. 12, 594484.
Guan X.M., Yu H., Palyha O.C., McKee K.K., Feighner S.D., Sirinathsinghji D.J.S., Howard A.D. (1997) Distribution of mRNA encoding the growth hormone secretagogue receptor in brain and peripheral tissues. Brain Res. Mol. Brain Res. 48(1), 23–29.
Zigman J.M., Jones J.E., Lee C.E., Saper C.B., Elmquist J.K. (2006) Expression of ghrelin receptor mRNA in the rat and the mouse brain. J. Comp. Neurol. 494(3), 528–548.
Hou Z., Miao Y., Gao L., Pan H., Zhu S. (2006) Ghrelin-containing neuron in cerebral cortex and hypothalamus linked with the DVC of brainstem in rat. Regul. Pept. 134(2–3), 126–131.
Alvarez-Crespo M., Skibicka K.P., Farkas I., Molnár C.S., Egecioglu E., Hrabovszky E., Liposits Z., Dickson S.L. (2012) The amygdala as a neurobiological target for ghrelin in rats: neuroanatomical, electrophysiological and behavioral evidence. PLoS One. 7(10), 46321.
Jang J.K., Kim W.Y., Cho B.R., Lee J.W., Kim J.H. (2017) Locomotor sensitization is expressed by ghrelin and D1 dopamine receptor agonist in the nucleus accumbens core in amphetamine pre-exposed rat. Addict. Biol. 23(3), 849–856.
Sustkova-Fiserova M., Puskina N., Havlickova T., Lapka M., Syslova K., Pohorala V., Charalambous C. (2019) Ghrelin receptor antagonism of fentanyl-induced conditioned place preference, intravenous self-administration, and dopamine release in the nucleus accumbens in rats. Addict. Biol. 25(6), 1–10.
Vestlund J., Bergquist F., Eckernäs D., Licheri V., Adermark L., Jerlhag E. (2019) Ghrelin signalling within the rat nucleus accumbens and skilled reach foraging. Psychoneuroendocrinology. 106, 183–194.
Ansari D., Gustafsson A., Andersson R. (2015) Update on the management of pancreatic cancer: surgery is not enough. World J. Gastroenterol. 21(11), 3214–3222.
Sato T., Nakamura Y., Shiimura Y., Ohgusu H., Kangawa K., Kojima M. (2011) Structure, regulation and function of ghrelin. J. Biochem. 151(2), 119–128.
Abizaid A., Hougland J.L. (2019) Ghrelin signaling: GOAT and GHS-R1a take a LEAP in complexity. Trends Endocrinol. Metab. 31(2), 107–117.
Rauh M., Groschl M., Rascher W. (2007) Simultaneous quantification of ghrelin and desacyl-ghrelin by liquid chromatography-tandem mass spectrometry in plasma, serum, and cell supernatants. Clin. Chem. 53(5), 902–910.
Kempinski R., Demissie M., Jasinska M., Paradowski L. (2008) Plasma ghrelin concentration in celiac patients. Gastroenterologia Polska. 15(6), 375–377.
Bednarek M.A., Feighner S.D., Pong S.S., McKee K.K., Hreniuk D.L., Silva M.V., Heck J.V. (2000) Structure-function studies on the new growth hormone-releasing peptide, ghrelin: minimal sequence of ghrelin necessary for activation of growth hormone secretagogue receptor 1a. J. Med. Chem. 43(23), 4370–4376.
Hosoda H., Doi K., Nagaya N., Okumura H., Nakagawa E., Enomoto M., Ono F., Kangawa K. (2004) Optimum collection and storage conditions for ghrelin measurements: octanoyl modification of ghrelin is rapidly hydrolyzed to desacyl ghrelin in blood samples. Clin. Chem. 50(6), 1077–1080.
Howard A.D., Feighner S.D., Cully D.F., Arena J.P., Liberator P.A., Rosenblum C.I., Hamelin M., Hreniuk D.L., Palyha O.C., Anderson J., Paress P.S., Diaz C., Chou M., Liu K.K., McKee K.K., Pong S.S., Cha-ung L.Y., Elbrecht A., Dashkevicz M., Heavens R., Rigby M., Sirinathsinghji D.J., Dean D.C., Melillo D.G., Patchett A.A., Nargund R., Griffin P.R., DeMartino J.A., Gupta S.K., Schaeffer J.M., Smith R.G., Van der Ploeg L.H. (1996) A receptor in pituitary and hypothalamus that functions in growth hormone release. Science. 273(5277), 974–977.
Hilger D., Masureel M., Kobilka B.K. (2018) Structure and dynamics of GPCR signaling complexes. Nat. Struct. Mol. Biol. 25(1), 4–12.
McKee K.K., Palyha O.C., Feighner S.D., Hreniuk D.L., Tan C.P., Phillips M.S., Smith R.G., Van der Ploeg L.H., Howard A.D. (1997) Molecular analysis of rat pituitary and hypothalamic growth hormone secretagogue receptors. Mol. Endocrinol. 11(4), 415–423.
Moon M., Kim H.G., Hwang L., Seo J.H., Kim S., Hwang S., Park S. (2009) Neuroprotective effect of ghrelin in the 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine mouse model of Parkinson’s disease by blocking microglial activation. Neurotox. Res. 15(4), 332–347.
Dong R., Chen M., Liu J., Kang J., Zhu S. (2019) Temporospatial effects of acyl-ghrelin on activation of astrocytes after ischaemic brain injury. J. Neuroendocrinol. 31(7), 12767.
Lee J.Y., Oh T.H., Yune T.Y. (2011) Ghrelin inhibits hydrogen peroxide-induced apoptotic cell death of oligodendrocytes via ERK and p38MAPK signaling. Endocrinology. 152(6), 2377–2386.
Baatar D., Patel K., Taub D.D. (2011) The effects of ghrelin on inflammation and the immune system. Mol. Cell. Endocrinol. 340(1), 44–58.
Bulgarelli I., Tamiazzo L., Bresciani E., Rapetti D., Caporali S., Lattuada D., Torsello A. (2009) Desacyl-ghrelin and synthetic GH-secretagogues modulate the production of inflammatory cytokines in mouse microglia cells stimulated by beta-amyloid fibrils. J. Neurosci. Res. 87(12), 2718–2727.
Song G., Zhu Q., Han F., Liu S., Zhao C., Zhou Y. (2018) Local infusion of ghrelin into the lateral amygdala blocks extinction of conditioned taste aversion in rats. Neurosci. Lett. 662, 71–76.
Chung H., Li E., Kim Y., Kim S., Park S. (2013) Multiple signaling pathways mediate ghrelin-induced proliferation of hippocampal neural stem cells. J. Endocrinol. 218(1), 49–59.
Wang G., Wang W., Zhao J., Ni Y., Zhou X., Zhang W. (2011) Ghrelin prevents neuronal apoptosis and cognitive impairments in sepsis-associated encephalopathy. Neuroreport. 22(18), 959–964.
Zeng M., Huang C., Zheng H., Chen Q., He W., Deng Y. (2018) Effects of ghrelin on iNOS-derived NO promoted LPS-induced pulmonary alveolar epithelial A549 cells apoptosis. Cell. Physiol. Biochem. 49(5), 1840–1855.
Zheng H., Liang W., He W., Huang C., Chen Q., Yi H., Zeng M. (2019) Ghrelin attenuates sepsis-induced acute lung injury by inhibiting the NF-κB, iNOS, and Akt signaling in alveolar macrophages. Am. J. Physiol. Lung Cell. Mol. Physiol. 317(3), 381–391.
Leung P.K., Chow K.B.S., Lau P.N., Chu K.M., Chan C.B., Cheng C.H.K., Wise H. (2007) The truncated ghrelin receptor polypeptide (GHS-R1b) acts as a dominant-negative mutant of the ghrelin receptor. Cell. Signal. 19(5), 1011–1022.
Wellman M., Abizaid A. (2015) Growth hormone secretagogue receptor dimers: a new pharmacological target. eNeuro. 2(2), 1–16.
Kern A., Mavrikaki M., Ullrich C., Albarran-Zeckler R., Brantley A.F., Smith R.G. (2015) Hippocampal dopamine/DRD1 signaling dependent on the ghrelin receptor. Cell. 163(5), 1176–1190.
Tian J., Guo L., Sui S., Driskill C., Phensy A., Wang Q., Du H. (2019) Disrupted hippocampal growth hormone secretagogue receptor 1α interaction with dopamine receptor D1 plays a role in Alzheimer’s disease. Sci. Transl. Med. 11(505), 1–29.
Schellekens H., Dinan T.G., Cryan J.F. (2013) Taking two to tango: a role for ghrelin receptor heterodimerization in stress and reward. Front. Neurosci. 7, 148.
Damian M., Pons V., Renault P., M’Kadmi C., Delort B., Hartmann L., Kaya A.I., Louet M., Gagne D., Sa-lah K.B.H., Denoyelle S., Ferry G., Boutin J.A., Wagner R., Fehrentz J.A., Martinez J., Marie J., Floquet N., Galès C., Mary S., Hamm H.E., Banères J.L. (2018) GHSR-D2R heteromerization modulates dopamine signaling through an effect on G protein conformation. Proc. Natl. Acad. Sci. USA. 115(17), 4501–4506.
Mear Y., Enjalbert A., Thirion S. (2013) GHS-R1a constitutive activity and its physiological relevance. Front. Neurosci. 7, 87.
Ribeiro L.F., Catarino T., Carvalho M., Cortes L., Santos S.D., Opazo P.O., Ribeiro L.R., Oliveiros B., Choquet D., Esteban J.A., Peça J., Carvalho A.L. (2021) Ligand-independent activity of the ghrelin receptor modulates AMPA receptor trafficking and supports memory formation. Sci. Signal. 14(670), 19–53.
Schellekens H., De Francesco P.N., Kandil D., Theeuwes W.F., McCarthy T., Oeffelen W.E., Cryan J.F. (2015) Ghrelin’s orexigenic effect is modulated via a serotonin 2C receptor interaction. ACS Chem. Neurosci. 6(7), 1186–1197.
Srisai D., Yin T.C., Lee A.A., Rouault A.A.J., Pearson N.A., Grobe J.L., Sebag J.A. (2017) MRAP2 regulates ghrelin receptor signaling and hunger sensing. Nat. Commun. 8(1), 713.
Ge X., Yang H., Bednarek M.A., Galon-Tilleman H., Chen P., Chen M., Kaplan D.D. (2018) LEAP2 is an endogenous antagonist of the ghrelin receptor. Cell Metab. 27(2), 461–469.
Mani B.K., Puzziferri N., He Z., Rodriguez J.A, Osborne-Lawrence S., Metzger N.P., Chhina N., Gaylinn B., Thorner M.O., Thomas E.L., Bell J.D., Williams K.W., Goldstone A.P., Zigman J.M. (2019) LEAP2 changes with body mass and food intake in humans and mice. J. Clin. Invest. 129(9), 3909–3923.
M’Kadmi C., Cabral A., Barrile F., Giribaldi J., Cantel S., Damian M., Fehrentz J.A. (2018) N-terminal liver-expressed antimicrobial peptide 2 (LEAP2) region exhibits inverse agonist activity toward the ghrelin receptor. J. Med. Chem. 62, 965–973.
Wang J.H., Li H.Z., Shao X.X., Nie W.H., Liu Y.L., Xu Z.G., Guo Z.Y. (2019) Identifying the binding mechanism of LEAP2 to receptor GHSR1a. FEBS J. 286, 1332–1345.
Eom J., Hong A., Kang Y.H., Yoo H.J., Chang E.J., Kang S.W., Song Y. (2014) Molecular cloning, regulation, and functional analysis of two GHS-R genes in zebrafish. Exp. Cell. Res. 326(1), 10–21.
Cai W., Yuan X., Yuan Y., Xie S., Gong Y., Su H., Qiao Y. (2015) Sequence, genomic organization and expression of ghrelin receptor in grass carp, Ctenopharyngodon idellus. Comp. Biochem. Physiol. A Mol. Integr. Physiol. 179, 54–61.
Kitazawa T., Nakamura T., Saeki A., Teraoka H., Hiraga T., Kaiya H. (2011) Molecular identification of ghrelin receptor (GHS-R1a) and its functional role in the gastrointestinal tract of the guinea-pig. Peptides. 32(9), 1876–1886.
Mitchell V., Bouret S., Beauvillain J.C., Schilling A., Perret M., Kordon C., Epelbaum J. (2001) Comparative distribution of mRNA encoding the growth hormone secretagogue-receptor (GHS-R) in Microcebus murinus (Primate, lemurian) and rat forebrain and pituitary. J. Comp. Neurol. 429(3), 469–489.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


