Молекулярная биология, 2021, T. 55, № 5, стр. 870-880
Аннексин A8 регулирует пролиферацию клеток немелкоклеточного рака легкого человека линии A549 за счет регуляции сигнального пути EGFR-Akt-mTOR
G.-Z. Zhou a, *, Y.-H. Sun a, Y.-Y. Shi a, Q. Zhang b, L. Zhang a, L.-Q. Cui a, G.-C. Sun c
a College of Bioengineering, Henan University of Technology
450001 Zhengzhou, China
b Henan Academy of Fishery Sciences
450044 Zhengzhou, China
c College of Chemistry and Chemical Engineering, Henan University of Technology
450001 Zhengzhou, China
* E-mail: gzzhou@163.com
Поступила в редакцию 21.10.2020
После доработки 27.01.2021
Принята к публикации 01.02.2021
Аннотация
Аннексин A8 (ANXA8), входящий в состав семейства аннексинов, участвует в регуляции многих процессов в раковых клетках, включая пролиферацию, метастазирование и воспаление. Однако роль ANXA8 в развитии рака легкого в настоящее время недостаточно изучена. Ранее по данным транскриптомного анализа мы установили пониженную экспрессию мРНК ANXA8 при обработке клеток немелкоклеточного рака легкого человека линии A549 аналогом куркумина (MHMD). Теперь, используя количественную ПЦР с обратной транскрипцией (ОТ-ПЦР) и иммуноблотинг, мы продолжили исследование экспрессии ANXA8 в клетках A549 и сравнили ее с экспрессией в клетках нормального легочного эпителия человека (линия BE-AS-2B). Индукция сверхэкспрессии ANXA8 с помощью плазмиды pEGFP-ANXA8 способствовала пролиферации и миграции клеток A549. Более того, в клетках со сверхэкспрессией ANXA8 зарегистрировано повышенное содержание циклина E1 ‒ белка клеточного цикла. Нокдаун ANXA8 с помощью РНК-интерференции приводил к снижению жизнеспособности клеток A549 и ограничению их миграционной подвижности. Экспрессия основных участников сигнального пути рецептора эпидермального фактора роста (EGFR), таких как PI3K, Akt, mTOR, p70S6K и 4EBP1, также изменялась при нокдауне или сверхэкспрессии ANXA8 в клетках A549, что подтверждает участие ANXA8 в активации сигнального пути EGFR/Akt/mTOR. Результаты проведенного исследования дают основания для дальнейшего изучения функциональной роли ANXA8 в развитии рака легкого.
Аннексины представляют собой семейство белков, вовлеченных в транспорт везикул, пролиферацию клеток, апоптоз и другие клеточные процессы [1]. Суперсемейство аннексинов позвоночных состоит из 12 высокогомологичных белков, вовлеченных в регуляцию множества физиологических и патофизиологических процессов. Ранее продемонстрирован вклад некоторых аннексинов в пролиферацию, инвазию и метастазирование различных видов злокачественых опухолей. Например, Sun и др. [2] обнаружили, что аннексин А10 (ANXA10) способствует эпителиально-мезенхимальному переходу и метастазированию внепеченочной холангиокарциномы за счет активации сигнального пути PLA2G4A/PGE2/STAT3. Также повышенная экспрессия ANXA2 оказывала влияние на пролиферацию, инвазию и миграцию клеток колоректального рака за счет активации STAT3 [3], тогда как подавление экспрессии ANXA2 блокировало пролиферацию и метастазирование гепатомы [4]. Lima и др. [5] установили, что ANXA1, который регулируется глюкокортикоидами и обладает противовоспалительным действием, по-видимому, является основной мишенью лекарств, индуцирующих образование cAMP и cAMP-миметиков. Недавно показано, что ANXA1 может быть геном-мишенью гонадолиберина в гонадотропных клетках LβT2 [6]. О разнообразии функциональных свойств аннексинов можно судить и по активными исследованиям ANXA6 и ANXA7 [7‒9].
ANXA8, будучи важным членом семейства аннексинов, оказывает влияние на несколько внутриклеточных сигнальных путей. Так, Jiang и др. [10] обнаружили, что ANXA8 регулирует гомеостаз эндометрия свиней через сигнальный путь Akt. Он также регулирует фенотип клеток пигментного эпителия сетчатки [11], а Heitzig и др. [12] подтвердили, что ANXA8 способствует VEGF-A-индуцируемому разрастанию кровеносных сосудов в эндотелиальных клетках. Ряд авторов указывает на возможность использования ANXA8 как прогностического маркера при развитии рака яичников [13] и метастазировании плоскоклеточного рака полости рта в лимфатические узлы [14]. Также обнаружена эктопическая экспрессия ANXA8 при раке поджелудочной железы [15].
Ранее в исследованиях, посвященных влиянию синтетического аналога куркумина (MHDM) на транскриптом клеток немелкоклеточного рака легкого человека линии A549, мы обнаружили, что обработка MHDM индуцировала апоптоз клеток A549 и снижение экспрессии гена ANXA8 [16, 17]. Однако детально роль ANXA8 в регуляции деления и миграции клеток A549 мы не исследовали. Теперь мы подтвердили разницу в экспрессии ANXA8 между клетками A549 и клетками нормального человеческого эпителия линии BE-AS-2B. Кроме того, используя технологии подавления или индукции экспрессии гена ANXA8, мы изучили влияние этого аннексина на фенотип клеток A549 (включая их жизнеспособность, скорость миграции и содержание факторов, регулирующих клеточный цикл).
Известно также, что ANXA8 может активировать сигнальный путь рецептора эпидермального фактора роста (EGFR). Будучи участником семейства мембранных тирозинкиназ и рецепторов факторов роста, EGFR и его лиганды участвуют в развитии многих видов рака, в особенности сóлидных опухолей [18]. В связи с этим их считают потенциальными мишенями для онкотерапии. Связывание лиганда с EGFR приводит к образованию гомо- и гетеродимеров рецептора с последующей активацией нижележащих сигнальных путей, таких как PI3K/Akt, участвующих в пролиферации, выживании и миграции клеток [19]. Интересно, что ранее выявлена способность ANXA8 активировать фосфорилирование белка Akt [10]. Исходя из этого, мы исследовали влияние сайленсинга и сверхэкспрессии ANXA8 на активацию сигнального пути EGFR в клетках A549. Получены результаты, на основании которых можно говорить о важной роли ANXA8 в пролиферации клеток A549 через активацию сигнального пути EGFR/Akt/mTOR. Эти знания позволяют нам приблизиться к пониманию механизма деления клеток рака легкого, а также задуматься о прогностическом и терапевтическом потенциале ANXA8.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клеточные линии и реагенты. MHDM был любезно предоставлен Dr. Gangchun Sun (College of Chemistry and Chemical Engineering, Henan University of Technology, Zhengzhou, Китай) [17]. Первичные поликлональные антитела: мышиные против ANXA8, кроличьи против Akt и фосфорилированного (p) Akt ‒ были приобретены у компании “Sigma Aldrich” (“Merck”, Германия); моноклональные кроличьи антитела против mTOR, p-mTOR, EGFR, p-EGFR, PI3K и p-PI3K, а также мышиные моноклональные антитела против циклина Е1 и поликлональные кроличьи антитела против p70S6K, p-p70S6K, 4EBP1 и p-4EBP1 ‒ у “Cell Signaling Technology, Inc.” (США). Поли-клональные антитела к GAPDH и тубулину приобретены соответственно у “Proteintech Group, Inc.” и “Abbkine Scientific Co., Ltd.” (Китай).
Фрагмент гена ANXA8 синтезирован в компании “Sangon Biotech” (Китай), а малые интерферирующие РНК (siРНК), специфичные к мРНК ANXA8, ‒ в компании “Shanghai GenePharma” (Китай).
Клетки линии A549 немелкоклеточного рака легкого человека культивировали в среде RPMI-1640 (“Gibco”, “Thermo Fisher Scientific”, США) с добавлением 10% фетальной сыворотки крупного рогатого скота (FBS; “Zhengjiang Tianhang Biotechnology”, Китай). Клетки линии BE-AS-2B нормального бронхиального эпителия человека культивировали в среде DMEM (“Beijing Solarbio Science and Technology”, Китай). Все клетки культивировали при 37°C в инкубаторе с 5% CO2.
Конструирование рекомбинантных плазмид и трансфекция. Рекомбинантный эукариотический вектор pEGFP-ANXA8 сконструирован путем клонирования в векторе pEGFP-N3 (“Clontech Laboratories, Inc.”, США) полной открытой рамки считывания ANXA8, используя соответствующие праймеры (прямой 5'-GGCTCGAGAGATGGCCTG-3' и обратный 5'-TCGAATTCTCTGGGGTCGC-3') согласно стандартному протоколу. ПЦР ставили по следующей программе: изначальное плавление 94°C в течение 5 мин, затем 35 циклов: 30 с при 94°C, 30 с при 57°C и 30 с при 72°C; в завершение проводили элонгацию при 72°C в течение 7 мин. Продукты ПЦР анализировали с помощью электрофореза в агарозном геле и визуализировали с помощью бромистого этидия. Плазмиду pEGFP-ANXA8 и siРНК к ANXA8 вводили в клетки A549 с помощью Lipofectamine 2000 (“Thermo Fisher Scientific”) согласно протоколу производителя.
MTT-тест. После трансфекции плазмидой pEGFP-ANXA8 или siРНК клетки линии A549 снимали с помощью трипсина и рассаживали в 96-луночные планшеты для анализа жизнеспособности с помощью MTT-теста. Вкратце, 20 мкл MTT (5 мг/мл, “GEN-VIEW Scientific Inc.”, Китай) добавляли к клеткам и инкубировали в темноте 4 ч при 37°C. Далее культуральную среду полностью удаляли и добавляли к клеткам 100 мкл DMSO. Оптическую плотность при 490 нм измеряли на планшетном ридере (“BioTek Instruments”, США). Выживаемость клеток считали по следующей формуле: Жизнеспособность (%) = = [A490(образца)/A490(контроля)] × 100 (n = 5).
Количественная ПЦР с обратной транскрипцией (ОТ-ПЦР). Тотальную РНК из клеток A549, трансфицированных плазмидой pEGFP-ANXA8, и контрольных клеток выделяли по протоколу производителя (“Sigma-Aldrich”). После получения кДНК на основе выделенной РНК (“Vazyme Biotech”, Китай) проводили количественную ПЦР (“Bio-Rad Laboratories”, США), используя праймеры на ген ANXA8 (прямой праймер: 5'-TGGGACCCTGATAAGAAACAT-3', обратный праймер: 5'-TCCTGGAGACTCTGGCTTCAT-3') по следующей программе: 95°C в течение 5 мин, далее 40 циклов: 30 с при 95°C, 30 с при 57°C и 30 с при 72°C. Поглощение SYBR Green I в лунках измеряли в конце каждого цикла. Качество ПЦР-продуктов оценивали по кривой плавления при температурах 60‒95°C. В качестве эндогенного контроля использовали GAPDH (прямой праймер: 5'-ACCCACTCCTCCACCTTTG-3' и обратный праймер: 5'-CTCTTGTGCTCTTGCTGGG-3'). Уровень экспрессии гена ANXA8 считали относительно GAPDH по методу 2–ΔΔCq [20]. Образцы анализировали в не менее чем в трех повторах.
Иммуноблотинг. Клетки собирали и лизировали для последующего выделения белка. Концентрацию белка определяли на микропланшетном спектрофотометре (“BioTek Instruments”) по методу Брэдфорда [21]. Далее белки разделяли с помощью электрофореза в SDS-ПААГ и переносили на PVDF-мембрану (“Sangon Biotech”). Сначала мембраны инкубировали с первичными антителами, описанными выше. После трехкратной промывки в буфере TBS: 0.05 М Трис-HCl (pH 7.6), 0.15 M NaCl ‒ с добавлением Tween 20 (TBST) мембраны инкубировали со вторичными антителами: козьими антикроличьими (“Beijing Solarbio Science & Technology Co., Ltd.”, Китай) или антимышиными (“Abbkine Scientific Co., Ltd.”), ‒ конъюгированными с пероксидазой хрена, и затем проявляли с использованием набора Enhanced Chemiluminescence Substrate kit (“Sangon Biotech”). Для денситометрического анализа иммуноблотинга использовали программу ImageJ (1.44p) (https://imagej.nih.gov/ij/).
Иммунофлуоресцентный анализ. Клетки A549 и BE-AS-2B высевали на 6-луночные планшеты (3 × 105 клеток/лунка). Клетки A549 обрабатывали MHDM (4 мкМ) в течение 48 ч. После фиксации 4%-ным параформальдегидом в течение 10 мин при комнатной температуре клетки инкубировали с антителами к ANXA8 в течение 18 ч при 4°C. После трехкратной отмывки с помощью TBST клетки инкубировали со вторичными антителами, конъюгированными с FITC, в течение 4 ч. Ядра клеток окрашивали Hoechst 33 342 в течение 15 мин. После тщательной отмывки с TBST клетки помещали в 50%-ный раствор глицерина в PBS и анализировали на флуоресцентном микроскопе Nikon TE2000-U (“Nikon Corporation”, Япония).
Анализ миграции клеток. После трансфекции клеток A549 в 6-луночном планшете плазмидой pEGFP-ANXA8 (600 нг/лунка) или siРНК к мРНК ANXA8 их высевали в верхнюю камеру системы Cepeda Transwell (“Corning”, США) и оценивали скорость миграции в нижнюю камеру со средой, содержащей 10% FBS. Через 24 и 48 ч камеры извлекали, среду из лунок верхней камеры удаляли и дважды промывали клетки PBS, после чего их фиксировали метанолом в течение 30 мин. В это время нижнюю камеру высушивали при комнатной температуре. Далее в лунки добавляли 600 мкл 0.1%-ного раствора кристаллического фиолетового на 15 мин, после чего планшет промывали и оценивали миграцию клеток с помощью микроскопа Nikon Eclipse TS100 (“Nikon Corporation”).
Статистический анализ. Статистическую обработку данных проводили с помощью теста Даннета (n ≥ 3) и представляли в виде среднего ± стандартная ошибка среднего (SEM). Анализ проводили с помощью программы IBM SPSS Statistics 22 (“IBM Corp.”). Значения *P < 0.05, **P < 0.01 и ***P < 0.001 отражают степень статистически достоверных различий.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Изучение экспрессии ANXA8 в клетках A549
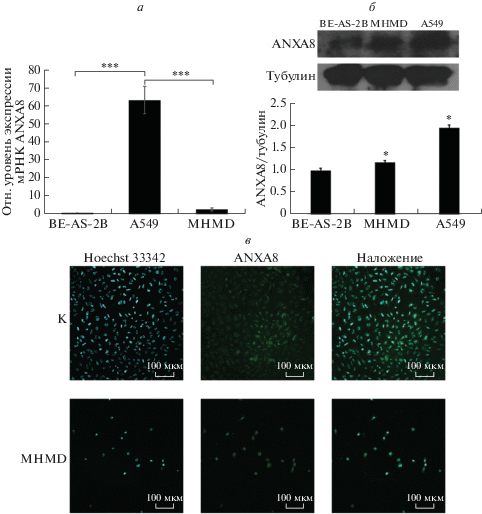
Ранее на основании данных транскриптомного анализа нами был сделан вывод о повышенной экспрессии ANXA8 в клетках A549, обработанных MHMD, по сравнению с контрольными клетками [17]. По результатам проведенного нами теперь количественного анализа методом ПЦР в реальном времени содержание мРНК ANXA8 в клетках A549 оказалось в 60 раз больше, чем в клетках линии BE-AS-2B нормального легкого (рис. 1a), тогда как обработка MHMD (4 мкМ) через 48 ч приводила к снижению экспрессии гена ANXA8 в клетках A549. В этой группе уровень экспрессии был всего в три раза выше по сравнению с клетками BE-AS-2B. Более того, по данным иммуноблотинга содержание белка ANXA8 было также значительно выше в клетках A549 по сравнению с клетками BE-AS-2B (рис. 1б). По результатам иммунофлуоресцентного анализа, после инкубации с MHDM в клетках A549 снижался флуоресцентный сигнал от ANXA8 (рис. 1в), что вполне соответствовало данным транскриптомного анализа. Учитывая предыдущие исследования, в которых показана способность MHMD блокировать пролиферацию клеток A549 [16], мы предположили, что ингибирующий эффект MHDM на деление раковых клеток может быть связан со снижением уровня экспрессии ANXA8.
Рис. 1.
Экспрессия ANXA8. а ‒ Анализ экспрессии гена ANXA8 в нормальных клетках легкого (BE-AS-2B) по сравнению с раковыми клетками линии A549 в присутствии MHDM (4 мкМ) или без него. Наибольший уровень экспрессии наблюдался в клетках A549. б ‒ Анализ содержания белка ANXA8 в вышеуказанных культурах клеток методом иммуноблотинга (вверху). Выявлен достоверно повышенный уровень ANXA8 в клетках линии A549 по сравнению с обработанными MHDM и клетками BE-AS-2B (внизу). в ‒ Иммунофлуоресцентный анализ клеток A549 обработанных (MHDM) и не обработанных (К) MHDM. Число позитивных сигналов снижено в MHDM-обработанных клетках. *P < 0.05, ***P < 0.001.
Биологический эффект сверхэкспрессии ANXA8 на клетки A549
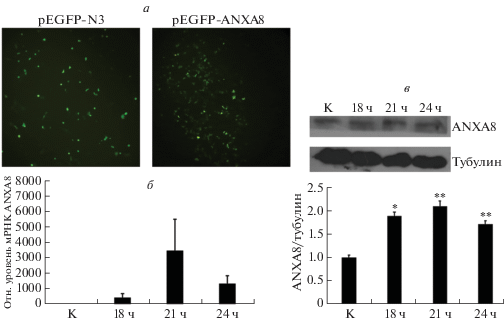
Эффективность сверхэкспрессии ANXA8 при трансфекции клеток A549 плазмидой pEGFP-ANXA8 подтверждена с помощью иммунофлуоресцентного анализа. В монослое клеток A549 наблюдали большое число зеленых, ANXA8-позитивных, сигналов (рис. 2а). Эффективность трансфекции составила 70% ‒ уровень, достаточный для проведения анализа. Экспрессию гена ANXA8 оценивали количественной ОТ-ПЦР. По сравнению с контрольными клетками для транфицированных клеток выявлена повышенная экспрессия ANXA8 в течение 24 ч, с пиком через 21 ч (рис. 2б). Кроме того, выделенные из клеток, трансфицированных плазмидой pEGFP-ANXA8, белки проанализировали методом иммуноблотинга и подтвердили в них избыточную экспрессию белка ANXA8 (рис. 2в).
Рис. 2.
Сверхэкспрессия белка ANXA8 в клетках линии A549, трансфицированных плазмидой pEGFP-ANXA8. а ‒ Иммунофлуоресцентное окрашивание клеток на белок ANXA8 (pEGFP-N3 – контрольная плазмида). б ‒ Экспрессию гена ANXA8 в течение 24 ч после трансфекции клеток А549 оценивали по уровню мРНК ANXA8 методом количественной ОТ-ПЦР. в ‒ Иммуноблотинг и полуколичественный анализ белка ANXA8 в препаратах трансфицированных клеток в указанных временных точках. *P < 0.05, **P < 0.01.
Далее мы приступили к исследованию влияния избыточной экспрессии ANXA8 на биологические процессы в клетках линии A549. По результатам MTT-теста выявлена повышенная выживаемость трансфицированных pEGFP-ANXA8 клеток по сравнению с контролем (рис. 3а), из чего можно предположить, что сверхэкспрессия ANXA8 усиливает пролиферацию клеток A549. С целью оценить влияние сверхэкспрессии ANXA8 на миграционную активность клеток A549 мы провели эксперимент с использованием системы Transwell. Установлено, что скорость миграции трансфицированных клеток повышена относительно контрольных (рис. 3б), так что сверхэкспрессия ANXA8 усиливает миграцию раковых клеток.
Рис. 3.
Влияние трансфекции клеток линии A549 плазмидой pEGFP-ANXA8 на их пролиферацию и миграцию. В качестве контроля использовали вектор pEGFP-N3. а ‒ Анализ выживаемости клеток в указанные временные точки с помощью МТТ-теста. У pEGFP-ANXA8-трансфицированных клеток повышена жизнеспособность по сравнению с контрольной группой. б ‒ ANXA8 повышает миграционную способность клеток A549 в тесте с использованием системы Transwell. Показаны результаты анализа вестерн-блот экспрессии циклина E1 в клетках A549, трансфицированных pEGFP-N3 (в) или pEGFP-ANXA8 (г). Выявлено повышенное содержание циклина E1 в группе pEGFP-ANXA8.
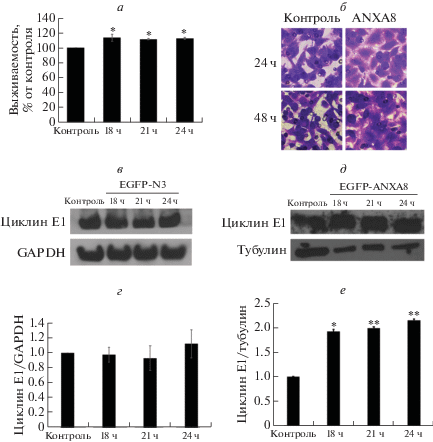
Исследовано влияние сверхэкспрессии ANXA8 на состояние клеточного цикла. Нарушения в клеточном цикле характерны для многих видов злокачественных опухолей и считаются важным маркером развития опухоли. Наиболее часто в раковых клетках регистрируют повышенные уровни циклинов D1 и E1. Мы обнаружили небольшое повышение уровня экспрессии циклина E1 в клетках линии A549, трансфицированных плазмидой pEGFP-ANXA8, по сравнению с трансфицированными контрольной плазмидой pEGFP-N3 (рис. 3в, г). По-видимому, ANXA8 может быть вовлечен в развитие немелкоклеточного рака легкого.
Нокдаун ANXA8 приводит к снижению пролиферации и миграции клеток A549
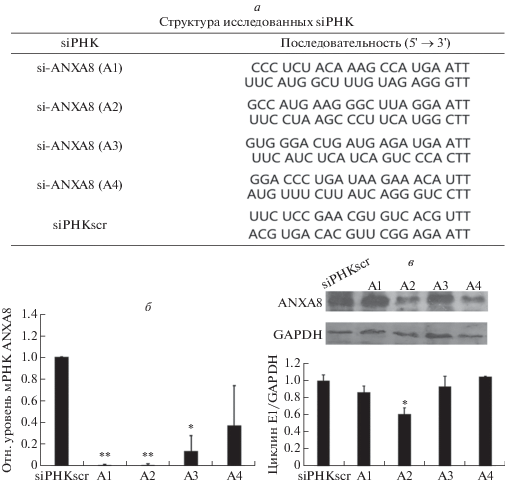
Убедившись, что сверхэкспрессия ANXA8 индуцирует пролиферацию и миграцию клеток линии A549, мы проанализировали влияние сайленсинга экспрессии ANXA8 на эти же клетки. Четыре siРНК (A1, A2, A3 и A4), специфичных к мРНК ANXA8, были сконструированы, синтезированы и использованы для трансфекции клеток линии A549 (рис. 4а). Из трансфицированных клеток выделили тотальную РНК и белки, проанализировали экспрессию мРНК и белка ANXA8. По результатам количественной ОТ-ПЦР A1 и A2 оказывали наибольший интерферирующий эффект на мРНК ANXA8 (рис. 4б), а на основании иммуноблотинга последовательность A2 была выбрана как наиболее оптимальная для подавления экспрессии ANXA8 в клетках линии A549 (рис. 4в) при сравнении с другими тремя siРНК.
Рис. 4.
Скрининг siРНК к гену ANXA8. а ‒ Последовательности четырех siРНК к ANXA8 (А1, А2, А3 и А4), а также скремблированной (siРНКscr), используемой в качестве контроля. б ‒ Влияние siРНК на ингибирование экспрессии ANXA8 через 48 ч после трансфекции по результатам количественной ОТ-ПЦР. Уровень экспрессии мРНК ANXA8 нормирован на экспрессию мРНК GAPDH. Наибольший интерферирующий эффект выявлен для siРНК А1 и А2. в ‒ Иммуноблотинг и полуколичественный анализ содержания белка ANXA8 в клетках A549, трансфицированных siРНК. Наибольший нокдаун-эффект выявлен для siРНК А2.
Через 48 ч после успешной трансфекции клеток A549 (рис. 5а) проведен МТТ-тест и выявлено понижение жизнеспособности клеток, трансфицированных siРНК А2, на 40% по сравнению с контрольной группой (рис. 5б). По-видимому, сайленсинг ANXA8 до определенной степени подавляет пролиферацию клеток A549. Также, используя систему Transwell, мы проанализировали влияние siРНК А2 на способность клеток А549 к миграции и выявили снижение скорости миграции трансфицированных клеток (рис. 5в). Таким образом, показано, что сайленсинг ANXA8 ингибирует миграцию клеток линии A549.
Рис. 5.
Влияние сайленсинга ANXA8 на пролиферацию и миграцию клеток линии A549. а ‒ Экспрессия белка ANXA8 по результатам иммуноблотинга снижена в клетках А549, трансфицированных siРНК А2 (si-ANXA8), по сравнению с трансфицированными контрольной siРНК (siРНКscr). б ‒ Анализ жизнеспособности клеток A549 через 48 ч после трансфекции. В клетках, трансфицированных siРНК А2 число живых клеток снижено по сравнению с трансфицированными siРНКscr и нетрансфицированными клетками (К). в ‒ Миграционную способность клеток оценивали в системе Transwell: через 24 и 48 ч после трансфекции siРНК А2 число мигрировавших в нижнюю камеру клеток значительно меньше, чем клеток, трансфицированных siРНКscr.
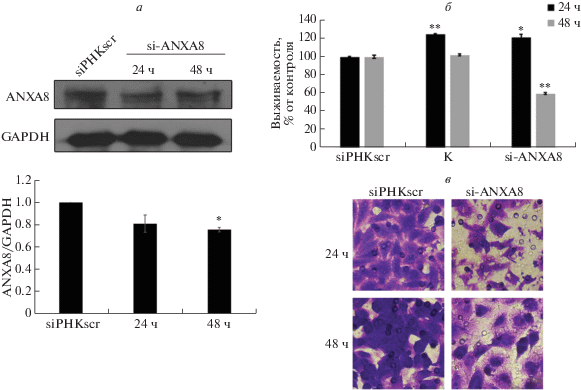
Влияние экспрессии ANXA8 на активацию сигнального пути EGFR
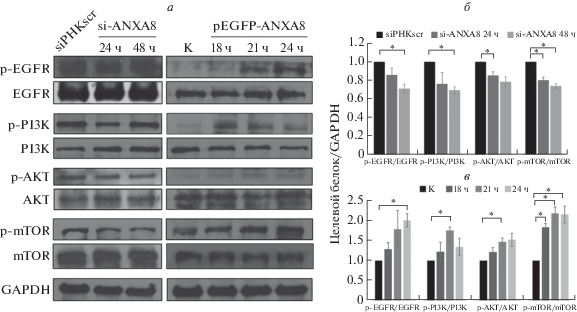
Ранее сообщалось о ключевой роли сигнального пути EGFR в поддержании неконтролируемого деления раковых клеток и прогрессии злокачественных опухолей [22]. Основываясь на обнаруженных нами эффектах ANXA8 на пролиферацию клеток линии A549, мы проверили возможную взаимосвязь между белком ANXA8 и сигнальным путем EGFR. Выявлено, что через 24 и 48 ч после трансфекции siРНК к ANXA8 в клетках линии A549 снижен уровень как EGFR, так и фосфорилирования нижележащих по сигнальному пути факторов: PI3K, Akt, mTOR, 4EBP1 и p70S6K (рис. 6). Кроме того, через 18, 21 и 24 ч после трансфекции клеток A549 проанализировано содержание ключевых белков сигнального пути EGFR. Установлено, что содержание EGFR, Akt и mTOR повышено в клетках А549, трансфицированных pEGFP-ANXA8 (рис. 6а, в), но не siРНК А2 к ANXA8 (рис. 6а, б), что подтверждает регуляторную роль ANXA8 в активации сигнального пути EGFR/Akt/mTOR в клетках линии A549.
Рис. 6.
ANXA8 регулирует сигнальный путь EGFR/Akt/mTOR в клетках А549. Клетки трансфицировали siРНК А2 или плазмидой pEGFP-ANXA8, после чего представленность факторов сигнального пути EGFR/Akt/mTOR анализировали иммуноблотингом (а). Статистически обработанные данные иммуноблотинга на клетках, трансфицированных siРНК А2 (б) или плазмидой pEGFP-ANXA8 (в). В качестве внутреннего контроля использовали GAPDH.
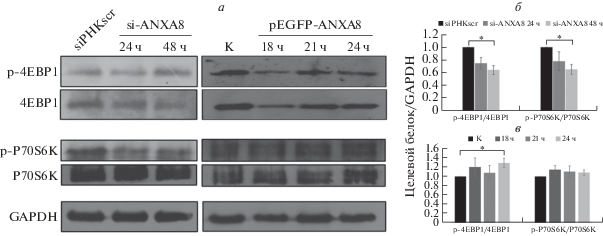
Кроме того, мы оценили экспрессию факторов нижележащего каскада сигнального пути mTOR (p70S6K и 4EBP1) в клетках, трансфицированных siРНК или плазмидой pEGFP-ANXA8. Установлено, что сайленсинг ANXA8 индуцировал снижение уровня фосфорилированных форм p-p70S6K и p-4EBP1 (рис. 7а, б), тогда как при сверхэкспрессии ANXA8 их уровень повышался (рис. 7а, в), но не в трансфицированных siРНК А2 клетках. Таким образом, ANXA8, по-видимому, участвует в регуляции сигнального пути mTOR/p70S6K/ 4EBP1 в клетках линии А549 и может быть вовлечен в пролиферацию этих клеток.
Рис. 7.
Анализ содержания белков p70S6K и 4EBP1 и их фосфорилированных форм методом иммуноблотинга в зависимости от экспрессии гена ANXA8 в клетках A549. ANXA8 регулирует экспрессию этих двух факторов из нижележащего каскада сигнального пути mTOR (а). Статистически обработанные данные иммуноблотинга на клетках, трансфицированных siРНК А2 (б) или плазмидой pEGFP-ANXA8 (в). В качестве внутреннего контроля использовали GAPDH.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Будучи важным членом семейства аннексинов, ANXA8 характеризуется разным уровнем экспрессии в здоровой ткани и в опухолях и участвует в пролиферации, дифференцировке, метастазировании и лекарственной устойчивости раковых клеток. Однако, насколько нам известно, влияние ANXA8 на биологические процессы, вовлеченные в развитие рака легкого, ранее не исследовались. В этой работе мы исследовали функцию ANXA8 в клетках линии A549 немелкоклеточного рака легкого человека, основываясь на ранее полученных нами данных транскриптомного анализа этих клеток. Результаты количественной ОТ-ПЦР и иммуноблотинга подтвердили ранее обнаруженный повышенный уровень экспрессии ANXA8 в клетках А549 по сравнению с нормальными клетками бронхиального эпителия [17].
Как показано в проведенном нами исследовании, ANXA8 может быть вовлечен в регуляцию пролиферации и миграции клеток А549. Сверхэкспрессия ANXA8 в клетках А549, трансфицированных плазмидой pEGFP-ANXA8, сопровождалась увеличением их скорости деления и миграции, тогда как сайленсинг ANXA8 с помощью технологии РНК-интерференции снижал их выживаемость и миграционную активность. Эти результаты согласуются с ранее опубликованными эффектами ANXA8 на клетки эндометрия свиней и рака поджелудочной железы [10, 15]. Jiang с соавт. [10] трансфицировали клетки эндометрия плазмидой pcDNA3.1-ANXA8 и siРНК, специфичной к мРНК ANXA8, и установили, что сверхэкспрессия ANXA8 сопровождается повышением экспресии ядерного антигена пролиферирующих клеток (PCNA) и облегчает переход клеток в S-фазу, что может ускорять деление клеток эндометрия [10]. На основании этих результатов авторы предположили вовлеченность ANXA8 в регуляцию клеточного цикла в раковых клетках. По данным проведенного нами иммуноблотинга, трансфекция клеток A549 плазмидой pEGFP-ANXA8 сопровождалась повышением уровня циклина Е1 (одного из участников клеточного цикла). Предполагается, что циклин E1 способствует пролиферации клеток A549. Но конкретную роль ANXA8 в этом процессе еще предстоит выяснить.
Ранее Goebeler и соавт. [23] обнаружили, что ANXA8 вовлечен в лизосомную рециркуляцию комплекса EGFR‒лиганд, а обеднение по ANXA8 приводит к более продолжительной активации сигнального пути EGFR на стадии связывания с лигандом. В этом исследовании мы продолжили изучение взаимосвязи между ANXA8 и EGFR на примере раковых клеток линии A549. Из литературы известно, что EGF индуцирует активность множества сигнальных каскадов, включая путь PI3K/Akt [24]. Активация PI3K происходит непосредственно за счет связывания с фосфорилированными по тирозину белками семейства EGFR [25]. Активированная PI3K может далее фосфорилировать PI(4)P и PI(4,5)P2, превращая их в PI(3,4)P2 и PI(3,4,5)P3 соответственно, которые далее привлекают фосфоинозитидзависимую киназу-1 (PDK1) и киназы семейства Akt к плазматической мембране, что приводит к их активации. Такой путь передачи сигнала, инициируемый PI3K, называется сигнальным путем PI3K/PDK1/Akt. Нами проанализированы изменения в этом сигнальном пути, вызванные сайленсингом или сверхэкспрессией гена ANXA8, и установлено, что ANXA8 может активировать сигнальный путь EGFR/Akt и позитивно регулировать экспрессию EGFR, PI3K и Akt в клетках линии A549.
Белок mTOR, нижележащая в сигнальном пути PI3K/Akt серин/треониновая киназа, часто активирован при различных видах неоплазий. Akt и mTOR играют роль “переключателей” в раковых клетках, контролируя клеточный цикл, что имеет большое значение при изучении ангиогенеза в опухолях [26]. В этом исследовании мы проанализировали уровень экспрессии mTOR и регулируемых этой киназой факторов: p70S6K и 4EBP1 ‒ в клетках А549, трансфицированных siРНК к мРНК ANXA8 или плазмидой pEGFP-ANXA8. Выявлена зависимость активации сигнального пути mTOR/p70S6K/4EBP1 от экспрессии ANXA8. Фактически фосфорилирование p70S6K и 4EBP1 необходимо для рекрутирования рибосом на мРНК на этапе инициации трансляции. Ингибирование mTOR блокирует инициацию трансляции и прогрессию клеточного цикла из-за снижения фосфорилирования p70S6K и 4EBP1, что влияет на деление клеток [27]. Нами показано, что экспрессия ANXA8 влияет на уровень фосфорилирования p70S6K и 4EBP1 и тем самым на пролиферацию и миграцию клеток линии A549.
В результате проведенного исследования показано, что ANXA8 может эффективно активировать сигнальный путь EGFR/Akt/mTOR, который в свою очередь оказывает влияние на пролиферацию и миграцию клеток линии A549 немелкоклеточного рака легкого.
Работа поддержана грантами на фундаментальные исследования от Хэнаньского технологического университета (the Fundamental Research Funds for the Henan Provincial Colleges and Universities in Henan University of Technology; грант № 2018RCJH17), Национального фонда естественных наук Китая (the National Natural Science Foundation of China; грант № U1704112) и Хэнаньского плана по развитию науки и технологий Китая (Science and Technology Planning Project of Henan Province; грант № 182102310270).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии финансовых/коммерческих конфликтов интересов, имеющих отношение к этой статье.
GZZ спланировал эксперименты и написал манускрипт. YHS и YYS поставили эксперименты и проанализировали данные. LQC, QZ и GCS участвовали в обсуждении данных и в редактировании манускрипта. Все авторы ознакомились и подтвердили финальную версию манускрипта.
Список литературы
Scholer S., Pajonczyk D., Rescher U. (2018) Annexins in translational research: hidden treasures to be found. Int. J. Mol. Sci. 19(6), 1781.
Sun R., Liu Z., Qiu B., Chen T., Li Z., Zhang X., Xu Y., Zhang Z. (2019) Annexin10 promotes extrahepatic cholangiocarcinoma metastasis by facilitating EMT via PLA2G4A/PGE2/STAT3 pathway. EBioMedicine. 47, 142‒155.
Xiu D., Liu L., Qiao F., Yang H., Cui L., Liu G. (2016) Annexin A2 coordinates STAT3 to regulate the invasion and migration of colorectal cancer cells in vitro. Gastroent. Res. Pract. 31, 1‒10.
Dong Z., Yao M., Zhang H., Wang L., Huang H., Yan M., Wu W., Yao D. (2014) Inhibition of annexin A2 gene transcription is a promising molecular target for hepatoma cell proliferation and metastasis. Oncol. Lett. 7, 28‒34.
Lima K.M., Vago J.P., Caux T.R., Negreiros-Lima G.L., Sugimoto M.A., Tavares L.P., Arribada R.G., Carmo A.A.F., Galvao I., Costa B.R.C., Soriani F.M., Pinho V., Solito E., Perretti M., Teixeira M.M., Sousa L.P. (2017) The resolution of acute inflammation induced by cyclic AMP is dependent on annexin A1. J. Biol. Chem. 292, 13758‒13773.
Fungbun N., Tungmahasuk D., Terashima R., Kurusu S., Kawaminami M. (2018) Annexin A1 is a novel target gene of gonadotropin-releasing hormone in LβT2 gonadotrope cells. J. Vet. Med. Sci. 80, 116‒124.
Seidel S., Neymeyer H., Kahl T., Röschel T., Mutig K., Flower R., Schnermann J., Bachmann S., Paliege A. (2012) Annexin A1 modulates macula densa function by inhibiting cyclooxygenase 2. Am. J. Physiol. Renal. Physiol. 303, F845‒F854.
Wang X., Zhang S., Zhang J., Lam E., Liu X., Sun J., Feng L., Lu H., Yu J., Jin H. (2013) Annexin A6 is down-regulated through promoter methylation in gastric cancer. Am. J. Transl. Res. 5, 555‒562.
Yuan H.F., Li Y., Zhao Q., Fan L.Q., Tan B.B., Ye W.H. (2014) Expression of annexin A7 and its clinical signi-ficance in differentiation and metastasis of gastric carcinoma. Int. J. Clin. Exp. Pathol. 7, 6567‒6574.
Jiang X., Xue S., Kang T., Liu H., Ren H., Hua R., Ni D., Lei M. (2019) Annexin A8 (ANXA8) regulates prolife-ration of porcine endometrial cells via Akt signaling pathway. Reprod Domest. Anim. 54, 3‒10.
Lueck K., Carr A.F., Stampoulis D., Gerke V., Rescher U., Greenwood J., Moss S.E. (2017) Regulation of retinal pigment epithelial cell phenotype by Annexin A8. Sci. Rep. 7, 4638.
Heitzig N., Brinkmann B.F., Koerdt S.N., Rosso G., Shahin V., Rescher U. (2017) Annexin A8 promotes VEGF-A driven endothelial cell sprouting. Cell Adh. Migr. 11, 275‒287.
Gou R., Zhu L., Zheng M., Guo Q., Hu Y., Li X., Liu J., Lin B. (2019) Annexin A8 can serve as potential prognostic biomarker and therapeutic target for ovarian cancer: based on the comprehensive analysis of Annexins. J. Transl. Med. 17, 275.
Oka R., Nakashiro K., Goda H., Iwamoto K., Toku-zen N., Hamakawa H. (2016) Annexin A8 is a novel molecular marker for detecting lymph node metastasis in oral squamous cell carcinoma. Oncotarget. 7, 4882–4889.
Hata H., Tatemichi M., Nakadate T. (2014) Involvement of annexin A8 in the properties of pancreatic cancer. Mol. Carcinog. 53, 181‒191.
Zhou G.Z, Cao F.K., Du S.W. (2015) The apoptotic pathways in the curcumin analog MHMD-induced lung cancer cell death and the essential role of actin polymerization during apoptosis. Biomed. Pharmacother. 71, 128‒134.
Zhou G.Z., Sun G.C., Zhou Y.H., Wang Q.Q. (2017) Transcriptomic analysis of human non-small lung cancer cells A549 treated by one synthetic curcumin derivative MHMD. Cell. Mol. Biol. 63, 35‒39.
Nicholson R.I., Gee J.M.W., Harper M.E. (2001) EGFR and cancer prognosis. Eur. J. Cancer. 37, 9‒15.
Prenzel N., Fischer O.M., Streit S., Hart S., Ullrich A. (2001) The epidermal growth factor receptor family as a central element for cellular signal transduction and diversification. Endocr. Relat. Cancer. 8, 11‒31.
Pfaffl M.W. (2001) A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res. 29, e45.
Bradford M.M. (1976) A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72, 248‒254.
Seshacharyulu P., Ponnusamy M.P., Haridas D., Jain M., Ganti A.K., Batra S.K. (2012) Targeting the EGFR signaling pathway in cancer therapy. Exp. Opin. Therap. Targets. 16, 15‒31.
Goebeler V., Poeter M., Zeuschner D., Gerke V., Rescher U. (2008) Annexin A8 regulates late endosome organization and function. Mol. Biol. Cell. 19, 5267‒5278.
Navolanic P.M., Seelman L.S., McCubrey J.A. (2003) EGFR family signaling and its association with breast cancer development and resistance to chemotherapy. Inter. J. Oncol. 22, 237‒252.
Ram T.G., Hosick H.L., Ethier S.P. (2000) Heregulin-beta is especially potent in activating phosphatidy-linositol 3-kinase in nontransformed human mammary epithelial cells. J. Cell. Physiol. 183, 301‒313.
Lionello M., Lovato A., Staffieri A., Blandamura S., Turato C., Giacomelli L., Staffieri C., Marioni G. (2014) The EGFR-mTOR pathway and laryngeal cancer angiogenesis. Eur. Arch. Otorhinolaryngol. 271, 757‒764.
Wang C., Yan Y., Hu L., Zhao L., Yang P., Moorhead J.F., Varghese Z., Chen Y.X., Ruan X.Z. (2014) Rapamycin-mediated CD36 translational suppression contributes to alleviation of hepatic steatosis. Biochem. Biophys. Res. Commun. 447, 57‒63.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


