Молекулярная биология, 2021, T. 55, № 5, стр. 858-869
Митоксантрон ингибирует индуцируемые FMLP дегенеративные изменения в нейтрофилах человека
S. G. Ali a, D. Shehwar a, M. R. Alam a, *
a Department of Biochemistry, Quaid-i-Azam University
45320 Islamabad, Pakistan
* E-mail: mralam@qau.edu.pk
Поступила в редакцию 24.10.2020
После доработки 18.12.2020
Принята к публикации 15.01.2021
Аннотация
В борьбе с патогенами нейтрофилы используют различные механизмы, включая дегрануляцию, фагоцитоз и высвобождение внеклеточных нейтрофильных ловушек (NET). Изучено влияние синтетического формил-пептида (FMLP) на нейтрофилы человека in vitro, а также роль митоксантрона (MTX) – фармакологического блокатора митохондриального Ca2+-унипортера (MCU), в изменениях нейтрофилов, вызванных FMLP. Изолированные нейтрофилы и препараты нейтрофилов цельной крови обрабатывали MTX, а затем стимулировали FMLP. Морфологию нейтрофилов и их содержание определяли с использованием светопольной микроскопии и окрашивания мазков по Филдсу. Повреждение нейтрофилов оценивали также по высвобождению внеклеточной ДНК. Показано, что дегенеративные изменения в нейтрофилах и повышение выхода ДНК из клеток, стимулированных FMLP, негативно ассоциированы с присутствием тромбоцитов в препаратах цельной крови. Предобработка MTX существенно снижает индуцируемое FMLP повреждение нейтрофилов и высвобождение ДНК. Индуцируемые FMLP изменения нейтрофилов уменьшает также метформин – известный ингибитор образования NET. Таким образом, мы не только подтвердили, что FMLP способен повреждать нейтрофилы, но также выявили вклад MCU в регуляцию морфологических изменений нейтрофилов человека, индуцированных FMLP.
ВВЕДЕНИЕ
Нейтрофилы – жизненно важные компоненты системы врожденного иммунитета – являются первой линией защиты от патогенов [1]. В ходе воспаления нейтрофилы поступают в участки инфекции, где убивают патогены с использованием таких механизмов, как дегрануляция, образование активных форм кислорода (ROS) и фагоцитоз [2]. При этом сильные стимулы влияют также на морфологию нейтрофилов, вызывая изменение формы ядер и экспансию цитоплазмы. В таких нейтрофилах расширена ядерная область, ликвидированы ядерные доли, деконденсирован хроматин, искажена форма клетки, разрушены ядерная и плазматическая мембраны, что может приводить к выходу покрытой клеточными белками ДНК в виде внеклеточных ловушек (NET), еще одной стратегии борьбы с инфекцией [3, 4]. В последнее время большой интерес вызывает участие NET в патогенезе таких неинфекционных болезней, как аутоиммунные состояния [5], почечно- и желчнокаменная болезни [6] и даже в первичной дисфункции трансплантата [7]. Более того, дегенеративные изменения нейтрофилов вносят вклад в патогенез таких заболеваний, связанных с воспалением, как атеросклероз, воспалительная болезнь кишечника, легочные синдромы [8–11].
Формил-метионил-лейцил-фенилаланин (FMLP) – мощный хемоаттрактант хемокинов, который имитирует формил-пептиды, высвобождаемые бактериями в ходе инфекции [12]. FMLP связывается с рецепторами формил-пептидов на нейтрофилах [13] и индуцирует дегрануляцию и фагоцитоз нейтрофилов, повышая уровень клеточного Ca2+ и продукцию ROS [14]. Однако роль FMLP в индукции дегенеративных изменений, которые могут быть ассоциированы с образованием NET в нейтрофилах, не установлена. Сообщается, что митохондриальный унипортер Ca2+ (MCU), который регулирует вход Ca2+ в митохондрии [15], индуцирует поляризацию и хемотаксис нейтрофилов [16], но его участие в образовании NET и дегенерации нейтрофилов, индуцируемой формил-пептидами, не доказано. Нами изучены опосредуемые FMLP изменения нейтрофилов и определен вклад поглощения Ca2+ митохондриями путем фармакологической модуляции MCU с использованием недавно идентифицированного блокатора – митоксантрона (MTX).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение препарата нейтрофилов центрифугированием в градиенте плотности (DGP). Обычно нейтрофилы изучают, используя обогащенные препараты этих клеток из крови животных, здоровых доноров и/или пациентов [17]. Нейтрофилы из крови человека выделяли с использованием центрифугирования в двойном градиенте плотности. У каждого донора отбирали по 3 мл крови в 15 мл фальконовскую пробирку, содержащую 12 мкл гепарина (20 МЕ/мл) в качестве коагулянта, и разбавляли 3 мл сбалансированного солевого раствора Хенкса (HBSS; “ThermoFisher”, США; Ref: 14175-095). Затем в такую же пробирку вносили 3 мл Pancoll Human Granulocytes 1.119 г/мл (“Pan-Biotech”, ФРГ, CAT. № 60110) и осторожно наслаивали сверху 3 мл Pancoll Human 1.077 г/мл (“Pan-Biotech”, CAT. № 60100) в соответствии с инструкциями фирмы. На верхний слой Pancoll медленно и осторожно наслаивали 6 мл разбавленной крови. Пробирки центрифугировали в бакет-роторе (“Kokusan” Япония; модель № H-103RS) при 1600 об./мин в течение 40 мин без торможения. После центрифугирования отбирали слой мононуклеарных клеток периферической крови (PBMC). В случае центрифугирования в двойном градиенте плотности мы не видели отдельного слоя гранулоцитов, как утверждалось в протоколе фирмы. Гранулоциты соосаждались с эритроцитами на дно пробирки.
Нижний слой, содержащий гранулоциты и эритроциты, разбавляли 5 мл HBSS и снова центрифугировали при 800 об./мин в течение 10 мин без торможения при комнатной температуре в той же центрифуге. После декантирования супернатанта в осадке, содержащем тонкий белый слой гранулоцитов, проводили лизис эритроцитов с использованием 33 и 267 мМ NaCl.
В качестве альтернативного дешевого и быстрого метода выделения PBMC из цельной крови использовали только Pancoll Human 1.077 г/мл. Нижний слой, содержащий красные кровяные клетки, обрабатывали для выделения нейтрофилов. В этом же методе 2 мл Pancoll 1.077 г/мл вносили в другую 15 мл фальконовскую пробирку, тщательно наслаивали на него 3 мл разбавленной крови и центрифугировали при 1600 об./мин без торможения в течение 15 мин при комнатной температуре. Слой PBMC отсасывали и переносили в отдельную пробирку. Слой эритроцитов разбавляли 5 мл HBSS, эритроциты лизировали, как описано ранее. Изолированные нейтрофилы ресуспендировали в HBSS и хранили при комнатной температуре до проведения эксперимента.
Получение препаратов нейтрофилов цельной крови (WBP). Ранее нейтрофилы получали, используя центрифугирование в градиенте плотности в комбинации с лизисом эритроцитов для отделения нейтрофилов от других клеток крови. Однако механический стресс, ассоциированный с активацией нейтрофилов, поставил под вопрос возможность использования длительного центрифугирования и осмотического шока для обогащения фракции нейтрофилов в градиенте плотности [18]. Поэтому для оценки изменений, вызванных центрифугированием в градиенте плотности, и влияния тромбоцитов на опосредуемую FMLP дегенерацию нейтрофилов применили подход, основанный на использовании цельной крови (WB). Для этого 5 мл крови отбирали в 15 мл фальконовскую пробирку, содержащую 20 мкл гепарина (20 МЕ/мл) в качестве антикоагулянта. Затем кровь переносили в две пробирки – 2 мл в одну и 3 мл в другую. Для опытов с WB в первой пробирке кровь (2 мл) разводили 2 мл HBSS. При получении препарата нейтрофилов из цельной крови (WBP) пробирку с 3 мл крови центрифугировали при 1100 об./мин в течение 20 мин без торможения при комнатной температуре. Всю обогащенную тромбоцитами плазму, полученную после стадии центрифугирования, удаляли, а оставшийся слой (примерно 2 мл), содержащий эритроциты и лейкоциты, разбавляли 2 мл HBSS для дальнейших опытов.
Стимуляция нейтрофилов. Способность FMLP индуцировать дегенеративные изменения изучали на нейтрофилах (DGP, WB и WBP), которые стимулировали 50 нM FMLP (Cat No. Sc-358988A, “Santa Cruz Biotechnology”, США) в течение 15 мин при 37°C в инкубаторе (“Thermo Scientific”, США). В процессе инкубации микроцентрифужные пробирки, содержащие контрольные образцы (обработанные и необработанные FMLP), постоянно вращали в роторном миксере.
Предварительная обработка нейтрофилов митоксантроном (MTX) и метформином. Стимулированные FMLP нейтрофилы (DGP и WBP) предварительно обрабатывали 10 мкМ MTX (Cat № sc-203136, “Santa Cruz”) в течение 60 мин при 37°C в инкубаторе с постоянным вращением в роторном миксере. В качестве положительного контроля при сравнении влияния MTX на FMLP-стимулированные нейтрофилы мы использовали метформин, который супрессирует нетоз (NETosis) путем ингибирования комплекса I. С этой целью стимулированные FMLP нейтрофилы (WBP) предварительно обрабатывали 1 мМ метформином в течение 30 мин при 37°C при постоянном перемешивании [19].
Морфологическая характеристика и количественное определение нейтрофилов. Для проверки морфологических изменений, возникающих в нейтрофилах в ответ на стимуляцию FMLP, растворы, содержащие обработанные FMLP нейтрофилы, наносили на предметные стекла, высушивали на воздухе и фиксировали метанолом (“Sigma Aldrich”, ФРГ; Cat № 32213-2) в течение 1 мин. Затем стекла окрашивали по методу Филдса. Изображения нейтрофилов при увеличении ×100 получали на световом микроскопе (“Olympus” CX41, Япония) с цифровой камерой (“Tuksen”; модель ISH5000). На каждом стекле обсчитывали примерно 100–150 клеток.
Выделение и количественное определение внеклеточной ДНК (вкДНК). Для дальнейшего анализа влияния FMLP на нейтрофилы использовали вкДНК, выделяемую центрифугированием на спин-колонках. Образцы контрольных и стимулированных FMLP растворов, содержащих нейтрофилы, наносили на колонки, центрифугировали в течение 10 мин при 1600 об./мин при комнатной температуре в микроцентрифуге (“Thermo scientific Heraeus Fresco 17”; Model No. 75002420) и тщательно собирали бесклеточные супернатанты. Количество вкДНК определяли спектрофотометрически при 260 нм.
Статистический анализ. Результаты анализировали, используя GraphPad Prism v5. T-тест. Статистически значимые различия между группами расcчитывали с помощью одно- и двухфакторного метода ANOVA. Значения p < 0.05 считали статистически значимыми.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Обогащение в градиенте плотности активирует нейтрофилы
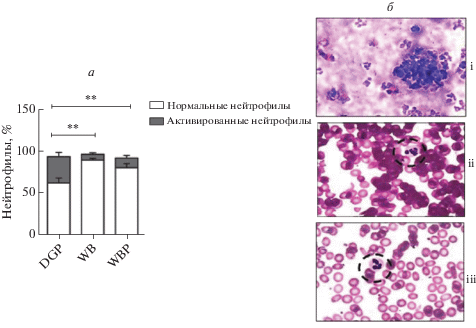
При центрифугировании в градиенте плотности нейтрофилы подвергаются механическому стрессу, что может приводить к их поляризации и активации [1]. Поэтому мы сравнили морфологию нейтрофилов в WB, в препаратах, полученных с помощью DGP, и в препаратах, свободных от тромбоцитов (WBP). Показано, что в препаратах, полученных с помощью DGP, содержание (%) активированных нейтрофилов существенно выше, чем в WB и WBP (рис. 1a). Микроскопическое исследование нестимулированных нейтрофилов выявило поляризацию плазматической мембраны и разрушение ядерных долей в препарате DGP (рис. 1б-i), что считается признаком активированных клеток. Напротив, в препаратах WBP (рис. 1б-ii) и в WB нейтрофилы (рис. 1б-iii) имеют нормальную плазматическую мембрану и ядра с несколькими дольками.
Рис. 1.
Основанное на дифференциальном центрифугировании в градиенте плотности (DGP) выделение приводит к большей активации нейтрофилов, чем при выделении из цельной крови (WB) и из препаратов цельной крови, свободных от тромбоцитов (WBP). а – Содержание (%) нормальных нейтрофилов в WB и WBP выше, чем в DGP. На диаграмме представлены результаты сравнения нормальных и активированных нейтрофилов (n = 4). Содержание активированных нейтрофилов в DGP значительно выше, чем в WB и WBP. **p < 0.01 как для DGP vs WB, так и для группы DGP vs WBP. б – Микроскопическое изображение нейтрофилов в трех разных препаратах. i – Нейтрофилы, выделенные в DGР, ii и iii – нейтрофилы из WBP и WB.
Обработка FMLP повышает число дегенеративных нейтрофилов
С помощью микроскопического исследования мы разделили стимулированные FMLP-нейтрофилы в препаратах WBP на три главных категории: нормальные нейтрофилы с интактными ядрами с несколькими дольками и плазматической мембраной (рис. 2a-i); активированные нейтрофилы, имеющие поляризованную форму (рис. 2a-ii), и нейтрофилы с искаженной формой, разбухшими ядрами, разделенными ядерными дольками, увеличенным размером и высвобожденными тонкими внеклеточными филаментами (рис. 2a-iii и 2a-iv).
Рис. 2.
FMLP индуцирует дегенеративные изменения в нейтрофилах человека. a – Морфологическая характеристика стимулированных FMLP нейтрофилов (мазки, окрашенные по Филдсу). б – Контрольные препараты WBP содержат больше нормальных и меньше измененных нейтрофилов, но при обработке 50 нM FMLP доля дегенеративных нейтрофилов заметно возрастает. На диаграмме приведены средние значения ± SEM (n = 5); ***p < 0.001 для нормальных и дегенерированных нейтрофилов как в необработанных, так и в обработанных образцах. в – Содержание вкДНК в суспензии WBP, обработанной FMLP, выше, чем в необработанной. Результаты анализа образцов, полученных от каждого донора, нормировали по отношению к необработанной группе для снижения ошибки, обусловленной индивидуальной вариабельностью концентрации ДНК. На диаграмме представлены средние значения ± SEM (n = 7), **p = = 0.001. г – Обработка DMSO незначительно влияет на изменение уровней нормальных и дегенеративных нейтрофилов. На диаграмме представлена доля нормальных и активированных нейтрофилов в обработанных и необработанных DMSO образцах WBP (n = 4). д – Содержание вкДНК, выделенной из контрольных и обработанных DMSO нейтрофилов, различается незначительно. На диаграмме представлены результаты сравнения количества вкДНК, вышедшей из обработанных и необработанных DMSO нейтрофилов (n = 4).
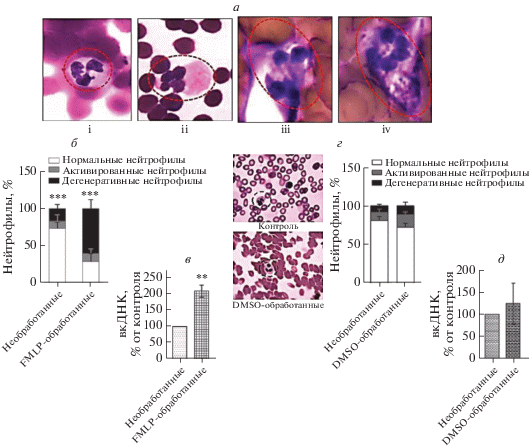
Обнаружено, что стимуляция нейтрофилов в препаратах WBP FMLP (50 нM) приводит к изменению их морфологии. Сравнение доли измененных и нормальных нейтрофилов в необработанных образцах выявило высокую способность FMLP вызывать повреждение нейтрофилов. Примечательно, что наши данные показывают значительное увеличение доли измененных нейтрофилов в группе, обработанной FMLP, что ассоциировано со снижением доли нормальных клеток (рис. 2б). Эти данные подтверждают тот факт, что FMLP способен вызывать дегенеративные изменения в нейтрофилах, что может быть связано с некрозом или высвобождением NET-подобных филаментов.
Высвобождаемая из нейтрофилов вкДНК используется также для диагностического выявления NET или поврежденных клеток при определенных патологиях [20, 21]. Интересно, что нами обнаружены значимые различия в высвобождении вкДНК стимулированными FMLP и необработанными контрольными образцами, что подтверждается микроскопическими данными (рис. 2в). На основании этих результатов мы предполагаем, что FMLP способен индуцировать в нейтрофилах человека дегенеративные изменения, которые могут быть связаны с некрозом или нетозом.
Нами показано также, что 0.45%-ный DMSO, использованный как растворитель FMLP, не может индуцировать такие морфологические изменения в нейтрофилах (рис. 2г). Обработка DMSO также не приводит к увеличению выхода вкДНК (рис. 2д).
Покоящиеся тромбоциты ингибируют дегенеративные изменения нейтрофилов, индуцируемые FMLP
Взаимодействие тромбоцитов с нейтрофилами рассматривали как длительный процесс, развивающийся в течение многих лет [3]. По нашим данным, число активированных нейтрофилов в WB и WBP увеличивается при стимуляции FMLP по сравнению с необработанными клетками (рис. 3a, б). Однако доля измененных нейтрофилов в WBP возрастает более значительно, чем в WB (рис. 3в). Эти препараты отличаются только наличием тромбоцитов, поэтому заманчиво было предположить, что присутствие покоящихся тромбоцитов в WB подавляет опосредуемое FMLP повреждение нейтрофилов.
Рис. 3.
Покоящиеся тромбоциты ингибируют опосредуемое FMLP повреждение нейтрофилов. a – В препаратах WB не выявлено различий в дегенерации нейтрофилов, обработанных 50 нM FMLP и в необработанных образцах. Морфология нейтрофилов и диаграмма активированных нейтрофилов после стимуляции FMLP. На диаграмме показано сравнение доли нормальных активированных и дегенеративных нейтрофилов в WB (n = 4). б – Значительное повышение доли дегенеративных нейтрофилов в препаратах WBP (без тромбоцитов) после стимуляции FMLP. Сравнение обработанных и необработанных FMLP нейтрофилов в WBP. На диаграмме показаны доли нормальных, активированных и измененных нейтрофилов в контрольных и стимулированных FMLP образцах WBP (n = 4). в – Доля измененных нейтрофилов в препаратах WBP, не содержащих тромбоцитов, значительно выше, чем в препаратах WB, содержащих тромбоциты. Приведены средние значения ± SEM (n = 4), ***p < 0.001 для нейтрофилов в WBP. г – Сравнение высвобождения вкДНК в WB и WBP свидетельствует о более высоком содержании вкДНК в отсутствие тромбоцитов в образцах, стимулированных в 50 нM FMLP. На диаграмме представлено содержание вкДНК, высвобождаемой контрольными и стимулированными FMLP образцами WB и WBP. ***p < 0.001 для высвобождения вкДНК нейтрофилами, стимулированным FMLP, в WB vs WBP.
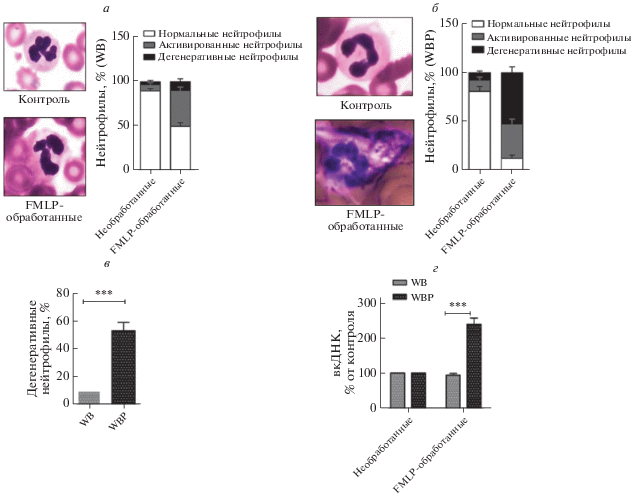
Нами изучено также влияние покоящихся тромбоцитов на опосредуемое FMLP высвобождение вкДНК. Обнаружено, что стимуляция FMLP образцов WB не приводит к значительному высвобождению вкДНК по сравнению с контрольной группой. Интересно, что нами обнаружено значительно более существенное высвобождение вкДНК в стимулированных FMLP образцах WBP (рис. 3г). Таким образом, покоящиеся тромбоциты существенно влияют на высвобождение вкДНК нейтрофилами, стимулированными FMLP.
Митоксантрон препятствует возникновению дегенеративных изменений в нейтрофилах, опосредуемых FMLP
Для определения роли поглощения Ca2+ митохондриями в опосредуемых FMLP дегенеративных изменениях нейтрофилов человека использовали MTX – недавно описанный блокатор MCU [22]. Нами показано, что предварительная обработка MTX приводит к значительному снижению доли измененных нейтрофилов в образцах, стимулированных FMLP (рис. 4a). В соответствии с уже опубликованными результатами изучения роли метформина в уменьшении ассоциированных с NET дегенеративных изменений в нейтрофилах [23], наши данные показывают снижение доли дегенеративных нейтрофилов в клетках, стимулированных FMLP после предварительной обработки метформином (рис. 4б).
Рис. 4.
Митоксантрон (МТХ) и метформин ослабляют индуцируемые FMLP изменения в нейтрофилах. a – FMLP-стимулированные нейтрофилы, предобработанные 10 мкМ МТХ (FMLP + МТХ), содержат значительно меньше измененных нейтрофилов, чем образцы, которые не обрабатывали МТХ (FMLP). На диаграмме представлены средние значения ± SEM (n = 5), ***p < 0.001 для нормальных нейтрофилов по сравнению с дегенерированными в группах, получавших как FMLP, так и FMLP + MTX. б – FMLP-стимулированные нейтрофилы, предобработанные 1 мM метформина, содержат значительно меньше (%) дегенеративных нейтрофилов, чем образцы без обработки (FMLP). На диаграмме представлены средние значения ± SEM (n = 5), **p < 0.001, *** p < 0.01 по сравнению с группой FMLP. в – Сравнение количества вкДНК, высвобождаемой нейтрофилами, стимулированными FMLP, с/без предварительной обработки МТХ. После обработки этим препаратом количество вкДНК значительно снижается. Результаты анализа образцов, полученных от каждого индивида, нормировали по результатам группы FMLP для снижения разброса данных, обусловленного индивидуальной вариабельностью и различным числом клеток. На диаграмме представлены средние значения ± SEM (n = 7), **p < 0.01 для группы FMLP + MTX. г – Сравнение количества вкДНК, высвобождаемой из стимулированных FMLP нейтрофилов, с/без предварительной обработки метформином. Обработка клеток метформином значительно снижает количество высвобождаемой вкДНК. Представлены средние значения ± SEM (n = 4), *p < 0.05 для группы FMLP + метформин.
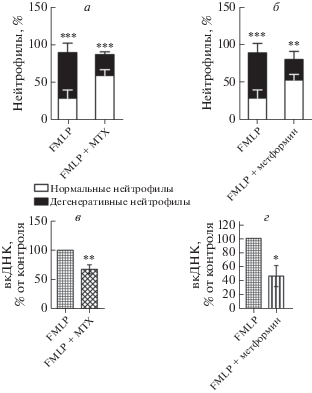
Используя данные, полученные с помощью светопольной микроскопии, мы проверили, может ли MTX ингибировать опосредованное FMLP высвобождение вкДНК нейтрофилами. Примечательно, что нами выявлено значительное снижение высвобождения вкДНК нейтрофилами, обработанными MTX и метформином (рис. 4в, г). Микроскопический анализ и количественное определение вкДНК в образцах, предварительно обработанных метформином, также свидетельствуют о супрессии дегенерации нейтрофилов под действием FMLP.
Все сказанное позволяет предположить, что ингибирование MCU под действием MTX снижает число дегенеративных нейтрофилов и высвобождение вкДНК в ответ на обработку FMLP. Подтверждена роль метформина в ингибировании дегенеративных изменений в нейтрофилах человека.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Центрифугирование в градиенте плотности часто применяют при изучении физиологии нейтрофилов [24]. Однако механический стресс, возникающий при этом, приводит к поляризации нейтрофилов [18, 25]. Предварительная активация нейтрофилов в ходе выделения может влиять на их чувствительность к индукторам дегенерации или на образование NET. Таким образом, предактивированные нейтрофилы не подходят для изучения дегенеративных изменений и способности синтетических соединений, подобных FMLP, индуцировать NET. С этой целью мы определили сначала морфологический статус нейтрофилов, выделенных с помощью центрифугирования в градиенте плотности, и обнаружили более высокое содержание активированных нейтрофилов. Активация нейтрофилов может влиять на исход стимуляции нейтрофилов FMLP ex vivo. Поэтому мы применили альтернативный и дешевый метод, в котором индуцируемые FMLP изменения морфологии нейтрофилов человека изучают в WB-образцах.
FMLP – синтетический аналог бактериальных формил-пептидов, который стимулирует мобилизацию Ca2+ нейтрофилами через мобилизацию рецепторов формил-пептидов [26]. Опосредуемая FMLP активация нейтрофилов вносит вклад в поляризацию [1, 27], направленную миграцию, адгезию и продукцию ROS клетками [14]. Однако сообщения о NET-индуцирующем потенциале FMLP неоднозначны [28]. Выделяют две категории образования NET, основанные на участии NADPH-оксидазы (NOX). NOX-зависимый процесс включает образование ROS с последующим некротическим лизисом нейтрофилов после высвобождения NET [29, 30]. Утверждалось, что генерация ROS под действием FMLP не может индуцировать образование NET в нейтрофилах, поскольку для этого необходима аутофагия и продукция супероксидных радикалов [31]. В 2016 г. показали, что стимуляция нейтрофилов 1 мкМ FMLP не индуцирует высвобождение NET, что свидетельствует в пользу этого утверждения [32]. Напротив, недавно обнаружили, что стимуляции нейтрофилов 1 мкМ FMLP приводит к образованию NET [33]. Показано также, что обработка клеток FMLP (4 ч, 30 нM) действует как потенциальный индуктор образования NET [34].
Нами установлено, что дегенеративные изменения в стимулированных FMLP нейтрофилах согласуются с данными о способности FMLP индуцировать образование NET. Изменения, включающие экспансию ядерных компонентов и набухание хроматина с последующей дезинтеграцией ядерной оболочки, смешиванием ядерного содержимого с белками цитоплазматических гранул и разрушением ядерной и цитоплазматических мембран, характерны для NET-ассоциированной дегенерации нейтрофилов [4, 35]. Некоторые характеристики нейтрофилов, ассоциированные с образованием NET, включают деконденсацию ядер, утрату ядерной лобуляции и высвобождение тонких филаментов [36]. В нашей работе морфологические изменения нейтрофилов были ассоциированы с образованием NET. Однако набухание цитоплазмы, наряду с правильной локализацией ядра и разрушением плазматической мембраны, наблюдаемые в нейтрофилах с признаками дегенерации, считаются также признаками некроза. Поскольку сообщалось, что FMLP индуцирует в нейтрофилах некротические повреждения [37], дегенеративные изменения в них могут быть результатом некроза. Таким образом, понять точный механизм дегенеративных изменений нейтрофилов, индуцированных FMLP, и их связь с NETозом или некрозом позволят дальнейшие эксперименты.
Предполагается, что присутствие вкДНК можно рассматривать как прогностический признак патологий, ассоциированных с NET [38]. Описано использование повышенного уровня вкДНК в сыворотке в качестве маркера образования NET – прогностического маркера некротизирующего энтероколита (NEC) у мышей и человека [39]. Повышенный уровень вкДНК предложено считать предиктивным маркером NETоза и воспаления при сахарном диабете типа 2 [40]. Описано существование тесной ассоциации между отложением NET и повышенным уровнем вкДНК при различных заболеваниях, включая ревматоидный артрит, системную красную волчанку, связанное с трансфузией острое повреждение легкого и рак [38, 41–44]. Присутствие окисленной вкДНК выявлено при разных воспалительных состояниях, что указывает на участие опосредуемого ROS окислительного стресса в воспалительном потенциале ДНК, высвобожденной из клеток с признаками дегенерации [45–47]. Более того, митохондриальное происхождение вкДНК считается потенциальной причиной воспалительного эффекта [48, 49]. Нами показано значительное увеличение доли вкДНК, высвобождаемой нейтрофилами, стимулированными FMLP, по сравнению с необработанными. Несмотря на это, индуцированные ROS изменения морфологии нейтрофилов, обработанных FMLP, также могут быть причиной высвобождения вкДНК. С другой стороны, циркулирующая вкДНК может происходить и из клеток, погибших в результате некроза [20]. Учитывая это, нельзя считать NET единственным источником вкДНК в наших образцах, стимулированных FMLP. Таким образом, обнаруженные нами дегенеративные изменения нейтрофилов, индуцированные FMLP, могут быть связаны с некрозом или образованием NET.
Взаимодействие циркулирующих нейтрофилов с другими белыми клетками крови, красными клетками крови и тромбоцитами вносит вклад в их физиологию [13, 14, 50]. Взаимодействие тромбоцитов с нейтрофилами зависит от связывания Р-селектина на поверхности тромбоцитов с гликопротеиновым лигандом 1 Р-селектина (PSGL-1) на нейтрофилах [8, 51]. В нескольких исследованиях показано, что активированные тромбоциты индуцируют образование NET при воспалительных болезнях и тромбозе [9, 10, 52]. Однако влияние покоящихся тромбоцитов на индуцируемую FMLP дегенерацию нейтрофилов не изучено. Интересно, что наши результаты показали ингибирование опосредуемой FMLP дегенерации в присутствии покоящихся тромбоцитов в препаратах WB. Эти данные подтвердили также полученные ранее результаты, согласно которым образование ROS нейтрофилами, стимулированными FMLP, ингибируется в присутствии покоящихся тромбоцитов in vitro [53]. Учитывая это, мы отделили обогащенную тромбоцитами плазму из цельной крови и получили WBP-препараты, которые не содержат тромбоциты. В WBP-препаратах нейтрофилов, стимулированных FMLP, обнаружено увеличение доли дегенеративных нейтрофилов. Поэтому мы можем утверждать, что присутствие покоящихся тромбоцитов ингибирует связанное с FMLP повреждение нейтрофилов in vitro. Однако точный механизм опосредуемой тромбоцитами супрессии дегенерации нейтрофилов еще предстоит определить.
Роль Ca2+-сигналов и изменений цитоплазматической концентрации Ca2+ в ходе стимуляции и миграции нейтрофилов хорошо известна [54]. Показано, что FMLP вызывает увеличение концентрации Ca2+ в цитоплазме и митохондриях [55]. Недавно обнаружено участие Ca2+-чувствительных рецепторов в стимулированных FMLP нейтрофилах [56]. Опосредуемое IP3 высвобождение Ca2+ из эндоплазматического ретикулума увеличивает концентрацию Ca2+ в цитозоле [26], часть которого захватывается также митохондриями через MCU. Вследствие этого индуцируемый Ca2+ метаболизм ведет к продукции митохондриями ROS, которые активируют протеинкиназу С. Активация протеинкиназы C может, в свою очередь, запускать окисление NADPH, вызывающее окислительный взрыв и активацию нейтрофилов при разных иммунных ответах [14, 29, 56, 57]. MCU – недавно открытый белок внутренней мембраны митохондрий, который регулирует гомеостаз Ca2+ [58]. Обнаружено, что MCU играет значительную роль в хемотаксисе и поляризации нейтрофилов путем модуляции полимеризации F-актина и расщепления митохондрий [16]. Однако вклад MCU в некроз нейтрофилов или в NET-ассоциированную дегенерацию остается неизученным. Мы использовали MTX, новый блокатор MCU, для изучения роли MCU в опосредованной FMLP дегенерации нейтрофилов. Нами показано, что предварительная обработка нейтрофилов MTX снижает стимулируемую FMLP дегенерацию клеток. Поскольку известно, что FMLP индуцирует образование ROS в нейтрофилах [59], можно предположить, что дегенеративные изменения, выявленные в нашей работе, могут быть следствием индуцируемой FMLP активации NOX через открытие канала MCU, запускаемого опосредуемым IP3 избытком Ca2+.
Способность МТХ подавлять индукцию повреждений в стимулированных FMLP нейтрофилах подтверждена также количественным определением вкДНК, которая высвобождается в условиях окислительного стресса, вызванного избытком Ca2+ в митохондриях и увеличенной продукцией ROS. Поэтому ингибирование митохондриального Ca2+ MTX ведет к значительному снижению концентрации вкДНК по сравнению с необработанными нейтрофилами. Эти результаты указывают на ключевую роль MCU в индукции дегенеративных изменений в нейтрофилах человека, стимулированных FMLP. В дополнение к MTX мы проверили также действие метформина (противодиабетическое средство, снижающее формирование NET) на клетки, стимулированные FMLP. Сообщалось, что метформин подавляет дегенеративные изменения нейтрофилов, ассоциированные с NET через ингибирование комплекса I [60, 61]. Интересно, что мы также наблюдали заметное снижение морфологических изменений и высвобождения вкДНК нейтрофилами, стимулированными FMLP, при обработке метформином. Мы предполагаем, что ингибирование метформином комплекса I, который является местом продукции ROS в митохондриях, может снижать негативное действие FMLP, сдерживая образование ROS в нейтрофилах.
Таким образом, полученные нами результаты подтверждают способность FMLP индуцировать дегенеративные изменения в нейтрофилах на самых ранних стадиях стимуляции. Изменения, индуцируемые FMLP, напоминают ответ нейтрофилов на высвобождение NET. Однако существует также возможность некротических повреждений нейтрофилов, вызыванных FMLP. WBP, использованные в нашей работе, могут обеспечивать условия, сходные с условиями, окружающими нейтрофилы в организме, пригодные для изучения сложных механизмов дегенеративных процессов. Полученные нами результаты подчеркивают важный вклад покоящихся тромбоцитов в опосредуемое FMLP повреждение нейтрофилов. Эти результаты могут способствовать пониманию аномальных повреждений нейтрофилов, индуцированных инфекцией, способной провоцировать развитие тяжелых воспалительных заболеваний. Наши данные свидетельствуют в пользу представлений о том, что MCU вносит вклад в опосредуемое FMLP повреждение нейтрофилов, которое может быть ассоциировано с образованием NET или некрозом. Поэтому ингибирование MCU может служить потенциальной терапевтической мишенью при болезнях, ассоциированных с обширными повреждениями нейтрофилов.
Авторы признательны всем донорам крови за участие в этом исследовании.
К участию в исследовании были привлечены здоровые взрослые доноры, от каждого из которых получено письменное информированное согласие. Экспериментальные исследования одобрены Этическим комитетом института в соответствии с Хельсинкской декларацией 1964 г.
Финансирование этого исследования было предоставлено URF Quaid-i-Azam University, Исламабад, Пакистан.
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
Ekpenyong A.E., Toepfner N., Fiddler C., Herbig M., Li W., Cojoc G., Summers C., Guck J., Chilvers E.R. (2017) Mechanical deformation induces depolarization of neutrophils. Sci. Adv. 3, e1602536. https://doi.org/10.1126/sciadv.1602536
Teng T.S., Ji A.L., Ji X.Y., Li Y.Z. (2017) Neutrophils and immunity: from bactericidal action to being conquered. J. Immunol. Res. 2017, 9671604. https://doi.org/10.1155/2017/9671604
Lisman T. (2018) Platelet-neutrophil interactions as drivers of inflammatory and thrombotic disease. Cell Tissue Res. 371, 567–576. https://doi.org/10.1007/s00441-017-2727-4
Lawrence S.M., Corriden R., Nizet V. (2020) How neutrophils meet their end. Trends Immunol. 41, 531–544. https://doi.org/10.1016/j.it.2020.03.008
Pruchniak M.P., Kotula I., Manda-Handzlik A, (2015) Neutrophil extracellular traps (Nets) impact upon autoimmune disorders. Cent. Eur. J. Immunol. 40, 217–224. https://doi.org/10.5114/ceji.2015.52836
Munoz L.E., Boeltz S., Bilyy R., Schauer C., Mahajan A., Widulin N., Gruneboom A., Herrmann I., Boada E., Rauh M., Krenn V., Biermann M.H.C., Podolska M.J., Hahn J., Knopf J., Maueroder C., Paryzhak S., Dumych T., Zhao Y., Neurath M.F., Hoffmann M.H., Fuchs T.A., Leppkes M., Schett G., Herrmann M. (2019) Neutrophil extracellular traps initiate gallstone formation. Immunity. 51, 443–450,e4. https://doi.org/10.1016/j.immuni.2019.07.002
Sayah D.M., Mallavia B., Liu F., Ortiz-Munoz G., Caudrillier A., DerHovanessian A., Ross D.J., Lynch J.P., 3rd, Saggar R., Ardehali A., Lung Transplant Outcomes Group I, Ware L.B., Christie J.D., Belperio J.A., Looney M.R. (2015) Neutrophil extracellular traps are pathogenic in primary graft dysfunction after lung transplantation. Am. J. Respir. Crit. Care Med. 191, 455–463. https://doi.org/10.1164/rccm.201406-1086OC
Etulain J., Martinod K., Wong S.L., Cifuni S.M., Schattner M., Wagner D.D. (2015) P-selectin promotes neutrophil extracellular trap formation in mice. Blood. 126, 242–246. https://doi.org/10.1182/blood-2015-01-624023
Patel M.S., Miranda-Nieves D., Chen J., Haller C.A., Chaikof E.L. (2017) Targeting P-selectin glycoprotein ligand-1/P-selectin interactions as a novel therapy for metabolic syndrome. Transl. Res. 183, 1–13. https://doi.org/10.1016/j.trsl.2016.11.007
Pircher J., Engelmann B., Massberg S., Schulz C. (2019) Platelet-neutrophil crosstalk. Atherothrombosis. Thromb. Haemost. 119, 1274–1282. https://doi.org/10.1055/s-0039-1692983
Zhou G.X., Liu Z.J. (2017) Potential roles of neutrophils in regulating intestinal mucosal inflammation of inflammatory bowel disease. J. Dig. Dis. 18, 495–503. https://doi.org/10.1111/1751-2980.12540
Li L., Chen K., Xiang Y., Yoshimura T., Su S., Zhu J., Bian X.W., Wang J.M. (2016) New development in studies of formyl-peptide receptors: critical roles in host defense. J. Leukoc. Biol. 99, 425–435. https://doi.org/10.1189/jlb.2RI0815-354RR
Dahlgren C., Gabl M., Holdfeldt A., Winther M., Forsman H. (2016) Basic characteristics of the neutrophil receptors that recognize formylated peptides, a danger-associated molecular pattern generated by bacteria and mitochondria. Biochem. Pharmacol. 114, 22–39. https://doi.org/10.1016/j.bcp.2016.04.014
Wen X., Xu X., Sun W., Chen K., Pan M., Wang J.M., Bolland S.M., Jin T. (2019) G-protein-coupled formyl peptide receptors play a dual role in neutrophil chemotaxis and bacterial phagocytosis. Mol. Biol. Cell. 30, 346–356. https://doi.org/10.1091/mbc.E18-06-0358
Paupe V., Prudent J. (2018) New insights into the role of mitochondrial calcium homeostasis in cell migration. Biochem. Biophys. Res. Commun. 500, 75–86. https://doi.org/10.1016/j.bbrc.2017.05.039
Zheng X., Chen M., Meng X., Chu X., Cai C., Zou F. (2017) Phosphorylation of dynamin-related protein 1 at Ser616 regulates mitochondrial fission and is involved in mitochondrial calcium uniporter-mediated neutrophil polarization and chemotaxis. Mol. Immunol. 87, 23–32. https://doi.org/10.1016/j.molimm.2017.03.019
Freitas M., Porto G., Lima J.L., Fernandes E. (2008) Isolation and activation of human neutrophils in vitro. The importance of the anticoagulant used during blood collection. Clin. Biochem. 41, 570–575. https://doi.org/10.1016/j.clinbiochem.2007.12.02118
Ekpenyong A.E., Toepfner N., Chilvers E.R., Guck J. (2015) Mechanotransduction in neutrophil activation and deactivation. Biochim. Biophys. Acta. 1853, 3105–3116. https://doi.org/10.1016/j.bbamcr.2015.07.015
Zmijewski J.W., Lorne E., Zhao X., Tsuruta Y., Sha Y., Liu G., Siegal G.P., Abraham E. (2008) Mitochondrial respiratory complex I regulates neutrophil activation and severity of lung injury. Am. J. Respir. Crit. Care Med. 178, 168–179. https://doi.org/10.1164/rccm.200710-1602OC
Jackson Chornenki N.L., Coke R., Kwong A.C., Dwivedi D.J., Xu M.K., McDonald E., Marshall J.C., Fox-Robichaud A.E., Charbonney E., Liaw P.C. (2019) Comparison of the source and prognostic utility of cfDNA in trauma and sepsis. Intensive Care Med. Exp. 7, 29. https://doi.org/10.1186/s40635-019-0251-4
Margraf S., Logters T., Reipen J., Altrichter J., Scholz M., Windolf J. (2008) Neutrophil-derived circulating free DNA (cf-DNA/NETs): a potential prognostic marker for posttraumatic development of inflammatory second hit and sepsis. Shock. 30, 352–358. https://doi.org/10.1097/SHK.0b013e31816a6bb1
Arduino D.M., Wettmarshausen J., Vais H., Navas-Navarro P., Cheng Y., Leimpek A., Ma Z., Delrio-Lorenzo A., Giordano A., Garcia-Perez C., Medard G., Kuster B., Garcia-Sancho J., Mokranjac D., Foskett J.K., Alonso M.T., Perocchi F. (2017) Systematic identification of MCU modulators by orthogonal interspecies chemical screening. Mol. Cell. 67, 711–723,e7. https://doi.org/10.1016/j.molcel.2017.07.019
Menegazzo L., Scattolini V., Cappellari R., Bonora B.M., Albiero M., Bortolozzi M., Romanato F., Ceolotto G., Vigili de Kreutzeberg S., Avogaro A., Fadini G.P. (2018) The antidiabetic drug metformin blunts NETosis in vitro and reduces circulating NETosis biomarkers in vivo. Acta Diabetol. 55, 593–601. https://doi.org/10.1007/s00592-018-1129-8
Cabanis A., Gressier B., Lebegue S., Brunet C., Dine T., Luyckx M., Cazin M., Cazin J.C. (1994) A rapid density gradient technique for separating polymorphonuclear granulocytes. APMIS. 102, 119–121. https://doi.org/10.1111/j.1699-0463.1994.tb04855.x
Yap B., Kamm R.D. (2005) Mechanical deformation of neutrophils into narrow channels induces pseudopod projection and changes in biomechanical properties. J. Appl. Physiol. 98, 1930–1939. https://doi.org/10.1152/japplphysiol.01226.2004
Dorward D.A., Lucas C.D., Chapman G.B., Haslett C., Dhaliwal K., Rossi A.G. (2015) The role of formylated peptides and formyl peptide receptor 1 in governing neutrophil function during acute inflammation. Am. J. Pathol. 185, 1172–1184. https://doi.org/10.1016/j.ajpath.2015.01.020
Servant G., Weiner O.D., Herzmark P., Balla T., Sedat J.W., Bourne H.R. (2000) Polarization of chemoattractant receptor signaling during neutrophil chemotaxis. Science. 287, 1037–1040. https://doi.org/10.1126/science.287.5455.1037
Bufe B., Schumann T., Kappl R., Bogeski I., Kummerow C., Podgorska M., Smola S., Hoth M., Zufall F. (2015) Recognition of bacterial signal peptides by mammalian formyl peptide receptors: a new mechanism for sensing pathogens. J. Biol. Chem. 290, 7369–7387. https://doi.org/10.1074/jbc.M114.626747
Воробьева Н.В., Черняк Б.В. (2020) НЕТоз: молекулярные механизмы, роль в физиологии и патологии (обзор). Биохимия. 85(10), 1383–1397. https://doi.org/10.1134/S0006297920100065
Nguyen G.T., Green E.R., Mecsas J. (2017) Neutrophils to the ROScue: mechanisms of NADPH oxidase activation and bacterial resistance. Front. Cell. Infect. Microbiol. 7, 73. https://doi.org/10.3389/fcimb.2017.00373
Remijsen Q., Vanden Berghe T., Wirawan E., Asselbergh B., Parthoens E., De Rycke R., Noppen S., Delforge M., Willems J., Vandenabeele P. (2011) Neutrophil extracellular trap cell death requires both autophagy and superoxide generation. Cell. Res. 21, 290–304. https://doi.org/10.1038/cr.2010.150
Yuen J., Pluthero F.G., Douda D.N., Riedl M., Cherry A., Ulanova M., Kahr W.H., Palaniyar N., Licht C. (2016) NETosing neutrophils activate complement both on their own NETs and bacteria via alternative and non-alternative pathways. Front. Immunol. 7, 137. https://doi.org/10.3389/fimmu.2016.00137
Pruchniak M.P., Demkow U., (2019) Potent NETosis inducers do not show synergistic effects in vitro. Cent. Eur. J. Immunol. 44, 51–58. https://doi.org/10.5114/ceji.2019.84017
Tatsiy O., McDonald P.P. (2018) Physiological stimuli induce PAD4-dependent, ROS-independent NETosis, with early and late events controlled by discrete signaling pathways. Front. Immunol. 9, 2036. https://doi.org/10.3389/fimmu.2018.02036
Neubert E., Meyer D., Rocca F., Gunay G., Kwaczala-Tessmann A., Grandke J., Senger-Sander S., Geisler C., Egner A., Schon M.P., Erpenbeck L., Kruss S. (2018) Chromatin swelling drives neutrophil extracellular trap release. Nat. Commun. 9, 3767. https://doi.org/10.1038/s41467-018-06263-5
Воробьева Н.В., Пинегин Б.В. (2014) Нейтрофильные внеклеточные ловушки: механизмы образования, роль в норме и при патологии (обзор). Биохимия. 79(12), 1582–1593. https://doi.org/10.1134/s0006297914120025
Peniche A.G., Bonilla D.L., Palma G.I., Melby P.C., Travi B.L., Osorio E.Y. (2017) A secondary wave of neutrophil infiltration causes necrosis and ulceration in lesions of experimental American cutaneous leishmaniasis. PLoS One. 12, e0179084. https://doi.org/10.1371/journal.pone.0179084
Zhang S., Lu X., Shu X., Tian X., Yang H., Yang W., Zhang Y., Wang G. (2014) Elevated plasma cfDNA may be associated with active lupus nephritis and partially attributed to abnormal regulation of neutrophil extracellular traps (NETs) in patients with systemic lupus erythematosus. Intern. Med. 53, 2763–2771. https://doi.org/10.2169/internalmedicine.53.2570
Vincent D., Klinke M., Eschenburg G., Trochimiuk M., Appl B., Tiemann B., Bergholz R., Reinshagen K., Boettcher M. (2018) NEC is likely a NETs dependent process and markers of NETosis are predictive of NEC in mice and humans. Sci. Rep. 8, 12612. https://doi.org/10.1038/s41598-018-31087-0
Bryk A.H., Prior S.M., Plens K., Konieczynska M., Hohendorff J., Malecki M.T., Butenas S., Undas A. (2019) Predictors of neutrophil extracellular traps markers in type 2 diabetes mellitus: associations with a prothrombotic state and hypofibrinolysis. Cardiovasc. Diabetol. 18, 49. https://doi.org/10.1186/s12933-019-0850-0
Lood C., Blanco L.P., Purmalek M.M., Carmona-Rivera C., De Ravin S.S., Smith C.K., Malech H.L., Ledbetter J.A., Elkon K.B., Kaplan M.J. (2016) Neutrophil extracellular traps enriched in oxidized mitochondrial DNA are interferogenic and contribute to lupus-like disease. Nat. Med. 22, 146–153. https://doi.org/10.1038/nm.4027
Sur Chowdhury C., Giaglis S., Walker U.A., Buser A., Hahn S., Hasler P. (2014) Enhanced neutrophil extracellular trap generation in rheumatoid arthritis: analysis of underlying signal transduction pathways and potential diagnostic utility. Arthritis. Res. Ther. 16, R122. https://doi.org/10.1186/ar4579
Thomas G.M., Carbo C., Curtis B.R., Martinod K., Mazo I.B., Schatzberg D., Cifuni S.M., Fuchs T.A., von Andrian U.H., Hartwig J.H., Aster R.H., Wagner D.D. (2012) Extracellular DNA traps are associated with the pathogenesis of TRALI in humans and mice. Blood. 119, 6335–6343. https://doi.org/10.1182/blood-2012-01-405183
Oklu R., Sheth R.A., Wong K.H.K., Jahromi A.H., Albadawi H. (2017) Neutrophil extracellular traps are increased in cancer patients but does not associate with venous thrombosis. Cardiovasc. Diagn. Ther. 7, S140–S149. https://doi.org/10.21037/cdt.2017.08.01
Ermakov A.V., Konkova M.S., Kostyuk S.V., Izevs-kaya V.L., Baranova A., Veiko N.N. (2013) Oxidized extracellular DNA as a stress signal in human cells. Oxid. Med. Cell. Longev. 2013, 649747. https://doi.org/10.1155/2013/649747
Lunec J., Herbert K., Blount S., Griffiths H.R., Emery P. (1994) 8-Hydroxydeoxyguanosine. A marker of oxidative DNA damage in systemic lupus erythematosus. FEBS Lett. 348, 131–138. https://doi.org/10.1016/0014-5793(94)00583-4
Collins L.V., Hajizadeh S., Holme E., Jonsson I.M., Tarkowski A. (2004) Endogenously oxidized mitochondrial DNA induces in vivo and in vitro inflammatory responses. J. Leukoc. Biol. 75, 995–1000. https://doi.org/10.1189/jlb.0703328
Oka T., Hikoso S., Yamaguchi O., Taneike M., Takeda T., Tamai T., Oyabu J., Murakawa T., Nakayama H., Nishida K., Akira S., Yamamoto A., Komuro I., Otsu K. (2012) Mitochondrial DNA that escapes from autophagy causes inflammation and heart failure. Nature. 485, 251–255. https://doi.org/10.1038/nature10992
West A.P., Khoury-Hanold W., Staron M., Tal M.C., Pineda C.M., Lang S.M., Bestwick M., Duguay B.A., Raimundo N., MacDuff D.A., Kaech S.M., Smiley J.R., Means R.E., Iwasaki A., Shadel G.S. (2015) Mitochondrial DNA stress primes the antiviral innate immune response. Nature. 520, 553–557. https://doi.org/10.1038/nature14156
Jerke U., Rolle S., Purfürst B., Luft F.C., Nauseef W.M., Kettritz R. (2013) B2 integrin-mediated cell–cell contact transfers active myeloperoxidase from neutrophils to endothelial cells. J. Biol. Chem. 288, 12910–12919. https://doi.org/10.1074/jbc.M112.434613
Polanowska-Grabowska R., Wallace K., Field J.J., Chen L., Marshall M.A., Figler R., Gear A.R., Linden J. (2010) P-selectin-mediated platelet-neutrophil aggregate formation activates neutrophils in mouse and human sickle cell disease. Arterioscler. Thromb. Vasc. Biol. 30, 2392–2399. https://doi.org/10.1161/ATVBAHA.110.211615
Ye Z., Zhong L., Zhu S., Wang Y., Zheng J., Wang S., Zhang J., Huang R. (2019) The P-selectin and PSGL-1 axis accelerates atherosclerosis via activation of dendritic cells by the TLR4 signaling pathway. Cell Death Dis. 10, 507. https://doi.org/10.1038/s41419-019-1736-5
Bengtsson T., Zalavary S., Stendahl O., Grenegard M. (1996) Release of oxygen metabolites from chemoattractant-stimulated neutrophils is inhibited by resting platelets: role of extracellular adenosine and actin polymerization. Blood. 87, 4411–4423.
Gupta A.K., Giaglis S., Hasler P., Hahn S. (2014) Efficient neutrophil extracellular trap induction requires mobilization of both intracellular and extracellular calcium pools and is modulated by cyclosporine A. PLoS One. 9, e97088. https://doi.org/10.1371/journal.pone.0097088
Bagur R., Hajnoczky G. (2017) Intracellular Ca2+ sensing: its role in calcium homeostasis and signaling. Mol. Cell. 66, 780–788. https://doi.org/10.1016/j.molcel.2017.05.028
Zhai T.Y., Cui B.H., Zou L., Zeng J.Y., Gao S., Zhao Q., Wang Y., Xie W.L., Sun Y.H. (2017) Expression and role of the calcium-sensing receptor in rat peripheral blood polymorphonuclear neutrophils. Oxid. Med. Cell. Longev. 2017, 3869561. https://doi.org/10.1155/2017/3869561
Itakura A., McCarty O.J. (2013) Pivotal role for the mTOR pathway in the formation of neutrophil extracellular traps via regulation of autophagy. Am. J. Physiol. Cell. Physiol. 305, C348–C54. https://doi.org/10.1152/ajpcell.00108.2013
Pathak T., Trebak M. (2018) Mitochondrial Ca2+ signaling. Pharmacol. Ther. 192, 112–123. https://doi.org/10.1016/j.pharmthera.2018.07.001
Hidalgo M.A., Carretta M.D., Teuber S.E., Zarate C., Carcamo L., Concha I.I., Burgos R.A. (2015) fMLP-induced IL-8 release is dependent on NADPH oxidase in human neutrophils. J. Immunol. Res 2015, 120348. https://doi.org/10.1155/2015/120348
Teng X., Liu Z., Wang H., Ye S. (2016) Neutrophil extracellular trap mitochondrial DNA and its autoantibody in systemic lupus erythematosus and a proof-of-concept trial of metformin. Arthritis Rheumatol. 68, 3043. https://doi.org/10.1002/art.39864
Rena G., Hardie D.G., Pearson E.R. (2017) The mechanisms of action of metformin. Diabetologia. 60, 1577–1585. https://doi.org/10.1007/s00125-017-4342-z
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


