Молекулярная биология, 2021, T. 55, № 6, стр. 1045-1056
miRNA-16 как внутренний контроль в исследованиях рака молочной железы: систематический обзор и мета-анализ
H. N. N. Thu a, H. T. N. Vy a, T. N. N. Thanh a, D. T. N. Giang a, T. N. Nhan a, N. P. Hoang a, T. N. Hue b, *
a Vietnam National University
70000 Ho Chi Minh City, Vietnam
b Department of Physiology and Animal Biotechnology, Faculty of Biology and Biotechnology, University of Science
70000 Ho Chi Minh City, Vietnam
* E-mail: nthue@hcmus.edu.vn
Поступила в редакцию 12.12.2020
После доработки 10.02.2021
Принята к публикации 24.02.2021
Аннотация
Количественная полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР) служит основным методом в количественном определении микроРНК. Обычно данные количественной ОТ-ПЦР нормализуют по референсным генам. Хотя микроРНК используют в диагностике и определении подтипов рака молочной железы (РМЖ), в различных исследованиях показано нарушение их регуляции при раке, из чего следует сделать вывод о некорректности использования микроРНК в качестве референсных генов. В обзоре проанализирован профиль экспрессии микроРНК miR-16 и предложены подходы к нормализации данных количественной ОТ-ПЦР при РМЖ. С использованием данных в выбранных рецензируемых работах определена разница в уровнях содержания miR-16 между пациентами с РМЖ и здоровыми людьми из контрольной группы, рассчитана стандартизированная разность средних (SMD) и применен тест χ2. Полученные значения: отрицательное для SMD (‒0.56) и 62.62 (p-value = 0.05) для χ2 ‒ показатели дерегуляции экспрессии miR-16 при РМЖ. Высокая вариабельность значений стабильности (SV) при оценке уровней miR-16 подтвердила некорректность ее использования в качестве референсного гена при РМЖ. Комбинация miR-16 и miR-425 охарактеризована как более надежный эндогенный контроль.
ВВЕДЕНИЕ
За последние несколько лет среди всех онкологических заболеваний рак молочной железы (РМЖ) занимает второе место как ведущая причина женской смертности. Показатель смертности женщин от РМЖ составляет примерно 1 : 38 (2.6%) [1]. Вероятность того, что у женщины будет диагностирован РМЖ, составляет 1 : 8 (13%), а каждая 39 женщина (3%) умирает от этого заболевания [2]. Несмотря на то, что за последние десятилетия общий процент женщин с РМЖ не изменился, среди афроамериканок, азиаток и женщин тихоокеанского региона этот показатель вырос [3]. Усовершенствование методов ранней диагностики РМЖ позволит оптимизировать стратегии лечения этого заболевания. Считается, что уровни определенных микроРНК могут быть использованы в качестве биомаркеров для ранней диагностике РМЖ.
История микроРНК началась в 1993 г., когда она была впервые обнаружена как часть группы регуляторных генов у Caenorhabditis elegans (см. обзор [4]). В дальнейших исследованиях показали, что первичные микроРНК транскрибируются с последовательностей ДНК в ядре, а затем процессируются в предшественники и зрелые микроРНК. Зрелые варианты микроРНК представляют собой короткие некодирующие одноцепочечные последовательности РНК, обычно длиной 19–23 нуклеотида. Выполняя регуляторную функцию, они связываются с РНК-индуцируемым комплексом сайленсинга (RISC) [5]. Связываясь с 3'-нетранслируемой областью (3'-UTR) определенных мРНК, комплекс вызывает либо ее деградацию мРНК, либо ингибирование трансляции. Одна микроРНК может привести к инактивации сотен генов. Они регулируют клеточную пролиферацию, дифференцировку, апоптоз и обмен глюкозы, холестерина и железа [4].
Поскольку микроРНК играют важную роль в нормальном развитии животных, нарушение их экспрессии “открывает окно” в патофизиологию многих заболеваний человека, в том числе онкологических [6]. В большинстве исследованных злокачественных опухолей обнаружено изменение профилей экспрессии микроРНК по сравнению теми же тканями здоровых людей, что позволяет считать микроРНК потенциальными биомаркерами для диагностики рака, прогноза течения и оптимизации схем лечения онкологических больных [6]. Так, первое сообщение о роли микроРНК в канцерогене относится к открытию потери гена miR-15a/16-1 при B-клеточном хроническом лейкозе [6].
Возможность использования микроРНК при изучении рака и, конечно РМЖ, зависит от надежности количественной оценки их экспрессии. Методы детекции микроРНК включают нозернблоттинг [7], проточную цитометрию с использованием гранул [8] и технологию микрочипов [9]. Количественная ПЦР с обратной транскрипцией (ОТ-ПЦР) стала наиболее широко используемой технологией для количественной оценки микроРНК, благодаря высокой чувствительности, широкому динамическому диапазону и низким требованиям к матрице [10].
Независимо от используемого метода, нормализация данных – ключевой этап к получению точной и надежной количественной оценки уровня экспрессии генов [11]. Вариации, включая различия в количестве исходного образца, извлечении РНК, целостности РНК и эффективности синтеза кДНК, неизбежно возникают в ходе многостадийного процесса количественной ОТ-ПЦР [11]. Использование внутренних референсных генов считается наиболее предпочтительным подходом к нормализации данных [12, 13]. Эти целевые последовательности должны иметь одинаковые вариации в процессе количественной оценки. Следовательно, успех количественного анализа определяется выбором адекватного контрольного гена [11].
miR-16 широко используют в качестве референсного гена в исследованиях рака, включая РМЖ. Однако экспрессия этой микроРНК нарушается при различных типах рака. В miR16 9-нуклеотидная якорная область нацелена на 3'-UTR различных генов, включая антиапоптотический белок BCL2. Кроме того, гены, вовлеченные в контроль перехода между G1/S-фазами клеточного цикла, такие как CCND1 (циклин D1), CCND3 (циклин D3), CCNE1 (циклин E1) и CDK6 (циклинзависимая киназа 6) [14, 15], и гены сигнального пути Wnt, например WNT3A [15], также служат мишенями miR-16. Следовательно, miR-16 регулирует клеточный цикл, стимулирует апоптоз клеток и подавляет их туморогенез [16].
Во многих исследованиях выявлена высокая стабильность уровня miR-16 при различных видах онкологических и других заболеваний, что позволяет рассматривать ее в качестве возможной референсной микроРНК. Однако miR-16 используется также и в качестве биомаркера для диагностики различных злокачественных опухолей человека. Следовательно, есть противоречие и его необходимо разрешить.
В обзоре на основании анализа опубликованных в научной литературе данных подробно рассмотрен профиль экспрессии miR-16 при РМЖ, оценена его пригодность для использования в качестве внутреннего контроля для нормализации результатов количественной ПЦР и предложен возможный подход к нормализации данных с использованием референсных генов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Поиск публикаций. Поиск работ, опубликованных до 2020 года, проводили в базах данных PubMed, Embase и ScienceDirect с использованием следующих ключевых слов: “microRNA 16” OR “miRNA-16” OR “mir-16” OR “mir16” AND “expression” OR “reference gene” OR “control gene” OR “internal control” OR “housekeeping” OR “deregulation” OR “biomarker” AND “breast cancer” OR “breast neoplasm”. Последний поиск проводили 11 апреля 2020 года.
Критерии включения и исключения. Исследования, включенные в мета-анализ, удовлетворяли следующим критериям: (1) оценка экспрессии miR-16 при РМЖ; (2) дизайн эксперимента по типу опыт-контроль; (3) описаны на английском языке; (4) наличие размера выборки и (AND) значения Cq или (OR) значения стабильности. Исследования исключали из анализа по следующим критериям: (1) обзорная статья, мета-анализ, реферат или материалы конференции; (2) дублированные публикации; (3) исследования на животных; (4) исследования без схемы опыт-контроль; oценка BIOCROSS меньше 7.
Сбор данных. Данные извлекали из каждого подходящего исследования и проверяли вручную. Затем для каждого подходящего исследования записывали следующие элементы: первый автор, год публикации, страна, этническая принадлежность, размер выборки и средний возраст субъектов в опытной и контрольной группах, тип злокачественной опухоли, источник контрольных образцов, значение Cq или показатели стабильности в случае опытной и контрольной групп.
Оценка качества. Контрольный список вопросов BIOCROSS применяли при оценке качества каждого исследования, включенного в мета-анализ. BIOCROSS ‒ это метод выбора при проверке качества перекрестных исследований биомаркеров [17]. В связи с тем, что в анализ вошли также исследования по эндогенному контролю, ко всем видам перекрестных анализов применяли только первые семь пунктов опросника. Учитывали три “проблемы при рассмотрении” (IC). При наличии всех трех исследование получало оценку “2”; если одна или две проблемы не рассматривались, выставляли оценку “1”, а при отсутствии упоминания каких-либо проблем ‒ оценку “0”. Таким образом, работа могла получить максимальную оценку 14 баллов.
Статистический анализ. Уровень экспрессии miR-16 в обозначениях Cq, стандартного отклонения и размера выборки получали и использовали при определении различий между пациентами с РМЖ (опытная группа) и без (контрольная группа). Модель случайных эффектов с обратной дисперсией применяли при определении стандартизированной разницы средних (SMD) и значения критерия χ2, а неоднородность между исследованиями выявляли с помощью статистики I2. Все статистические анализы выполняли с использованием программного обеспечения RevMan v5.3 (The Nordic Cochrane Center, The Cochrane Collaboration, 2014; Великобритания) и программного обеспечения Microsoft Excel.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Характеристики отобранных исследований
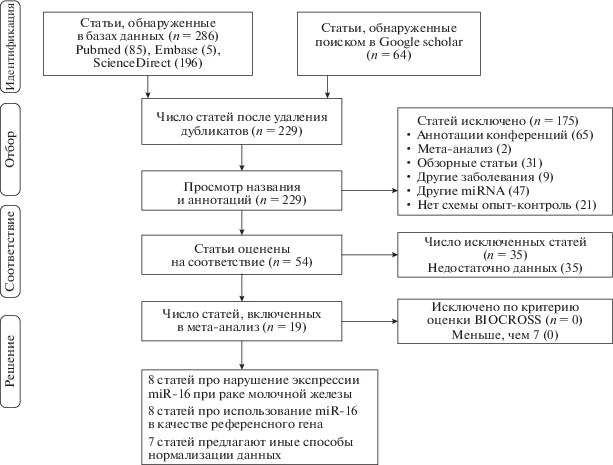
Подходящие исследования отбирали по схеме, представленной на рис. 1. По заголовкам и аннотациям из различных источников данных обнаружили в общей сложности 350 статей. Далее исключили 296 статей, так как они не соответствовали критериям: 121 статья оказалась дубликатом, 65 статей рефератами, 2 статьи мета-анализом, 31 обзорными статьями, 9 статей были связаны с исследованием других заболеваний, в 47 статьях рассматривали другие микроРНК и еще в 21 статье исследование не проводилось по схеме опыт-контроль. Оставшиеся 54 работы изучали детально, после чего еще 35 публикаций исключили, так как содержащихся в них данных было недостаточно. В итоге до финала “дошло” 19 работ [14, 15, 18‒34].
Рис. 1.
Блок-схема определения подходящих исследований для мета-анализа экспрессии miR-16 при РМЖ. В ходе поиска в базах данных и других источниках изначально обнаружили 350 статей. Затем в процессе отбора по различным критериям исключили 331 статью. В итоге мета-анализ выполнен на наборе из 19 статей.
miR-16 в качестве референсного гена в исследованиях РМЖ
miR-16 рекомендуется в качестве подходящего референсного гена в различных исследованиях РМЖ, так как экспрессия этой микроРНК стабильна и не различается между раковыми и нормальными клетками [14]. В общей сложности в 8 работах, рассмотренных в этом обзоре, использовали miR-16 в таком формате (табл. 1).
Таблица 1.
Основные характеристики работ, использующих MIR16 в качестве референсного гена при РМЖ
| IDa | Страна | Этническая принад-лежность | Размер выборки | Средний возраст | Тип рака | Контроль | Экспрессия miR-16 | Образец | Оценка BIOCROSS | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| опыт | конт-роль | опыт | конт-роль | ||||||||
| [14] | Ирландия | Европейская | 31 | 5 | NAb | РМЖ | Здоровые ткани | Без отличий | Ткань | 6 | |
| [15] | Ирландия | Европейская | 50 | 30 | 56.17 | 49.65 | РМЖ | Здоровые люди | Без отличий | Кровь | 9 |
| [19] | Ирландия | Европейская | 83 | 63 | 55.1 | 52.1 | РМЖ | Здоровые люди | Без отличий | Кровь | 9 |
| [20] | Америка | Европейская, Африканская, Американская | 13 | 8 | NA | РМЖ | Здоровые люди | Без отличий | Кровь | 6 | |
| [21] | Китай | Азиатская | 30 | 20 | 56 | 53 | РМЖ | Здоровые люди | Без отличий | Сыворотка | 8 |
| [22] | Китай | Азиатская | 21 | 30 | 41 | 55 | РМЖ | Здоровые люди | Без отличий | Кровь | 9 |
| [23] | Австрия | Европейская | 16 | 41 | Одинаковый | Метастазы | Первичная опухоль | Без отличий | Ткань | 6 | |
| [24] | Америка | Европейская | 10 | 12 | Одинаковый | РМЖ | Люди без опухолей | Без отличий | Плазма крови | 6 | |
В исследовании Davoren и соавт. [14] 2008 года miR-16 идентифицирована как единственная наиболее стабильно экспрессируемая микроРНК ‒ с M-значением GeNorm 1.191. miR-16 также выбрана из 15 наиболее стабильно экспрессируемых микроРНК в 40 типах нормальных тканей человека [14]. Более того, экспрессия miR-16 не различается в клетках первичной опухоли и ее метастазов [23]. Сообщалось, что уровень экспрессии и воспроизводимость его оценки для miR-16 стабильны в 226 образцах периферической крови [19]. В 2013 McDermott и др. [15] сравнили использование miR-16 в качестве эндогенного контроля с другими кандидатами, включая U6 ‒ общий эндогенный контроль при РМЖ. Авторы выявили значительные колебания в уровнях содержания U6, в то время как содержание miR-16 оставалось относительно стабильным. Уровни большинства сывороточных микроРНК изменялись после многократного замораживания и оттаивания; в то время как miR-16 не изменялся [21]. В другом исследовании [22] для четырех РНК: miR-16, miR-223, miR-let-7a и RNU6B, ‒ часто используемых в качестве контролей, определены уровни экспрессии в образцах РМЖ. Установлено, что let-7a и RNU6B не соответствуют критериям референсной РНК, тогда как для miR-16 обнаружен высокий уровень экспрессии и высокая стабильность.
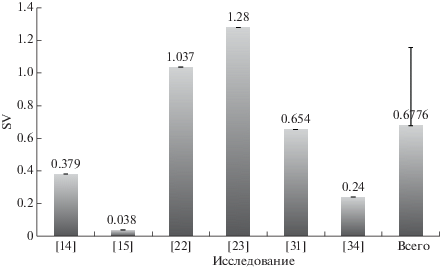
В шести работах приведены значения стабильности (SV) miR-16 с использованием программного обеспечения NormFinder, которое позволяет напрямую оценивать систематическую ошибку, вносимую при использовании исследуемого гена при нормализации данных. Эта программа учитывает внутри- и межгрупповые различия и по полученному значению стабильности определяет наилучшее сочетание двух генов. Чем ниже SV, тем более стабилен паттерн экспрессии референсного гена. Хотя во всех этих работах получены небольшие значения SV для miR-16, необходимо было оценить вариативность данных. По результатам, полученным в шести выбранных исследованиях, построили график для определения среднего и стандартного отклонения SV miR-16 (рис. 2). Установлено, что различия по стандартному отклонению составили 0.479, что составляло 71% от среднего значения (0.6776). В каждом отдельном исследовании уровень miR-16 был стабилен, однако при их сравнении для разных исследований различия были значительными.
Рис. 2.
Расчет среднего и стандартного отклонений по значениям SV для miR-16, полученным из 6 отобранных работ. Среднее значение и стандартное отклонение SV были рассчитаны и представлены на графике в виде числа над каждой полосой. Полоса “Всего” отображает среднее значение и стандартное отклонение “по всем исследованиям” (0.6776 ± 0.479).
Регуляция miR-16 нарушена при РМЖ
Изменение экспрессии miR-16 ясно наблюдали во многих исследованиях различных типов рака, а также в исследованиях неопухолевых заболеваний. РМЖ ‒ одно из самых распространенных онкологических заболеваний с нарушенной регуляцией miR-16. В рассматриваемых далее восьми работах проанализированы связанные с раком паттерны экспрессии miR-16 (табл. 2).
Таблица 2.
Основные характеристики работ, определяющих изменение содержания miR-16 при РМЖ
| IDa | Страна | Этническая принадлеж-ность | Размер выборки | Средний возраст | Тип рака | Контроль | Экспрессия miR-16 | Образец | Оценка BIOCROSS | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| опыт | конт-роль | опыт | контроль | ||||||||
| [18] | Германия | Европейская | 111 | 39 | 63 | 59 | РМЖ | Здоровые люди | Повышена | Плазма крови | 10 |
| [25] | Пакистан | Азиатская | 90 | 14 | 43 | NA | РМЖ | Здоровые люди | Повышена | Кровь | 11 |
| [26] | Китай | Азиатская | 67 | 95 | 55.7 | 55.1 | TNBCb | не-TNBC | Снижена | Плазма крови | 10 |
| [27] | Китай | Азиатская | 260 | 170 | 59 | 58 | РМЖ | Здоровые люди | Повышена | Ткань | 11 |
| [28] | Китай | Азиатская | NA | NA | NA | NA | РМЖ | Здоровые люди | Повышена | Кровь | 6 |
| [29] | Америка | Европейская | 29 | 15 | 46 | 53.26 | РМЖ | Здоровые люди | Повышена | Сыворотка | 10 |
| [30] | Германия | Европейская | 111 | 46 | 56 | 63 | РМЖ | Здоровые люди | Повышена | Плазма крови | 11 |
| [31] | Китай | Азиатская | 84 | 96 | 54.00 + 10.30 | 51.04 + 12.80 | РМЖ | Здоровые люди | Повышена | Плазма крови | 12 |
В целом, уровень содержания miR-16 значительно повышен у пациентов с РМЖ по сравнению со здоровыми людьми. У пациентов с РМЖ, позитивным на рецепторы эстрогенов (ER+) и прогестерона (PR+), по сравнению с пациентами с ER‒, PR‒ и трижды негативным РМЖ (TNBC), уровни экзосомной miR-16 повышены [18]. На уровень miR-16 у пациентов с РМЖ влияют стадии заболевания. Так, у пациентов с инвазивной внутрипротоковой карциномой III стадии регистрировали повышенную экспрессию miR-16 [25]. Показано, что уровень этой микроРНК значительно увеличивается у пациентов, не имеющих метастазов, и снижается до нормального уровня при появлении метастазов в лимфатических узлах. В отличие от других проверенных микроРНК, химиотерапия не влияла на уровень miR-16 в плазме пациентов с РМЖ [30]. В одном из исследований, проведенном с использованием 30 образцов плазмы, показано, что уровень miR-16 не зависит от пола [27]. Интересно, что H. Appaiah и др. [29] еще в 2011 году обнаружили значительное повышение содержания miR-16 в сыворотке реконвалесцентов, у которых ранее был диагностирован РМЖ, по сравнению со здоровыми индивидами. Повышенный уровень miR-16 наблюдали также у пациентов с активным метастатическим процессом [29]. Кроме того, показано нарушение регуляции miR-16 при TNBC. На основании этих данных можно говорить о возможной связи между низким уровнем miR-16 и опухолевой нагрузкой, что в перспективе можно использовать в качестве диагностического маркера TNBC. Также в плазме прооперированных пациентов в значительной степени восстанавливается уровень miR-16 [26].
Есть сообщения об изменении паттерна экспрессии miR-16 при РМЖ. Модель случайных эффектов с обратной дисперсией (с использованием значения Cq, стандартного отклонения и размера выборки) использована при определении значения SMD и критерия χ2. SMD иногда используют как синоним термина “размер эффекта”. Как правило, лекарственное средство сравнивают с плацебо или другим активным лекарственным препаратом. Нулевое значение SMD означает, что эффект нового препарата и плацебо эквивалентен. Если улучшение связано с более высокими баллами по определению исхода, SMD больше нуля указывает на степень эффективности лекарственного средства по сравнению с плацебо, а SMD меньше нуля указывает на степень, в которой лечение менее эффективно, чем плацебо [35]. Кроме того, критерий χ2 применяется при проверке различий между классами в популяции. Если наблюдаемая статистика критерия χ2 превышает критическое значение, нулевая гипотеза будет отклонена, что означает наличие различия между исследуемыми группами.
Среднее значение SMD ‒0.52 [‒1.25, 0.22] означает, что существует значимая разница в уровнях экспрессии miR-16 между образцами пациентов с РМЖ и контрольными образцами здоровых людей. С точки зрения критерия χ2, полученное значение F составляет 62.62, что больше критического, равного 12.59 (степень свободы (DF) = 6, p-value = 0.05), а p-value ‒ менее 0.00001 (табл. 3). Полученные данные подтверждают, что существует статистически значимая разница в уровне экспрессии miR-16 между пациентами с РМЖ и здоровыми людьми. Следовательно, при РМЖ, действительно, нарушена регуляция miR-16, а значит ее уровень нельзя использовать в качестве референсного при этом типе рака.
Поиск других возможных эндогенных контролей
Помимо дерегуляции miR-16 при РМЖ есть и другие факты, указывающие на то, что miR-16 не подходит в качестве референсного гена. Эритроциты – это неиссякаемый источник miR-16. Неосторожная экстракция ведет к их гемолизу, что приводит к искусственному повышению уровня miR-16 в плазме [36]. McDonald др. [37] сообщали о том, что уровень циркулирующей эндогенной miR-16 выше в образцах плазмы, чем в образцах сыворотки, из-за гемолиза, что приводит к увеличению величины Cq на 1‒2 (т.е. соответствует увеличению числа копий в 2‒4 раза). Это значит, что при использовании эндогенной miR-16 в качестве внутреннего контроля могут возникать ошибки при нормализации данных. Таким образом, эту микроРНК нельзя рассматривать в качестве идеального внутреннего контроля без строгого мониторинга гемолиза [34].
Shen и др. [32] исследовали возможность использования пяти микроРНК: miR-93, miR-103, miR-191, miR-423-3p и miR-425 ‒ в качестве возможных референсных микроРНК при нормализации данных. Оказалось, что miR-93 экспрессируется наиболее стабильно и поэтому была выбрана в качестве референсной микроРНК. Ранее Stückrath и др. [30] показали, что экспрессия miR-16 аберрантна и поэтому в качестве референса для нормализации данных количественной ОТ-ПЦР выбрали miR-1207. Выбор был обусловлен тем, что для этой микроРНК был зарегистрирован стабильный уровень экспрессии с отсутствием различий между всеми сравниваемыми группами, а также наименьший коэффициент вариаций в популяциях. Однако в других исследованиях сообщалось о нарушение регуляции обеих микроРНК [18, 38]. Таким образом, выбор гена “домашнего хозяйства” для использования в качестве референсного при нормализации данных ‒ задача не из легких.
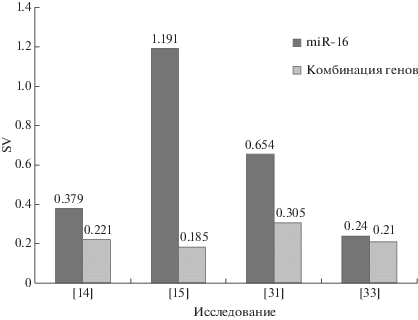
Необходим более точный подход при нормализации данных количественной ОТ-ПЦР. В целях повышения точности анализа предложено использовать комбинацию референсных генов (табл. 4). McDermott и др. [15] еще в 2013 году установили, что комбинация из двух микроРНК: miR-16 и miR-425 ‒ в качестве эндогенного контроля дает более точные и надежные результаты, чем любые методы, использующие микроРНК или U6 по отдельности. Использование этого подхода позволило выявить паттерн дерегуляции целевых микроРНК, дифференциально экспрессирующихся при раке и в контроле, в образцах крови человека [16]. miR-16 продолжают использовать в сочетании с другими микроРНК, как например в исследовании Davoren и др. [14], где на основании результатов NormFinder указали на let-7a и miR-16 как наиболее стабильную пару эндогенных контролей.
Таблица 4.
Основные характеристики исследований, посвященных оценке эндогенных контролей РМЖ
| IDa | Страна | Этническая принадлеж-ность | Размер выборки | Средний возраст | Рак | Контроль | Референсная miРНК | Стабиль-ность | Образец | Оценка BIOCROSS | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| опыт | конт-роль | опыт | конт-роль | |||||||||
| [32] | Америка | Европейская | 87 | 35 | NA | РМЖ | Здоровые люди | miR-93 | NA | Плазма крови, моча, ткань | 11 | |
| [30] | Германия | Европейская | 111 | 46 | 56 | 63 | РМЖ | Здоровые люди | miR-1207 | NA | Плазма крови | 11 |
| [15] | Ирландия | Европейская | 50 | 30 | 56.17 | 49.65 | РМЖ | Здоровые люди | miR-16 + miR-425 | 0.184 | Кровь | 9 |
| [14] | Ирландия | Европейская | 31 | 5 | NA | РМЖ | Здоровые люди | miR-16 + let-7a | 0.221 | Ткань | 6 | |
| [33] | Германия | Европейская | 16 | 16 | NA | Первичный РМЖ | Метастазы в лимфоузлах | U48 + let-7a | 0.21 | Ткань | 10 | |
| [31] | Китай | Азиатская | 84 | 96 | 54.00 + +10.30 | 51.04 + + 12.80 | РМЖ | Здоровые люди | miR-484 + miR-191 | 0.305 | Плазма крови | 12 |
| [34] | Китай | Азиатская | 25 | 20 | 52 | 50.5 | РМЖ | Здоровые люди | miR-103a + miR-132 | 0.44 | Сыворотка | 11 |
Raychaudhuri и др. [33] проанализировали возможные референсные гены в различных образцах первичного РМЖ и метастазов в лимфатические узлы, используя miR-16, let-7a, U48, U44 ‒ как по-отдельности, так и в различных комбинациях пар микроРНК. Они установили, что комбинация U48 и let-7a имеет самое низкое значение стабильности: SV = 0.21. В экспериментах Hu и соавт. [31] лучшей комбинацией в качестве эндогенного контроля при детекции сывороточной микроРНК, по крайней мере для наиболее распространенных видов рака, оказалась пара miR-484 и miR-191; а Zhang и соавт. [34] выявили самую высокую стабильность в комбинация miR-103a и miR-132.
Сравнение miR-16 и новых комбинаций контрольных генов проводили путем вычисления SV (рис. 3). Сочетание miR-16 с другими контрольными генами позволяет снизить SV. Например, SV для miR-16 и miR-425, рассчитанное Davoren и др. [14], составило 0.185, что на 85% ниже, чем для только miR-16. Сочетание miR-16 с let-7a также снижало SV до 0.221, или на 42% по сравнению с использованием только miR-16 [15]. В других исследованиях [31, 33] использовали другие комбинации, включая U48 и let 7a, miR-484 и miR-191, а также miR-103a и miR-132. Во всех случаях полученные значения SV были ниже, чем для одной miR-16.
Источники неоднородности результатов
Тест на неоднородность результатов использует статистику I2, которая количественно определяет величину дисперсии и показывает, в какой степени результаты исследований согласованы (диапазон от 0 до 100%). Разброс значений I2 не зависит от размера выборки и от числа анализируемых при мета-анализе работ. Статистика I2 описывает процент изменчивости при оценке эффекта, которая связана с неоднородностью, а не с ошибкой создания выборки [39]. Низкое значение p свидетельствует о неоднородности эффектов медицинского вмешательства. Чем выше значение I2, тем выше степень неоднородности результатов анализа. Как следует из данных, представленных в табл. 3, высокое значение I2 (90%) указывает на высокую неоднородность результатов выполненного мета-анализа.
Исследования, включенные в обзор, различались по многим аспектам. Первая причина может быть связана с различиями в методах измерения уровня содержания miR-16. В большинстве исследований использовали образцы плазмы/сыворотки крови, а в других микроРНК выделяли из образцов тканей. Стадии РМЖ также могут быть источником неоднородности. Образцы получены на разных стадиях РМЖ, которые, как установлено ранее, имеют разные паттерны микроРНК. В большинстве работ отсутствует информация о предыстории лечении и времени последующего наблюдения. Результаты этих исследований были представлены различными способами. В некоторых работах приведены значения Ct и стандартного отклонения (SD), а в других использована кратность изменений или результаты представлены в терминах квартильного диапазона, что усложняет вычисление Ct в ходе мета-анализа.
ЗАКЛЮЧЕНИЕ
В проведенном исследовании дано общее представление о характере экспрессии miR-16 и проанализирована возможность использовать эту микроРНК в качестве эндогенного контроля при РМЖ. Хотя в различных исследованиях miR-16 использована для нормализации данных количественной ОТ-ПЦР, выяснилось, что при РМЖ ее экспрессия нарушается. Кроме того, поскольку miR-16, скорее всего, высвобождается из эритроцитов посредством гемолиза, уровни ее содержания в плазме могут быть искусственно завышены во время выделения. Объединение нескольких микроРНК на одной панели может стать полезным инструментом в таких экспериментах ‒ как например, комбинация miR-16 и miR-425, которую использовали Mcdermott и соавт. [15]. Точность этого комбинированного эндогенного контроля показана впоследствии в исследованиях других авторов. Задача найти идеальный ген “домашнего хозяйства” в качестве внутреннего контроля может быть нерешаемой, однако стратегия комбинированного эндогенного контроля позволяет повысить точность анализа количественной ОТ-ПЦР при диагностике РМЖ.
Авторы выражают благодарность Oncology Hospital HCMC за участие в сборе данных.
Исследование выполнено при поддержке Vietnam National University, Ho Chi Minh City (VNU-HCM; grant No. 562-2020-18-02).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
American Cancer Society. (2020) How common is breast cancer? https://www.cancer.org/cancer/breast-cancer/about/how-common-is-breast-cancer.html
Centers for Disease Control and Prevention. (2019) Basic information about breast cancer. https://www.cdc.gov/cancer/breast/basic_info/index.htm
O’Brien J., Hayder H., Zayed Y., Peng C. (2018) Overview of microRNA biogenesis, mechanisms of actions, and circulation. Front. Endocrinol. 9, 402. https://doi.org/10.3389/fendo.2018.00402
MacFarlane L.A., Murphy P.R. (2010) MicroRNA: biogenesis, function and role in cancer. Curr. Genomics. 11(7), 537–561. https://doi.org/10.2174/138920210793175895
Tan W., Liu B., Qu S., Liang G., Luo W., Gong C. (2018) MicroRNAs and cancer: key paradigms in molecular therapy. Oncol. Lett. 15(3), 2735‒2742. https://doi.org/10.3892/ol.2017.7638
Lu J., Getz G., Miska E.A., Alvarez-Saavedra E., Lamb J., Peck D., Sweet-Cordero A., Ebert B.L., Mak R.H., Ferrando A.A., Downing J.R., Jacks T., Horvitz H.R., Golub T.R. (2005) MicroRNA expression profiles classify human cancers. Nature. 435(7043), 834–838. https://doi.org/10.1038/nature03702
Miska E.A., Alvarez-Saavedra E., Townsend M., Yoshii A., Šestan N., Rakic P., Constantine-Paton M., Horvitz H.R. (2004) Microarray analysis of microRNA expression in the developing mammalian brain. Genome Biol. 5(9), R68. https://doi.org/10.1186/gb-2004-5-9-r68
Chen C. (2005) Real-time quantification of microRNAs by stem-loop RT-PCR. Nucleic Acids Res. 33(20), e179–e179. https://doi.org/10.1093/nar/gni178
Li W., Ruan K. (2009) MicroRNA detection by microarray. Anal. Bioanal. Chem. 394(4), 1117‒1124. https://doi.org/10.1007/s00216-008-2570-2
Bustin S. (2002) Quantification of mRNA using real-time reverse transcription PCR (RT-PCR): trends and problems. J. Mol. Endocrinol. 29(1), 23–39. https://doi.org/10.1677/jme.0.0290023
Nolan T., Hands R.E., Bustin S.A. (2006) Quantification of mRNA using real-time RT-PCR. Nat. Protoc. 1(3), 1559–1582. https://doi.org/10.1038/nprot.2006.236
Aqeilan R.I., Calin G.A., Croce C.M. (2010) miR-15a and miR-16-1 in cancer: discovery, function and future perspectives. Cell Death Differ. 17(2), 215–220. https://doi.org/10.1038/cdd.2009.69
Linsley P.S., Schelter J., Burchard J., Kibukawa M., Martin M.M., Bartz S.R., Johnson J.M., Cummins J.M., Raymond C.K., Dai H.Y., Chau N., Cleary M., Jackson A.L., Carleton M., Lim L. (2007) Transcripts targeted by the microRNA-16 family cooperatively regulate cell cycle progression. Mol. Cell. Biol. 27(6), 2240–2252. https://doi.org/10.1128/MCB.02005-06
Davoren P.A., McNeill R.E., Lowery A.J., Kerin M.J., Miller N. (2008) Identification of suitable endogenous control genes for microRNA gene expression analysis in human breast cancer. BMC Mol. Biol. 9(1), 76. https://doi.org/10.1186/1471-2199-9-76
McDermott A.M., Kerin M.J., Miller N. (2013) Identification and validation of miRNAs as endogenous controls for RQ-PCR in blood specimens for breast cancer studies. PLoS One. 8(12), e83718. https://doi.org/10.1371/journal.pone.0083718
Liu Q., Fu H., Sun F., Zhang H., Tie Y., Zhu J., Xing R., Sun Z., Zhenget X. (2008) miR-16 family induces cell cycle arrest by regulating multiple cell cycle genes. Nucleic Acids Res. 36(16), 5391.
Wirsching J., Graßmann S., Eichelmann F., Harms L.M., Schenk M., Barth E., Berndzen A., Olalekan M., Sarmini L., Zubere H., Aleksandrova K. (2018) Deve-lopment and reliability assessment of a new quality appraisal tool for cross-sectional studies using biomarker data (BIOCROSS). BMC Med. Res. Methodol. 18(1), 122. https://doi.org/10.1186/s12874-018-0583-x
Ni Q., Stevic I., Pan C., Müller V., Oliveira-Ferrer L., Pantel K., Schwarzenbach H. (2018) Different signatures of miR-16, miR-30b and miR-93 in exosomes from breast cancer and DCIS patients. Sci. Rep. 8(1), 12974. https://doi.org/10.1038/s41598-018-31108-y
Heneghan H.M., Miller N., Kelly R., Newell J., Kerin M.J. (2010) Systemic miRNA-195 differentiates breast cancer from other malignancies and is a potential biomarker for detecting noninvasive and early stage disease. Oncologist. 15(7), 673–682. https://doi.org/10.1634/theoncologist.2010-0103
Zhu W., Qin W., Atasoy U., Sauter E.R. (2009) Circulating microRNAs in breast cancer and healthy subjects. BMC Res. Notes. 2(1), 89. https://doi.org/10.1186/1756-0500-2-89
Xiang M., Zeng Y., Yang R., Xu H., Chen Z., Zhong J., Xie H., Xu Y., Zeng X. (2014) U6 is not a suitable endogenous control for the quantification of circulating microRNAs. Biochem. Biophys. Res. Commun. 454(1), 210–214. https://doi.org/10.1016/j.bbrc.2014.10.064
Hu J., Wang Z., Liao B.Y., Yu L., Gao X., Lu S., Wang S., Dai Z., Zhang X., Chen Q., Qiu S.-J., Wu Y., Zhu H., Fan J., Zhou J., Wang J. (2014) Human miR-1228 as a stable endogenous control for the quantification of circulating microRNAs in cancer patients: miR-1228 as a control for quantifying circulating miRNAs. Int. J. Cancer. 135(5), 1187–1194. https://doi.org/10.1002/ijc.28757
Rinnerthaler G., Hackl H., Gampenrieder S., Hamacher F., Hufnagl C., Hauser-Kronberger C., Zehentmayr F., Fastner G., Sedlmayer F., Mlineritsch B., Greil R. (2016) miR-16-5p is a stably-expressed housekeeping microRNA in breast cancer tissues from primary tumors and from metastatic sites. Int. J. Mol. Sci. 17(2), 156. https://doi.org/10.3390/ijms17020156
Rice J., Roberts H., Rai S.N., Galandiuk S. (2015) Housekeeping genes for studies of plasma microRNA: a need for more precise standardization. Surgery. 158(5), 1345–1351. https://doi.org/10.1016/j.surg.2015.04.025
Usmani A., Shoro A.A., Shirazi B., Memon Z., Hussain M. (2017) miR-16: a novel hereditary marker in breast cancer and their offspring. J. Pak. Med. Assoc. 67(3), 5.
Shin V.Y., Siu J.M., Cheuk I., Ng E.K.O., Kwong A. (2015) Circulating cell-free miRNAs as biomarker for triple-negative breast cancer. Br. J. Cancer. 112(11), 1751–1759. https://doi.org/10.1038/bjc.2015.143
Ng E.K.O., Li R., Shin V.Y., Jin H.C., Leung C.P.H., Ma E.S.K., Pang R., Chua D., Chu K.-M., Law W.L., Law S.Y.K., Poon R.T.P., Kwong A. (2013) Circulating microRNAs as specific biomarkers for breast cancer detection. PLoS One. 8(1), e53141. https://doi.org/10.1371/journal.pone.0053141
Zhao Q., Deng S., Wang G., Liu C., Meng L., Qiao S., Shen L., Zhang Y., Lü J., Li W., Zhang Y., Wang M., Pestell R.G., Liang C., Yu Z. (2016) A direct quantification method for measuring plasma microRNAs identified potential biomarkers for detecting metastatic breast cancer. Oncotarget. 7(16), 21865–21874. https://doi.org/10.18632/oncotarget.7990
Appaiah H.N., Goswami C.P., Mina L.A., Badve S., Sledge G.W., Liu Y., Nakshatri H. (2011) Persistent upregulation of U6:SNORD44 small RNA ratio in the serum of breast cancer patients. Breast Cancer Res. 13(5), R86. https://doi.org/10.1186/bcr2943
Stückrath I., Rack B., Janni W., Jäger B., Pantel K., Schwarzenbach H. (2015) Aberrant plasma levels of circulating miR-16, miR-107, miR-130a and miR-146a are associated with lymph node metastasis and receptor status of breast cancer patients. Oncotarget. 6(15), 13387.
Hu Z., Dong J., Wang L.E., Ma H., Liu J., Zhao Y., Tang J., Chen X., Dai J., Wei Q., Zhang C., Shen H. (2012) Serum microRNA profiling and breast cancer risk: the use of miR-484/191 as endogenous controls. Carcinogenesis. 33(4), 828–834. https://doi.org/10.1093/carcin/bgs030
Shen J., Hu Q., Schrauder M., Yan L., Wang D., Me-dico L., Medico L., Guo Y., Yao S., Zhu Q., Liu B., Qin M., Beckmann M.W., Fasching P.A., Strick R., Johnson C.S., Ambrosone C.B., Zhao H., Liu S. (2014) Circulating miR-148b and miR-133a as biomarkers for breast cancer detection. Oncotarget. 5(14), 5284–5294. https://doi.org/10.18632/oncotarget.2014
Raychaudhuri M., Schuster T., Buchner T., Malinowsky K., Bronger H., Schwarz-Boeger U., Höfler H., Avril S. (2012) Intratumoral heterogeneity of microRNA expression in breast cancer. J. Mol. Diagn. 14(4), 376–384. https://doi.org/10.1016/j.jmoldx.2012.01.016
Zhang L., Xu Y., Jin X., Wang Z., Wu Y., Zhao D., Chen G., Li D., Wang X., Cao H., Xie Y., Liang Z. (2015) A circulating miRNA signature as a diagnostic biomarker for non-invasive early detection of breast cancer. Breast Cancer Res. Treat. 154(2), 423–434. https://doi.org/10.1007/s10549-015-3591-0
Faraone S.V. (2008) Interpreting estimates of treatment effects: implications for managed care. Pharm. Ther. 33(12), 700.
Leidner R.S., Li L., Thompson C.L. (2013) Dampening enthusiasm for circulating microRNA in breast cancer. PLoS One. 8(3), e57841. https://doi.org/10.1371/journal.pone.0057841
McDonald J.S., Milosevic D., Reddi H.V., Grebe S.K., Algeciras-Schimnich A. (2011) Analysis of circulating microRNA: preanalytical and analytical challenges. Clin. Chem. 57 (6), 833–840. https://doi.org/10.1373/clinchem.2010.157198
Hamam R., Hamam D., Alsaleh K., Kassem M., Zaher W., Alfayez M., Aldahmash A., Alajez N.M. (2017) Circulating microRNAs in breast cancer: novel diagnostic and prognostic biomarkers. Cell Death Dis. 8(9), e3045. https://doi.org/10.1038/cddis.2017.440
Higgins J.P., Thompson S.G. (2002) Quantifying hete-rogeneity in a meta-analysis. Stat. Med. 21(11), 1539–1558.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология