Молекулярная биология, 2022, T. 56, № 2, стр. 343-352
Физический базис функционирования белка-антифриза
Б. С. Мельник a, *, А. В. Финкельштейн a, b
a Институт белка Российской академии наук
142290 Пущино, Московская обл., Россия
b Биологический факультет Московского государственного университета им. М.В. Ломоносова
119234 Москва, Россия
* E-mail: bmelnik@phys.protres.ru
Поступила в редакцию 16.08.2021
После доработки 16.08.2021
Принята к публикации 31.08.2021
- EDN: QWVMPZ
- DOI: 10.31857/S0026898422020112
Аннотация
Белки-антифризы, экспрессируемые в холоднокровных организмах, мешают образованию льда в их телах и тем помогают им выживать при экстремально низких зимних температурах. Однако механизм действия этих белков все еще непонятен. Во всяком случае, он не сводится просто к понижению температуры сосуществования льда и воды. В данной работе, исследуя ледсвязывающий белок (мутантную форму белка-антифриза cfAFP из гусеницы Choristoneura fumiferana, зимующей в хвое), мы показали, что этот белок-антифриз вовсе не понижает температуру замерзания воды и, как ни парадоксально, даже повышает температуру плавления льда. С другой стороны, расчеты, основанные на теории кристаллизации, показывают, что при температурах 0°…–30°C лед может возникать только на контактирующих с водой стенках (особенно “рифленых”), но никак не в толще воды. Полученные нами факты позволяют по-новому взглянуть на роль белков-антифризов: их задача не в том, чтобы связываться с уже образовавшимися в организме кристалликами льда (как это принято полагать) и останавливать их рост, а в том, чтобы связываться с теми поверхностями, на которых могут возникнуть зародыши льда, и тем самым полностью ингибировать образование льда в переохлажденной воде или биологической жидкости.
Белки, связывающие лед (IBP), также называемые белками-антифризами (AFP), синтезируют различные организмы для выживания при отрицательных температурах. Эти белки впервые обнаружены в крови рыб, обитающих в арктических и антарктических водах, где температура падает до –2°С [1–3]. Механизм действия этих белков все еще непонятен [4, 5]. Обычно полагают, что IBP снижает температуру замерзания жидкостей организма на несколько градусов [6]. В ряде работах высказано предположение, что IBP связывают кристаллы льда и предотвращают их рост или влияют на форму кристаллов льда при повторяющихся циклах замерзания–оттаивания [7–9]. Анализируя литературные данные, можно также обратить внимание на то, что требуемая для предотвращения гибели клеток при небольших отрицательных температурах молярная концентрация IBP в сотни раз меньше, чем молярная концентрация соли или спирта, нужная для такого же снижения температуры замерзания [10, 11]. Один только этот факт наталкивает на мысль, что механизм действия AFP должен отличаться от механизма действия “обычных” антифризов типа низкомолекулярных спиртов и солей, которые, как известно, понижают химический потенциал воды пропорционально своей молярной концентрации, так что эти водорастворимые молекулы понижают химический потенциал воды в растворе сильнее, чем во льду [12], что приводит просто к понижению температуры точки термодинамического равновесия лед–вода.
В этой работе мы экспериментально показываем, что IBP, взятый сам по себе, не работает как антифриз, т.е. он не понижает ни температуру замерзания воды, ни температуру плавления льда; а теоретическое изучение процесса замерзания говорит о том, что при 0°…–30°C лед по кинетическим причинам не может возникнуть в толще воды, но на контактирующих с водой лед-связывающих стенках может; и именно блокировка этих стенок является наиболее вероятной функцией AFP.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В экспериментах с IBP мы использовали мутантную форму AFP ‒ cfAFP, названную нами mIBP83 [13]. Белок cfAFP из зимующей в хвое гусеницы Choristoneura fumiferana исследован ранее [14–16]. Оказалось, что mIBP83 [13] не снижает температуру замерзания воды и даже немного повышает температуру плавления льда (такое повышение ранее отмечено для AFP рыб [17]). Это заставило нас пересмотреть общепринятую точку зрения [6, 18], согласно которой IBP снижают температуру замерзания воды и биологических жидкостей, связываясь со льдом.
Выделение и очистка mIBP83 и mIBP83-GFP. Ранее нами спроектирована мутантная форма белка cfAFP из гусеницы Choristoneura fumiferana (далее в тексте ‒ mIBP83), в которой заменены некоторые из цистеинов. Кроме того, для экспериментов по связыванию с поверхностью льда спроектирован химерный белок, в котором небольшим линкером соединены mIBP83 и зеленый флуоресцентный белок GFP [13]. mIBP83 и mIBP83-GFP выделяют в мономерной форме стандартными методами в больших концентрациях без добавления восстанавливающих веществ [13].
Для экспрессии генов IBP использовали штамм-продуцент Escherichia сoli BL21 (DE3). Трансформацию компетентных клеток E. сoli проводили, используя плазмиду pET-22b, кодирующую целевой белок (mIBP83 или mIBP83-GFP). Биомассу культивировали в жидкой среде LB (“Amresco”, США) со следующим составом (на 1 л): триптон, дрожжевой экстракт, NaCl – 10, 5 и 10 г соответственно, NaOH (10 М) – 600 мкл. В качестве субстрат-специфичного маркера в среду добавляли канамицин, ген устойчивости к которому закодирован в целевой векторной плазмиде, в соотношении растительная среда : антибиотик – 1 : 100. Чтобы повысить выход целевого продукта, в клетки добавляли IPTG (изопропил-β-D-тиогалактопиранозид) до конечной концентрации 100 мM. Для разрушения клеток использовали гомогенизатор высокого давления. Все растворы приготовлены на основе дистиллированной и дионизованной воды.
Выделение белка из клеточного лизата штамма- продуцента E. сoli проводили последовательно с помощью гель-фильтрационной, ионообменной и гидрофобной хроматографии. Чистоту выделенных белковых препаратов анализировали с помощью электрофореза в 12%-ном ПААГ. Концентрацию mIBP83 определяли по поглощению при длине волны 280 нм, с учетом его коэффициента экстинкции (0.683). Концентрацию белков GFP и mIBP83-GFP определяли при длине волны 395 нм, соответствующей поглощению хромофора GFP.
Во всех экспериментах мы использовали вариант GFP ‒ Cycle3-GFP [19]. Cycle3-GFP (для краткости далее в статье GFP) хорошо сворачивается при 37°С (при экспрессии в клетках E. сoli), поэтому во многих работах этот белок используют в качестве “белка GFP дикого типа”. Кроме того, для этой работы важно то, что этот белок не димеризуется в нативных условиях при низких концентрациях (до 2 мг/мл) [20]. Это проверено методами седиментации и аналитической гель-хроматографии. С помощью гель-хроматографии также проверен химерный белок mIBP83-GFP. Белок выходил одним узким пиком, как и GFP, что свидетельствует о том, что он не димеризуется.
Приборы и материалы, использованные в работе. Эксперименты по замораживанию и плавлению льда проводили в установке, собранной из термостата, управляемого компьютером [13]. Измерение температуры проводили электронным термометром, относительная точность которого (повторяемость) составляет 0.01°С, а абсолютная точность после юстировки в области 0°С составляла 0.1°С. Растворы готовили на дистиллированной воде, фильтровали через фильтры “Corning Inc.” (Германия) 0.25 мкм и исследовали в пробирках объемом 250 мкл (“Eppendorf”, Германия). Эксперименты по плавлению и замораживанию растворов белков проводили при концентрации белка 0.6 мг/мл (что близко [11] к нативной концентрации cfAFP в гусенице Choristoneura fumiferana [11]), поскольку при таких же концентрациях cfAFP исследовали ранее [18].
В экспериментах по взаимодействию белка GFP-mIBP83 с поверхностью льда для возбуждения флуоресценции использовали трансиллюминатор VILBER ecx-f20.m (Франция).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Проверка способности mIBP83 связываться с поверхностью льда
Чтобы проверить связывание mIBP83 (мутантной формы AFP ‒ cfAFP) с поверхностью льда, поставили следующий эксперимент. Две одинаковые пробирки с буферным раствором (1.0 мл, 20 мM натрий-фосфатного буфера, pH7) замораживали при –20°С, затем выдерживали при комнатной температуре до тех пор, пока лед не начинал таять. Таким образом, в каждой пробирке был кусочек льда, окруженный водой. В одну пробирку добавляли раствор mIBP83-GFP, в другую ‒ GFP (в обоих случаях ‒ по 0.20 мл с концентрацией 2 мг/мл). Пробирки подсвечивали на трансиллюминаторе. Если mIBP83 в составе химерного белка mIBP83-GFP не утрачивает способности связываться с поверхностью льда, то он покроет плавающую в воде льдинку, и контур льдинки должен флуоресцировать более интенсивно, чем раствор. GFP не способен связываться со льдом, поэтому он должен равномерно окрасить раствор. На рис. 1 показаны фотографии такого эксперимента. Видно, что в пробирке с mIBP83-GFP светится в основном льдинка. Видны ее очертания. В пробирке с GFP контуры льда не видны ‒ светится раствор вокруг льдинки. Таким образом, можно сделать вывод, что mIBP83 связывается с поверхностью льда.
Рис. 1.
Связывание химерного белка mIBP83-GFP с поверхностью льда. В каждой пробирке есть небольшая льдинка. Слева на фотографии пробирка, в которую добавили раствор mIBP83-GFP, справа — раствор GFP. Пробирки подсвечивали снизу ультрафиолетовым светом. В пробирке с mIBP83-GFP светится в основном окрашенная прилипшим белком льдинка, в пробирке с GFP льдинка не заметна, поскольку не светится.

Проверка способности mIBP83 влиять на процесс замерзания воды
Чтобы проверить способность mIBP83 влиять на температуру замерзания воды, мы провели следующий эксперимент. В пробирку наливали 50, 100, 150 или 200 мкл раствора, в центр пробирки помещали щуп электронного термометра, пробирку закрывали и помещали в металлический держатель, по которому циркулировала охлаждающая жидкость термостата [13]. Термостат охлаждал пробирку, изменяя температуру линейно со скоростью 0.24 град/мин. Если в образце не происходит процессов теплопоглощения или тепловыделения, то температура в образце меняется линейно со временем с такой же скоростью, как и в термостате. При замерзании воды выделяется тепло, и температура образца повышается. Такой скачок температуры в момент замерзания воды фиксируется термометром.
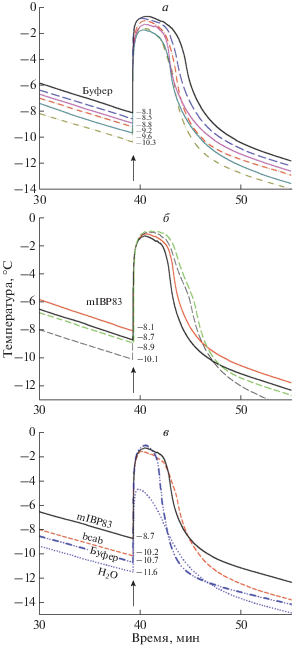
На рис. 2 показаны кривые изменения температуры в образцах в зависимости от времени охлаждения. Кривые, для удобства сравнения, выравнены по времени замерзания (отмеченном стрелкой на рис. 2).
Рис. 2.
Зависимость температуры образцов от времени охлаждения. а ‒ Шесть одинаковых опытов замораживания одинакового количества одинакового раствора (150 мкл, 20 мМ натрий-фосфатный буфер, pH 7) в одинаковых пробирках. б ‒ Две пары одинаковых опытов замораживания раствора mIBP83 (с концентрацией 0.6 мг/мл) в 20 мМ натрий-фосфатном буфере, pH 7. Сплошные линии ‒ два опыта с 150 мкл раствора, пунктирные линии ‒ с 200 мкл раствора. в ‒ Кривые охлаждения раствора mIBP83 (с концентрацией 0.6 мг/мл) в 20 мМ натрий-фосфатном буфере, pH 7 (сплошная линия), раствора карбоангидразы (с концентрацией 0.6 мг/мл) в 20 мМ натрий-фосфатном буфере (пунктирная линия), того же натрий-фосфатного буфера (пунктир с точками), и дистиллированной воды (точки). Кривые выравнены по времени замерзания растворов. Момент замерзания обозначен стрелкой. Температура, при которой начинается замерзание воды в каждом из экспериментов, приведена на графике.
Здесь нужно отметить две особенности:
1) температура замерзания всех образцов гораздо ниже 0°С; что вполне согласуется с известным фактом, что вода может долго существовать в переохлажденном состоянии.
2) “Нестабильность экспериментов”, т.е. большой разброс температур замерзания даже для одного и того же раствора (см. рис. 2а и 2б) в разных (но одинаковых) пробирках; повторение опытов с одной и той же пробиркой с одним и тем же образцом раствора дает практически совпадающие кривые (результаты не показаны).
Момент замерзания переохлажденной жидкости зависит не только от ее температуры, но и от микро- и даже наноскопических дефектов поверхности пробирки. (см. раздел “Теоретическая оценка характерного времени образования зародыша льда на различных поверхностях”). Присутствие таких микроскопических дефектов сложно контролировать, поэтому в экспериментах по замораживанию невозможно добиться идеальной повторяемости результатов, полученных в разных пробирках с одинаковыми жидкостями. Тем не менее, сравнивая рис. 2а и 2б, можно прийти к выводу, что присутствие mIBP83 в растворе слабо влияет (в пределах показанной на рис. 2а погрешности опыта ±1°С) на температуру замерзания воды, но оно, по крайней мере, не понижает ее. На рис. 2в для сравнения показаны четыре кривые, отражающие процессы замерзания раствора mIBP83, раствора карбоангидразы (пример белка, для которого не выявлена активность антифриза), натрий-фосфатного буфера и дистиллированной воды. Если учесть погрешность экспериментов по замерзанию (см. рис. 2а и 2б), то можно сделать вывод, что замерзание всех приведенных на рис. 2в жидкостей происходит при одинаково низкой температуре.
Проверка способности mIBP83 влиять на плавление льда
На рис. 3 показаны зависимости температуры образцов от времени нагрева, т.е. кривые плавления льда, содержащего и не содержащего mIBP83. Технические особенности эксперимента описаны в статье [13]. “Стабильность” опытов по плавлению льда несравненно выше, чем стабильность опытов по его образованию [13]; погрешность составляет ±0.1°С. На рис. 3а показана схема, где изображены все этапы изменения температуры в образце. При низких температурах лед нагревается с той же скоростью, что и жидкости в термостате, но не происходит его плавления (I на рис. 3а). Приближаясь к температуре плавления льда, линия II на рис. 3а начинает отклоняться от этой скорости, поскольку при нагреве пробирки лед начинает плавиться у ее стенки, где раньше достигается температура плавления, в то время как температура в центре пробирки, где находится измерительная термопара, еще отрицательная. Если проводить измерение образца большого объема, то кривая, приблизившись к температуре плавления, некоторое время будет почти горизонтальной (III на рис. 3а); чем больше объем образца, тем дольше кривая будет оставаться горизонтальной, поскольку смесь воды и льда удерживает температуру плавления. После того, как лед растаял, вода быстро нагревается до температуры термостата (IV на рис. 3а). Последняя часть кривой (V на рис. 3а) должна отражать процесс нагрева жидкости в пробирке, идущий с той же скоростью, что и жидкости в термостате.
Рис. 3.
Эксперименты по плавлению льда. а ‒ Упрощенное объяснение особенностей формы экспериментальной кривой: I ‒ нагрев льда, II ‒ лед начинает плавиться, III ‒ смесь воды и льда удерживает температуру плавления, IV ‒ быстрый нагрев жидкого образца после того, как весь лед растаял, V ‒ нагрев воды. б ‒ Экспериментальные кривые плавления образцов жидкости при скорости нагрева термостата, равной 0.24 град/мин. Красные кривые ‒ образцы содержат 0.6 мг/мл mIBP83, синие ‒ не содержат. Пунктир с точками, сплошная линия и пунктир ‒ кривые, полученные для образцов объемом 50, 100 и 150 мкл соответственно.

На рис. 3б показаны экспериментальные кривые плавления льда, содержащего и не содержащего mIBP83. Видно, что форма экспериментальных кривых похожа на схематичную кривую, показанную на рис. 3а. Отличие только в том, что этап III у экспериментальных кривых очень маленький, поскольку объемы исследуемых образцов всего 50, 100 и 150 мкл. При этом заметно, что с увеличением объема образца этап III тоже увеличивается. На рис. 3б также видно, что на этом этапе кривые, измеренные для образцов без mIBP83, приближаются к линии 0°С, то есть к температуре плавления “чистого” льда, а кривые для образцов, содержащих mIBP83, пересекают линию 0°С и приближаются к 1°С. Это означает, что температура плавления льда в присутствии mIBP83 увеличивается. В среднем, присутствие mIBP83 в концентрации 0.6 мг/мл увеличивает температуру плавления льда на один градус. Это можно объяснить тем, что mIBP83 связывается с поверхностью льда (см. рис. 1), которая в обычных условиях представляет собой как бы переохлажденную воду [21], и “укрепляет” ее. Явление перегрева кристаллов известно, хотя наблюдается крайне редко [22–24].
Теоретическая оценка характерного времени образования зародыша льда в толще воды при различных температурах
Теоретические оценки показывают, что по кинетическим причинам зарождение льда в толще чистой воды возможно только при очень низких температурах, ниже –30°С, а возникновение льда при около нулевых температурах возможно только на контактирующих с водой ледсвязывающих поверхностях [25].
Чтобы доказать это, мы рассмотрим сначала образование трехмерного зародыша льда в толще жидкости. Приращение свободной энергии при образовании компактного фрагмента новой трехмерной фазы, состоящего из n частиц, можно приблизительно оценить [12, 26] как
где $\mu < 0$ ‒ химический потенциал молекулы в “новой” фазе (например, во льду) минус ее потенциал в “старой” фазе (например, в воде), $B > 0$ ‒ дополнительная свободная энергия молекулы на поверхности ”новой” фазы, ${{\alpha }_{3}}{{n}^{{\frac{2}{3}}}}$ ‒ количество молекул на поверхности компактного кусочка новой фазы, состоящего из n частиц (для наших оценок, где важен только порядок величины, можно взять ${{\alpha }_{3}}$ ≈ 5, поскольку для сферы ${{\alpha }_{3}} = \sqrt[3]{{36\pi }}$, а для кубика ${{\alpha }_{3}} = 6$). Свободная энергия у менее компактных (с бóльшими значениями α3) ядер нуклеации новой фазы выше, чем у компактных; поэтому можно не обращать внимание на “неконкурентоспособные”, медленные пути, проходящие через некомпактные ядра нуклеации новой фазы [27].В биологическом объекте появление льда ожидается при относительно небольших отрицательных температурах, когда, как мы увидим ниже, ядра нуклеации льда довольно велики. Это оправдывает наше пренебрежение деталями структуры ядер нуклеации льда.
Немного ниже точки термодинамического равновесия фаз (0°C, т.e. ${{T}_{0}}$= 273 K), лед стабильнее, чем жидкое состояние воды (μ ≡ 0 при ${{T}_{0}}$ = 273°K, и $0 < - \mu $ при $T < {{T}_{0}}$), но лишь немного ($ - \mu \ll {{k}_{{\text{B}}}}{{T}_{0}}$, где ${{k}_{{\text{B}}}}$ — константа Больцмана, и $ - \mu \ll B$). В этом случае $G\left( n \right)$ сначала растет при увеличении n (см. уравнение (1)), проходит через максимум ${{G}^{\# }}$ в “переходном” состоянии (определяющем критический размер ядра нуклеации K), и затем уменьшается. Максимум ${{G}^{\# }}$ функции $G\left( n \right)$ достигается при ${{\left. {\frac{{dG}}{{dn}}} \right|}_{{n = {{n}_{0}}}}}$ = $\mu + \frac{2}{3}{{\alpha }_{3}}n_{0}^{{\frac{{ - 1}}{3}}}B = 0$, то есть когда ядро нуклеации куска льда содержит ${{n}_{0}} \approx {{\left( {\frac{2}{3}{{\alpha }_{3}}\frac{B}{{ - \mu }}} \right)}^{3}}$ молекул Н2О. Тогда “зародыш”, т.е. минимальный стабильный кусок льда (с $G\left( n \right) = 0$ при $n > 0$), содержит
молекул Н2О, а свободная энергия переходного состояния:
(3)
${{G}^{\# }} \equiv G\left( {{{n}_{0}}} \right) \approx \frac{{{{\alpha }_{3}}B}}{3}{{\left( {\frac{2}{3}{{\alpha }_{3}}\frac{B}{{ - \mu }}} \right)}^{2}}$.При температуре ${{T}_{0}}$, $\mu \equiv 0~$, так что при ${{T}_{0}} - \Delta T$ (где $\Delta T \ll {{T}_{0}}$), $\mu = - \Delta {{S}_{{\left( 1 \right)}}}\left( { - \Delta T} \right)$ = $ - \Delta {{H}_{{\left( 1 \right)}}}\left( {\frac{{ - \Delta T}}{{{{T}_{0}}}}} \right)$ согласно классическим уравнениям термодинамики (здесь $\Delta {{S}_{{\left( 1 \right)}}}$ и $\Delta {{H}_{{\left( 1 \right)}}}$ – соответственно энтропия и энтальпия замерзания в расчете на 1 молекулу Н2О). Согласно экспериментальным данным (см. [28]), для воды $\Delta {{H}_{{\left( 1 \right)}}}$ ≈ –6.0 кДж/моль ≈ $ - 2.6{{k}_{{\text{B}}}}{{T}_{0}}$, так что
Величина В ($ \approx {\kern 1pt} 0.85~{{k}_{{\text{B}}}}{{T}_{0}}$ вблизи ${{T}_{0}} = 273\,\,{\text{К}}$) следует из экспериментальной оценки свободной энергии границы лед/вода [29], ≈32 эрг/см2, и того, что молекула H2O занимает ≈10 Å2 на этой поверхности. Поэтому для воды $\frac{B}{{ - \mu }}~ \approx \frac{{85^\circ }}{{\Delta T}}$, в результате:
(5)
$\frac{{{{G}^{\# }}}}{{{{k}_{{\text{B}}}}{{T}_{0}}}} \approx 12{{\left( {\frac{{100^\circ }}{{\Delta T}}} \right)}^{2}}.$Тогда, согласно классической теории нуклеации фазовых переходов [27, 30], основанной на теории переходных состояний [31, 32], характерное время появления зародыша льда вокруг одной данной молекулы воды можно оценить как
где τ ‒ характерное время добавления к растущему льду еще одной молекулы воды, не менее ${{{{\tau }}}_{0}}$ ~ ~ 10–11 с, что есть время переворота диффундирующей в воде молекулы Н2О при 273 К [33]. Более детальная оценка показывает, что τ на несколько порядков величины больше, чем ${{{{\tau }}}_{0}}$ [25], но для нас это неважно, так как нам надо будет лишь оценить нижний предел времени образования льда.Если в рассматриваемом объеме (в клетке, в пробирке) есть ${{N}_{V}}$ молекул воды, и вокруг любой из них может возникнуть лед, то характерное время появления первого (и единственного) ядра образования льда в таком объеме можно оценить (см. уравнения (5), (6)) как
(7)
$\begin{gathered} TIM{{E}_{{3{\text{D}}}}}~\sim ~{{\tau exp}}{{\left( {\frac{{{{G}^{\# }}}}{{{{k}_{B}}T}}} \right)} \mathord{\left/ {\vphantom {{\left( {\frac{{{{G}^{\# }}}}{{{{k}_{B}}T}}} \right)} {{{N}_{V}}}}} \right. \kern-0em} {{{N}_{V}}}}~\sim \\ \sim \,\,\frac{{{\tau }}}{{{{N}_{V}}}}\Delta {\text{exp}}\left( {12{{{\left( {\frac{{{{{100}}^{0}}}}{{\Delta T}}} \right)}}^{2}}} \right)\,\,{\text{c}}{\text{.}} \\ \end{gathered} $Так как τ > 10–11 с, то зародыш льдинки может появиться в толще воды в пробирке (содержащей ${{N}_{V}}$ ~ 1023 молекул H2O в ~1 см3) за >10482 с = 10473 лет (!!!) при –10°С и через >1014 лет (!!!) при –30°С (т.е., с биологической точки зрения, зародыш льда не может появиться в толще покоящейся воды).
Теоретически, он может появиться в толще покоящийся воды за минуты только при –38°С (на опыте: при –35°C [34]), хотя при резком взбалтывании — и при ≈ –15°C [35]. Зародыш льда в толще воды (см. уравнение (2) и рис. 4а) довольно велик: в нем ~103 молекул H2O при –35°С (и тогда его диаметр ~4 нм), а при –10°С его диаметр ~15 нм.
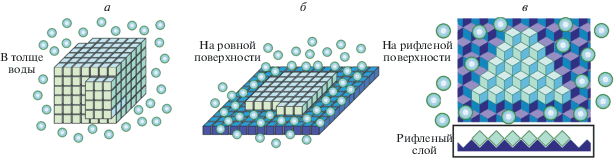
Рис. 4.
Схематическое представление процесса кристаллизации. 3-мерное ядро образования льда (a) появляется в толще жидкости; 2-мерные ледяные ядра (б, в) ‒ на связывающих лед или ледяных поверхностях. Поверхность может быть ровной (б) или рифленой (в); на вставке к (в) видно, что контакт между молекулами льда в рифленом слое на много слабее, чем в ровном [25]. Молекулы Н2О изображены на этом рисунке крайне схематично. Молекулы кристаллических слоев изображены голубыми или зеленовато-голубыми кубиками; молекулы связывающих лед поверхностей ‒ темно-синие или фиолетово-синие; “свободные” молекулы жидкости ‒ шарики. Дополнительная “краевая” свободная энергия ядер связана с поверхностью 3-мерного (а) или периметром 2-мерного (б, в) ядра, причем “краевая” свободная энергия ядра на рифленой (в) поверхности близка к нулю из-за малого контакта молекул внутри рифленого слоя; поэтому такой слой менее компактен, но образуется быстрее (см. текст).
Теоретическая оценка характерного времени образования зародыша льда на различных поверхностях
Итак, зародыш льда не может появиться в толще воды при околонулевых температурах. Иначе выглядит появление льда на ледсвязывающих поверхностях. Когда такая поверхность может связывать лед (согласно Фарадею, этим свойством обладает, например, фланель, но не золото [36]), на ней возникает ледяное ядро не как 3-мерный (рис. 4а), а как 2-мерный объект (рис. 4б, 4в). Нас не интересует первый мономолекулярный слой льда: при сильном связывании льда поверхностью такой слой может появиться (но не может расти дальше) даже при положительных температурах. Нас интересует начало дальнейшего роста слоя льда на льду, идущий лишь при минусовых температурах. И хотя образование 2-мерного слоя, строго говоря, не является фазовым переходом первого рода [37], этот слой все же довольно похож на кристалл [37], и мы можем оценить его зарождение, используя уравнения, подобные приведенные выше.
Когда слой льда намерзает на более или менее ровную ледяную поверхность (рис. 4б, 4в), дополнительная свободная энергия, связанная с границей нового слоя, зависит только от его периметра, но не от его площади (потому что в этом случае одна поверхность льда только заменяет другую, см. рис. 4б, 4в).
В связи с этим свободная энергия 2-мерного слоя на более или менее ровной поверхности (рис. 4б, 4в) может быть выражена так же, как в уравнении (1):
(где степень n не $\frac{2}{3}$, а $\frac{1}{2}$, и ${{\alpha }_{2}}\tilde {B}$ относится к периметру, а не ко всей поверхности, как ${{\alpha }_{3}}B$). Теперь ${{\alpha }_{2}} \approx 4$, так как ${{\alpha }_{2}} = \sqrt {4\pi } $ для окружности, и ${{\alpha }_{2}} = 4$ для квадрата. Величина $\tilde {B}$ для периметра слоя на ровной поверхности (рис. 4б) близка к величине B для поверхности 3-мерного тела (рис. 4а), но для молекулы периметра рифленого слоя (рис. 4в) величина $\tilde {B}$ близка к нулю из-за малого контакта молекул внутри рифленого слоя (см. вставку к рис. 4в).Величина $\tilde {G}\left( n \right)$ имеет максимум ${{\tilde {G}}^{\# }}$ при $n = {{\tilde {n}}_{0}}$, где ${{\left. {\frac{{d\tilde {G}}}{{dn}}} \right|}_{{n = {{{\tilde {n}}}_{0}}}}}$ = $\mu + \frac{1}{2}{{\alpha }_{2}}\tilde {n}_{0}^{{\frac{{ - 1}}{2}}}\tilde {B} = 0$, т.е. ядро нуклеации слоя льда содержит $~{{\tilde {n}}_{0}} \approx {{\left( {\frac{1}{2}{{\alpha }_{2}}\frac{{\tilde {B}}}{{ - \mu }}} \right)}^{2}}$ молекул Н2О, а “зародыш” слоя
молекул Н2О. Свободная же энергия переходного состояния при образовании слоя
(10)
${{\tilde {G}}^{\# }} \equiv \tilde {G}\left( {{{{\tilde {n}}}_{0}}} \right) \approx \frac{{{{\alpha }_{2}}\tilde {B}}}{2}\left( {\frac{1}{2}{{\alpha }_{2}}\frac{{\tilde {B}}}{{ - \mu }}} \right).$Если слой льда нарастает на ровную поверхность, $\tilde {B} \approx B \approx 0.85~{{k}_{B}}{{T}_{0}}$ [25], и ${{\tilde {n}}_{{{\text{seed}}}}} = {{2}^{2}}{{\tilde {n}}_{0}}$ ≈ $~{{\left( {\frac{{340^\circ }}{{\Delta T}}} \right)}^{2}},$ а
(11)
$\frac{{{{{\tilde {G}}}^{\# }}}}{{{{k}_{{\text{B}}}}{{T}_{0}}}} \approx \frac{{{{{\left( {{{\alpha }_{2}}\tilde {B}} \right)}}^{2}}}}{{ - 4\mu {{k}_{{\text{B}}}}{{T}_{0}}}} \approx \,\,~\frac{{300^\circ }}{{\Delta T}}.$Если же слой — рифленый (как на рис. 4в), то $\tilde {B}$ близко к нулю, и ${{\tilde {n}}_{0}}$, ${{\tilde {n}}_{{{\text{seed}}}}}$, ${{\tilde {G}}^{\# }}$ ‒ тоже.
Характерное время появления двумерного ядра льда на ровной поверхности, способной вместить ${{N}_{S}}$ молекул H2O, оценивается, согласно классической теории нуклеации фазовых переходов (см. уравнения (6), (7), (11)), как
(12)
$\begin{gathered} TIM{{E}_{{2{\text{D}}\_{\text{smooth}}}}}\sim \frac{\tau }{{{{N}_{S}}}}{\text{exp}}\left( {\frac{{{{{\tilde {G}}}^{\# }}}}{{{{k}_{{\text{B}}}}{{T}_{0}}}}} \right)\sim \\ \sim \,\,~\frac{\tau }{{{{N}_{S}}}}{\text{exp}}\left( {\frac{{300^\circ }}{{\Delta T}}} \right)\,\,{\text{c}}, \\ \end{gathered} $Подводим итог: хотя лед не может появиться в толще воды (путем гомогенного зародышеобразования) при температурах выше –30°C (см. выше), он может возникнуть при примерно –6°C…–10°C на окружающих воду стенках путем гетерогенного зародышеобразования (которое вообще гораздо чаще встречается, чем гомогенное зародышеобразование [38]).
До сих пор мы говорили только о времени, необходимом для нуклеации льдинки, но не для ее последующего роста, так как временем роста льда можно пренебречь по сравнению с гораздо большим, как правило, временем его нуклеации [25]. Резкий скачок температуры при замерзании (рис. 2) также показывает, что рост льда – очень быстрый процесс.
Также мы до сих пор говорили только о кинетике замерзания, но не о кинетике таяния, потому, что инициация плавления льда быстра: она не требует заметного предварительного перегрева воды, так как поверхность льда изначально сходна с переохлажденной водой [21, 25].
Возможность “зарождения льда без нуклеации” на экзотических поверхностях
Время рассмотренного выше зарождения слоя льда на ровной поверхности (рис. 4б) обращается в бесконечность, когда температура приближается к 0°C (см. уравнение (9)). Этот эффект возникает из-за потери контактов на периферии слоя льда. Однако этой потери (приводящей к бесконечно большому времени кристаллизации при 0°C) можно избежать, если связывающая лед поверхность имеет рифленую форму (рис. 4в).
Тогда лед может возникать не кооперативно, без медленного фазового перехода, но для этого требуется экзотическая (в данном случае рифленая) поверхность, инициирующая образование льда.
Приведенные выше оценки показывают, что существование, величина и наноскопическая структура лед-связывающих поверхностей чрезвычайно важны для возникновения зародышей льда; они определяют температуру, при которой возникает лед.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализируя полученные данные, можно сделать несколько выводов.
Чистую воду или растворы белков заморозить не так-то просто. По крайней мере, в пробирке до –8°C растворы прекрасно существуют в переохлажденном состоянии. При этом добавление IBP не влияет на процесс замерзания, но явно повышает температуру плавления льда.
Опираясь на результаты теоретических расчетов, можно сделать вывод, что существенный фактор, повышающий температуру замерзания переохлажденной воды, ‒ наличие и структура лед-связывающих поверхностей. Если предположить, что задача IBP состоит в том, чтобы инактивировать такие поверхности, то становится понятным, как такие белки могут выступать в роли антифриза.
Когда клетка или кровеносный сосуд имеют заметные (размером больше нескольких мкм2) поверхности, на которых могут возникнуть зародыши льда при отрицательных температурах, необходимы какие-то молекулы-“антифризы”, чтобы связываться с этими поверхностями и блокировать рост льда на них.
На сегодняшний день мы практически ничего не знаем о поверхностях, инициирующих образование льда (которые могут быть мишенями для AFP). Идентификация таких поверхностей и изучение их свойств станут следующим шагом в исследовании действия AFP.
Предотвращение образования льда ‒ это не единственное свойство IBP. Поскольку эти белки связываются со льдом (рис. 1), они могут его стабилизировать (это действительно так ‒ см. рис. 3). Таким образом, IBP может служить не только в качестве антифриза, но и в качестве белка, инициирующего образование льда. Однако, как следует из приведенных выше расчетов, линейный размер поверхности, пригодной для зарождения льда, должен быть не менее ~10 нм. Это согласуется с работами, в которых показано, что большие (~200 кДа, т.е. диаметром не менее 7 нм) IBP могут не только предотвращать, но в некоторых условиях инициировать образование льда [39], в то время как маленькие “работают” только как антифриз, предотвращая образование льда.
Кроме того, слипание IBP с клеточными поверхностями должно стабилизировать их, что может защитить клетки от повреждения при гипотермии (предшествующей появлению льда); это согласуется с гипотезой Хирано и др. [5].
Таким образом, предполагаемое слипание IBP с клеточными поверхностями может объяснить два экспериментально наблюдаемых при замораживании клеток явления [9, 39]: (i) устойчивость клеток к холодовому шоку при умеренном охлаждении до 0°C (возможно, из-за стабилизации клеточных поверхностей при слипании с ними лед-связывающих белков) и (ii) выживание клеток при более сильном охлаждении (видимо, из-за того, что IBP блокирует поверхности, инициирующие нуклеацию льда, и тем самым предотвращает появление ледяных кристаллов).
Стоит подчеркнуть, что эта работа дает принципиально иной взгляд на функционирование AFP. Их задача состоит не в том, чтобы связываться с кристаллами льда и останавливать их рост, а в том, чтобы связываться непосредственно или через тончайший слой молекул воды с теми поверхностями клеток или тканей, где могут образовываться зародыши льда, тем самым предотвращая образование на них льда в переохлажденной воде. Закупорка поверхностей, на которых возникают зародыши льда, – единственный способ предотвратить замерзание с использованием небольшого количества молекул антифриза.
Авторы благодарны Г. Ферми, А.Ю. Гросбергу, М.Д. Франк-Каменецкому, Е.Г. Маленкову, Е.И. Шахновичу, Д. Френкелю и А.Н. Гавришеву за плодотворные дискуссии, а также Г.С. Нагибиной, Ю.Д. Окуловой и Е.Н. Саматовой за помощь при выполнении работы.
Работа выполнена при поддержке Российского научного фонда (21-14-00268).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Scholander P.F., van Dam L., Kanwisher J.W., Hammel H.T., Gordon M.S. (1957) Supercooling and osmoregulation in arctic fish. J. Cell. Comp. Physiol. 49, 5–24.
DeVries A.L. (1971) Glycoproteins as biological antifreeze agents in antarctic fishes. Science. 172, 1152–1155.
DeVries A.L. (1982) Biological antifreeze agents in coldwater fishes. Comp. Biochem. Physiol. Part A Physiol. 73, 627–640.
Surís-Valls R., Voets I.K. (2019) The impact of salts on the ice recrystallization inhibition activity of antifreeze (glyco)proteins. Biomolecules. 9, 347.
Hirano Y., Nishimiya Y., Kowata K., Mizutani F., Tsuda S., Komatsu Y. (2008) Construction of time-lapse scanning electrochemical microscopy with temperature control and its application to evaluate the preservation effects of antifreeze proteins on living cells. Anal. Chem. 80, 9349–9354.
Jorov A., Zhorov B.S., Yang D.S.C. (2004) Theoretical study of interaction of winter flounder antifreeze protein with ice. Protein Sci. 13, 1524–1537.
DeVries A.L. (1974) Survival at freezing temperatures. Biochem. Biophys. Perspect. Mar. Biol. 289–330.
Celik Y., Drori R., Pertaya-Braun N., Altan A., Barton T., Bar-Dolev M., Groisman A., Davies P.L., Braslavsky I. (2013) Microfluidic experiments reveal that antifreeze proteins bound to ice crystals suffice to prevent their growth. Proc. Natl. Acad. Sci. USA. 110, 1309–1314.
Kuramochi M., Takanashi C., Yamauchi A., Doi M., Mio K., Tsuda S., Sasaki Y.C. (2019) Expression of ice-binding proteins in caenorhabditis elegans improves the survival rate upon cold shock and during freezing. Sci. Rep. 9, 6246.
Zachariassen K.E., Kristiansen E. (2000) Ice nucleation and antinucleation in nature. Cryobiology. 41(4), 257–279.
Pertaya N., Marshall C.B., Celik Y., Davies P.L., Braslavsky I. (2008) Direct visualization of spruce budworm antifreeze protein interacting with ice crystals: basal plane affinity confers hyperactivity. Biophys. J. 95, 333–341.
Уббелоде А. (1969) Плавление и кристаллическая структура (главы 2, 14). М: Мир.
Glukhova K.A., Okulova J.D., Melnik B.S. (2020) Designing and studying a mutant form of the ice-binding protein from Choristoneura fumiferana. BioRxiv. https://doi.org/10.1101/2020.08.31.275651
Leinala E.K., Davies P.L., Doucet D., Tyshenko M.G., Walker V.K., Jia Z. (2002) A β-helical antifreeze protein isoform with increased activity. J. Biol. Chem. 277, 33349–33352.
Leinala E.K., Davies P.L., Jia Z. (2002) Crystal structure of β-helical antifreeze protein points to a general ice binding model. Structure. 10, 619–627.
Tyshenko M.G., Doucet D., Davies P.L., Walker V.K. (1997) The antifreeze potential of the spruce budworm thermal hysteresis protein. Nat. Biotechnol. 15, 887–890.
Cziko P.A., DeVries A.L., Evans C.W., Cheng C.-H.C. (2014) Antifreeze protein-induced superheating of ice inside Antarctic notothenioid fishes inhibits melting during summer warming. Proc. Natl. Acad. Sci. USA. 111, 14583–14588.
Doucet D., Tyshenko M.G., Kuiper M.J., Graether S.P., Sykes B.D., Daugulis A.J., Davies P.L., Walker V.K. (2000) Structure–function relationships in spruce budworm antifreeze protein revealed by isoform diversity. Eur. J. Biochem. 267, 6082–6088.
Fukuda H., Arai M., Kuwajima K. (2000) Folding of green fluorescent protein and the cycle3 mutant. Biochemistry. 39, 12025–12032.
Glukhova K.F, Marchenkov V.V., Melnik T.N., Melnik B.S. (2017) Isoforms of green fluorescent protein differ from each other in solvent molecules “trapped” inside this protein. J. Biomol. Struct. Dyn. 35, 1215–1225.
Smit W.J., Bakker H.J. (2017) The surface of ice is like supercooled liquid water. Angew. Chem. Int. Ed. Engl. 56, 15540–15544.
Métois J.J., Heyraud J.C. (1989) The overheating of lead crystals. J. Phys. 50, 3175–3179.
Forsblom M., Grimvall G. (2005) How superheated crystals melt. Nat. Mater. 4, 388–390.
Mei Q.S., Lu K. (2007) Melting and superheating of crystalline solids: from bulk to nanocrystals. Prog. Mater. Sci. 52, 1175–1262.
Finkelstein A.V. (2020) Some peculiarities of water freezing at small sub-zero temperatures. Preprint. ArXiv 2008.13682. https://arxiv.org/abs/2008.13682
Чернов А.А. (1980) Процессы кристаллизации. В кн.: Современная кристаллография. Том 3. Образование кристаллов (глава 1, §§ 3, 5, 6). Под ред. Гиваргизова Е.И., Багдасарова Х.С., Кузнецова В.А., Демьянец Л.Н., Лобачева А.Н. М.: Наука.
Ruckenstein E., Berim G. (2016) Kinetic Theory of Nucleation. Boca Raton, CRC Press, Taylor & Francis Group.
Lide D.R. (2005) CRC Handbook of Chemistry and Physics on CD (section 6). Boca Raton, CRC Press.
Hillig W.B. (1998) Measurement of interfacial free energy for ice/water system. J. Cryst. Growth. 183, 463–468.
Эмануэль Д.Г., Кнорре Н.М. (1984) Курс химической кинетики, 4-е изд. (главы II, III, V (§§ 2, 3)). М: Высшая школа.
Becker R., Döring W. (1935) Kinetic treatment of grain-formation in super-saturated vapours. Ann. Phys. 24, 719–752.
Eyring H. (1935) The activated complex in chemical reactions. J. Chem. Phys. 3, 107–115.
Holz M., Heil S.R., Sacco A. (2000) Temperature-dependent self-diffusion coefficients of water and six selected molecular liquids for calibration in accurate 1H NMR PFG measurements. Phys. Chem. Chem. Phys. 2(20), 4740–4742.
Koop T., Murray B.J. (2016) A physically constrained classical description of the homogeneous nucleation of ice in water. J. Chem. Phys. 145, 211915.
Зельдович Я.Б. (1942) К теории образования новой фазы. Кавитация. ЖЭТФ. 12, 525–538.
Faraday M. (1859) Experimental Researches in Chemistry and Physics. London: Taylor and Francis, pp. 372‒382.
Strandburg K.J. (1988) Two-dimensional melting. Rev. Mod. Phys. 60. 161–207.
Sear R.P. (2007) Nucleation: theory and applications to protein solutions and colloidal suspensions. J. Physics: Condens. Matter. 19(3), 033101.
Bissoyi A., Reicher N., Chasnitsky M., Arad S., Koop T., Rudich Y., Braslavsky I. (2019) Ice nucleation properties of ice-binding proteins from snow fleas. Biomolecules. 9, 532.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


