Молекулярная биология, 2022, T. 56, № 4, стр. 652-662
Релевантность экспонированных на поверхности лакказы остатков лизина, предназначенных для ее функционализации
A. A. Arteaga-Castrejón a, M. R. Trejo-Hernández a, Y. Mekmouche b, A. Amouric b, P. Rousselot-Pailley b, V. Robert b, T. Tron b, *, F. Martínez-Morales a, **
a Centro de Investigación en Biotecnología
62209 Cuernavaca, Morelos, Av. Universidad 1001 Col. Chamilpa, México
b Centrale Marseille, CNRS, Aix Marseille Université
13397 Marseille, iSm2 UMR 7313, France
* E-mail: thierry.tron@univ-amu.fr
** E-mail: fernandomm@uaem.mx
Поступила в редакцию 05.09.2021
После доработки 02.12.2021
Принята к публикации 10.12.2021
- EDN: MURAVV
- DOI: 10.31857/S0026898422040024
Аннотация
Лакказы грибов ‒ это оксидоредуктазы с низкой субстратной специфичностью. Для получения гибридных катализаторов с новыми свойствами на основе лакказы необходимо знать характеристики поверхности этого фермента. Мишенями для реакций иммобилизации служат молекулы лизина, экспонированные на поверхности лакказы. В качестве платформы для выявления экспонированных на поверхности лакказы сайтов, потенциально пригодных для замещения остатками лизина, мы использовали LAC3-K0, лишенный остатков лизина. На основе 3D модели LAC3-K0 были выбраны семь сайтов и с помощью сайт-направленного мутагенеза получены мутанты с единичными остатками лизина (UNIKn, где n ‒ номер остатка). Все мутанты экспрессировали в клетках Saccharomyces cerevisiae W303-1A. По способности окислять гваякол или 2,2'-азино-бис(3-этилбензотиазолин-6-сульфоновую кислоту (ABTS) на чашках с агаром их отнесли к функционально секретируемым белкам. Все варианты, как и ожидалось, были активными при кислых, но не при нейтральных значениях рН. Эти варианты оставались стабильными при температуре 15‒55°C и полностью утрачивали активность при 70°C. Показано, что замена одного или двух поверхностных остатков лизина сильно влияла на активность фермента и его субстратную специфичность независимо от расстояния этих остатков от сайта Т1. Каталитические параметры ($K_{{\text{M}}}^{{{\text{app}}}}$ и $k_{{{\text{cat}}}}^{{{\text{app}}}}$), измеренные по отношению к ABTS, различались у разных вариантов; $V_{{\max }}^{{{\text{app}}}}$ была в 1.5‒2 раза выше у UNIK269 и у тройного мутанта с $V_{{\text{M}}}^{{{\text{app}}}}$ = 0.27 и 0.30 соответственно; $k_{{{\text{cat}}}}^{{{\text{app}}}}$ равна 30.25 у UNIK238 и 32.34 у тройного мутанта. Установлено, что свойства гидрофобных областей на поверхности LAC3-K0 следует учитывать при взаимодействии гибридных материалов. Все полученные нами варианты с уникальными поверхностными остатками лизина содержат сайты, пригодные для контролируемой ориентации лакказы при дизайне гибридных материалов.
ВВЕДЕНИЕ
Лакказы ‒ п-дифенолоксидоредуктазы [КФ 1.10.3.2] ‒ “мультимедные” ферменты, содержащие четыре иона меди, организованных в два активных центра. Расположенный на поверхности медный сайт типа I участвует в окислении фенольных субстратов, тогда как скрытый трехъядерный медный центр участвует в сопутствующем восстановлении O2 до воды [1, 2]. Лакказы рассматриваются как “зеленые катализаторы”, благодаря их способности использовать молекулярный O2 как акцептор электронов с образованием воды в качестве единственного побочного продукта [3‒5]. Низкая специфичность лакказ позволяет им катализировать окисление широкого круга фенольных соединений, ароматических аминов и ионов металлов. Лакказы, широко распространенные в природе, выполняют разнообразные биологические функции, включая участие в морфогенезе, защите от стресса и деградацию лигнина [6]. Лакказы грибов обладают высоким редокс-потенциалом (730–790 мВ), однако для деградации некоторых компонентов лигнина и других субстратов с высоким редокс-потециалом требуется присутствие редокс-медиаторов [7, 8].
В последние 10 лет лакказы привлекали особое внимание из-за их редокс-свойств и надежности как катализаторов. Они используются в экологически чистых производствах, включающих биотехнологические процессы получения текстиля, косметических средств, пищевых продуктов, лекарственных препаратов, биотоплива и энергии. Недавно лакказы нашли применение в нанобиотехнологиях [6, 9], области, возникшей на переднем крае биотехнологии, в которой технологии функционализации и иммобилизации используются для интеграции ферментов при дизайне гибридных наноматериалов (NM) с улучшенными характеристиками и свойствами, еще не обнаруженными в природе.
Иммобилизация ‒ давно известный мощный инструмент улучшения свойств природных ферментов [10], применение которых затрудняется такими постпроизводственными проблемами, как недостаточная стабильность, длительность хранения, условия применения (pH и температура), восстановление и рециклинг катализатора. Для иммобилизации используют свойства аминокислотных остатков, локализованных на поверхности молекулы фермента, такие как, например, активные группы цистеина или лизина, которые могут участвовать в ковалентном связывании [10]. Как описано в обзоре Hoarau и соавт. [11], химически хорошо охарактеризованные самособирающиеся монослойные (SAM) поверхности, образованные короткими цепочками этиленгликоля и цистеин-активными малеимидными группами, могут использоваться для ковалентного связывания остатков цистеина, расположенных на поверхности фермента. Прогресс в изучении взаимодействий на молекулярном уровне между белками и материалом подложек, которые вносят вклад в повышение стабильности и активности, обеспечивают разработку методов, которые модулируют взаимодействие фермент-подложка. Один из таких подходов ‒ рациональный дизайн вариантов с контролируемой ориентацией фермента по отношению к поверхности подложки [11‒13]. Обеспечить нужную ориентацию можно путем сайт-направленного замещения аминокислотных остатков, расположенных на поверхности, остатками с активными функциональными группами, которые будут мишенями последующих реакций сопряжения с выбранным материалом. Например, описана ориентация лакказ на поверхности модифицированных карбоновых нанотрубок с целью синтеза эффективных биокатодов через специфичную ковалентную функционализацию уникальных остатков лизина [14, 15]. Ориентация молекул фермента (при увеличении числа “связанных” молекул) на поверхности электрода позволяет измерить прямой перенос электронов (DET) с электрода на фермент; DET может модулироваться как функция ориентации фермента [14, 15].
Благодаря хорошо изученной топографии, некоторые лакказы идеальны для получения представлений о модуляции функций фермента посредством сайт-направленного мутагенеза поверхностных аминокислотных остатков, предсказанных с помощью биоинформатических инструментов, для дизайна точных изменений. Лакказа LAC3 Trametes sp. штамм C30 катализирует окисление природных и синтетических соединений [16, 17], ее активность модулируется путем создания на поверхности разных сайтов функционализации [14, 15, 18]. Использование варианта LAC3, лишенного лизиновых групп, позволяет ввести уникальные остатки лизина в любое место поверхности фермента [18].
С целью выяснения влияния локализации остатков лизина на поверхности лакказы на функцию лакказы нами получен и охарактеризован набор вариантов LAC3 с оригинальными единичными остатками лизина.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Штаммы, среды и плазмиды. Во всех манипуляциях с ДНК использовали штамм Escherichia coli DH5α (FΔ80lacZ ΔM15 Δ(lacZYAargF)U169 deoR recA1 endA1 hsdR17(rk, mk +) phoA supE44 thi1gyrA96 relA1 λ)). Клетки E. coli растили в среде Luria–Bertani (LB, 10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl). При необходимости добавляли ампициллин (100 мкг/л). Плазмиды и праймеры, использованные в настоящей работе, приведены в табл. 1 . Рекомбинантные лакказы экспрессировали в дрожжевой плазмиде pAKLAC3-K0 [16, 18], используемой в качестве исходной плазмиды для получения мутантных производных лакказы. Штамм Saccharomyces cerevisiae W303-1A (MATa{leu2-3,112 trp1-1 can1-100 ura3-1 ade2-1 his3-11,15}) использовали для экспрессии лакказы. Трансформанты S. cerevisiae выращивали в селективной среде (6.7 г/л YNB без аминокислот, 5 г/л казаминокислот, 90 мг/л аденина; 40 мг/л триптофана; 50 мM сукцинатного буфера pH 5.3; 0.5% v/v гваякола; 100 мкM CuSO4) и 20 г/л глюкозы в качестве источника углерода (SD).
Молекулярная модель. На сервере Swiss Model (swissmodel.expasy.org) сгенерирована замещенная 3D модель, основанная на кристаллической структуре лакказы 1GYC T. versicolor в качестве матрицы (Protein Data Bank, http://www.rcsb.org). Эту модель использовали для предсказания экспонированных на поверхности аминокислотных остатков LAC3 (GenBank AAR00925.1) с применением программ GetArea (www.expasy.org) и PyMOL (pymol.org). Для предсказания гидрофобных участков (HP) на поверхности белков использовали web server protein-sol (http://protein-sol.manchester.ac.uk/) [19].
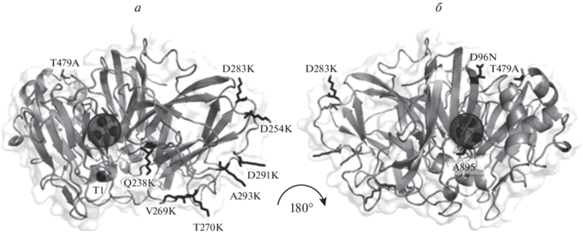
Дизайн и конструирование мутантов. Плазмиду pAKLAC3-K0, кодирующую вариант LAC3, не содержащий остатков лизина (K0 = K40 > M, K71 > H), использовали как ДНК-матрицу для получения единичных лизиновых мутантов, названных UNIKn, где n ‒ положение остатка лизина в последовательности LAC3. Для получения вариантов UNIK, названных UNIK238 (Q238K), UNIK254 (D254K), UNIK269 (V269K), UNIK270 (T270K), UNIK283 (D283K), UNIK291 (D291K) и UNIK293 (A293K), использовали набор Quick-change mutagenesis kit (“Thermo Scientific”, США). Последовательности мутагенных праймеров, сконструированных в этой работе, приведены в табл. 1 . Правильность мутантных последовательностей подтверждена секвенированием. В двух случаях, обусловленных, возможно, ошибками ДНК-полимеразы, обнаружены случайные мутации (выделены полужирным) в вариантах UNIK269 (D96N/ V269K/T479A) и UNIK291 (A89S/D291K). Поскольку эти мутации картированы на поверхности 3D модели LAC3-K0, а мутантные варианты ферментативно активны, мы решили включить их в исследование и сравнить активности этих вариантов и реципрокных единичных мутантов (рис. 1).
Рис. 1.
3D модель LAC3-K0, представленная в виде серых ленточных диаграмм (a и б). Поверхностные аминокислотные остатки, выбранные для мутагенеза, выделены черными палочками, медь в сайте Т1 показана черной сферой, трехъядерный медный сайт обведен кружком. В качестве образца использованы координаты кристаллической структуры лакказы (1GYC) Trametes versicolor.
Tаблица 1. Плазмиды и праймеры , использованные в работе
| Плазмида | Положение кодона | Расстояние до Т1, Åa | Ссылка |
|---|---|---|---|
| pAK145-LAC3 | K40/K71 | 31.8/27 | [16] |
| pAK-145-K0 | M40/H71 | 31.8/27 | [14] |
| pAK-145-Q238K | 238 | 17.5 | Эта работа |
| pAK145-D254K | 254 | 42 | То же |
| pAK145-V269K | 269 | 20.8 | » |
| pAK145-T270K | 270 | 24.5 | » |
| pAK145-D283K | 283 | 41 | » |
| pAK145-D291K | 291 | 36.4 | » |
| pAK145-A293K | 293 | 32.8 | » |
| pAK145-D96N/V269K/T479A | 96/269/479 | 30.6/20.8/33 | » |
| pAK145-A89S/D291K | 89/291 | 30/36.4 | » |
| Праймер | Нуклеотидная последовательность (5' → 3')а | ||
| Q238KFwd Q238KRev |
GTCGACTCGATCAAAATTTTCGCCGGG CCCGGCGAAAATTTTGATCGAGTCGAC |
||
| D254KFwd D254KRev |
ACCGCGGATCAAAAAATCGGTAACTAC GTAGTTACCGATTTTTTGATCCGCGGT |
||
| V269KFwd V269KRev |
CTAACACCGGTACAAAAACCACCGATGG CCATCGGTGGTTTTTGTACCGGTGTTAG |
||
| T270KFwd T270KRev |
GGTACAGTCAAAACCGATGGCGGC GCCGCCATCGGTTTTGACTGTACC |
||
| D283KFwd D283KRev |
CATTCTGCGTTACAAAACGGCGGACCC GGGTCCGCCGTTTTGTAACGCAGAATG |
||
| D291KFwd D291KRev |
CGATCGAACCCAAAGCCGCAGACC GGTCTGCGGCTTTGGGTTCGATCG |
||
| A293KFwd A293KRev |
GAACCCGACGCCAAAGACCCCACCAG CTGGTGGGGTCTTTGGCGTCGGGTTC |
||
Трансформация клеток дрожжей и анализ активности лакказы на чашках. Штамм S. cerevisiae W303-1A трансформировали плазмидами по прототипу с использованием ацетата лития/ДНК-носителя /PEG [20]. После трансформации клетки распределяли по поверхности чашек с селективной средой SD и инкубировали при 28°C в течение 4 дней. Лакказную активность определяли количественно на чашках со средой SD, содержащей 100 мкM CuSO4 и 0.5% v/v гваякола. Ферменты LAC3 и LAC3-K0, использованные в качестве контроля, получали, как описано Zhou и соавт. [21].
Продукция вариантов лакказы в дрожжах и определение лакказной активности. Клетки дрожжей, продуцирующие варианты лакказы, культивировали в течение 60 ч при начальной плотности OD600 = 0.1 в 50 мл среды SD в 250 мл колбах при 28°C и 160 об./мин. После центрифугирования (4200 об./мин, 10 мин), супернатант фильтровали через бумажный фильтр (Whatman № 1), затем пропускали через фильтр из стекловолокна (поры 1.6 мкM) и концентрировали в ячейке для ультрафильтрации (“Amicon”, CША) с мембраной для белков 10 кДа (“Millipore”, США). Концентрат фермента хранили при –80°C в 30% (w/v) глицерине. Активность лакказы (5 мкл концентрированного супернатанта) определяли при 25°C путем окисления 1 мM 2,2'-азино-бис (3-этилбензотиазолина-6-сульфоновой кислоты) (ABTS) в 100 мM натрий-ацетатном буфере (pH 4.4) в суммарном объеме 1 мл. Окисление ABTS измеряли при 436 нм (ε = 29300 M–1 см-1), используя спектрофотометр DU640 (“Beckman”). Ферментативную активность выражали в международных единицах (U). За одну единицу активности принимали количество фермента, необходимое для окисления 1 мкмоль/мин ABTS. Концентрацию белка определяли по методу Брэдфорда [22].
Характеристика кинетических параметров (кажущаяся Vmax и KM) и условия стабильности грубого экстракта лакказы. Значения кажущейся Vmax и KM определяли по уравнению Михаэлиса‒Ментен, затем рассчитывали значения kcat. Использовали ABTS в концентрации 0.25, 0.5, 1,0, 2.5, 3.0 и 5.0 мМ в 100 мМ натрий-ацетатном буфере (pH 4.4) с 5 мкл концентрированного фермента в объеме 1 мл. Все измерения проводили в трех повторностях в описанных ранее условиях. Поскольку в катализе лакказы участвуют два субстрата и инвариантный [O2], который, как полагают, присутствует в насыщающей концентрации, KM для разных субстратов считали кажущейся ($K_{{\text{M}}}^{{{\text{app}}}}$). При допущении, что 100% лакказы участвует в катализе как активный фермент, измеренные kcat и Vmax также считали кажущимися ($k_{{{\text{cat}}}}^{{{\text{app}}}}$ и $V_{{{\text{max}}}}^{{{\text{app}}}}$).
Температурная и рН-стабильность лакказы. Термостабилььность выбранных вариантов лакказы анализировали, инкубируя грубый концентрированный супернатант среды культивирования при разных температурах (15, 25, 37, 55 и 70°C) в течение 120 мин и оставляли при 4°C до измерения активности. Лакказную активность определяли при 25°C в предварительно описанных условиях с 1 мM ABTS в качестве субстрата в 100 мM натрий-ацетатном буфере (pH 4.4). Влияние pH на стабильность лакказы исследовали, инкубируя супернатанты при разных значениях pH в 100 мM ацетатном буфере (pH 3.5‒4.5) или в 100 мM фосфатном буфере (pH 5‒7.5) в течение 180 мин при 25°C. Концентрированные супернатанты переносили в стандартные реакционные смеси для определения лакказной активности с 1 мM ABTS в качестве субстрата (pH 4.4), затем рассчитывали удельную активность каждого варианта (SA).
Влияние температуры и рН на активность лакказы. Для изучения действия температуры концентрированные супернатанты инкубировали при 15, 25, 37, 55 и 70°C в течение 30 мин, активность лакказы определяли при соответствующей температуре в стандартных условиях [21]. Влияние рН на активность лакказы определяли в концентрированном супернатанте в 100 мM ацетатном буфере/100 мM фосфатном буфере (pH 3.5‒7.5) при 25°C с 1 мM ABTS в качестве субстрата, затем рассчитывали удельную активность каждого варианта.
Скрининг окисления фенольных соединения. Окисление соединений определяли по протоколу, описанному Pardo и соавт. [7] с некоторыми изменениями. Катехол, ванильную кислоту, галловую кислоту, феруловую кислоту и ванилин получили от “Sigma-Aldrich” (ФРГ). Исходные 10 мM растворы готовили в 20%-ном этаноле за исключением катехола, который растворяли в воде. Реакции проводили в 96-луночных планшетах, добавляя 10 мкл концентрированного экстракта лакказы, 180 мкл 100 мM ацетатного буфера pH 5.0 и 20 мкл исходного раствора субстрата в лунку. Контрольную реакцию проводили в отсутствие субстрата. Реакции проводили в двух повторах для каждого варианта в планшетном ридере (“Bio-Rad”, CША, Model 680) с каждым субстратом при подходящей длине волны (400‒450 нм). Показания снимали после инкубации в течение 0, 0.5, 1, 2, 4, 6, 8 и 24 ч. Среднее значение ΔAbs на 1 мкг белка рассчитывали для каждого варианта и нормировали по активности LAC3 дикого типа. Относительную активность каждого варианта по отношению к активности контрольной LAC3 рассчитывали согласно следующей формуле [7]:
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Дизайн и экспрессия вариантов UNIK лакказы
С целью получения единичных экспонированных функционализованных остатков лизина, локализованных на разных расстояниях от медных сайтов T1 или T2/3, сначала анализировали 3D модель поверхности фермента LAC3-K0. На поверхности K0 экспонированы 115 аминокислотных остатков, остатки глицина и пролина мы не рассматривали, чтобы избежать потенциально крупных изменений структурно-функциональных отношений в молекуле белка. Из оставшихся 85 аминокислотных остатков с разной степенью экспонированности растворителю для замены на остаток лизина были отобраны семь в домене 2 (который содержит небольшое число консервативных остатков). Эти остатки локализованы на разных расстояниях от медного сайта 1, из них консервативным в лакказах является только Q238 (рис. 1). Расстояние от сайта мутации до T1 во всех потенциальных вариантах UNIK LAC3 рассчитывали на основе модели. Таким образом, на первом этапе мы ввели остатки К, которые будут находиться на расстоянии от 17.5 до 41 Å от T1 (табл. 1 ). В этой работе все варианты UNIK лакказы, экспрессируемые в S. cerevisiae в виде секретируемых белков, обладали способностью окислять гваякол, ABTS и выбранные субстраты (рис. S1 Приложения, см. Дополнительные материалы на сайте http://www.molecbio.ru/downloads/2022/4/ supp_Arteaga-Castrejón_rus.pdf). Примечательно, что спонтанные мутации, возникшие в ходе мутагенеза и приведшие к дополнительным заменам на поверхности двух производных UNIK ‒ UNIK269 (D96N/V269K/T479A) и UNIK291 (A89S/D291K) ‒ без нарушения ферментативной активности. Поэтому эти мутанты включили в исследование и сравнили с соответствующими единичными UNIK-мутантами. Биохимические свойства вариантов анализировали с использованием грубых супернатантов без дальнейшей очистки. Активности нормировали по содержанию белка (относительная удельная активность).
Определение кажущихся кинетических параметров
Кажущиеся кинетические параметры ($V_{{{\text{max}}}}^{{{\text{app}}}}$, $k_{{{\text{cat}}}}^{{{\text{app}}}}$ и $K_{{\text{M}}}^{{{\text{app}}}}$) получали путем подгонки кривой Vi = = f([ABTS]) по уравнению Михаэлиса‒Ментен. Величины $K_{{\text{M}}}^{{{\text{app}}}}$ имели субмиллимолярные значения (≈0.3‒0.9 мM). Примечательно, что они находились в том же диапазоне, что и у контрольного фермента ‒ 0.27‒0.30 у UNIK269 тройного мутанта. Значения $V_{{{\text{max}}}}^{{{\text{app}}}}$ были относительно близкими у разных вариантов за исключением мутантного варианта V269K, у которого оно было немного выше ‒ в 1.5‒2 раза (табл. 2 ). С другой стороны, UNIK238 и UNIKD96N/V269K/T479A имели сходные значения $k_{{{\text{cat}}}}^{{{\text{app}}}}$ ‒ 30.25 и 32.24, соответственно, более высокие, чем у остальных вариантов.
Tаблица 2. Кинетические параметры ферментативней активности вариантов LAC3 в концентрированном грубом экстрактеa
| Параметр | K0 | Q238K | D254K | V269K | T270K | D283K | D291K | A293K | D96N/V269K/ T479A |
A89S/D291 |
|---|---|---|---|---|---|---|---|---|---|---|
| SAb, U/мг | 2.52 ± ± 0.20 | 3.92 ± ± 0.27 | 3.58 ± ± 0.15 | 4.44 ± ± 0.21 | 2.80 ± ± 0.08 | 2.90 ± ± 0.11 | 2.42 ± ± 0.06 | 6.07 ± ± 0.36 | 18.58 ± 0.27 | 21.02 ± ± 0.24 |
| Vmax, мкM/мин | 5.54 ± ± 0.27 | 4.55 ± ± 0.18 | 5.24 ± ± 0.10 | 8.22 ± ± 0.29 | 2.85 ± ± 0.075 | 2.96 ± ± 0.10 | 2.98 ± ± 0.09 | 3.94 ± ± 0.06 | 11.98 ± 0.21 | 6.00 ± ± 0.07 |
| KM, мМ | 0.64 ± ± 0.08 | 0.28 ± ± 0.01 | 0.48 ± ± 0.02 | 0.27 ± ± 0.001 | 0.40 ± ± 0.02 | 0.43 ± ± 0.01 | 0.45 ± ± 0.03 | 0.46 ± ± 0.03 | 0.30 ± 0.004 | 0.81 ± ± 0.01 |
| kcat, с‒1 | 16.7376 | 30.2539 | 11.8157 | 18.0768 | 3.7858 | 4.8349 | 5.5861 | 10.1747 | 32.3469 | 10.0784 |
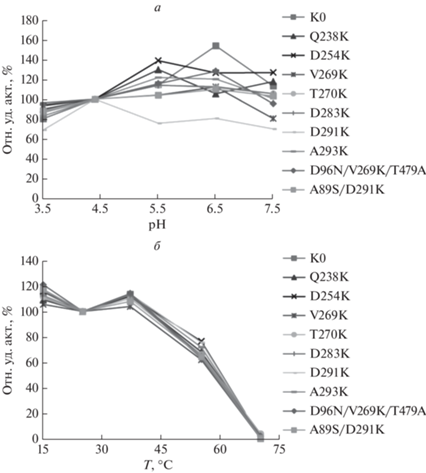
pH и температурная стабильность
Стабильность вариантов лакказы оценивали, преинкубируя ферменты при разных температурах или значениях рН и определяя остаточную активность окисления ABTS. Стабильность вариантов оставалась постоянной в интервале pH 5.5‒7.5 с ABTS в качестве субстрата и слегка увеличивалась при pH 5.5 у большинства вариантов в отличие от стабильности лакказы UNIK291, сниженной примерно на 20% при pH 5.5 и 6.5. Показано, что LAC3-K0 была более стабильной, чем мутантные варианты, причем стабильность увеличивалась на 53% при pH 6.5 (рис. 2а). Обнаружено, что все варианты остаются стабильными при температуре от 15 до 37°C; после 120 мин инкубации при 55°C сохраняется от 63 до 75% исходной активности. Все варианты полностью инактивируются после продолжительной инкубации при 70°C (рис. 2б).
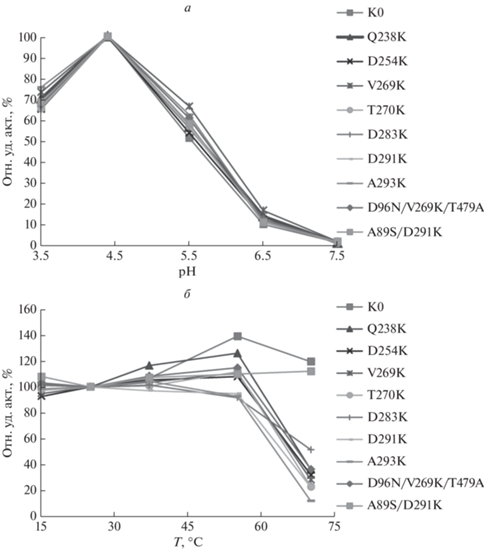
Влияние pH и температуры на активность лакказы
Самая высокая активность лакказы обнаружена при кислых значениях pH 4.5 (рис. 3а). При более высоких значениях pH активность лакказы во всех случаях снижается почти до нуля (при pH 7.5 потеря активности достигает 98%). Активность вариантов лакказы, достаточно стабильная в интервале 15‒55°C, резко снижается при температуре выше 55°C у большинства вариантов. Напротив, относительные активности K0-контроля и варианта UNIKA89S/D291K оставались стабильными до 70°C (рис. 3б).
Окисление фенольных соединений
Лакказы грибов известны своей способностью к окислению соединений, образующихся из лигнина [23]. В качестве субстратов лакказ были выбраны пять фенольных соединений с разными химическими структурами (табл. 1S, см. Приложение). Окисление фенольных соединений изучали с использованием концентрированных экстрактов каждого варианта. Все варианты и контроль K0 сохраняют способность окислять все пять соединений (рис. 4). Относительные активности нормировли по активности LAC3, определенной с использованием каждого субстрата.
Рис. 4.
Значения относительной активности вариантов лакказы по отношению к разным фенольным соединениям, использованным в качестве субстрата. Активность вариантов нормировали по активности LAC3.
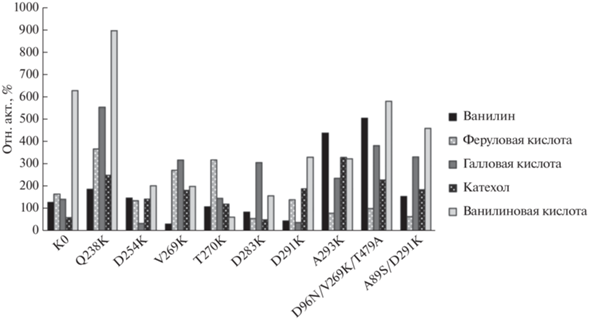
Обнаружено, что мутанты UNIK293 и UNIKD96N/V269K/T479A наиболее активно окисляли ванилин, тогда как UNIK238, UNIK269 и UNIK270 активнее других окисляли феруловую кислоту. UNIK238 окисляет галловую кислоту в 1.4 раза лучше, чем K0. Способность к окислению катехола повышена у всех вариантов, особенно у UNIK238, UNIK293 и UNIKD96N/V269K/T479A. Наконец, UNIK238 окисляет ванилиновую кислоту в 10 раз быстрее, чем LAC3, что делает этот вариант наиболее эффективным для окисления тестируемых соединений.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Лакказы грибов являются “зелеными” катализаторами со значительным биотехнологическим потенциалом во многих приложениях [9]. Недавно эти ферменты начали использовать для разработки гибридных NM. Ковалентное связывание лакказ с поверхностью NM может придавать им новые свойства, еще не обнаруженные в природе, а контролируемое направленное связывание фермента с поверхностью NM может быть предпосылкой к тонкой настройке эффективности гибридного материала. Поэтому экспонируемая растворителю поверхность молекулы каждого фермента представляет собой требующий изучения ландшафт для выявления горячих точек рациональной функционализации остатками лизина, участвующими в дальнейших реакциях сопряжения. В этой работе нами использован фермент, лишенный остатков лизина (K0), полученный из лакказы LAC3 (содержит два природных остатка лизина), продуцируемой штаммом Trametes sp. C30. K0 функционирует как платформа для введения новых единичных остатков лизина в отобранные сайты на поверхности фермента (рис. 1). На первом этапе семь из 85 экспонированных на поверхности остатков, расположенных на разном расстоянии от T1Cu, заместили остатками К. Все уникальные производные UNIK, включая варианты со спонтанными поверхностными заменами, в дополнение к единственному остатку лизина, остаются активными по отношению к набору испытанных субстратов, что свидетельствует о консервативности свойств sine qua non лакказ, которые желательно сохранить консервативными. Близость T1Cu к сайту функционализации может усиливать положительный эффект после ковалентной иммобилизации лакказы, например, отмечено увеличение эффективности DET при контролируемой ориентации фермента по отношению к материалу электрода [18, 24]. Ковалентное связывание с поверхностью NM, происходящее при алкилировании остатков лизина, создает бимолекулярный интерфейс, определяемый химической природой материала и микроокружения экспонированных на поверхности остатков вокруг точки функционализации.
Все варианты UNIK, сконструированные в работе, и два мутанта LAC3 с единичными остатками лизина (UNIK157 и UNIK161), ранее охарактеризованные Robert и соавт. [18], имели сравнимую или даже несколько повышенную активность, а также сходную с LAC3 и K0 рН- и термостабильность (рис. 3 и табл. 2 ). На первом этапе для исключения потери ферментативной активности мы выбрали неконсервативные аминокислотные остатки, включая спонтанные мутанты; консервативным у лакказ был только Q238 [25].
Все варианты UNIK сохранили способность окислять все пять выбранных фенольных соединений в разной степени. Величина $K_{{\text{M}}}^{{{\text{app}}}}$ у мутантов Q238K (68%), V269K (69%), D96N/ V269K/T479A (66%) была ниже, чем у LAC3. Величина kcat возросла с 2.2 до 7 раз у большинства вариантов. Более значительное повышение отмечено у UNIK238, UNIK269 и UNIKD96N/V269K/T479A (табл. 2 ). Влияние этих мутаций на KM и kcat соответствовало данным Mollania и соавт. [26]. Из единичных мутантов самую высокую каталитическую эффективность в отношении всех исследованных субстратам имел UNIK238, локализованный на расстоянии 17.5 Å от T1. Таким образом, Q238 (консервативный у лакказ базидиомицетов) может критически влиять на аффинность к субстрату, благодаря гибкости боковой цепи лизина и увеличению локальной гидрофобной сети. Более того, большинство вариантов сохраняют способность окислять производные п-гидробензойной кислоты (галловая и ванилиновая кислоты). Напротив, ванилин-п-гидроксибензальдегид эффективно окисляется вариантами UNIKD96N/V269K/T479A и UNIK293, тогда как другие варианты были менее активными. С другой стороны, UNIK238, UNIK293 и UNIKD96N/V269K/T479A лучше окисляли катехол. Феруловая кислота, производное п-гидроксикоричной кислоты, хорошо окислялась вариантами UNIK238, UNIK269 и UNIK270. Эти результаты подтверждают предположение Festa и соавт. [27], согласно которому мутации, не затрагивающие каталитический карман в лакказах, могут влиять на эффективность и стабильность фермента, хотя эти белки содержат обширные высококонсервативные и функционально важные районы. Относительная удельная активность случайно полученного варианта UNIKD96N/V269K/T479A была заметно выше, чем у единичного мутанта UNIK269. Дополнительные замены поверхностных остатков D96N и T479A, найденные в этом варианте, не сближены пространственно с таргетной заменой V269K. Однако из внимательного анализа нашей модели следует, что положения 96 и 479 расположены “лицом к лицу” в интерфейсе между капредоксин-подобным доменом 1 и доменом 3. Поэтому вполне вероятно, что эта новая комбинация аминокислот (N96, A479) локально влияет на третичную структуру лакказы на границе D1/D3 с дистанционным влиянием на окисление субстрата. В целом, можно думать, что если мутантные сайты не находятся в тесном контакте, то высока вероятность аддитивного мутационного эффекта. Напротив, если такие мутации контактируют, то их вклад оказывается низким [28, 29]. Феноменом аддитивности можно объяснить положительный эффект, наблюдаемый у UNIKD96N/V269K/T479A, но такой эффект отсутствует у варианта UNIKA89S/D291K.
Не обнаружено общей тенденции во взаимосвязи между структурой субстрата и активностью разных вариантов, а высокий редокс-потенциал лакказы не всегда гарантирует более эффективное окисление субстрата [30]. Гидрофобное окружение T1Cu является одной из главных биохимических детерминант в модуляции редокс-потенциала лакказ грибов, и введение даже более интенсивной гидрофобной сети вблизи сайта T1Cu может приводить к положительному эффекту. Редокс-потенциал можно повысить без полной модификации каталитического кармана, поскольку подобная модификация может затруднить взаимодействие с субстратом [31]. Такие элементы белка, как локальный заряд, HP и гликозильные остатки могут вносить важный вклад в новый межмолекулярный интерфейс, образующийся после ковалентного связывания NM и лакказы. Хорошо документировано, что HP являются главными элементами, модулирующими лиганд-рецепторные взаимодействия [32]. Распределение HP можно рассматривать, вероятно, как главный фактор, влияющий на интерфейс между лакказой и NM, или интерфейс, образованный соседними молекулами LAC3 на поверхности NM. Разные HP, разбросанные по поверхности K0 (рис. S2, см. Приложение), могут быть важными для дизайна взаимодействующих областей в зависимости от природы используемого NM. Отметим, что распределение остатков K, по-видимому, вносит главный вклад в границы полярных/неполярных поверхностей в разных HP [32, 33] и положительно влияет на структурно-функциональные отношения в молекуле лакказы. Поэтому, помимо рационального выбора остатков лизина для функционализации (селективность реакции, распределение в природном ферменте), наиболее целесообразным представляется использование этой специфической аминокислоты, способной играть главную роль в дизайне гетерогенных интерфейсов. Например, у варианта Q238K остатки, окружающие положение 238 (N211; S236; F240, P300, рис. S3 Приложения, см. Дополнительные материалы на сайте http://www.molecbio.ru/downloads/ 2022/4/supp_Arteaga-Castrejón_rus.pdf), формируют bona fide HP, которые могут способствовать гидрофобному вкладу лизина и положительно влиять на гидрофобный карман вблизи T1. Однако при планировании проведения функционализации необходимо тщательно изучать поведение каждого мутанта, чтобы выяснить роль, которую играет HP.
ЗАКЛЮЧЕНИЕ
Все варианты UNIK сохраняют такие ферментативные свойства, как окислительная активность и операционная стабильность. Таким образом, относительно большая область поверхности LAC3, экспонированная растворителю, по-видимому, может оставаться толерантной к мутациям в разных сайтах без драматического изменения структурно-функциональных отношений. Это поддерживает представления о том, что лакказа может быть функционализирована из любого положения на поверхности, встроенной в редокс-структуру (материал электрода или комплекс переходного металла). По этой причине UNIK238, UNIK269 и UNIK270 можно использовать для последующего встраивания электродов в ориентации, способствующей DET к T1. С другой стороны, UNIK254, UNIK283, UNIK291 или UNIK293 обеспечивают точку для закрепления на конце домена 2 и создают таким образом возможность проверки противоположной ориентации DET. Таким образом, для тонкой настройки взаимодействий между иммобилизованной LAC3 и встроенным материалом необходимо изучение множественных сайтов.
Мы признательны Dr. Bertrand B. (ICF, UNAM) за обсуждение работы и критические замечания.
Выполнение работы поддержано CONACyT ‒ ANUIES ECOS NORD и ECOS NORD UNIVERSITÉ PARIS 13 project no. 277027, а также грантом Conacyt scholarship для Ariana Arteaga (Plateforme AVB).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследования.
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
Mate D.M., Alcalde M. (2017) Laccase: a multi-purpose biocatalyst at the forefront of biotechnology. Microbial Biotechnol. 10, 1457‒1467.
Stanzione I., Pezzella C., Giardina P., Sannia G., Piscitelli A. (2020) Beyond natural laccases: extension of their potential applications by protein engineering. Appl. Microbiol. Biotechnol. 104, 915‒924.
Bertrand B., Martinez-Morales F., Trejo-Hernandez M.R. (2017) Upgrading laccase production and biochemical properties: strategies and challenges. Biotechnol. Prog. 33, 1015‒1034.
Martínez A.T., Ruiz-Dueñas F.J., Camarero S., Serrano A., Linde D., Lund H., Vind J., Tovborg M., Herold-Majumdar O.M., Hofrichter M., Liers C., Ullrich R., Scheibner K., Sannia G., Piscitelli A., Pezzella C., Sener M.E., Kılıç S., van Berkel W.J.H., Guallar V., Lucas M.F., Zuhse R., Ludwig R., Hollmann F., Fernández-Fueyo E., Record E., Faulds C.B., Tortajada M., Winckelmann I., Rasmussen J.-A., Gelo-Pujic M., Gutiérrez A., Del Río J.C., Rencoret J., Alcalde M. (2017) Oxidoreductases on their way to industrial biotransformations. Biotechnol. Adv. 35, 815‒831.
Pardo I., Rodríguez-Escribano D., Aza P., de Salas F., Martínez A.T., Camarero S. (2018) A highly stable laccase obtained by swapping the second cupredoxin domain. Sci. Rep. 8, 15669.
Su J., Fu J., Wang Q., Silva C., Cavaco-Paulo A. (2018) Laccase: a green catalyst for the biosynthesis of poly-phenols. Crit. Rev. Biotechnol. 38, 294‒307.
Pardo I., Camarero S. (2015) Exploring the oxidation of lignin-derived phenols by a library of laccase mutants. Molecules. 20, 15929‒15943.
Yin Q., Zhou G., Peng C., Zhang Y., Kües U., Liu J., Xiao Y., Fang Z. (2019) The first fungal laccase with an alkaline pH optimum obtained by directed evolution and its application in indigo dye decolorization. AMB Express. 9, 151.
Pezzella C., Guarino L., Piscitelli A. (2015) How to enjoy laccases. Cell. Mol. Life Sci. 72, 923‒940.
Mateo C., Palomo J.M., Fernandez-Lorente G., Guisan J.M., Fernandez-Lafuente R. (2007) Improvement of enzyme activity, stability and selectivity via immobilization techniques. Enzyme Microbial. Technol. 40, 1451‒1463.
Hoarau M., Badieyan S., Marsh E.N.G. (2017) Immobilized enzymes: understanding enzyme – surface interactions at the molecular level. Org. Biomol. Chem. 15, 9539‒9551.
Shen L., Zhu J. (2016) Oriented protein nanoarrays on block copolymer template. Macromol. Rapid Commun. 37, 494‒499.
Liu Y., Ogorzalek T.L., Yang P., Schroeder M.M., Marsh E.N.G., Chen Z. (2013) Molecular orientation of enzymes attached to surfaces through defined chemical linkages at the solid–liquid interface. J. Am. Chemical Soc. 135, 12660‒12669.
Lalaoui N., Rousselot-Pailley P., Robert V., Mekmouche Y., Villalonga R., Holzinger M., Cosnier S., Tron T., Le Goff A. (2016) Direct electron transfer between a site-specific pyrene-modified laccase and carbon nanotube/gold nanoparticle supramolecular assemblies for bioelectrocatalytic dioxygen reduction. ACS Catalysis. 6, 1894‒1900.
Gentil S., Rousselot-Pailley P., Sancho F., Robert V., Mekmouche Y., Guallar V., Tron T., Le Goff A. (2020) Efficiency of site-specific clicked laccase–carbon nanotubes biocathodes towards O2 reduction. Chemistry – A Eur. J. 26, 4798‒4804.
Klonowska A., Gaudin C., Asso M., Fournel A., Rég-lier M., Tron T. (2005) LAC3, a new low redox potential laccase from Trametes sp. strain C30 obtained as a recombinant protein in yeast. Enzyme Microbial. Technol. 36, 34‒41.
Mekmouche Y., Schneider L., Rousselot-Pailley P., Faure B., Simaan A.J., Bochot C., Réglier M., Tron T. (2015) Laccases as palladium oxidases. Chem. Sci. 6, 1247‒1251.
Robert V., Monza E., Tarrago L., Sancho F., De Falco A., Schneider L., Npetgat Ngoutane E., Mekmouche Y., Pailley P.R., Simaan A.J., Guallar V., Tron T. (2017) Probing the surface of a laccase for clues towards the design of chemo-enzymatic catalysts. ChemPlusChem. 82, 607‒614.
Hebditch M., Warwicker J. (2019) Web-based display of protein surface and pH-dependent properties for assessing the developability of biotherapeutics. Sci. Rep. 9, 1969.
Gietz R.D., Woods R.A. (2006) Yeast transformation by the LiAc/SS carrier DNA/PEG method in yeast protocol. Ed. Xiao W. Totowa, N.J.: Humana Press, pp. 107‒120.
Zhou S., Rousselot-Pailley P., Ren L., Charmasson Y., Dezord E.C., Robert V., Tron T., Mekmouche Y. (2018) Production and manipulation of blue copper oxidases for technological applications. Methods Enzymol. 613, 17‒61.
Bradford M.M. (1976) A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein–dye binding. Analyt. Biochem. 72, 248‒254.
Wang X., Yao B., Su X. (2018) Linking enzymatic oxidative degradation of lignin to organics detoxification. Int. J. Mol. Sci. 19, 3373.
Li Y., Zhang J., Huang X., Wang T. (2014) Construction and direct electrochemistry of orientation controlled laccase electrode. Biochem. Biophys. Res. Commun. 446, 201‒205.
Koschorreck K., Schmid R.D., Urlacher V.B. (2009) Improving the functional expression of a Bacillus licheniformis laccase by random and site-directed mutagenesis. BMC Biotechnol. 9, 12.
Mollania N., Khajeh K., Ranjbar B., Hosseinkhani S. (2011) Enhancement of a bacterial laccase thermostability through directed mutagenesis of a surface loop. Enzyme Microb. Technol. 49, 446‒452.
Festa G., Autore F., Fraternali F., Giardina P., Sannia G. (2008) Development of new laccases by directed evolution: functional and computational analyses. Proteins: Structure, Function, Bioinformatics. 72, 25‒34.
Ming D., Chen R., Huang H. (2018) Amino-acid network clique analysis of protein mutation non-additive effects: a case study of lysozyme. Int. J. Mol. Sci. 19, 1427.
Konishi A., Ma X., Yasukawa K. (2014) Stabilization of Moloney murine leukemia virus reverse transcriptase by site-directed mutagenesis of surface residue Val433. Biosci. Biotechnol. Biochem. 78, 75‒78.
Glazunova O.A., Trushkin N.A., Moiseenko K.V., Filimonov I.S., Fedorova T.V. (2018) Catalytic efficiency of basidiomycete laccases: redox potential versus substrate-binding pocket structure. Catalysts. 8, 152.
Mateljak I., Monza E., Lucas M.F., Guallar V., Aleksejeva O., Ludwig R., Leech D., Shleev S., Alcalde M. (2019) Increasing redox potential, redox mediator activity, and stability in a fungal laccase by computer-guided mutagenesis and directed evolution. ACS Catalysis. 9, 4561‒4572.
Lijnzaad P., Berendsen H.J.C., Argos P. (1996) Hydrophobic patches on the surfaces of protein structures. Proteins: Structure, Function, Bioinformatics. 25, 389‒397.
Ernst H.A., Jørgensen L.J., Bukh C., Piontek K., Plattner D.A., Østergaard L.H., Larsen S., Bjerrum M.J. (2018) A comparative structural analysis of the surface properties of asco-laccases. PLoS One. 13, e0206589.
Дополнительные материалы
- скачать ESM_1.docx
- Supplementary
Инструменты
Молекулярная биология