Молекулярная биология, 2022, T. 56, № 4, стр. 642-651
Молекулярная диагностика вовлеченности в процесс малигнизации визуально нормальной слизистой при уротелиальном раке мочевого пузыря
Т. А. Богуш a, *, А. А. Башарина a, З. М. Сафаров a, И. Э. Мизаева a, А. Н. Гришанина a, Е. А. Богуш b, Я. В. Гриднева a, М. И. Волкова a, В. Б. Матвеев a, В. С. Косоруков a
a Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина
Министерства здравоохранения Российской Федерации
115478 Москва, Россия
b Первый Московский государственный медицинский университет им. И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет)
119991 Москва, Россия
* E-mail: tatbogush@mail.ru
Поступила в редакцию 17.02.2022
После доработки 09.03.2022
Принята к публикации 09.03.2022
- EDN: XNHHOD
- DOI: 10.31857/S0026898422040036
Аннотация
Иммунофлуоресцентным методом и проточной цитометрией провели количественную оценку экспрессии опухоль-ассоциированного белка βIII-тубулина (TUBB3) в ткани уротелиального рака мочевого пузыря и визуально нормальной слизистой (суммарно – 56 образцов). Экспрессия маркёра выявлена в 100% случаев, при значительной гетерогенности уровня экспрессии TUBB3 как в опухоли, так и в “нормальной” слизистой. Уровень TUBB3 в “нормальной” слизистой не зависел от удаленности относительно опухоли (1 см или более 3 см) и в среднем по группе был статистически значимо ниже, чем в опухолевой ткани (соответственно 21.8 ± 10.8% и 24.9 ± 13.2% vs 35.2 ± 12.4%; p = 0.04 и 0.005). Выявлено повышение экспрессии TUBB3 в опухоли и в “нормальной” слизистой при инвазивной по сравнению с неивазивной в мышечный слой формой рака мочевого пузыря. Таким образом, при уротелиальном раке мочевого пузыря опухоль-ассоциированный белок TUBB3 может являться молекулярным маркёром вовлеченности в процесс малигнизации слизистой мочевого пузыря и прогнозировать риск мышечной инвазии опухоли, что влияет на формулировку показаний к ранней цистэктомии.
ВВЕДЕНИЕ
Бета-тубулины – семейство белков, входящих в состав микротрубочек, среди которых наиболее полно изучен βIII-тубулин (TUBB3). Белок регистрируют в широком спектре опухолей разных локализаций [1] и традиционно ассоциируют с устойчивостью к противоопухолевым препаратам из группы таксанов [2‒4]. Эти препараты, связываясь с β-тубулином, нарушают динамику микротрубочек, вызывают остановку митоза и, в конечном счете, апоптоз [5, 6]. Сообщалось, что TUBB3 связан с резистентностью к еще одной группе антитубулиновых агентов – алкалоидам Винка [7].
Уровень TUBB3 в опухоли ассоциирован также с агрессивностью заболевания и регионарным метастазированием. В экспериментах in vitro показано, что экспрессия TUBB3 связана с реализацией клеточного фенотипа, устойчивого к неблагоприятным воздействиям, таким как гипоксия, недостаток глюкозы или окислительный стресс [8‒10]. Включение данной изоформы β-тубулина в состав микротрубочек изменяет их динамические свойства, усиливает клеточную подвижность и позволяет эпителиальным клеткам терять связь с базальной мембраной и мигрировать за нее [11‒13]. В итоге гиперэкспрессия TUBB3 в опухоли увеличивает ее метастатический потенциал.
Уникальность TUBB3 как потенциального опухолевого маркёра заключается в том, что этот белок практически не экспрессируется в эпителиальных тканях. В норме его экспрессия регистрируется только в нейронах, меланоцитах, эндотелиоцитах и макрофагах с низким уровнем и интенсивностью, на порядки отличающихся от аналогичных показателей в опухоли [1]. Это позволило нам сформулировать гипотезу о возможности диагностики локальной молекулярной распространенности опухолевого процесса в пораженном органе на основании оценки экспрессии TUBB3 в нормальной ткани, окружающей опухолевый очаг. Реальность этого предположения была подтверждена в экспериментах на животных [14] и затем – при клинических исследованиях [15‒17]. Наличие клеток, экспрессирующих TUBB3, выявлено в визуально нормальной ткани соответствующего органа при опухолях разных локализаций: немелкоклеточном раке легкого, раке желудка и пищевода, – при этом уровень экспрессии маркёра значительно варьировал от пациента к пациенту [15‒17].
Таким образом, белок TUBB3 как потенциальный молекулярный маркёр имеет три модальности: предиктивную (предсказывающую резистентность к химиотерапии), прогностическую (предсказывающую агрессивность течения болезни) и диагностическую (определяющую локальную распространенность опухолевого процесса в пораженном органе).
В настоящем исследовании мы развили последнее направление, предложив возможность молекулярной диагностики вовлеченности визуально нормальной слизистой мочевого пузыря в процесс малигнизации при поражении органа уротелиальным раком мочевого пузыря. Это заболевание принято рассматривать как исходно многофокусное поражение слизистой мочевого пузыря [18‒20], а потому выявление опухоль-ассоциированного маркёра TUBB3 в визуально нормальной слизистой может быть показателем степени ее вовлеченности в процесс малигнизации. В свою очередь такого рода данные могут стать дополнительным ориентиром в прогнозе агрессивности течения болезни, что особенно ценно при исследовании материала, полученного в ходе трансуретральной резекции.
Сказанное и определило цель исследования, в котором проведена сравнительная количественная оценка уровня экспрессии TUBB3 в ткани уротелиального рака мочевого пузыря и окружающей нормальной слизистой органа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материал исследования. Дизайн исследования включал сравнительный анализ уровня экспрессии TUBB3 в образце ткани уротелиального рака мочевого пузыря и в двух образцах визуально нормальной слизистой того же больного. Всего исследовано 56 образцов нормальной и опухолевой ткани 18 пациентов. Характеристика больных, включенных в исследование, представлена в табл. 1.
Таблица 1.
Характеристика больных раком мочевого пузыря, включенных в исследование (n = 18)
| Характеристики | ||
| Средний возраст (годы) – 61.1 ± 10.3 | ||
| Пол | мужчины – 83.3% | |
| женщины – 16.7% | ||
| Гистологический тип опухоли, согласно классификации ВОЗ (2004 г.) | ||
| Уротелиальный рак in situ – 16.7% | ||
| Папиллярный уротелиальный рак | низкой степени злокачественности – 50.0% | |
| высокой степени злокачественности – 33.3% | ||
Непосредственно сразу после выполнения трансуретральной резекции или цистэктомии образцы ткани объемом от 8 до 125 мм3 помещали в 4%-ный раствор формальдегида (рН 7.4). У каждого пациента исследована опухолевая ткань, а также два образца визуально нормальной слизистой: вблизи опухоли (на расстоянии около 1 см) и вдали от нее (на расстоянии более 3 см).
Не менее чем через двое суток фиксации в формальдегиде каждый образец подвергали многоступенчатой процедуре подготовки одноклеточной суспензии, пригодной для работы на проточном цитометре. Подробно метод описан ранее [21].
Иммунофлуоресцентное окрашивание и проточная цитометрия. Суспензию опухолевых клеток (2 × 105 клеток/мл) в 0.5%-ном растворе бычьего сывороточного альбумина (BSA), приготовленном в фосфатном буфере (pH 7.4), инкубировали в течение 1.5 ч при комнатной температуре в темноте с первичными моноклональными кроличьими антителами к TUBB3 (ab52623, клон EP1569Y, “Abcam”, Великобритания) в разведении 1 : 500. После однократной отмывки в 20-кратном объеме 0.5%-ного раствора BSA, приготовленного в фосфатном буфере (pH 7.4), клетки инкубировали в течение 1.5 ч при 4°C в темноте со вторичными антикроличьими антителами, конъюгированными с флуоресцентной меткой DyLight 650 (ab98510, “Abcam”), в разведении 1 : 500. Для удаления из анализа разрушенных клеток и эритроцитов суспензию в течение 15 мин инкубировали с ДНК-красителем Hoechst 33258 (“Sigma-Aldrich”, США) в концентрации 1.2 мгк/мл, после чего дважды отмывали 20‑кратным объемом 0.5%-ного раствора BSA.
Иммунофлуоресцентное окрашивание образцов опухолевой и нормальной ткани мочевого пузыря, полученных от одного больного, проводили в одном эксперименте. В качестве контроля активности антител в каждом опыте использовали культуру клеток рака молочной железы MCF-7 (ATCC, США).
Измерение флуоресценции клеток проводили на проточном цитометре Navios (“Beckman Coulter”, США). Флуоресценцию красителей DyLight 650 и Hoechst 33258 регистрировали на каналах FL6 и FL9 соответственно.
В работе оценен уровень экспрессии TUBB3 – количество специфически флуоресцирующих клеток (%) относительно контроля (инкубация клеток только с вторичными антителами), – рассчитанный в программе FlowJo 10.0 (FlowJo, LLC) с помощью теста Колмогорова–Смирнова.
Ранжирование молекулярного прогноза течения болезни в соответствии с уровнем экспрессии TUBB3 в визуально нормальной слизистой мочевого пузыря проведено следующим образом:
1) благоприятный – уровень экспрессии TUBB3 в “норме” не превышает 20%;
2) настороженный – уровень экспрессии TUBB3 в “норме” >20%, но <40%;
3) неблагоприятный – уровень экспрессии TUBB3 в “норме” ≥ 40%.
Статистический анализ. Статистическая обработка полученных данных проведена с помощью метода квантильных диаграмм, критерия Шапиро–Уилка, для попарного сравнения групп использовали Тьюки-тест. Эти методы включены в пакет GraphPad Prism 7.0 (GraphPad Software). Различия считали статистически значимыми при p ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Экспрессия TUBB3 в визуально нормальной слизистой и в ткани рака мочевого пузыря
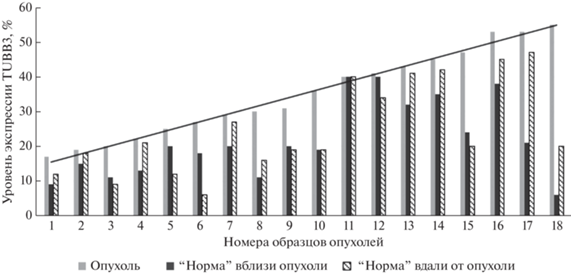
Из 36 хирургических образцов нормальной слизистой мочевого пузыря экспрессия TUBB3 выявлена в 100% случаев (рис. 1). Учитывая, что исследование включает опухоли на самых ранних этапах их развития, этот результат подтверждает правомочность рассмотрения немышечно-инвазивного рака мочевого пузыря как “болезни слизистой”. Молекулярная вовлеченность визуально нормальной ткани в процесс малигнизации у разных больных оказалась различной, так как в разных парах сравнения отмечены в разной степени выраженные различия между уровнем экспрессии TUBB3 в “норме” по сравнению с опухолью того же больного – от практически полного совпадения (образец 11) до 9-кратно более низкого значения (образец 18). Ни у одного пациента не выявлено более высокой экспрессия TUBB3 в нормальной слизистой по сравнению с опухолью.
Рис. 1.
Распределение образцов ткани рака мочевого пузыря и визуально нормальной слизистой органа по уровню экспрессии TUBB3. Образцы ранжированы от минимального до максимального значения уровня экспрессии TUBB3 в ткани рака мочевого пузыря. Серая линия – это линия тренда, построенная по показателям уровня экспрессии TUBB3 в опухолевой ткани.
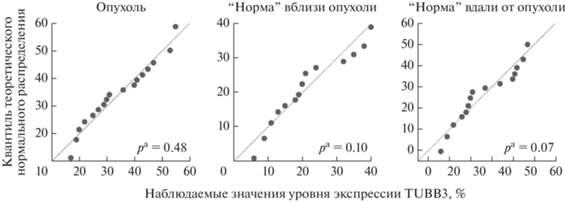
На рис. 2 представлены квантильные диаграммы, на которых приведен характер распределения уровня экспрессии TUBB3 в опухоли и в “нормальной” слизистой мочевого пузыря. Видно, что во всех трех случаях значения уровня экспрессии TUBB3 подчинялись закону нормального распределения (p > 0.05), что учтено при дальнейшей статистической обработке результатов.
Рис. 2.
Квантильные диаграммы характера распределения показателей уровня экспрессии TUBB3 в опухолевой и “нормальной” слизистой мочевого пузыря. Прямая линия на рисунке соответствует нормальному распределению (линия регрессии); pa ‒ уровень значимости, рассчитанный с помощью критерия Шапиро‒Уилка; нулевая гипотеза о нормальности распределения показателя в выборке принималась при p > 0.05.
Несомненный самостоятельный интерес представляет результат анализа количественных показателей уровня экспрессии TUBB3 у разных больных. Данные, представленные на рис. 1 и в табл. 2, демонстрируют значительную гетерогенность опухолей по количественным показателям уровня экспрессии TUBB3 у разных пациентов: от минимального значения – 17%, до максимального – 55% (медиана – 33.5%, среднее значение – 35.2 ± 12.4%).
Таблица 2.
Количественные показатели экспрессии TUBB3 в клетках рака мочевого пузыря и в визуально нормальной слизистой
| № группы | Образец ткани | Уровень экспрессии TUBB3, % | ||||
|---|---|---|---|---|---|---|
| Среднее значениеa | Медиана [Q1; Q2]b |
Тьюки-тест | ||||
| группы сравнения | pc | |||||
| I | Опухоль | 35.2 ± 12.4 | 33.5 [24.5; 45.5] |
I vs II | 0.005 | |
| II | “Норма”d | 1 | 21.8 ± 10.8 | 20.5 [12.5; 32.5] |
II vs III | 0.72 |
| III | 2 | 24.9 ± 13.2 | 20.0 [15.0; 40.5] |
I vs III | 0.04 | |
a Среднее значение ± стандартное отклонение. b Нижняя и верхняя квартили соответственно. c Уровень значимости, рассчитанный при попарном сравнении групп Тьюки-тестом); нулевая гипотеза об отсутствие различий по показателю экспрессии маркёра при попарном сравнении групп отклонялась при p < 0.05. Полужирным шрифтом выделены статистически значимые различия. d Здесь и далее: образцы визуально нормальной слизистой мочевого пузыря вблизи и вдали от опухоли: 1 – на расстоянии 1 см, 2 – на расстоянии более 3 см.
Столь же гетерогенна по уровню экспрессии TUBB3 “нормальная” ткань мочевого пузыря по группе в целом; при этом как медианы показателей для образцов нормальной слизистой вблизи опухоли и в отдалении, так и средние значения не различались между собой и составили 20.5% vs 20.0% и 21.8 ± 10.8% vs 24.9 ± 13.2% соответственно.
Статистический анализ результатов с использованием Тьюки-теста показал, что количественный уровень экспрессии TUBB3 статистически значимо выше в опухолях по сравнению с образцами визуально нормальной слизистой мочевого пузыря ‒ как вблизи (р = 0.005), так и вдали от новообразования (р = 0.04).
Уровень экспрессии TUBB3 в зависимости от инвазии опухоли в мышечной слой
В табл. 3 представлен анализ результатов исследования уровня экспрессии TUBB3 в образцах уротелиального рака мочевого пузыря и визуально нормальной слизистой органа. Деление на группы сравнения проведено в зависимости от наличия инвазии опухоли в мышечный слой – с инвазией (группа I) и без инвазии (группа II). В группу III включены образцы опухолей и “нормальной” слизистой мочевого пузыря, когда диагностировать наличие мышечной инвазии опухоли не удалось из-за отсутствия в материале фрагментов мышечной ткани.
Таблица 3.
Уровень экспрессии TUBB3 в образцах визуально нормальной слизистой и поверхностного рака мочевого пузыря
| № | Гистологический диагноз | Уровень экспрессииTUBB3, % | Прогнозa | Вид операцииb | ||
|---|---|---|---|---|---|---|
| опухоль | “норма” | |||||
| 1 | 2 | |||||
| 1 | I. Без инвазии в мышечный слой | 17 | 9 | 12 | благоприятный | ТУР |
| 2 | 19 | 15 | 18 | |||
| 3 | 20 | 11 | 9 | |||
| 4 | 22 | 13 | 21 | |||
| 5 | 25 | 20 | 12 | |||
| 6 | 27 | 18 | 6 | |||
| 7 | 30 | 11 | 16 | |||
| 8 | 31 | 20 | 19 | |||
| 9 | 29 | 20 | 27 | настороженный | ||
| 10 | 45 | 35 | 42 | неблагоприятный | ||
| 11 | II. Инвазия в мышечный слой | 41 | 40 | 34 | неблагоприятный | ЦЭ |
| 12 | 53 | 38 | 45 | |||
| 13 | 40 | 40 | 40 | |||
| 14 | 43 | 32 | 41 | ТУР → ЦЭ | ||
| 15 | III. Неизвестно | 47 | 24 | 20 | настороженный | ТУР |
| 16 | 53 | 21 | 47 | неблагоприятный | ||
| 17 | 36 | 19 | 19 | благоприятный | ||
| 18 | 55 | 6 | 20 | |||
a Прогноз развития заболевания на основании уровня экспрессии TUBB3 в визуально нормальных тканях: благоприятный (≤20%); настороженный (>20%, но <40%); неблагоприятный (≥40%). b Хирургическое лечение проведено методом трансуретральной резекции (ТУР), цистэктомии (ЦЭ) или реализовано оба подхода (ТУР → ЦЭ).
Прежде всего, стоит обратить внимание на различие средних значений уровня экспрессии TUBB3 в опухоли между группами I и II – 26.5% vs 44.3%. Это может указывать на ассоциацию уровня экспрессии TUBB3 в опухоли с инвазией в мышечный слой, то есть с нарастанием агрессивности опухолевого процесса.
В группе I отчетливо просматриваются также различия по уровню экспрессии TUBB3 в опухоли и в образцах визуально нормальной слизистой мочевого пузыря независимо от ее удаленности от новообразования. Суммарно, среднее значение уровня экспрессии TUBB3 в “норме” составило 17.7%, что статистически значимо отличается от показателя в опухоли – 26.5% (р = 0.01).
Другая картина отмечена в группе II с инвазией опухоли в мышечный слой и высокими показателями уровня экспрессии TUBB3: не выявлено статистически значимых различий в уровне экспрессии TUBB3 в опухоли и в образцах “нормальной” слизистой мочевого пузыря. Суммарный средний уровень экспрессии TUBB3 в “норме” составил 38.8%, а в опухоли – 44.3% (р > 0.05).
Ранжирование молекулярного прогноза течения болезни в соответствии с уровнем экспрессии TUBB3 в визуально нормальной слизистой мочевого пузыря проведено, опираясь на следующие данные. Так, в группе I без инвазии опухоли в мышечный слой в 80% случаев индивидуальный показатель уровня экспрессии TUBB3 не превысил 20% (при среднем значении 17.7%). Учитывая, что существует некий фон показателя, ассоциированный с наличием в исследуемом материале нейронов, клеток эндотелия и макрофагов с крайне низкой экспрессией TUBB3, который, по данным литературы и собственным оценкам, суммарно может достигать 10% [1, 14], выявленный в исследуемом образце ткани уровень экспрессии TUBB3 ≤20% является крайне низким. Именно поэтому уровень экспрессии TUBB3 в визуально нормальной слизистой ≤20% следует рассматривать как указание на благоприятный прогноз течения болезни.
Только у двух из 10 больных в группе I без инвазии опухоли в мышечный слой отмечен более высокий уровень экспрессии TUBB3 в нормальной ткани (табл. 3, образцы № 9 и № 10). По нашему мнению, в этих случаях прогноз течения болезни необходимо рассматривать соответственно как “настороженный” и “неблагоприятный”.
Согласно такой оценке, у всех пациентов группы II с подтвержденной инвазией опухоли в мышечный слой по результатам молекулярного фенотипирования TUBB3 можно прогнозировать неблагоприятное течение заболевания. Следует отметить, что у всех больных в этой группе высокий уровень экспрессии TUBB3 в опухоли практически не отличался от “нормальной” слизистой мочевого пузыря, как вблизи, так и отдаленно от опухолевого узла.
Подтверждением правомочности подобного рассмотрения результатов молекулярного фенотипирования может быть клинический случай, приведенный в нашем исследовании (образец № 14 в табл. 3). По результатам анализа образцов опухоли и визуально нормальной ткани, полученных во время трансуретральной резекции, у больного диагностирован неблагоприятный молекулярный прогноз течения болезни. Спустя 3 месяца по совокупности клинических признаков диагностировано прогрессирование болезни и больному выполнена цистэктомия.
Что же касается группы III, в которой из-за отсутствия адекватного материала не удалось оценить инвазию опухоли в мышечный слой, по результатам молекулярного тестирования в нее вошли больные с разным прогнозом. Эти пациенты, а также все больные из группы I остаются под динамическим наблюдением в реальном времени для того, чтобы достоверно оценить практическую информативность молекулярной диагностики “нормальной” слизистой в прогнозе агрессивности течения уротелиального рака мочевого пузыря. Особенно важным это может оказаться для тех случаев, когда при трансуретральном вмешательстве не удается получить фрагмент мышечной ткани и достоверно оценить степень ее инвазии опухолевыми клетками. А случаев таких, как видно из представленного материала, немало – 4 из 14 трансуретральных резекций (около 30%).
Реальные гистограммы распределения клеток по интенсивности внутриклеточной флуоресценции после завершения иммунофлуоресцентного окрашивания, по результатам которого количественно оценивается уровень экспрессии белка TUBB3 в исследуемой ткани, представлены на рис. 3.
Рис. 3.
Примеры гистограмм распределения клеток в зависимости от интенсивности клеточной флуоресценции при иммунофлуоресцентном окрашивании опухоль-ассоциированного белка TUBB3. Сигнал флуоресценции детектировали в канале FL6 проточного цитометра. На серых гистограммах представлены контрольные образцы, которые инкубировали только со вторичными антителами, конъюгированными с флуоресцентным красителем; на прозрачных – экспериментальные образцы (инкубация с антителами к TUBB3 и затем со вторичными антителами); числа на гистограммах – уровень экспрессии маркёра (%).
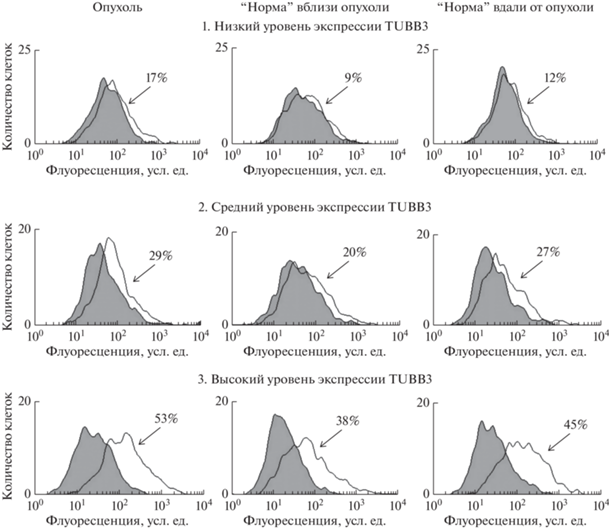
Первый ряд гистограмм демонстрирует результат анализа, который дает благоприятный молекулярный прогноз заболевания (табл. 3, № 1). Видно, что уровень экспрессии TUBB3 низкий как в опухоли, так и в двух образцах “нормальной” слизистой: 17, 9 и 12% соответственно.
Второй ряд гистограмм демонстрирует результат анализа, который выявил уровень экспрессии TUBB3 в опухоли и в одном из образцов “нормы” около 30% (табл. 3, № 9). Согласно предложенной градации, молекулярный диагноз распространенности опухолевого процесса в слизистой мочевого пузыря в этом случае настороженный, хотя при гистологическом исследовании инвазии опухоли в мышечный слой не выявлено.
И наконец, третий пример относится к неблагоприятному молекулярному прогнозу (табл. 3, образец № 12). Как в опухоли, так и в “нормальной” слизистой выявлен высокий уровень экспрессии TUBB3: 53, 38 и 45% соответственно. В совокупности это указывает на выраженную локальную распространенность опухолевого процесса в слизистой мочевого пузыря и в данном случае молекулярный диагноз совпадает с гистологическим заключением о наличии мышечной инвазии опухоли.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Молекулярная диагностика опухолей является важнейшим ориентиром в мотивированном выборе тактики хирургического и лекарственного ведения пациентов с разными злокачественными новообразованиями. Раздел, который мы развиваем в последние годы, – молекулярная диагностика локальной распространенности процесса в пораженном органе с использованием уникального маркёра TUBB3.
Уникальная особенность этого белка состоит в том, что его экспрессия ассоциирована с опухолевой трансформацией, а в нормальной эпителиальной ткани TUBB3 в незначительных количествах выявляется лишь в нейронах, эндотелиоцитах и макрофагах [1]. Этот факт и лег в основу сформулированного ранее предположения о возможности использования TUBB3 для “молекулярного вылавливания” опухолевых клеток из визуально и морфологически нормальной ткани, окружающей опухолевый очаг. И реальность такого подхода к оценке локальной распространенности опухолевого процесса была подтверждена нами при изучении немелкоклеточного рака легкого, рака желудка и пищевода [10‒12].
В настоящем исследовании опухоль-ассоциированный белок TUBB3 был изучен как возможный молекулярный маркёр вовлеченности в опухолевый процесс визуально нормальной слизистой, окружающей очаг немышечно-инвазивного рака мочевого пузыря.
Суммируя полученные результаты, прежде всего необходимо отметить их отличительную особенность – они получены при количественной оценке уровня исследуемого молекулярного маркёра иммунофлуоресцентным методом, ассоциированным с проточной цитометрией. Используя новую методологию, мы получили прямое доказательство того, что опухоль-ассоциированный белок TUBB3 может рассматриваться как новый молекулярный маркёр, позволяющий надежно, количественно оценить при поверхностном раке мочевого пузыря вовлеченность в процесс малигнизации визуально нормальной слизистой. Следует заметить, что в большом числе исследований сообщается о безусловном вкладе TUBB3 как в резистентность к противоопухолевой терапии, так и в агрессивность течения онкологических заболеваний [7, 22, 23].
Какова фундаментальная и практическая значимость описания новой модальности TUBB3? Прежде всего, это важно с точки зрения оценки агрессивности на разных этапах течения болезни, что потенциально может быть ориентиром в выборе тактики хирургического и лекарственного лечения опухолей вообще и уротелиального рака мочевого пузыря в частности. В последнем случае это особенно актуально для немышечно-инвазивных опухолей, при которых дополнительный фактор риска рецидива может повлиять на решение вопроса о показаниях к повторной трансуретральной резекции мочевого пузыря, на выбор вида и продолжительности адъювантной внутрипузырной терапии, а также на интенсивность наблюдения за пациентом. Весьма перспективным в практическом плане представляется дальнейшее изучение выявленной корреляции между вовлеченностью в процесс малигнизации нормальной слизистой мочевого пузыря и инвазией опухоли в мышечный слой. По результатам проведенного исследования обнаружение опухоль-ассоциированного белка TUBB3 более чем в 40% клеток “нормальной” слизистой указывает на инвазию опухоли в мышечный слой, то есть на ее агрессивность. Теоретически, появление молекулярного маркёра, свидетельствующего не только о высоком риске поражения уротелия, локализующегося за пределами визуально определяемой опухоли, но и о риске мышечной инвазии, способно оказать влияние на формулировку показаний к ранней цистэктомии.
Учитывая тот факт, что гиперэкспрессия TUBB3 является молекулярным маркёром резистентности опухоли к ряду антитубулиновых противоопухолевых препаратов [2‒4], следует отметить, что оценка уровня экспрессии этого молекулярного маркёра в опухоли имеет самостоятельное значение и должна быть использована для мотивированного включения этих препаратов в схемы лечения рака мочевого пузыря.
И наконец, необходимо подчеркнуть, что полученные результаты подтверждают справедливость ранее высказанного нами утверждения, что морфологически нормальная ткань, окружающая опухоль, является источником актуальной информации и должна подвергаться молекулярной диагностике наряду с тканью новообразования. Как и в случае с TUBB3, при этом могут быть получены важные сведения для понимания “молекулярного патогенеза” малигнизации слизистой мочевого пузыря.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации (соглашение о субсидии № 075-15-2021-1060 от 28.09.2021) и в рамках НИР ФГБУ “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России 2020–2022 гг. (№ АААА-А20-120020690077-0).
Все процедуры, выполненные в данной работе, соответствуют этическим стандартам Институционального комитета по исследовательской этике и Хельсинкской декларации 1964 года и ее последующим изменениям или сопоставимым нормам этики. У всех пациентов получено письменное информированное согласие.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Person F., Wilczak W., Hube-Magg C., Burdelski C., Möller-Koop C., Simon R., Noriega M., Sauter G., Steurer S., Burdak-Rothkamm S., Jacobsen F. (2017) Prevalence of βIII-tubulin (TUBB3) expression in human normal tissues and cancers. Tumour Biol. 39(10), 1010428317712166.
Prassanawar S.S., Panda D. (2019) Tubulin heterogeneity regulates functions and dynamics of microtubules and plays a role in the development of drug resistance in cancer. Biochem. J. 476(9), 1359‒1376.
Parker A.L., Teo W.S., McCarroll J.A., Kavallaris M. (2017) An emerging role for tubulin isotypes in modulating cancer biology and chemotherapy resistance. Int. J. Mol. Sci. 18(7), 1434.
Duran G.E., Wang Y.C., Moisan F., Francisco E.B., Sikic B.I. (2017) Decreased levels of baseline and drug-induced tubulin polymerisation are hallmarks of resistance to taxanes in ovarian cancer cells and are associated with epithelial-to-mesenchymal transition. Br. J. Cancer. 116(10), 1318‒1328.
Čermák V., Dostál V., Jelínek M., Libusová L., Kovář J., Rösel D., Brábek J. (2020) Microtubule-targeting agents and their impact on cancer treatment. Eur. J. Cell Biol. 99(4), 151075.
Kaul R., Risinger A.L., Mooberry S.L. (2019) Microtubule-targeting drugs: more than antimitotics. J. Nat. Prod. 82(3), 680‒685.
Krause W. (2019) Resistance to anti-tubulin agents: from vinca alkaloids to epothilones. Cancer Drug Resist. 2, 82‒106.
Kanakkanthara A., Miller J.H. (2021) βIII-tubulin overexpression in cancer: causes, consequences, and potential therapies. Biochim. Biophys. Acta Rev. Cancer. 1876(2), 188607.
Raspaglio G., Filippetti F., Prislei S., Penci R., De Maria I., Cicchillitti L., Mozzetti S., Scambia G., Ferlini C. (2008) Hypoxia induces class III beta-tubulin gene expression by HIF-1alpha binding to its 3' flanking region. Gene. 409(1‒2), 100‒108.
Raspaglio G., De Maria I., Filippetti F., Martinelli E., Zannoni G.F., Prislei S., Ferrandina G., Shahabi S., Scambia G., Ferlini C. (2010) HuR regulates β-tubulin isotype expression in ovarian cancer. Cancer Res. 70(14), 5891‒5900.
Sobierajska K., Wieczorek K., Ciszewski W.M., Sacewicz-Hofman I., Wawro M.E., Wiktorska M., Boncela J., Papiewska-Pajak I., Kwasniak P., Wyroba E., Cierniewski C.S., Niewiarowska J. (2016) β-III tubulin modulates the behavior of Snail overexpressed during the epithelial-to-mesenchymal transition in colon cancer cells. Biochim. Biophys. Acta. 1863(9), 2221‒2233.
Liu Z., Li S., Dong J., Miao Y. (2021) TUBB3 promotes growth and invasion of gallbladder cancer cells by Akt/mTOR signal pathway. J. Environ. Pathol. Toxicol. Oncol. 40(2), 23‒33.
Sekino Y., Han X., Babasaki T., Miyamoto S., Kitano H., Kobayashi G., Goto K., Inoue S., Hayashi T., Teishima J., Sakamoto N., Sentani K., Oue N., Yasui W., Matsubara A. (2020) TUBB3 is associated with high-grade histology, poor prognosis, p53 expression, and cancer stem cell markers in clear cell renal cell carcinoma. Oncology. 98(10), 689‒698.
Богуш Т.А., Маяк М.А., Сапрыкина Н.С., Башарина А.А., Рябинина О.М., Гришанина А.Н., Богуш Е.А., Каменский А.А., Косоруков В.С. (2021) Экспериментальная проверка гипотезы о возможности молекулярной диагностики локальной распространенности опухоли на модели рака легкого Льюис. Вест. Моск. ун-та, сер. 2, Химия. 4, 341‒347.
Bogush T.A., Mamichev I.A., Dudko E.A., Grisha-nina A.N., Ramanauskaite R.J., Vichljantzeva N.O., Tjulandin S.A., Polotsky B.E., Davydov M.I. (2015) The comparative estimation of TUBB3 expression in non-small-cell lung carcinoma and adjacent lung tissue. Ann. Oncol. 26(Suppl. 1), i10‒i14.
Мамичев И.А., Богуш Т.А., Богуш Е.А., Гришанина А.Н., Вихлянцева Н.О., Сапрыкина Н.С., Каменский А.А. (2019) Экспрессия бета-III тубулина в ткани рака пищевода и окружающей морфологически нормальной ткани. Росс. биотерапевтический журнал. 18(3), 48‒52.
Богуш Т.А., Капура-Бреховских Е.М., Башарина А.А., Богуш Е.А., Кирсанов В.Ю., Абу-Хайдар О.Б., Лозбина П.А., Вихлянцева Н.О., Косоруков В.С. (2021) Сравнительный иммунофлуоресцентный анализ экспрессии бета-III тубулина (TUBB3) в ткани злокачественных новообразований желудка и морфологически нормальной окружающей ткани органа. Вест. Моск. ун-та, сер.2, Химия. 3, 223‒229.
Матвеев Б.П., Фигурин К.М., Карякин О.Б. (2001) Рак мочевого пузыря. Mосква: Вердана. 254 с.
Acar Ö., Özkurt E., Demir G., Saraç H., Alkan C., Esen T., Somel M., Lack N.A. (2015) Determining the origin of synchronous multifocal bladder cancer by exome sequencing. BMC Cancer. 15, 871.
Wu C.H., Silvers C.R., Messing E.M., Lee Y.F. (2019) Bladder cancer extracellular vesicles drive tumorigenesis by inducing the unfolded protein response in endoplasmic reticulum of nonmalignant cells. J. Biol. Chem. 294(9), 3207‒3218.
Bogush T.A., Basharina A.A., Eliseeva B.K., Kaliuzhny S.A., Bogush E.A., Kirsanov V.Y., Davydov M.M., Kosorukov V.S. (2020) A new approach to epithelial-mesenchymal transition diagnostics in epithelial tumors: double immunofluorescent staining and flow cytometry. Biotechniques. 69(4), 257‒263.
Miyata Y., Matsuo T., Nakamura Y., Yasuda T., Ohba K., Takehara K., Sakai H. (2018) Expression of class III beta-tubulin predicts prognosis in patients with cisplatin-resistant bladder cancer receiving paclitaxel-based second-line chemotherapy. Anticancer Res. 38(3), 1629‒1635.
Hinsch A., Chaker A., Burdelski C., Koop C., Tsourlakis M.C., Steurer S., Rink M., Eichenauer T.S., Wilczak W., Wittmer C., Fisch M., Simon R., Sauter G., Büschek F., Clauditz T., Minner S., Jacobsen F. (2017) βIII-tubulin overexpression is linked to aggressive tumor features and genetic instability in urinary bladder cancer. Hum. Pathol. 61, 210‒220.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


