Молекулярная биология, 2023, T. 57, № 1, стр. 139-148
Влияние нокаута основных генов транссульфурации на паттерн белкового синтеза у D. melanogaster
А. Ш. Заклута a, В. Ю. Шилова a, О. Г. Зацепина a, *
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: olzacepina@yandex.ru
Поступила в редакцию 01.07.2022
После доработки 21.07.2022
Принята к публикации 21.07.2022
- EDN: AWNKFK
- DOI: 10.31857/S0026898423010160
Аннотация
Ферменты пути транссульфурации и продукции сероводорода – цистатионин-β-синтаза (CBS), цистатионин-γ-лиаза (CSE) и 3-меркаптопируват-сульфотрансфераза (3-МST) – играют важную цитопротекторную роль в организме. Ранее с помощью технологии CRISPR/Cas9 мы получили линии Drosophila melanogaster с делециями генов cbs, cse, mst, а также с двойной делецией генов cbs и cse. Нами проанализировано влияние этих делеций на паттерн белкового синтеза в слюнных железах личинок третьего возраста и в яичниках половозрелых мух. В слюнных железах линий с делециями cbs и cse обнаружено снижение накопления белка FBP2, содержащего 20% остатков метионина. В яичниках выявлены изменения в уровне экспрессии и в точках изофокусирования белков, участвующих в защите клеток от окислительного стресса, гипоксии и в деградации белков. Показано, что степень окисленности белков в линиях мух с делециями ферментов транссульфурации сходна со степенью окисленности в контрольной линии. Обнаружено снижение общего количества протеасом и их каталитических субъединиц в линиях с делециями генов cbs и cse.
ВВЕДЕНИЕ
Сероводород (H2S), считавшийся ранее относительно токсичным газом, исследуется в настоящее время в качестве биологического медиатора, участвующего во многих физиологических процессах у всех высших организмов.
Сероводород имеет важное значение для устойчивости клеток к окислительному стрессу и влияет на продолжительность жизни [1–5]. H2S является эндогенным модулятором окислительного стресса, удаляющим активные радикалы кислорода (ROS) и азота [6], увеличивающим уровень внутриклеточного глутатиона (GSH) [7], повышающим уровень антиоксидантной защиты [6]. Ферменты цистатионин-β-синтаза (CBS), цистатионин-γ-лиаза (CSE) и 3-меркаптопируват-сульфотрансфераза (3-МST) играют центральную роль в синтезе H2S, превращая гомоцистеин в цистеин после распада метионина [8, 9] в результате реакции транссульфурации (TSP). Показано, что подавление экспрессии гена cbs приводит к накоплению гомоцистеина и развитию гомоцистинурии – мультисистемного расстройства, затрагивающего соединительную и мышечную ткань, центральную нервную систему и сердечно-сосудистую систему [10]. CBS также необходима для женской репродуктивной функции [11]. Противоречивые результаты получены при исследовании мышей со сниженной экспрессией гена cse. Одни авторы показали, что делеция гена cse или подавление его экспрессии улучшают выживаемость мышей при эндотоксическом шоке, снижая уровень воспалительной реакции [12–14]. Согласно другим данным, экспрессия cse играeт важную роль в функционировании эндотелия и состоянии сосудов, способствуя ангиогенезу в ишемизированных участках и увеличивая проницаемость эндотелия [15, 16], а также может ингибировать прогрессию нейродегенеративных заболеваний [17].
Нами получены линии Drosophila melanogaster с делецией основных генов серного метаболизма [18]. Анализ транскриптома целых мух с делецией генов cbs и cse, а также двойных трансформантов выявил изменения в уровне экспрессии множества генов, вовлеченных в различные биологические процессы. Наиболее существенными были изменения уровня экспрессии генов, участвующих в процессах окислительного восстановления и репродукции [18].
Модельная система дрозофилы делает возможным изучение влияния делеций генов серного метаболизма на уровне целого организма. Интересно было понять, какие физиологические параметры подвергаются наибольшим изменениям при делеции этих генов. Выявлены значимые нарушения в функционировании репродуктивной системы самок. Отмечена задержка в развитии яичников и в откладке яиц у линий мух с делецией гена cbs, задержка в развитии на стадиях от откладки яиц до окукливания и сокращение длительности репродуктивного возраста у линий с двойной делецией генов cbs и cse [19].
В представленной работе методом двумерного электрофореза изучены паттерны белков из слюнных желез личинок третьего возраста, а также из яичников 5-дневных мух D. melanogaster с делецией генов cbs, cse и mst. В линиях с делецией генов серного метаболизма выявлены изменения в уровне экспрессии ряда белков. Исследована активность и общее количество протеасом в изучаемых линиях мух.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Содержание дрозофил. В работе использовали лабораторные линии D. melanogaster, полученные из стокового центра Bloomington Drosophila Stock Center (линия 58492), а также линии с делецией генов серного метаболизма, полученные в нашей лаборатории – линия с делецией гена cbs (CBS–/–), линия с делецией гена cse (CSE–/–), линии с делециями обоих генов (CBS–/–;CSE–/– (1) и CBS–/–;CSE–/– (2)), линия с делецией гена mst (MST–/–). В эксперименте использовали девственных самок, которых содержали в течение 5 дней в пробирках со стандартным кормом при температуре +24°C, не более 20 самок в пробирке.
Двумерный электрофорез белков (2D). Для получения белковых проб для 2D-электрофореза из личинок третьего возраста извлекали слюнные железы (или яичники из 5-дневных самок) в фосфатно-солевом буфере (PBS). Слюнные железы метили в течение 1 ч в 200 мкл PBS, добавляя 1 мкл (1.85 MBq) L-35S-метионина (“Amersham Biosciences Corp.”, США). Одновременно готовили немеченые пробы. Далее железы лизировали в 75 мкл буфера О′Фаррелла с 1% PMSF и 1% коктейля ингибиторов протеаз (“Amresco”, США), растирали и центрифугировали (10 мин, 10 000 g). Супернатант замораживали в жидком азоте и хранили при –70°С. 2D-электрофорез проводили согласно классическому методу О’Фаррелла [20] с некоторыми вариациями. На первое направление c изофокусом 3.5–9 pH наносили лизат из 10 пар слюнных желез. После изофокусирования столбики геля извлекали из трубок, промывали в течение 40 мин в буфере Лэммли для подготовки к электрофорезу во втором направлении и замораживали при –80°С. Во втором направлении белки разделяли методом диск-электрофореза в 11%-ном полиакриламидном геле (ПААГ). После окрашивания гели высушивали для последующей радиоавтографии. Радиоавтографию проводили на Typhoon FLA 9500 (“GE Healthcare Life Sciences”, США). Гели окрашивали в 0.2%-ном растворе Coomassie Brilliant Blue G-250, вырезали белковые пятна, которые использовали для проведения масс-спектрометрического анализа.
Измерение активности протеасом. Активность протеасом измеряли в соответствии с [21] с некоторыми изменениями. Пятидневных самок дрозофилы замораживали в жидком азоте, далее гомогенизировали в лизирующем буфере NP40 (50 мM Tрис-HCl pH 7.4, 150 мM NaCl, 1% NP40). Концентрацию белка определяли по методу Бредфорда. В полученные 25 мкг лизата с концентрацией белка 1 мкг/мкл добавляли 50 мкМ Me4 BodipyFL-Ahx 3 Leu 3 VS (флуоресцентно меченный аналог субстрата, реагирующий с N-концевым треонином всех активных субъединиц протеасом).
Образцы инкубировали в течение 1 ч при +37°C. Белки разделяли с помощью гель-электрофореза в денатурирующих условиях (SDS-PAGE) в 12.5%-ном ПААГ. Сканирование геля проводили на системе ChemiDoc MP (возбуждение при 480 нм и эмиссия при 530 нм).
Измерение общего количества протеасом. Для определения количества протеасом мух замораживали в жидком азоте и лизировали в буфере Лэммли. Белки разделяли в 12.5%-ном ПААГ. После электрофореза белки переносили на нитроцеллюлозную мембрану (“Amersham Protran 0.45 µm”, Великобритания) методом полусухого блотинга. Протеасомы выявляли с помощью первичных антител к субъединицам α1, 2, 3, 5, 6 & 7 20S протеасомы (MCP231, “Enzo Life Sciences”, Швейцария, разведение 1 : 1000) и вторичных антител козы к IgG мыши, конъюгированных с пероксидазой хрена (HRP) (разведение 1 : 5000). Иммунные комплексы выявляли с помощью хемилюминесцентного набора Thermo Scientific SuperSignal West Pico Plus (США) с последующей визуализацией на системе ChemiDoc MP.
MALDI-TOF-масс-спектрометрия. Масс-спектрометрию пептидов после трипсинолиза белков проводили, как описано ранее [22]. Белки идентифицировали, используя программное обеспечение Mascot (www.matrixscience.com) в базе NCBI.
Обсчет данных и статистический анализ. В каждом эксперименте анализировали по три биологических повтора. При измерении активности протеасом интенсивность свечения обсчитывали по общему количеству белка, окрашенного Coomassie Brilliant Blue G-250. При измерении общего количества протеасом в качестве внутреннего контроля использовали актин. Результаты обрабатывали с помощью программы Fiji. В каждом эксперименте рассчитывали стандартные отклонения и значение t-коэффициента Стьюдента.
Детекция окисленных белков. Пятидневных мух замораживали в жидком азоте. Гомогенизировали в буфере RIPA, содержащем 2% β-меркаптоэтанола. Окисление белков оценивали с помощью набора OxyBlot Protein Oxidation Detection Kit (“Millipore”, США) в соответствии с инструкциями производителя. В этом методе карбонильные группы белков дериватизируют до 2,4-динитрофенилгидразона (ДНФ-гидразон) путем реакции с 2,4-динитрофенилгидразином (ДНФГ). Далее ДНФ-дериватизированные белки выявляют методом Вестерн-блотинга с помощью антител, специфичных к ДНФ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изменения в уровне накопления белка жирового тела у линий мух с делецией гена cbs
Ранее мы показали, что у линий D. melanogaster с делецией гена cbs, особенно у линий с двойной делецией генов cbs и cse, наблюдается задержка развития на стадиях от откладки яиц до окукливания [19]. С целью выявления возможных причин удлинения времени развития мы провели протеомный анализ белков, выделенных из слюнных желез личинок третьей стадии развития.
Анализ меченных метионином белков из слюнных желез изучаемых линий мух выявил множественные незначительные различия в уровне синтеза белков с низким уровнем экспрессии, детектируемые при включении метионина, но не видимые при окрашивании гелей Coomassie. Нами обнаружено значимое различие в уровне экспрессии белка жирового тела 2 (FBP2) (рис. 1). Ген fbp2 кодирует белок из 256 аминокислотных остатков, который накапливается в жировом теле личинок третьей стадии и в куколках. Этот белок гомологичен алкогольдегидрогеназе, кодируемой геном Adh, но не обладает ферментативной активностью. Кодируемый fbp2 полипептид содержит 20% остатков метионина, тогда как в зрелом полипептиде, кодируемом Adh, имеется лишь один остаток метионина [23]. Предполагается, что FBP2 является белком, служащим источником метионина и серы, необходимых на стадии метаморфоза дрозофилы.
Рис. 1.
Включение S35-метионина в белки слюнных желез Drosophila melanogaster. Белки разделяли методом двумерного электрофореза. Слюнные железы выделяли из линий: 58492 – контроль, линии с делециями CSE–/– и CBS–/–, и с двойной делецией CBS–/–;CSE–/–. Стрелка указывает положение белка FBP2.
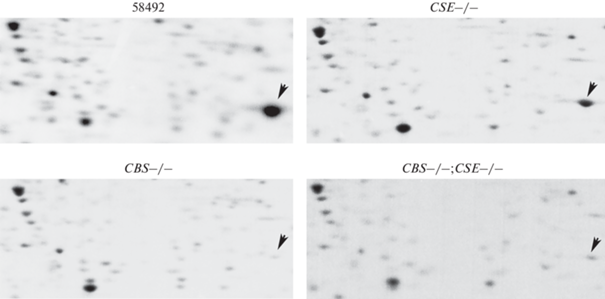
На рис. 1 видно мощное включение метионина в белок FBP2 (отмечен стрелкой) в контрольной линии и снижение уровня включения метионина в этот белок в линии с делецией гена cse. В линиях с делецией гена cbs и с двойной делецией генов cbs и cse наблюдали наиболее значительное снижение синтеза этого белка.
Анализ гелей, окрашенных в растворе Coomassie, подтвердил различия в уровне накопления белка FBP2 в анализируемых линиях (рис. 2). Мы также проанализировали линию с делецией гена mst. Делеция этого гена не влияет на путь транссульфурации и, соответственно, на синтез аминокислот. Уровень синтеза белка FBP2 в этой линии остается таким же, как в контрольной линии (не показано).
Рис. 2.
Двумерный электрофорез белков слюнных желез. Гели окрашивали в 0.2%-ном растворе Coomassie Brilliant Blue G-250. Стрелкой отмечен белок FBP2.
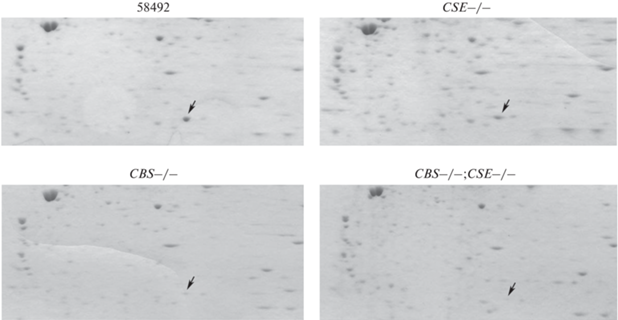
Проведенный нами ранее анализ уровня аминокислот [24] выявил двух–трехкратное увеличение количества свободного метионина в линиях мух с делецией гена cbs и с двойной делецией генов cbs и cse. Таким образом, наши результаты показывают существование обратной корреляции между уровнем свободного метионина и уровнем экспрессии белка FBP2 и предполагают, что накопление этого белка зависит от уровня накопления метионина. Можно предположить, что нарушение пути транссульфурации (рис. 3), приводящее к накоплению метионина и снижению уровня цистеина, может влиять на уровень синтеза запасающих белков, используемых в процессе метаморфоза.
Рис. 3.
Путь транссульфурации и трансметилирования. Гомоцистеин синтезируется из метионина, получаемого с пищей. Гомоцистеин может быть реметилирован в метионин под действием 5,10–метилентетрагидрофолатредуктазы (MTHFR). CBS конденсирует гомоцистеин с серином с образованием цистатионина, который служит субстратом для CSE при синтезе цистеина. CSE может генерировать H2S либо из цистеина, либо из гомоцистеина. CBS при генерировании H2S использует комбинацию цистеина и гомоцистеина. Третий фермент, генерирующий H2S, 3-MST, в сочетании с цистеинамино-трансферазой (CAT) использует цистеин для образования H2S.

Анализ протеома яичников
Ранее мы выявили изменения в развитии яичников и плодовитости у самок дрозофилы с делецией гена cbs и с двойной делецией генов cbs и cse [19]. В данной работе методом 2D-электрофореза изучали синтез белков в яичниках девственных пятидневных самок этих линий. Наиболее значимые различия наблюдали при сравнении линий с двойной делецией CBS–/–;CSE–/– с контрольной линией (рис. 4).
Рис. 4.
Двумерный электрофорез белков, выделенных из яичников 5-дневных девственных самок контрольной линии 58492 и линии с двойной делецией CBS–/–;CSE–/–. Окрашивание Coomassie Brilliant Blue G-250. Цифрами отмечены белки, идентифицированные методом пептидного фингерпринтинга (табл. 1).

Интересно, что среди белков с измененным уровнем экспрессии или с измененной точкой изофокусирования идентифицированы два белка, относящихся к семейству тиоредоксинов (рис. 4, белки #1 (Jafrac1) и #7 (Thioredoxin- like); табл. 1). Тиоредоксины – высококонсервативные белки, содержащие в активном центре каталитически активный цистеиновый S–S-мостик. Тиоредоксины обладают свойствами редокс-активного дисульфида белковой природы и служат переносчиками электронов, а также играют важную роль в защите клеток от окислительного стресса путем детоксикации пероксидов. Экспрессия гена jafrac1 в нейронах снижает уровень ROS, восстанавливает функцию митохондрий, ослабляет активацию JNK, вызванную паракватом [25]. Из рис. 4 видно, что в линии CBS–/–;CSE–/– повышен уровень экспрессии белков #1 и #7, а белок Jafrac1 сдвинут в кислую сторону, что свидетельствует о модификации этого важного белка. Транскриптомный анализ, проведенный нами ранее, выявил увеличение уровня экспрессии jafrac1 у самцов с делетированными генами cbs и cse [18]. Также мы наблюдали повышение уровня экспрессии мРНК [18] и белка Lethal(2)-37Cc. Уровень экспрессии белка Lethal(2)-37Cc увеличивается при хронической гипоксии и имеет адаптогенный эффект [26]. Наш транскриптомный анализ выявил увеличение экспрессии всех генов, кодирующих белки хориона. Мы также обнаружили увеличение уровня экспрессии белка хориона Cp7Fc (Chorion protein c at 7F). Двумерный электрофорез (рис. 4) выявил смещение в кислую область точки изофокусирования одной из основных субъединиц протеасомы (Proteasome beta 4 subunit) и изменение уровня экспрессии металлопротеазного компонента 26S протеасомы CSN5. Эти изменения могут влиять на активность протеасом.
Таблица 1.
Основные белки, характер экспрессии которых изменился
| Белок | Краткая характеристика | 2D-анализ: сравнение белков линии CBS–/–;CSE–/– и 58492 |
|---|---|---|
| #1. Jafrac1 (Thioredoxin peroxidase 1, CG1633) |
Тиолспецифическая пероксидаза, катализирует восстановление пероксида водорода и органических гидропероксидов до воды и спиртов соответственно | Уровень экспрессии увеличивается в 1.2 раза, сдвигается точка изофокусирования сдвигается в кислую сторону |
| #2. Fer1HCH (Ferritin 1 heavy chain homologue, CG2216) |
Одна из двух субъединиц основного комплекса хранения железа – молекулы ферритина 1 | |
| #3. Prosβ4 (Proteasome beta4 subunit, GC17331) |
Субъединица протеасомы-β4 | Изменяется точка изофокусирования (сдвигается в кислую сторону) |
| #4. MFS14 (Lethal(2)-37Cc, CG15095) |
Транспортер 14 надсемейства основных посредников (MFS14) участвует в реакции на гипоксию. | Уровень экспрессии увеличивается в 1.2 раза |
| #5. Hsp26 (Heat shock protein 26, CG4183) |
Белок теплового шока 26 (Hsp26), участвует в белковом фолдинге | Уровень экспрессии снижается 0.74 раза |
| #6. Cp7Fc (Chorion protein c at 7F (Cp7Fc), isoform A) |
Белок хориона С в 7F (Cp7Fc), принадлежит к семейству из девяти белков хориона. Экспрессируется в фолликулярных клетках | Уровень экспрессии увеличивается в 1.9 раза |
| #7. Txl (Thioredoxin- like, CG5495) |
Тиоредоксин-подобный белок, участвует, согласно предварительному анализу, в окислительно-восстановительном гомеостазе клетки | Уровень экспрессии увеличивается в 1.5 раза |
| #8. COP9 signalosome
subunit 5, CSN5 (Metalloprotease component of the 26S proteasome, CG14884) |
CSN5 – пятая субъединица сигналосомы COP9. Сигналосома играет центральную роль в регуляции E3-куллинового кольца убиквитинлигаз | Уровень экспрессии снижается 0.75 раза |
Активность протеасом и уровень их экспрессии в изучаемых линиях дрозофилы
На основании результатов 2D-анализа представлялось интересным проанализировать количество и активность протеасом в изучаемых линиях дрозофилы. Известно, что основной функцией протеасом является деградация различных белков, в том числе окисленных и поврежденных, до коротких пептидов [27, 28]. Ранее была выявлена активация протеасом в условиях окислительного стресса и в ходе восстановления после теплового шока [29, 30].
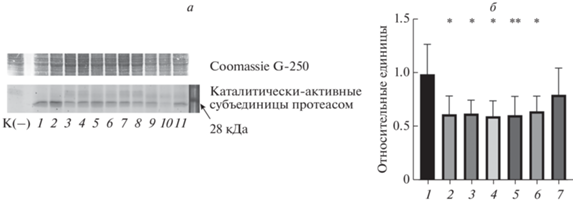
Мы предположили возможность изменения активности протеасом в линиях мух с делетированными генами серного метаболизма. Для проверки этой гипотезы измерили общую активность протеасом в белковом лизате, полученном из пятидневных самок (рис. 5). Видно, что во всех линиях с делетированными генами cbs и cse, а также у двойных трансформантов наблюдается уменьшение количества каталитически-активных субъединиц протеасом. В линии с делецией гена mst это снижение минимально.
Рис. 5.
а – Выявление каталитически активных субъединиц протеасом, специфически связывающихся с флуоресцентным зондом Me4BodipyFL–Ahx3Leu3VS. 1, 2 – Контрольная линия 58492; 3, 4 – CSE–/–; 5, 6 – CBS–/–; 7, 8 – CBS–/–, CSE–/–(1); 9, 10 – CBS–/–, CSE–/–(2); 11 – MST–/–; K(–) – отрицательный контроль. б – Изменение количества каталитически–активных субъединиц, нормализация по актину, окрашенному Coomassie G-250. 1 – 58492; 2 – CSE–/–; 3, 4 – CBS–/–; 5 – CBS–/–, CSE–/–(1); 6 – CBS–/–; CSE–/–(2); 7 – MST–/–. Объединены данные трех независимых экспериментов. Статистическая значимость изменения по сравнению с контрольной линией. *p < 0.05, **p < 0.01.
Для того, чтобы выяснить, не связано ли снижение активности протеасом с уменьшением их общего количества, был проведен Вестерн-блот-анализ содержания структурных субъединиц протеасом в лизатах тканей (рис. 6).
Рис. 6.
а – Вестерн–блот–анализ белков со специфическими антителами к субъединицам α1, 2, 3, 5, 6, 7 протеасомы 20S (см. Экспериментальную часть). 1 – Контрольная линия 58492; 2 – CSE–/–; 3, 4 – СBS–/–; 5 – CBS–/–; CSE–/–(1); 6 – CBS–/–;CSE–/–(2); 7, 8 – MST–/–; K(+) – положительный контроль. б –Изменение общего количества субъединиц протеасом, нормализация по актину. 1 – 58492; 2 – CSE–/–; 3, 4 – CBS–/–; 5 – CBS–/–, CSE–/–(1); 6 – CBS–/–, CSE–/–(2); 7 – MST–/–. Общее количество протеасом вычисляли по данным трех независимых экспериментов. Статистическая значимость изменения по сравнению с контрольной линией. *p < 0.05, **p < 0.01, ***p < 0.005.

Видно, что в линиях с делецией генов серного метаболизма наблюдается снижение содержания субъединиц α1, 2, 3, 5, 6, 7 протеасом. Таким образом наблюдается корреляция между снижением количества каталитически-активных и структурных субъединиц протеасом. Полученные данные оказались довольно неожиданными для нас. Ранее транскриптомный анализ библиотек РНК, полученных из самок исследуемых нами линий, не выявил значимых различий в уровне экспрессии генов, кодирующих структурные белки протеасом и убиквитинлигаз [18]. При этом мы выявили активацию генов, участвующих в окислительно-восстановительных процессах в линиях с делециями генов cbs, cse, что свидетельствует об окислительном стрессе. Известно, что накопление окисленных белков приводит к активации протеасом и деградации окисленных белков [29–31]. Исходя из этих соображений, мы проверили, имеются ли различия в количестве окисленных белков в линиях с делециями генов серного метаболизма. ОксиБлот-анализ экстрактов, полученных из пятидневных самок, использовали для определения общего количества окисленных белков (рис. 7).
Рис. 7.
а – ОксиБлот-анализ (см. Экспериментальную часть). 1 – 58492; 2 – CSE–/–; 3, 4 – CBS–/–; 5 – CBS–/–, CSE–/–(1); 6 – CBS–/–, CSE–/–(2); 7 – MST–/–. б – Общее количество окисленных белков, нормализация по актину. 1 – 58492; 2 – CSE–/–; 3, 4 – CBS–/–; 5 – CBS–/–, CSE–/–(1); 6 – CBS–/–, CSE–/–(2); 7 – MST–/–. Объединены данные пяти независимых экспериментов.

Из рис. 7 видно, что по количеству окисленных белков линии мух с делециями генов серного метаболизма не отличаются статистически значимо от контрольной линии, что может свидетельствовать об адаптации мух к сниженной продукции сероводорода и предотвращении окисления белков.
Причины и механизмы снижения количества протеасом требуют дальнейшего изучения. Мы полагаем, что одной из возможных причин является дисбаланс количества свободных аминокислот (избыток метионина и недостаток цистеина) у мух с делециями генов cbs и cse. Ранее на клетках млекопитающих показали, что аминокислотное голодание значительно ускоряет деградацию 26S протеасомы, что может приводить к снижению числа таких комплексов в клетке [33, 34].
Полученные нами результаты показали, что нарушение пути транссульфурации и трансметилирования при делеции генов cbs и cse имеет значимые последствия на уровне протеома. У личинок третьего возраста выявлено снижение синтеза и накопления белка FBP2, запасающего метионин. В яичниках обнаружены изменения в характере экспрессии белков, участвующих в защите организма от окислительного стресса и гипоксии. Особый интерес вызывает снижение количества каталитически-активных и структурных субъединиц протеасом у мух с делециями генов cbs и cse, что требует дальнейшего изучения.
Благодарим А.В. Морозова за консультации и помощь в постановке экспериментов, М. Серебрякову за проведение масс-спектрометрического анализа пептидов и С. Сорокину за техническую помощь.
Работа проведена при поддержке Российского научного фонда (№ 2017-74- 30030-П).
В работе использованы лабораторные линии Drosophila melanogaster, соблюдены все применимые международные стандарты ведения и использования линий.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Mota-Martorell N., Jové M., Borrás C., Berdún R., Obis È., Sol J., Cabré R., Pradas I., Galo-Licona J.D., Puig J., Viña J., Pamplona R. (2020) Methionine transsulfuration pathway is upregulated in long-lived humans. Free Rad. Biol. Med. 162, 38–52.
Parkhitko A.A., Jouandin P., Mohr S.E., Perrimon N. (2019) Methionine metabolism and methyltransferases in the regulation of aging and lifespan extension across species. Aging Cell. 18, e13034.
Perridon B.W., Leuvenink H.G., Hillebrands J.L., van Goor H., Bos E.M. (2016) The role of hydrogen sulfide in aging and age-related pathologies. Aging. 8, 2264–2289.
Sokolov A.S., Nekrasov P.V., Shaposhnikov M.V., Moskalev A.A. (2021) Hydrogen sulfide in longevity and pathologies: inconsistency is malodorous. Ageing Res. Rev. 67, 101262.
Tabibzadeh S. (2021) Signaling pathways and effectors of aging. Front. Biosci. 26, 50–96.
Xiao Q., Ying J., Xiang L., Zhang C. (2018) The biologic effect of hydrogen sulfide and its function in various diseases. Medicine. 97, e13065.
KimuraY., GotoY., Kimura H. (2010) Hydrogen sulfide increases glutathione production and suppresses oxidative stress in mitochondria. Antioxid. Redox Signal. 12, 1–13.
Kabil O., Banerjee R. (2014) Enzymology of H2S biogenesis, decay and signaling. Antioxid. Redox Signal. 20, 770–782.
Paul B.D., Snyder S.H. (2012) H2S signaling through protein sulfhydration and beyond. Nat. Rev. Mol. Cell. Biol. 13, 499–507.
Mudd S.H., Levy H.L., Kraus J.P. (2001) Disorders of transsulfuration. In: The Online Metabolic and Molecular Bases of Inherited Disease. New York: McGraw-Hill, 2007–2056.
Guzmán M.A., Navarro M.A., Carnicer R., Sarría A.J., Acín S., Arnal C., Muniesa P., Surra J.C., Arbonés-Mainar J.M., Maeda N., Osada J. (2006) Cystathionine β-synthase is essential for female reproductive function. Hum. Mol. Genet. 21, 3168–3176.
Shirozu K., Tokuda K., Marutani E., Lefer D., Wang R., Ichinose F. (2014) Cystathionine γ-lyase deficiency protects mice from galactosamine/lipopolysaccharide induced acute liver failure. Antioxid. Redox Signal. 20, 204–216.
Badiei A., Chambers S.T., Gaddam R.R., Bhatia M. (2016) Cystathionine γ-lyase gene silencing with siRNA in monocytes/macrophages attenuates inflammation in cecal ligation and puncture induced sepsis in the mouse. J. Biosci. 41, 87–95.
Gaddam R.R., Fraser R., Badiei A., Chambers S., Cogger V.C., Le Couteur D.G., Ishii I., Bhatia M. (2016) Cystathionine gamma-lyase gene deletion protects mice against inflammation and liver sieve injury following polymicrobial sepsis. PLoS One. 11, e0160521.
Kolluru G.K., Bir S.C., Yuan S., Shen X., Pardue S., Wang R., Kevil C.G. (2015) Cystathionine gamma-lyase regulates arteriogenesis through no-dependent monocyte recruitment. Cardiovasc. Res. 107, 590–600.
Yuan S., Yurdagul A., Jr, Peretik J.M., Alfaidi M., Al Yafeai Z., Pardue S., Kevil C.G., Orr A. W. (2018) Cystathionine γ-lyase modulates flow-dependent vascular remodeling. Arterioscler, Thromb. Vasc. Biol. 38, 2126–2136.
Snijder P.M., Baratashvili M., Grzeschik N.A., Leuvenink H.G.D., Kuijpers L., Huitema S., Schaap O., Giepmans B.N.G., Kuipers J., Miljkovic J.L., Mitrovic A., Bos E.M., Szabó C., Kampinga H.H., Dijkers P.F., Bos E.M., Szabó C., Kampinga H.H., Dijkers P.F., Dunnen WFAD, Filipovic M.R., Goor H.V., Sibon OCM. (2016). Overexpression of cystathionine γ-lyase suppresses detrimental effects of spinocerebellar ataxia type 3. Mol. Med. 21, 758–768.
Zatsepina O., Karpov D., Chuvakova L., Rezvykh A., Funikov S., Sorokina S., Zakluta A., Garbuz D., Shilova V., Evgen’ev M. (2020) Genome-wide transcriptional effects of deletions of sulphur metabolism genes in Drosophila melanogaster. Redox Biol. 36, 101654.
Shaposhnikov M.V., Zakluta A.S., Zemskaya N.V., Guvatova Z.G., Shilova V.Y., Yakovleva D.V., Gorbunova A.A., Koval L.A., Ulyasheva N.S., Evgen’ev M.B., Zatsepina O.G., Moskalev A.A. (2022) Deletions of the cystathionine-β-synthase (CBS) and cystathionine-γ-lyase (CSE) genes, involved in the control of hydrogen sulfide biosynthesis, significantly affect lifespan and fitness components of Drosophila melanogaster. Mech. Ageing Dev. 203, 111656.
O’Farrell P.Z., Goodman H.M., O’Farrell P.H. (1977). High resolution two-dimensional electrophoresis of basic as well as acidic proteins. Cell. 12, 1133–1141.
de Jong A., Schuurman K.G., Rodenko B., Ovaa H., Berkers C.R. (2012) Fluorescence-based proteasome activity profiling. Meth. Mol. Biol. 803, 183–204.
Zatsepina O.G., Kechko O.I., Mitkevich V.A., Kozin S.A., Yurinskaya M.M., Vinokurov M.G., Serebryakova M.V., Rezvykh A.P., Evgen’ev M.B., Makarov A.A. (2018) Amyloid-β with isomerized Asp7 cytotoxicity is coupled to protein phosphorylation. Sci. Rep. 8, 3518.
Meghlaoui G.K., Veuille M. (1997) Selection and methionine accumulation in the fat body protein 2 gene (FBP2), a duplicate of the Drosophila alcohol dehydrogenase (ADH) gene. J. Mol. Evol. 44, 23–32.
Zatsepina O.G., Chuvakova L.N., Nikitina E.A., Rezvykh A.P., Zakluta A.S., Sarantseva S.V., Surina N.V., Ksenofontov A.L., Baratova L.A., Shilova V.Y., Evgen’ev M.B. (2022) Genes responsible for H2S production and metabolism are involved in learning and memory in Drosophila melanogaster. Biomolecules. 12, 751.
Lee K.S., Iijima-Ando K., Iijima K., Lee W.J., Le J.H., Yu K., Lee D.S. (2009) JNK/FOXO-mediated neuronal expression of fly homologue of peroxiredoxin II reduces oxidative stress and extends life span. J. Biol. Chem. 284, 29454–29461.
Azad P., Zhou D., Russo E., Haddad G.G. (2009) Distinct mechanisms underlying tolerance to intermittent and constant hypoxia in Drosophila melanogaster. PLoS One. 4, e5371.
Raynes R., Pomatto L.C., Davies K.J. (2016) Degradation of oxidized proteins by the proteasome: distinguishing between the 20S, 26S, and immunoproteasome proteolytic pathways. Mol. Aspects Med. 50, 41–55.
Lefaki M., Papaevgeniou N., Chondrogianni N. (2017) Redox regulation of proteasome function. Redox Biol. 13, 452–458.
Aiken C.T., Kaake R.M., Wang X., Huang L. (2011) Oxidative stress-mediated regulation of proteasome complexes. Mol. Cell. Proteomics. 10, R110.006924.
Морозов А.В., Буров А.В., Астахова Т.М., Спасская Д.С., Маргулис Б.А., Карпов В.Л. (2019) Динамика функциональной активности и экспрессии субъединиц протеасом в условиях адаптации клетки к тепловому шоку. Молекуляр. биология. 53, 638–647.
Jung T., Höhn A., Grune T. (2014) The proteasome and the degradation of oxidized proteins: Part II – protein oxidation and proteasomal degradation. Redox Biol. 2, 99–104.
Höhn T.J., Grune T. (2014) The proteasome and the degradation of oxidized proteins: part III – redox regulation of the proteasomal system. Redox Biol. 2, 388–394.
Cohen-Kaplan V., Livneh I., Avni N., Fabre B., Ziv T., Kwon Y.T., Ciechanover A. (2016) p62- and ubiquitin-dependent stress-induced autophagy of the mammalian 26S proteasome. Proc. Natl. Acad. Sci. USA. 113, E7490–E7499.
Hoeller D., Dikic I. (2016) How the proteasome is degraded. Proc. Natl. Acad. Sci. USA. 113, 13266–13268.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


