Молекулярная биология, 2023, T. 57, № 2, стр. 362-372
Гены, ассоциированные с повышенной чувствительностью гипертензивных крыс линии НИСАГ к стрессу
Л. А. Федосеева a, С. Э. Смоленская a, А. Л. Маркель a, b, О. Е. Редина a, *
a Институт цитологии и генетики Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
b Новосибирский государственный университет
630090 Новосибирск, Россия
* E-mail: oredina@ngs.ru
Поступила в редакцию 02.08.2022
После доработки 16.08.2022
Принята к публикации 22.08.2022
- EDN: EEDYSX
- DOI: 10.31857/S0026898423020076
Аннотация
Крысы линии НИСАГ с наследуемой индуцируемой стрессом артериальной гипертензией характеризуются повышенной стресс-реактивностью гипоталамо-гипофизарно-надпочечниковой и симпатоадреналовой систем. Изучены генетические основы повышенной восприимчивости гипертензивных крыс НИСАГ к воздействию стресса. Секвенирование транскриптомов надпочечников гипертензивных крыс линии НИСАГ и нормотензивных крыс WAG выявило девять дифференциально экспрессирующихся генов в локусе хромосомы Х, ассоциация которого с приростом уровня артериального давления и концентрации кортикостерона в плазме крови при воздействии мягкого эмоционального стресса, а также с увеличенным весом надпочечников у крыс НИСАГ была показана ранее. Анализ функций белков, кодируемых этими генами, позволил предположить, что в локусе хромосомы Х геном, с наибольшей вероятностью связанным с повышенным уровнем стресс-чувствительности крыс НИСАГ, может быть ген Sms, кодирующий сперминсинтазу.
ВВЕДЕНИЕ
Эмоциональный стресс активирует симпатоадреналовую и гипоталамо-гипофизарно-адренокортикальную системы, вызывая повышение уровня кортикостерона и адреналина в плазме крови [1]. Крысы линии НИСАГ с наследуемой индуцируемой стрессом артериальной гипертензией характеризуются повышенной стресс-реактивностью гипоталамо-гипофизарно-адренокортикальной и симпатоадреналовой систем [2]. Крысы НИСАГ получены в результате селекции из аутбредного стока крыс Wistar по признаку значительного повышения уровня артериального давления (АД) в ответ на действие мягкого эмоционального стресса, обусловленного получасовым ограничением подвижности (рестрикцией) в тесной проволочной клетке [3]. Базальный уровень АД у крыс НИСАГ, составляющий 170–175 мм рт. ст., в условиях рестрикционного стресса резко повышается до 200–220 мм рт. ст., что является отличительной особенностью крыс этой линии. У контрольных нормотензивных крыс линии WAG (Wistar Albino Glaxo) такой стресс не вызывает статистически значимого изменения уровня АД.
Анализ локусов количественных признаков (QTL, quantitative trait locus), проведенный нами ранее с использованием самцов F2 (НИСАГ × WAG) в возрасте 3–4 мес., позволил выявить генетические локусы, ассоциированные с проявлением ряда физиологических и патофизиологических особенностей фенотипа гипертензивных крыс линии НИСАГ. В том числе определены три QTL (на хромосомах 11, 15 и Х), присутствие аллелей крыс НИСАГ в которых ассоциировано с увеличением уровня АД при воздействии рестрикционного стресса [4]. В этих районах хромосом могут находиться гены, обуславливающие повышение АД при стрессе. Логично предположить, что некоторые из этих генов могут быть ключевыми для формирования гипертензивного статуса у крыс НИСАГ.
С целью определения генов-кандидатов часто используют поиск дифференциально экспрессирующихся генов (ДЭГ), локализованных в QTL, что существенно увеличивает вероятность выявления генов, вовлеченных в контроль изучаемых фенотипических характеристик [5, 6]. Однако найти связь некоторых признаков, в том числе и изучаемого нами признака прироста уровня АД при стрессе, с уровнем экспрессии определенных генов напрямую практически невозможно. Эта проблема решается через определение вспомогательного фенотипа (intermediate phenotype), т.е. признака, который имеет отношение к регуляции проявления основного признака и картируется в те же генетические районы хромосом. Использование вспомогательного фенотипа значительно повышает вероятность нахождения искомых генов, включая гены с плейотропным эффектом на изучаемые признаки [7].
Из трех локусов, ассоциированных с увеличением уровня АД при стрессе, ковариация с другими признаками, изучаемыми в нашей работе и физиологически связанными с регуляцией АД, найдена только для QTL на хромосоме Х. Этот локус, ассоциированный с повышением уровня АД при стрессе, перекрывается с локусами, ассоциированными с такими признаками, как “прирост концентрации кортикостерона в плазме крови при стрессе” и “вес надпочечников” [4]. Присутствие аллелей НИСАГ в данном локусе ассоциировано со статистически значимым увеличением значений всех трех признаков.
Нейроэндокринные изменения, вызванные стрессом, могут влиять на уровень АД и другие признаки, в том числе и на морфометрические показатели ряда органов-мишеней [8–10]. Надпочечник считается ключевым звеном в развитии реакции на стрессовые воздействия [11]. В надпочечнике синтезируются кортикостероидные гормоны и катехоламины, которые регулируют большой спектр жизненно важных функций организма, включая ответ на стрессовые стимулы, водно-солевой гомеостаз, сердечно-сосудистую систему, а также уровень АД [12, 13]. Учитывая, что размер надпочечников может быть связан с продукцией важнейших гормонов, таких как кортикостерон [14–16], альдостерон [17] и адреналин, можно предположить, что в найденном нами на хромосоме Х локусе действительно могут находиться гены, участвующие в генетическом контроле активности надпочечника, способные приводить как к изменению его веса, так и влиять на увеличение концентрации гормонов и уровня АД при стрессе. Выявление таких генов-кандидатов и стало целью данной работы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Животные. В работе использовали самцов крыс гипертензивной линии НИСАГ/Icgn (Наследуемая Индуцируемая Стрессом Артериальная Гипертензия) и нормотензивной линии WAG/GSto-Icgn (Wistar Albino Glaxo) в возрасте 3 мес. Работа выполнена на базе Центра генетических ресурсов лабораторных животных ИЦиГ СО РАН. Крыс содержали в стандартных условиях, воду и сбалансированный корм давали без ограничения. Базальное систолическое АД измеряли непрямым методом на хвосте (tail-cuff method) при легком эфирном наркозе, чтобы избежать эмоционального стресса, связанного с проведением измерения. Измерение АД при стрессе проводили на ненаркотизированных крысах после помещения их на 30 мин в проволочную клетку-цилиндр (рестрикционный стресс). Анализ транскриптома (RNA-Seq) проводили в группах из трех животных. Уровень базального систолического АД у этих крыс НИСАГ составил 171.7 ± 1.22 мм рт. ст., а у крыс WAG 116.33 ± 1.86 мм рт. ст. Подтверждение результатов RNA-Seq методом ПЦР с детекцией в реальном времени (РВ-ПЦР) проводили в группах из семи животных. Уровень базального систолического АД составил 174.3 ± 1.3 мм рт. ст. у крыс НИСАГ и 122.1 ± 1.8 мм рт. ст. у крыс WAG. Во всех экспериментах крыс декапитировали через 6 дней после измерения АД, выделяли надпочечники и хранили их в RNA Later (“Qiagen”, США) при –70°С до использования.
Эксперименты выполнены в соответствии с Международными правилами проведения работ с использованием животных и одобрены комитетом по биоэтике ИЦиГ СО РАН.
RNA-Seq проводили как описано ранее [18]. Надпочечники крыс пересылали в ЗАО “Геноаналитика” (Россия), где проводили пробоподготовку, полногеномное секвенирование транскриптома и биоинформатический анализ данных для определения ДЭГ. Все образцы анализировали как биологические повторы.
Фракцию мРНК получали из общей РНК с использованием набора Dynabeads mRNA Purification Kit (“Ambion”, США) согласно протоколу фирмы. Библиотеки кДНК получали с использованием NEBNext mRNA Library Prep Reagent Set for Illumina (“New England Biolabs”, США). Секвенирование библиотек кДНК проводили на платформе Illumina (более 10 млн ридов для каждого образца). Файлы в формате “fastq” использовали для картирования на референсный геном (Rnor_5.0\rn5), представленный на сайте Rat Genome Sequencing Consortium (RGSC), при помощи программы TopHat2 [19]. Аннотацию генов проводили в базе данных NCBI RefSeq. Качество картированных данных оценивали с использованием модуля CollectRnaSeqMetrics в пакете программ Picard (http://broadinstitute. github.io/picard/). С помощью программ Cufflinks/Cuffdiff определяли уровни экспрессии генов и оценивали различия между ними [20] с учетом поправки на множественные сравнения. Гены относили к ДЭГ при значении q < 0.05. Ассоциацию ДЭГ с заболеваниями определяли с использованием данных, представленных в базе Rat Genome Database (RGD, http://rgd.mcw.edu/). Определение однонуклеотидных полиморфизмов описано в [21].
QTL-анализ. Проведение QTL-анализа описано ранее [4]. Работу проводили на самцах крыс F2 (НИСАГ × WAG) в возрасте 3 мес. (n = 103). Анализ сцепления проводили с помощью программ MAPMAKER/EXP 3.0 и MAPMAKER/QTL 1.1.
РВ-ПЦР. Суммарную РНК выделяли из надпочечников крыс и обрабатывали ДНКазой с помощью набора SV Total RNA Isolation system (“Promega”, США) согласно рекомендациям производителя. Обратную транскрипцию проводили в растворе объемом 50 мкл, содержащем 1 мкг выделенной РНК, 0.25 нмоля праймеров (N9 – случайные нонануклеотидные праймеры, “Биосан”, Россия), 36 мкл буфера для обратной транскрипции и 40 ед. акт. обратной транскриптазы MoMLV (“Вектор-Бест”, Россия) и 0.4 мM смеси dNTP. кДНК cинтезировали в течение 1 ч при 37°C, затем 30 мин при 42°C и 10 мин при 50°C. Фермент инактивировали, прогревая смесь в течение 5 мин при 75°C. Из каждого образца отбирали и смешивали по 5 мкл кДНК. Усредненный раствор использовали в РВ-ПЦР в качестве кДНК-стандарта для построения калибровочных кривых.
РВ-ПЦР проводили на амплификаторе iQ5 (“Bio-Rad”, США) с использованием красителя SYBR Green I. Олигонуклеотидные праймеры подбирали с помощью программы PrimerBLAST (http://www.ncbi.nlm.nih.gov/tools/primer-blast/), их последовательности приведены в табл. 1.
Таблица 1.
Праймеры, использованные в ПЦР с детекцией в режиме реального времени
| Символ гена | Праймеры, 5' → 3' | Длина ПЦР-фрагмента, п.н. |
|
|---|---|---|---|
| прямой | обратный | ||
| Gapdh | GTGCCAGCCTCGTCTCATA | TCGTTGATGGCAACAATGTCC | 123 |
| Rpl30 | CATCTTGGCGTCTGATCTTG | TCAGAGTCTGTTTGTACCCC | 143 |
| Sms | GTGAAGCGATTACCACCCATA | CCAAGTCACTCTCTGCCAAAT | 205 |
| Tmem35a | GGACTATCAAGTTGACCCCCA | AGGGTCATGACAATGCCACA | 172 |
Протокол РВ-ПЦР: прогрев 1 мин, 95°C; далее 40 основных циклов – 15 с при 95°C, 20 с при 63°C, 20 с при 72°C. Флуоресценцию продуктов ПЦР регистрировали в течение 10 с при 83°C; кривую плавления записывали в интервале от 63 до 94°C. В качестве генов сравнения использовали гены Gapdh и Rpl30. ПЦР проводили не менее 2 раз с каждым образцом кДНК. По калибровочным кривым, полученным с использованием разведений кДНК-стандарта, определяли относительное содержание изучаемых кДНК. Эту величину для целевых генов относили к среднему геометрическому значению количества кДНК генов сравнения в тех же образцах, определяя межлинейные различия в уровнях экспрессии изучаемых генов.
Статистическую обработку результатов проводили с помощью t-теста Стьюдента с использованием пакета компьютерных программ Statistica 6.0 (StatSoft, США). Данные представлены в виде средних арифметических значений и ошибки среднего (М ± SEM), уровень экспрессии у контрольных крыс линии WAG принят за 1.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Описание эффектов аллелей крыс НИСАГ и WAG в локусе хромосомы Х, ассоциированном с приростом уровня АД при стрессе, с весом надпочечников, а также с приростом концентрации кортикостерона в плазме крови при стрессе, представлено в табл. 2.
Таблица 2.
Эффекты аллелей крыс НИСАГ и WAG в QTL, ассоциированных с признаками вес надпочечников, прирост АД и концентрации кортикостерона в плазме крови при стрессе, в группе самцов F2 (НИСАГ × WAG) в возрасте 3–4 мес.
| Маркер в пике локуса, Mb∆ | Протяженность локуса, Mb∆ | LOD-балл | P chromosome- wise |
Генотип | |
|---|---|---|---|---|---|
| Н/Н M ± SEM n |
W/W M ± SEM n |
||||
| Прирост АД | |||||
| DXRat93–DXRat34 (88.6–101.5) |
42–118 | 2.30 | 0.025 | 38.2 ± 3.0** 44 |
25.9 ± 2.4 57 |
| Вес надпочечников | |||||
| DXRat93 (88.6) |
34–116 | 1.78 | 0.05 | 37.61 ± 0.75** 44 |
34.90 ± 0.59 58 |
| Прирост концентрации кортикостерона в плазме крови | |||||
| DXRat26-DXRat93 (45.1–88.6) |
28–126 | 1.62 | 0.05 | 2.48 ± 0.11* 43 |
2.11 ± 0.10 57 |
Надпочечник – один из основных органов, которому уделяют внимание при изучении комплексной природы развития гипертонической болезни, либо изменений нейроэндокринного профиля в ответ на стрессовые воздействия [22–24]. Учитывая взаимное расположение локусов, представленных на рис. 1, можно предположить, что в обсуждаемом нами районе хромосомы Х могут находиться несколько генов, ассоциированных с изучаемыми признаками. Эти гены могут быть тесно сцепленными и оказывать влияние на какой-либо из перечисленных признаков, но существует вероятность нахождения в первой половине локуса также и генов с плейтропным действием на все три признака. Во второй половине локуса могут находиться гены с плейотропным действием на два признака (вес надпочечников и прирост уровня АД при стрессе).
Рис. 1.
Локализация генов, дифференциально экспрессирующихся в надпочечниках крыс НИСАГ и WAG, на хромосоме Х в QTL, ассоциированном с весом надпочечников, с увеличением концентрации кортикостерона в плазме крови при стрессе и с увеличением уровня АД при стрессе. Mb – млн.п.н. от начала хромосомы.
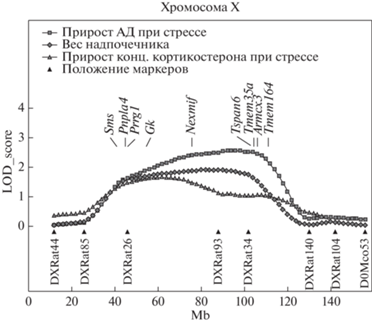
Результаты RNA-Seq-анализа позволили выявить в этом локусе девять генов, дифференциально экспрессирующихся в надпочечниках крыс НИСАГ и WAG (табл. 3). Уровень транскрипции семи из них в надпочечниках крыс НИСАГ был ниже, чем у крыс WAG. Локализация ДЭГ в QTL показана на рис. 1.
Таблица 3.
Гены, дифференциально экспрессирующиеся в надпочечниках крыс НИСАГ и WAG и локализованные в QTL на хромосоме Х, ассоциированном с весом надпочечников, с повышением концентрации кортикостерона в плазме крови при стрессе, а также с повышением уровня АД при стрессе
| Символ гена | ID гена | Положение гена, млн п.н.* | Уровень экспрессии у крыс НИСАГ, FPKM | Уровень экспрессии у крыс WAG, FPKM | НИСАГ/WAG, log2 (кратность изменения) | q | Кодируемый белок |
|---|---|---|---|---|---|---|---|
| Sms# | 363469 | 40.7 | 19.68 | 28.66 | –0.54 | 0.027 | Сперминсинтаза (spermine synthase) |
| Pnpla4# | 363471 | 45.7 | 5.01 | 2.79 | 0.84 | 0.042 | Белок 4, содержащий пататин-подобный фосфолипазный домен (patatin-like phospholipase domain-containing 4) |
| Prrg1 | 363472 | 45.9 | 5.07 | 8.36 | –0.72 | 0.018 | Богатый пролином белок 1, содержащий Gla-домен (proline rich and Gla domain 1) |
| Gk∆ | 79223 | 54.4 | 1.68 | 2.61 | –0.63 | 0.043 | Глицеринкиназа (glycerol kinase) |
| Nexmif # | 302396 | 75.7 | 7.12 | 9.81 | –0.46 | 0.048 | Фактор удлинения и миграции нейритов (neurite extension and migration factor) |
| Tspan6 | 302313 | 104.6 | 18.03 | 28.71 | –0.67 | 0.002 | Тетраспанин 6 (tetraspanin 6) |
| Tmem35a | 308134 | 105.0 | 2.6 | 1.5 | 0.75 | 0.052 | Трансмембранный белок 35а (transmembrane protein 35a) |
| Armcx3 | 367902 | 105.4 | 33.18 | 48.07 | –0.53 | 0.018 | Х-сцепленный белок 3 с повтором armadillo armadillo repeat containing, X-linked 3 |
| Tmem164 | 367763 | 112.4 | 24.89 | 34.63 | –0.48 | 0.038 | Трансмембранный белок 164 (transmembrane protein 164) |
В базе данных RGD гены, представленные в табл. 3, не аннотированы как гены, ассоциированные с гипертонической болезнью. Однако известно, что несколько генов (Sms, Pnpla4, Nexmif) связаны с развитием заболеваний нервной системы, а ген Gk ассоциирован с развитием сосудистых заболеваний.
Анализ нуклеотидных последовательностей показал, что только мРНК гена Prrg1 содержит замену в 3'-нетранслируемой области (rs199067204, 26T > C), которая встречается не только у крыс НИСАГ, но и у нескольких других как гипертензивных, так и нормотензивных линий крыс [21]. Соответственно, эта замена не должна быть ассоциирована с развитием гипертонии у крыс НИСАГ.
Для выявления возможных генов-кандидатов, ассоциированных с изучаемыми признаками, рассмотрим известные функции генов, дифференциально экспрессирующихся в надпочечниках крыс НИСАГ и WAG и локализованных в QTL на хромосоме Х.
Ген Sms кодирует сперминсинтазу, которая синтезирует спермин, используя спермидин в качестве субстрата [25]. Спермидин и спермин относятся к полиаминам, которые индуцируются в ответ на воздействие таких стрессирующих факторов, как изменение осмолярности, нагревание, активные формы кислорода, ультрафиолет, психологический стресс. Спермин предотвращает образование супероксида, оказывая антиокислительное и противовоспалительное действие [26]. Показано, что спермин может противодействовать эффектам синтетического глюкокортикоида дексаметазона в гепатоцитах [27] и ингибировать индуцированный дексаметазоном апоптоз тимоцитов [28].
Считается, что полиамины могут опосредовать ответ на стресс путем позитивной регуляции экспрессии генов, участвующих в ответе на стрессовые факторы, что может объяснять их протективное действие против различных видов стресса [29]. Спермидин и спермин играют важную роль в регуляции ионных каналов, включая каналы, опосредующие возбуждающую синаптическую передачу в мозге млекопитающих, каналы, регулирующие мембранный потенциал и гомеостаз ионов калия в клетках всего организма, а также каналы, которые влияют на внутриклеточные сигнальные пути кальция и транспорт ионов натрия [30–32]. Спермин более эффективно взаимодействует с каналами, чем спермидин, поэтому снижение количества или активности сперминсинтазы и изменение соотношения этих двух полиаминов может влиять на уровень сигнала или мембранный потенциал во многих клетках, что, в свою очередь, может влиять на состояние всего организма [25].
Учитывая это, можно предположить, что снижение уровня транскрипции гена Sms может приводить к уменьшению количества сперминсинтазы и, возможно, спермина, что будет снижать способность организма противодействовать эффектам глюкокортикоидов, увеличивать уровень окислительного стресса, а также нарушать регуляцию работы ионных каналов. Известно, что все эти эффекты провоцируют повышение уровня АД и развитие гипертонии [33, 34].
Мутации в гене SMS человека, приводящие к снижению активности сперминсинтазы, вызывают развитие Х-сцепленного синдрома Снайдера–Робинсона (Snyder–Robinson syndrome) [25], для которого характерны различные патологические проявления, включая гипотонию, судороги и остеопороз [35]. Эти факты подтверждают, что сперминсинтаза вовлечена в регуляцию АД. Роль кортизола в развитии синдрома Снайдера–Робинсона до настоящего времени не изучена, но известно, что на развитие остеопороза может влиять повышенный уровень кортизола (гиперкортицизм) [36], а судороги часто сопровождаются состоянием стресса и увеличением уровня кортизола (для обзора см. [37]). На моделях синдрома Снайдера–Робинсона показано, что дефицит сперминсинтазы приводит к нарушению функций митохондрий, вызывает дисфункцию лизосом и окислительный стресс [38].
Снижение активности сперминсинтазы, как правило, сопровождается накоплением спермидина. Физиологические последствия этого процесса в настоящее время не до конца понятны и во многом противоречивы. У крыс Dahl с соль-чувствительной гипертонией (Dahl salt-sensitive rats) обогащение пищевого рациона спермидином приводило к снижению системного АД и уменьшению гипертрофии сердца [39]. Однако в исследованиях, проведенных на моделях синдрома Снайдера–Робинсона, при накоплении спермидина в условиях сниженной активности сперминсинтазы наблюдается аномальный катаболизм спермидина, что приводит к генерации токсичных метаболитов, вызывающих дефекты лизосом и окислительный стресс [38].
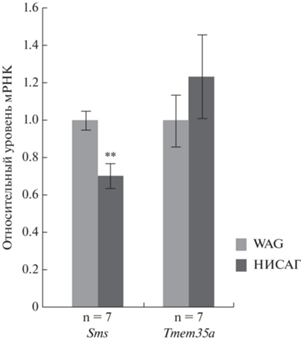
Данные о функциональной роли сперминсинтазы позволяют нам предположить, что снижение уровня транскрипции гена Sms в надпочечниках крыс НИСАГ, вероятно, может увеличивать стресс-чувствительность организма и влиять на все три признака, ассоциированные нами с локусом на хромосоме Х. Статистически значимое снижение уровня транскрипции гена Sms в надпочечниках крыс НИСАГ подтверждено методом РВ-ПЦР (рис. 2).
Рис. 2.
Сравнение уровня транскрипции генов в надпочечниках гипертензивных крыс НИСАГ и контрольных крыс WAG. **p = 0.004.
Ген Pnpla4 кодирует фермент, обладающий фосфолипазной [40] и трансацилазной [41] активностями. Он вовлечен в регуляцию гомеостаза триглицеридов в клетках [40] и способствует накоплению в них ретиниловых эфиров [41], предшественников ретинола и ретиноевой кислоты [42]. Ретиниловые эфиры являются формой запасания витамина А. Известно, что глюкокортикоиды увеличивают концентрацию ретинола и ретинол-связывающих белков в плазме крови за счет снижения концентраций витамина А, ретинола и ретиниловых эфиров в органах (легкие и печень), которые выполняют функцию депо для этих веществ [43]. Снижение концентрации ретиниловых эфиров при воздействии стресса (ультрафиолетовое облучение) показано и в эпидермисе мышей [44]. Продолжительный иммобилизационный стресс приводит к увеличению веса надпочечника и снижению концентрации ретинола в плазме крови и ретиниловых эфиров в некоторых тканях [45]. Однако хронический иммобилизационный стресс вызывает тканезависимые изменения содержания витамина А. В отличие от других тканей (печень, почки) в надпочечниках крыс, подвернутых хроническому иммобилизационному стрессу, наблюдали аккумуляцию витамина А [46]. Отмеченное нами повышение уровня транскрипции гена Pnpla4 у крыс НИСАГ хорошо согласуется с этими данными. Мы можем предполагать, что увеличение экспрессии Pnpla4 может быть связано с генетически детерминированным повышением активности коры надпочечников у крыс НИСАГ, т.е. быть следствием стрессовой ситуации, направленным на восстановление гомеостаза, но не причиной повышения стресс-чувствительности крыс НИСАГ.
Функции белка, кодируемого геном Prrg1, изучены недостаточно, однако показано, что уровень транскрипции Prrg1 увеличивается при экспериментально индуцированном процессе кальцификации сосудов крыс [47]. В эпителиальных клетках глаза человека уровень транскрипции гена Prrg1 повышается при воздействии дексаметазона [48]. Таким образом, маловероятно, что снижение уровня транскрипции гена Prrg1 может быть связано с увеличением стресс-реактивности. Скорее наоборот, можно предположить, что снижение уровня транскрипции гена Prrg1 в надпочечниках крыс НИСАГ по сравнению с WAG может быть компенсаторным и направленным на смягчение процессов, вызванных генетически детерминированным повышением активности гипоталамо-гипофизарно-адренокортикальной системы у крыс НИСАГ.
Ген Gk кодирует глицеринкиназу, недостаток которой приводит к дисфункции надпочечников. Дефицит глицеринкиназы, возникающий в результате делеции, рассматривают как рецессивное заболевание, сцепленное с Х хромосомой, при котором наблюдается задержка развития, адренокортикальная недостаточность и гипоплазия надпочечников [49]. Таким пациентам для коррекции состояния требуется экзогенное введение стероидов и соли. Известно, что недостаток глицеринкиназы приводит к снижению синтеза глицерофосфолипидов и, соответственно, стероидогенеза, а также лимитирует превращение холестерина в прегненолон – предшественник глюкокортикоидов, синтезируемых в коре надпочечников. При этом снижение продукции кортизола сопровождается снижением сигнала обратной связи, поступающего в гипофиз, что приводит к увеличению синтеза АКТГ и гипертрофии пучковой зоны надпочечников. Снижение синтеза минералокортикоидов в клубочковой зоне надпочечников может приводить к развитию гипонатриемии [50]. Показано, что делеция гена глицеринкиназы приводит к развитию гиперглицеридемии [51]. Количество мРНК и активность глицеринкиназы хорошо коррелируют между собой и регулируются симпатической нервной системой [52]. Учитывая все сказанное, можно предположить, что снижение уровня транскрипции гена Gk, показанное в нашей работе, может быть адаптивным и способствовать снижению как уровня синтеза стероидов, так и реабсорбции ионов натрия и, соответственно, препятствовать чрезмерному повышению АД у крыс НИСАГ.
Функции белка, кодируемого геном Nexmif, связаны с развитием нервной системы. У носителей мутации данного гена наблюдается снижение интеллекта [53, 54]. Показано, что экспериментально смоделированная потеря функции этого гена в культивируемых нейронах гиппокампа крыс приводит к нарушению роста дендритов и аксонов, что предполагает участие гена в развитии нейронов и функциях мозга [53]. У некоторых пациентов с мутациями в гене Nexmif, наряду с когнитивными нарушениями, наблюдаются гипотония и стероидзависимый нефротический синдром [55], который поддается лечению кортикостероидами. Таким образом, функции белка, кодируемого геном Nexmif, могут быть связаны как с уровнем кортикостерона, так и с регуляцией уровня АД у крыс НИСАГ, однако, найденное нами снижение уровня транскрипции этого гена у крыс НИСАГ предполагает, что его действие может быть направлено на снижение уровня кортикостерона и АД, но не на увеличение стресс-чувствительности.
Ген Tspan6 кодирует белок тетраспанин 6, влияющий на свойства постсинаптической мембраны. Функции тетраспанина 6 в надпочечниках неизвестны. В гиппокампе мышей с нокаутом гена Tspan6 усиливается синаптическая передача и снижается долгосрочное потенцирование [56], что, как считают, может быть следствием постоянно повышенного базального уровня синаптической трансмиссии. Такой эффект “закупоренного” синапса наблюдается при повышении уровня синтеза белков, усиливающих синаптическую передачу [57, 58]. Зависит ли уровень экспрессии тетраспанина 6 от уровня глюкокортикоидов и может ли этот белок участвовать в регуляции АД не установлено, однако показано, что тетраспанин 6 участвует в регуляции нескольких сигнальных путей [59, 60], что делает ген Tspan6 потенциально интересным для дальнейшего изучения.
Изменения в концентрации ионов натрия вызывают ряд функциональных и структурных изменений в клубочковой зоне коры надпочечников, затрагивающих синтез альдостерона, симпатическую иннервацию, а также размеры клубочковой зоны. Эти процессы сопровождаются координированным изменением уровня синтеза белка TUF1, кодируемого геном TMEM35 [17]. Увеличение количества мРНК TMEM35 наблюдали в клетках клубочковой зоны коры надпочечников и после воздействия ангиотензина II [17]. Tmem35 признан важным фактором, необходимым для нормальной активности гипоталамо-гипофизарно-надпочечниковой системы; делеция этого гена влияет на функционирование систем, ассоциированных с ответом на рестрикционный стресс [61]. Обнаруженное нами повышение уровня транскрипции гена Tmem35а в надпочечниках крыс НИСАГ по сравнению с WAG хорошо согласуется с повышенным уровнем ангиотензина II в плазме крови крыс НИСАГ [62]. Согласно известным функциям белка, кодируемого геном Tmem35а, этот ген можно рассматривать как ген-кандидат, ассоциированный как с приростом уровня АД при стрессе, так и с изменением веса надпочечников крыс НИСАГ. Однако различия в уровне транскрипции гена Tmem35а, установленные методом RNA-Seq, характеризуются пограничным уровнем статистической значимости (табл. 3), а результаты РВ-ПЦР выявили значительную вариабельность измерений, что при 20%-ной межлинейной разнице в уровне транскрипции не позволило говорить о значимых межлинейных различиях в уровне транскрипции гена Tmem35а (рис. 2). Вероятно, сложность подтверждения значимости различий может быть связана с низким уровнем экспрессии данного гена (табл. 3). Тем не менее, существует мнение, что даже небольшие изменения в уровне экспрессии генов могут быть причиной значительных биологических эффектов [63]. В связи с этим, вероятно, все же следует обратить внимание на ген Tmem35а, как на потенциальный ген-кандидат для дальнейшего изучения его роли в развитии стресс-чувствительной гипертензии у крыс НИСАГ.
Белок, кодируемый геном Armcx3, является интегральным мембранным белком, функции которого изучены недостаточно. Известно, что этот белок локализован на мембране митохондрий и регулирует их перемещение и распределение в нейронах [64]. Этот белок относится к маркерам старения, уровень его экспрессии с возрастом снижается [65]. О возможной связи гена Armcx3 с регуляцией уровня АД можно судить по результатам работы, в которой показано, что в условиях экспериментально индуцированной гипертонии (2-Kidney 1-Clip) уровень экспрессии гена Armcx3 в средней мозговой артерии кроликов снижался статистически значимо [66].
Ген Tmem164 кодирует трансмембранный белок, функции которого изучены недостаточно и не ассоциированы с регуляцией уровня АД.
Обсуждение известных функций белков, кодируемых генами, представленными в табл. 3, показывает, что наиболее вероятным геном-кандидатом в локусе на хромосоме Х, ассоциированном с повышенной стресс-чувствительностью крыс НИСАГ, можно считать ген Sms, кодирующий сперминсинтазу. Однако протяженность описанного нами локуса предполагает, что в нем могут находиться несколько генов, ассоциированных с генетическим контролем проявления изучаемых признаков (вес надпочечника, прирост концентрации кортикостерона и уровня АД при воздействии эмоционального стресса). Согласно нашему обсуждению, дальнейшего исследования заслуживает еще один ген – Tmem35а. Кроме того, функции ряда рассмотренных нами генов в надпочечниках изучены слабо либо не изучены совсем. Возможно, дальнейшее их исследование позволит выявить дополнительные гены, связанные с повышенной чувствительностью к стрессу.
Авторы выражают благодарность ЗАО “Геноаналитика” (Россия) за помощь в секвенировании транскриптома и выполнение первичного биоинформатического анализа.
Работа поддержана грантом Российского научного фонда (проект № 22-14-00082).
В работе соблюдены все применимые международные, национальные и/или институциональные принципы ухода и использования животных.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Lin W., Wang W., Shao F. (2003) New animal model of emotional stress: behavioral, neuroendocrine and immunological consequences. Chinese Sci. Bull. 48, 1565–1568.
Markel A.L., Redina O.E., Gilinsky M.A., Dymshits G.M., Kalashnikova E.V., Khvorostova Y.V., Fedoseeva L.A., Jacobson G.S. (2007) Neuroendocrine profiling in inherited stress-induced arterial hypertension rat strain with stress-sensitive arterial hypertension. J. Endocrinol. 195, 439–450.
Markel A.L. (1992) Development of a new strain of rats with inherited stress-induced arterial hypertension. Genet. Hypertens. 218, 405–407.
Redina O.E., Smolenskaya S.E., Maslova L.N., Markel A.L. (2013) The genetic control of blood pressure and body composition in rats with stress-sensitive hypertension. Clin. Exp. Hypertens. 35, 484–495.
Lee S.J., Liu J., Qi N., Guarnera R.A., Lee S.Y., Cicila G.T. (2003) Use of a panel of congenic strains to evaluate differentially expressed genes as candidate genes for blood pressure quantitative trait loci. Hypertens. Res. 26, 75–87.
Hoffman P., Tabakoff B. (2005) Gene expression in animals with different acute responses to ethanol. Addict. Biol. 10, 63–69.
Jacob H.J., Kwitek A.E. (2002) Rat genetics: attaching physiology and pharmacology to the genome. Nat. Rev. Genet. 3, 33–42.
Markel A.L., Maslova L.N., Shishkina G.T., Bulygina V.V., Machanova N.A., Jacobson G.S. (1999) Developmental influences on blood pressure regulation in ISIAH rats. Dev. Hypertens. Phenotype: Basic Clin. Stud. 19, 493–526.
Tamashiro K.L., Nguyen M.M., Ostrander M.M., Gardner S.R., Ma L.Y., Woods S.C., Sakai R.R. (2007) Social stress and recovery: implications for body weight and body composition. Am. J. Physiol. Regul. Integr. Comp. Physiol. 293, R1864–1874.
de Souza D.B., Silva D., Silva C.M.C., Sampaio F.J.B., Costa W.S., Cortez C.M. (2011) Effects of immobilization stress on kidneys of Wistar male rats: a morphometrical and stereological analysis. Kidney Blood Press. Res. 34, 424–429.
Antonov Y.V., Alexandrovich Y.V., Redina O.E., Gilinsky M.A., Markel A.L. (2016) Stress and hypertensive disease: adrenals as a link. Experimental study on hypertensive ISIAH rat strain. Clin. Exp. Hypertens. 38, 415–423.
De Champlain J., Van Ameringen M.R. (1972) Regulation of blood pressure by sympathetic nerve fibers and adrenal medulla in normotensive and hypertensive rats. Circ. Res. 31, 617–628.
Lewicka S., Nowicki M., Vecsei P. (1998) Effect of sodium restriction on urinary excretion of cortisol and its metabolites in humans. Steroids. 63, 401–405.
Skelton F.R., Bernardis L.L. (1966) Effect of age, sex, hypophysectomy and gonadectomy on plasma corticosterone levels and adrenal weights following the administration of ACTH and stress. Experientia. 22, 551–552.
Tizabi Y., Aguilera G. (1992) Desensitization of the hypothalamic-pituitary-adrenal axis following prolonged administration of corticotropin-releasing hormone or vasopressin. Neuroendocrinology. 56, 611–618.
Willenberg H.S., Bornstein S.R., Dumser T., Ehrhart-Bornstein M., Barocka A., Chrousos G.P., Scherbaum W.A. (1998) Morphological changes in adrenals from victims of suicide in relation to altered apoptosis. Endocr. Res. 24, 963–967.
Tran P.V., Georgieff M.K., Engeland W.C. (2010) Sodium depletion increases sympathetic neurite outgrowth and expression of a novel TMEM35 gene-derived protein (TUF1) in the rat adrenal zona glomerulosa. Endocrinology. 151, 4852–4860.
Fedoseeva L.A., Klimov L.O., Ershov N.I., Alexandrovich Y.V., Efimov V.M., Markel A.L., Redina O.E. (2016) Molecular determinants of the adrenal gland functioning related to stress-sensitive hypertension in ISIAH rats. BMC Genomics. 17(Suppl 14), 989.
Kim D., Pertea G., Trapnell C., Pimentel H., Kelley R., Salzberg S.L. (2013) TopHat2: accurate alignment of transcriptomes in the presence of insertions, deletions and gene fusions. Genome Biol. 14, R36.
Trapnell C., Hendrickson D.G., Sauvageau M., Goff L., Rinn J.L., Pachter L. (2013) Differential analysis of gene regulation at transcript resolution with RNA-seq. Nat. Biotechnol. 31, 46–53.
Ершов Н.И., Маркель А.Л., Редина О.Е. (2017) Однонуклеотидные полиморфизмы, специфичные для гипертензивных крыс линии НИСАГ. Биохимия. 82, 344–356.
Friese R.S., Mahboubi P., Mahapatra N.R., Mahata S.K., Schork N.J., Schmid-Schonbein G.W., O’Connor D.T. (2005) Common genetic mechanisms of blood pressure elevation in two independent rodent models of human essential hypertension. Am. J. Hypertens. 18, 633–652.
Romero D.G., Plonczynski M.W., Welsh B.L., Gomez-Sanchez C.E., Zhou M.Y., Gomez-Sanchez E.P. (2007) Gene expression profile in rat adrenal zona glomerulosa cells stimulated with aldosterone secretagogues. Physiol. Genomics. 32, 117–127.
Liu X., Serova L., Kvetnansky R., Sabban E.L. (2008) Identifying the stress transcriptome in the adrenal medulla following acute and repeated immobilization. Ann. N.Y. Acad. Sci. 1148, 1–28.
Pegg A.E., Michael A.J. (2010) Spermine synthase. Cell. Mol. Life Sci. 67, 113–121.
Løvaas E. (1995) Hypothesis: spermine may be an important epidermal antioxidant. Med. Hypotheses. 45, 59–67.
Pittner R.A., Bracken P., Fears R., Brindley D.N. (1986) Spermine antagonises the effects of dexamethasone, glucagon and cyclic AMP in increasing the activity of phosphatidate phosphohydrolase in isolated rat hepatocytes. FEBS Lett. 207, 42–46.
Hegardt C., Andersson G., Oredsson S.M. (2001) Different roles of spermine in glucocorticoid- and Fas-induced apoptosis. Exp. Cell Res. 266, 333–341.
Rhee H.J., Kim E.J., Lee J.K. (2007) Physiological polyamines: simple primordial stress molecules. J. Cell. Mol. Med. 11, 685–703.
Fleidervish I.A., Libman L., Katz E., Gutnick M.J. (2008) Endogenous polyamines regulate cortical neuronal excitability by blocking voltage-gated Na+ channels. Proc. Natl. Acad. Sci. USA. 105, 18994–18999.
Kurata H.T., Diraviyam K., Marton L.J., Nichols C.G. (2008) Blocker protection by short spermine analogs: refined mapping of the spermine binding site in a Kir channel. Biophys. J. 95, 3827–3839.
Pegg A.E. (2009) Mammalian polyamine metabolism and function. IUBMB Life. 61, 880–894.
Vaziri N.D., Wang X.Q., Oveisi F., Rad B. (2000) Induction of oxidative stress by glutathione depletion causes severe hypertension in normal rats. Hypertension. 36, 142–146.
Lou Y., Zhang F., Luo Y., Wang L., Huang S., Jin F. (2016) Serum and glucocorticoid regulated kinase 1 in sodium homeostasis. Int. J. Mol. Sci. 17, pii: E1307.
Schwartz C.E., Peron A., Kutler M.J. (1993–2022) Snyder-Robinson syndrome. In: GeneReviews.® Eds Adam M.P., Everman D.B., Mirzaa G.M., Pagon R.A., Wallace S.E., Bean L.J.H., Gripp K.W., Amemiya A. [Internet]. Seattle (WA): Univ. Washington, Seattle.
Chiodini I., Scillitani A. (2008) Role of cortisol hypersecretion in the pathogenesis of osteoporosis. Recenti Prog. Med. 99, 309–313.
Cano-Lopez I., Gonzalez-Bono E. (2019) Cortisol levels and seizures in adults with epilepsy: a systematic review. Neurosci. Biobehav. Rev. 103, 216–229.
Li C., Brazill J.M., Liu S., Bello C., Zhu Y., Morimoto M., Cascio L., Pauly R., Diaz-Perez Z., Malicdan M.C.V., Wang H., Boccuto L., Schwartz C.E., Gahl W.A., Boerkoel C.F., Zhai R.G. (2017) Spermine synthase deficiency causes lysosomal dysfunction and oxidative stress in models of Snyder-Robinson syndrome. Nat. Commun. 8, 1257.
Huynh K. (2017) Basic research: cardioprotective benefits of dietary spermidine. Nat. Rev. Cardiol. 14, 65.
Hermansson M., Hänninen S., Hokynar K., Somerharju P. (2016) The PNPLA-family phospholipases involved in glycerophospholipid homeostasis of HeLa cells. Biochim. Biophys. Acta. 1861, 1058–1065.
Gao J.G., Shih A., Gruber R., Schmuth M., Simon M. (2009) GS2 as a retinol transacylase and as a catalytic dyad independent regulator of retinyl ester accretion. Mol. Genet. Metab. 96, 253–260.
O'Byrne S.M., Blaner W.S. (2013) Retinol and retinyl esters: biochemistry and physiology. J. Lipid Res. 54, 1731–1743.
Georgieff M.K., Radmer W.J., Sowell A.L., Yeager P.R., Blaner W.S., Gunter E.W., Johnson D.E. (1991) The effect of glucocorticosteroids on serum, liver, and lung vitamin A and retinyl ester concentrations. J. Pediatr. Gastroenterol. Nutr. 13, 376–382.
Sorg O., Tran C., Carraux P., Didierjean L., Saurat J. (1999) Retinol and retinyl ester epidermal pools are not identically sensitive to UVB irradiation and anti-oxidant protective effect. Dermatology. 199, 302–307.
Takase S., Goda T., Yokogoshi H., Hoshi T. (1992) Changes in vitamin A status following prolonged immobilization (simulated weightlessness). Life Sci. 51, 1459–1466.
Nakano K., Morita A. (1982) Redistribution of vitamin A in tissues of rats with imposed chronic confinement stress. Br. J. Nutr. 47, 645–652.
Jiang Z.M., Wu X.J., Liu Y., Du X.H., Shen S.J., Xu L.Y., Sun W.X. (2013) Changes of gene expression profiles across different phases of vascular calcification in rats. Genet. Mol. Res. 12, 5945–5957.
Gupta V., Galante A., Soteropoulos P., Guo S., Wagner B.J. (2005) Global gene profiling reveals novel glucocorticoid induced changes in gene expression of human lens epithelial cells. Mol. Vis. 11, 1018–1040.
Korkut S., Baştuğ O., Raygada M., Hatipoğlu N., Kurtoğlu S., Kendirci M., Lyssikatos C., Stratakis C.A. (2016) Complex glycerol kinase deficiency and adrenocortical insufficiency in two neonates. J. Clin. Res. Pediatr. Endocrinol. 8, 468–471.
Seltzer W.K., Firminger H., Klein J., Pike A., Fennessey P., McCabe E.R. (1985) Adrenal dysfunction in glycerol kinase deficiency. Biochem. Med. 33, 189–199.
Huq A.H., Lovell R.S., Ou C.N., Beaudet A.L., Craigen W.J. (1997) X-linked glycerol kinase deficiency in the mouse leads to growth retardation, altered fat metabolism, autonomous glucocorticoid secretion and neonatal death. Hum. Mol. Genet. 6, 1803–1809.
Festuccia W.T., Guerra-Sá R., Kawashita N.H., Garófalo M.A., Evangelista E.A., Rodrigues V., Kettelhut I.C., Migliorini R.H. (2003) Expression of glycerokinase in brown adipose tissue is stimulated by the sympathetic nervous system. Am. J. Physiol. Regul. Integr. Comp. Physiol. 284, R1536–1541.
Van Maldergem L., Hou Q., Kalscheuer V.M., Rio M., Doco-Fenzy M., Medeira A., de Brouwer A.P., Cabrol C., Haas S.A., Cacciagli P., Moutton S., Landais E., Motte J., Colleaux L., Bonnet C., Villard L., Dupont J., Man H.Y. (2013) Loss of function of KIAA2022 causes mild to severe intellectual disability with an autism spectrum disorder and impairs neurite outgrowth. Hum. Mol. Genet. 22, 3306–3314.
de Lange I.M., Helbig K.L., Weckhuysen S., Møller R.S., Velinov M., Dolzhanskaya N., Marsh E., Helbig I., Devinsky O., Tang S., Mefford H.C., Myers C.T., van Paesschen W., Striano P., van Gassen K., van Kempen M., de Kovel C.G., Piard J., Minassian B.A., Nezarati M.M., Pessoa A., Jacquette A., Maher B., Balestrini S., Sisodiya S., Warde M.T., De St Martin A., Chelly J., EuroEPINOMICS-RES MAE working group, van 't Slot R., Van Maldergem L., Brilstra E.H., Koeleman B.P. (2016) De novo mutations of KIAA2022 in females cause intellectual disability and intractable epilepsy. J. Med. Genet. 53, 850–858.
Kuroda Y., Ohashi I., Naruto T., Ida K., Enomoto Y., Saito T., Nagai J., Wada T., Kurosawa K. (2015) Delineation of the KIAA2022 mutation phenotype: two patients with X-linked intellectual disability and distinctive features. Am. J. Med. Genet. A. 167, 1349–1353.
Salas I.H., Callaerts-Vegh Z., Arranz A.M., Guix F.X., D’Hooge R., Esteban J.A., De Strooper B., Dotti C.G. (2017) Tetraspanin 6: a novel regulator of hippocampal synaptic transmission and long term plasticity. PLoS One. 12, e0171968.
Zhong L., Cherry T., Bies C.E., Florence M.A., Gerges N.Z. (2009) Neurogranin enhances synaptic strength through its interaction with calmodulin. EMBO J. 28, 3027–3039.
Stein V., House D.R., Bredt D.S., Nicoll R.A. (2003) Postsynaptic density-95 mimics and occludes hippocampal long-term potentiation and enhances long-term depression. J. Neurosci. 23, 5503–5506.
Matsuda A., Suzuki Y., Honda G., Muramatsu S., Matsuzaki O., Nagano Y., Doi T., Shimotohno K., Harada T., Nishida E., Hayashi H., Sugano S. (2003) Large-scale identification and characterization of human genes that activate NF-kappaB and MAPK signaling pathways. Oncogene. 22, 3307–3318.
Wang Y., Tong X., Omoregie E.S., Liu W., Meng S., Ye X. (2012) Tetraspanin 6 (TSPAN6) negatively regulates retinoic acid-inducible gene I-like receptor-mediated immune signaling in a ubiquitination-dependent manner. J. Biol. Chem. 287, 34626–34634.
Kennedy B.C., Dimova J.G., Dakoji S., Yuan L.L., Gewirtz J.C., Tran P.V. (2016). Deletion of novel protein TMEM35 alters stress-related functions and impairs long-term memory in mice. Am. J. Physiol. Regul. Integr. Comp. Physiol. 311, R166–178.
Дубинина А.Д., Антонов Е.В., Федосеева Л.А., Пивоварова Е.Н., Маркель А.Л., Иванова Л.Н. (2016) Ренин-ангиотензин-альдостероновая система у крыс линии НИСАГ (ISIAH) со стресс-индуцированной артериальной гипертензией Вавиловский журн. генетики и селекции. 20, 954–958.
Sato S., Hasegawa M., Fujimoto M., Tedder T.F., Takehara K. (2000) Quantitative genetic variation in CD19 expression correlates with autoimmunity. J. Immunol. 165, 6635–6643).
López-Doménech G., Serrat R., Mirra S., D’Aniello S., Somorjai I., Abad A., Vitureira N., García-Arumí E., Alonso M.T., Rodriguez-Prados M., Burgaya F., Andreu A.L., García-Sancho J., Trullas R., Garcia-Fernàndez J., Soriano E. (2012) The Eutherian Armcx genes regulate mitochondrial trafficking in neurons and interact with Miro and Trak2. Nat. Commun. 3, 814.
Althubiti M., Lezina L., Carrera S., Jukes-Jones R., Giblett S.M., Antonov A., Barlev N., Saldanha G.S., Pritchard C.A., Cain K., Macip S. (2014) Characterization of novel markers of senescence and their prognostic potential in cancer. Cell Death Dis. 5, e1528.
Ong W.Y., Ng M.P., Loke S.Y., Jin S., Wu Y.J., Tanaka K., Wong P.T. (2013) Comprehensive gene expression profiling reveals synergistic functional networks in cerebral vessels after hypertension or hypercholesterolemia. PLoS One. 8, e68335.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


