Молекулярная биология, 2023, T. 57, № 2, стр. 373-383
Изменение экспрессии генов, ассоциированных с кальциевыми процессами в гиппокампе мышей, под влиянием хронического социального стресса
М. Б. Павлова a, *, Д. А. Смагин b, Н. Н. Кудрявцева b, Н. А. Дюжикова a, **
a Институт физиологии им. И.П. Павлова
199034 Санкт-Петербург, Россия
b Институт цитологии и генетики Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: pavlova@infran.ru
** E-mail: dyuzhikova@infran.ru
Поступила в редакцию 05.08.2022
После доработки 24.08.2022
Принята к публикации 07.09.2022
- EDN: EEDPRC
- DOI: 10.31857/S0026898423020192
Аннотация
Используя данные полного транскриптомного анализа, исследовали изменение экспрессии генов, кодирующих белки, вовлеченные в процессы кальциевой регуляции, в гиппокампе самцов мышей с симптомами депрессии, вызванными хроническим социальным стрессом. Экспрессия генов Cacna1g, Cacnb3, Camk1g, Camk2d, Camk2n2, Caly, Caln1, S100a16, Slc24a4 в гиппокампе депрессивных животных была выше, а экспрессия генов Cacna2d1, Cacng5, Grin2a, Calm2 – ниже, чем в контроле. Наибольшее число значимых корреляционных взаимосвязей выявлено между экспрессией гена Сalm2, имеющего наибольшую транскрипционную активность, и других дифференциально экспрессируемых генов. Предполагается, что под влиянием хронического социального стресса происходит нарушение кальциевой сигнализации в гиппокампе мышей. Обсуждается участие в этом процессе гена Calm2 и генов Сamk1g, Camk2d и Сamk2n2.
ВВЕДЕНИЕ
Депрессия – многофакторное заболевание, вызванное взаимодействием социальных, психологических и физиологических факторов, является одним из наиболее распространенных психических расстройств [1]. Молекулярно-генетическим механизмам депрессии посвящено большое количество исследований. Активно ведутся поиски генов, ассоциированных с депрессией [2–4]. Многообразие выявляемых генов согласуется с представлением о депрессии, как о сложном гетерогенном заболевании, включающем самые разнообразные нейрофизиологические процессы [5–7].
Известно, что механизмы большинства психоэмоциональных расстройств, в том числе депрессии [8–10] и неврологических заболеваний [11–15], связаны с нарушениями кальциевого гомеостаза в центральной нервной системе. Показано, что ионы кальция регулируют различные процессы нормальной жизнедеятельности клетки [16, 17]. Они выполняют функцию вторичных посредников, запускающих важнейшие внутриклеточные сигнальные каскады в ответ на внешние стимулы [18] посредством взаимодействия с кальций-связывающим белком кальмодулином [19–21]. При этом в нервной ткани кальциевая сигнализация играет особую роль в деполяризации мембраны и в синаптической активности [22, 23], обеспечивая пластичность нейронов, процессы обучения и памяти [24].
Различные заболевания, вызванные нарушением кальциевых процессов, принято обозначать общим термином кальциопатии. А нарушения в работе потенциалзависимых кальциевых каналов, вызванные дисфункцией субъединиц ионного канала и/или регулирующих их белков, называют кальциевыми каналопатиями, которые, наряду с дисфункцией регуляторных путей и митохондрий, составляют основу кальциопатий [25].
Важную роль в механизмах психических расстройств, в частности депрессии [15, 26, 27], играет гиппокамп – один из центральных отделов лимбической системы, непосредственно участвующий в процессах нейрогенеза, формирования эмоций, консолидации памяти, в реакции организма на стресс [28, 29]. Поэтому цель нашей работы состояла в выявлении генов, экспрессия которых в гиппокампе изменяется под влиянием хронического социального стресса и которые кодируют белки, принимающие участие в регуляции кальциевых процессов. Мы использовали данные транскриптомного анализа (RNA-seq) гиппокампа самцов мышей, находившихся под влиянием хронического социального стресса, приводящего к развитию депрессивноподобного состояния [30, 31].
Предполагалось, что изучение степени и направленности изменений экспрессии отдельных генов, связанных с кальциевыми процессами в клетках гиппокампа, позволит приблизиться к пониманию Са2+-зависимых молекулярных механизмов формирования депрессивноподобного состояния у мышей, вызванного влиянием хронического социального стресса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Животные. Эксперименты проводили на половозрелых самцах мышей линии C57BL/6J в возрасте 2.5–3 мес. и массой тела 26–28 г. Воду и корм (гранулы) животные получали в достаточном количестве. Световой режим был равен 12 : 12 ч. Все экспериментальные процедуры проводили в соответствии с международными правилами и стандартами работы с животными (Directive 2010/63/EU of the European Parliament and of the Council on the Protection of Animals Used for Scientific Purposes). Протокол эксперимента № 9 одобрен Комиссией по биоэтике ИЦиГ СО РАН (Март, 24, 2010, N 613).
Формирование депрессивноподобного состояния у самцов мышей. Депрессивноподобное состояние формировали, используя модель хронического социального стресса [31, 32]. Животных попарно помещали в экспериментальные клетки, разделенные пополам прозрачной перегородкой с отверстиями, что позволяло мышам видеть, слышать, воспринимать запахи друг друга (сенсорный контакт), но предотвращало физическое взаимодействие. Ежедневно во второй половине дня (с 15 до 17 ч) перегородку убирали, что приводило к агонистическим взаимодействиям. В течение первых 2–3 дней выявляли победителей, ежедневно демонстрирующих агрессивное поведение, и особей, терпящих поражение при взаимодействии с одним и тем же партнером. В дальнейшем ежедневно побежденного самца после теста пересаживали в новую клетку к незнакомому агрессивному партнеру, сидящему за перегородкой. Если интенсивные атаки со стороны нападающей особи во время теста агонистических взаимодействий длились более 3 мин, то взаимодействие самцов прекращали, устанавливая между ними перегородку во избежание повреждения партнера. В других случаях тест продолжали до 10 мин. После 3 нед эксперимента у самцов с повторным опытом социальных поражений развивалось депрессивноподобное состояние [31].
Для нейрогеномного исследования отбирали животных с отрицательным опытом поражений и выраженным депрессивным расстройством, сопровождающимся тревогой, страхом, сниженной двигательной активностью (далее – депрессивные мыши). В качестве альтернативного варианта для выявления специфики изменений использовали также животных контрастной социальной группы – с положительным опытом побед в межсамцовых конфронтациях, показывающих агрессивное поведение (далее – агрессивные мыши) во время теста.
Опытные группы депрессивных и агрессивных мышей декапитировали на следующий день после последней конфронтации. Контролем служили самцы без последовательного опыта агонистических взаимодействий. Гиппокампы выделял согласно анатомическому атласу Allen Mouse Brain Atlas [http://mouse.brain-map.org/static/atlas] один и тот же исследователь. Все пробы маркировали, помещали в раствор для предотвращения деградации РНК (RNAlater) и хранили при температуре –70°C до секвенирования.
Транскриптомный анализ. Образцы гиппокампа самцов мышей отправляли в ЦКП “Геноаналитика” для секвенирования транскриптома (http://genoanalytica.ru/, Москва, Россия). Анализировали по три животных каждой группы. Секвенировали каждый образец отдельно. мРНК выделяли с использованием набора Dynabeads RNA Purificatio nKit (“Ambion”, США). Библиотеки кДНК конструировали с использованием протокола NEBNext для Illumina (“NEB”, США). Библиотеки кДНК секвенировали на платформе Illumina Hiseq 1500 (“Illumina Sequencing”, США). В последующий анализ брали только аннотированные гены. Уровень экспрессии генов оценивали в единицах FPKM (fragments per kilobase of transcript per million mapped reads) с использованием программы Cufflinks.
Категории генных онтологий списков дифференциально экспрессируемых генов (ДЭГ) определяли с использованием биоинформатического Интернет-ресурса. Дифференциально экспрессируемыми считали гены, уровень экспрессии которых статистически значимо различался (p < 0.05) при сравнении депрессивных и контрольных мышей; агрессивных и контрольных; депрессивных и агрессивных. Решение о статистической значимости различий принимали также с использованием поправки на множественные сравнения (q-значения – p-значения, скорректированные по методу Беньямини–Хохберга (FDR)). Категории генных онтологий списков ДЭГ оценивали с использованием Интернет-ресурсов:
1) “STRING: functional protein association networks” (http://string-db.org);
2) “GeneCards: The human gene database” (https://genecards.org);
3) “MalaCards: Human disease database” (https://malacards.org).
Изначально внимание в нашей работе было сконцентрировано на 75 генах, которые кодируют белки, участвующие в различных клеточных процессах, связанных с Са2+ – от транспорта Са2+ через ионные каналы, меняющего его внутриклеточную концентрацию – до запуска Са2+/кальмодулинзависимых сигнальных каскадов посредством активации соответствующих ферментов. Список этих генов приведен в табл. S1 (см. Дополнительные материалы на сайте http://www.molecbio.ru/downloads/2023/2/supp_Pavlova_rus.pdf).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Нами обнаружены различия в наборе ДЭГ, а также в направленности и выраженности изменений экспрессии генов в гиппокампе мышей с альтернативным (негативным и позитивным) опытом социальных взаимодействий.
Экспрессия 26 из 75 проанализированных генов у депрессивных мышей значимо отличалась от экспрессии в группах контрольных и агрессивных особей (табл. 1). Эти гены кодируют функционально различные белки, участвующие в процессах кальциевой сигнализации: 11 генов (Cacna1a, Cacna1b, Cacna1g, Cacna1h, Cacna1i, Cacna2d1, Cacnb1, Cacnb3, Cacng2, Cacng3, Cacng5) кодируют белки потенциалзависимых кальциевых каналов; семь генов (Calb1, Calcoco1, Calm2, Caln1, Hpcal4, Ppp3r1, S100a16) – кальций-связывающие белки; один ген (Caly) кодирует нейрон-специфичный белок кальцион, необходимый для максимального высвобождения Са2+; три гена (Camk1g, Camk2d, Camk2n2) кодируют Са2+/кальмодулинзависимые протеинкиназы Iγ, IIϭ и ингибитор протеинкиназы II; два гена (Slc24a2, Slc24a4) – это гены белков-переносчиков Na/K/Ca; два гена (Grin2a, Grin2c) кодируют субъединицы 2A и 2С глутаматного рецептора NMDA c высокой проницаемостью для Са2+.
Таблица 1.
ДЭГ, участвующие в регуляции кальциевых процессов в гиппокампе мышей с альтернативным опытом социального поведения
| Ген | Кодируемый белок* | Д vs K | А vs K | Д vs A |
|---|---|---|---|---|
| Cacna1a | Кальциевый канал, потенциалзависимый, тип P/Q, альфа-1A субъединица | ▼ | Δ | |
| Cacna1b | Кальциевый канал, потенциалзависимый, N-тип, альфа-1B субъединица | Δ | ||
| Cacna1g | Кальциевый канал, потенциалзависимый, Т-тип, альфа-1G субъединица | ΔΔΔ | ΔΔΔ* | |
| Cacna1h | Кальциевый канал, потенциалзависимый, Т-тип, альфа-1Н субъединица | ΔΔ* | ||
| Cacna1i | Кальциевый канал, потенциалзависимый, альфа-1I субъединица | Δ | ||
| Cacna2d1 | Кальциевый канал, потенциалзависимый, альфа-2/дельта-1 субъединица | ▼ | ▼▼▼* | |
| Cacnb1 | Кальциевый канал, потенциалзависимый, бета-1 субъединица | Δ | ||
| Cacnb3 | Кальциевый канал, потенциалзависимый, бета-3 субъединица | Δ | ΔΔΔ* | |
| Cacng2 | Кальциевый канал, потенциалзависимый, гамма-2 субъединица | ▼▼ | ΔΔΔ* | |
| Cacng3 | Кальциевый канал, потенциалзависимый, гамма-3 субъединица | Δ | ||
| Cacng5 | Кальциевый канал, потенциалзависимый, гамма-5 субъединица | ▼ | ▼▼▼* | |
| Calb1 | Кальбиндин 1, кальций-связывающий белок | ▼ | ||
| Calcoco1 | Кальций-связывающий белок 1, домен со свернутыми спиралями | Δ | ||
| Calm2 | Кальмодулин 2, кальций-связывающий белок | ▼ | ▼ | |
| Caln1 | Кальнейрон 1, кальций-связывающий белок 8 | Δ | ΔΔ* | |
| Caly | Кальцион, нейронспецифический везикулярный трансмембранный белок | Δ | ||
| Camk1g | Кальций/кальмодулинзависимая протеинкиназа I гамма | Δ | ΔΔΔ* | |
| Camk2d | Кальций/кальмодулинзависимая протеинкиназа II дельта | ΔΔΔ* | ΔΔ* | |
| Camk2n2 | Ингибитор 2 кальций/кальмодулинзависимой протеинкиназы II | ΔΔ | ΔΔΔ* | |
| Hpcal4 | Гиппокальцин, подобный 4, кальций-связывающий белок | Δ | ||
| Ppp3r1 | Протеинфосфатаза 3, кальцинейрин B, тип I, Са/кальмодулинзависимая | ▼▼ | ||
| S100a16 | S100 кальций-связывающий белок A16 | ΔΔ | Δ | |
| Slc24a2 | Транспортный белок-переносчик ионов Na/K/Ca, семейство 24, член 2 | ▼ | ||
| Slc24a4 | Транспортный белок-переносчик ионов Na/K/Ca, семейство 24, член 4 | Δ | ||
| Grin2a | Глутаматный ионотропный рецептор NMDA 2A (проницаем для Са2+) | ▼▼ | ▼▼ | |
| Grin2c | Глутаматный ионотропный рецептор NMDA 2C (проницаем для Са2+) | Δ | ||
| Всего генов | 26 | 13 | 2 | 24 |
* Источник: http://string-db.org Примечание: Δ – повышение экспрессии: Δ – p < 0.05, ΔΔ – p < 0.01, ΔΔΔ – p < 0.001;▼ – снижение экспрессии: ▼ – p < 0.05, ▼▼ – p < 0.01, ▼▼▼ – p < 0.001, *q < 0.05. Д – депрессивные мыши; K – контрольные; А – агрессивные.
Cравнение экспрессии генов у депрессивных и агрессивных мышей (Д vs A) выявило различия в экспрессии 24 генов. Экспрессия 17 из этих генов (Cacna1, Cacna1b, Cacna1g, Cacna1h, Cacna1i, Cacnb1, Cacnb3, Cacng2, Cacng3, Calcoco1, Caln1, Camk1g, Camk2d, Camk2n2, Hpcal4, S100a16, Grin2c) у депрессивных животных была выше, чем у агрессивных, а остальные семь генов (Cacna2d1, Cacng5, Calb1, Calm2, Ppp3r1, Slc24a2, Grin2a) экспрессировались на более высоком уровне у агрессивных особей (табл. 1).
У депрессивных животных экспрессия 13 генов статистически значимо отличалась от экспрессии у контрольных животных (рис. 1; табл. 1). В частности, экспрессия 9 генов (Cacna1g, Cacnb3 Camk1g, Camk2d, Camk2n2, Caly, Caln1, S100a16, Slc24a4) повысилась, а четырех (Cacna2d1, Cacng5, Grin2a, Calm2) снизилась. Экспрессия двух генов (Cacng2, Cacna1a) у агрессивных животных снизилась по сравнению с контролем, не выявлены гены, экспрессия которых увеличилась под влиянием стресса (рис. 1, табл. 1).
Рис. 1.
Повышение (а) и понижение (б) экспрессии ДЭГ, связанных с регуляцией кальциевых процессов в гиппокампе агрессивных и депрессивных мышей. *р < 0.05; **р < 0.01; ***р < 0.001 – по сравнению с контролем; светлый столбик – контрольные животные; темный столбик – опытные.

Корреляционный анализ экспрессии 15 ДЭГ, представленных на рис. 1, выявил различия в степени и направленности корреляционных связей между ними (табл. 2; подробные данные представлены в табл. S2 , см. дополнительные материалы).
Таблица 2.
Коэкспрессия ДЭГ в гиппокампе самцов мышей#
| Ген | Cacna1g | Camk1g | Camk2n2 | Caln1 | Calm2 |
|---|---|---|---|---|---|
| Cacna1g | – | 0.812** | 0.844** | 0.903*** | –0.853** |
| Cacnb3 | 0.791* | 0.796* | 0.795* | 0.826** | –0.845** |
| Camk1g | 0.812** | – | 0.891** | 0.949*** | –0.927*** |
| Camk2d | 0.678* | 0.560 | 0.697* | 0.648 | –0.703* |
| Camk2n2 | 0.844** | 0.891** | – | 0.941*** | –0.953*** |
| Caly | 0.571 | 0.666 | 0.654 | 0.697* | –0.784* |
| Caln1 | 0.903*** | 0.949*** | 0.941*** | – | –0.942*** |
| S100a16 | 0.869** | 0.750* | 0.719* | 0.851** | –0.756* |
| Slc24a4 | 0.790* | 0.644 | 0.566 | 0.719* | –0.704* |
| Cacna2d1 | –0.634 | –0.830** | –0.783* | –0.861** | 0.717* |
| Cacng5 | –0.317 | -0.398 | -0.137 | –0.283 | 0.287 |
| Grin2a | –0.670* | –0.832** | –0.812** | –0.801** | 0.851** |
| Calm2 | –0.853** | –0.927*** | –0.953*** | –0.942*** | – |
| Cacna1a | 0.573 | 0.689* | 0.640 | 0.608 | –0.614 |
| Cacng2 | 0.620 | 0.826** | 0.651 | 0.671* | –0.683* |
| n | 9 | 10 | 9 | 11 | 12 |
Обнаружена разнонаправленная корреляционная связь между двумя группами генов, экспрессия которых изменилась у депрессивных мышей. Так ДЭГ, экспрессия которых повысилась (Cacna1g, Cacnb3, Camk1g, Camk2d, Camk2n2; Caly, Caln1, S100a16, Slc24a4), проявили, с одной стороны, только положительную корреляционную связь (либо ее отсутствие) между собой, а с другой – только отрицательную связь (либо ее отсутствие) с ДЭГ, экспрессия которых понизилась (Cacna2d1, Cacng5, Grin2a, Calm2). Выявлена только положительная корреляционная связь между ДЭГ со сниженной экспрессией (либо ее отсутствием). Экспрессия гена Cacng5 не коррелировала с экспрессией других генов (табл. S2 , см. Дополнительные материалы на сайте http://www.molecbio.ru/ downloads/2023/2/supp_Pavlova_rus.pdf).
Выявлена положительная корреляционная связь между двумя ДЭГ кальциевых каналов (Cacna1a и Cacng2), экспрессия которых изменилась у агрессивных мышей. Эти данные свидетельствуют о том, что субъединицы белков кальциевых каналов, кодируемые этими генами, координированно участвуют в регуляции кальциевых процессов в гиппокампе агрессивных мышей (табл. S2 ).
У пяти из 15 генов (Cacna1g, Camk1g, Camk2n2, Caln1, Calm2) мышей альтернативных поведенческих групп обнаружено максимальное количество корреляционных связей, в том числе высокозначимых (р < 0.01 или р < 0.001), между собой и с остальными генами (табл. 2). Максимальное количество корреляционных связей с другими генами выявлено у гена Саlm2, причем большинство из этих связей были отрицательными (табл. 2).
С целью получения дополнительных сведений о характере взаимодействия этих 15 ДЭГ в регуляции кальциевых процессов проанализировали функциональные ассоциативные взаимосвязи белков, кодируемых этими генами, с использованием базы данных STRING (http://string-db.org). Ассоциативные взаимосвязи белков, кодируемых 11 из 15 ДЭГ, представлены на рис. 2.
Рис. 2.
Функциональные ассоциативные взаимосвязи 11 белков, кодируемых ДЭГ (по данным STRING (http://string-db.org)).
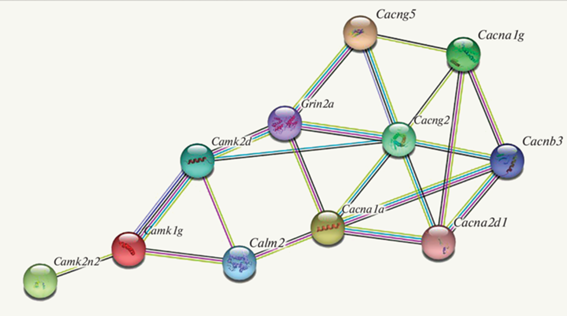
Эта схема указывает на возможную ключевую роль ДЭГ Сalm2, Сamk1g, Camk2d, Сamk2n2, а также гена Grin2a, кодирующего альфа-субъединицу глутаматного рецептора NMDA c высокой проницаемостью для Са2+, в формировании возможных путей регуляции работы кальциевых каналов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В нашей работе впервые показано изменение экспрессии генов, кодирующих белки, связанные с регуляцией процессов кальциевой сигнализации в гиппокампе самцов мышей, подвергнутых воздействию хронического социального стресса. Полученные результаты согласуются с экспериментальными свидетельствами участия гиппокампа, как одного из центральных звеньев лимбической системы мозга, в реакции организма на хронический социальный стресс [28, 29, 33, 34] и в патогенезе различных психических заболеваний – аутизма, тревожных расстройств, шизофрении и, в том числе, депрессии [26, 27, 35–39].
Нами показано, что реакция на хронический социальный стресс у животных обеих опытных групп сопровождается специфическим изменением экспрессии ассоциированных с кальциевыми процессами генов в гиппокампе. Причем картина изменений более выражена у депрессивных мышей, рассматриваемых в качестве модели депрессивной психопатологии у человека [30, 31]. Так у депрессивных животных изменилась (по сравнению с контролем) экспрессия 13 из 15 исследованных генов, а у агрессивных только двух, но экспрессия этих двух генов не изменилась у депрессивных мышей (рис. 1; табл. 1, столбцы Д vs K; А vs K).
Однако сравнение двух групп животных с альтернативным опытом социального поведения выявило различия в экспрессии 24 генов (табл. 1, столбец Д vs A). По-видимому, при сравнении агрессивных и депрессивных особей проявилась разнонаправленность изменений экспрессии в этих группах по сравнению с контролем.
Следует отметить, что эту модель использовали также для изучения экспрессии других групп генов в гиппокампе и получили схожие результаты. Так, в тех же условиях в гиппокампе агрессивных мышей изменилась экспрессия пяти генов, кодирующих белки коллагена, у депрессивных – 15 генов; только два гена были общими в обеих группах животных, при этом экспрессия изменялась разнонаправленно [40]. Изучение глутаматергических генов выявило изменение экспрессии только одного из них у агрессивных мышей и семи – у депрессивных [41]. Эти результаты, наряду с фактами, полученными в данной работе, свидетельствуют о том, что депрессивные животные более подвержены негативному влиянию хронического социального стресса на экспрессию различных генов в гиппокампе.
Именно мембранные потенциалзависимые кальциевые каналы играют наиболее значимую роль в кальциевой сигнализации, поскольку проходящие через них ионы Са2+ влияют на множество внутриклеточных процессов, таких как проведение электрических импульсов в нейронах, синаптическая передача, регуляция секреторных клеточных механизмов, активация Са2+-зависимых каскадных процессов, экспрессия генов [23, 42–44]. Считается, что потенциалзависимые каналы неактивны и активируются при деполяризации мембраны и сдвиге потенциала в положительную область, открывая поток ионов Са2+ в клетку [45, 46]. Показано, что неконтролируемое воздействие хронического стресса изменяет структуру дендритов в гиппокампе и приводит к более высокой кальциевой нагрузке на клетки при деполяризации [28].
Нами выявлена разная направленность изменений экспрессии шести генов, кодирующих белки потенциалзависимых каналов, у животных обеих опытных групп (рис. 1), а также разные степень и направление (положительное/отрицательное) корреляционных связей этих генов между собой и с другими генами (табл. S2 , см. Дополнительные материалы на сайте http://www.molecbio.ru/downloads/2023/2/supp_Pavlova_rus.pdf). Так, например, обнаружена положительная корреляционная связь экспрессии гена Cacna1g с 9 другими ДЭГ и увеличение экспрессии этого гена у депрессивных животных. Вместе с тем, ген Сасna2d1 (принадлежащий к этому же семейству), экспрессия которого снизилась, связан отрицательной корреляционной зависимостью с пятью генами. Выявлено снижение экспрессии гена Cacng5 и отсутствие его корреляционных связей с другими ДЭГ. Эти результаты не позволяют получить детальную картину совместной регуляции кальциевых процессов ДЭГ потенциалзависимых кальциевых каналов, но могут свидетельствовать о различном характере их участия в условиях хронического социального стресса.
Под влиянием хронического социального стресса, вызывающего депрессивноподобное состояние, у животных изменялась экспрессия не только генов, кодирующих белки субъединиц кальциевых каналов, но также ряда других генов, ответственных за продукцию белков, которые подключаются к процессу регуляции кальциевой сигнализации в клетке на разных ее этапах. Показано изменение экспрессии генов, кодирующих кальций-связывающие белки, в том числе кальмодулин, кальций/кальмодулинзависимые протеинкиназы, ингибитор протеинкиназы, трансмембранные белки, регулирующие поступление Са2+ в клетку, белки-транспортеры (рис. 1; табл. 1).
Интересны данные, полученные для гена Саlm2, кодирующего кальций-связывающий белок кальмодулин (кальций-модулирующий белок). Во-первых, экспрессия этого гена в гиппокампе (>800 FPKM) многократно превышает экспрессию других генов (рис. 1). Во-вторых, у этого гена обнаружено самое большое количество корреляционных связей с другими ДЭГ – 10 положительных и две отрицательных (табл. 2).
Кальмодулину, ответственному за передачу сигналов Са2+/кальмодулинзависимым протеинкиназам, принадлежит ключевая роль в патогенезе нейропсихических расстройств [47]. Активность Са2+/кальмодулинзависимых протеинкиназ наиболее выражена в тканях мозга, где они отвечают за целый ряд функций, регулируя процессы синаптической пластичности, экспрессию генов и ремоделирование цитоскелета. Обсуждается роль Са2+/кальмодулинзависимых протеинкиназ в развитии депрессии у человека и депрессивноподобных состояний у животных [48]. Показано, что комплекс Са2+/кальмодулин способен инактивировать потенциалзависимые кальциевые каналы при поступлении избытка Са2+ в клетку, что позволило ввести термин “кальмодуляция”, означающий регуляцию активности кальциевых каналов кальмодулином [49].
Снижение экспрессии гена Саlm2 и повышение экспрессии генов Camk1g, Camk2d и Camk2n2, функционально связанных с Сalm2, в сочетании с выявленными корреляционными связями с другими генами свидетельствует о значительных изменениях в работе кальций/кальмодулинзависимого протеинкиназного комплекса и опосредованной им системы внутриклеточной кальциевой сигнализации в гиппокампе животных, вызванных хроническим социальным стрессом.
Полученные результаты позволяют рассматривать эти гены в качестве ключевых в регуляции кальцийзависимой сигнальной системы в гиппокампе в условиях хронического социального стресса, что косвенно подтверждается ассоциативными связями кодируемых ими белков.
Обнаруженное нами значительное снижение экспрессии гена Grin2a в группе депрессивных мышей дополняет картину изменений активности других ДЭГ в гиппокампе (рис. 1). Ген Grin2a кодирует один из белков глутамат-управляемых Са2+-проницаемых ионных каналов, он играет ключевую роль в механизмах определенных видов памяти и обучения [50]. Этот ген связан положительной корреляционной связью с геном Саlm2 и отрицательной – с шестью генами, в число которых входят гены Camk1g, Camk2d, Camk2n2, а также ген Саln1, кодирующий белок семейства кальмодулинов, что говорит о координации активности Grin2a и перечисленных генов в гиппокампе этой группы мышей.
Полученные нами данные могут свидетельствовать о возможности развития в гиппокампе мышей кальциопатии, в том числе кальциевой каналопатии, связанных с нарушением процессов кальциевой сигнализации под влиянием хронического социального стресса.
В настоящее время особое внимание привлекают гены, входящие в группу Сасna. Эти гены кодируют белки потенциалзависимых кальциевых каналов, которые рассматривают в качестве ключевых и универсальных в патогенезе целого ряда психонейропатологий [51–55]. Так, например, с аутизмом ассоциированы четыре гена – Cacna1b, Cacna1g, Cacna1h и Cacna1i, экспрессия которых, как показано в нашем исследовании, изменилась у депрессивных животных. Этот факт согласуется с результатами другой работы, выполненной на этой поведенческой модели [41, 56], в которой выявлено повышение экспрессии генов, связанных с аутистическими проявлениями у депрессивных мышей.
Мы соотнесли 26 ДЭГ, ассоциированных с кальциевой сигнализацией у мышей (табл. 1), с аналогичными генами человека, используя генетические базы данных https://www.malacards.org/ и https://www.genecards.org/ и опубликованные данные [54]: 24 гена, дифференциально экспрессируемые в гиппокампе мышей, связаны с нейродегенеративными и психическими заболеваниями человека (табл. 3). Сходство генов, ассоциированных с кальциевыми процессами у мышей и у человека, позволяет прогнозировать возможность обнаружения общих механизмов формирования различных психонейропатологий, а также риск развития этих патологий, с использованием установленных генетических маркеров.
Таблица 3.
Гены-кандидаты психонейропатологий человека, участвующие в регуляции кальциевых процессов
| Ген | Психонейропатология |
|---|---|
| CACNA1A | Эпилепсия. Аутизм. Болезнь Хантингтона. Расстройство аутистического спектра.Шизофрения. Болезнь Паркинсона. Большое депрессивное расстройство. Биполярное расстройство. Большое аффективное расстройство. Умственная отсталость и глобальная задержка развития. Спиномозжечковая атаксия. Мигрень. Эпилептическая энцефалопатия |
| CACNA1B | Шизофрения. Биполярное расстройство. Синдром Тимоти. Эпилепсия. Аутизм. Расстройство аутистического спектра. Большое депрессивное расстройство. Психоз. Спиномозжечковая атаксия. Эпилептическая энцефалопатия |
| CACNA1G | Эпилепсия. Синдром Тимоти. Расстройство аутистического спектра. Аутизм. Паркинсонизм. Шизофрения. Эпилепсия. Умственная отсталость и глобальная задержка развития, в том числе в тяжелой форме. Спиномозжечковая атаксия |
| CACNA1H | Эпилепсия. Аутизм. Расстройство аутистического спектра. Синдром Тимоти. Биполярное расстройство. Шизофрения. Психоз. Умственная отсталость и глобальная задержка развития. Семейная гемиплегическая мигрень |
| CACNA1I | Эпилепсия. Шизофрения. Расстройство аутистического спектра. Болезнь Хантингтона. Умственная отсталость и глобальная задержка развития. Аутизм |
| CACNA2D1 | Синдром Тимоти. Эпилепсия. Шизофрения. Расстройство аутистического спектра. Аутизм. Шизофрения. Биполярное расстройство. Большое депрессивное расстройство. Умственная отсталость и глобальная задержка развития |
| CACNB1 | Расстройство аутистического спектра. Аутизм. Большое депрессивное расстройство. Эпилепсия. Болезнь Хантингтона |
| CACNB3 | Биполярное расстройство. Синдром гиперактивности с дефицитом внимания |
| CACNG2 | Шизофрения. Эпилепсия. Биполярное расстройство. Большое депрессивное расстройство. Умственная отсталость. Нарушение умственного развития |
| CACNG3 | Эпилепсия. Расстройство аутистического спектра |
| CACNG5 | Шизофрения. Биполярное расстройство. Болезнь Паркинсона. Эпилепсия |
| CALB1 | Болезнь Хантингтона. Болезнь Альцгеймера. Болезнь Паркинсона. Шизофрения. Биполярное расстройство. Эпилепсия. Деменция. Расстройство аутистического спектра |
| CALCOCO1 | Шизофрения. Паническое расстройство |
| CALM2 | Болезнь Альцгеймера. Большое депрессивное расстройство |
| CALN1 | Шизофрения. Аутизм |
| CALY | Шизофрения. Синдром гиперактивности с дефицитом внимания. Большое депрессивное расстройство. Посттравматическое стрессорное расстройство. Ментальная депрессия. Маразм. Паническое расстройство. Аутизм. Деменция. Биполярное расстройство. Расстройство аутистического спектра. Эпилепсия |
| CAMK1G | Болезнь Альцгеймера. Болезнь Хантингтона. Шизофрения |
| CAMK2D | Большое депрессивное расстройство. Болезнь Паркинсона. Эпилепсия. Шизофрения. Биполярное расстройство |
| CAMK2N2 | Шизофрения. Боковой амиотрофический склероз |
| PPP3R1 | Болезнь Альцгеймера. Деменция. Болезнь Паркинсона. Большое депрессивное расстройство. Спиномозжечковая атаксия |
| SLC24A2 | Эпилепсия. Аутизм. Болезнь Альцгеймера. Расстройство аутистического спектра. Шизофрения |
| SLC24A4 | Болезнь Альцгеймера. Биполярное расстройство. Деменция |
| GRIN2A | Эпилепсия. Шизофрения. Биполярное расстройство. Болезнь Хантингтона. Болезнь Альцгеймера. Аутизм. Обсессивно-компульсивное расстройство. Психоз. Ментальная депрессия. Болезнь Паркинсона. Большое аффективное расстройство |
| GRIN2C | Болезнь Паркинсона, болезнь Альцгеймера, депрессия, шизофрения. Aутизм, умственная отсталость |
ЗАКЛЮЧЕНИЕ
Установлено, что гены Calm2, Camk1g, Сamk2d и Camk2n2, дифференциально экспрессируемые в гиппокампе депрессивных мышей, связаны с ДЭГ потенциалзависимых кальциевых каналов и могут рассматриваться в качестве ключевых в регуляции работы этих каналов. Существенную роль может играть ген Grin2a, кодирующий субъединицу ионотропного глутаматного рецептора. В целом, полученные данные свидетельствуют об изменении экспрессии генов, связанных с кальциевой сигнализацией, и позволяют предположить развитие кальциопатии, в том числе кальциевой каналопатии, в гиппокампе мышей, находящихся в депрессивноподобном состоянии, формируемом под влиянием негативного опыта поражений при воздействии хронического социального стресса.
Работа выполнена при поддержке Госпрограммы 47 ГП “Научно-технологическое развитие Российской Федерации” (2019–2030), тема 0134-2019-0002, и ИЦиГ СО РАН в рамках БП № FWNR-2022-0019.
Работа с мышами проведена в соответствии с международными правилами и стандартами работы с животными (Directive 2010/63/EU of the European Parliament and of the Council on the Protection of Animals Used for Scientific Purposes). Протокол эксперимента № 9 одобрен Комиссией по биоэтике ИЦиГ СО РАН (Март, 24, 2010, N 613).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Li Z., Ruan M., Chen J., Fang Y. (2021) Major depressive disorder: advances in neuroscience research and translational applications. Neurosci. Bull. 37, 863–880.
Lohoff F.W. (2010) Overview of the genetics of major depressive disorder. Curr. Psychiatry Rep. 12, 539–546.
Sall S.S., Thompson W., Santos A., Dwyer D.S. (2021) Analysis of major depression risk genes reveals evolutionary conservation, shared phenotypes, and extensive genetic interactions. Front. Psychiatry. 12, 698029.
Mariani N., Cattane N., Pariante C., Cattaneo A. (2021) Gene expression studies in depression development and treatment: an overview of the underlying molecular mechanisms and biological processes to identify biomarkers. Translat. Psychiatry. 11, 354.
Stacey D., Cohen-Woods S., Toben C., Arolt V., Dannlowski U., Baune B.T. (2013) Evidence of increased risk for major depressive disorder in individuals homozygous for the high-expressing 5-HTTLPR/rs25531 (LA) allele of the serotonin transporter promoter. Psychiatr. Genet. 23, 222–223.
Fan T., Hu Y., Xin J., Zhao M., Wang J. (2020) Analyzing the genes and pathways related to major depressive disorder via a systems biology approach. Brain Behav. 10, e01502.
Nobis A., Zalewski D., Waszkiewicz N. (2020) Peripheral markers of depression. J. Clin. Med. 9, 3793.
Duman R.S., Voleti B. (2012) Signaling pathways underlying the pathophysiology and treatment of depression: novel mechanisms for rapid-acting agents. Trends Neurosci. 35, 47–56.
Donev R., Alawam K. (2015) Alterations in gene expression in depression: prospects for personalize patient treatment. Adv. Protein Chem. Struct. Biol. 101, 97–124.
Norkeviciene A., Gocentiene R., Sestokaite A., Sabaliauskaite R., Dabkeviciene D., Jarmalaite S., Bulotiene G.A. (2022) Systematic review of candidate genes for major depression. Medicina (Kaunas). 58, 285.
Berridge M.J. (2014) Calcium signaling and psychiatric disease: bipolar disorder and schizophrenia. Cell Tissue Res. 357, 477–492.
Fairless R., Williams S.K., Diem R. (2014) Dysfunction of neuronal calcium signaling in neuroinflammation and neurodegeneration. Cell Tissue Res. 357, 455–462.
Czeredys M. (2020) Dysregulation of neuronal calcium signaling via store-operated channels in Huntington’s disease. Front. Cell Dev. Biol. 8, 611735.
Da Silva P.R., Gonzaga do N.T.K.S, Maia R.E., da Silva B.A. (2022) Ionic channels as potential targets for the treatment of autism spectrum disorder: a review. Curr. Neuropharmacol. 20, 1834–1849.
Xu J., Minobe E., Kameyama M. (2022) Ca2+ dyshomeostasis links risk factors to neurodegeneration in Parkinson′s disease. Front. Cell. Neurosci. 16, 867385.
Schmunk G., Gargus J.J. (2013) Channelopathy pathogenesis in autism spectrum disorders. Front. Genet. 4, 222.
Cortés-Mendoza J., de León-Guerrero S.D., Pedraza-Alva G., Pérez-Martínez L. (2013) Shaping synaptic plasticity: the role of activity mediated epigenetic regulation on gene transcription. Int. J. Dev. Neurosci. 6, 359–369.
Berridge M.J., Lipp P., M.D., Bootman M.D. (2000) The versatility and universality of calcium signaling. Nat. Rev. Mol. Cell Biol. 1, 11–21.
Van Eldik L.J., Watterson D.M. (1998) Calmodulin and calcium signal transduction: an introduction. In: Calmodulin and Signal Transduction. Eds Van Eldik L.J., Watterson D.M. Elsevier: Academic Press, 1–15.
Brandt P.C., Vanaman T.C. (1998) Calmodulin and ion flux regulation. In: Calmodulin and Signal Transduction. Eds Van Eldik L.J., Watterson D.M. Elsevier: Academic Press, 397–471.
Zhang M., Abrams C., Wang L., Gizzi A., He L., Lin R., Chen Y., Loll P.J., Pascal J.M., Zhang J.-F. (2012) Structural basis for calmodulin as a dynamic calcium sensor. Structure. 20, 911–923.
Salińska E., Łazarewicz J.W. (2012) Role of calcium in physiology and pathology of neurons. Postepy Biochem. 58, 403–417.
Brini M., Calì T., Ottolini D., Carafoli E. (2014) Neuronal calcium signaling: function and dysfunction. Cell. Mol. Life Sci. 71, 2787–2814.
Napolioni V., Persico A.M., Porcelli V., Palmieri L. (2011) The mitochondrial aspartate/glutamate carrier AGC1 and calcium homeostasis: physiological links and abnormalities in autism. Mol. Neurobiol. 44, 83–92.
Schmunk G., Gargus J.J. (2013). Channelopathy pathogenesis in autism spectrum disorders. Front. Genet. 4, 222.
Savitz J.B., Drevets W.C. (2009) Imaging phenotypes of major depressive disorder: genetic correlates. Neuroscience. 164, 300–330.
Grace A.A. (2016). Dysregulation of the dopamine system in the pathophysiology of schizophrenia and depression. Nat. Rev. Neurosci. 17, 524–532.
Krugers H.J., Lucassen P.J., Karst H., Joëls M. (2010) Chronic stress effects on hippocampal structure and synaptic function: relevance for depression and normalization by anti-glucocorticoid treatment. Front. Synaptic Neurosci. 2, 24.
Lagace D.C., Donovan M.H., DeCarolis N.A., Farnbauch L.A., Malhotra S., Berton O., Nestler E.J., Krishnan V., Eisch A.J. (2010) Adult hippocampal neurogenesis is functionally important for stress-induced social avoidance. Proc. Natl. Acad. Sci. USA. 107, 4436–4441.
Golden S.A., Covington H.E., Berton O., Russo S.J. (2011) A standardized protocol for repeated social defeat stress in mice. Nat. Protoc. 6, 1183–1191.
Kudryavtseva N.N. (2021) Development of mixed anxiety/depression-like state as a consequences of chronic anxiety: review of experimental data. In: Curr. Topics Behav. Neurosci. Berlin, Heidelberg: Springer, 54, 125–152.
Kudryavtseva N.N., Bakshtanovskaya I.V., Koryakina L.A. (1991) Social model of depression in mice of C57BL/6J strain. Pharmacol. Biochem. Behav. 38, 315–320.
Karst H., Joëls M. (2007). Brief RU 38486 treatment normalizes the effects of chronic stress on calcium currents in rat hippocampal CA1 neurons. Neuropsychopharmacology. 32, 1830–1839.
Smagin D.A., Bondar N.P., Kovalenko I.N., Kudryavtseva N.N., Michurina T.V., Enikolopov G., Park J.-H., Peunova N., Glass Z., Sayed K. (2015) Altered hippocampal neurogenesis and amygdalar neuronal activity in adult mice with repeated experience of aggression. Front. Neurosci. 9, 443.
DeLong G.R. (1992) Autism, amnesia, hippocampus and learning. Neurosci. Biobehav. Rev. 16, 63–70.
Irle E., Ruhleder M., Lange C., Seidler-Brandler U., Salzer S., Dechent P., Weniger G., Leibing E., Leichsenring F. (2010) Reduced amygdalar and hippocampal size in adults with generalized social phobia. J. Psychiatry Neurosci. 35, 126–131.
Moon A.L., Haan N., Lawrence S. Wilkinson L.S., Thomas K.L., Hall J. (2018) CACNA1C: Association with psychiatric disorders, behavior and neurogenesis. Schizophrenia Bull. 44, 958–965.
Xu W., Yao X., Zhao F., Zhao H., Cheng Z., Yang W., Cui R., Xu S., Li B. (2020) Changes in hippocampal plasticity in depression and therapeutic approaches influencing these changes. Neural Plasticity. Article ID 8861903. 16.
Schwarz K., Moessnang C., Schweiger J.I., Harneit A., Schneider M., Chen J., Cao H., Schwarz E., Witt S.H., Rietschel M., Nöthen M., Degenhardt F., Wackerhagen C., Erk S., Romanczuk-Seiferth N., Walter H., Tost H., Meyer-Lindenberg A. (2022) Ventral striatal-hippocampus coupling during reward processing as a stratification biomarker for psychotic disorders. Biol. Psychiatry. 91, 216–225.
Smagin D.A., Galyamina A.G., Kovalenko I.L., Babenko V.N., Kudryavtseva N.N. (2019) Aberrant expression of collagen gene family in the brain regions of male mice with behavioral psychopathologies induced by chronic agonistic interactions. BioMed. Res. Internat. 7276389.
Коваленко И.Л., Галямина А.Г., Смагин Д.А., Кудрявцева Н.Н. (2020) Коэкспрессия глутаматергических генов и генов аутистического спектра в гиппокампе у самцов мышей с нарушением социального поведения. Вавиловский журн. генетики и селекции. 24, 191–199.
Berridge M.J., Bootman M.D., Roderick H.L. (2003) Calcium: calcium signaling: dynamics, homeostasis and remodeling. Nat. Rev. Mol. Cell Biol. 4, 517–529.
Clapham D.E. (2007) Calcium signaling. Cell. 131, 1047–1058.
Николлс Дж.Г., Мартин А.Р., Валлас Б. Дж., Фукс П.А. (2003) От нейрона к мозгу а. — М.: Едиториал УРСС, 672 с.
Долгачева Л.П., Тулеуханов С.Т., Зинченко В.П. (2020) Участие Са2+-проницаемых AMPA-рецепторов в синаптической пластичности. Биол. мембраны: Журн. мембранной и клеточной биологии. 37, 175–187.
Мельников К.Н. (2006) Разнообразие и свойства кальциевых каналов возбудимых мембран. Психофармакология и биологическая наркология. 6, 1139–1155.
Stratton M.M., Chao L.H., Schulman H., Kuriyan J. (2013) Structural studies on the regulation of Ca2+/calmodulin dependent protein kinase II. Curr. Opin. Struct. Biol. 23, 292–301.
Sałaciak K., Koszałka A., Zmudzka E., Pytka K. (2021) The calcium/calmodulin-dependent kinases II and IV as therapeutic targets in neurodegenerative and neuropsychiatric disorders. Int. J. Mol. Sci. 22, 1–32.
Ben-Johny M., Yue D.T. (2014) Calmodulin regulation (calmodulation) of voltage-gated calcium channels. J. Gen. Physiol. 143, 679–692.
Lucia D., Burgess D., Cullen C.L., Dorey E.S., Rawashdeh O., Moritz K.M. (2019) Periconceptional maternal alcohol consumption leads to behavioural changes in adult and aged offspring and alters the expression of hippocampal genes associated with learning and memory and regulators of the epigenome. Behav. Brain Res. 362, 249–257.
Dedic N., Pohlmann M.L., Richter J.S., Mehta D., Czamara D., Metzger M.W., Dine J., Bedenk B.T., Hartmann J., Wagner K.V., Jurik A., Almli L.M., Lori A., Moosmang S., Hofmann F., Wotjak C.T., Rammes G., Eder M., Chen A., Ressler K.J., Wurst W., Schmidt M.V., Binder E.B., Deussing J.M. (2018) Cross-disorder risk gene CACNA1C differentially modulates susceptibility to psychiatric disorders during development and adulthood. Mol. Psychiatry. 23, 533–543.
O′Roak B.J., Vives L., Girirajan S., Karakoc E., Krumm N., Coe B.P., Levy R., Ko A., Lee C., Smith J.D.,Turner E.H., Stanaway I.B., Vernot B., Malig M.,Baker C.,Reilly B., Akey J.M., Borenstein E., Rieder M.J., Nickerson D.A., Bernier R., Shendure J., Eichler E.E. (2012) Sporadic autism exomes reveal a highly interconnected protein network of de novo mutations. Nature. 485, 246–250.
Li B., Tadross M.R., Tsien R.W. (2016) Sequential ionic and conformational signaling by calcium channels drives neuronal gene expression. Science. 351, 863–867.
Kessi M., Chen B., Peng J., Yan F., Yang L., Yin F. (2021) Calcium channelopathies and intellectual disability: a systematic review. Orphanet. J. Rare. Dis. 16, 219.
Andrade A., Brennecke A., Mallat S., Brown J., Rivadeneira J., Czepiel N., Londrigan L. (2019) Genetic associations between voltage-gated calcium channels and psychiatric disorders. Int. J. Mol. Sci. 20, 3537.
Kudryavtseva N.N., Kovalenko I.L., Smagin D.A., Galyamina A.G., Babenko V.N. (2017) Abnormality of social behavior and dysfunction of autism related gene expression developing under chronic social defeat stress in male mice. Eur. Neuropsychopharmacol. 27, S678.
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Таблица S1. Гены, связанные с регуляцией кальциевых процессов, выбранные для анализа
Таблица S2. Коэкспрессия ДЭГ (15), вовлеченных в регуляцию кальциевых процессов в гиппокампе самцов мышей
Инструменты
Молекулярная биология


