Молекулярная биология, 2023, T. 57, № 2, стр. 299-306
Изменения уровня мРНК генов Tph1, Tph2, активности триптофангидроксилазы и метаболизма серотонина в мозге мышей через 5 суток после введения липополисахарида
Д. В. Щербаков a, А. Б. Арефьева a, П. Д. Комлева a, А. Е. Изъюров a, Н. В. Хоцкин a, Д. В. Базовкина a, А. В. Куликов a, *, **
a Институт цитологии и генетики Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: v_kulikov@bionet.nsc.ru
** E-mail: avkulikov52@gmail.com
Поступила в редакцию 24.07.2022
После доработки 25.08.2022
Принята к публикации 25.08.2022
- EDN: EEWKAW
- DOI: 10.31857/S0026898423020209
Аннотация
Триптофангидроксилазы 1 и 2 (ТПГ1 и ТПГ2) играют ключевую роль в синтезе гормона и медиатора серотонина (5-HT) в периферических тканях и 5-HT нейронах соответственно. С целью изучения роли ТПГ1 в головном мозге мыши определили уровень мРНК гена Tph1 в разных структурах мозга мышей в норме и при воспалении и сравнили его с уровнем мРНК гена Tph2, с активностью ТПГ и метаболизмом 5-HT. Опыты проводили на трех группах молодых (4 недели) самцов мышей линии C57BL/6 (интактных, контрольных, которым вводили в/б физиологический раствор, и опытных, у которых воспаление моделировали однократным в/б введением липополисахарида (2 мг/кг, ЛПС)). Через 5 суток после введения физиологического раствора или ЛПС определяли маркеры воспаления, массу селезенки и тимуса. В коре головного мозга, гиппокампе, стриатуме, гипоталамусе и среднем мозге с помощью ВЭЖХ оценивали уровень 5-HT и его метаболита – 5-гидроксииндолуксусной кислоты (5-HIAA), активность ТПГ. Уровень мРНК генов Tph1 и Tph2 определяли методом количественной ОТ-ПЦР. Через 5 суток после введения ЛПС наблюдали значительное увеличение массы селезенки и уменьшение массы тимуса. Выявлено значительное увеличение уровня 5-HT и 5-HIAA в среднем мозге и снижение уровня 5-HIAA и активности ТПГ в гипоталамусе мышей, которым вводили физиологический раствор и ЛПС, по сравнению с интактными мышами. Уровень мРНК гена Tph2 была максимальной в среднем мозге, где расположены тела 5-HT нейронов, тогда как в коре, гиппокампе, стриатуме и гипоталамусе уровень мРНК этого гена был в несколько раз ниже. В среднем мозге мышей всех групп уровень мРНК гена Tph1 был в несколько сотен раз ниже, чем уровень мРНК гена Tph2. Таким образом, в мозге мышей ТПГ1 экспрессируется на слишком низком уровне, чтобы существенно влиять на синтез 5-HT в норме и при воспалении.
ВВЕДЕНИЕ
Серотонин (5-HT) действует как ключевой медиатор в мозге и гормон на периферии. В мозге позвоночных 5-HT синтезируется в 5-HT нейронах, тела которых расположены в стволовой части мозга [1], тогда как на периферии он синтезируется в энтерохромаффинных клетках кишечника, тучных клетках кожи и эпифизе. Нарушения 5-HT системы мозга связывают с риском различных психопатологий, тогда как транспортер и рецепторы 5-HT служат мишенями для клинически эффективных антидепрессантов, анксиолитиков и антипсихотиков [2–4].
В организме млекопитающих 5-HT синтезируется из незаменимой аминокислоты – L-триптофана. Ключевыми ферментами синтеза 5-HT являются триптофангидроксилазы 1 и 2 (ТПГ1 и ТПГ2), которые гидроксилируют L-триптофан до 5-гидрокситриптофана (5-HTP) [5, 6]. Основным геном считается Tph2, который экспрессируется в 5-HT нейронах, тогда как Tph1 экспрессируется исключительно в периферических клетках, таких как энтерохромаффинные клетки кишечника, тучные клетки и пинеалоциты эпифиза [5–9]. Однако транскрипты гена Tph1 найдены в мозге крысы [10], мыши [11, 12] и человека [13–15], причем концентрации транскриптов Tph1 и Tph2 были соизмеримыми. Стресс может усиливать экспрессию гена Tph1 в мозге мышей [12].
Вопрос об экспрессии гена Tph1 принципиально важен для понимания роли ТПГ2 и ТПГ1 в функционировании 5-HT системы мозга в норме и при патологиях, поэтому основная цель нашей работы состояла в определении соотношения этих ферментов в мозге в норме и при патологии. Изучена экспрессия мРНК генов Tph1 и Tph2 в структурах головного мозга, содержащих тела 5-HT нейронов (средний мозг), в которых экспрессируется ген Tph2, и окончания этих нейронов (кора, гиппокамп, стриатум и гипоталамус), в которых данный ген не экспрессируется, в норме и через 5 сут после активации иммунной системы мышей бактериальным липополисахаридом (ЛПС). Состояние иммунной системы оценивали по массе селезенки и тимуса, а 5-HT системы – по уровню 5-HT и его основного метаболита, 5-гидроксииндолуксусной кислоты (5-HIAA), а также по активности ТПГ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Животные и воздействия. Опыты проводили на мышах линии C57BL/6 (24 молодых самца в возрасте 4 недель с массой тела 16.7 ± 0.4 г). Выбор молодых животных обусловлен их повышенной чувствительностью к ЛПС и лабильностью 5-HT системы мозга.
Для снятия группового эффекта животных сразу после получения рассаживали поодиночно в вентилируемые клетки Optimice (“Animal Care Systems, Inc.”, США) и содержали в течение всего эксперимента при температуре 24°С, влажности 45–50% и стандартном для вивария световом режиме (14 ч свет, 10 ч темнота). Стерильный корм и воду животные получали без ограничения. Все мыши были разделены на три выровненные по весу группы: интактную (n = 8, масса 16.4 ± 0.5 г), контрольную (n = 8, масса 17.1 ± 0.7 г) – мышам этой группы в/б вводили физиологический раствор; и опытную (n = 8, масса 16.7 ± 0.8 г.) – мышам этой группы в/б вводили 2 мг/кг ЛПС (“Sigma-Aldrich”, Германия), растворенного в физиологическом растворе. Через 5 сут после введения физиологического раствора или ЛПС животных усыпляли углекислым газом, декапитировали, выделяли головной мозг, селезенку и тимус. Последние взвешивали с точностью до мг на весах Ohaus AX124 (“Ohaus Corp.”, США). Из головного мозга выделяли структуры, содержащие окончания (переднюю кору, гиппокамп, стриатум, гипоталамус) и тела (средний мозг) 5-HT нейронов, замораживали в жидком азоте и хранили при –80°С.
Биохимические протоколы. В работе использовали метод, позволяющий определять содержание 5-HT, активность ТПГ и уровень мРНК целевых генов в одних и тех же образцах ткани. Для сохранения активности ТПГ кору, стриатум и гипоталамус гомогенизировали в 250 мкл, гиппокамп в 300 мкл и средний мозг в 400 мкл холодного 50 мМ Трис-HCl, pH 7.6, содержащего 1 мМ дитиотреитола. Одну аликвоту (50 мкл) суспензии немедленно переносили в пробирку эппендорф (1.5 мл), содержащую 150 мкл 0.6 М HClO4, для экстракции 5-HT и 5-HIAA. Другую аликвоту (100 мкл) суспензии немедленно переносили в пробирку эппендорф (1.5 мл), содержащую 500 мкл Trizol Reagent (“Ambion, Life Technologies”, США) для экстракции РНК. Остальной гомогенат центрифугировали в течение 15 мин при +4°С и 12700 об./мин, чистый супернатант переносили в пробирки, хранили при –80°С и использовали для определения активности ТПГ2. Процедура гомогенизации в буфере и аликвотирования одной пробы занимает меньше 1 мин и не вызывает деградации ни 5-HT, ни РНК.
Определение уровня 5-HT и 5-HIAA. Смесь суспензии (50 мкл) и 0.6 М HClO4 (150 мкл) центрифугировали в течение 20 мин при 12700 об./мин (+4°С). Полученный супернатант разбавляли в 2 раза водой MilliQ и использовали для определения уровня 5-HT и 5-HIAA с помощью высокоэффективной жидкостной хроматографии на колонке Luna C18(2) (частицы 5 мкм, L × I.D = = 75 × 4.6 мм, “Phenomenex”, США) и электрохимического детектора (750 мВ, DECADE II™ Electrochemical Detector; “Antec”, Нидерланды). Осадок растворяли в 0.1 М NaOH для определения концентрации общего белка в пробе по Брэдфорду (“BioRad”, США) согласно протоколу производителя. Концентрации 5-НТ и 5-HIAA в пробе определяли по площади пика с помощью программы LabSolution LG/GC (“Shimadzu Corp.”, Япония) и нормировали по калибровочной кривой, полученной с использованием стандартов 1, 2 и 3 нг для 5-HT и 5-HIAA [16]. Содержание 5-HT и 5-HIAA выражали в нг/мг белка.
Определение активности ТПГ2. Аликвоту супернатанта (15 мкл) инкубировали в течение 15 мин при 37°С в присутствии 1 мМ дитиотреитола, 0.4 мМ субстрата, L-триптофана (“Sigma-Aldrich”), 0.3 мМ кофактора – 6-метилтетрагидроптерина (“Sigma-Aldrich”), 0.3 мМ ингибитора декарбоксилазы – 3-гидроксибензилгидразина (“Sigma-Aldrich”) и 5 ед. каталазы (“Sigma-Aldrich”), в конечном объеме 25 мкл. Реакцию останавливали, приливая 75 мкл 0.6 М HClO4, центрифугировали в течение 20 мин при 12 700 об./мин (+4°С). Чистый супернатант разбавляли в 2 раза водой MilliQ и использовали для определения уровня синтезированного 5-HTP с помощью высокоэффективной жидкостной хроматографии на колонке Luna C18(2) (размер частиц 5 мкм, L × I.D = 75 × 4.6 мм, “Phenomenex”) и электрохимического детектора (750 мВ, DECADE II™ Electrochemical Detector; “Antec,” США) согласно [16]. Концентрации 5-HTP в пробе определяли по площади пика с помощью программы LabSolution LG/GC (“Shimadzu Corp.”) и нормировали по калибровочной кривой, полученной с использованием стандартов 50, 100 и 200 пмоль 5-HTP [16]. В контрольные пробирки добавляли те же реактивы, но не инкубировали, а немедленно приливали 75 мкл 0.6 М HClO4. Аликвоту супернатанта (10 мкл) смешивали с 90 мкл 0.1 М NaOH и определяли белок по Брэдфорду (“BioRad”) согласно протоколу производителя. Активность ТПГ2 выражали в пмолях 5-HTP, синтезированных за 1 мин в пересчете на 1 мг белка (пмоль/мг/мин).
Выделение РНК и ОТ-ПЦР. РНК выделяли из аликвоты (100 мкл) гомогената с помощью Trizol Reagent (“Ambion, Life Technologies”, США) согласно протоколу производителя. Следы геномной ДНК удаляли, используя ДНКазу, свободную от РНКазы (“Promega”, США). Целостность РНК определяли с помощью электрофореза в 0.8%-ном агарозном геле. кДНК синтезировали с помощью набора R01-250 (“Биолабмикс”, Россия) согласно протоколу производителя. Концентрацию мРНК определяли методом количественной ОТ-ПЦР с помощью наборов R-402 (“Синтол”, Россия) и специфически подобранных праймеров (табл. 1). Использовали следующие условия: денатурация 94°С, 4 мин, (денатурация 94°С, 15 с; отжиг и элонгация при температуре отжига (табл. 1), 60 с; измерение флуоресценции – 80°С, 2 с) 40 циклов (“Синтол”, Россия). Праймеры подбирали таким образом, чтобы продукты (ампликоны) не включали интроны. Это условие необходимо для использования геномной ДНК мыши в качестве внешнего стандарта. Уровень экспрессии оценивали с использованием калибровочной кривой, построенной по известным концентрациям геномной ДНК мыши и нормировали на 100 транскриптов гена Polr2a в пробе, служащей внутренним стандартом [16–18]. Такой метод позволяет измерить реальное число копий кДНК целевых генов и гена домашнего хозяйства и нормировать экспрессию целевых генов на ген домашнего хозяйства [17].
Таблица 1.
Характеристика праймеров, использованных для проведения количественной ОТ-ПЦР в реальном времени
| Ген | Праймер | Температура плавления, °С | Длина ампликона, п.н. | Эффективность амплификации |
|---|---|---|---|---|
| Tph2 | 5′-CATTCCTCGCACAATTCCAGTCG-3′ 5′-AGTCTACATCCATCCCAACTGCTG-3′ |
62 | 239 | 1.8 |
| Tph1 | 5' ACAAACTCTACCCGACCCAC-3' 5'- CAGTTGCGGGATGTTGTCTT-3' |
63 | 197 | 1.7 |
| Polr2a | 5′-GTTGTCGGGCAGCAGAATGTAG-3′ 5′-TCAATGAGACCTTCTCGTCCTCC-3′ |
63 | 188 | 1.9 |
Статистика. Результаты представляли как среднее ± ошибка среднего и анализировали с помощью однофакторного метода ANOVA. Сравнение post hoc проводили по Фишеру. Уровень значимости принят равным 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
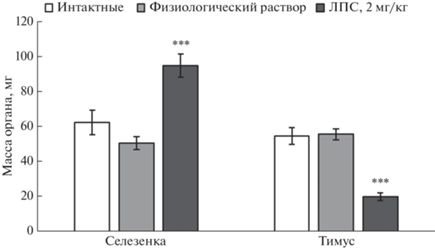
Изменение массы селезенки и тимуса через 5 суток после введения мышам физиологического раствора или ЛПС
Нами выявлены значительные различия в массе селезенки (F(2,21) = 15.5, p < 0.001) и тимуса (F(2,21) = 36.9, p < 0.001) у мышей разных групп. В группе мышей, которым вводили ЛПС (2 мг/кг), отмечено резкое увеличение массы селезенки и снижение массы тимуса через 5 сут после инъекции по сравнению с животными, которым вводили физиологический раствор (селезенка, p <0.001; тимус, p < 0.001), или интактными мышами (селезенка, p = 0.001; тимус, p <0.001) (рис. 1). При этом введение физиологического раствора не влияло на массу селезенки и тимуса, которые оставались такими же, как у интактных животных (селезенка, p = 0.18; тимус, p = 0.84) (рис. 1).
Изменения уровней 5-HT и 5-HIAA в структурах мозга мышей через 5 суток после введения физиологического раствора или ЛПС
Обнаружены значительные межгрупповые различия в уровне 5-HT в гиппокампе и среднем мозге, 5-HIAA в гипоталамусе и среднем мозге, в гиппокампе и гипоталамусе мышей (табл. 2). Однократное введение как физиологического раствора, так и ЛПС (2 мг/кг) приводило к увеличению уровня 5-HT в гиппокампе и среднем мозге, уровня 5-HIAA в среднем мозге, но к уменьшению уровня 5-HIAA в гипоталамусе (табл. 2).
Таблица 2.
Уровни 5-HT и 5-HIAA (нг/мг белка) в структурах мозга 4-недельных самцов мышей C57BL/6, интактных и через 5 суток после однократного введения физиологического раствора или липополисахарида
| Структура мозга | Интактные мыши | Физиологический раствор | ЛПС, 2 мг/кг | p |
|---|---|---|---|---|
| 5-HT | ||||
| Кора | 2.51 ± 0.22 | 3.15 ± 0.32 | 3.08 ± 0.15 | F(2,21) = 2.1, p = 0.15 |
| Гиппокамп | 2.92 ± 0.16 | 3.67 ± 0.22** | 3.14 ± 0.16# | F(2,21) = 4.48, p = 0.02 |
| Стриатум | 1.5 ± 0.1 | 2.45 ± 0.43 | 2.22 ± 0.13 | F(2,21) = 3.44, p = 0.051 |
| Гипоталамус | 9.45 ± 1.13 | 7.66 ± 0.41 | 6.91 ± 0.33 | F(2,21) = 3.3, p = 0.057 |
| Средний мозг | 3.88 ± 0.19 | 5.47 ± 0.3* | 5.63 ± 0.38*** | F(2,21) = 10.3, p <0.001 |
| 5-HIAA | ||||
| Кора | 1.02 ± 0.1 | 1.02 ± 0.13 | 1.1 ± 0.21 | F(2,21) <1 |
| Гиппокамп | 3.28 ± 0.16 | 3.18 ± 0.16 | 3.44 ± 0.38 | F(2,21) <1 |
| Стриатум | 1.38 ± 0.12 | 1.69 ± 0.21 | 1.72 ±0.19 | F(2,21) = 1.1, p = 0.34 |
| Гипоталамус | 3.45 ± 0.0.37 | 2.33 ± 0.29** | 2.52 ± 0.21* | F(2,21) = 5.77, p = 0.01 |
| Средний мозг | 2.54 ± 0.15 | 3.23 ± 0.18* | 3.7 ± 0.21*** | F(2,21) = 10.4, p <0.001 |
Изменения активности ТПГ2 в структурах мозга мышей через 5 суток после введения физиологического раствора или ЛПС
Как и ожидалось, активность ТПГ2 в коре, гиппокампе, стриатуме и гипоталамусе мышей была ниже, чем в среднем мозге. Не выявлено межгрупповых различий в активности фермента в коре (F(2,21) = 1.3, p = 0.29), гиппокампе (F(2,21) = 1.76, p = 0.2), стриатуме (F(2,21) = 1.57, p = 0.23) и среднем мозге (F(2,21) < 1). Однако введение физиологического раствора и ЛПС снижало активность ТПГ2 в гипоталамусе (F(2,21) = 8.88, p = 0.0016) (рис. 2).
Изменения уровней мРНК генов Tph1 и Tph2 в структурах мозга мышей через 5 суток после введения физиологического раствора или ЛПС
Максимальный уровень транскриптов гена Tph1 обнаружен в гиппокампе, в других структурах мозга он был в основном ниже (табл. 3). Введение физиологического раствора и ЛПС значительно снизило экспрессию гена Tph1 в коре головного мозга мышей (табл. 3).
Таблица 3.
Уровни мРНК* генов Tph1 и Tph2 в структурах мозга 4-недельных самцов мышей C57BL/6 интактных и через 5 суток после однократного введения физиологического раствора или липополисахарида
| Структура мозга | Интактные мыши | Физиологический раствор | ЛПС, 2 мг/кг | р |
|---|---|---|---|---|
| Tph1 | ||||
| Кора | 1.77 ± 0.68 | 0.18 ± 0.0.02** | 0.21 ± 0.03** | F(2,21) = 5.32, p = 0.013 |
| Гиппокамп | 3.35 ± 1.34 | 7.02 ± 2.86 | 7.14 ± 0.3.11 | F(2,21) < 1 |
| Стриатум | 0.18 ± 0.05 | 0.14 ± 0.03 | 0.44 ± 0.21 | F(2,21) = 1.6, p = 0.23 |
| Гипоталамус | 0.12 ± 0.11 | 0.06 ± 0.04 | 1.85 ± 1.77 | F(2,21) < 1 |
| Средний мозг | 0.26 ± 0.08 | 0.44 ± 0.11 | 0.3 ± 0.07 | F(2,21) = 1.1, p = 0.32 |
| Tph2 | ||||
| Кора | 9.57 ± 2.17 | 4.5 ± 0.58 | 6.2 ± 1.6 | F(2,21)= 2.63, p = 0.1 |
| Гиппокамп | 9.04 ± 2.21 | 17.6 ± 5.8 | 11.45± 3.14 | F(2,21) = 1.2, p = 0.32 |
| Стриатум | 3.88 ± 0.8 | 4.9 ± 0.0.63 | 6.29 ± 1.49 | F(2,21) = 1.34, p = 0.28 |
| Гипоталамус | 0.96 ± 0.3 | 0.79 ± 0.14 | 3.9 ± 2.9 | F(2,21) < 1 |
| Средний мозг | 63.56 ± 9.72 | 77.94 ± 6.51 | 76.84 ± 12.19 | F(2,21) < 1 |
Уровень транскриптов гена Tph2 в коре, гиппокампе, стриатуме и гипоталамусе был в несколько раз ниже, чем в среднем мозге. Ни физиологический раствор, ни ЛПС не влияли на экспрессию гена Tph2 в исследованных структурах мозга (табл. 3).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нами впервые оценены отдаленные последствия (5 суток) однократного введения ЛПС на уровень 5-HT, 5-HIAA, активность ТПГ, экспрессию генов Tph1 и Tph2 в головном мозге мышей. Мы намеренно выбрали молодых животных, поскольку они более чувствительны к стрессу и инфекциям.
Однократное введение ЛПС (2 мг/кг) приводит к активации иммунной системы, которая сохраняется по крайней мере в течение 5 суток в виде увеличения массы селезенки и снижения массы тимуса по сравнению с интактными животными и животными, которым вводили физиологический раствор.
Нами обнаружено увеличение уровня 5-HIAA и 5-HT в среднем мозге, а также снижение уровня 5-HIAA в гипоталамусе через 5 суток после введения ЛПС по сравнению с интактными животными. Важно отметить, что введение физиологического раствора вызывало изменения в уровне 5-HT и 5-HIAA в этих структурах, сходные с вызванными ЛПС. Это свидетельствует о том, что наблюдаемые изменения в уровнях 5-HT и 5-HIAA вызваны, скорее всего, отдаленными последствиями стресса, сопряженного с в/б инъекцией, чем с активацией иммунной системы. Действительно, ранее мы показали увеличение уровня 5-HIAA в мозге мышей при эмоциональном стрессе [19].
Снижение уровня 5-HIAA в гипоталамусе мышей, которым вводили физиологический раствор и ЛПС, по-видимому, вызвано снижением активности ТПГ2 и сопряженным снижением синтеза медиатора. В то же время, увеличение уровня 5-HT и 5-HIAA в среднем мозге мышей, которым вводили физиологический раствор и ЛПС, вероятно, не связано с увеличением синтеза медиатора, поскольку мы не выявили изменений активности ТПГ в данной структуре у этих мышей.
Длительные изменения в 5-HT системе в ответ на введение физиологического раствора кажутся странными. Однако до нас никто не оценивал отдаленных последствий одной инъекции физиологического раствора на 5-HT систему мозга. Можно предположить, что молодые мыши очень чувствительны к стрессу, вызванному всего одной инъекцией физиологического раствора, и его последствия сохраняются длительное время. Однако это предположение нуждается в дальнейшей проверке.
Главной целью нашего исследования было сравнение уровней транскриптов генов Tph2 и Tph1 в различных структурах головного мозга. В качестве внешнего стандарта мы использовали заданные концентрации геномной ДНК, что позволяет построить калибровочную кривую зависимости порогового цикла от исходного количества матрицы и, следовательно, определить абсолютную концентрацию транскриптов в исследуемых пробах [17, 18]. Измерение абсолютных значений концентрации транскриптов позволило нам не только оценить влияние введения физиологического раствора и ЛПС на экспрессию генов Tph1 и Tph2 в каждой структуре мозга по отдельности, но и оценить соотношение транскриптов этих генов в разных структурах.
Как и следовало ожидать, наибольшей концентрация транскриптов гена Tph2 была в среднем мозге, где локализованы тела серотониновых нейронов и транскрибируется данный ген. Мы обнаружили также небольшие, но хорошо детектируемые концентрации транскриптов гена Tph2 и в структурах, не содержащих тела 5-HT нейронов (в коре, гиппокампе, стриатуме и гипоталамусе), где теоретически этот ген не должен транскрибироваться. Мы не знаем причин присутствия мРНК гена Tph2 в коре, гиппокампе, стриатуме и гипоталамусе, однако можно предположить два гипотетических механизма появления транскриптов гена Tph2 в этих структурах: аксональный транспорт мРНК данного гена из тел 5-HT нейронов и наличие небольшого числа клеток, способных экспрессировать ген Tph2. Этот вопрос требует дальнейшего исследования.
Важно отметить, что концентрация транскриптов Tph1 во всех исследованных структурах находится примерно на одинаковом и довольно низком, практически следовом, уровне по сравнению с концентрацией транскриптов гена Tph2. Этот контраст в экспрессии генов Tph1 и Tph2 проявляется в полной мере в среднем мозге, где концентрация транскриптов гена Tph2 в несколько сотен раз больше, чем гена Tph1. Этот результат хорошо согласуется с данными других авторов [8], которые не нашли мРНК гена Tph1 [7] и белка ТПГ1 в мозге грызунов. Данные RNA-Seq показали, что в ядрах шва среднего мозга мыши уровень экспрессии генов Tph2 и Tph1 составляет 1680 и 0.8 ТРМ (число транскриптов генов Tph2 и Tph1 на миллион транскриптов) соответственно [20]. Более того, наши результаты хорошо согласуются с данными, согласно которым нокаут гена Tph1 снижает уровень 5-HT в мозге мышей всего на несколько процентов, тогда как нокаут гена Tph2 драматически снижает уровень этого биогенного амина [9]. Можно предполагать, что в мозге мыши имеется небольшое число клеток, способных экспрессировать ТПГ1. В любом случае, вклад ТПГ1 в синтез 5-HT в мозге мышей значительно ниже, чем ТПГ2.
Поскольку уровень мРНК гена Tph1 возрастал в 1.8 раза через несколько часов после стресса, было высказано предположение о возможности повышения относительной роли ТПГ1 в мозге при патологиях [12]. В нашем исследовании мы моделировали патологическое состояние, вызванное введением ЛПС, и не выявили существенных изменений в экспрессии гена Tph1 в структурах мозга. Синтез белка ТПГ1 может происходить только в телах 5-HT нейронов. Поэтому о вкладе ТПГ1 и ТПГ2 в синтез 5-HT в 5-HT нейронах можно судить по относительной экспрессии генов Tph1 и Tph2 в среднем мозге, где локализованы тела 5-HT нейронов. Поскольку экспрессия гена Tph2 в этой структуре в несколько сотен раз превышает экспрессию Tph1, вклад ТПГ2 в синтез серотонина в 5-HT нейронах во много раз превышает вклад ТПГ1. Даже стресс, который может увеличить экспрессию гена Tph1 в 1.8 раза [12], не способен изменить доминирование ТПГ2 в синтезе 5-HT.
Тем не менее, соизмеримые концентрации мРНК генов Tph1 и Tph2 найдены в мозге грызунов [10–12] и человека [13–15]. Проанализируем подробно эти результаты. В работах, выполненных на грызунах [10–12], использовали метод 2–∆∆Ct, который не позволяет определить абсолютную концентрацию транскриптов, а оценивает только степень изменения концентрации при воздействии по сравнению с животными контрольной группы, уровень транскриптов у которых принимается за 1 (или 100) [21]. Поэтому измеренная методом 2–∆∆Ct экспрессия разных генов вне зависимости от абсолютной концентрации их транскриптов всегда будет 1 (или 100), что мы и наблюдаем в работах [10–12]. Иными словами, одинаковость экспрессии генов Tph1 и Tph2 в мозге грызунов в этих работах является иллюзорной и обусловлена особенностью метода. Авторы, изучающие экспрессию генов Tph1 и Tph2 в мозге человека [13–15], использовали модифицированный протокол, позволяющий оценить концентрацию мРНК целевого гена относительно гена домашнего хозяйства. В этих работах обнаружен высокий уровень мРНК гена Tph1 в мозге человека. Поскольку анализировали посмертные образцы, то нельзя исключить, что относительно высокая экспрессия гена Tph1 может быть обусловлена изменениями в мозге, вызванными агонией. Наконец, высокий уровень экспрессии гена Tph1 в мозге может быть видовой особенностью человека. Недавно мы показали, что одинаковый уровень экспрессии генов Tph1a, Tph1b и Tph2 в мозге является видовой особенностью рыб Nothobranhius furzeri [22] и Danio rerio [16].
Таким образом, нами получены три существенных результата. Во-первых, стресс (инъекция) оставляет продолжительный след (5 cуток) на уровне метаболизма 5-HT в мозге молодых мышей. Во-вторых, наибольший уровень мРНК гена Tph2 наблюдается в среднем мозге, где расположены тела 5-HT нейронов, тогда как в коре, гиппокампе, стриатуме и гипоталамусе, где расположены их аксоны и окончания, уровень мРНК данного гена в несколько раз ниже. В-третьих, в мозге мышей в норме и при воспалении выявлены лишь следовые количества мРНК Tph1. Это свидетельствует о том, что ТПГ1, по-видимому, не играет существенной роли в синтезе 5-HT в мозге мышей как в норме, так и при патологиях.
Мышей содержали и разводили в Российском национальном центре генетических ресурсов лабораторных животных, который поддерживается бюджетными проектами № FWNR-2022-0023 и RFMEFI62117X0015.
Выполнение данной работы поддержано Российским научным фондом (грант № 21-15-00035).
Содержание и экспериментальные процедуры проведены в соответствии с правилами Совета Европейского Парламента (Директива 2010/63/EU от 22 сентября 2010 г) и одобрены Комиссией по биоэтике ИЦиГ СО РАН.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Gaspar P., Lillesaar C. (2012) Probing the diversity of serotonin neurons. Philos. Trans. R Soc. Lond. B Biol. Sci. 367, 2382–2394.
Willner P., Scheel-Krüger J., Belzung C. (2013) The neurobiology of depression and antidepressant action. Neurosci. Biobehav. Rev. 37, 2331–2371.
Hamon M., Blier P. (2013) Monoamine neurocircuitry in depression and strategies for new treatments. Prog. Neuropsychopharmacol. Biol. Psychiatry. 45, 54–63.
Miller B.R., Hen R. (2015) The current state of the neurogenic theory of depression and anxiety. Curr. Opin. Neurobiol. 30, 51–58.
Walther D.J., Peter J.U., Bashammakh S., Hörtnagl H., Voits M., Fink H., Bader M. (2003) Synthesis of serotonin by a second tryptophan hydroxylase isoform. Science. 299, 76.
Walther D.J., Bader M. (2003) A unique central tryptophan hydroxylase isoform. Biochem. Pharmacol. 66, 1673–1680.
Patel P.D., Pontrello C., Burke S. (2004) Robust and tissue-specific expression of TPH2 versus TPH1 in rat raphe and pineal gland. Biol. Psychiatry. 55, 428–433
Sakowski S.A., Geddes T.J., Thomas D.M., Levi E., Hatfield J.S., Kuhn D.M. (2006) Differential tissue distribution of tryptophan hydroxylase isoforms 1 and 2 as revealed with monospecific antibodies. Brain Res. 1085, 11–18.
Savelieva K.V., Zhao S., Pogorelov V.M., Rajan I., Yang Q., Cullinan E., Lanthorn T.H. (2008) Genetic disruption of both tryptophan hydroxylase genes dramatically reduces serotonin and affects behavior in models sensitive to antidepressants. PLoS One. 3, e3301.
Megha K., Deshmukh P.S., Ravi A.K., Tripathi A.K., Abegaonkar M.P., Banerjee B.D. (2015) Effect of low-intensity microwave radiation on monoamine neurotransmitters and their key regulating enzymes in rat brain. Cell Biochem. Biophys. 73, 93–100.
Igarashi K., Kuchiiwa T., Kuchiiwa S., Iwai H., Tomita K., Sato T. (2021) Kamishoyosan (a Japanese traditional herbal formula), which effectively reduces the aggressive biting behavior of male and female mice, and potential regulation through increase of Tph1, Tph2, and Esr2 mRNA levels. Brain Res. 1768, 147580.
Browne C.A., O’Brien F.E., Connor T.J., Dinan T.G., Cryan J.F. (2012) Differential lipopolysaccharide-induced immune alterations in the hippocampus of two mouse strains: effects of stress. Neurosci. 6, 237–248.
Zill P., Büttner A., Eisenmenger W., Möller H.J., Ackenheil M., Bondy B. (2007) Analysis of tryptophan hydroxylase I and II mRNA expression in the human brain: a post-mortem study. J. Psychiatr. Res. 41, 168–173.
Zill P., Büttner A., Eisenmenger W., Müller J., Möller H.J., Bondy B. (2009) Predominant expression of tryptophan hydroxylase 1 mRNA in the pituitary: a postmortem study in human brain. Neuroscience. 159, 1274–1282.
Sugden K., Tichopad A., Khan N., Craig I.W., D’Souza U.M. (2009) Genes within the serotonergic system are differentially expressed in human brain. BMC. Neurosci. 10, 50.
Сорокин И.Е., Евсюкова В.С., Куликов А.В. (2022) Влияние короткого светового дня на поведение и серотониновую систему головного мозга рыб вида Danio rerio. Бюлл. Эксп. Биол. Мед. 173, 279–284.
Kulikov A.V., Naumenko V.S., Voronova I.P., Tikhonova M.A., Popova N.K. (2005) Quantitative RT-PCR of 5-HT1A and 5-HT2A serotonin receptor mRNAs using genomic DNA as an standard. J. Neurosci. Meth. 141, 97–101.
Науменко В.С., Куликов А.В. (2006) Количественное определение экспрессии гена 5-НТ1А серотонинового рецептора в головном мозге. Молекуляр. биология. 40, 37–44.
Bazhenova E.Y., Bazovkina D.V., Kulikova E.A., Fursenko D.V., Khotskin N.V., Lichman D.V., Kulikov A.V. (2017) C1473G polymorphism in mouse tryptophan hydroxylase-2 gene in the regulation of the reaction to emotional stress. Neurosci. Lett. 640, 105–110.
Bonthuis P.J., Huang W.C., Stacher Hörndli C.N., Ferris E., Cheng T., Gregg C. (2015) Noncanonical genomic imprinting effects in offspring. Cell Rep. 12, 979–991.
Livak K.J., Schmittgen T.D: (2001) Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25, 402–408.
Evsiukova V.S., Kulikova E.A., Kulikov A.V. (2021) Age-related alterations in the behavior and serotonin-related gene mRNA levels in the brain of males and females of short-lived turquoise killifish (Nothobranchius furzeri). Biomolecules. 11, 1421.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология