Молекулярная биология, 2023, T. 57, № 2, стр. 307-315
Возможности интерферона лямбда как ингибитора SARS-CoV-2
Л. А. Олейник a, *, П. Г. Мадонов a, М. Б. Пыхтина a
a Научно-исследовательский институт клинической и экспериментальной лимфологии – филиал Федерального исследовательского центра Институт цитологии и генетики Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: larisaoleynik81@gmail.com
Поступила в редакцию 05.08.2022
После доработки 06.10.2022
Принята к публикации 06.10.2022
- EDN: EEPAOI
- DOI: 10.31857/S0026898423020179
Аннотация
Представлен обзор литературных данных относительно возможности применения интерферонов (ИФН) III типа против SARS-CoV-2. В работе использована база данных PubMed за период 2020‒2022 гг., а также результаты собственных исследований фармакологических субстанций на основе рекомбинантного ИФН-λ1 и его пегилированной формы. Завершенные и продолжающиеся исследования позволяют позиционировать ИНФ-λ в качестве эффективного терапевтического средства против SARS-CoV-2.
ВВЕДЕНИЕ
Интерфероны (ИФН) ‒ естественные противовирусные цитокины, необходимые для эффективной защиты в ходе раннего иммунного ответа. Вырабатываясь в ответ на вирусные инфекции, ИФН способствуют эндогенному противовирусному состоянию, индуцируя ИФН-стимулируемые гены (ISGs). ISGs снижают вирусную нагрузку, подавляя проникновение вируса в клетку, его репликацию внутри клетки и/или высвобождение из клетки [1, 2].
На сегодняшний день известно три типа ИФН: I (ИФН-α/β), II (ИФН-γ) и III (ИФН-λ). ИФН-λ ‒ преобладающий тип ИФН, продуцируемый в эпителии слизистой оболочки, играет ключевую роль в защите хозяина при вирусных инфекциях легких [3‒5]. С момента открытия ИФН-λ в 2003 году многое стало известно об этой группе цитокинов и их функциях в организме [6]. Исследование функций ИФН-λ подтвердили не только значительное сходство с противовирусной активностью ИФН I типа, реализующиеся по тем же сигнальным путям, но и отличительные особенности воздействия ИФН-λ на организм, связанные с ограниченным распределением его рецепторов. В отличие от повсеместной экспрессии рецептора ИФН I типа, присутствующего практически во всех ядерных клетках, экспрессия рецептора ИФН-λ ‒ IFNLR1 ‒ происходит преимущественно в эпителиальных клетках слизистых оболочек, служащих анатомическими барьерами организма. Такое избирательное распределение экспрессии ИФН-λ препятствует проникновению через поверхность слизистой и кожи большинства патогенов из окружающей среды [7]. ИФН-λ, в отличие от ИФН I типа, не вызывает системной воспалительной реакции, а скорее обладает тканезащитным и противовоспалительным действием [8]. Отсутствие провоспалительных эффектов в тканях легких [9] считают одним из важных преимуществ ИФН-λ перед ИФН I типа.
Таким образом, ИФН-λ обеспечивает первый рубеж защиты, который затем вместе с ИФН-α формирует противовирусный ответ организма в целом. Феномен “сторожевой молекулы” присущ именно ИФН-λ, поскольку фактическое действие ИФН-α реализуется только через 48 ч после проникновения вируса [10]]. В целом, ИФН III типа контролируют инфекцию на участках слизистого барьера, в то время как ИФН I типа важны для широкого системного инфекционного контроля.
ВОЗМОЖНЫЕ ПУТИ УКЛОНЕНИЯ SARS-CoV-2 ОТ ПРОТИВОВИРУСНОГО ДЕЙСТВИЯ
Коронавирус-2, вызывающий тяжелый острый респираторный синдром (SARS-CoV-2), стал серьезной проблемой для здравоохранения во всем мире. Для прекращения пандемии вызванного им заболевания, COVID-19, а также его лечения необходимы новые тактические и стратегические подходы.
SARS-CoV-2 высокочувствителен к ингибирующему действию ИФН, в то же время к особенностям этого вируса относится способность обходить врожденный иммунный ответ. В настоящее время известно несколько стратегий уклонения SARS-CoV-2 от иммунной системы организма [11]. Одна из них ‒ экранирование вирусной двухцепочечной РНК (дцРНК) SARS-CoV-2 в двумембранных везикулах, защищающих дцРНК от узнавания паттернраспознающим рецептором (PRR, pattern recognition receptor) [12]. Другая стратегия ‒ ингибирование сигнальных путей, обеспечивающих продукцию и действие ИФН. В нескольких исследованиях было показано, что продукцию ИФН-β ингибирует ряд белков SARS-CoV-2: NSP1, NSP3, NSP5, NSP12, NSP13, NSP14, NSP15, ORF3a, ORF3b, ORF6, ORF7a, ORF7b, ORF8, ORF9b, N и M [13‒15]. Показано, что эти белки снижают опосредованную RIG-I (retinoic acid-inducible gene I) активность промотора гена ИФН-β (IFNB1), что позволяет предположить, что они могут подавлять опосредованную RLR (RIG-I-like receptors) передачу сигналов [13, 16, 17]. H. Xia и соавт. [17] сравнили ингибирующую активность коронавируса ближневосточного респираторного синдрома (MERS-CoV), коронавируса-1 тяжелого острого респираторного (SARS-CoV-1) и SARS-CoV-2 в отношении продукции и передачи сигнала ИФН I типа и выявили, что белки NSP1 и NSP6 SARS-CoV-2 подавляют передачу сигналов ИФН I типа более эффективно, чем два других коронавируса. Одной из стратегий уклонения может быть блокирование сигналинга ИФН через подавление фосфорилирования транскрипционного фактора STAT1 [18]. Miorin с соавт. [19] показали, что SARS-CoV-2 эффективно блокирует ядерную транслокацию STAT1 и STAT2, ингибируя тем самым транскрипцию ISGs. D. Shin с соавт. [20] обнаружили, что уклонение SARS-CoV-2 от действия ИФН может быть обусловлено активностью папаинподобной протеазы (PLpro), которая расщепляет убиквитинподобный модификатор ИФН-стимулируемого гена-15 (ISG15) – белка с высокой противовирусной активностью.
Коронавирусная инфекция подавляет выработку эндогенного ИФН и во многом определяет тяжесть клинических проявлений заболевания [21‒23]. Scagnolari и др. [24] выявили, что у пациентов с тяжелым течением COVID-19, которым требовалась механическая вентиляция легких, снижена экспрессия мРНК ИФН-λ(1‒3), ИФН I типа и ISGs. Кроме того, сообщалось, что тяжелое течение COVID-19 может быть обусловлено наличием нейтрализующих аутоантител к ИФН [25, 26]. В то же время у некоторых пациентов с тяжелыми формами COVID-19 были повышены уровни ИФН-α, что может быть объяснено снижением чувствительности вируса к ИФН [27].
Представляет интерес также роль полиморфизма генов ИФН в ответе на вирусную инфекцию и их возможное влияние на тяжесть клинических проявлений COVID-19. Известно, что некоторые заболевания могут быть вызваны генетическими вариациями в компонентах иммунной системы, например в опосредованных ИФН сигнальных путях. В 2009 г. в результате трех независимых полногеномных ассоциативных исследований было выявлено, что однонуклеотидный полиморфизм rs12979860 в промоторной области гена ИФН-λ3 (IL28B) в значительной степени ассоциирован со спонтанным клиренсом вируса гепатита C и устойчивым вирусологическим ответом на терапию хронического гепатита С [28‒30]. Позднее выявили, что индивидуальные вариации гена IL28B определяют различия и в иммунном ответе на острые респираторные инфекции и на инфекцию SARS-CoV-2. Гомозиготные варианты генов, кодирующих ИФН-λ3/4, могут коррелировать со снижением клиренса вируса у детей, больных острыми респираторными инфекциями [31]. J. Saponi-Cortes и др. [32] выявили связь полиморфизма rs12979860 гена ИФН-λ4 (IFNL4) с симптоматической инфекцией COVID-19. В сравнении с контрольной группой, у пациентов с COVID-19 был сверхэкспрессирован T-аллель rs12979860, который может быть фактором риска заражения и тяжелого течения COVID-19. Также обнаружено, что полиморфизмы: C/T rs1297860 гена IL28B и TT/ΔG rs368234815 гена IFNL4 ‒ могут влиять на способность хозяина модулировать инфекцию SARS-CoV-2 без явного влияния на исход заболевания [33]. P. Rahimi с соавт. [34] продемонстрировали, что пациенты с “неблагоприятными” SNP в гене IL28B и IFNL4 подвержены более тяжелому течению COVID-19 по сравнению с пациентами “благоприятных” генотипов. Взаимосвязь тяжести течения COVID-19 с определенными аллельными вариантами генов ИФН имеет важное клиническое значение и может использоваться для прогнозирования и оптимизации индивидуальных схем противовирусной терапии.
ИФН-λ КАК ИНГИБИТОР SARS-CoV-2
При вирусных заболеваниях верхних и нижних дыхательных путей первой линией защиты служит врожденная иммунная система респираторного эпителия, которая продуцирует ИФН-λ (ИФН-λ1, -λ2, -λ3 и -λ4), обеспечивающие быстрый иммунный ответ на респираторные вирусы [35].
В исследованиях S. Davidson и др. [9] и J. Fox с соавт. [36] показано, что первичные респираторные эпителиальные клетки трахеи мыши и линии эпителиальных клеток легких мыши реагируют как на ИФН I, так и III типа индукцией антивирусных генов. Несмотря на то, что эти клетки отвечают на оба типа цитоконов, они преимущественно индуцируют ИФН III типа в ответ на вирус гриппа А, респираторно-синцитиальный вирус, SARS-CoV-2 и другие [37, 38]. Появившиеся в последние десятилетия новые штаммы коронавирусов ассоциированы с тяжелой инфекцией верхних и нижних дыхательных путей. Учитывая это, Beucher G. с соавт. [39] реконструировали первичный бронхиальный эпителий, полученный от взрослых и детских доноров, чтобы проследить динамику распространения SARS-CoV-2. Анализируя течение инфекции с помощью методов визуализации и ОТ-ПЦР в режиме реального времени, исследователи отметили ограничение репликации и распространение вируса в некоторых образцах. Этот фенотип чаще встречался в эпителии детей, чем взрослых, и коррелировал с ускоренным высвобождением ИФН III типа, в то время как блокирование экспрессии гена ИФН III типа с использованием системы CRISPR/Cas9 приводило к значительному увеличению инфицированных SARS-CoV-2 клеток. Эти данные свидетельствуют о важной роли ИФН-λ в противовирусной защите дыхательных путей. Что касается ИНФ I типа (α и β), они не были обнаружены ни в супернатанте, ни при анализе транскриптома.
В настоящее время существует ряд доказательств того, что ИФН-λ обладает противовирусной активностью в отношении SARS-CoV-2 in vitro и in vivo. Эти наблюдения подчеркивают важную роль ИФН-λ в борьбе с инфекцией SARS-CoV-2 и его клиническими последствиями. Способность ИФН-λ активировать более узкий набор генов по сравнению с ИФН I типа в ограниченной группе клеток-мишеней, экспрессирующих IFNLR1, и отсутствие системного воспалительного ответа позволяют рассматривать этот тип ИФН перспективным терапевтическим противовирусным агентом. Решающим моментом интерферонотерапии считается время начала лечения. Недавно в ретроспективном исследовании 446 пациентов с COVID-19 показано, что применение ИФН-α на поздней стадии заболевания, когда вирусом инфицировано много тканей и органов, не дает должного терапевтического эффекта, в то время как ранняя интерферонотерапия благоприятно влияет на исход заболевания и выздоровление [40].
В работе U. Felgenhauer и др. [41] продемонстрировано противовирусное действие ИФН I (ИФН-α) и III (ИФН-λ) типов относительно SARS-CoV-2. Исследователи использовали две линии эпителиальных клеток млекопитающих и обнаружили, что оба цитокина дозозависимо ингибировали SARS-CoV-2. На основании полученных результатов они пришли к заключению, что SARS-CoV-2 чувствителен к экзогенному ИФН [41]. А. Vanderheiden и др. [42] показали, что обработка культуры клеток эпителия дыхательных путей человека ИФН I или III типа за 24 ч до заражения приводила к снижению уровня вирусной РНК в три раза, а репликация вируса уменьшалась на 90%. Обработка зараженной клеточной культуры ИФН также снижала вирусную нагрузку: значимый эффект проявлялся к третьим суткам эксперимента. В вышеупомянутом исследовании G. Beucher с соавт. [39] продемонстрировано, что обработка эпителия взрослых пациентов экзогенным ИФН III типа ограничивала инфекцию SARS-CoV-2. В проведенном S. Sohn с соавт. [43] исследовании ИФН-λ1 значительно ограничивал продукцию SARS-CoV-2 в культуре первичных бронхиальных эпителиальных клеток человека. Предварительная обработка клеток эпителия легких человека ИФН I типа полностью блокировала продукцию вируса, а обработка ИФН-λ1 зараженных клеток ингибировала репликацию вируса более чем на порядок. В экспериментах с трансгенными мышами, экспрессирующими ангиотензинконвертирующий фермент-2 человека (АСЕ2), авторы показали, что одна доза интраназально введенного ИФН-λ1 приводила к снижению тяжести заболевания и смертности животных при заражении SARS-CoV-2. R. Dijkman с соавт. [44] провели поиск эффективной схемы лечения ближневосточного респираторного синдрома (MERS), вызванного соответствующим коронавирусом, препаратами ИФН-λ1. Они использовали первичную культуру клеток дыхательного эпителия человека (hAECs) и продемонстрировали, что однократная доза ИФН-α и ИФН-λ в равной степени индуцировала экспрессию ISGs, в то время как двукратное увеличение дозировки препаратов ИФН вызывало повышение экспрессии ISGs лишь на культуре, обработанной ИФН-λ. В экспериментах на мышах также показана эффективность применения двухдозового режима ИФН-λ, а комбинация профилактических и отсроченных терапевтических режимов в полной мере защищала мышей от инфекции MERS-CoV.
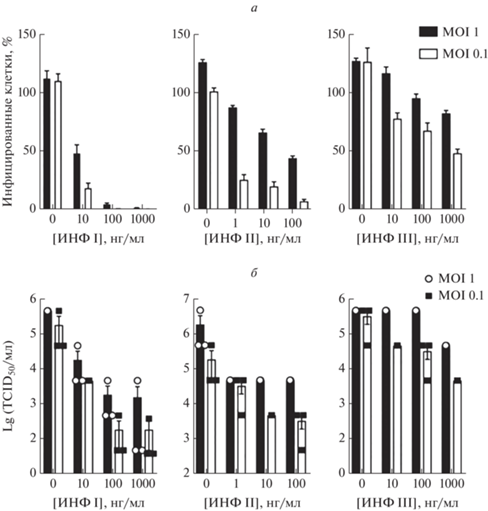
L. Miorin и др. [19] оценили чувствительность SARS-CoV-2 к ИФН. Авторы инкубировали клетки Vero E6 с различными концентрациями ИФН I, II и III типов, после чего проводили заражение культуры вирусом. Оказалось, что предынкубация клеток Vero E6 с ИФН I типа резко снижала процент инфицированных клеток; наблюдали снижение и в случае предынкубации с ИФН II, в то время как для ИФН III типа регистрировали лишь незначительный ингибиторный эффект (рис. 1 ). Учитывая выраженный противовирусный эффект ИФН III типа относительно SARS-CoV-2, ранее продемонстрированный в экспериментах in vitro и in vivo [45, 46], L. Miorin и соавт. предположили, что полученные ими результаты обусловлены низкой экспрессией рецепторов ИФН III типа клетками Vero E6.
Рис. 1.
Влияние интерферонов I, II и III типов на инфицированные SARS-CoV-2 клетки Vero E6. а ‒ Процент инфицированных клеток Vero E6, рассчитанный как соотношение клеток, позитивных на вирусный белок нуклеопротеин (NP), к общему числу клеток (данные представлены как среднее значение ± стандартное отклонение, n = 3). б ‒ Анализ титров вируса, выраженных как TCID50,в супернатантах клеток Vero E6 (данные представлены как среднее ± SEM, n = 3) [17, Creative Commons Attribution License 4.0 (CC BY)].
Z. Chong с соавт. [47] в экспериментах на трех стандартных линиях мышей и линии мышей, трансгенной по ACE2 человека, показали, что интраназальное введение IFN-λ обеспечивает до- и постэкспозиционную защиту от заражения несколькими штаммами SARS-CoV-2, не вызывая обширного воспаления.
РАЗРАБОТКА ПРЕПАРАТОВ НА ОСНОВЕ ИФН-λ ДЛЯ ЛЕЧЕНИЯ COVID-19
Вышеприведенные данные свидетельствуют о высокой перспективности создания лекарственных средств на основе рекомбинантного ИФН-λ1 человека для лечения COVID-19. Однако, несмотря на острую потребность в подобных противовирусных препаратах, в настоящее время на фармацевтическом рынке их нет. Уже показано, что лекарственные средства на основе рекомбинантных белков имеют хороший фармакокинетический профиль и устойчивы к ферментативным системам крови.
Одна из наиболее распространенных стратегий повышения стабильности белковых препаратов и увеличения времени их полувыведения из организма ‒ химическая модификация целевых белков и пептидов полиэтиленгликолем (ПЭГ) – пегилирование [48]. В настоящее время на фармацевтическом рынке циркулирует много таких препаратов (Pegasys, PEG-Intron, Neulasta, Esperoct, Plegridy и др.) и множество подобных соединений находится на этапе разработки и доклинических исследований. Компанией “ZymoGenetics” и “Bristol-Myers Squibb” (США) разработан препарат пегилированного ИФН-λ, предназначенный для парентерального введения, для профилактики вирусных гепатитов. Для этого соединения зарегистрирован более высокий профиль безопасности в сравнении с пегилированным ИФН-α [49]. Но на настоящий момент лекарственного препарата на основе ПЭГ-ИФН-λ на фармацевтическом рынке нет.
Химическая иммобилизация терапевтических белков в ряде случаев может быть успешно заменена технологией электронно-лучевой иммобилизации (ЭЛИ) [50]. Эта технология основана на применении направленного потока ускоренных электронов с широким диапазоном энергии (1‒5 МэВ) и доз от 0.5 до 6 Мрад, а также γ-излучения и иммобилизации биологически активных молекул на низкомолекулярных водорастворимых носителях. Применение такой технологии позволяет получать препараты белков, обладающие повышенной биодоступностью, сниженной токсичностью и сохраненной биологической активностью.
Мы тоже использовали технологию ЭЛИ при разработке пегилированной формы ИФН-λ1 в целях получения активной фармацевтической субстанции для ингибирования SARS-CoV-2. Лекарственный препарат на основе ПЭГ-ИФН-λ1 создан на базе Института цитологии и генетики СО РАН (Новосибирск, Россия) и НИИ фармакологии и регенеративной медицины им. Е.Д. Гольдберга (Томск, Россия) в содружестве c фармацевтической компании “Сибирский центр фармакологии и биотехнологии” (Россия). Пегилирование проводили низкомолекулярным ПЭГ по технологии ЭЛИ [51]. Цитотоксичность полученного препарата ПЭГ-ИФН-λ1, проведенная на культуре клеток Vero E6, проявлялась лишь в максимальной из использованных концентраций ‒ 108 мкг/мл, в то время как в три раза меньшая концентрация уже не оказывала достоверного повреждающего действия. При исследовании противовирусной активности обеих форм ИФН-λ1 в отношении SARS-CoV-2 в клетках Vero E6 обнаружили, что концентрация 50%-ного ингибирования (IC50) для ПЭГ-ИФН-λ1 составила 25.0 ± ± 6.5 нг/мл, в то время как для рекомбинантного ИФН-λ1 этот показатель составлял 7.3 ± 3.1 нг/мл (p < 0.05, тест Манна‒Уитни) (табл. 1).
Таблица 1.
Ингибирование репликации SARS-CoV-2 в клетках Vero E6, предынкубированных с ИФН-λ1 или ПЭГ-ИФН-λ1а
| [ИФН-λ1], нг/мл | Сохранность монослоя, OD540 | [ПЭГ-ИФН-λ1], нг/мл | Сохранность монослоя, OD540 |
|---|---|---|---|
| К‒b | 1.25 ± 0.25c | К‒ | 1.20 ± 0.23c |
| 42 000.00 | 1.15 ± 0.20c | 108 000.00 | 0.30 ± 0.11d |
| 14 000.00 | 1.20 ± 0.20c | 36 000.00 | 1.15 ± 0.21c |
| 4667.00 | 1.18 ± 0.15c | 12 000.00 | 1.17 ± 0.21c |
| 1555.00 | 1.13 ± 0.15c | 4000.00 | 1.15 ± 0.18e |
| 518.00 | 1.19 ± 0.17c | 1333.00 | 1.05 ± 0.21f |
| 173.00 | 1.16 ± 0.18c | 444.00 | 0.95±0.19f |
| 57.60 | 1.12 ± 0.15c | 148.00 | 0.91 ± 0.20f |
| 19.20 | 1.10 ± 0.14e | 49.40 | 0.85 ± 0.18f |
| 6.40 | 0.50 ± 0.11g | 16.50 | 0.51 ± 0.13h |
| 2.13 | 0.18 ± 0.10i | 5.50 | 0.23 ± 0.08h |
| 0.71 | 0.21 ± 0.11i | 1.82 | 0.20 ± 0.07i |
| 0.23 | 0.18 ± 0.10i | 0.61 | 0.23 ± 0.08i |
| К+j | 0.14 ± 0.09i | К+ | 0.15 ± 0.10i |
а В таблице приведены данные из работы [52]. Учет результатов проводили микроскопией (по наличию вирусспецифического цитопатогенного действия) и с использованием теста метаболической активности клеток (МТТ-тест). Жирным шрифтом выделены статистические значимые результаты (p < 0.05). bОтрицательный контроль ‒ клетки Vero E6, не инфицированные SARS-СoV-2. cПолная сохранность монослоя Vero E6. dПолная гибель монослоя в результате цитотоксического действия максимальной дозировки ПЭГ-ИФН-λ1. eЕдиничные фокусы вирусспецифического цитопатического действия. f20‒45% вирусспецифического цитопатического действия. g40‒60% вирусспецифического цитопатического действия. h50‒85% вирусспецифического цитопатического действия. iПолная гибель монослоя Vero E6. jПоложительный контроль ‒ клетки Vero E6, инфицированные SARS-СoV-2, но не обработанные ИФН-λ1; показания принимали за 100%.
Таким образом, ингибирующая активность ПЭГ-ИФН-λ1 на репликацию SARS-CoV-2 в клетках Vero E6 оказалась в 3 раза ниже, чем для непегилированной формы ИФН-λ1. Известно, что модификации белковых молекул часто приводят к снижению их удельной активности за счет возрастающей стереоспецифической блокады, затрудняющей связывание с рецепторами [53, 54]. В то же время существенное повышение стабильности и увеличение времени циркуляции модифицированных белков зачастую компенсируют их сниженную биологическую активность.
В настоящее время проводятся исследования пегилированной формы ИФН-λ в качестве лекарственного средства против COVID-19. K. Dinnon с соавт. [55] на мышиной модели продемонстрировали, что ПЭГ-ИФН-λ1a человека существенно тормозит репликацию SARS-CoV-2 в эпителиальных клетках, а профилактическое или терапевтическое введение препарата значительно снижает вирусную нагрузку в тканях легких.
В исследовании J. Feld и др. [56] описано преимущество подкожного введения ПЭГ-ИФН-λ при лечении COVID-19 легкой и средней степени тяжести в течение 7 суток после появления симптомов или первого положительного теста при отсутствии симптомов. В то же время в другом рандомизированном плацебо-контролируемом исследовании на 120 пациентах с COVID-19 легкой и средней степени тяжести подкожные инъекции ПЭГ-ИФН-λ1 в течении 72 ч после постановки диагноза не снижали вирусовыделение и не улучшали самочувствие больных [57]. Неоднозначность результатов клинических исследований подчеркивает необходимость дальнейшего изучения возможности применения ПЭГ-ИФН-λ для профилактики и лечения COVID-19.
ЗАКЛЮЧЕНИЕ
К настоящему моменту закончен этап фундаментального, академического понимания роли ИФН-λ в отношении его противовирусной активности. Вполне обоснованно выглядит концепция, что ИФН-λ выполняет роль сторожевой молекулы эпителиальных барьеров и вносит ощутимый вклад в экстренную противовирусную защиту. По нашему мнению, сейчас наступает так называемый “этап внедрения” этой концепции. Очевидно, что повышение противовирусной защиты будет более эффективным при применении экзогенных ИФН, а не их индукторов. В условиях высоких рисков вирусных пандемий возникает очевидная потребность в разработке и производстве лекарственных препаратов на основе ИФН-λ. Принимая во внимание опыт использования в медицине ИФН I и II типов, можно утверждать, что наиболее перспективными будут модифицированные формы ИФН-λ ‒ например, их пегилирование по электронно-лучевой или химической технологии в зависимости от требований по оптимальной фармакокинетике лекарственного препарата.
Написание настоящего обзора не потребовало специального финансирования.
Статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Schneider W.M., Chevillotte M.D., Rice C.M. (2014) Interferon-stimulated genes: a complex web of host defenses. Annu. Rev. Immunol. 32, 513–545.
Totura A.L., Baric R.S. (2012) SARS coronavirus pathogenesis: host innate immune responses and viral antagonism of interferon. Curr. Opin. Virol. 2(3), 264–275.
Andreakos E., Salagianni M., Galani I.E., Koltsida O. (2017) Interferon-lambdas: front-line guardians of immunity and homeostasis in the respiratory tract. Front. Immunol. 8, 1232.
Dellgren C., Gad H.H., Hamming O.J., Melchjorsen J., Hartmann R. (2009) Human interferon-λ3 is a potent member of the type III interferon family. Genes Immun. 10(2), 125–131.
Galani I.E., Triantafyllia V., Eleminiadou E.E., Koltsida O., Stavropoulos A., Manioudaki M., Thanos D., Doyle S.E., Kotenko S.V., Thanopoulou K., Andreakos E. (2017) Interferon-λ mediates nonredundant front-line antiviral protection against influenza virus infection without compromising host fitness. Immunity. 46(5), 875–890.e6.
Donnelly R.P., Kotenko S.V. (2010) Interferon-lambda: a new addition to an old family. J. Interferon Cytokine Res. 30(8), 555–564. https://doi.org/10.1089/jir.2010.0078
Mordstein M., Neugebauer E., Ditt V., Jessen B., Rieger T., Falcone V., Sorgeloos F., Ehl S., Mayer D., Kochs G., Schwemmle M., Günther S., Drosten C., Michiels T., Staeheli P. (2010) Lambda interferon renders epithelial cells of the respiratory and gastrointestinal tracts resistant to viral infections. J. Virol. 84(11), 5670–5677.
Ye L., Schnepf D., Staeheli P. (2019) Interferon-λ orchestrates innate and adaptive mucosal immune responses. Nat. Rev. Immunol. 19(10), 614–625.
Davidson S., McCabe T.M., Crotta S., Gad H.H., Hessel E.M., Beinke S., Hartmann R., Wack A. (2016) IFNλ is a potent anti-influenza therapeutic without the inflammatory side effects of IFNα treatment. EMBO Mol. Med. 8(9), 1099–1112.
Jewell N.A., Cline T., Mertz S.E., Smirnov S.V., Flaño E., Schindler C., Grieves J.L., Durbin R.K., Kotenko S.V., Durbin J.E. (2010) Lambda interferon is the predominant interferon induced by influenza A virus infection in vivo. J. Virol. 84(21), 11515–11522. https://doi.org/10.1128/JVI.01703-09
Znaidia M., Demeret C., van der Werf S., Komarova A.V. (2022) Characterization of SARS-CoV-2 evasion: interferon pathway and therapeutic options. Viruses. 14(6), 1247.
Kumar S., Nyodu R., Maurya V.K., Saxena S.K. (2020) Host immune response and immunobiology of human SARS-CoV-2 infection. In: Coronavirus Disease 2019 (COVID-19). Ed. S. Saxena. Medical Virology: From Pathogenesis to Disease Control. Springer, Singapore. 43–53. https://doi.org/10.1007/978-981-15-4814-7_5
Yuen C.K., Lam J.Y., Wong W.M., Mak L.F., Wang X., Chu H., Cai J.P., Jin D.Y., To K.K., Chan J.F., Yuen K.Y., Kok K.H. (2020) SARS-CoV-2 Nsp13, Nsp14, Nsp15 and Orf6 function as potent interferon antagonists. Emerg. Microbes Infect. 9(1), 1418–1428.
Lei X., Dong X., Ma R., Wang W., Xiao X., Tian Z., Wang C., Wang Y., Li L., Ren L., Guo F., Zhao Z., Zhou Z., Xiang Z., Wang J. (2020) Activation and evasion of type I interferon responses by SARS-CoV-2. Nat. Commun. 11(1), 3810.
Shemesh M., Aktepe T.E., Deerain J.M., McAuley J.L., Audsley M.D., David C.T., Purcell D.F.J., Urin V., Hartmann R., Moseley G.W., Mackenzie J.M., Schreiber G., Harari D. (2021) SARS-CoV-2 suppresses IFNβ production mediated by NSP1, 5, 6, 15, ORF6 and ORF7b but does not suppress the effects of added interferon. PLoS Pathog. 17(8), e1009800.
Kouwaki T., Nishimura T., Wang G., Oshiumi H. (2021) RIG-I-like receptor-mediated recognition of viral genomic RNA of severe acute respiratory syndrome coronavirus-2 and viral escape from the host innate immune responses. Front. Immunol. 12, 700926.
Xia H., Cao Z., Xie X., Zhang X., Chen J.Y., Wang H., Menachery V.D., Rajsbaum R., Shi P.Y. (2020) Evasion of type I interferon by SARS-CoV-2. Cell Rep. 33(1), 108234.
Lokugamage K.G., Hage A., de Vries M., Valero-Jimenez A.M., Schindewolf C., Dittmann M., Rajsbaum R., Menachery V.D. (2020) Type I interferon susceptibility distinguishes SARS-CoV-2 from SARS-CoV. J. Virol. 94(23), e01410-20.
Miorin L., Kehrer T., Sanchez-Aparicio M.T., Zhang K., Cohen P., Patel R.S., Cupic A., Makio T., Mei M., Moreno E., Danziger O., White K.M., Rathnasinghe R., Uccellini M., Gao S., Aydillo T., Mena I., Yin X., Martin-Sancho L., Krogan N.J., Chanda S.K., Schotsaert M., Wozniak R.W., Ren Y., Rosenberg B.R., Fontoura B.M.A., Garcia-Sastre A. (2020) SARS-CoV-2 Orf6 hijacks Nup98 to block STAT nuclear import and antagonize interferon signaling. Proc. Natl. Acad. Sci. USA. 117(45), 28344–28354.
Shin D., Mukherjee R., Grewe D., Bojkova D., Baek K., Bhattacharya A., Schulz L., Widera M., Mehdipour A.R., Tascher G., Geurink P.P., Wilhelm A., van der Heden van Noort G.J., Ovaa H., Müller S., Knobeloch K.P., Rajalingam K., Schulman B.A., Cinatl J., Hummer G., Ciesek S., Dikic I. (2020) Papain-like protease regulates SARS-CoV-2 viral spread and innate immunity. Nature. 587(7835), 657‒662.
Hadjadj J., Yatim N., Barnabei L., Corneau A., Boussier J., Smith N., Pere H., Charbit B., Bondet V., Chenevier-Gobeaux C., Breillat P., Carlier N., Gauzit R., Morbieu C., Pene F., Marin N., Roche N., Szwebel T.A., Merkling S.H., Treluyer J.M., Veyer D., Mouthon L., Blanc C., Tharaux P.L., Rozenberg F., Fischer A., Duffy D., Rieux-Laucat F., Kerneis S., Terrier B. (2020) Impaired type I interferon activity and inflammatory responses in severe COVID-19 patients. Sci-ence. 369(6504), 718‒724.
Blanco-Melo D., Nilsson-Payant B.E., Liu W.C., Uhl S., Hoagland D., Moller R., Jordan T.X., Oishi K., Panis M., Sachs D., Wang T.T., Schwartz R.E., Lim J.K., Albrecht R.A., tenOever B.R. (2020) Imbalanced host response to SARS-CoV2 drives development of COVID-19. Cell. 181(5), 1036–1045.e9.
Schultze J.L., Aschenbrenner A.C. (2021) COVID-19 and the human innate immune system. Cell. 184(7), 1671–1692.
Scagnolari C., Pierangeli A., Frasca F., Bitossi C., Viscido A., Oliveto G., Scordio M., Mazzuti L., Di Carlo D., Gentile M., Solimini A., Ceccarelli G., Pugliese F., Mastroianni C.M., d’Ettorre G., Turriziani O., Antonelli G. (2021) Differential induction of type I and III interferon genes in the upper respiratory tract of patients with coronavirus disease 2019 (COVID-19). Virus Res. 295, 198283.
Bastard P., Orlova E., Sozaeva L., Levy R., James A., Schmitt M.M., Ochoa S., Kareva M., Rodina Y., Gervais A., Le Voyer T., Rosain J., Philippot Q., Neehus A.L., Shaw E., Migaud M., Bizien L., Ekwall O., Berg S., Beccuti G., Ghizzoni L., Thiriez G., Pavot A., Goujard C., Fremond M.L., Carter E., Rothenbuhler A., Linglart A., Mignot B., Comte A., Cheikh N., Hermine O., Breivik L., Husebye E.S., Humbert S., Rohrlich P., Coaquette A., Vuoto F., Faure K., Mahlaoui N., Kotnik P., Battelino T., Trebušak Podkrajšek K., Kisand K., Ferré E.M.N., DiMaggio T., Rosen L.B., Burbelo P.D., McIntyre M., Kann N.Y., Shcherbina A., Pavlova M., Kolodkina A., Holland S.M., Zhang S.Y., Crow Y.J., Notarangelo L.D., Su H.C., Abel L., Anderson M.S., Jouanguy E., Neven B., Puel A., Casanova J.L., Lionakis M.S. (2021) Preexisting autoantibodies to type I IFNs underlie critical COVID-19 pneumonia in patients with APS-1. J. Exp. Med. 218(7), e20210554.
Bastard P., Rosen L.B., Zhang Q., Michailidis E., Hoffmann H.H., Zhang Y., Dorgham K., Philippot Q., Rosain J., Béziat V., Manry J., Shaw E., Haljasmägi L., Peterson P., Lorenzo L., Bizien L., Trouillet-Assant S., Dobbs K., de Jesus A.A., Belot A., Kallaste A., Catherinot E., Tandjaoui-Lambiotte Y., Le Pen J., Kerner G., Bigio B., Seeleuthner Y., Yang R., Bolze A., Spaan A.N., Delmonte O.M., Abers M.S., Aiuti A., Casari G., Lampasona V., Piemonti L., Ciceri F., Bilguvar K., Lifton R.P., Vasse M., Smadja D.M., Migaud M., Hadjadj J., Terrier B., Duffy D., Quintana-Murci L., van de Beek D., Roussel L., Vinh D.C., Tangye S.G., Haerynck F., Dalmau D., Martinez-Picado J., Brodin P., Nussenzweig M.C., Boisson-Dupuis S., Rodríguez-Gallego C., Vogt G., Mogensen T.H., Oler A.J., Gu J., Burbelo P.D., Cohen J.I., Biondi A., Bettini L.R., D’Angio M., Bonfanti P., Rossignol P., Mayaux J., Rieux-Laucat F., Husebye E.S., Fusco F., Ursini M.V., Imberti L., Sottini A., Paghera S., Quiros-Roldan E., Rossi C., Castagnoli R., Montagna D., Licari A., Marseglia G.L., Duval X., Ghosn J., Tsang J.S., Goldbach-Mansky R., Kisand K., Lionakis M.S., Puel A., Zhang S.Y., Holland S.M., Gorochov G., Jouanguy E., Rice C.M., Cobat A., Notarangelo L.D., Abel L., Su H.C., Casanova J.L. (2020) Autoantibodies against type I IFNs in patients with life-threatening COVID-19. Science. 370(6515), eabd4585.
Lucas C., Wong P., Klein J., Castro T.B.R., Silva J., Sundaram M., Ellingson M.K., Mao T., Oh J.E., Israelow B., Takahashi T., Tokuyama M., Lu P., Venkataraman A., Park A., Mohanty S., Wang H., Wyllie A.L., Vogels C.B.F., Earnest R., Lapidus S., Ott I.M., Moore A.J., Muenker M.C., Fournier J.B., Campbell M., Odio C.D., Casanovas-Massana A., Herbst R., Shaw A.C., Medzhitov R., Schulz W.L., Grubaugh N.D., Dela Cruz C., Farhadian S., Ko A.I., Omer S.B., Iwasaki A. (2020) Longitudinal analyses reveal immunological misfiring in severe COVID-19. Nature. 584(7821), 463–469.
Ge D., Fellay J., Thompson A.J., Simon J.S., Shianna K.V., Urban T.J., Heinzen E.L., Qiu P., Bertelsen A.H., Muir A.J., Sulkowski M., McHutchison J.G., Goldstein D.B. (2009) Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance. Nature. 461(7262), 399–401.
Suppiah V., Moldovan M., Ahlenstiel G., Berg T., Weltman M., Abate M.L., Bassendine M., Spengler U., Dore G.J., Powell E., Riordan S., Sheridan D., Smedile A., Fragomeli V., Muller T., Bahlo M., Stewart G.J., Booth D.R., George J. (2009) IL28B is associated with response to chronic hepatitis C interferon-α and ribavirin therapy. Nat. Genet. 41(10), 1100–1104.
Tanaka Y., Nishida N., Sugiyama M., Kurosaki M., Matsuura K., Sakamoto N., Nakagawa M., Korenaga M., Hino K., Hige S., Ito Y., Mita E., Tanaka E., Mochida S., Murawaki Y., Honda M., Sakai A., Hiasa Y., Nishiguchi S., Koike A., Sakaida I., Imamura M., Ito K., Yano K., Masaki N., Sugauchi F., Izumi N., Tokunaga K., Mizokami M. (2009) Genome-wide association of IL28B with response to pegylated interferon-α and ribavirin therapy for chronic hepatitis C. Nat. Genet. 41(10), 1105–1109.
Rugwizangoga B., Andersson M.E., Kabayiza J.C., Nilsson M.S., Ármannsdóttir B., Aurelius J., Nilsson S., Hellstrand K., Lindh M., Martner A. (2019) IFNL4 genotypes predict clearance of RNA viruses in Rwandan children with upper respiratory tract infections. Front. Cell Infect. Microbiol. 9, 340.
Saponi-Cortes J.M.R., Rivas M.D., Calle-Alonso F., Sanchez J.F., Costo A., Martin C., Zamorano J. (2021) IFNL4 genetic variant can predispose to COVID-19. Sci. Rep. 11(1), 21185.
Amodio E., Pipitone R.M., Grimaudo S., Immordino P., Maida C.M., Prestileo T., Restivo V., Tramuto F., Vitale F., Craxì A., Casuccio A. (2020) SARS-CoV-2 viral load, IFNλ polymorphisms and the course of COVID-19: an observational study. J. Clin. Med. 9(10), 3315.
Rahimi P., Tarharoudi R., Rahimpour A., Mosayebi Amroabadi J., Ahmadi I., Anvari E., Siadat S.D., Aghasadeghi M., Fateh A. (2021) The association between interferon lambda 3 and 4 gene single-nucleotide polymorphisms and the recovery of COVID-19 patients. Virol. J. 18(1), 221.
Kim H.J., Jo A., Jeon Y.J., An S., Lee K.M., Yoon S.S., Choi J.Y. (2019) Nasal commensal Staphylococcus epidermidis enhances interferon-λ-dependent immunity against influenza virus. Microbiome. 7(1), 80.
Fox J.M., Crabtree J.M., Sage L.K., Tompkins S.M., Tripp R.A. (2015) Interferon lambda upregulates IDO1 expression in respiratory epithelial cells after influenza virus infection. J. Interferon Cytokine Res. 35(7), 554–562.
Iwasaki A., Pillai P.S. (2014) Innate immunity to influenza virus infection. Nat. Rev. Immunol. 14(5), 315–328.
Wang J., Oberley-Deegan R., Wang S., Nikrad M., Funk C.J., Hartshorn K.L., Mason R.J. (2009) Human alveolar type II cells secrete antiviral IL-29 (IFN-λ1) in response to influenza A infection. J. Immunol. 182(3), 1296–1304.
Beucher G., Blondot M.L., Celle A., Pied N., Recordon-Pinson P., Esteves P., Faure M., Métifiot M., Lacomme S., Dacheux D., Robinson D.R., Längst G., Beaufils F., Lafon M.E., Berger P., Landry M., Malvy D., Trian T., Andreola M.L., Wodrich H. (2022) Bronchial epithelia from adults and children: SARS-CoV-2 spread via syncytia formation and type III interferon infectivity restriction. Proc. Natl. Acad. Sci. USA. 119(28), e2202370119.
Wang N., Zhan Y., Zhu L., Hou Z., Liu F., Song P., Qiu F., Wang X., Zou X., Wan D., Qian X., Wang S., Guo Y., Yu H., Cui M., Tong G., Xu Y., Zheng Z., Lu Y., Hong P. (2020) Retrospective multicenter cohort study shows early interferon therapy is associated with favorable clinical responses in COVID-19 patients. Cell Host Microbe. 28(3), 455–464.
Felgenhauer U., Schoen A., Gad H.H., Hartmann R., Schaubmar A.R., Failing K., Drosten C., Weber F. (2020) Inhibition of SARS-CoV-2 by type I and type III interferons. J. Biol. Chem. 295(41), 13958‒13964.
Vanderheiden A., Ralfs P., Chirkova T., Upadhyay A.A., Zimmerman M.G., Bedoya S., Aoued H., Tharp G.M., Pellegrini K.L., Manfredi C., Sorscher E., Mainou B., Lobby J.L., Kohlmeier J.E., Lowen A.C., Shi P.Y., Menachery V.D., Anderson L.J., Grakoui A., Bosinger S.E., Suthar M.S. (2020) Type I and type III interferons restrict SARS-CoV-2 infection of human airway epithelial cultures. J. Virol. 94(19), e00985-20.
Sohn S.Y., Hearing J., Mugavero J., Kirillov V., Gorbunova E., Helminiak L., Mishra S., Mackow E., Hearing P., Reich N.C., Kim H.K. (2021) Interferon-lambda intranasal protection and differential sex pathology in a murine model of SARS-CoV-2 infection. mBio. 12(6), e0275621.
Dijkman R., Verma A.K., Selvaraj M., Ghimire R., Gad H.H., Hartmann R., More S., Perlman S., Thiel V., Channappanavar R. (2022) Effective interferon lambda treatment regimen to control lethal MERS-CoV infection in mice. J. Virol. 96(11), e0036422. https://doi.org/10.1128/jvi.00364-22
Stanifer M.L., Kee C., Cortese M., Zumaran C.M., Triana S., Mukenhirn M., Kraeusslich H.G., Alexandrov T., Bartenschlager R., Boulant S. (2020) Critical role of type III interferon in controlling SARS-CoV-2 infection in human intestinal epithelial cells. Cell Rep. 32(1), 107863.
Dinnon K.H., Leist S.R., Schäfer A., Edwards C.E., Martinez D.R., Montgomery S.A., West A., Yount B.L., Hou Y.J., Adams L.E., Gully K.L., Brown A.J., Huang E., Bryant M.D., Choong I.C., Glenn J.S., Gralinski L.E., Sheahan T.P., Baric R.S. (2020) A mouse-adapted SARS-CoV-2 model for the evaluation of COVID-19 medical countermeasures. bioRxiv. 2020.05.06.081497. https://doi.org/10.1101/2020.05.06.081497
Chong Z., Karl C.E., Halfmann P.J., Kawaoka Y., Winkler E.S., Yu J., Diamond M.S. (2022) Nasally-delivered interferon-λ protects mice against upper and lower respiratory tract infection of SARS-CoV-2 variants including Omicron. bioRxiv. 2022.01.21.477296. https://doi.org/10.1101/2022.01.21.477296
Yadav D., Dewangan H.K. (2021) PEGYLATION: an important approach for novel drug delivery system. J. Biomater. Sci. Polym. Ed. 32(2), 266–280.
Chan H.L.Y., Ahn S.H., Chang T.T., Peng C.Y., Wong D., Coffin C.S., Lim S.G., Chen P.J., Janssen H.L.A., Marcellin P., Serfaty L., Zeuzem S., Cohen D., Critelli L., Xu D., Wind-Rotolo M., Cooney E. (2016) Peginterferon lambda for the treatment of HBeAg-positive chronic hepatitis B: a randomized phase 2b study (LIR-A-B). J. Hepatol. 64(5), 1011–1019.
Мадонов П.Г., Ершов К.И., Дубровин А.В., Заполоцкий Е.Н., Мирошников П.Н., Шилова, М.А. Киншт Д.Н. (2013) Электронно-лучевая модификация препаратов белковой природы для улучшения их фармакологических свойств. Медицина и образование в Сибири. 4, 83.
Артамонов А.В., Бекарев А.А., Дыгай А.М., Жданов В.В., Киншт Д.Н., Мадонов П.Г., Шерстобоев Е.Ю. (2019) Пегилированный интерферон лямбда, обладающий высокой биодоступностью при пероральном применении, и способ его получения. Патент No. RU2678332C1, опубл. 2019.01.28.
Мадонов П.Г., Святченко В.А., Легостаев С.С., Кихтенко Н.А., Котлярова А.А., Олейник Л.А., Байкалов Г.И., Удут В.В. (2021) Противовирусная активность в отношении SARS-CoV-2 фармацевтической субстанции на основе иммобилизированного рекомбинантного человеческого интерферона лямбда-1. Экспериментальная и клиническая фармакология. 84(7), 15‒20.
Kubetzko S., Sarkar C.A., Plückthun A. (2005) Protein PEGylation decreases observed target association rates via a dual blocking mechanism. Mol. Pharmacol. 68(5), 1439–1454.
Grace M.J., Lee S., Bradshaw S., Chapman J., Spond J., Cox S., Delorenzo M., Brassard D., Wylie D., Cannon-Carlson S., Cullen C., Indelicato S., Voloch M., Bordens D. (2005) Site of pegylation and polyethylene glycol molecule size attenuate interferon-alpha antiviral and antiproliferative activities through the JAK/STAT signaling pathway. J. Biol. Chem. 280(8), 6327–6336.
Dinnon K.H., Leist S.R., Schäfer A., Edwards C.E., Martinez D.R., Montgomery S.A., West A., Yount B.L. Jr., Hou Y.J., Adams L.E., Gully K.L., Brown A.J., Huang E., Bryant M.D., Choong I.C., Glenn J.S., Gralinski L.E., Sheahan T.P., Baric R.S. (2020) A mouse-adapted model of SARS-CoV-2 to test COVID-19 countermeasures. Nature. 586(7830), 560–566.
Feld J.J., Kandel C., Biondi M.J., Kozak R.A., Zahoor M.A., Lemieux C., Borgia S.M., Boggild A.K., Powis J., McCready J., Tan D.H.S., Chan T., Coburn B., Kumar D., Humar A., Chan A., O’Neil B., Noureldin S., Booth J., Hong R., Smookler D., Aleyadeh W., Patel A., Barber B., Casey J., Hiebert R., Mistry H., Choong I., Hislop C., Santer D.M., Lorne Tyrrell D., Glenn J.S., Gehring A.J., Janssen H.L.A., Hansen B.E. (2021) Peginterferon lambda for the treatment of outpatients with COVID-19: a phase 2, placebo-controlled randomised trial. Lancet Respir. Med. 9(5), 498–510.
Jagannathan P., Andrews J.R., Bonilla H., Hedlin H., Jacobson K.B., Balasubramanian V., Purington N., Kamble S., de Vries C.R., Quintero O., Feng K., Ley C., Winslow D., Newberry J., Edwards K., Hislop C., Choong I., Maldonado Y., Glenn J., Bhatt A., Blish C., Wang T., Khosla C., Pinsky B.A., Desai M., Parsonnet J., Singh U. (2021) Peginterferon lambda-1α for treatment of outpatients with uncomplicated COVID-19: a randomized placebo-controlled trial. Nat. Commun. 12(1), 1967.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


