Российские нанотехнологии, 2020, T. 15, № 1, стр. 34-43
НОВЫЕ ПОЛИКАТИОННЫЕ ПОЛИМЕРЫ НА ОСНОВЕ ПОЛИЭТИЛЕНИМИНА И РАСТИТЕЛЬНЫХ НАПОЛНИТЕЛЕЙ ДЛЯ ИММОБИЛИЗАЦИИ КЛЕТОК ФОТОТРОФНЫХ МИКРООРГАНИЗМОВ
С. Г. Васильева 1, *, Е. С. Лобакова 1, А. С. Морозов 1, К. А. Шибзухова 1, М. В. Титова 2, А. М. Носов 2
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Институт физиологии растений им. К.А. Тимирязева РАН
Москва, Россия
* E-mail: vankat2009@mail.ru
Поступила в редакцию 01.05.2020
После доработки 01.05.2020
Принята к публикации 12.05.2020
Аннотация
Изучена иммобилизация клеток микроводорослей на биосорбентах на основе полиэтиленимина и целлюлозосодержащих растительных компонентов. Поликатионные полимеры на основе полиэтиленимина обладают высоким сродством к поверхностным структурам микроводорослей и обеспечивают прочное прикрепление клеток к поверхности сорбента. Введение растительных наполнителей в состав таких полимеров способствует увеличению степени их биодеградации и снижению себестоимости. Для исследования были синтезированы шесть нерастворимых пористых полимерных материалов, полученных методом криополимеризации смеси полиэтиленимина и различных растительных компонентов с помощью диэтиленгликоль диглицидилового эфира. В качестве бионаполнителей использована лиофильно высушенная биомасса культур клеток растений Ajuga turkestanica, Polyscias fruticosa, а также клеточно-структурированный материал, полученный из их биомассы. Изучение кинетики и оценка эффективности иммобилизации клеток модельной культуры микроводоросли показали высокую сорбционную способность полученных материалов, так, через 24 ч культивирования эффективность иммобилизации составляла 72–77%. Оценка уровня фотосинтетической активности клеток микроводоросли методом импульсно-моделированной флуориметрии показала, что исследованные биосорбенты не оказывают какого-либо токсического действия на клетки и не влияют на их функциональную активность. Новые биосорбенты могут эффективно использоваться для сбора биомассы микроорганизмов из природных водных сред и промышленных культиваторов.
ВВЕДЕНИЕ
В настоящее время интенсивно развиваются биотехнологии на основе иммобилизованных культур оксигенных фототрофных микроорганизмов (ОФМ) – цианобактерий и микроводорослей (МВ) [1], с целью получения биомассы и ценных метаболитов (полиненасыщенных жирных кислот, витаминов, пигментов), очистки сточных вод от избытка биогенных элементов и тяжелых металлов, получения биоводорода, а также при создании биосенсоров [2]. Главное преимущество иммобилизованных клеток по сравнению с использованием клеточных суспензий – упрощение сбора биомассы, что является одной из ключевых проблем биотехнологии с участием МВ и цианобактерий. Иммобилизация также может способствовать повышению устойчивости клеток ОФМ к действию неблагоприятных факторов (температура, кислотность, концентрация токсикантов), улучшению микроокружения клеток и их межклеточной коммуникации, увеличению градиента концентрации питательных веществ, что может приводить к увеличению метаболической активности клеток. В большинстве случаев иммобилизация позволяет добиться большей плотности клеток на единицу объема питательной среды в сравнении с культивированием суспензионных культур, а также уменьшить риск контаминации [3].
Технологии иммобилизации клеток ОФМ с использованием полимерных сорбентов могут также применяться для сбора биомассы в природных условиях при неконтролируемом их развитии, что позволит ликвидировать и/или не допускать возникновения “цветения” водоемов. Известно, что массовое развитие ОФМ в открытых и закрытых водоемах приводит к их сильной токсификации, поскольку вторичные метаболиты цианобактерий и МВ являются чрезвычайно устойчивыми in vivo токсическими веществами [4, 5]. В последние годы “цветение” водоемов в связи с промышленной и сельскохозяйственной деятельностью приобрело глобальный характер, отмечены вспышки массового развития представителей ОФМ в пресных и морских водоемах не только традиционных регионов с теплым климатом, но и в районах Северной Европы, Северной Европейской части России и Сибири [6].
Основная сложность при использовании технологий с участием иммобилизованных культур заключается в выборе носителя. В качестве природных носителей для иммобилизации ОФМ часто используют субстраты из плодов люфы, сфагнум, торф, стекло, пластик, дерево, натуральные полисахариды (агар-агар, целлюлозу, альгинат, каррагинан, хитозан), в качестве синтетических носителей – полиакриламид, полиуретан, поливинилхлорид, полипропилен, полисульфон [2, 7].
Перспективным компонентом полимерных носителей может являться биомасса культур клеток высших растений или культур водных растений, например ряски, характеризующихся быстрым ростом, низким содержанием лигнина [8–10]. Культивируемые клетки высших растений являются объектами уже внедренных и разрабатываемых биотехнологий [11] и после получения из них целевого продукта (стероидов, алкалоидов, каротиноидов, витаминов и других ценных веществ) оставшиеся каркасы клеточных стенок могут быть использованы при создании биосорбентов [12].
Включение в состав синтетических полимерных сорбентов растительных наполнителей, обладающих развитой системой пор, позволяет значительно увеличить удельную площадь поверхности сорбентов и облегчить иммобилизацию микроорганизмов. Клетки микроорганизмов могут активно прикрепляться как к поверхности таких сорбентов, так и располагаться внутри них, заселяя пространство межклетников и полости клеток [9].
В настоящей работе исследованы сорбционная активность и биосовместимость полимерных материалов, полученных методом криополимеризации смеси полиэтиленимина (ПЭИ) и различных растительных компонентов. В качестве бионаполнителей была использована лиофильно высушенная биомасса суспензионных культур клеток растений Ajuga turkestanica или Polyscias fruticosa, а также клеточно-структурированный материал (КСМ), полученный из этих объектов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве полимерного компонента выбран материал на основе ПЭИ, полученный методом криополимеризации с диэтиленгликоль диглицидиловым эфиром (ДЭГ) и последующей дегидратации продукта по аналогии с методикой, описанной в [13]. В качестве бионаполнителей были отобраны следующие материалы: биомасса суспензионных культур клеток растений A. turkestanica и P. fruticosa, а также КСМ, полученный из биомассы этих культур клеток.
Культуры клеток высших растений живучки туркестанской A. turkestanica (Regel), Briq штамм At21, и полисциаса кустарникового P. fruticosa (L.), Harms штамм 6a, депонированны во Всероссийской коллекции культур клеток высших растений (ВККК ВР) под номерами 88 и 70 соответственно.
Культура клеток A. turkestanica получена из дикорастущего растения, произрастающего в горном районе Узбекистана, а культура клеток P. fruticosa – из корней растения, выращенного в теплице ИФР РАН.
Биомасса культур клеток для проведения исследований получена в результате выращивания суспензионных культур A. turkestanica и P. fruticosa в лабораторных барботажных биореакторах V-типа в УНУ ОБК ИФР РАН при температуре 26 + 0.5°C на модифицированной питательной среде с минеральной основой по Мурасиге–Скуга [14] с добавлением источников углеводов, витаминов и регуляторов роста (в соответствии с коллекционным паспортом ВККК ВР). В зависимости от фазы ростового цикла расход воздуха на барботаж составлял 0.1–1.0 л/л/мин. Концентрацию растворенного кислорода в среде поддерживали на уровне 10–40% от насыщения. Биомассу собирали в конце ростового цикла (16–20-е сутки выращивания), клетки отделяли от среды фильтрованием под вакуумом, промывали водой и лиофилизировали. Краткая характеристика биогенных наполнителей представлена в табл. 1.
Таблица 1.
Краткая характеристика биогенных наполнителей
| Биогенный наполнитель | Химический состав |
|---|---|
| A. turkestanica лиофильно высушенная биомасса суспензионной культуры клеток | Крахмал, свободные аминокислоты, биогенные макро- и микроэлементы, редуцирующие сахара, ряд биологически активных веществ (в том числе фитоэкдистероиды) |
| КСМ из A. turkestanica | В основном целлюлоза и геммицеллюлоза |
| P. fruticosa (лиофильно высушенная биомасса суспензионной культуры клеток) | Крахмал, свободные аминокислоты, биогенные макро- и микроэлементы, редуцирующие сахара, ряд биологически активных веществ (в том числе тритерпеновые гликозиды – полисциозиды) |
| КСМ из P. fruticosa | В основном целлюлоза и геммицеллюлоза |
Клеточно-структурированный материал получали, помещая 5.0 г биомассы в 100 мл этилового спирта (95%), затем смесь кипятили в течение 2 ч и проводили декантирование спирта. Процедуру спиртовой обработки культуры клеток повторяли 5 раз, после чего полученный КСМ сушили при 70°С до постоянной массы.
Для получения биосорбентов 3.15 г 50%-ного раствора ПЭИ растворяли в 33 мл деионизованной воды, добавляли 2.51 г биогенного наполнителя и интенсивно перемешали на минишейкере. Затем к полученной массе добавляли 0.81 мл ДЭГ. Синтез сорбентов и последующую промывку вели по аналогии с методикой, описанной в [13].
Для определения насыпной плотности образцы сорбентов объемом 5–15 мл помещали в цилиндр объемом 25 мл, измеряли объем и массу сорбента. Процесс повторяли до получения двух расходящихся не более чем на 10% значений. Для определения набухания навески сорбентов (15–50 мг) помещали в стеклянную колбу объемом 4.0 мл и прибавляли 3.0 мл буферных растворов одинаковой концентрации (0.1 М), но с разной кислотностью (pH 9 – фосфатный буферный раствор, pH 5 – ацетатный буферный раствор). Инкубирование сорбентов проводили при комнатной температуре в течение 1 ч. Набухание рассчитывали по формуле (1). Данные представлены в таблице как среднее из пяти измерений. Доверительные интервалы рассчитаны для доверительной вероятности p = 0.90.
где S – набухание, mw – масса набухшего сорбента, md – масса исходного сорбента.Для исследования методом сканирующей электронной микроскопии образцы исследуемых сорбентов массой 50–80 мг высушивали при температуре 60–80°С в течение 1 ч, а образцы сорбентов с иммобилизованными клетками МВ фиксировали 2%-ным раствором глутарового альдегида в 0.1 М какодилатном буфере (рН 7.2) в течение 1.5 ч. Далее процедуру обезвоживания, высушивания и напыление образцов проводили, как указано в [12].
Для исследования кинетики иммобилизации клеток МВ на сорбентах предварительно выращивали культуру Lobosphaera sp. IPPAS 2047 при постоянной температуре 25°C в фотобиореакторах закрытого типа в 0.6 л стеклянных колоннах диаметром 40 мм с 400 мл минеральной среды BG-11 [15]. Культивирование осуществляли при освещении белым светом интенсивностью 40 мкмоль квантов ФАР/м2/с до середины экспоненциальной фазы роста. Конечную плотность культур определяли по содержанию хлорофилла (Хл), которое составляло 35–40 мг/л. По окончании культивирования (непосредственно перед экспериментом) суспензии клеток разводили в 4–6 раз стерильной водопроводной водой до концентрации хлорофилла 10–12 мг/л. Иммобилизацию клеток МВ на сорбентах проводили в стерильных пластиковых контейнерах для культивирования (“Eppendorf”) объемом 100 мл, содержащих навески сорбентов массой 450 мг и 50 мл суспензии клеток МВ. Колбы помещали в термостатированный шейкер (120 об./мин, 25°С) и инкубировали в течение 48 ч. Процесс иммобилизации контролировали по измерению содержания хлорофилла в суспензии, содержащей не прикрепившиеся к сорбенту клетки МВ. Отбор образцов осуществляли через 1, 3, 24 и 48 ч с начала иммобилизации, для чего отбирали 1 мл суспензии клеток и пропускали через сетчатый фильтр для удаления частиц сорбента. В качестве контроля использовали суспензию клеток без сорбентов.
Для определения содержания Хл 1.0 мл суспензии клеток центрифугировали в течение 5 мин со скоростью 13400 об./мин на центрифуге MiniSpin (“Eppendorf”, Германия); cупернатант удаляли. Клетки инкубировали в диметилсульфоксиде при 70°C в течение 15 мин при интенсивном перемешивании на термошейкере TS-100C (“BioSan”, Латвия). Процедуру экстракции повторяли дважды. Определение концентрации Хл a и Хл b в экстракте МВ проводили спектрофотометрически в кварцевых кюветах с длиной оптического пути 1 см на спектрофотометре Agilent Cary Bio 300 (“Agilent Technologies”, США). Расчет суммарной концентрации Хл для клеток МВ проводили с использованием уравнений [16]:
где СХлa, СХлb – концентрации хлорофиллов а и b в экстракте соответственно, Dλ – оптическая плотность при соответствующей длине волны в нанометрах. Эффективность иммобилизации для сорбентов вычисляли по формуле(4)
$A = ({{С}_{{{\text{Хл}}1}}} - {{С}_{{{\text{Хл2}}}}}) \times 100\% {\text{/}}{{С}_{{{\text{Хл1}}}}},$Влияние сорбентов на жизнеспособность клеток МВ оценивали по фотосинтетической активности (ФСА) клеток, культивируемых в присутствии сорбентов. Для этого навески сорбентов массой 450 мг помещали в колбы объемом 100 мл, содержащие 50 мл суспензии клеток МВ (содержание Хл 10–12 мг/л). Колбы помещали в термостатированный шейкер (120 об./мин, 25°С) и инкубировали в течение 7 сут. Через 3, 24, 72 и 168 ч отбирали 30–40 мг сорбентов с прикрепленными клетками, выдерживали в темноте в течение 5 мин непосредственно перед каждым измерением флуоресценции хлорофилла. Для регистрации флуоресценции использовали стационарный импульсно-модулированный флуориметр Dual PAM-100 (“Heinz Walz GmbH”, Германия); облученность актиничного света – 11 и 865 мкмоль квантов ФАР/м2/с, измеряющего света – 500 мкмоль квантов ФАР/м2/с и насыщающей вспышки – 2000 мкмоль квантов ФАР/м2/с; канал возбуждения: 635–730 нм; канал детекции: 830–875 нм.
Эксперименты проводили в трехкратной повторности. На графиках результаты представлены как средние значения ±s.d.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследованные в работе биосорбенты были получены путем криополимеризации смеси ПЭИ и растительного наполнителя в присутствии сшивающего агента – диэтиленгликоль диглицидилового эфира [17].
Для включения в состав биосорбента в качестве биологического компонента были выбраны: лиофильно высушенная биомасса суспензионных культур клеток растений A. turkestanica (рис. 1a, 1б) и P. fruticosa (рис. 1в, 1г), состоящих преимущественно из меристематических и паренхимных клеток, объединенных в агрегаты. Культура клеток P. fruticosa при выращивании формирует компактные агрегаты до 300 мкм в диаметре, содержащие 150–250 клеток. Клетки в агрегатах мелкие, меристематического типа без крупных вакуолей плотно прижаты друг к другу, отсутствуют межклеточные пространства (рис. 1в, 1г). Суспензионная культура A. turkestanica достаточно гетерогенна, в среде обнаруживаются клетки разного диаметра как собранные в рыхлые агрегаты, содержащие от 10 до 100 клеток, так и одиночные клетки (рис. 1a, 1б). Клеточно-структурированный материал из лиофильно высушенной биомассы суспензионных культур клеток A. turkestanica и P. fruticosa получен в результате экстракции из нее спиртом биологически активных веществ. Клеточно-структурированный материал сформирован частицами, содержащими агрегаты клеточных стенок (до 100 и более клеток), губчатую структуру и характеризуется широким диапазоном размеров и форм. В России культура клеток близкого вида полисциаса Polyscias filicifjlia выращивается в биореакторах промышленного объема УНУ “Опытный биотехнологический комплекс” ИФР РАН (ОБК ИФР РАН), получаемая биомасса служит сырьем для производства нутрицевтика ВИТАГМАЛ компанией “BioPharmos Group” г. Санкт-Петербург (https://bioconstructor.ru/). Отходом этого производства является КСМ после экстракции из биомассы целевых метаболитов.
Рис. 1.
Морфоструктурные особенности суспензионных культур клеток A. turkestanica (а, б) и P. fruticosa (в, г) и их лиофильно высушенной биомассы (д, е) соответственно.

В результате введения в ПЭИ растительных наполнителей были получены биосорбенты ПЭИ-At50 и ПЭИ-Pf50 на основе биомассы суспензионных культур клеток A. turkestanica, P. fruticosa соответственно и биосорбенты ПЭИ-At50-кс, ПЭИ-Pf50-кс на основе КСМ из A. turkestanica, P. fruticosa. Доля растительного наполнителя в составе полученных биосорбентов составляла 50%.
Проведено сравнение характеристик полученных биосорбентов и сорбента К-ДЭГ60, не содержащего растительных наполнителей. Исследованный ранее полимер K-ДЭГ-60 показал хорошие сорбционные свойства в отношении клеток ОФМ, а также отсутствие токсического эффекта на клетки гетеротрофных [18] и фототрофных микроорганизмов [13].
Полученные биосорбенты представляют собой гранулы неправильной формы размером от 0.5 до 1.5 см (табл. 2). Их насыпная плотность несколько меньше, чем у сорбента без наполнителя ПЭИ-ДЭГ60, что объясняется очень низкой насыпной плотностью использованных растительных наполнителей. Все сорбенты не имеют запаха и несколько менее гигроскопичны по сравнению с материалом ПЭИ-ДЭГ60 (определяли по изменению массы при стоянии на воздухе в течение одних суток).
Таблица 2.
Насыпная плотность и набухание биосорбентов
| Шифр | Насыпная плотность, г/мл | Набухание при pH 5 | Набухание при pH 9 |
|---|---|---|---|
| К-ДЭГ60 | 0.18 | 4.5 ± 0.1 | 4.2 ± 1.0 |
| ПЭИ-Pf50 | 0.13 | 5.4 ± 0.3 | 5.9 ± 0.6 |
| ПЭИ-Pf50-кс | 0.12 | 8.1 ± 1.1 | 6.6 ± 1.3 |
| ПЭИ-At50 | 0.13 | 7.8 ± 1.3 | 7.7 ± 1.1 |
| ПЭИ-At50-кс | 0.13 | 10.3 ± 1.1 | 9.4 ± 1.7 |
| Pf | 0.072 | ||
| At | 0.088 |
Образцы биосорбентов заметно набухают в водных растворах. Для определения набухания образцы погружали в два буферных раствора одинаковой концентрации (0.1 М), но с разной кислотностью (pH 9 – фосфатный буферный раствор, pH 5 – ацетатный буферный раствор) (табл. 2). В большинстве случаев композиционные материалы сильнее набухают в кислом растворе, что, по-видимому, объясняется протонированием полиэтилениминной матрицы и последующим “расталкиванием” положительно заряженных полимерных цепей. Биосорбент, где в качестве наполнителя выступает биомасса P. fruticosa, являются исключением, что, возможно, связано с особенностями синтезируемых данной культурой вторичных метаболитов. В большинстве случаев введение растительного сырья в полимерный материал приводит к увеличению набухания. Другим интересным фактом является увеличение набухания биосорбентов при введении в состав КСМ, полученных при отмывке биомассы культур этиловым спиртом, что приводит к получению практически чистых клеточных стенок наполнителей, состоящих преимущественно из целлюлозы и гемицеллюлозы [19]. Подобная закономерность, по-видимому, обусловлена наличием пустот внутри клеток, недоступных для ПЭИ, но доступных для молекул воды.
По данным сканирующей электронной микроскопии (СЭМ) лиофильно высушенная биомасса суспензионной культуры клеток P. fruticosa представлена губчато-ячеистой массой. В основном биомасса сформирована плотными агрегатами, состоящими из 30–50 округлых паренхимных клеток диаметром до 40 мкм. Клетки в агрегатах располагаются хаотично, плотно прижаты друг к другу, вследствие чего полости между клетками практически не выявляются. Поверхность клеточных структур слабо морщинистая (рис. 1e).
Биомасса A. turkestanica (рис. 1д) представлена рыхлой губчато-ячеистой массой клеточных агрегатов, состоящих преимущественно из паренхимных клеток диаметром до 50 мкм. Между клетками и агрегатами клеток выявляются многочисленные полости. Поверхность клеток мелкоморщинистая.
По данным СЭМ полученные биосорбенты и полимер К-ДЭГ60 представляют собой полимерные материалы с развитой складчато-пористой рваной поверхностью. На поверхности гранул выявляются поры, каналы и бороздки разной конфигурации, формирование которых происходит при кристаллизации смеси ПЭИ и ДЭГ вокруг микрокристаллов льда (рис. 2а).
Рис. 2.
Фрагменты поверхности гранул сорбента К-ДЭГ60 (а), биосорбентов ПЭИ-Pf50 (б, в), ПЭИ-At50 (г) и ПЭИ-Pf50-кс (д, е).

Введение в состав сорбентов на основе ПЭИ материала в виде биомассы растительных клеток существенно изменяет его поверхностную структуру (рис. 2б). Поверхность биосорбентов, содержащих 50% биомассы культуры клеток P. fruticosa и A. turkestanica, характеризовалась наличием отверстий и пор в виде сплющенных овалов диаметром 15–20 мкм и длиной от 30 до 150 мкм. На рис. 3б, 3в видно, что внутренняя часть биосорбентов имеет разветвленную систему каналов разного диаметра.
Рис. 3.
Кинетика (а, в) и эффективность (б, г) иммобилизации клеток Lobosphaera sp. IPPAS 2047 на биосорбентах, содержащих культуру клеток (а, б) и клеточно-структурированный материал (в, г) растений A. turkestanika и P. fruticosa в сравнении с клетками МВ, культивируемыми c сорбентом К-ДЭГ60. Контролем служила культура МВ, культивируемая в отсутствие сорбентов.

Отличием биосорбента, полученного на основе культуры клеток A. turkestanica, является наличие на поверхности округлых вдавлений диаметром от 500 до 700 нм (рис. 3г).
Наиболее интересными являются структурные особенности биосорбентов, полученных при добавлении в полиэтиленимин КСМ биомассы суспензионных культур клеток P. fruticosа (рис. 2д, 2е) и A. turkestanica. Введение КСМ при синтезе сорбентов приводит к формированию крупноячеистых сетчатых материалов ПЭИ-At50кс и ПЭИ-Pf50кс, схожих по характеру поверхностных и внутренних структур. Средний размер ячеек составляет 150 мкм. Поверхность стенок ячеек не ровная, бугристо-ямчатая. На некоторых участках находятся структуры, которые по форме и размерам соответствуют клеткам растений A. turkestanica и P. fruticosa.
Результаты исследований кинетики иммобилизации клеток зеленой МВ Lobosphaera sp. IPPAS 2047 на синтезированных биосорбентах представлены на рис. 3а, 3в. В течение первых трех часов культивирования наибольшее количество клеток МВ прикреплялось к поверхности сорбента К-ДЭГ60 (рис. 3а), в то время как количество клеток МВ, иммобилизованных на биосорбентах ПЭИ-At50 и ПЭИ-Pf50, содержащих биомассу культуры клеток A. turkestanika и P. fruticosa, было в 2.5–3 раза ниже. Однако в течение 24 ч культивирования скорость и полнота прикрепления клеток Lobosphaera sp. IPPAS 2047 к сорбенту К-ДЭГ60 значительно снижались по сравнению с биосорбентами ПЭИ-At50 и ПЭИ-Pf50, и к окончанию эксперимента количество иммобилизованных клеток на всех сорбентах было практически одинаковым.
На рис. 3б представлены значения рассчитанной по формуле (4) эффективности иммобилизации клеток МВ Lobosphaera sp. IPPAS 2047 на сорбентах. При культивировании МВ в присутствии сорбента К-ДЭГ60 около 59–61% клеток переходило в иммобилизованное состояние в течение трех часов (рис. 3б). Высокая сорбционная способность поликатионного сорбента К-ДЭГ60 на основе ПЭИ связана с его высоким сродством с отрицательно заряженными поверхностными структурами клеток МВ. Полисахариды, белки и полипептиды, входящие в состав поверхностных структур клеток МВ, имеют отрицательно заряженные группы (как правило, карбоксильные) и могут взаимодействовать с положительно заряженными аминогруппами, расположенными на поверхности сорбентов.
Эффективность иммобилизации сорбентов ПЭИ-At50 и ПЭИ-Pf50 в течение трех часов была значительно ниже и составляла 18–21%. Более низкая сорбционная активность биосорбентов, по-видимому, объясняется уменьшением поверхностного заряда полимеров ПЭИ-At50 и ПЭИ-Pf50 в сравнении с К-ДЭГ60, вызванного введением в состав растительных наполнителей. В течение 48 ч культивирования процесс иммобилизации на сорбенте К-ДЭГ60 существенно замедлялся, возможно, из-за уменьшения количества доступных сайтов связывания с клетками МВ. В этот же период скорость прикрепления клеток к поверхности биосорбентов ПЭИ-At50 и ПЭИ-Pf50 была выше, чем для К-ДЭГ60, что может объясняться большей площадью их поверхности, доступной для адсорбционного прикрепления клеток МВ.
Как видно из рис. 3в, описывающего кинетику иммобилизации клеток Lobosphaera sp. IPPAS 2047 на биосорбентах, содержащих КСМ растительных материалов, в течение одного часа иммобилизации клетки с одинаковой полнотой и скоростью прикреплялись к поверхности сорбентов ПЭИ-At-50кс, ПЭИ-Pf-50кс, при этом сорбционная активность указанных носителей была значительно ниже, чем К-ДЭГ60. Однако в период от 3 до 24 ч инкубации скорость прикрепления клеток к биосорбентам, содержащим КСМ, была выше, чем для К-ДЭГ60. Схожая тенденция была отмечена ранее для полимеров ПЭИ-At50 и ПЭИ-Pf50, содержащих культуру клеток растений.
По-видимому, основными типами взаимодействия клеток МВ и изученных полимеров на основе ПЭИ и растительных наполнителей являются электростатическое и адсорбционное взаимодействие. Скорость электростатического взаимодействия значительно превышает скорость адсорбционного [20], поэтому в течение первых часов иммобилизации наибольшее количество клеток прикрепляется к носителю К-ДЭГ60, имеющему наибольшее количество заряженных аминогрупп, доступных для связывания с отрицательно заряженными карбоксильными группами соединений, входящих в состав поверхностных структур МВ. После быстрого этапа сорбции клеток по мере исчерпания количества доступных аминогрупп на поверхности К-ДЭГ60 скорость иммобилизации начинает снижаться, при этом клетки начинают более активно прикрепляться к незаряженным поверхностям полимера благодаря адсорбционному механизму взаимодействия. В этот период скорость прикрепления клеток МВ к поверхности сорбентов, содержащих биомассу культуры клеток растений и КСМ, значительно выше по сравнению с К-ДЭГ60, что можно объяснить большей площадью их поверхности из-за введения в состав ячеистых и пористых растительных компонентов. Одиночные клетки или агрегаты клеток МВ могут заселять многочисленные поры в составе растительных наполнителей и таким образом надежно удерживаться на их поверхности.
Как видно из рис. 3б, 3г, эффективность иммобилизации сорбентов, содержащих биомассу культуры клеток и КСМ A. turkestanika, практически не различалась. В случае P. fruticosa композитные материалы с добавлением культуры клеток были более эффективны по сравнению с КСМ этого растительного наполнителя, при этом эффективность иммобилизации клеток МВ для ПЭИ-Pf-50 и ПЭИ-Pf-50-кс через 24 ч культивирования составила 75 и 59% соответственно.
Сравнение эффективности иммобилизации клеток МВ на биосорбентах, содержащих КСМ и культуры клеток A. turkestanika и P. fruticosa, показало, что в течение 24 ч культивирования сорбционная активность сорбентов ПЭИ-Pf-50, ПЭИ-At-50 и ПЭИ-At50кс (рис. 3б, 3г) практически не различалась и составляла 70–75%, в то время как к сорбенту ПЭИ-Pf50кс прикреплялось в среднем около 58% клеток.
Известно, что в стенках культивируемых растительных клеток встречаются три типа ионообменных групп: карбоксильные группы полигалактуроновой и гидрооксикоричной кислот и первичные аминогруппы. Карбоксильные группы полигалактуроновой кислоты являются наиболее представленными, их доля составляет от 11.5% для культур Dioscorea deltoides и Pana japonicus и до 13.4% в клеточных стенках культур рода Polyscias filicifolia [19]. Можно предположить, что более низкая сорбционная активность сорбента ПЭИ-Pf50кс связана с наличием в составе КСМ большого количества свободных карбоксильных групп, взаимодействие которых с аминогруппами ПЭИ может приводить к частичной нейтрализации поверхностного заряда полимеров и снижению их электростатического взаимодействия с клетками МВ.
Таким образом, изучение кинетики и оценка эффективности иммобилизации клеток Lobosphaera sp. IPPAS 2047 показали, что биосорбенты с добавлением биомассы суспензионных культур клеток A. turkestanica и P. fruticosa, а также полимеры, содержащие КСМ, полученный из этих культур, иммобилизуют около 75–84% клеток в течение 48 ч культивирования.
На следующем этапе была проведена оценка влияния синтезированных сорбентов на жизнеспособность клеток Lobosphaera sp. IPPAS 2047, с этой целью применяли метод импульсно-моделированной флуориметрии, с помощью которого оценивали уровень ФСА клеток. Измерение флуоресценции Хл а – один из самых популярных неинвазивных методов анализа ФСА, основой которого является то, что хлорофилл, находящийся в фотосинтетических мембранах, служит своего рода природным индикатором состояния клеток [21].
Известно, что фотосинтез иммобилизованных клеток может меняться из-за изменения условий освещенности по сравнению со свободными клетками [2], недостатка СО2, а также наличия токсичных веществ в составе сорбентов, влияющих на метаболическую активность клеток [3].
Как видно из рис. 4a, значения ${{F}_{v}}{\text{/}}{{F}_{m}}$, определяющие величину фотохимического квантового выхода ФСII, для Lobosphaera sp. IPPAS 2047, культивируемой без сорбентов, относительно высоки и составляли приблизительно 0.65–0.67 на протяжении всего семидневного эксперимента. В течение трех часов культивирования для клеток, иммобилизованных на сорбентах ПЭИ-At50 и ПЭИ-Pf50, наблюдалось незначительное снижение ФСА, не более 10% от контроля. Через 48 ч значения квантового выхода ФСII для клеток, иммобилизованных на указанных сорбентах, восстанавливались до первоначальных значений. Незначительное ингибирующее действие сорбентов, наблюдаемое на начальном этапе культивирования их с клетками обеих исследованных культур, может быть связано с наличием в клеточной биомассе вторичных метаболитов (табл. 1) и их влиянием на иммобилизацию и эффективность флюоресценции клеток МВ.
Рис. 4.
Оценка фотосинтетической активности клеток Lobosphaera sp. IPPAS 2047, культивируемой в присутствии биосорбентов, содержащих культуры клеток (а) и клеточно-структурированный материал (б), в сравнении с клетками МВ, культивируемых в отсутствие сорбентов.
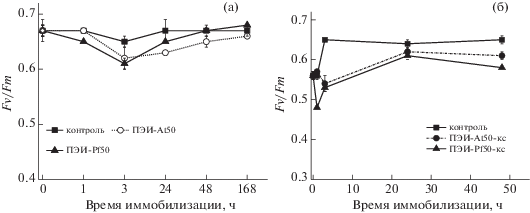
Следует отметить, что в [13] было исследовано влияние сорбента К-ДЭГ60 на ФСА иммобилизованных клеток и биолюминесценцию фотобактерий [18], и показано отсутствие токсичности для гетеротрофных бактерий, Цб и МВ.
В течение трех часов культивирования клеток Lobosphaera sp. IPPAS 2047 в присутствии биосорбентов, содержащих КСМ P. fruticosа и A. turkestanika (рис. 4б), наблюдалось снижение ${{F}_{v}}{\text{/}}{{F}_{m}}$ до значений 0.48–0.53, однако после 24 ч культивирования значения квантового выхода ФСII увеличивались до 0.58–0.63. Последующее инкубирование клеток в присутствии сорбента, содержащего КСМ P. fruticosa, сопровождалось незначительным падением выходов фотохимической утилизации энергии, при этом для клеток Lobosphaera sp. IPPAS 2047, иммобилизованных на ПЭИ-At50-кс, ингибирования не наблюдалось.
Следует отметить, что при культивировании клеток Lobosphaera CALU925 в течение семи суток в присутствии всех сорбентов не наблюдали снижения ФСА клеток по сравнению с контролем.
Таким образом, на основании проведенного эксперимента можно сделать вывод, что исследованные биосорбенты не оказывали негативного влияния на функционирование фотосинтетического аппарата клеток модельных культур МВ, а значит, не содержали токсичных для них соединений.
ЗАКЛЮЧЕНИЕ
Полимерные сорбенты на основе полиэтиленимина могут быть использованы для быстрого и эффективного сбора биомассы микроорганизмов из природных водных сред и промышленных культиваторов. Включение в состав синтетических полимерных сорбентов биологических растительных наполнителей, обладающих развитой системой пор и с шероховатой внешней поверхностью, позволяет значительно увеличить удельную площадь поверхности сорбентов и облегчить иммобилизацию микроорганизмов. Клетки микроорганизмов могут активно заселять как поверхность сорбентов, так и располагаться внутри них, заселяя полости межклеточных пространств и клеток. По сравнению с биомассой интактных растений в процессе приготовления клеточно-структурированного материала происходит формирование мелких повреждений поверхности, которые могут являться дополнительными элементами заселения клетками микроорганизмов структур КСМ и созданных сорбентов. Следует добавить, что использованные в работе растительные материалы являются объектами уже внедренных и разрабатываемых биотехнологий и после получения из них целевого продукта (стероидов, алкалоидов, каротиноидов и других ценных веществ) оставшиеся компоненты могут быть использованы при создании биосорбентов. Данные, полученные с помощью элементного и функционального анализов, показали, что стенки культивируемых клеток растений характеризуются высоким содержанием пектинов (~40 мас. %) и структурных белков (~17–30 мас. %) и не содержат фенольных ОH-групп, характерных для лигнина [19], т.е. лиофильно высушенная биомасса культур клеток растений A. turkestanica и P. fruticosa, а также КСМ, полученный из этих объектов, не содержат труднодеградируемого природного полимера лигнина.
Изучение кинетики и эффективности иммобилизации клеток оксигенных фототрофных микроорганизмов на биосорбентах показало, что на начальном этапе иммобилизации они с меньшей скоростью и полнотой сорбируют клетки в сравнении с синтетическим полимером К-ДЭГ60, однако в течение суток эффективность биосорбентов и К-ДЭГ-60 практически не различается. Оценка уровня фотосинтетической активности клеток МВ методом импульсно-моделированной флуориметрии показала, что исследованные биосорбенты не оказывают какого-либо токсического действия на клетки и не влияют на их функциональную активность в течение продолжительного инкубирования, поэтому они могут использоваться не только для быстрой сорбции клеток, но и для долговременного культивирования иммобилизованных клеток в биореакторах.
Работа выполнена на базе “Научно-производственного биотехнологического комплекса для проведения работ по изучению, сохранению и практическому применению культивируемых клеток и органов высших растений и микроводорослей” при финансовой поддержке Правительства Российской Федерации (соглашение № 075-15-2019-1882).
Список литературы
Cassidy M.B., Lee H., Trevors J.T. // J. Ind. Microbiol. 1996. V. 16 (2). P. 79.
Moreno-Garrido I. // Bioresour. Technol. 2008. V. 99. P. 3949.
De-Bashan L.E., Bashan Y. // Bioresour. Technol. 2010. V. 101 (6). P. 1611.
Apeldoorn M.E., Egmond H.P., Speijers G.J.A. et al. // Molecular Nutrition Food Research. 2007. V. 51. P. 7.
Pearson L., Mihali T., Moffitt M. et al. // Marine Drugs. 2010. V. 8. P. 1650.
Davis T.W., Berry D.L., Boyer G.L. et al. // Harmful Algae. 2009. V. 8. P. 715.
Hameed M.S.A., Ebrahim O.H. // J. Agric. Biol. 2007. V. 9 (1). P. 183.
Ehwald R., Woehlecke H., Titel K. // Photochemistry. 1992. V. 33. P. 3033.
Baulina O.I., Ehwald R., Gorelova O.A. et al. // Microbiology. 1995. V. 64(4). P. 440.
Lobakova E., Vasilieva S., Kashcheeva P. et al. // Int. Biodeterior. Biodegrad. 2016. V. 108. P. 99.
Носов А.М. // Биотехнология. 2010. Т. 5. С. 8.
Ivanova E.A., Lobakova E.S., Idiatulov R.K. et al. // Pet. Chem. 2019. V. 59. P. 420.
Vasilieva S., Shibzukhova K., Morozov A. et al. // J. Biotechnol. 2018. V. 281. P. 31.
Murashige T., Skoog F. // Physiol. Plant. 1962. V. 15. P. 473.
Stanier R., Kunisawa R., Mandel M. et al. // Bacteriol Rev. 1971. V. 35 (2). P. 171.
Solovchenko A., Merzlyak M.N., Khozin-Goldberg I. et al. // J. Phycology. 2010. V. 46. P. 763.
Nuzhdina A.V., Morozov A.S., Kopitsyna M.N. et al. // Mater. Sci. Eng. C 2017. V. 1(70). P. 788.
Орлова А.А., Алескерова Л.Э., Васильева С.Г. и др. // Биотехнология. 2020. № 3. (В печати).
Meychik N., Nikolaeva Y., Kushunina M. et al. // Plant Cell Tissue Organ. Culture. 2017. V. 129. P. 493.
Синицын А., Райнина Е., Лозинский В., Спасов С. Иммобилизованные клетки микроорганизмов. М.: Изд-во МГУ, 1994. 288 с.
Плюснина Т.Ю., Хрущев С.С., Ризниченко Г.Ю. и др. // Биофизика. 2015. Т. 60. № 3. С. 487.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


