Российские нанотехнологии, 2020, T. 15, № 1, стр. 44-51
ПОЛУЧЕНИЕ И ФИЗИКО-ХИМИЧЕСКИЕ ХАРАКТЕРИСТИКИ ЭКДИСТЕРОИДСОДЕРЖАЩИХ НАНОДИСПЕРСИЙ НА ОСНОВЕ ТРИТЕРПЕНОИДОВ БЕРЕСТЫ
В. В. Володин 1, *, Нгуен Хонг Куанг 2, А. П. Каплун 3, С. О. Володина 1
1 Институт биологии ФИЦ “Коми НЦ УрО РАН”
Сыктывкар, Россия
2 Российско-Вьетнамский научно-исследовательский и технологический тропический центр
Ханой, Вьетнам
3 МИРЭА – Российский технологический университет, Институт тонких химических технологий
им. М.В. Ломоносова
Москва, Россия
* E-mail: vladimir131035@yandex.ru
Поступила в редакцию 12.05.2020
После доработки 12.05.2020
Принята к публикации 25.05.2020
Аннотация
Изучены физико-химические параметры сферических аморфных наночастиц (САНЧ), состоящих из смеси тритерпеноидов бересты (СТБ) с 20-гидроксиэкдизоном (20Е). Наночастицы получены методом инжекции и исследованы методом электронной микроскопии, динамического рассеяния света и УФ-спектроскопии. В изученном ряду концентраций 20Е от 5 до 20 мас. % по отношению к массе СТБ оптимальной является концентрация 20Е 10 мас. %, при которой образуются наиболее стабильные нанодисперсии в воде, 20Е полностью включается в САНЧ, их средние размеры составляют 193.1 нм, характеризуются узким интервалом полидисперсности, имеют наибольшее абсолютное значение ζ-потенциала. Экдистероидсодержащие САНЧ данного состава могут быть рекомендованы для использования в медицине как пролонгированные формы экдистероидов в качестве радиопротекторных и других фармакологических средств.
ВВЕДЕНИЕ
Большой интерес исследователей привлекает малоизученный класс биологически активных веществ – экдистероиды, обнаруженные у представителей и животного, и растительного мира. У насекомых экдистероиды являются гормонами линьки, а у растений – защитой от насекомых-фитофагов. По своей химической природе фитоэкдистероиды представляют собой полигидроксилированные стерины, характерными элементами молекул которых являются цис-сочленение колец A и B, 7-ен-6-оновая группировка в кольце В, 14α-гидроксильная группа. Наиболее распространенным экдистероидом является 20-гидроксиэкдизон (20Е). К настоящему времени в растениях обнаружено более 150 структур экдистероидов (рис. 1) [1].
В связи с обнаружением растений с высоким содержанием экдистероидов, отсутствием у этих соединений токсического и гормонального действия на теплокровных животных, обнаружением выраженного действия на пластический и энергетический обмен у млекопитающих и человека открылась перспектива их использования медицине [1, 2]. На основе экдистероидов, выделенных из растений Serratula coronata L. (Asteraceae), в Институте биологии Коми НЦ УрО РАН (Россия) (профессор В.В. Володин) была разработана экдистероидсодержащая субстанция Серпистен и зарегистрирована линия биологически активных добавок к пище противоишемического (Кардистен), противодиабетического (Диастен) и адаптогенного (Адастен) действия [3]. Кроме того, на лабораторных мышах линий СВА/Lac изучалось противолучевое действие субстанции Серпистен. Было установлено, что профилактическое введение субстанции в дозе 15 мг/кг в течение семи суток по показателям красной крови и интенсивности процессов перекисного окисления липидов в селезенке и печени ослабляет повреждающее действие хронического низкоинтенсивного γ-излучения. Показана возможность создания на основе фитоэкдистероидов эффективных радиопротекторных лечебных и профилактических средств [4].
Среди причин, сдерживающих разработку новых лекарственных средств на основе фитоэкдистероидов, следует назвать использование высоких доз препаратов в виду их быстрого метаболизма и выведения из организма и, как следствие, высокую цену препаратов.
Для решения названных проблем и создания пролонгированных форм экдистероидных препаратов в Институте биологии Коми НЦ УрО РАН были разработаны методы получения экдистероидсодержащих липосом [5]. Липидные наночастицы (липосомы) уже более четверти века успешно используются в мировой медицинской практике. Разработаны и хорошо зарекомендовали себя липосомальные формы противоопухолевых препаратов доксорубицина, даунорубицина, оксалиплатины, иринотекана, топотекана и других фармацевтических субстанций. В современных обзорах описаны разнообразные методы и условия включения физиологически активных веществ в липосомы [6, 7].
Было показано, что свободный 20Е (рис. 2), наиболее доступный экдистероид, встречающийся в растениях, слабо включается в липосомы, вероятно, из-за наличия в молекуле шести гидроксильных групп в стероидном ядре и в боковой цепи. Гидрофобизация молекулы 20Е ацетилированием (были получены, моно-, три- и тетра-ацетаты 20Е) не привела к увеличению их включения в липидный бислой. Значительное включение экдистероида в липидный бислой было достигнуто лишь при ацилировании концевой гидроксильной группы боковой цепи (в 22 положении) высшими жирными кислотами (пальмитиновой). В опытах in vitro с использованием комплекса ферментов гидролаз экдистероидсодержащие липосомы легко распадались, высвобождая свободную форму 20Е благодаря ферментативному гидролизу сложноэфирных групп. Описанный принцип конструирования липосом был назван биомиметическим, поскольку на стадии получения и разрушения конъюгатов 20Е с высшими жирными кислотами происходят те же химические процессы, как и в ооцитах самок насекомых происходит резервирование гормона линьки (20Е) в неактивной форме конъюгатов с высшими жирными кислотами и его активация на начальных стадиях эмбриогенеза путем ферментативного гидролиза сложноэфирной группы с образованием свободного 20Е [8]. Несмотря на всю привлекательность разработанной липосомальной формы экдистероидов, необходимость стадии химической модификации 20Е жирными кислотами, усложняющая процесс, стимулировала дальнейшие исследования по получению других транспортных форм экдистероидов.
При разработке пролонгированных форм лекарственных препаратов, систем адресной доставки лекарств в клетки-мишени кроме липосом в качестве носителей лекарственных средств в настоящее время широко используются циклодекстрины, природные и синтетические полимеры, полиэлектролитные комплексы и дендримеры, микрокапсулы и микросферы, углеродные наноматериалы, гибридные материалы на основе конъюгатов полимеров с наночастицами [9–12].
Среди большого количества типов наночастиц в качестве носителей лекарственных и диагностических субстанций выбраны сферические аморфные наночастицы (САНЧ) на основе тритерпеноидов бересты, представляющие собой природную смесь бетулина (56–68%), лупеола (25–30%) и кофеата бетулина (7–9%) (рис. 2). Эти наночастицы можно отнести к твердым липидным наночастицам [13], одним из характерных свойств которых является их стабильность из-за невозможности твердых наночастиц к слиянию, а при абсолютных значениях ζ-потенциала больше 30 мВ –устойчивость к агрегации [14, 15]. Твердые липидные наночастицы успешно используются для солюбилизации стероидных гормонов [16–18]. Для данного исследования важно, что лупановые и стероидные тритерпеноиды, в том числе 20Е, имеют сходную структуру, что позволяло предположить их сродство в наночастицах.
Известные свойства САНЧ – узкий интервал распределения по размерам (100–200 нм) [19], способность включать в себя значительные количества гидрофобных и амфифильных субстанций. Противоопухолевая субстанция доксорубицин основание, противотуберкулезные субстанции рифампицин и рифабутин, синтетический аналог эстрогена диэтилстильбэстрол, нестероидные противовоспалительные субстанции диклофенак и ацетилсалициловая кислота, гепатопротектор силибинин включаются в САНЧ от 5 до 20% [19]; загрузка гидрофобных порфиринов для фотодинамической терапии рака [20], радиопротекторного средства генистеин [21] также составляла 5–15%.
Характерно, что САНЧ на основе тритерпеноидов бересты способны без добавления детергентов к самопроизвольному образованию устойчивых нанодисперсий благодаря наличию в природной смеси бетулина и лупеола третьего компонента – кофеата бетулина, фенольные гидроксилы которого даже при рН 7.4 ионизируются на 0.3%, что приводит к формированию на поверхности наночастиц отрицательного заряда, препятствующего их коагуляции [19].
Цель настоящей работы – получение и исследование САНЧ, загруженных 20Е, в качестве потенциальных радиопротекторных средств пролонгированного действия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и материалы. В работе использовали смесь тритерпеноидов бересты (СТБ) производства ООО “Березовый мир” (Москва, Россия), состоящую из бетулина (60 ± 5%), лупеола (30 ± ± 4%) и кофеата бетулина (9 ± 3%) [22]; гемисукцинат холестерина (ГСХ) (≥99) (рис. 2) (Sigma-Aldrich, CША); дигидрофосфат натрия (Merk, Германия); гидрофосфат натрия (Merk, Германия); тетрагидрофуран (ТГФ) (Merk, Германия); 20Е, выделенный из листьев растений Serratula coronata L. в лаборатории биохимии и биотехнологии Института биологии Коми НЦ УрО РАН. Дистиллированную воду, используемую при приготовлении фосфатного буфера для получения нанодисперсий, предварительно фильтровали через фильтр с размером пор 220 нм (Milliроrе, США).
Оборудование для получения САНЧ. Испаритель ротационный R300 (Buchi, Швейцария); магнитная мешалка EM180 (Froilabo, Франция); механическая мешалка SH-II-4 (Faithful, Китай); ультразвуковая баня WUC-A06H (Daihan, Республика Корея); спектрофотометр UV-VIS 2910 (Hitachi High-Technologies, Япония); Вортекс Lab Dancer (IKA, Германия); центрифуга Z 206 A (Labnet, США).
Методика получения экдистероидсодержащих САНЧ. Наночастицы получали методом инжекции аналогично [23, 24]. Для проведения исследования готовили две серии САНЧ. Первая серия САНЧ содержала 20Е в количествах от 5 до 20% к массе СТБ и стабилизатор ГСХ. Вначале готовили растворы компонентов САНЧ в тетрагидрофуране: СТБ (5 мг/мл) (А), 20Е (1 мг/мл) (Б), ГСХ (1 мг/мл) (В) и фосфатный буфер 10 мМ, рН 7.5. Далее в круглодонной колбе смешивали 4 мл раствора А с необходимым количеством раствора Б (1, 2, 3 или 4 мл, что соответствовало 5, 10, 15 и 20% 20E от массы СТБ). Для стабилизации нанодисперсий САНЧ добавляли 0.4 мл раствора В (2% по отношению к массе СТБ). При интенсивном перемешивании к смеси растворов быстро добавляли соответственно 95, 94, 93 и 92 мл фосфатного буфера (рН 7.5; 10 мМ) при комнатной температуре. Затем растворители упаривали на роторном испарителе при температуре 55°С до конечного объема 25 мл (для всех образцов). Для получения САНЧ, содержащих 20Е, образцы центрифугировали, супернатант подвергали действию ультразвука в течение 5 мин, и образующийся осадок отделяли фильтрацией. В качестве образца сравнения использовали САНЧ, не нагруженные 20Е, которые готовили аналогичным образом путем смешения 1 мл раствора А и 0.1 мл раствора В, 25 мл фосфатного буфера и упаривания раствора до объема 10 мл.
Процедура получения образцов второй серии, содержащих от 5 до 20% 20Е к массе СТБ, аналогична первой, но без добавления стабилизатора.
Распределение по размерам частиц и ζ-потенциал определяли с помощью анализатора DelsaTM Nano (Beckman Coulter, США).
Микрофотографии получали с помощью электронного микроскопа JEM-1400 (JEOL, Япония) при инструментальном увеличении 10 или 20 тыс.
Концентрацию 20Е определяли спектрофотометрически на основе измерения поглощения в электронном спектре при длине волны, соответствующей максимуму (243 нм) поглощения 20Е. Для этого к образцу дисперсии объемом 200 мкл добавляли 2 мл ТГФ. Так как в этой области поглощает кофеат бетулина, вычитали соответствующее число. Его рассчитывали из спектра кофеата по соотношению интенсивности поглощения при 243 нм в максимуме (327 нм) А243/А327 = 0.74. Итак, поглощение 20Е рассчитывали по формуле А20Е = Аизм – А327 × 0.74.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для достижения поставленной цели необходимо было найти оптимальные условия получения наночастиц, загруженных 20Е. Для выяснения основных закономерностей готовили дисперсии с включением 5, 10, 15 и 20% 20Е. Критическими параметрами, определяющими потребительские свойства наночастиц, являются размер (распределение по размерам) и ζ-потенциал.
Определение размера наночастиц дисперсий САНЧ, нагруженных 20Е. Размер САНЧ, модифицированных 20Е, определяли методом динамического светорассеяния.
Предварительные эксперименты показали, что дисперсии наночастиц, загруженных 20Е, образуют кроме САНЧ кристаллы бетулина (рис. 2). Поэтому использовали дополнительный стабилизатор ГСХ, хорошо зарекомендовавший себя ранее [21].
Было установлено, что использование ГСХ в концентрации 2% к массе СТБ во всем изученном интервале концентраций существенно тормозит укрупнение и слипание частиц (рис. 3, 4, табл. 1). Оптимальной концентрацией 20Е является 10% к массе СТБ, при которой средние размеры САНЧ составляют 193.1 нм и характеризуются узким интервалом полидисперсности. Данные характеристики оптимально удовлетворяют требованиям к наночастицам, применяемым в медицине. Наночастицы размером 100–200 нм не выходят из кровяного русла и сохраняют высокую концентрацию в плазме. Очевидно, что скорость биотрансформации субстанции 20Е при этом уменьшится, так как она не будет контактировать с ферментами, клиренс также уменьшится, поскольку почки не выпускают наночастицы из организма, уменьшатся возможные побочные эффекты. Кроме того, должно увеличиться время циркуляции 20Е в организме, а следовательно, обеспечиться пролонгация его действия; обеспечиться солюбизизация 20Е компонентами САНЧ, в частности ГСХ за счет сродства молекул друг к другу. При этом эффективность направленной доставки субстанции к клеткам должна возрасти, так как 20Е в составе САНЧ эндоцитируются легче, чем отдельные молекулы.
Рис. 3.
Гистограммы распределения наночастиц по размерам в дисперсиях САНЧ с 20Е. Верхний ряд без стабилизатора, нижний с 2% ГСХ; а – контроль – без 20Е; б – с 5% 20Е, в – с 10% 20Е.
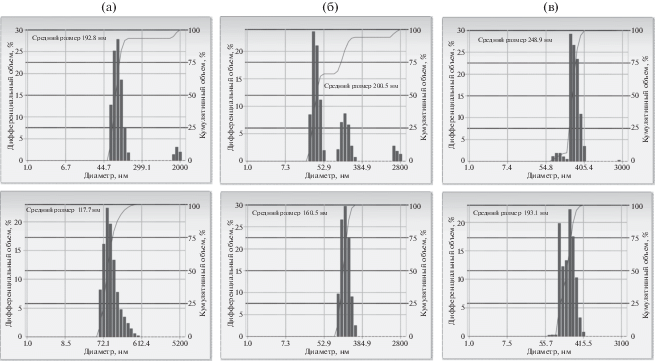
Рис. 4.
Гистограммы распределения наночастиц по размерам в дисперсиях САНЧ с 20Е. Верхний ряд без стабилизатора, нижний с 2% ГСХ; а – с 15% 20Е, б – с 20% 20Е.
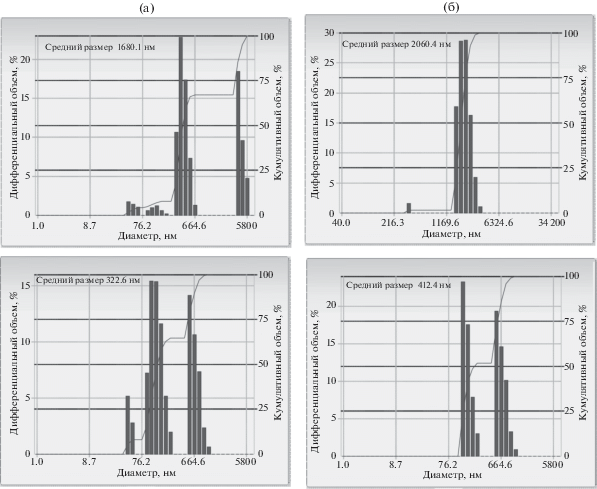
Таблица 1.
Средние размеры САНЧ и значения ζ-потенциала с различным содержанием 20Е без стабилизатора и со стабилизатором
| Доля 20Е, % от массы СТБ | Размер частиц/стандартное отклонение | Значения ζ-потенциала, мВ | |
|---|---|---|---|
| Без ГСХ | +2% ГСХ | +2% ГСХ | |
| 0 | 192.8/401.8 | 117.7/60.9 | –34.47 |
| 5 | 200.5/522.1 | 160.5/36.3 | –35.25 |
| 10 | 248.9/127.9 | 193.1/67.7 | –36.54 |
| 15 | 1703.7/1948.9 | 322.6/279.2 | –33.21 |
| 20 | 2060.4/447.1 | 412.4/277.8 | –26.34 |
В дальнейшем использовали образцы нанодисперсий, полученных только с использованием ГСХ.
Определение ζ-потенциала САНЧ. ζ-Потенциал является важной характеристикой, определяющей стабильность нанодисперсии. Основную роль в стабилизации дисперсий САНЧ играет кофеат бетулина, пирокатехиновые группы которого диссоциируют, создавая на поверхности наночастиц отрицательный заряд. Использование дополнительного стабилизатора ГСХ целесообразно по нескольким причинам. Благодаря холестериновому фрагменту он должен встраиваться в наночастицы из СТБ, а наличие карбоксильной группы должно увеличивать отрицательный заряд наночастиц, что было зафиксировано в проведенных экспериментах (табл. 1).
Была обнаружена интересная закономерность: при добавлении 20Е в концентрации 5 и 10% абсолютное значение ζ-потенциала наночастиц возрастает, что должно приводить к повышению стабильности нагруженных САНЧ. При дальнейшем увеличении количества добавляемого 20Е абсолютное значение ζ-потенциала уменьшается. При концентрации 20Е 20% значение ζ-потенциала становится существенно ниже значения для интактных САНЧ, при концентрации 20Е выше 10% стабильность САНЧ ухудшается, усиливается тенденция к агрегации наночастиц, что согласуется с результатами по определению размеров и степени полидисперсности САНЧ, нагруженных повышенным количеством 20Е (рис. 4, табл. 1).
Вероятно, 20Е как самое полярное вещество из всех имеющихся компонентов САНЧ сосредотачивается в поверхностном слое, и ГСХ благодаря силам межмолекулярного взаимодействия из-за структурного сродства с 20Е (оба соединения являются производными холестерина) “вытягивается” на поверхность, что приводит к увеличению плотности отрицательного заряда на поверхности. Но при значениях загрузки больше 10% тенденция оборачивается.
Исследование морфологии САНЧ, нагруженных 20Е. С помощью метода просвечивающей электронной микроскопии проведено исследование морфологии САНЧ, содержащих 20Е в изученном интервале концентраций от 5 до 20% к массе СТБ, по сравнению с ненагруженными САНЧ, как содержащих, так и не содержащих дополнительный стабилизатор нанодисперсии ГСХ (рис. 5). На микрофотографиях нанодисперсий при содержании нагружаемого вещества 20Е в концентрациях 5 и 10%, как и у ненагруженных САНЧ, отчетливо видны изолированные сферические наночастицы приблизительно одинакового размера. Загрузка САНЧ бóльшими количествами 20Е приводит к значительному изменению морфологии наночастиц. Добавление к САНЧ 15% 20Е к массе СТБ приводит к появлению в нанодисперсии более крупных частиц, в том числе кристаллов бетулина, а увеличение доли 20Е до 20% приводит к образованию их агрегатов и цепочек наночастиц. Эти данные согласуются с результатами по определению размера и дисперсности САНЧ, полученными с помощью метода динамического светорассеяния.
Рис. 5.
Экдистероидсодержащие нанодисперсии САНЧ: a – контрольная нанодисперсия 1 (СТБ без 20E и без ГСХ); б – контрольная нанодисперсия 2 (СТБ, 2% ГСХ без 20E); в – нанодисперсия САНЧ с 5% 20Е + 2% ГСХ; г – нанодисперсия САНЧ с 10% 20Е + 2% ГСХ; д – нанодисперсия САНЧ с 15% 20Е + 2% ГСХ; е – нанодисперсия САНЧ с 20% 20Е + 2% ГСХ.

Таким образом, молекулы 20Е и САНЧ, стабилизированные ГСХ, образуют устойчивые дисперсии сферических наночастиц оптимального размера с узким распределением по размерам при концентрации 20Е 10% к массе СТБ, однако использованные методы не позволили получить однозначный ответ на вопрос о локализации 20Е в составе САНЧ. Изменение ζ-потенциала при увеличении загрузки 20Е с 5 до 10% косвенно свидетельствует о преимущественно поверхностной локализации 20Е.
Исследование включения 20Е в состав САНЧ. Говоря о локализации 20Е в нанодисперсиях СТБ, можно говорить по крайней мере о трех случаях: 20Е включается в состав наночастиц; 20Е находится в свободном виде в растворе; 20Е осаждается с избытком СТБ на стадии получения САНЧ.
Проведена количественная оценка включения 20Е в нанодисперсии с помощью УФ-спектроскопии на примере САНЧ с включенным 20Е в концентрации 10% к массе СТБ. Содержание 20Е в составе нанодисперсии рассчитывали с использованием метода абсолютной калибровки путем сравнения поглощения исследуемого раствора со стандартными растворами 20Е в максимуме поглощения (243 нм) 7-ен-6-оновой группы. Кофеат бетулина поглощает в этой области, поэтому необходимо было учитывать его вклад в поглощение при 243 нм. Для этого дисперсию разбавляли десятикратным избытком ТГФ для получения гомогенного раствора. Снимали электронный спектр в интервале от 200 нм. Измеряли поглощение при 243 нм и в максимуме поглощения кофеата бетулина 327 нм. По спектру чистого кофеата бетулина определили соотношение поглощения при этих длинах волн А243/А327 = 0.74. Поглощение 20Е рассчитывали по формуле А20Е = Аизм – А327 × × 0.74.
На рис. 6 показано, что все количество введенного 20Е полностью присутствует в нанодисперсии и не уносится с осадком избытка СТБ на стадии получения САНЧ.
ЗАКЛЮЧЕНИЕ
Нанодисперсии на основе тритерпеноидов бересты, стабилизированные гемисукцинатом холестерина, являются удобными наноразмерными транспортными системами для фитоэкдистероидов.
Оптимальной концентрацией модифицирующего агента 20Е является 10% к массе СТБ – максимальное значение, при котором сохраняется стабильность дисперсии. В этих условиях 20Е полностью включается в нанодисперсии СТБ, средние размеры САНЧ составляют 193.1 нм, характеризуются узким интервалом полидисперсности и по предъявляемым требованиям могут использоваться в медицине как пролонгированные формы экдистероидов в качестве радиопротекторных и других фармакологических средств.
Исследования выполнены по теме НИР Института биологии ФИЦ Коми научного центра УрО РАН (№ гос. регистрации АААА-А17-117121270025-1) и теме НИР Российско-Вьетнамского научно-исследовательского и технологического тропического центра “Биологически активные вещества тропических растений и микроорганизмов” (Эколан М-4.1).
Список литературы
Фитоэкдистероиды / Под ред. Володина В.В. Санкт-Петербург: Наука, 2003. 293 с.
Lafont R., Dinan L. // Insect. Sci. 2003. V. 3. № 7. 30 p.
Володин В.В., Володина С.О. // Фармацевтический бюллетень. Научно-практический журнал. 2015. № 3–4. С. 69.
Кудяшева А.Г., Володин В.В., Шевченко О.Г. и др. Противолучевое средство. Патент № 2326672 РФ. 20.06.08. Бюл. № 17.
Ковлер Л.А., Володин В.В., Политова Н.К. и др. // Докл. АН СССР. 1988. Т. 363. № 5. С. 641.
Краснопольский Ю.М., Григорьева А.С., Кацай А.Г. и др. // Российские нанотехнологии. 2017. Т. 12. № 7–8. С. 132.
Harshal R., Bhosale S., Derle Nikita D. // Int. J. Pharm. Sci. Res. 2012. V. 3. № 10. P. 3585.
Hochberg R.B., Pahuja S.L., Zielinski J.E. et al. // J. Steroid Biochem. Mol. Biol. 191. V. 40. № 3. P. 577.
Wim H. De Jong, Paul J.A. Borm. // Int. J. Nanomedicine. 2008. V. 3. № 2. P. 133.
Нанолекарства. Концепции доставки лекарств в нанонауке / Под ред. Лампрехт А., пер. с англ. Таратиной О.В. М.: Научный мир, 2010. 232 с.
Nanoparticulates as Drug Carriers / Ed. Torchilin V.P. London: Imperial College Press. 2006. 724 p.
Hao Zhong, Ging Chan, Yuanjia Hu et al. // Pharmaceutics. 2018. V. 10. № 4. P. 263. https://doi.org/10.3390/pharmaceutics10040263
Vijay Mishra, Kuldeep K. Bansal, Asit Verma et al. // Pharmaceutics. 2018. V. 10. № 4. P. 191. https://doi.org/10.3390/pharmaceutics10040191
Clogston J.D., Patri A.K. // Methods Mol. Biol. 2011. V. 697. P. 63. https://doi.org/10.1007/978-1-60327-198-1_6.PMID
Mehnert W., Mäder K. // Adv. Drug Deliv. Rev. 2012. V. 64. P. 83.
Yuan H., Wang L.-L., Du Y.-Z. et al. // Colloids Surf. B. 2007. V. 60. P. 174.
Chen G., Hou S., Hu P., Hu Q. et al. // J. South. Med. Univ. 2008. V. 28. P. 1022.
Araújo J., Nikolic S., Egea M.A., Souto et al. // Colloids Surf. B. 2011. V. 88. P. 150.
Каплун А.П., Безруков Д.А., Попенко В.И., Швец В.И. // Биофармацевтический журнал. 2011. Т. 3. № 2. С. 28.
Нгуен Х.К., Жданова К.А., Уварова В.С. и др. // Биоорганическая химия. 2015. Т. 41. № 2. С. 185.
Нгуен Х.К., Чупин В.В., Прохоров Д.И. и др. // Докл. РАН. 2015. Т. 464. С. 750. https://doi.org/10.7868/S0869565215300258
Чистяков А.Н., Преснова Г.А., Балакшин В.В., Каплун А.П. Композиция биологически активных веществ и способ получения нанодисперсии. Патент РФ 2322091. 20.04.2008. Бюл. № 11.
Iqbal M.A., Md S., Sahni J.K. et al. // J. Drug Target. 2012. V. 20. P. 813.
Schubert M., Müller-Goymann C. // Eur. J. Pharm. Biopharm. 2003. V. 55. P. 125.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии