Российские нанотехнологии, 2020, T. 15, № 1, стр. 118-124
НАНОРЕНТГЕНОЛЮМИНОФОРЫ НА ОСНОВЕ BaGdF5 ДЛЯ РЕНТГЕНОВСКОЙ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ В ОНКОЛОГИИ
Д. Ю. Кирсанова 1, *, В. В. Бутова 1, В. А. Поляков 1, П. В. Золотухин 1, А. А. Беланова 1, В. М. Легостаев 2, Е. А. Кучма 1, 2, З. М. Гаджимагомедова 1, А. В. Солдатов 1
1 Международный исследовательский институт интеллектуальных материалов,
Южный федеральный университет
Ростов-на-Дону, Россия
2 Национальный медицинский исследовательский центр онкологии Министерства здравоохранения РФ
Ростов-на-Дону, Россия
* E-mail: dkirs27@gmail.com
Поступила в редакцию 29.04.2020
После доработки 29.05.2020
Принята к публикации 29.05.2020
Аннотация
Для расширения возможностей фотодинамической терапии при лечении глубоко лежащих опухолей возможно применение излучений рентгеновского и гамма-диапазона. Одним из перспективных материалов для перевода рентгеновского излучения в оптическое являются допированные ионами редкоземельных элементов наночастицы BaGdF5. Показано, что сольвотермальный синтез и методика с использованием микроволнового излучения приводят к получению близких по своим характеристикам наночастиц BaGdF5:Eu, однако при использовании микроволнового излучения время синтеза уменьшается как минимум на порядок. Синтезированные микроволновым методом допированные наночастицы BaGdF5:Eu являются биосовместимыми и по своим размерам (порядка 6–14 нм) соответствуют требованиям последующего получения на их основе необходимых для рентгеновской фотодинамической терапии нанокомпозитов с фотосенсибилизаторами оптического диапазона.
ВВЕДЕНИЕ
Заболеваемость и смертность при злокачественных новообразованиях являются одними из самых социально значимых проблем как в России, так и за рубежом. По оценкам Всемирной организации здравоохранения (ВОЗ) в 2012 г. общее число случаев смерти от рака в Европейском союзе (ЕС) составило 1 283 101 [1]. На сегодняшний день в мире разработано множество подходов к лечению такого заболевания, как онкология. Традиционными способами лечения злокачественных опухолей являются хирургическое вмешательство, радиотерапия, химиотерапия или их комбинации. Недостатки этих методов – большое количество осложнений и высокий уровень смертности. Фотодинамическая терапия (ФДТ) появилась в качестве альтернативного метода лечения онкологических заболеваний и считается минимально инвазивным методом по сравнению с химиотерапией и лучевой терапией. Фотодинамическая терапия включает в себя три основных компонента: фоточувствительное вещество (фотосенсибилизатор, ФС), кислород и свет. Два компонента – ФС и свет – являются внешними факторами. Третьим необходимым компонентом фотодинамической реакции является эндогенный фактор – кислород. Фотосенсибилизатор инъекционно вводится пациенту, а затем избирательно накапливается в опухоли. Следующий этап – облучение опухолевой ткани видимым или ближним инфракрасным светом определенной длины волны, необходимой для активации ФС, что приводит к образованию активных форм кислорода (АФК) [2]. Активная форма кислорода – это группа высокоактивных химикатов, которые изменяют некоторые компоненты опухолевой стромы и в конечном итоге уничтожают раковые клетки [3], имеющие более высокий уровень окисления по сравнению с нормальными клетками [4]. Известно, что синглетный кислород 1O2 является ключевым цитотоксическим агентом в ФДТ, однако было высказано предположение, что и другие свободные радикалы могут играть главную роль в фотодинамическом повреждении клеток [5]. Использование ФДТ позволяет обеспечить максимальное количество здоровых клеток, лечить больных без хирургического вмешательства и уменьшить количество осложнений. Однако при всех достоинствах ФДТ его применение для лечения глубоких новообразований малоэффективно. Проблема заключается в сложности проникновения излучения оптического диапазона в глубь тканей. Традиционный видимый свет, используемый в ФДТ (спектральный диапазон 400–700 нм), ограничен поверхностными поражениями, и глубина проникновения света не превышает 1 см. Это приводит к тому, что во время обычной ФДТ удается обработать только поверхностные опухоли. Поэтому исследователи пытаются повысить эффективность ФДТ, особенно путем поиска новых источников проникающего глубже излучения [6].
Для увеличения глубины проникновения света и активации процесса ФДТ в глубоких тканях в качестве источника излучения могут быть использованы рентгеновские или гамма-лучи [7]. Эта методика, называемая рентгеновской фотодинамической терапией (РФДТ), обладает большим потенциалом для лечения опухолей внутренних органов. Данная терапия проводится по той же схеме, что и ФДТ, но основана она на использовании рентгеновских нанолюминофоров (сцинтилляционных наночастиц), которые под воздействием ионизирующего (в данном случае рентгеновского) излучения излучают свет в видимой области, который активирует сопряженный ФС посредством флуоресцентного резонансного переноса энергии и приводит к генерации АФК.
Чаще всего в научной литературе встречается использование для РФДТ люминесцентных материалов, основанных на излучении редкоземельных ионов [8]. Например, наночастицы фторида редкоземельных элементов (таких как BaGdF5) наиболее интересны и изучены в качестве материала-основы для легирования редкоземельными ионами (Eu3+, Sm3+ и др.). Это связано с тем, что наночастицы BaGdF5 обладают низкой токсичностью, низкой энергией фонона, многоцветной перестраиваемой люминесценцией, а также высокой устойчивостью к фотообесцвечиванию и фотохимическому разложению [9]. Это семейство материалов обладает перестраиваемыми характеристиками люминесценции [10–12] и достаточно хорошей биосовместимостью [13]. Также они способны эффективно преобразовывать ионизирующее излучение в видимую или ультрафиолетовую область за счет ступенчатого многофотонного процесса, происходящего в системе энергетических уровней ионов редкоземельных элементов, которые встроены в кристаллическую решетку основного вещества [14, 15]. Кроме того, окислительно-восстановительная стабильность ионов лантаноидов Ln3+ делает их подходящими для применения в клетках биологических тканей [16, 17], в том числе в человеческих эритроцитах [18]. Хотя некоторые исследователи считают более перспективными для РФДТ наночастицы на основе NaGdF4:Eu3+ [19].
В настоящей работе представлен новый метод синтеза нанорентгенолюминофоров для РФДТ на основе наночастиц BaGdF5 с использованием микроволнового реактора, а также изучена возможность легирования данного материала редкоземельным элементом Eu3+. Для полученных наночастиц проведено детальное исследование их характеристик, в том числе изучена их цитотоксичность.
МАТЕРИАЛЫ И МЕТОДЫ
Исходные вещества: хлорид гадолиния(III) GdCl3, хлорид европия(III) EuCl3, этиленгликоль, дигидрат хлорида бария BaCl2 ⋅ 2H2O, полиэтиленгликоль (ПЭГ, M = 1500 г/моль), фторид аммония NH4F.
Синтез проводили с использованием двух методик. Сольвотермальный метод был адаптирован из работы [20]. На его основе в настоящей работе был разработан новый микроволновый синтез данного материала. Детали синтеза образцов нанорентгенолюминофоров представлены в табл. 1.
Для получения образцов BaGdF5:Eu-ST и BaGdF5:Eu-MW 0.9 ммоль (237.2 мг) хлорида гадолиния(III) и 0.1 ммоль (25.8 мг) хлорида европия(III) растворяли в 20 мл этиленгликоля под действием ультразвука (10 мин). Затем к полученному раствору прибавляли 1 ммоль (244.2 мг) дигидрата хлорида бария, и полученную смесь перемешивали в течение 30 мин. После этого к смеси прибавляли 1.5 г ПЭГ и проводили обработку ультразвуком в течение 15 мин. Отдельно был приготовлен раствор 5.5 ммоль (203.7 мг) фторида аммония в 10 мл этиленгликоля. Смесь тщательно перемешивали и обрабатывали ультразвуком в течение 30 мин.
Далее в случае синтеза образца BaGdF5:Eu-ST полученную суспензию переносили в тефлоновый стакан стального автоклава, герметично закрывали и выдерживали 24 ч при температуре 200°С.
Для получения образца BaGdF5:Eu-MW полученную суспензию переносили в тефлоновую ампулу и помещали в микроволновую печь CEM Mars6. В течение 20 мин реакционную смесь нагревали до 200°С, затем выдерживали при данной температуре 2 ч. Использованная мощность микроволнового реактора составила 600 Вт.
Полученные осадки 3 раза промывали дистиллированной водой методом центрифугирования, а затем сушили при 60°С.
Данные рентгеновской порошковой дифракции были получены с помощью дифрактометра D2 Phaser (Bruker, США). Форма и размер частиц изучены с помощью просвечивающей электронной микроскопии (ПЭМ) на микроскопе Tecnai G2 Spirit BioTWIN (FEI, США). Элементный состав контролировали с помощью рентгеновского микрофлуоресцентного спектрометра M4 Tornado 2D (Bruker, США).
Анализ цитотоксичности и влияния исследуемых наноматериалов на окислительный статус клеток проводили на клетках человека линий HeLa и K562. Клетки культивировали в 24-луночных планшетах (SPL Lifesciences, Южная Корея) в среде GlutaMax DMEM (Thermo Fisher Scientific, США) с добавлением 10%-ной эмбриональной коровьей сыворотки (GE Healthcare, Великобритания), 50 МЕ/мл пенициллина и 50 мкг/мл стрептомицина (Thermo Fisher Scientific, США). Клетки инкубировали при 37°C и 5% углекислого газа в инкубаторе Sanyo MCO-18AC (Panasonic, Япония). Состояние культуры оценивали с помощью инвертированного микроскопа Premiere MIS-9000 (C&A, Китай).
Для анализа цитотоксичности материалов на клетках HeLa проводили тест с трипановым синим с оценкой на автоматическом анализаторе жизнеспособности клеток Countess II FL по протоколу производителя (Thermo Fisher Scientific, США). В ходе эксперимента стоковый раствор наноматериала в физрастворе вводили в культуральную среду до конечной концентрации 50 мкг/мл. В контрольной группе вместо раствора наноматериала вводили физраствор. Инкубацию в обеих группах проводили в течение 24 ч.
Проточную цитофлуориметрию выполняли на клетках K562. Клетки инкубировали с наноматериалом аналогично эксперименту по определению цитотоксичности, но в течение одного часа. Анализ проводили на проточном цитофлуориметре CytoFlex (Beckman Coulter, США) с применением следующих молекулярных зондов:
– CellRox Green – зонд на АФК митохондрий и ядра;
– Cell Rox Orange – зонд на цитозольные АФК;
– 7-AAD – контрольный краситель для детекции анализа популяции живых клеток.
Все красители использовали в соответствии с рекомендациями производителя (Thermo Fisher Scientific, США). В каждом образце анализировали не менее 10 000 событий. В анализ включали только события, морфологически характеризующиеся как живые синглеты умеренной грануляции – с гейтированием по каналам FSC-A, SSC-A, FSC-H, 7-AAD.
Нормализацию сигнала от молекулярных зондов проводили по каналу прямого светорассеяния.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Рентгеновская дифракция. Как видно из профилей порошковой рентгеновской дифракции, синтезированные образцы BaGdF5:Eu-ST и BaGdF5:Eu-MW представляют собой однофазные материалы со структурой, аналогичной литературным данным. Уширение пиков связано с мелким размером частиц. С помощью программы Jana2006 для образцов BaGdF5:Eu-ST и BaGdF5:Eu-MW рассчитаны параметры элементарной ячейки – 5.930(3) и 5.9431(19) Å соответственно. Данные значения оказались меньше заявленного в литературе параметра a = 6.023 Å для BaGdF5 [21]. Это объясняет тот факт, что при частичной замене Gd3+ на Eu3+ наблюдается смещение пиков в высокоугловую область, что в свою очередь соответствует уменьшению параметра элементарной ячейки.
Таким образом, использование стандартного сольвотермального метода и метода с использованием микроволнового излучения приводит к получению близких по своим структурным данным наночастиц, однако время синтеза с применением микроволнового излучения более чем на порядок меньше, чем в стандартном сольвотермальном подходе, что соответствует полученным ранее результатам для синтеза других классов наночастиц [22, 23].
Результаты электронной микроскопии. Полученные материалы BaGdF5:Eu-ST и BaGdF5:Eu-MW представляют собой сферические частицы размером 4–14 нм (рис. 1, рис. 2а, 2б), что вполне соответствует требованиям для получения на их основе нанокомпозитов для РФДТ, которые должны соединять нанолюминофоры и наночастицы ФС [24, 25]. Оценка распределения наночастиц по размерам была выполнена по данным ПЭМ, при этом проанализировано 760 частиц BaGdF5:Eu-ST и 1140 частиц BaGdF5:Eu-MW (рис. 2в, 2г). В результате выявлено, что наночастицы BaGdF5:Eu-ST характеризуются дисперсией в интервале 4–8 нм с преобладающей фракцией в 6 нм, а наночастицы BaGdF5:Eu-MW в свою очередь имеют размеры 6–14 нм с преобладающей фракцией, равной 10 нм. Таким образом, по своим размерам синтезированные наноматериалы подходят для целей последующего синтеза нанокомпозитов для рентгеновской фотодинамической терапии.
Рис. 1.
Профили порошковой рентгеновской дифракции синтезированных образцов BaGdF5:Eu-ST и BaGdF5:Eu-MW. Для сравнения приведен профиль BaGdF5 из базы данных PDF-2 (№24-0098).
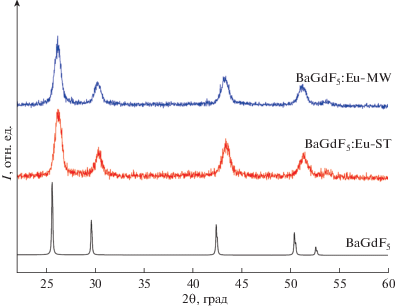
Рис. 2.
ПЭМ-изображения образцов BaGdF5:Eu-ST и BaGdF5:Eu-MW (а, б); распределение по размерам частиц BaGdF5:Eu-ST и BaGdF5:Eu-MW согласно данным ПЭМ (в, г).

Результаты рентгенофлуоресцентного анализа (РФА). Соотношение металлов, закладываемое в синтезе BaGdF5:Eu-MW, составляет Ba:Gd:Eu 1:0.9:0.1. Соотношение, определенное с помощью РФА, составило 1:0.9:0.08. Отклонения от стехиометрии связаны, по-видимому, с разницей ионных радиусов гадолиния и вводимых ионов европия (радиусы ионов Gd3+ и Eu3+ равны 0.0938 и 0.0947 нм соответственно).
Результаты анализа цитотоксичности материалов. С помощью метода оценки целостности мембран с окрашиванием трипановым синим была определена токсичность синтезированного наноматериала в эксперименте in vitro – на малигнизированных клетках человека линии HeLa (рис. 3).
Рис. 3.
Жизнеспособность клеток HeLa в контроле и после воздействия синтезированными наноагентами в конечной концентрации 50 мкг/мл в течение 24 ч. Планки погрешности соответствуют стандартному отклонению. * – различия статистически значимы, p = 0.002.
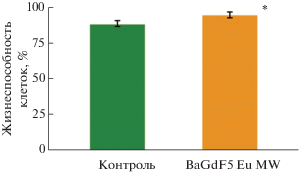
В результате исследования установлено, что образец [BaGdF5:Eu-MW] повышал жизнеспособность культуры клеток HeLa на 8% (p = 0.002).
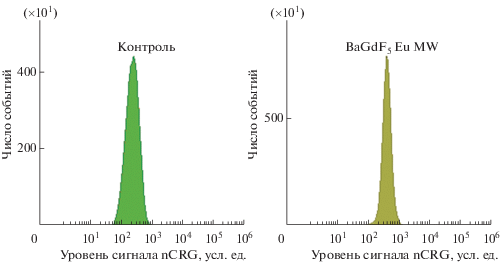
Результаты анализа индукции наноматериалами генерации АФК в клетках in vitro. Анализ по каналам CRO (рис. 4) и CRG (рис. 5) проводили с нормализацией по размеру клеток (канал FSC, площадь под кривой; параметры nCRO и nCRG соответственно) и только в области положительного сигнала целевых зондов (гейты CRO+ и CRG+ соответственно), т.е. с аналитической компенсацией автофлуоресценции. Использование такого алгоритма позволяет повысить аналитическую чувствительность и специфичность метода, а также компенсировать различия между уровнем сигнала и реальными функциональными параметрами клеток разного размера.
Рис. 4.
Примеры гистограмм распределения клеток по интенсивности сигнала nCRO+ (нормализованные на размер клеток уровни АФК цитозоля) клеток K562 в контроле и после воздействия синтезированными наноагентами в конечной концентрации 50 мкг/мл в течение одного часа.
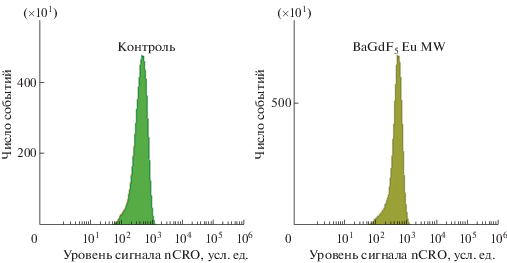
Рис. 5.
Примеры гистограмм распределения клеток по интенсивности сигнала nCRG+ (нормализованные на размер клеток уровни АФК митохондрий и ядер) клеток K562 в контроле и после воздействия синтезированными наноагентами в конечной концентрации 50 мкг/мл в течение одного часа.
В количественном анализе в качестве числового параметра использовали медианный уровень сигнала – как наиболее репрезентативный при потенциальных качественных и количественных влияниях наноагента на физиологические параметры клеток.
Как видно по характеру гистограмм в канале CRO (уровни АФК цитозоля), контрольная и опытная группы имеют некоторые различия в характере влияния на отдельные популяции клеток – пики гистограмм в опытной группе более узкие, с характерным смещением популяций клеток в сторону увеличения сигнала.
Исследование в канале CRG подтвердило наблюдаемые в канале CRO качественные различия между исследуемыми группами, в этом случае различия были намного более выраженными.
Количественный анализ показал, что исследуемые группы действительно имеют выраженные различия параметров окислительного статуса клеток модельной линии – в первую очередь в генерации АФК в ядре и митохондриях (табл. 2).
Таблица 2.
Нормализованная интенсивность сигналов CRO и CRG в клетках после воздействия наноагента в течение одного часа и в контроле
| Группа | Анализируемый параметр | |||
|---|---|---|---|---|
| Канал CRO | Канал CRG | |||
| M±SD*, усл. ед. | pMW** | M±SD, усл. ед. | pMW | |
| Контроль | 462.6±53.31 | 264.67±36.97 | ||
| BaGdF5:Eu-MW | 507.6±14.77 | 0.065 | 421.75±22.31 | 0.002 |
Если различия по продукции АФК в цитозоле лишь приближались к порогу значимости, то в ДНК-содержащих органеллах продукция АФК возрастала примерно на 60%.
В результате исследования цитотоксичности установлена перспективность для дальнейшего применения наночастиц BaGdF5:Eu-MW даже без покрытия. Более того, наноагент не просто не был токсичным – он статистически значимо повышал жизнеспособность клеток почти на 8%. Как правило, такая картина наблюдается при стимуляции действующим агентом защитных каскадов клетки.
В связи с этим с помощью проточной цитофлуориметрии была исследована АФК-индуцирующая способность наноагента. В ходе этого эксперимента клетки K562 в течение одного часа инкубировали вместе с наночастицами – это стандартное время индукции первичной волны АФК под действием редокс-активных агентов. В результате исследования установлено, что в пользу способности изучаемого наноагента к стимуляции защитных систем клетки свидетельствовала слабо повышенная индукция АФК в цитозоле на фоне значительного повышения АФК ДНК-содержащих органелл. Такая картина свидетельствует о классическом варианте дифференциальной активации защитных систем клетки. Более того, такая разница в физиологической активности интересна тем, что цитозольные защитные системы клеток будут отвечать на воздействие гораздо слабее, чем фактически требуется – из-за более низкой степени индукции АФК цитозоля и значительно более ограниченного спектра АФК-сенсоров в ядре и митохондриях по сравнению с цитозолем. Как следствие, такие агенты способны вызывать эффективное повреждение ДНК ядра и митохондрий и вызывать клеточную гибель разными механизмами – от метаболической катастрофы и до некроза и автошизиса – на фоне внесения дополнительных повреждений в ДНК клеток даже в случае интенсифицированной работы их антиоксидантных систем.
Таким образом, описанная для BaGdF5:Eu-MW способность к индукции генерации активных форм кислорода в ДНК-содержащих органеллах после проникновения в клетки является одним из важнейших для биомедицинских применений параметров наночастиц. Информация об этом свойстве синтезированного наноагента позволяет, с одной стороны, разработать протокол заблаговременной адаптации немалигнизированных клеток организма (отличающихся от малигнизированных по способности реагировать на прооксидантные смещения окислительного статуса) и, с другой стороны, использовать выявленные свойства как дополнительную терапевтическую модальность при РФДТ.
ЗАКЛЮЧЕНИЕ
Применение стандартного сольвотермального метода и методики с использованием микроволнового излучения приводит к получению близких про своим структурным данным наночастиц BaGdF5 размером порядка 6–14 нм. Однако при использовании микроволнового излучения время синтеза уменьшается как минимум на целый порядок. По своим размерным характеристикам данные наночастицы соответствуют требованиям к последующему получению на их основе нанокомпозитов для рентгеновской фотодинамической терапии. Синтезированные наночастицы BaGdF5:Eu-MW являются вполне биосовместимыми и не оказывают значимого негативного влияния на жизнеспособность клеток линий HeLa и K562.
Работа выполнена при поддержке Российского научного фонда (проект № 19-15-00305).
Список литературы
Malvezzi M., Bertuccio P., Levi F. et al. // Ann. Oncology. 2012. V. 23. № 4. P. 1044.
Ashen-Garry D., Selke M. // Photochem. Photobiol. 2014. V. 90. № 2. P. 257.
Abliz E., Collins J.E., Bell H., Tata D.B. // J. X-ray Sci. Technol. 2011. V. 19. № 4. P. 521.
Yang Y., Karakhanova S., Werner J., Bazhin A.V. // Curr. Med. Chem. 2013. V. 20. № 30. P. 3677.
Sapre A.A., Novitskaya E., Vakharia V. et al. // Mater. Lett. 2018. V. 228. P. 49.
Mordon S., Cochrane C., Tylcz J.B. et al. // Photodiagnosis and Photodynamic Therapy. 2015. V. 12. № 1. P. 1.
Bulin A.-L., Truillet C., Chouikrat R. et al. // J. Phys. Chem. C. 2013. V. 117. № 41. P. 21583.
Chen M.H., Jenh Y.J., Wu S.K. et al. // Nanoscale Res. Lett. 2017. V. 12. № 1. P. 62.
Guan H., Sheng Y., Song Y. et al. // RSC Advances. 2016. V. 6. № 77. P. 73160.
Li H., Liu G., Wang J. et al. E // J. Luminescence. 2017. V. 186. P. 6.
Yanes A.C., del-Castillo J., Ortiz E. // J. Alloys Compd. 2019. V. 773. P. 1099.
Huang X., Jiang L., Li X., He A. // J. Alloys Compd. 2017. V. 721. P. 374.
Becerro A.I., Gonzalez-Mancebo D., Cantelar E. et al. // Langmuir. 2016. V. 32. № 2. P. 411.
Hao S., Chen G., Yang C. // Theranostics. 2013. V. 3. № 5. P. 331.
Hamblin M.R. // Dalton Trans. 2018. V. 47. № 26. P. 8571.
Teo R.D., Termini J., Gray H.B. // J. Med. Chem. 2016. V. 59. № 13. P. 6012.
Yang D., Dai Y., Liu J. et al. // Biomaterials. 2014. V. 35. № 6. P. 2011.
Grzyb T., Mrowczynska L., Szczeszak A. et al. // J. Nanopart Res. 2015. V. 17. № 10. P. 399.
Bakhmetyev V.V., Dorokhina A.M., Keskinova M.V. et al. // Chemical Papers. 2019. V. 74. № 3. P. 787.
Sudheendra L., Das G.K., Li C. et al. // Chem. Mater. 2014. V. 26. № 5. P. 1881.
International Centre for Diffraction Data (ICDD). База данных PDF-2. Карточка № 24-0098. https://www.icdd.com/
Butova V.V., Polyakov V.A., Bulanova E.A. et al. // Microporous Mesoporous Mater. 2020. V. 293.
Butova V.V., Vetlitsyna-Novikova K.S., Pankin I.A. et al. // Microporous Mesoporous Mater. 2020. V. 296.
Kirsanova D.Yu., Gadzhimagomedova Z.M., Maksimov A.Y., Soldatov A.V. // Nanomaterials for deep tumor treatment. 2020. Manuscript submitted for publication.
Gadzhimagomedova Z.M., Kit O.I., Zolotikhin P.V. et al. // Nanocomposites for X-ray photodynamic therapy. 2020. Manuscript submitted for publication.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


