Российские нанотехнологии, 2020, T. 15, № 1, стр. 108-117
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ И БЕЗОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ НАНОЧАСТИЦ СЕЛЕНА, ИНКАПСУЛИРОВАННЫХ В МАКРОМОЛЕКУЛЫ КРАХМАЛА
А. И. Перфильева 1, *, О. А. Ножкина 1, М. С. Третьякова 1, И. А. Граскова 1, И. В. Клименков 2, Н. П. Судаков 2, Г. П. Александрова 3, Б. Г. Сухов 3
1 Сибирский институт физиологии и биохимии растений СО РАН
Иркутск, Россия
2 Лимнологический институт СО РАН
Иркутск, Россия
3 Иркутский институт химии им. А.Е. Фаворского СО РАН
Иркутск, Россия
* E-mail: alla.light@mail.ru
Поступила в редакцию 10.03.2020
После доработки 10.03.2020
Принята к публикации 26.05.2020
Аннотация
Изучена биологическая активность наночастиц селена, инкапсулированных в матрицу крахмала (НК Se/Кр), в отношении бактерии, вызывающей кольцевую гниль картофеля Clavibacter sepedonicus (Cms) и растений картофеля in vitro. Обнаружено, что НК Se/Кр состоит из сферических наночастиц селена широкого диапазона размерности, образующих кластеры. НК Se/Кр обладает бактерицидной и антибиопленочной активностью к бактерии Cms. Эксперименты, проведенные на растениях, показали стимулирующее влияние НК Se/Кр на биометрические показатели. Нанокомпозит снижал негативный эффект заражения картофеля Cms благодаря усилению защитных функций растений. Установлено отсутствие накопления селена в тканях картофеля после его обработки НК Se/Кр. Выявлено, что НК Se/Кр не подавляет жизнеспособность почвенных бактерий Acinetobacter guillouiae и Rhodococcus erythropolis. Полученные результаты позволяют рассматривать НК Se/Кр как эффективный и экологически безопасный агент для стимуляции развития сельскохозяйственных растений благодаря целевой низкодозной доставке антимикробных наноселеновых биокомпозитов к бактериальным фитопатогенам.
ВВЕДЕНИЕ
В связи с глобальным изменением климата в северных и восточных территориях расширяется ареал обитания фитопатогенных организмов [1–3]. Одним из таких патогенов является грамположительная бактерия Clavibacter michiganensis ssp. sepedonicus (Cms), вызывающая заболевание картофеля – кольцевая гниль [4], которая, согласно новой классификации, обозначается как Clavibacter sepedonicus [5]. У инфицированных растений наблюдается вилт стеблей, пожелтение листьев и значительное снижение урожайности [4]. На сегодняшний день не найдено эффективных методов регуляции численности Cms. Обеззараживающие мероприятия, как правило, носят превентивный характер, включают в себя применение агрессивных агентов. Также осуществляется удаление больных растений с полей ручным методом [6, 7]. В связи с этим важно разработать экологически безопасный способ на основе химических соединений по оздоровлению культурных растений от бактериозов, в частности картофеля от кольцевой гнили.
В качестве потенциальных агентов для этих целей интересно применение нанокомпозитов (НК) – комплекса наночастиц (НЧ) с полимерными матрицами. Такая конструкция соединений является выигрышной, так как в НК токсичные НЧ плотно упакованы в безопасную для растений матрицу природного происхождения и способны высвобождаться под действием экзоферментов бактерий, убивая их. В качестве матриц НК перспективно применение полисахаридов. Это обусловливается не только их безвредностью для человека и животных, но и их антибактериальными свойствами. Имеются сведения об антимикробной активности полисахаридов в отношении патогенов человека и животных, как грамположительных, так и грамотрицательных микроорганизмов [8, 9]. Считается, что такая активность связана с кислотным разрушением поверхностных структур бактериальной клетки и нарушением адгезии бактерий к субстрату [10, 11].
В качестве матрицы для НЧ в нанокомпозитах перспективно использование крахмала, так как он относится к безопасным для человека и животных растворимым пищевым волокнам. Кроме того, он является наиболее предпочтительным питательным субстратом для Cms. Имеются исследования биологической активности веществ с использованием крахмала. Так, на основе очищенного кукурузного крахмала было синтезировано новое биологически активное вещество – сульфаминовое производное, обладающее антимикробным эффектом в концентрации 50 мг/мл к следующим микроорганизмам: Staphylococcus aureus, Staphylococcus epidermidis, Escherichia coli, Proteus vulgaris, Streptococcus faecalis и Streptococcus pyogenes [12]. Крахмал используется для создания препаратов, применяемых в медицине и ветеринарии. Например, с помощью плазменной технологии на основе НЧ меди и серебра в комплексе с крахмалом синтезирован порошкообразный препарат с антибактериальным эффектом для регенерации мягких тканей [13]. Разработаны добавки к пище для кур-несушек и цыплят-бройлеров в виде йодистого крахмала [14, 15]. Таким образом, крахмал является хорошо зарекомендовавшим себя веществом в качестве матрицы НК.
В [16–19] был исследован ряд НК селена с природными матрицами – арабиногалактаном и каррагинаном, содержание НЧ селена в которых варьировалось от 1.23 до 6.4%. Наличие явного антибактериального эффекта выявлено только у некоторых НК [16]. Возможно, это связано с неспецифичностью матриц НК из арабиногалактана или каррагинана как пищевого субстрата для Cms. В некоторых случаях отмечалась стимуляция прироста растений картофеля in vitro под влиянием НК [16, 19]. В [20] были проведены предварительные исследования НК селена и крахмала на жизнеспособность Cms, в которых показан его значительный антибактериальный эффект.
Цель настоящей работы – изучить влияние НК селена на основе крахмала с высоким содержанием НЧ селена (12.0%) на возбудитель кольцевой гнили Clavibacter sepedonicus, растения картофеля in vitro, а также исследовать безопасность его применения для окружающей среды.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез НК селена на основе крахмала (НК Se/Кр) осуществляли на основе водорастворимого крахмала (Sigma-Aldrich, USA) по описанной ранее методике [20]. К раствору крахмала (500 мг) в 30 мл воды со средней молекулярной массой 342 кДа добавляли при перемешивании раствор 12 мг H2SeO3 в 3 мл воды. Через 10 мин добавляли 5 мг NaBH4 и выдерживали при комнатной температуре в течение 15 мин. Образовавшийся НК высаживали в четырехкратный объем 95% этилового спирта и промывали. Получали серый порошок с содержанием селена 12.0% (выход 89%). Для экспериментов использовали растворы НК Se/Кр, в которых содержание селена составляло 0.000625% в конечной концентрации.
Культивирование растений картофеля. Влияние НК Se/Кр изучали на растениях картофеля in vitro сорта Лукьяновский, восприимчивого к Сms [21]. Микроклональное размножение пробирочных растений осуществляли с помощью черенкования на агаризованной питательной среде Мурасиге–Скуга (Sigma, USA). Растения культивировали в факторостатных условиях в течение 20 сут при 26°С и освещенности 5–6 кЛк.
Бактерии. Использовали штамм Clavibacter sepedonicus (Сms) Ac-1405, возбудителя кольцевой гнили картофеля (получен из Всероссийской коллекции микроорганизмов, г. Пущино, Московская обл.). Бактерии Cms выращивали на среде с глюкозой, пептоном и дрожжевым экстрактом (GPY) [22]. Влияние НК Se/Кр на биопленкообразование Cms исследовали с применением планшетного метода [23].
Бактерии Acinetobacter guillouiae и Rhodococcus erythropolis были выделены из ризосферы Пырея ползучего (Elytrigia repens), произрастающего на нефтезагрязненной территории Заларинского района Иркутской области (п. Тыреть), Россия. Бактерии культивировали в течение одних суток в темноте на твердой среде, состоящей из агара, ферментативного гидролизата говяжьего мяса, и жидкой питательной среде аналогичного состава. Для исследования бактериостатической активности НК Se/Кр в отношении почвенных бактерий их жидкую культуру инкубировали в аэрируемых условиях (80 об./мин) в темноте при 26°С, измеряя оптическую плотность бактериальной суспензии при 595 нм в динамике: в начале инкубации и через 2, 4, 6, 8, 24, 28, 48, 52 и 72 ч.
Схема эксперимента с растениями. Для проведения эксперимента в среду роста картофеля вносили водный раствор НК Se/Кр. В вариантах с заражением в среду роста вносили односуточную бактериальную суспензию Cms. Растения инкубировали 26 сут, отслеживая каждые двое суток биометрические показатели (длину растений и количество листьев, длину междоузлий, массу корней и массу вегетативной части).
Активность гвояколзависимой пероксидазы определяли по методу Бояркина [24]. Активность фермента измеряли спустя 60 мин коинкубации растений с НК Se/Кр.
Для выявления областей продукции активных форм кислорода (АФК) растения заражали Cms, выдерживали четверо суток, затем обрабатывали НК Se/Кр, спустя 1 ч кокультивирования осуществляли подготовку проб для анализа. Образцы ткани корня растений инкубировали 30 мин с 5 мкM CellROX Deep Red Reagent (ex/em 644/665 nm) (Thermo Fisher Scientific Inc., USA), растворенном в фосфатном буфере. Далее ткань фиксировали 2%-ным параформальдегидом в течение 15 мин. Полученные препараты заключали в ProLong Gold antifade reagent (Thermo Fisher Scientific Inc., USA) и исследовали на конфокальном микроскопе LSM 710 (Zeiss, Germany). Для исследования применяли лазеры 405, 561 нм и фильтры Ch1 410–522.
Определение содержания первичных продуктов перекисного окисления липидов (ПОЛ) – диеновых конъюгатов в тканях картофеля проводили по методике [25] с использованием гексана и изопропанола спустя 30 и 60 мин после внесения раствора НК Se/Кр в среду роста картофеля in vitro.
Методика пробоподготовки для рентгеновского спектрального энергодисперсионного микроанализа (РСЭДМА). Растение заражали Cms. Через двое суток, когда оно было полностью колонизировано патогеном, его обрабатывали НК Se/Кр. Спустя двое суток кокультивирования в факторостатных условиях осуществляли подготовку проб для анализа. Пробы, полученные из растертой и слегка подсушенной растительной ткани, наклеивали на электропроводный клей и помещали в камеру для съемки при помощи электронного сканирующего микроскопа Hitachi ТМ 3000 с X-детектором SDD Xflash 4304, где они подвергались электронному удару. С помощью пучка электронов атомы исследуемого образца возбуждались, испуская характерное для каждого химического элемента рентгеновское излучение. Исследуя энергетический спектр такого излучения, делали выводы о качественном и количественном составе образца.
Электронная микроскопия. НК Se/Кр растворяли в воде, после чего наносили на сетки с формваровыми подложками и высушивали. Подготовленные пробы исследовали с помощью просвечивающего электронного микроскопа (ПЭМ) LEO 906E (Carl Zeiss, Германия) при ускоряющем напряжении 80 кВ. Микрофотографии получали камерой MegaView II и обрабатывали с помощью программного обеспечения Mega Vision.
Полученные данные подвергали статистической обработке с использованием пакета программ MS Excel.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтезированный НК Se/Кр по данным рентгенофазового анализа представлял собой рентгеноаморфный порошок серого цвета. Наночастицы селена, визуализированные в ПЭМ, имели округлую форму. Размер частиц варьировал в интервале 20–90 нм со средним значением 40 нм. Наночастицы селена равномерно распределены в полисахаридных матрицах. Установлено, что НЧ селена способны образовывать кластеры (рис. 1).
Ранее было показано, что НК Se/Кр обладает бактериостатическим эффектом по отношению к Cms. При использовании красителя пропидий иодид, окрашивающего мертвые клетки, было выявлено, что доля мертвых клеток в суспензии с НК Se/Кр достигала от 33 до 59% в поле зрения ПЭМ. Отмечена деформация бактериальных клеток. Так, их длина по сравнению с контролем значительно уменьшалась, а ширина увеличивалась на 9–22% [20]. Это свидетельствует о токсичности исследуемого НК селена и его высокой биодоступности, вероятно, вследствие наличия полисахаридной крахмальной матрицы.
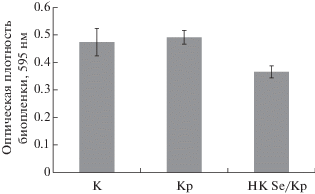
Важным аспектом патогенности кольцевой гнили является биопленкообразование. Благодаря этой способности бактерии скапливаются в сосудах ксилемы растений, вызывая их закупоривание, что приводит к вилту стеблей [4]. В связи с этим изучено влияние НК Se/Кр на способность Cms образовывать биопленки. Выявлено, что крахмал не влиял на биопленкообразование Cms, НК Se/Кр снижал этот процесс (рис. 2). Таким образом, продемонстрировано широкое антибактериальное действие НК Se/Кр по отношению к фитопатогену Cms – бактериостатический эффект, эффект нарушения морфологии бактериальных клеток [20] и антибиопленочный эффект.
Рис. 2.
Биопленкообразование бактерий Cms под влиянием НК Se/Кр. К – контроль, Кр – бактерии Cms после инкубации с крахмалом, НК Se/Кр – бактерии Cms после инкубации с НК Se/Кр.
Следующий этап исследования – оценка влияния НК Se/Кр на растения, зараженные возбудителем кольцевой гнили картофеля. Были измерены биометрические характеристики растений. НК Se/Кр не оказывал влияния на прирост здоровых растений в течение всего эксперимента (рис. 3). Заражение растений Cms снижало прирост растений. Обработка НК Se/Кр зараженного Cms картофеля на начальном этапе наблюдения не оказывала воздействия на прирост, но спустя 20 сут инкубации снизила негативный эффект заражения (рис. 3а).
Рис. 3.
Влияние заражения Cms и обработки НК Se/Кр на прирост растений картофеля (а), длину междоузлий (б), массу корней (в), массу вегетативной части (ВЧ) (г). К – контроль, Б – растения картофеля, зараженные Cms, НК Se/Кр – растения картофеля, обработанные НК Se/Кр, Б + НК Se/Кр – зараженные Cms растения картофеля, обработанные НК Se/Кр.

Рис. 3.
Окончание.
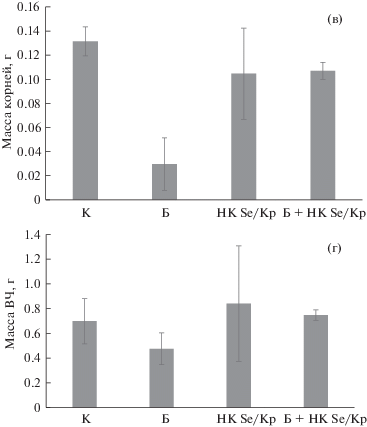
Вторым использованным биометрическим показателем было количество листьев у растений картофеля, подвергнутых обработке НК Se/Кр и его предшественниками. Достоверного воздействия как заражения Cms, так и обработки растений НК на количество листьев выявлено не было. При этом не наблюдалось эффекта “вытягивания” растений. Наоборот, при обработке здорового картофеля НК отмечалось увеличение количества узлов кущения по сравнению с контролем. Заражение растений Cms способствовало уменьшению длины междоузлий. Не выявлено какого-либо влияния на исследуемый показатель растений при совместном действии НК и Cms (рис. 3б). При завершении эксперимента была измерена масса надземной части растений и их корней (рис. 3в, 3г). Обнаружено, что заражение растений снижало биомассу корней и вегетативной части. НК Se/Кр не оказывал влияния на биомассу как вегетативной части растений, так и корней. Обработка НК Se/Кр растений, зараженных Cms, снижала негативный эффект заражения по отношению к контролю. Таким образом, показано отсутствие негативного воздействия НК Se/Кр на биометрические характеристики картофеля in vitro. В случае добавления НК Se/Кр к зараженным растениям негативный эффект заражения снижался.
Для выявления механизмов воздействия НК Se/Кр на защиту растений от стрессовых факторов были исследованы изменение активности пероксидазы, содержание АФК и содержание продуктов ПОЛ в тканях картофеля, инфицированного Cms и подвергнутого обработке НК. На рис. 4 представлены результаты воздействия НК Se/Кр на активность пероксидазы в тканях листьев картофеля. Известно, что пероксидаза является очень чувствительным ферментом к различным стрессовым факторам, поэтому некоторые исследователи предлагают использовать его для оценки устойчивости организма к стрессу [26–28]. Выявлено, что заражение Cms несколько повышает активность фермента. Обработка растений НК Se/Кр влияет на активность фермента в тканях картофеля, внесение НК к здоровым растениям приводило к повышению активности фермента приблизительно в 2 раза. Добавление НК Se/Кр к зараженным Cms растениям демонстрирует еще большее повышение активности фермента по сравнению с вариантом опыта – зараженные растения без обработки НК. Такой результат свидетельствует об усилении защитной реакции растения при биотическом стрессе под влиянием НК Se/Кр (рис. 4).
Рис. 4.
Влияние НК Se/Кр на активность пероксидазы в тканях листьев картофеля. К – контроль, Б – растения картофеля, зараженные Cms, НК Se/Кр – растения картофеля, обработанные НК Se/Кр, Б + НК Se/Кр – зараженные Cms растения картофеля, обработанные НК Se/Кр.

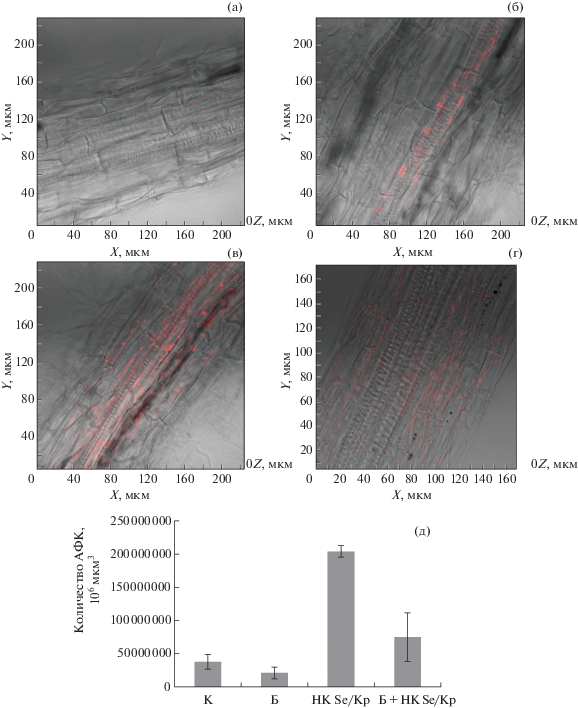
Известно, что АФК являются одними из первых молекул, свидетельствующих о наличии стрессового состояния у растений [29–31]. Для оценки уровня стресса с помощью АФК были использованы растения, больные кольцевой гнилью. Они были полностью колонизированы патогеном, так как с момента их заражения прошло четверо суток, и в этот период времени повышения АФК в тканях корня у них уже не было зафиксировано (рис. 5б). Наблюдаемая картина вполне объяснима, поскольку известно, что уровень АФК значительно поднимается на начальном этапе ответа растения на воздействие стрессового фактора [29–31]. Если здоровые растения подвергали обработке НК Se/Кр, наблюдали значительное увеличение количества АФК в тканях корня картофеля более чем в 4 раза по сравнению с контрольными значениями (рис. 5в). Очевидно, это говорит о повышении защитной реакции клеток растений на стресс благодаря влиянию НК Se/Кр. В случае обработки НК растений, больных кольцевой гнилью, также было отмечено повышение содержания АФК. Полученный результат указывает на активизацию защитных функций растительного организма при стрессе.
Рис. 5.
ПЭМ-изображение влияния НК Se/Кр на образование АФК в тканях растений картофеля, неинфицированного (а), инфицированного Cms (б), обработанного НК Se/Кр (в), обработанного НК Se/Кр и инфицированного Cms (г). Количество АФК, образовавшегося в тканях картофеля при воздействии Cms (Б, Б + НК Se/Кр) и нанокомпозита селена (НК Se/Кр, Б + НК Se/Кр) (д). К – контроль, Б – растения картофеля, зараженные Cms, НК Se/Кр – растения картофеля, обработанные НК Se/Кр, Б + НК Se/Кр – зараженные Cms растения картофеля, обработанные НК Se/Кр.
Высокое количество АФК способно спровоцировать биохимическое повреждение клеток – перекисное окисление липидов [32]. Содержание продуктов ПОЛ некоторыми исследователями предлагается применять в качестве показателя степени повреждения клеток растений при стрессе [33]. Было исследовано влияние НК Se/Кр на содержание диеновых конъюгатов в тканях корня и листьев картофеля. Обработка растений НК Se/Кр не приводила к выраженному изменению содержания диеновых конъюгатов в корнях и листьях картофеля через 30 и 60 мин после внесения НК в среду роста растений (табл. 1). Полученные данные указывают на отсутствие отрицательного влияния НК Se/Кр на липидные компоненты клеток растений.
Таблица 1.
Изменение содержания диеновых конъюгатов в тканях картофеля под влиянием НК Se/Кр, Нм/г сырого веса
| Контроль | 30 мин после обработки НК Se/Кр | 60 мин после обработки НК Se/Кр | |
|---|---|---|---|
| Корни | 0.292162 ± 0.048961 | 0.399900 ± 0.054030 | 0.473736 ± 0.094216 |
| Листья | 0.35629 ± 0.092847 | 0.4515 ± 0.047357 | 0.425678 ± 0.111608 |
Таким образом, изучение влияния исследуемого нанокомпозита на картофель свидетельствует об отсутствии негативного эффекта НК Se/Кр на картофель как зараженный Cms, так и свободный от инфекции. Обработка здоровых растений НК Se/Кр способствовала повышению защитных функций организма благодаря усилению продукции АФК в тканях корня, причем такое количество АФК не приводило к повреждению липидов мембран растительных клеток. Обработка НК Se/Кр зараженных растений снижала концентрацию АФК, что доказывает ингибирующий эффект НК Se/Кр по отношению к возбудителю кольцевой гнили.
Следующий этап работы посвящен исследованию безопасности НК Se/Кр для окружающей среды. Большинство применяемых в сельском хозяйстве пестицидов накапливается в семенах и плодах культурных растений [34, 35], проникает в водоемы [36] и почву [37, 38], негативно влияя на ее обитателей [39, 40]. Накопление действующих веществ пестицидов в плодах культурных растений является серьезной проблемой используемых сейчас препаратов [41]. В связи с этим необходимо проверить, накапливается ли селен в тканях картофеля после обработки НК Se/Кр. Были проведены эксперименты по выявлению селена в тканях картофеля методом РСЭДМА спустя одни сутки после обработки. Для чего провели расчет количества обнаруженных биогенных элементов (углерод, кислород, азот, фосфор, магний, селен) в тканях картофеля. Был проведен анализ следующих вариантов – контрольные растения; растения, зараженные Cms; растения, обработанные НК Se/Кр; растения, зараженные Cms и обработанные НК Se/Кр. Во всех исследуемых пробах селена выявлено не было. Полученный результат свидетельствует о безопасности обработки растений НК Se/Кр в используемой концентрации.
Также было изучено влияние НК Se/Кр на жизнеспособность ризосферных микроорганизмов Acinetobacter guillouiae и Rhodococcus erythropolis, обитающих не только в ризосфере растений, но и встречающихся в почве. В почве они способны осуществлять биодеструкцию углеводородов, биоремедиацию почв [41–44]. Кроме того, родококк обладает фитостимулирующей активностью [45]. Так, при обработке семян микроорганизмом Rhodococcus erythropolis всхожесть семян редьки масличной в условиях нефтезагрязнения повышалась на 25% относительно контроля, длина корня увеличивалась на 50%, высота надземной части и ее масса на 40%. Это свидетельствует о снижении ингибирующего действия нефти на растение. Rhodococcus erythropolis проявлял высокие фитозащитные свойства, снижая негативное влияние нефти на растения редьки масличной. Проведенные в настоящей работе эксперименты демонстрируют отсутствие бактериостатического эффекта НК Se/Кр по отношению к исследуемым микроорганизмам (рис. 6). Изучено наличие бактерицидного и антибиопленочного эффектов НК Se/Кр по отношению к исследуемым ризосферным бактериям. В результате проведенных экспериментов негативного воздействия НК Se/Кр на жизнеспособность бактерий и их биопленкообразование выявлено не было. Различный эффект НК Se/Кр на ризосферные бактерии и патоген Cms, вероятно, связан с природой исследуемых микроорганизмов. A. guillouiae и R. erythropolis, как микроорганизмы, обитающие в почве, обладают высокой биологической активностью: являются биоремедиантами, способны снижать негативное влияние углеводородов на растения [45], оказывать фитостимулирующий эффект благодаря выработке фитогормонов, поверхностно активных веществ и биосурфактантов [46]. Возможно, изучаемые ризосферные бактерии из-за наличия в их клетке плазмид [47] обладают высокой устойчивостью к действию различных стрессовых факторов, что предстоит доказать в будущих исследованиях.
Рис. 6.
Влияние заражения обработки НК Se/Кр на прирост ризосферных бактерий Acinetobacter guillouiae (A. q.) и Rhodococcus erythropolis (R. e.).

Таким образом, представленные результаты демонстрируют наличие у НК Se/Кр антибиопленочного эффекта по отношению к фитопатогену Cms. Не наблюдалось негативного влияния НК на биометрические характеристики здоровых растений картофеля in vitro. Отмечено снижение негативного эффекта заражения растений Cms в результате обработки НК Se/Кр. Кроме того, показано, что селен не накапливается в тканях картофеля после их обработки композитом. Отсутствует негативное влияние НК Se/Кр на жизнеспособность ризосферных бактерий. Полученные данные позволяют сделать заключение о возможности рассматривать НК Se/Кр в качестве эффективного и экологически безопасного вещества для регуляции численности бактериозов культурных растений.
Работа выполнена с использованием коллекций ЦКП “Биоресурсный центр” Сибирского института физиологии и биохимии растений СО РАН, ЦКП “Ультрамикроанализ” ЛИН СО РАН (http://www.lin.irk.ru/copp/rus/), материально-технической базы Байкальского аналитического центра коллективного пользования. Работа выполнена при частичной финансовой поддержке Президента Российской Федерации молодых ученых – кандидатов наук (грант № МК-1220.2019.11, проект АААА-А19-119022690046-4).
Список литературы
Jones R.A.C. // CAB Reviews Perspectives in Agriculture Veterinary Science Nutrition and Natural Resources 2012. V. 2. P. 461. https://doi.org/10.1079/PAVSNNR20127022
Godefroid M., Cruaud A., Streito J.C. et al. // Sci. Rep. 2019. № 8844. https://doi.org/10.1038/s41598-019-45365-y
Helen N., Sarah J. Gurr // BMC Biol. 2017. V. 15. P. 36. https://doi.org/10.1186/s12915-017-0376-4
Eichenlaub R., Gartemann K.H. // Annu. Rev. Phytopathol. 2011. V. 49. P. 445. https://doi.org/10.1146/annurev-phyto-072910-095258
Li X., Tambong J., Yuan K. et al. // Int. J. Syst. Evol. Microbiol 2018. V. 68. P. 234. https://doi.org/10.1099/ijsem.0.002492
Secor G.A., De Buhr L., Gudmestad N.C. // Plant Disease. 1988. V. 72. № 7. P. 585.
Van der Wolf J.M., Elphinstone J.G., Stead D.E. et al. // Plant Research International B.V. Wageningen Report 95. February 2005 (http://edepot.wur.nl/39352).
Потиевский Э.Г., Новиков A.K. Медицинские аспекты применения пектина. М.: Медицинская книга, 2002. 96 с.
Бабешина Л.Г., Горина Я.В., Колоколова А.П. и др. // J. Siberian Federal University. Chemistry. 2010. V. 4. P. 413.
Валышев А.В. // Бюллетень Оренбургского научного центра УрО РАН (электронный журнал). 2013. № 3. С. 1.
Shibata H., Kimura Takagi I., Nagaoka M. et al. // J. Nutr. Sci. Vitaminol. 1999. V. 45. № 3. P. 325.
Ахедов О.Р., Шомуротов Ш.А., Раханова Г.Г. и др. // Химия растительного сырья 2016. № 3. С. 19. https://doi.org/10.14258/jcprm.2016031092
Бабушкина И.В., Гладкова Е.В., Пучиньян Д.М. // Современные проблемы науки и образования. 2016. № 5. С. 33.
Гаврикова Л.М. // Вестник Алтайского государственного аграрного университета. 2007. № 6 (32). С. 29.
Булгаков А.М., Гаврикова Л.М. // Вестник Алтайского государственного аграрного университета. 2007. № 3 (29). С. 47.
Papkina A.V., Perfileva A.I., Zhivet’yev M.A. et al. // Nanotechnologies in Russia. 2015. V. 10. № 5–6. P. 484.
Граскова И.А., Перфильева А.И., Ножкина О.А. и др. // Химия растительного сырья. 2019. № 3. С. 345. https://doi.org/10.14258/jcprm.2019034794
Ножкина О.А., Перфильева А.И., Граскова И.А. и др. // Российские нанотехнологии. 2019. Т. 14. № 3. С. 79. https://doi.org/10.21517/1992-7223-2019-5-6-79-86
Перфильева А.И., Ножкина О.А., Граскова И.А. и др. // Докл. РАН. 2019. Т. 489. № 3. С. 325. https://doi.org/10.31857/S0869-56524893325-330
Перфильева А.И., Ножкина О.А., Граскова И.А. и др. // Изв. РАН. Сер. хим. 2018. № 1. С. 157. https://doi.org/10.31255/978-5-94797-319-8-626-629
Romanenko A.S., Riffel A.A., Graskova I.A. et al. // J. Phytopathology. 1999. V. 147. № 11–12. P. 679. https://doi.org/10.1046/j.1439-0434.1999.00450.x
Roozen N.J.M., van Vuurde J.W.L. // Netherlands Journal of Plant Pathology. 1991. V. 97. №5. P. 321.
Шагинян И.А., Данилина Г.А., Чернуха М.Ю. и др. // Журнал микробиологии, эпидемиологии и иммунобиологии. 2007. № 1. С. 3.
Бояркин А.Н. // Биохимия. 1951. Т. 16. С. 352.
Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. М.: Наука, 1972. 252 с.
Huang Y., Bie Z., Liu Z. et al. // Soil Science and Plant Nutrition. 2009. V. 55. P. 698.
Baysal Furtana G., Tipirdamaz R. // Turk. J. Biol. 2010. V. 34. P. 287.
Олешук Е.Н., Гриц А.Н., Попов Е.Г. и др. // Proceedings of the National Academy of Sciences of Belarus. Biological series. 2016. № 4. Р. 33.
Колупаев Ю.Е., Карпец Ю.В. Активные формы кислорода, антиоксиданты и устойчивость растений к действию стрессоров. Киев: Логос, 2019. 277 с.
Zandalinas S.I., Mittler R. // Free Radic. Biol. Med. 2018 V. 122. P. 21. https://doi.org/10.1016/j.freeradbiomed.2017.11.028
Kohli S.K., Khanna K., Bhardwaj R. // Antioxidants (Basel). 2019. V. 12. (8) P. 12. https://doi.org/10.3390/antiox8120641El
Курганова Л.Н. // СОЖ. 2001. № 6. С. 76.
Петухов А.С., Хритохин Н.А., Петухова Г.А. // Вестн. РУДН. Сер. Экология и безопасность жизнедеятельности. 2018. Т. 26. № 1. С. 82. https://doi.org/10.22363/2313-2310-2018-26-1-82-90
Mehdawi A.F., Pilon-Smits E.A.H. // Plant Biol. 2012. V. 14. P. 1. https://doi.org/10.1111/j.1438-8677.2011.00535.x
Bempah C.K., Donkor A., Yeboah P.O et al. // Food Chem. 2011. V. 128. P. 1058.
Hijosa-Valsero M., Bécares E., Fernández-Aláez C. et al. // Sci. Total Environment. 2016. V. 544. P. 797.
Ukalska-Jaruga A., Smreczak B., Siebielec G. // Molecules. 2020 V. 29 (3). P. 25. https://doi.org/10.3390/molecules25030587
Zhang F., He J., Yao Y. et al. // Environ Monit Assess. 2013 V. 185 (8). P. 6893. https://doi.org/10.1007/s10661-013-3073-y
Baćmaga M., Wyszkowska J., Kucharski J. // Ecotoxicology. 2018 V. 27 (9). P. 1188. https://doi.org/10.1007/s10646-018-1968-7
Иванцова Е.А. // Вестн. Волгогр. гос. ун-та. Сер. 11. Естеств. науки. 2013. № 1 (5) С. 35.
Schiavon M., Pilon-Smits E.A.H. // New Phytologist. 2017. V. 213. P. 1582. https://doi.org/10.1111/nph.14378
Chen X., He S., Liu X. et al. // Ecotoxicol Environ Saf. 2018 V. 159. P. 190. https://doi.org/10.1016/j.ecoenv.2018.04.047
Adegoke A.A., Mvuyo T., Okoh A.I. // J. Basic Microbiol. 2012 V. 52 (6). P. 620. https://doi.org/10.1002/jobm.201100323
de Carvalho C.C., da Fonseca M.M. // Appl. Microbiol. Biotechnol. 2005. V. 67 (6). P. 715. https://doi.org/10.1007/s00253-005-1932-3
Третьякова М.С., Беловежец Л.А., Маркова Ю.А. и др. // Агрохимия. 2017. № 12. С. 46.
Tretyakova M.S., Ivanova M.V., Belovezhets L.A., Markova Yu. A. // IOP Conference Series Earth and Environmental Science. 2019. V. 315. P. 1.
Муродова С.С., Давранов К.Д. // Microbiol. Biotechnol. 2015. № 4. С. 61.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии



