Российские нанотехнологии, 2020, T. 15, № 2, стр. 231-237
ПОЛУЧЕНИЕ ЛИПОСОМНОГО САНГВИНАРИНА И ИЗУЧЕНИЕ ЕГО ЦИТОТОКСИЧЕСКОГО ДЕЙСТВИЯ НА ОПУХОЛЕВЫЕ КЛЕТКИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Н. Б. Фельдман 1, *, С. Н. Орехов 1, И. И. Чакалева 1, Е. А. Мучкинова 1, Н. Е. Седякина 1, С. В. Луценко 1
1 Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России
Москва, Россия
* E-mail: n_feldman@mail.ru
Поступила в редакцию 14.05.2020
После доработки 14.05.2020
Принята к публикации 04.06.2020
Аннотация
Бензофенантрединовый алкалоид сангвинарин из Macleaya macrocarpa проявляет противоопухолевую, антиангиогеную и ряд других активностей. Описаны некоторые побочные эффекты сангвинарина, существенно ограничивающие возможности его терапевтического применения. Для увеличения эффективности терапевтического действия сангвинарин был введен в состав рН-чувствительных липосом методом дистанционной загрузки с использованием дигидрофосфата аммония. рН-чувствительные липосомы, оказываясь в кислом окружении опухоли или эндосомном компартменте, высвобождают сангвинарин, который вызывает гибель опухолевых клеток. Средний диаметр липосомных частиц составлял 112.6 ± 1.8 нм; дзета-потенциал –13.9 ± 1.7 мВ по данным метода динамического рассеяния света. Степень включения сангвинарина в липосомы составляла 89.54 ± ± 2.13%. Исследована динамика высвобождения сангвинарина из состава липосомного препарата, продемонстрирован пролонгированный характер высвобождения. Исследована in vitro цитотоксическая активность (ЦТА) липосомного сангвинарина в отношении опухолевых клеток карцином предстательной железы линий LNCaP, DU145 и PC-3. Липосомный сангвинарин проявлял дозозависимую ЦТА в отношении клеток всех исследуемых линий в микромолярном диапазоне концентраций. Наиболее высокая ЦТА липосомного сангвинарина проявлялась в отношении гормончувствительных клеток линии LNCaP (IC50 2.86 мкМ). В отношении гормоннезависимых клеток линий DU145 и PC-3 цитотоксическая активность липосомного сангвинарина была несколько ниже и составляла 3.37 и 3.63 мкМ соответственно. Также продемонстрирована дозозависимая индукция апоптоза клеток линий LNCaP, DU145 и PC-3. Липосомный сангвинарин с высокой эффективностью индуцировал апоптоз как гормончувствительных, так и гормоннезависимых клеток. При концентрации в культуральной среде 8 мкМ липосомный сангвинарин индуцировал апоптоз у 93.14% клеток линии LNCaP, 90.65% клеток линии DU145 и 98.12% клеток линии PC-3. Таким образом, липосомный сангвинарин может рассматриваться в качестве перспективного противоопухолевого агента для терапии гормончувствительных и гормоннезависимых опухолей.
ВВЕДЕНИЕ
Целый ряд растительных алкалоидов обладает высоким терапевтическим потенциалом и широкими перспективами применения в медицине. К таким соединениям относится бензофенантридиновый алкалоид сангвинарин, который наряду с другими бензофенантридиновыми алкалоидами (хелеритрином, сангвилютином, хелилютином, сангвирубином, хелирубином) и двумя протопиновыми алкалоидами (протопин и аллокриптопин) содержится в растениях семейства Papaveraceae (маковых) – Sanguinaria canadensis, Macleya cordata, Macleaya macrocarpa и Chelidonium majus [1]. Сангвинарин относится к хорошо изученным алкалоидам и отличается довольно высоким содержанием (30.4%) в сангвинарии канадской (Sanguinaria canadensis) по сравнению с другими алкалоидами – хелеритрином (18.8%), сангвилютином (12%), хелилютином (11.3%), хелирубином (9.5%), а также протопином (9.5%), аллокриптопином (8.4%) и сангвирубином (до 1.2%) [2]. У растений Macleaya macrocarpa 12-летнего возраста содержание бензофенантрединовых алкалоидов до 14 раз выше по сравнению с молодыми растениями возраста 2 года [3].
Несмотря на высокий терапевтический потенциал, сангвинарин отличается довольно низкой растворимостью в биологических жидкостях и способностью вызывать некоторые побочные эффекты в результате интеркаляции между парами оснований ДНК [4] с последующим ее разрушением [5]. Повысить эффективность терапевтического действия сангвинарина и снизить побочные эффекты можно путем его включения в состав липосомных наночастиц. Липосомы представляют собой липидные везикулы с бислойной мембраной, состоящей из фосфолипидов [6, 7]. Впервые потенциал липосом в качестве транспортного средства для доставки ферментов, противоопухолевых и антимикробных агентов был продемонстрирован в [8–10]. В последующие годы технологии получения и применения наноносителей для транспорта терапевтических агентов активно развивались [11].
Одним из наиболее перспективных путей повышения эффективности терапевтического действия противоопухолевых лекарственных препаратов является применение рН-чувствительных липосом. Известно, что pH опухолевой стромы отличается от нормальных тканей более кислым значением [12]. В связи с этим рН-чувствительные липосомы конструируют из рН-чувствительных компонентов таким образом, что когда липосомы оказываются в кислом окружении опухолевых клеток или эндосомном компартменте, их содержимое высвобождается и оказывает терапевтический эффект. К преимуществам применения липосомного препарата также относится его избирательное проникновение через опухолевые сосуды и капилляры, имеющие обширные разрывы базальной мембраны и участки, лишенные эндотелиальной выстилки [13].
В настоящее время в научной литературе представлены довольно обширные сведения, касающиеся антимикробной и противоопухолевой активности свободного сангвинарина [14–17], в то время как биологическая активность липосомного сангвинарина изучена недостаточно. В связи с этим в данной работе получены рН-чувствительные липосомы с сангвинарином и исследованы их антипролиферативная активность и апоптотическое действие на опухолевые клетки предстательной железы. Клетки рака предстательной железы образуются в результате трансформации нормальных андрогензависимых клеток предстательной железы, однако в процессе злокачественного перерождения часть из этих клеток выходит из-под контроля гормональной системы организма. К моменту диагностики у пациента с раком предстательной железы опухоль чаще всего является метастазирующей и гетерогенной по клеточной популяции [18]. Она включает в себя андрогензависимые клетки, требующие для развития андрогенной стимуляции и погибающие в ее отсутствие, андрогенчувствительные клетки, не погибающие при отсутствии андрогенов, а также андрогеннезависимые клетки, не требующие для роста присутствия андрогенов [19]. При удалении андрогенов из среды или проведении антиандрогенной терапии андрогенчувствительные клетки погибают в результате индукции апоптоза, тогда как андрогеннезависимые клетки обходят механизмы апоптоза и не реагируют на отсутствие андрогенов, продолжая активно пролиферировать, обеспечивая прогрессию опухоли. Поиск путей элиминирования этой клеточной популяции является одной из важнейших задач противоопухолевой терапии. Опухолевые клетки нечувствительной к действию гормонов популяции являются наиболее опасными, именно их пролиферативная и инвазивная активность чаще всего приводит к смерти пациентов, страдающих раком предстательной железы [20]. Ранее было показано, что свободный сангвинарин вызывает арест клеточного цикла и апоптоз клеток карциномы предстательной железы человека путем воздействия на циклинзависимые протеинкиназы [19]. Применение сангвинарина в липосомной форме позволит расширить спектр терапевтических средств, действующих как на гормончувствительные, так и на гормонрезистентные опухоли.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали сангвинарин, холестерин, HEPES, дигидроортофосфат аммония NH4H2PO4, фосфатно-солевой буфер, сефарозу CL-4B (Merck), лецитин (AppliChem). Остальные реагенты имели квалификацию ч.д.а.
Липосомы получали модифицированным методом дистанционной загрузки с использованием дигидрофосфата аммония [21]. Пустые липосомы получали методом гидратации тонкослойной пленки буфером с последующей обработкой дисперсии ультразвуком. Для получения тонкослойной липидной пленки смесь лецитина и холестерина (массовое соотношение 5:1) в этаноле упаривали на роторном испарителе при 30°С. Липосомную дисперсию получали путем добавления к липидной пленке 0.4 М раствора NH4H2PO4 (гидратирующий, или внутренний буфер, рН 4.4) и обработки ультразвуком в течение 5 мин с помощью ультразвукового дезинтегратора “Misonix sonicator S-4000” при амплитуде 60%. После фильтрации на фильтре с размером пор 0.45 мкм липосомный препарат подвергали 15-кратной экструзии через поликарбонатную мембрану с размером пор 100 нм с помощью экструдера Avanti Mini-Extruder (Avanti Polar Lipids, Inc., США).
Для установления трансмембранного градиента рН липосомную дисперсию пропускали через колонку с сефарозой CL-4B, уравновешенную буферным раствором (наружный буфер), содержащим 20 мM HEPES (pH 7.4) и 150 мМ NaCl. К препарату пустых липосом добавляли необходимое количество 10 мМ раствора сангвинарина в диметилсульфоксиде. Загрузку липосом сангвинарином продолжали в течение 1 ч при при 40°С.
Очистку липосомной дисперсии от невключившегося сангвинарина проводили на колонке с сефарозой CL-4B, уравновешенной буферным раствором, содержащим 20 мM HEPES (pH 7.4) и 150 мМ NaCl. Элюирование препарата липосом проводили при скорости потока 1 мл/мин под контролем УФ-детектора при λ = 275 нм. Фракции, содержащие липосомный препарат, объединяли и использовали в дальнейших экспериментах.
Для определения эффективности включения сангвинарина в липосомы к 100 мкл препарата липосом после диализа добавляли 200 мкл метанола, перемешивали и подвергали обработке ультразвуком в течение 5 мин. Затем образец центрифугировали и отбирали 100 мкл супернатанта для анализа с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), проводимого с использованием хроматографа Agilent Technologies 1260 Infinity (США) на обращеннофазовой колонке С18. В работе использовали линейный градиент подвижной фазы, создаваемый элюентом А (0.1% раствор трифторуксусной кислоты (ТФУ) в воде) и элюентом В (0.1% раствор ТФУ в ацетонитриле). Детектирование сангвинарина осуществляли при длине волны 275 нм. Хроматографию образцов проводили в линейном градиенте концентрации элюента В от 0 до 100% при скорости потока 1.0 мл/мин; время анализа составляло 20 мин для каждой пробы. С помощью стандартного образца сангвинарина строили калибровочный график, по которому определяли концентрацию сангвинарина в пробах. Эффективность включения сангвинарина в липосомы (E) рассчитывали по формуле
Форму и размеры липосомных частиц оценивали с помощью сканирующего электронного микроскопа JEOL JSM–6490LV (Япония). Исследуемые пробы покрывали 20 нм (40 с при 40 мА) слоем платины в автоматическом коутере JEOL JFC–1600.
Размеры и дзета-потенциал частиц определяли методом динамического рассеяния света, или фотонной корреляционной спектроскопии на анализаторе Zetasizer Nano ZS (Malvern Instruments Ltd, Великобритания).
Изучение динамики высвобождения сангвинарина из липосом проводили с помощью модифицированного метода [22]. Препарат липосом (40 мл) в диализном мешке помещали в термостатируемый шейкер и диализировали при 37°С в течение 24 ч при постоянном перемешивании (50 об./мин) против буферного раствора, содержащего 20 мМ HEPES (высвобождение оценивали параллельно при трех значениях pH – 7.4, 6.5 и 5.5), 150 мМ NaCl, 2% метанол. Образцы отбирали для анализа через определенные промежутки времени, добавляя к исходному диализному раствору тот же объем свежего буфера. Содержание сангвинарина в диализате определяли с помощью обращеннофазовой ВЭЖХ. Все данные приведены как средние значения трех экспериментов.
Цитотоксическую активность (ЦТА) липосомного сангвинарина in vitro исследовали в отношении опухолевых клеток трех линий карцином предстательной железы человека – LNCaP (ATCC® CRL-1740™), DU 145 (ATCC® HTB-81™) и PC-3 (ATCC® CRL-1435™). Клетки исследуемых линий выращивали в пластиковых флаконах (Costar) в среде RPMI-1640 (Sigma) с добавлением 10%-ной фетальной бычьей сыворотки и 100 мкг/мл стрептомицина (Sigma) в атмосфере 5%-ного CO2 при 37°C. За 1 сут до эксперимента клетки рассевали в 96-луночные планшеты для микротитрования в среде для культивирования в плотности 5000–7000 клеток в лунке. Инкубировали клетки с растворами исследуемых препаратов в различных концентрациях в стандартных условиях 72 ч, после чего определяли выживаемость клеток с помощью МТТ-теста [23]. Цитотоксическую активность препарата выражали в единицах IC50 (молярная концентрация препарата, вызывающая гибель 50% клеток).
Для количественной оценки уровня апоптоза опухолевых клеток клетки наращивали в 100 мм чашках Петри до плотности 1 · 106 на чашку и инкубировали с липосомным сангвинарином в различных концентрациях в течение 24 ч. Затем клетки обрабатывали трипсином, отмывали фосфатно-солевым буфером и обрабатывали флуоресцентно меченным нуклеотидом dUTP и пропидиум иодидом с использованием набора “Apo-direct apoptosis kit” (Thermo Fisher Scientific) согласно протоколу производителя. Флуоресцентно меченные клетки анализировали с помощью проточной цитометрии (цитометр EPICS-XL, Beckman Coulter).
Статистическую обработку результатов осуществляли в программе Microcal Origin 8.0 (OriginLab Corporation). Все данные в таблицах и рисунках представлены как средние арифметические значения (M) и стандартные отклонения (±SD). Для выявления статистической значимости различий применяли однофакторный дисперсионный анализ (ANOVA); различия считали достоверными при значениях р < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Влияние внутрилипосомной концентрации дигидроортофосфата аммония на эффективность загрузки сангвинарином. Одним из важных факторов, влияющих на эффективность включения сангвинарина в рН-чувствительные липосомы, является внутрилипосомная концентрация NH4H2PO4. Для дистанционной загрузки использовали пустые липосомы с внутренними концентрациями NH4H2PO4 от 0.1 до 0.5 М с шагом 0.1 М. В качестве контроля использовали липосомы с внутренним буфером 20 мМ HEPES, рН 7.4.
Как видно из табл. 1, эффективность инкапсулирования сангвинарина и размер липосом прогрессивно возрастали при увеличении внутрилипосомной концентрации NH4H2PO4 от 100 до 200 мМ. При дальнейшем увеличении внутрилипосомной концентрации дигидроортофосфата аммония эффективность загрузки липосом повышалась и достигала максимального значения (89.54 ± 2.18%) при концентрации NH4H2PO4 400 мМ. Размер липосом при их максимальной загрузке сангвинарином оставался относительно небольшим и составлял 112.6 ± 1.8 нм по данным метода динамического рассеяния света; дзета-потенциал был равен –13.9 ± 1.7 мВ. Данный препарат использовали в дальнейших экспериментах. Микрофотография липосомных частиц с сангвинарином, полученная с помощью сканирующего электронного микроскопа (СЭМ), приведена на рис. 1.
Таблица 1.
Эффективность инкапсулирования (E) сангвинарина при различных внутрилипосомных концентрациях дигидроортофосфата аммония (n = 3)
| Концентрация NH4H2PO4, мМ | Эффективность инкапсулирования (E) сангвинарина, % (±SD) | Размер липосом, нм (±SD) |
|---|---|---|
| 0 | 1.78 ± 0.46 | 105.3 ± 1.5 |
| 100 | 43.07 ± 4.32 | 111.4 ± 1.7 |
| 200 | 65.13 ± 5.14 | 126.8 ± 2.3 |
| 300 | 82.94 ± 2.45 | 121.7 ± 2.9 |
| 400 | 89.54 ± 2.18 | 112.6 ± 1.8 |
| 500 | 86.32 ± 1.27 | 119.1 ± 2.2 |
Поскольку опухолевые кровеносные сосуды имеют аномальное строение и часто бывают лишены целых участков эндотелиальной выстилки и фрагментов базальной мембраны, они имеют крупные размеры пор (от 100 до 780 нм) [13]. В связи с этим липосомы размером 100–200 нм считаются оптимальными транспортными системами, способными эффективно доставлять терапевтические агенты и накапливаться в околоопухолевом пространстве путем так называемого “пассивного нацеливания”. Противоопухолевую активность полученных липосом с сангвинарином исследовали in vitro c целью определить их противоопухолевый потенциал.
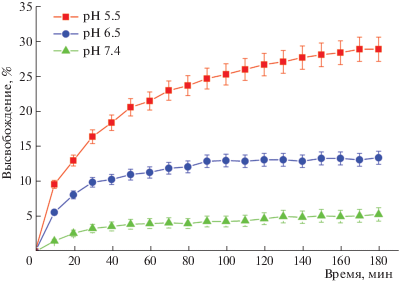
Динамика высвобождения сангвинарина из липосом. Высвобождение сангвинарина из липосом изучали при значениях pH – 7.4, 6.5 и 5.5, моделирующих условия, в которых липосомы могут оказаться при их терапевтическом применении. Так, pH ~7.4 характерен для плазмы крови, лимфы и межклеточной жидкости; pH ~6.5 – для опухолевых тканей; pH ~5.5 – для внутренней среды эндосомного компартмента, где липосомы могут оказаться после их поглощения клеткой [24, 25].
Высвобождение сангвинарина из липосомного препарата носило выраженный рН-зависимый характер (рис. 2). При этом с наиболее высокой скоростью во все среды сангвинарин высвобождался в первые 10 мин; в последующий период процесс высвобождения постепенно замедлялся. После 3 ч эксперимента в наиболее кислую среду (рН 5.5) высвобождалось больше всего сангвинарина (~28%); в среду с рН 6.5 высвобождалось ~12% и наиболее низкий уровень высвобождения наблюдался в среде со слабощелочной реакцией (рН 7.4). В целом высвобождение сангвинарина из липосом в кислую среду носит пролонгированный характер. В условиях слабощелочной среды сангвинарин оказывается практически полностью “запертым” в липосомах – через 3 ч инкубации из липосомной дисперсии высвобождается лишь 2.5% сангвинарина. Такой характер высвобождения может оказаться полезным при внутривенном введении липосомного сангвинарина в качестве противоопухолевого препарата. В крови при транспортировке к опухоли-мишени значение pH слабощелочное (рН 7.4) и практически весь сангвинарин будет оставаться в составе липосом. При достижении опухоли в кислой среде, характерной для опухолевой ткани, высвобождение сангвинарина будет увеличиваться и, наконец, в кислом содержимом эндосомного компартмента (рН 5.5) захваченные опухолевыми клетками путем эндоцитоза липосомы будут наиболее активно высвобождать действующее вещество. Таким образом, разница в кислотности биологических жидкостей и внутриклеточных компартментов может служить основой для разработки эффективных стратегий применения pH-чувствительных липосом.
Рис. 2.
Высвобождение сангвинарина из липосом при различных значениях pH наружного буфера (20 мМ HEPES (pH 7.4, 6.5, 5.5), 150 мМ NaCl).
Цитотоксический и апоптотический потенциал липосомного сангвинарина. Исследование цитотоксического и апоптотического действия липосомного сангвинарина проводили на опухолевых клетках предстательной железы, чувствительных к андрогенам и обладающих умеренным метастатическим потенциалом (аденокарцинома предстательной железы человека линии LNCaP), в сравнении с гормоннезависимыми клетками с умеренным (карцинома предстательной железы человека линии DU145) и высоким (карцинома предстательной железы человека линии PC-3).
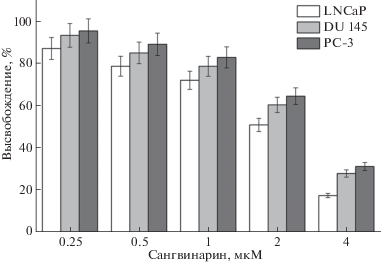
Результаты исследования ЦТА липосомного сангвинарина в отношении опухолевых клеток линий LNCaP, DU145 и PC-3 представлены на рис. 3. Липосомный сангвинарин проявлял дозозависимую ЦТА в отношении опухолевых клеток всех исследуемых линий в микромолярном диапазоне концентраций. Наиболее высокая ЦТА липосомного сангвинарина проявлялась в отношении гормончувствительных клеток линии LNCaP (IC50 2.86 мкМ). В отношении гормоннезависимых клеток линий DU145 и PC-3 цитотоксическая активность липосомного сангвинарина была несколько ниже и составляла 3.37 и 3.63 мкМ соответственно.
Рис. 3.
Цитотоксическая активность липосомного сангвинарина в отношении опухолевых клеток человека линий LNCaP, DU145 и PC-3.
Ранее было показано, что свободный сангвинарин вызывает апоптоз у опухолевых клеток [26, 27]. В настоящей работе для исследования апоптотического действия на опухолевые клетки использовали липосомную форму сангвинарина как альтернативу свободному веществу. Клетки инкубировали 24 ч в присутствии различных концентраций сангвинарина и метили нуклеотидом 2'-дезоксиуридин-5'-трифосфатом (dUTP) с помощью терминальной дезоксирибонуклеотидилтрансферазы (TDT) (осуществляет последовательное присоединение дезоксирибонуклеозидмонофосфатов из пула дезоксирибонуклеозидтрифосфатов к 3'-OH-группам молекул ДНК) и пропидиум иодида. Клетки, уровень dUTP-флуоресценции которых превышал уровень флуоресценции контрольных клеток, рассматривали как апоптотические, в табл. 2 представлено процентное содержание таких клеток от контроля.
Таблица 2.
Влияние липосомного сангвинарина на апоптоз опухолевых клеток линий LNCaP, DU145 и PC-3
| Липосомный сангвинарин, мкМ | Апоптоз, % | ||
|---|---|---|---|
| LNCaP | DU145 | PC-3 | |
| Контроль (без липосом) | 1.68 ± 0.12 | 2.50 ± 0.3 | 2.82 ± 0.23 |
| 0.25 | 4.71 ± 0.34 | 7.61 ± 0.08 | 13.83 ± 0.97 |
| 0.5 | 9.75 ± 0.72 | 13.91 ± 0.73 | 22.19 ± 1.68 |
| 1.0 | 15.55 ± 1.01 | 19.72 ± 3.18 | 27.17 ± 2.01 |
| 2.0 | 36.29 ± 2.48 | 40.02 ± 3.85 | 47.90 ± 3.59 |
| 4.0 | 68.42 ± 5.11 | 73.81 ± 4.36 | 80.44 ± 6.73 |
| 8.0 | 93.14 ± 6.54 | 90.65 ± 5.07 | 98.12 ± 7.84 |
Как видно из табл. 2, инкубация клеток с различными концентрациями липосомного сангвинарина приводит к дозозависимому увеличению опосредуемого TDT уровня включения метки dUTP в 3'-концевые разрывы цепи ДНК, что свидетельствует о дозозависимом приросте числа апоптотических клеток. При этом липосомный сангвинарин с высокой эффективностью индуцировал апоптоз как гормончувствительных, так и гормоннезависимых клеток. При концентрации в культуральной среде 8 мкМ липосомный сангвинарин индуцировал апоптоз у 93.14% клеток линии LNCaP, 90.65% клеток линии DU145 и 98.12% клеток линии PC-3.
Таким образом, липосомный сангвинарин индуцирует гибель подавляющего числа опухолевых клеток всех исследуемых линий путем индукции апоптоза. Очевидно, что липосомный сангвинарин может рассматриваться в качестве перспективного противоопухолевого агента для терапии гормонзависимых опухолей, находящихся на разных стадиях прогрессии.
ЗАКЛЮЧЕНИЕ
Полученные с помощью метода дистанционной загрузки рН-чувствительные липосомы с сангвинарином проявляют цитотоксическую активность в отношении как чувствительных к андрогенам, так и гормоннезависимых опухолевых клеток предстательной железы. Представляет интерес исследование активности полученного препарата в отношении опухолевых клеток других типов, а также опухолей, резистентных к действию антибиотиков. Для более полного раскрытия терапевтического потенциала и рассмотрения возможности создания на основе липосомного сангвинарина противоопухолевого препарата необходимы дополнительные исследования.
Работа выполнена при поддержке проекта повышения конкурентоспособности ведущих российских университетов среди ведущих мировых научно-образовательных центров.
Список литературы
Bambagiotti-Alberti M., Pinzauti S., Moneti G. et al. // J. Pharm. Biomed. Anal. 1991. V. 9. № 10–12. P. 1083.
Salmore A.K., Hunter M.D. // J. Chem. Ecol. 2001. V. 27. № 9. P. 1729.
Pěnčíková K., Urbanová J., Musil P. et al. // Molecules. 2011. V. 16. № 4. P. 3391.
Stiborova M., Simanek V., Frei E. et al. // Chem. Biol. Interact. 2002. V. 140. P. 231.
Ansari K.M., Dhawan A., Khanna S.K., Das M. // Food Chem. Toxicol. 2005. V. 43. № 1. P. 147.
Torchilin V.P. // Nat. Rev. Drug Discov. 2005. V. 4. P. 145.
Wacker M. // Int. J. Pharm. 2013. V. 457. P. 50.
Gregoriadis G. // N Engl. J. Med. 1976. V. 295. P. 704.
Gregoriadis G. // N Engl. J. Med. 1976. V. 295. P. 765.
Gregoriadis G. // Trends Biotechnol. 1995. V. 13. P. 527.
Kreuter J. // Int. J. Pharm. 2007. V. 331. P. 1.
Ganta S., Devalapally H., Shahiwala A., Amiji M. // J. Control. Rel. 2008. V. 126. P. 187.
Hobbs S.K., Monsky W.L., Yuan F. et al. // Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 4607.
Zuo G.Y., Meng F.Y., Hao X.Y. et al. // J. Pharm. Pharm. Sci. 2008. V. 11. № 4. P. 90.
Meng F., Zuo G., Hao X. et al. // J. Ethnopharmacol. 2009. V. 125. P. 494.
Ahsan H., Reagan-Shaw S., Breur J., Ahmad N. // Cancer Lett. 2007. V. 249. P. 198.
Jang B.C., Park J.G., Song D.K. et al. // Toxicol. In Vitro. 2009. V. 23. № 2. P. 281.
Tang D.G., Porter A.T. // Prostate. 1997. V. 32. P. 284.
Gleave M., Bruchovsky N., Goldenberg S.L., Rennie P. // Eur. Urol. 1998. V. 34. P. 37.
Denmeade S.R., Lin X.S., Isaacs J.T. // Prostate. 1996. V. 28. P. 251.
Fritze A., Hens F., Kimpfler A., Schubert R. // Biochim. Biophys. Acta. 2006. V. 1758. P. 1633.
Zhang X., Lu S., Han J. et al. // Pharmazie. 2011. V. 66. P. 404.
Adan A., Kiraz Y., Baran Y. // Curr. Pharm. Biotechnol. 2016. V. 17. № 14. P. 1213.
Stubbs M., McSheehy P.M., Griffiths J.R., Bashford C.L. // Mol. Med. Today. 2000. V. 6. № 1. P. 15.
Hu Y.B., Dammer E.B., Ren R.J., Wang G. // Transl. Neurodegener. 2015. V. 4. Art. 18.
Debiton E., Madelmont J.C., Legault J., Barthomeuf C. // Cancer Chemother. Pharmacol. 2003. V. 51. P. 474.
Ding Z., Tang S.C., Weerasinghe P. et al. // Biochem. Pharmacol. 2002. V. 63. P. 1415.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии



