Российские нанотехнологии, 2020, T. 15, № 2, стр. 219-230
УГЛЕРОДНЫЕ НАНОМАТЕРИАЛЫ ВЛИЯЮТ НА ПОКАЗАТЕЛИ ТОКСИЧНОСТИ ЦИКЛОФОСФАМИДА ПРИ СОВМЕСТНОМ ВВЕДЕНИИ
И. В. Гмошинский 1, *, Н. А. Ригер 1, В. А. Шипелин 1, 2, А. А. Шумакова 1, Э. Н. Трушина 1, О. К. Мустафина 1, С. А. Хотимченко 1, 3
1 Федеральный исследовательский центр питания, биотехнологии и безопасности пищи
Москва, Россия
2 Российский экономический университет им. Г.В. Плеханова
Москва, Россия
3 Первый Московский медицинский университет им. И.М. Сеченова
Москва, Россия
* E-mail: gmosh@ion.ru
Поступила в редакцию 24.03.2020
После доработки 30.04.2020
Принята к публикации 30.04.2020
Аннотация
Углеродные наноматериалы (УНМ) – одно-, многостенные углеродные нанотрубки и производные фуллеренов – рассматриваются как перспективные агенты для доставки фармакологических препаратов к органам-мишеням в противоопухолевой терапии и тераностике. Одним из химиотерапевтических препаратов, адресная доставка которых возможна с помощью УНМ, является цитостатик циклофосфамид (ЦФ). Однако ввиду наличия у различных УНМ собственного токсического действия возникает вопрос об их возможном влиянии на общетоксическое и иммунотоксическое действие ЦФ при совместном поступлении в организм. Изучено сочетанное воздействие на крыс линии Вистар ЦФ ежедневно вводимых перорально в дозе 0.1 мг/кг массы тела УНМ: многостенных (МУНТ), одностенных углеродных нанотрубок (ОСУНТ) и полигидроксилированного фуллеренола (ПГФ60). В двух экспериментах длительностью 16 и 35 дней с разными сценариями индуцированной ЦФ иммуносупрессии оценивали летальность и интегральные показатели, в крови изучали содержание эритроцитов и лейкоцитов, биохимические показатели, уровни цитокинов, хемокинов и ростовых факторов, активность глутатионпероксидазы-I эритроцитов; в моче – концентрацию селена, экскрецию креатинина и 8-оксо-2-дезоксигуанозина; в гомогенате печени – уровень восстановленного глутатиона. В первом эксперименте потребление как МУНТ, так и ОСУНТ приводило к практически двукратному снижению летальности, вызванной введением ЦФ. Во втором эксперименте двукратное снижение летальности отмечено только для ОСУНТ, тем не менее МУНТ и ПГФ60 также положительно влияли на выживаемость животных. Потребление УНМ не оказывало значимого действия на биохимические показатели, состояние системы эритропоэза, массу тимуса и селезенки, уровни ключевых регуляторных молекул, нарушенные вследствие затравки ЦФ. Вместе с тем МУНТ, ОСУНТ и ПГФ60 способны снижать ряд проявлений иммунотоксического действия ЦФ, включая летальность, лимфопению и нарушенный баланс цитокинов и хемокинов/ростовых факторов: IL-4, IL-13, IL-17A, IFN-γ, IL-18, GM-CSF, GRO-KC, IL-12p70, IL-1β, IL-7, TNF-α и VEGF. Таким образом, МУНТ и ОСУНТ при совместном введении с ЦФ оказывают парадоксальное действие, состоящее в частичной отмене вызванных им нарушений, что может быть объяснено за счет известной способности УНТ к усилению мобилизации, миграции и адгезии клеток крови и запуску иммунных реакций.
ВВЕДЕНИЕ
Углеродные наноматериалы (УНМ) – углеродные нанотрубки (УНТ) и производные фуллеренов – рассматриваются как перспективные объекты в противоопухолевой химиотерапии и тераностике в качестве носителей различных фармакологических препаратов [1, 2]. Рассматривая перспективы медицинского применения УНТ, следует иметь в виду наличие у них выраженного собственного токсического действия, проявляющегося в усилении синтеза токсичных активных форм кислорода, модуляции продукции цитокинов и хемокинов, развитии воспаления и долговременных морфофункциональных эффектов в экспонированных тканях [3–5]. В числе лекарственных препаратов, являющихся потенциальными объектами доставки с помощью УНМ, выделяются цитостатические агенты, такие как циклофосфамид (ЦФ). Циклофосфамид представляет собой алкилирующий агент, подавляющий развитие большинства быстро делящихся клеток и находящий применение в химиотерапии ряда онкологических и аутоиммунных заболеваний [6, 7]. Однако возможная модуляция общетоксического и иммунотоксического действия данного практически важного цитостатика под действием потенциально токсичных УНМ в аспекте их совместного использования в тераностике [8] в настоящее время не изучена. Целью настоящего исследования стало изучение возможных эффектов сочетанного воздействия на лабораторных крыс ЦФ и перорально вводимых в низкой дозе УНМ: многостенных (МУНТ), одностенных углеродных нанотрубок (ОСУНТ) и полигидроксилированного фуллеренола (ПГФ60).
МАТЕРИАЛЫ И МЕТОДЫ
Использовали следующие образцы углеродных наноматериалов.
“Таунит-М®” производства ООО “Нанотехцентр” (г. Тамбов, Россия), представленный по данным изготовителя >98% МУНТ с наружным диаметром 15–40 нм, диаметром внутренней полости 3–8 нм и длиной более 2 мкм с примесью менее 1% аморфного углерода и кобальтового катализатора. По данным исследования методом динамического рассеяния света (ДРС) МУНТ имели в водной дисперсии бимодальное распределение частиц со средними гидродинамическими диаметрами около 80 и 200 нм. Методом трансмиссионной электронной микроскопии (ТЭМ) показано наличие в образце индивидуальных волокнистых объектов диаметром около 20 нм с хорошо различимой при наибольшем увеличении внутренней полостью и с поликристаллической углеродной структурой, соответствующей МУНТ [9].
“ОСУНТ90Т” производства фирмы ООО “Углерод-ЧГ” (г. Черноголовка, Московская область, Россия), содержащие по данным изготовителя >90% ОСУНТ диаметром 1–3 нм и длиной более 1000 нм с примесью двустенных УНТ и менее 1% катализатора (железо–хром). В водной дисперсии частицы ОСУНТ характеризовались по данным ДРС гидродинамическими диаметрами 161 нм (98% по числу частиц) и 1100 нм (2%), а при исследовании ТЭМ были представлены индивидуальными волокнистыми объектами диаметром около 5 нм и длиной более 1000 нм с примесью сферических частиц диаметром 5–10 нм (предположительно, аморфного углерода) [10].
Фуллеренол (ПГФ60) производства “Фуллерен-Центр” (г. Нижний Новгород, Россия), содержащий по данным ВЭЖХ 98% С60(ОН)24, менее 1% гомологов С60(ОН)22 и С60(ОН)26 и не содержащий в пределах чувствительности анализа не гидроксилированного фуллерена С60 и его высших гомологов. По данным ДРС (прибор Nanotrack Wave фирмы Microtrack, США, с программным обеспечением FLEX 11.0.0.1) ПГФ60 в водном растворе демонстрировал гидродинамические диаметры 1.05 (24.9%) и 2.89 нм (75.1%), что отвечает присутствию как его свободных сольватированных молекул, так и их агрегатов (мицелл).
Перечисленные наноматериалы для введения животным диспергировали в 1.0%-ном водном растворе Твин-20 (пищевая добавка Е432, далее – “носитель”, производства фирмы “Panreac” (Испания), имеющая чистоту более 99%). При диспергировании МУНТ и ОСУНТ применяли обработку ультразвуком согласно [9]; ПГФ60 легко растворялся в носителе при перемешивании.
Дизайн биологического эксперимента. Эксперименты проводили на крысах-самцах линии Вистар, полученных из питомника Филиала “Столбовая” ФГБУН “Научный центр биомедицинских технологий ФМБА России”, возрастом около 60 сут с исходной массой тела 120 ± 10 г. Исследования на животных выполняли в соответствии с Российскими и международными требованиями надлежащей лабораторной практики11. Животные получали сухой сбалансированный корм производства фирмы ООО “Лабораторкорм” (Россия) в режиме неограниченного доступа. Крыс содержали по две особи в клетках из поликарбоната при 12/12-часовом режиме освещенности и температуре 21 ± 1°С. Вместо питьевой воды животные всех групп получали 1%-ный водный раствор носителя или дисперсии МУНТ, ОСУНТ и ПГФ60. Объемы потребляемой жидкости ежедневно измеряли и проверяли расчетную дозу наноматериалов, которая составила 0.1 мг/кг массы тела (м. т.). Доза носителя во всех группах составляла в среднем 2 г/кг м. т. в сутки. Воду для приготовления дисперсий получали в установке обратного осмоса “Milli-RO” производства фирмы Waters (США). Массу тела крыс определяли 1 раз в трое суток с точностью ± 1 г.
Всего было проведено два эксперимента. В первом из них воспроизвели модель индуцированной ЦФ иммуносупресии согласно [11]. Для этого после семисуточного карантина и последующего семисуточного введения трем группам крыс численностью 11, 10 и 11 особей раствора носителя, МУНТ и ОСУНТ соответственно проводили внутрибрюшинное (в/б) введение ЦФ (препарат “Эндоксан ® 1000 мг” производства фирмы “Бакстер онкология Гмбх”, Германия, рег. свидетельство в РФ № ПN014446/02-2002) в дозе 200 мг/кг м. т. в стерильном апирогенном 0.9%-ном растворе NaCl. После этого введение УНМ с питьевой водой было продолжено. Ввиду высокой летальности в группах животных эксперимент был досрочно прекращен на 16-е сутки.
Во втором эксперименте было сформировано восемь групп крыс с первой по восьмую численностью 8, 8, 8, 8, 14, 14, 14 и 14 особей соответственно. Крысы групп 1 и 5 получали с питьевой водой носитель, 2 и 6 – дисперсию МУНТ, 3 и 7 – ОСУНТ, 4 и 8 – ПГФ60. На 7, 14 и 21-е сутки крысам групп 1–4 вводили в/б по 1.0 мл раствора NaCl, а 5–8 – тот же объем раствора ЦФ в дозе 70 мг/кг м. т. На 32–33-е сутки опыта у выживших крыс собирали суточную мочу. Выведение животных из эксперимента выполняли на 35-е сутки путем декапитации под эфирной анестезией. Собирали кровь, определяли массу внутренних органов (печень, почки, селезенка, головной мозг, легкие, тимус, надпочечники, гонады) с точностью ±0.01 г.
Анализ биологических образцов. В сыворотке крови определяли биохимические показатели (содержание глюкозы, холестерина общего и ЛПВП, общего белка, альбуминов, мочевины, мочевой кислоты, активности трансаминаз АЛТ и АСТ, щелочной фосфатазы) по стандартным методикам на биохимическом анализаторе “Konelab 20i” (Финляндия); содержание цитокинов и хемокинов (GM-CSF, GRO/KC, IL-10, IL-12p70, IL-13, IL-17A, IL-18, IL-1α, IL-1β, IL-2, IL-4, IL-5, IL-6, IL-7, INF-γ, MCP-1, M-CSF, MIP-1a, MIP-3a, RANTES, TNF-α, VEGF, TGF-β1, TGF-β2, TGF-β3) методом мультиплексного иммуноанализа на приборе Luminex-200 (производства фирмы Luminex Corporation, США) по технологии хМАР с использованием программного обеспечения Luminex x PONENT Version 3.1. и наборов реактивов “Procarta Plex Rat” производства фирмы “Termo Fisher Scientific” (Австрия). В цельной крови определяли показатели эритроцитов и лейкоцитов на гематологическом анализаторе “Coulter AC TTM 5 diff OV” (производства фирмы “Beckman Coulter”, США) со стандартным набором реагентов (“Beckman Coulter”, Франция). Активность глутатионпероксидазы-I эритроцитов определяли согласно [12]. В моче определяли содержание креатинина спектрофотометрическим методом, селена микрофлуориметрическим методом [13] и 8-оксо-2-дезоксигуанозина методом ВЭЖХ [14]; в гомогенате печени – содержание восстановленных тиолов с реактивом Эллмана.
Статистическая обработка данных. Статистический анализ данных выполняли с использованием двухфакторного дисперсионного анализа ANOVA по факторам воздействия УНМ и ЦФ. Гипотезу о различии функции распределения данных в сравниваемых группах дополнительно проверяли с использованием непараметрического критерия Манна–Уитни. Различия принимали за достоверные на уровне значимости p < 0.05. Расчеты выполняли в пакете программ SPSS 20.0.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты эксперимента 1 (введение циклофосфамида в дозе 200 мг/кг м. т.). В эксперименте 1, начиная с третьих суток после инъекции ЦФ в дозе 200 мг/кг м. т. наблюдалась летальность животных (рис. 1а). К девятым суткам после инъекции, при выведении из эксперимента, она составила 7 из 11 (64%) в группе, получавшей носитель, 3 из 10 (30%) при потреблении МУНТ и 3 из 11 (27%) при потреблении ОСУНТ. Поскольку динамика гибели животных в двух последних группах не различалась, они были объединены, и в этом случае различие в летальности между группами, получавшей носитель и получавшими оба вида нанотрубок, было статистически достоверным (p < < 0.05, точный двусторонний тест Фишера). Вскрытие погибших крыс показало, что смерть наступала, по-видимому, вследствие развития двусторонней пневмонии. Таким образом, потребление как МУНТ, так и ОСУНТ приводит практически к двукратному снижению летальности, вызванной введением ЦФ, однако ввиду малого числа выживших животных в группах провести статистический анализ влияния наноматериалов на биохимические и иммунологические показатели не представилось возможным.
Рис. 1.
Летальность у крыс, получавших внутрибрюшинные инъекции ЦФ и углеродные наноматериалы с питьевой водой: а – эксперимент 1 с однократным введением ЦФ 200 мг/кг м.т.; б – эксперимент 2 с трехкратным введением ЦФ в дозе 70 мг/кг м. т. Летальность дана в процентах от числа животных в группе.
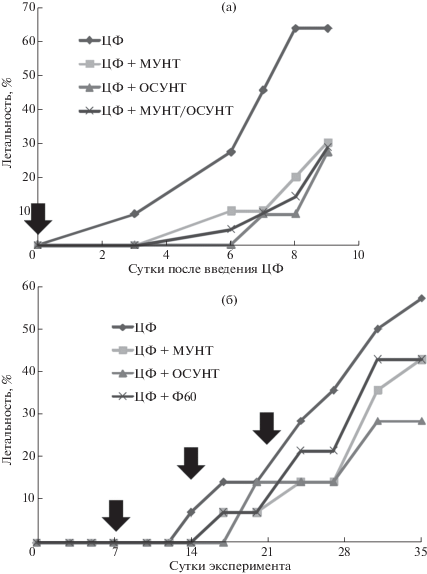
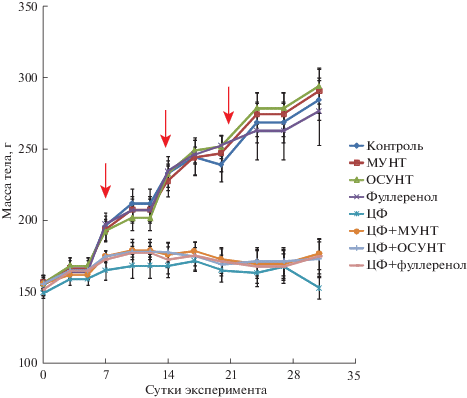
Результаты эксперимента 2 (трехкратное введение ЦФ в дозе 70 мг/кг м. т.). В первые двое–трое суток после первой инъекции ЦФ крысы групп 5–8 начали отставать в прибавке массы тела, которая у них практически не увеличилась к 35-м суткам опыта, тогда как животные групп 1–4, получавшие инъекции раствора NaCl, стабильно прибавляли в массе (рис. 2). К моменту выведения из эксперимента в группе 5 (рис. 1б) погибло 8 из 14 животных (57%), а летальность в группах 6–8 составила соответственно 43, 28 и 43%. Непосредственной причиной гибели всех животных по данным вскрытия явилась, по-видимому, пневмония. Летальность и заболеваемость животных в группах 1–4 отсутствовали. Ранее в трехмесячных экспериментах крысы, получавшие по аналогичной схеме МУНТ и ОСУНТ с питьевой водой в дозе 0.1 мг/кг м. т., также не демонстрировали летальности [9, 10]. Таким образом, потребление ОСУНТ (но не других наноматериалов) вызвало во втором эксперименте практически двукратное снижение летальности крыс, получавших инъекции ЦФ.
В конце эксперимента абсолютная масса селезенки у животных, получавших ЦФ, достоверно не отличалась от значений контрольных групп, тогда как абсолютная масса тимуса на фоне введения ЦФ уменьшилась в 2 раза (р < 0.05) по сравнению с контролем, а относительная масса (в процентах от массы тела) изменилась недостоверно.
У крыс группы 5, получавшей инъекцию ЦФ, наблюдалось по сравнению с животными контрольной группы 1 снижение таких индикаторов, характеризующих систему антиоксидантной защиты, как содержание восстановленных тиолов в печени (рис. 3а, p < 0.05), экскреция селена (рис. 3б, различие на уровне тенденции), активность селензависимой глутатионпероксидазы-1 (рис. 3в, p < 0.05). Отмечалось также более чем трехкратное повышение содержания 8-оксо-2-дезоксигуанозина в моче, однако в расчете на единицу содержания креатинина данное увеличение было недостоверным. Крысы, получавшие инъекции ЦФ, характеризовались гипогликемией (рис. 3г, p < 0.05), а также сниженным (p < 0.05) содержанием в сыворотке крови общего белка, альбумина, мочевины, триглицеридов, ЛПВП и повышенным содержанием мочевой кислоты, индекса атерогенности (ЛПНП/ЛПВП − определение расчетным методом) и коэффициента де-Ритиса (АСТ/АЛТ), рассматриваемого как индикатор интенсивности процессов катаболизма. Однако, за исключением двух последних показателей (повышение на 63 и 39%), амплитуда изменения остальных биохимических индикаторов была незначительной и не превышала 30%. Крысы, получавшие ЦФ, характеризовались значительным нарушением функции эритропоэза, судя по сниженному количеству эритроцитов (рис. 3д, p < 0.05), содержанию гемоглобина (рис. 3е, p < < 0.05) и гематокриту (рис. 3ж, p < 0.05). Для них были характерны выраженные лейко- и лимфопения (рис. 3з, 3и; p < 0.05). Введение с носителем МУНТ, ОСУНТ и ПГФ60 не оказывало у обработанных ЦФ животных достоверного влияния на перечисленные показатели, за исключением глутатионпероксидазы-I эритроцитов (рис. 3в), которая значимо повышалась в группе 7, получавшей ОСУНТ (р < 0.05 по сравнению с группой 5), экскреции селена (рис. 3б), которая достоверно снижалась в группе 6 (потребление дисперсии МУНТ), и количества лимфоцитов, которое было достоверно повышено в той же группе (р < 0.05 по сравнению с группой 5).
Рис. 3.
Показатели (M ± m), характеризующие токсическое действие ЦФ на крыс в эксперименте 2: а – содержание тиолов в печени, мкмоль/орган; б – экскреция селена с мочой, нг/мкмоль креатинина; в – активность глутатионпероксидазы-1 эритроцитов, мкмоль/мин/мг белка; г – концентрация глюкозы в сыворотке крови, моль/л; д – количество эритроцитов в крови, 1012/л; е – концентрация гемоглобина, г/л; ж – гематокрит, %; з – количество лейкоцитов, 109/л; и – количество лимфоцитов (109/л); к – концентрация IL-2, пг/мл; л – отношение концентраций IL-10/IL-17A, безразмерное. Представлены данные для групп 1 и 5 (а, г–з, к, л); 1, 2, 5 и 6 (и) и для всей выборки животных (б, в). * – различие с группой “контроль” достоверно, # – различие с группой “ЦФ” достоверно, p < 0.05, U-тест Манна–Уитни.
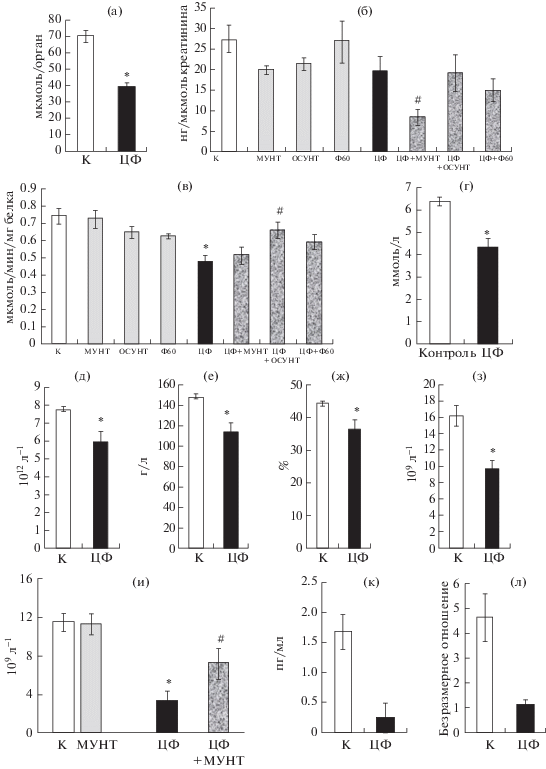
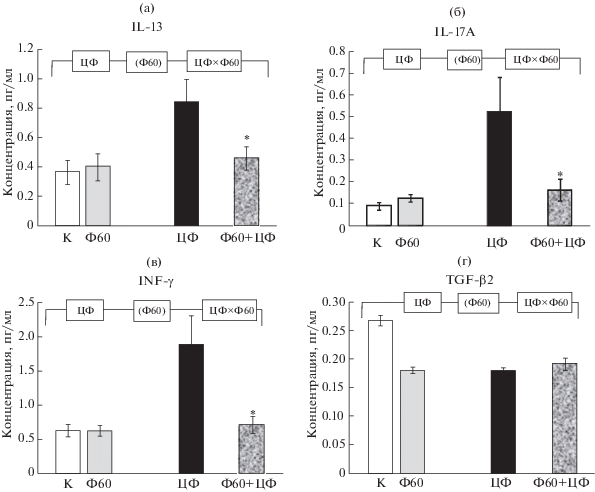
Сочетанное влияние циклофосфамида и углеродных наноматериалов на иммунологические показатели. Введение крысам групп 5–8 ЦФ привело у выживших животных к значительному изменению иммунного статуса, что выразилось в глубоких изменениях уровней цитокинов и хемокинов. В частности, средний уровень IL-2 (рис. 3к) снизился более чем шестикратно (p < 0.05), а безразмерное соотношение IL-10/IL-17A, характеризующее сравнительный уровень активности двух важнейших популяций Т-лимфоцитов (Th1 и Treg) [15], уменьшилось в 4 раза (рис. 3л, p < 0.05). Достоверно (p < 0.05) снизились уровни RANTES, TFG-β2 и TFG-β3. Напротив, содержание IL-4, 6, 13, 17А; IFN-γ, MIP-3a, TNF-α под действием ЦФ повысилось (ANOVA, p < 0.05 по фактору “ЦФ”). На фоне этих изменений, как показывают данные рис. 4, потребление крысами МУНТ приводило к достоверному снижению содержания в сыворотке крови IL-13, IL-17A, MIP-3a, IFN-γ (ANOVA, p < 0.05 по фактору “МУНТ”); оказывало понижающее действие на IL-4, IL-6 (ANOVA, p < 0.05 по фактору “ЦФ×МУНТ”), а также, возможно, на TNF-α (различие на уровне тенденции, ANOVA, p < 0.1 по фактору “МУНТ”). Потребление ОСУНТ крысами, обработанными ЦФ (рис. 5), вызывало снижение уровня IL-4, IL-13, IL-6, IL-7, а также, по-видимому, IL-17A (последнее с различием на уровне тенденции). Под воздействием фуллеренола (рис. 6) наблюдалось достоверное снижение концентраций IL-13, IL-17A и IFN-γ. Содержание TGF-β2, напротив, снижалось под влиянием фуллеренола только у не обработанных ЦФ крыс (ANOVA, p < 0.05 по факторам “ЦФ”, “ПГФ60” и “ЦФ×ПГФ60”). Направленность всех указанных изменений у получавших УНМ вместе с инъекциями ЦФ крыс соответствовала нормализации, т.е. сближала значения содержания цитокинов с показателями, характерными для контрольных животных. На остальные перечисленные выше индикаторы цитокинового статуса, являющиеся мишенями воздействия ЦФ, углеродные наноматериалы не оказывали значимого действия. У не обработанных ЦФ крыс (группы 2–4) отмечалось достоверное (p < 0.05) возрастание уровня TGF-β1 (наиболее выраженное для МУНТ) и снижение TGF-β2 и TGF-β3; в группе 4 (потребление ПГФ60) был достоверно снижен уровень GRO/KC. Уровни остальных цитокинов у крыс, не обработанных ЦФ, в результате потребления МУНТ, ОСУНТ и ПГФ60 изменялись недостоверно.
Рис. 4.
Влияние потребления дисперсии МУНТ на уровни цитокинов у крыс, получающих инъекции NaCl (контроль) и ЦФ: а – IL-13, б – IL-17A, в – IL-6, г – IFN-γ, д – IL-4, е – MIP-3а, ж – TNF-α. * – различие с группой “ЦФ” достоверно, p < 0.05, U-тест Манна–Уитни. Горизонтальная скобка – распределение неоднородно (ANOVA, p < 0.05) по факторам “ЦФ”, “МУНТ” и их комбинации (“ЦФ × МУНТ”).
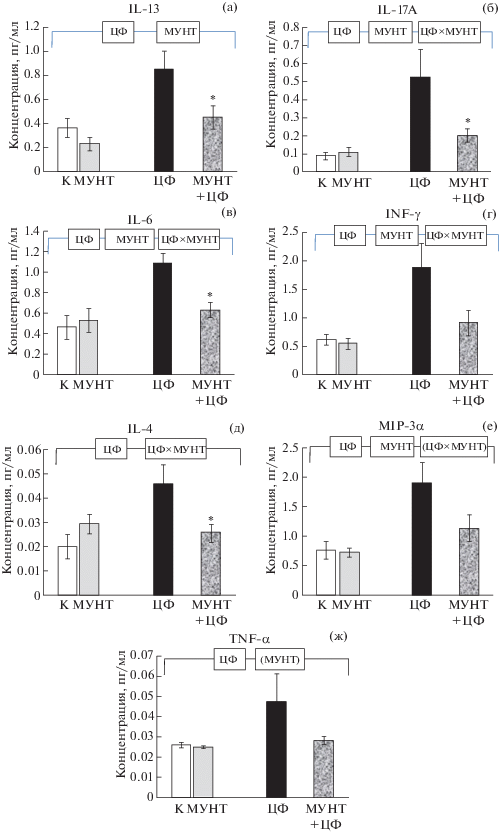
Рис. 5.
Влияние потребления дисперсии ОСУНТ на уровни цитокинов у крыс, получающих инъекции NaCl (контроль) и ЦФ: а – IL-13, б – IL-17A, в – IL-4, г – IL-6, д – IL-7. * – различие с группой “ЦФ” достоверно, p < 0.05, U-тест Манна–Уитни. Горизонтальная скобка – распределение неоднородно (ANOVA, p < 0.05) по факторам “ЦФ”, “ОСУНТ” и их комбинации (“ЦФ × ОСУНТ”).

Рис. 6.
Влияние потребления раствора фуллеренола на уровни цитокинов у крыс, получающих инъекции NaCl (контроль) и ЦФ: а – IL-13, б – IL-17A, в – IFN-γ, г – TGF-2β. * – различие с группой “ЦФ” достоверно, p < 0.05, U-тест Манна–Уитни. Горизонтальная скобка – распределение неоднородно (ANOVA, p < 0.05) по факторам “ЦФ”, “фуллеренол” (ПГФ60) и их комбинации (“ЦФ × ПГФ60”).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Циклофосфамид представляет собой алкилирующий противоопухолевый препарат. Его токсический эффект в отношении любых активно делящихся клеток связывают с развитием окислительного стресса [15]. При этом влияние ЦФ на клеточные субпопуляции обусловлено не только прямым цитотоксическим действием, но и развивающимися на фоне восстановления гемопоэза и миграции миелоидных и лимфоидных клеток системными иммуномодулирующими механизмами, включающими изменение соотношения Тreg и различных фенотипов Th-клеток и В-лимфоцитов. Это сопровождается стимуляцией или супрессией продукции многочисленных цитокинов [16, 17]. Индуцированная ЦФ гибель лейкоцитов сопровождается выработкой ряда специфических сигнальных молекул, что ведет к развитию асептического воспалительного ответа, поддерживаемого повышением продукции цитокинов и хемокинов. Данный феномен известен как “цитокиновый шторм” [18, 19]. Введение ЦФ модулирует экспрессию около тысячи генов, тесно связанных с процессами деструкции ДНК, окислительным стрессом, апоптозом, экспрессией образраспознающих рецепторов, цитокинов, хемокинов и их рецепторов [20].
Углеродные нанотрубки при поступлении в организм также могут вызывать системную иммуномодуляцию, оказывая влияние на функции Т-клеток [21]. По многим данным УНТ, такие как МУНТ и в меньшей степени ОСУНТ, способны активировать “респираторный взрыв” и продукцию провоспалительных цитокинов макрофагами по механизму “незавершенного фагоцитоза” [22]. Воздействие МУНТ на клетки бронхолегочного эпителия приводило к индукции пироптоза за счет активации комплекса NLRP3 инфламмосом [23]. Биологическим маркером провоспалительного действия МУНТ является повышенный уровень TGF-1β [24]. Одним из вероятных механизмов обусловленной УНТ иммуносупрессии является активация сигнального пути циклооксигеназы-2 (COX-2), что было показано в экспериментах на дефицитных по COX-2 животных [25]. Считается, что COX-2 может выступать в роли защитного фактора против воспалительной клеточной реакции и метаплазии [26]. Вызываемые под действием УНТ изменения данного фактора сопряжены с активацией смешанного Th1/Th2/Th17-иммунного ответа. В отличие от МУНТ и ОСУНТ фуллеренол С60(ОН)24 является одним из наиболее мощных из известных антиоксидантов [27].
Изначальной целью проведенных экспериментов было изучить предполагаемое синергическое усиление иммуносупрессивного действия ЦФ под влиянием углеродных наноматериалов (МУНТ, ОСУНТ и фуллеренола). По данным исследований [9, 10, 28] МУНТ и ОСУНТ при пероральном пути поступления характеризовались немонотонной зависимостью большого числа показателей токсичности от дозы с максимумом вблизи 0.1 мг/кг м. т. Поэтому в настоящем исследовании была выбрана данная действующая доза УНМ. Доза ЦФ выбрана в размере 200 мг/кг м. т. при однократном введении, что соответствует данным работы [11], в которой излагается методика воспроизведения ЦФ-индуцированной иммуносупрессии у мышей Balb/C. Однако в отличие от них у крыс Вистар в настоящей работе такая схема введения ЦФ привела к очень высокой летальности, что не позволило статистически достоверно определить большинство лабораторных показателей. Неожиданным результатом при этом явилось то, что потребление крысами УНТ существенно уменьшало гибель животных.
Поэтому во втором эксперименте схема введения ЦФ была изменена, его суммарную дозу (210 мг/кг м. т.) разделили на три равные порции, вводимые с недельным интервалом. В этих условиях наблюдались значительное угнетение роста животных и летальность, однако число выживших крыс было достаточным для проведения анализа биохимических и иммунологических показателей.
В условиях проведенного эксперимента из 25 исследуемых факторов под влиянием ЦФ достоверно повышались уровни цитокинов и ростовых факторов, продуцируемых преимущественно Th-1 (IFN-γ), Th-2 (IL-4, IL-6 и IL-13) и Th-17 (IL-17A, GM-CSF). Кроме того, были выявлены повышение содержания MIP-3A и уменьшение TGF-β2 и -β3, продуцируемых Т-регуляторными популяциями, макрофагами и клетками многих тканевых структур. Одновременно выявлено снижение уровня в плазме IL-2 и RANTES, участвующих в регуляции пролиферации, дифференцировки и активации Т-клеточных субпопуляций. Закономерными результатами введения ЦФ были снижение массы тимуса, угнетение эритропоэза, лимфопения, а также гипогликемия, нарушение липидного обмена и усиление катаболизма. Выявленные эффекты аналогичны известным из [15, 17, 27, 29].
Потребление крысами МУНТ, ОСУНТ и ПГФ60 не оказывало значимого действия на биохимические показатели, состояние системы эритропоэза, массу тимуса и селезенки, уровни таких ключевых регуляторных молекул, как IL-1α, IL-1β, IL-2, RANTES, соотношение IL-10/IL-17A, нарушенные вследствие затравки ЦФ. Однако уровни ряда цитокинов и хемокинов/ростовых факторов (IL-4, IL-13, IL-17A, IFN-γ, IL-18, GM-CSF, GRO-KC, IL-12p70, IL-1β, IL-7, TNF-α и VEGF) у крыс, получавших ЦФ в сочетании с УНМ, снижались по сравнению с животными, обработанными только ЦФ, приближаясь к контрольным значениям. Помимо этого, МУНТ значимо препятствовали падению общего числа лимфоцитов у животных, получавших ЦФ.
Таким образом, наблюдался парадоксальный эффект МУНТ и ОСУНТ на фоне воздействия ЦФ, состоящий в частичной отмене вызванных им нарушений и возвращении цитокинового профиля к нормальным значениям. Для объяснения этого явления следует принять во внимание известные из литературы эффекты УНТ, способствующие мобилизации, миграции, адгезии клеток крови и запуску иммунных реакций. Так, известно, что при поступлении УНТ в организм наблюдается гиперэкспрессия MYD88 (Myeloid differentiation primary response gene), кодирующего цитозольный белок, содержащий домен TIR, участвующий в функционировании TLR-рецепторов [30]. Другой специфически экспрессируемой при воздействии УНТ молекулой является IL-33, принадлежащий семейству интерлейкина 1 и действующий как фактор транскрипции для Т-хелперов типа 2, молекул адгезии и кластеров дифференцировки (CD49d и CD54/ICAM-1).
В проведенных экспериментах гибель животных с очень высокой вероятностью была обусловлена развивающимися на фоне постцитостатической аплазии костного мозга инфекционно-токсическими осложнениями при введении ЦФ в дозе около 200 мг/кг м. т. однократно или дробно. Известно, что существенно уменьшить эти осложнения после интенсивных курсов полихимиотерапии (комбинации цитостатических препаратов, применяемых при лечении гемобластозов и солидных опухолей) можно назначением препаратов G-/GM-CSF (гранулоцитарно-моноцитарные колониестимулирующие факторы) [31]. Ростовые факторы способствуют в этих случаях мобилизации из гемопоэтической ткани митотически не активных, ускользающих от цитостатического влияния, при этом ускоренно созревающих предшественников гранулоцитов и моноцитов с последующей миграцией в ткани для уменьшения интенсивности инфекционно-токсических осложнений. Можно предположить, что в проведенных экспериментах гиперэкспрессия мРНК MYD88, IL-33 и, как следствие этого, (CD)49d и CD54 (ICAM-1) способствовала мобилизации и миграции в ткани созревающих предшественников грануло-монопоэза с последующей редукцией инфекционно-токсических осложнений, что могло существенно снизить вызванную инфекционными осложнениями летальность на фоне введения ЦФ. В подтверждение сделанного предположения о механизме протективной роли УНТ за счет гиперэкспрессии мРНК MYD88 свидетельствует наличие у животных, нокаутных по гену MYD88 (rs7744), повышенной чувствительности к различным инфекционным заболеваниям, а также ассоциации дефицита этого фактора с аутоиммунными процессами типа язвенного колита [32–34].
Таким образом, проведенные исследования показали, что при пероральном введении МУНТ, ОСУНТ и ПГФ60 способны снижать проявления иммунотоксического действия ЦФ, включая летальность, лимфопению и нарушенный баланс провоспалительных цитокинов. Как можно понять из имеющихся данных литературы, подобный эффект в проведенном исследовании показан впервые. Механизм наблюдаемого протективного действия ПГФ60 может быть связан с его антиоксидантной активностью, тогда как для МУНТ и ОСУНТ предположительно обусловлен стимуляцией ими экспрессии иммунорегуляторных факторов, включая MYD88 и IL-33. Возможная значимость обнаруженных эффектов для практического применения углеродных наноматериалов в качестве носителей и вспомогательных средств в комбинированной цитостатической терапии заслуживает специального исследования.
Авторы выражают благодарность А.В. Селифанову и Х.С. Сото за предоставленные результаты биохимических анализов, А.Г. Масютину за проведение электронно-микроскопического исследования наноматериалов.
Работа проведена за счет средств субсидии на выполнение государственного задания в рамках Программы фундаментальных научных исследований (тема Минобрнауки России № 0529-2014-0053).
Список литературы
Bianco A., Kostarelos K., Prato M. // Curr. Opin. Chem. Biol. 2005. V. 9. № 6. P. 674. https://doi.org/10.1016/j.cbpa.2005.10.005
Kushwaha S.K.S., Ghoshal S., Rai A.K., Singh S. // Brazilian J. Pharm. Sci. 2013. V. 49. № 4. P. 629. https://doi.org/10.1590/S1984-82502013000400002
Fatkhutdinova L.M., Khaliullin T.O., Vasil’yeva O.L. et al. // Toxicol. Appl. Pharmacol. 2016. V. 299. P. 125. https://doi.org/10.1016/j.taap.2016.02.016
Aschberger K., Johnston H.J., Stone V. et al. // Crit. Rev. Toxicol. 2010. V. 40. № 9. P. 759. https://doi.org/10.3109/10408444.2010.506638
Van der Zande M., Junker R., Walboomers X.F., Jansen J.A. // Tissue Eng. Part B. Rev. 2011. V. 17 № 1. P. 57. https://doi.org/10.1089/ten.TEB.2010.0472
Ahlmann M., Hempel G. // Cancer Chemother. Pharmacol. 2016. V. 78. P. 661. https://doi.org/10.1007/s00280-016-3152-1
Teles K.A., Medeiros-Souza P., Lima F.A.C. et al. // Rev. Bras. Reumatol. Engl. Ed. 2017. V. 57. № 6. P. 596. https://doi.org/10.1016/j.rbre.2016.09.008
Azqhandi M.H.A., Farahani B.V., Dehghani N. // Mater. Sci. Eng. C. 2017. V. 79. P. 841. https://doi.org/10.1016/j.msec.2017.05.089
Shipelin V.A., Shumakova A.A., Masyutin A.G. et al. // Nanotechnologies in Russia. 2017. V.12. № 9–10. P. 559. https://doi.org/10.1134/S199507801705010X
Шипелин В.А., Ригер Н.А., Трушина Э.Н. и др. // Гигиена и санитария. 2018. Т. 97. № 11. С. 1114. https://doi.org/10.18821/0016-9900-2018-97-11-1114-21
Лебединская Е.А., Лосева Л.Ф., Лебединская О.В. и др. // Фундаментальные исследования. 2008. № 10. С. 78.
Разыграев А.В. // Клинико-лабораторный консилиум. 2004. № 4. С. 19.
Голубкина Н.А. // Журн. аналит. химии. 1995. Т. 50. № 8. С. 492.
De Martinis B.S., Bianchi M.L.P. // Pharmacol. Res. 2002. V. 46. № 2. P. 129. https://doi.org/10.1016/s1043-6618(02)00080-4
El-Sebaey A.M., Abdelhamid F.M., Abdalla O.A. // Environ. Sci. Pollut. Res. Int. 2019. V. 26. P. 15559. https://doi.org/10.1007/s11356-019-04993-7
Galluzzi L., Buque A., Kepp O. et al. // Nat. Rev. Immunol. 2017. V. 17. P. 97. https://doi.org/10.1038/nri.2016.107
Buccione C., Fragale A., Polverino F. et al. // Int. J. Cancer. 2018. V. 142. № 5. P. 976. https://doi.org/10.1002/ijc.31083
Bracci L., Moschella F., Sestili P. et al. // Clin. Cancer Res. 2007. V. 13. № 2. P. 644. https://doi.org/10.1158/1078-0432.CCR-06-1209
Moschella F., Valentini M., Arico E. et al. // Cancer Res. 2011. V. 71. № 10. P. 3528. https://doi.org/10.1158/0008-5472.CAN-10-4523
Moschella F., Torelli G.F., Valentini M. et al. // Clin. Cancer Res. 2013. V. 19. № 15. P. 4249. https://doi.org/10.1158/1078-0432.CCR-12-3666
Mitchell L.A., Gao J., Wal R.V. et al. // Toxicol Sci. 2007. V. 100. № 1. P. 203. https://doi.org/10.1093/toxsci/kfm196
Madani S.Y., Mandel A., Seifalian A.M. // Nano Rev. 2013. V. 4. P. 21521. https://doi.org/10.3402/nano.v4i0.21521.
Hussain S., Sangtian S., Anderson S. et al. // Part. Fibre Toxicol. 2014. V. 11. P. 28. https://doi.org/10.1186/1743-8977-11-28
Fatkhutdinova L.M., Khaliullin T.O., Zalyalov R.R. et al. // Nanotechnologies in Russia. 2016. V. 11. № 1–2. P. 110. https://doi.org/10.1134/S1995078016010055
Mitchell L.A., Lauer F.T., Burchiel S.W., Mcdonald J.D. // Nat. Nanotechnol. 2009. V. 4. P. 451. https://doi.org/10.1038/nnano.2009.151
Sayers B.C., Taylor A.J., Glista-Baker E.E. et al. // Am. J. Respir. Cell. Mol. Biol. 2013. V. 49. P. 525. https://doi.org/10.1165/rcmb.2013-0019OC
Xiao L., Takada H., Maeda K. et al. // Biomed. Pharmacother. 2005. V. 59. № 7. P. 351. https://doi.org/10.1016/j.biopha.2005.02.004
Gmoshinski I.V., Shumakova A.A., Shipelin V.A. et al. // Nanotechnologies in Russia. 2019. V. 14. № 3–4. P. 149. https://doi.org/10.1134/S1995078019020071
Choi E.W., Lee M., Song J.W. et al. // Sci. Rep. 2016. V. 6. P. 38237. https://doi.org/10.1038/srep38237
Yamaguchi A., Fujitani T., Ohyama K. et al. // J. Toxicol. Sci. 2012. V. 37. № 1. P. 177. https://doi.org/10.2131/jts.37.177
Liu Q., Qiao L., Hu P. et al. // JBUON. 2017. V. 22. № 1. P. 21.
Van der Weyden L., White J.K., Adams D.J., Logan D.W. // Genome Biol. 2011. V. 12. № 6. P. 224. https://doi.org/10.1186/gb-2011-12-6-224
Netea M.G., Wijmenga C., O’Neill L.A. // Nature Immunol. 2012. V. 13. P. 535. https://doi.org/10.1038/ni.2284
Matsunaga K., Tahara T., Shiroeda H. et al. // Mol. Med. Reps. 2014. V. 9. № 1. P. 28. https://doi.org/10.3892/mmr.2013.1769
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии