Российские нанотехнологии, 2020, T. 15, № 2, стр. 213-218
ИССЛЕДОВАНИЕ НЕЙРОПРОТЕКТОРНЫХ СВОЙСТВ ФУЛЛЕРЕНОЛА С60(ОН)30 НА МОДЕЛИ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
А. Д. Слободина 1, О. И. Большакова 1, А. Е. Комиссаров 1, Н. В. Сурина 1, С. Б. Ланда 1, П. А. Мелентьев 1, С. В. Саранцева 1, *
1 Петербургский институт ядерной физики Национального исследовательского центра “Курчатовский институт”
Гатчина, Россия
* E-mail: Sarantseva_SV@pnpi.nrcki.ru
Поступила в редакцию 18.06.2020
После доработки 30.06.2020
Принята к публикации 30.06.2020
Аннотация
Актуальной задачей современной медицины является поиск препаратов, способных остановить или замедлить течение нейродегенеративных заболеваний, в частности болезни Альцгеймера. Целью работы являлось определение эффекта фуллеренола С60(OH)30 на патогенез болезни Альцгеймера на модели Drosophila melanogaster. Исследовано влияние фуллеренола на продолжительность жизни, уровень геотаксиса, обучаемость и память, уровень нейродегенерации и активных форм кислорода в мозге животных. На основе полученных результатов можно предположить, что фуллеренол С60(ОН)30 является перспективным агентом для разработки комплексной терапии болезни Альцгеймера.
ВВЕДЕНИЕ
Болезнь Альцгеймера (БА) является наиболее распространенной формой нейродегенеративных заболеваний. Она характеризуется прогрессирующим расстройством памяти и речи, нарушением когнитивных функций, распадом интеллекта [1]. Установлено, что риск развития БА значительно увеличивается с возрастом [2]. Несмотря на значительные усилия, направленные на поиск препаратов, способных остановить или замедлить течение БА, до сих пор не удалось разработать эффективные методы лечения этого заболевания. Успехи современной медицины и повышение качества жизни привели к значительному увеличению средней продолжительности жизни населения в большинстве развитых стран. Это, в свою очередь, повлекло за собой рост числа случаев заболеваний у лиц пожилого возраста, в том числе увеличение заболеваемости БА. Для лечения и ухода за людьми, страдающими БА, требуются большие экономические затраты. Согласно прогнозам в ближайшие несколько десятилетий ожидаются существенное старение населения и рост числа больных БА. Таким образом, БА является не только нерешенной медико-биологической, но и важной социально-экономической проблемой современного общества [3].
Значительная часть исследований показывает, что накопление в мозге токсических интермедиатов амилоидных фибрилл является центральным звеном в патогенезе БА. Согласно современным представлениям наибольшей токсичностью обладают олигомеры амилоидного пептида β (Aβ) [4, 5]. В связи с этим перспективным подходом в терапии БА может служить поиск биологических молекул и химических соединений, взаимодействующих in vivo с Aβ и блокирующих его агрегацию [6].
Одним из факторов риска развития БА является Aβ-индуцированный окислительный стресс. Для предотвращения его негативных последствий в мозге при разработке терапии можно использовать различные антиоксиданты, к которым относятся фуллерены. Благодаря многочисленным исследованиям свойств фуллеренов и их производных в последнее время был обнаружен широкий спектр биологической активности этих веществ, которая обусловлена совокупностью физико-химических свойств этих молекул – липофильностью, электронодефицитностью и способностью генерировать синглетный кислород после облучения. Благодаря этим свойствам фуллерены могут найти применение в биологии и медицине [7]. Основная проблема изучения биологических свойств фуллеренов связана с их нерастворимостью в воде и других полярных растворителях, низкой биосовместимостью и склонностью к образованию агрегатов. Одним из способов преодоления указанных недостатков может служить функционализация молекул фуллеренов за счет присоединения химических групп (–NH2, –OH, –COOH и др.) или других молекул. Наиболее простым и освоенным методом является присоединение гидроксильных групп – гидроксилирование фуллеренов, при этом образуются фуллеренолы [7–9].
В экспериментах in vitro не всегда удается воспроизвести условия целого организма, поэтому нейродегенеративные заболевания изучаются на клеточных культурах и трансгенных животных. Одним из наиболее удобных модельных объектов для исследования механизмов, лежащих в основе развития таких заболеваний, является плодовая мушка Drosophila melanogaster. Это многоклеточный организм, представляющий промежуточную модельную систему между культурами клеток различного происхождения, одноклеточными организмами и млекопитающими. На сегодняшний день Drosophila melanogaster является наиболее изученным во всех биологических аспектах модельным объектом [10–12].
В настоящей работе исследовано влияние фуллеренола С60(ОН)30 на патогенез БА при моделировании его у Drosophila melanogaster.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез фуллеренола С60(ОН)30 провели в лаборатории нейтронных физико-химических исследований НИЦ “Курчатовский институт” – ПИЯФ, новым оригинальным двухстадийным способом [13].
Для приготовления препаратов амилоидный пептид β, состоящий из 42 аминокислот (Aβ42), был разведен в натрий-фосфатном буфере (PBS), pH 7.5, в концентрации 5 мкМ. К готовому раствору добавляли фуллеренол С60(OH)30 в концентрации 10 мг/мл. Препараты инкубировали в течение 24 ч при температуре 37°C.
Для проведения атомно-силовой микроскопии (АСМ) на поверхность свежесколотой слюды наносили по 2 мкл образца. Образцы промывали деионизированной водой и высушивали на воздухе. Изображения получены на атомно-силовом микроскопе Solver Bio (NT-MDT) в режиме прерывистого контакта с использованием зонда NSG03 при частоте сканирования 1 Гц. В трех идентичных образцах было изучено не менее пяти областей на поверхности слюды, чтобы подтвердить однородность их структуры и определить морфологию [14].
Исследование свойств фуллеренола in vivo проводили на трансгенной линии Drosophila melanogaster, которая хорошо воспроизводит основные патологические и клинические черты БА [15]. Линия UAS-APP.Abeta42.В (Ab) содержит в геноме последовательность, кодирующую пептид Aβ42. Экспрессию трансгена проводили в нервных и фоторецепторных клетках мух в системе UAS-GAL4 с помощью активаторов транскрипции elav-GAL4 и GMR-GAL4 соответственно [16]. Далее в тексте потомки от скрещивания особей этих линий и линии Ab обозначены как elav;Ab и GMR;Ab соответственно. Все линии получены из Bloomington Drosophila Stock Center, (США). Мухи содержались при температуре 25°С и 12-часовом световом дне.
Оценку продолжительности жизни осуществляли у одновозрастных имаго. Мух содержали в пробирках с агаром по 30 особей. На агар наносили 80 мкл корма (1 г дрожжей, разведенных в 6 мл воды). В контрольных группах мух кормили дрожжами, инактивированными нагреванием до 65°C, в опытных группах в корм добавляли фуллеренол С60(ОН)30 в различных концентрациях (0.05, 0.5, 2.5 мг/мл). Каждые трое суток живых мух пересаживали на свежую среду с кормом и проводили подсчет умерших особей в контрольных и опытных группах. Наблюдение проводили до обнаружения последней погибшей мухи. По окончании эксперимента подсчитывали всех учтенных особей и принимали сумму за 100%. Далее строили график зависимости количества живых особей от их возраста, фиксировали показатели максимальной продолжительности жизни и 50%-ной выживаемости. В каждом эксперименте было учтено не менее 300 мух. Каждый из вариантов эксперимента повторяли трижды.
Анализ поведения Drosophila заключался в оценке уровня отрицательного геотаксиса (движения организмов, обусловленного силой земного притяжения) на 30-й день жизни мух. На высоком пластиковом флаконе делали отметку на расстоянии 4 см от дна. Мух (примерно 20 особей) помещали во флакон, осторожным постукиванием по флакону опускали мух на дно. Через 5 с фотографировали флакон и подсчитывали количество мух в верхней и нижней части флакона на фотографии. В каждом эксперименте тестировали по 300 мух. Эксперимент проводили в трех и более повторностях.
Уровень нейродегенерации оценивали на 30-й день жизни мух, анализируя парафиновые срезы глазных долей мозга мух. Оценивали дегенерацию фоторецепторных клеток. Для получения препаратов мозга мух фиксировали в 4%-ном параформальдегиде в течение 24 ч при температуре 4°С. Затем проводили обезвоживание в этаноле и метиловом эфире бензойной кислоты и заливали парафином. Полученные парафиновые срезы толщиной 6 мкм окрашивали гематоксилином и эозином. Препараты заключали в монтирующую среду и анализировали с помощью светового микроскопа Leica DM 2500. В каждом эксперименте анализировали по шесть препаратов мозга мух. Степень нейродегенарции оценивали по соотношению площади вакуолей ко всей площади глаза в программе ImageJ.
Анализ обучаемости и среднесрочной памяти проводили классическим методом [17].
Для анализа уровня активных форм кислорода в мозге мух использовали флуоресцентный маркер H2DCF-DA (MolecularProbes/Invitrogen, Carlsbad, USA) согласно инструкции производителя.
Достоверность различий между контролем и вариантами эксперимента определяли с помощью t-критерия Стьюдента в программе Kyplot. Полученные данные сначала были проверены на нормальность распределения критерием Шапиро–Уилка. Далее анализ проводили с помощью t-критерия Стьюдента. Ошибкой обозначен 95%-ный доверительный интервал. Статистические решения принимали на уровне значимости: p < 0.05 (*), p < 0.01 (**), p < 0.001 (***). При анализе обучаемости и памяти статистический анализ данных проводили в программе Statistica10, используя методы: критерий Колмогорова–Смирнова для оценки нормальности распределения; непараметрические критерии Краскела–Уоллиса, Колмогорова–Смирнова и Манна–Уитни для попарных сравнений независимых выборок; непараметрический медианный тест для попарных сравнений независимых выборок.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На первом этапе работы методом АСМ было проведено исследование морфологических характеристик препарата Aβ42. В инкубированных образцах наблюдался плотный слой агрегатов разного типа (рис. 1а), что отражает разные стадии фибриллогенеза: асимметричные гранулярные частицы диаметром до 50–60 нм, короткие неразветвленные структуры длиной до 100 нм, стабильные высокоупорядоченные неразветвленные нити длиной до 300 нм и диаметром 40–50 нм (амилоидные фибриллы). В образцах также присутствовали пучки линейных фибрилл (около трех-четырех нитей), короткие фибриллярные структуры, возможно, протофибриллы,
Рис. 1.
АСМ-изображения агрегатов, образующихся при инкубации Aβ42 (а) и при совместной инкубации Aβ42 и фуллеренола С60(OH)30 (б).

При инкубации Aβ42 с фуллеренолом агрегация Aβ42 снижалась относительно контроля (рис. 1б). В образцах присутствовали только гранулярные частицы, а фибриллярные образования отсутствовали. По-видимому, наблюдаемые структуры являются комплексами мономеров или олигомеров Aβ42 и фуллеренола, что предотвращает образование зрелых амилоидных фибрилл и останавливает амилоидогенез. Действительно, показано, что фуллерены ингибируют агрегацию Aβ на ранней стадии, специфически связываясь с его центральным гидрофобным мотивом, KLVFF [18].
Исследование нейропротекторных свойств С60(OH)30in vivo проводили на модели БА Drosophila melanogaster. На первом этапе работы оценивали продолжительность жизни животных (рис. 2).
Рис. 2.
Кривые выживаемости Drosophila melanogaster линии elav;Ab при добавлении фуллеренола С60(ОН)30 в корм.
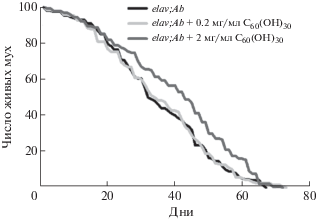
Из графиков на рис. 2 видно, что фуллеренол С60(ОН)30 не оказывает токсического воздействия на мух линии Ab. Напротив, при использовании дозы 2.0 мг/мл наблюдается достоверное увеличение 50%-ной выживаемости мух (32 дня в контроле и 43 дня при добавлении в корм фуллеренола), что говорит об улучшении качества жизни животных.
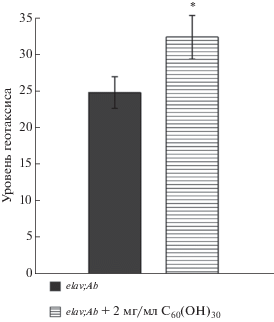
Был проведен анализ влияния С60(ОН)30 на нарушение поведенческих функций, наблюдаемых у мух elav;Ab. Анализ поведения заключался в оценке доли 30-дневных мух, преодолевающих условную черту в тесте на отрицательный геотаксис (рис. 3). Из представленных данных видно, что при добавлении в корм фуллеренола С60(ОН)30 наблюдается улучшение этого показателя у мух.
Рис. 3.
Уровень отрицательного геотаксиса Drosophila melanogaster линии elav;Ab на 30-й день жизни при добавлении фуллеренола С60(ОН)30 в корм. Статистически значимые результаты отмечены звездочками (*p < 0.05).
В мозге мух с экспрессией последовательности Aβ42 развивается прогрессирующая с возрастом нейродегенерация, которая захватывает также фоторецепторные клетки. Нейродегенерация проявляется в виде полостей, наблюдаемых на парафиновых срезах мозга мух (рис. 4а). В то же время добавление в корм фуллеренола С60(ОН)30 статистически значимо снижало уровень дегенерации фоторецепторных клеток у мух GMR;Ab (рис. 4б, 4в).
Рис. 4.
Парафиновые срезы глазных долей мух линии GMR;Ab на 30-й день жизни: а – контрольный мозг мухи; б – мозг мухи, в корм которой добавляли фуллеренол С60(ОН)30 в концентрации 2 мг/мл. Стрелками показаны вакуоли; в – уровень дегенерации фоторецепторных клеток мух линии GMR;Ab на 30-й день жизни при добавлении фуллеренола С60(ОН)30 в корм (***p < 0.01).

Основным клиническим признаком БА является снижение когнитивных функций, таких как способность к обучению и память. Drosophila имеет хорошо развитую центральную нервную систему и поведенческие реакции, которые делают возможным исследовать нарушение памяти и когнитивных функций на этом модельном объекте. Анализ влияния фуллеренола С60(ОН)30 на показатели обучаемости (измеренные сразу после обучения) и среднесрочной памяти (измеренные через 30–60 мин после обучения) проводили на 30-й день жизни животных (рис. 5).
Рис. 5.
Квартильная диаграмма: коэффициенты обучаемости и среднесрочной памяти особей Drosophila melanogaster на 30-й день жизни при добавлении фуллеренола С60(ОН)30 в корм: а – коэффициенты обучаемости; б – коэффициенты среднесрочной памяти.
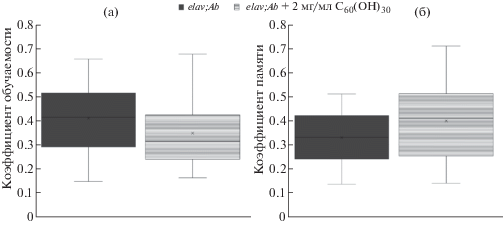
У мух, в корм которых добавляли фуллеренол С60(ОН)30, статистически значимых различий коэффициентов обучаемости и среднесрочной памяти не было обнаружено. Для этих мух значение медианы коэффициента обучаемости составило 0.35, а коэффициента памяти – 0.40.
Как было отмечено ранее, окислительный стресс является одним из маркеров БА. Многочисленные работы показывают увеличение уровня свободных радикалов в мозге больных БА [19–21]. В настоящей работе также наблюдали повышение уровня активных форм кислорода в мозге 30-дневных мух с генотипом elav;Ab, который был измерен с помощью флуоресцентного зонда H2DCF-DA. Добавление в корм фуллеренола С60(ОН)30 снижало уровень активных форм кислорода (рис. 6).
В последнее время появился ряд работ, посвященных изучению антиамилоидных свойств фуллеренов и их производных. Так, в [22] методом электронной микроскопии показано, что гидратированный фуллерен С60 связывается с растущими амилоидными фибриллами пептида Аβ25–35 и препятствует их дальнейшему росту. В [23] методом АСМ обнаружено, что фуллерены С60 и С180 ингибируют рост фибрилл, образованных пептидом Аβ16–22, причем фуллерен С180 обладает более сильным антиамилоидным потенциалом. В [9] с помощью методов флуоресцентного анализа, АСМ и компьютерного моделирования показано, что фуллеренол С60(OH)16 является эффективным ингибитором образования амилоидных фибрилл пептида Аβ40.
Наблюдаемые в проведенном исследовании эффекты у мух, воспроизводящих признаки БА, вероятно, связаны как с подавлением агрегации Аβ фуллеренолом С60(ОН)30, так и снижением интенсивности окислительного стресса. В то же время не обнаружено влияния С60(ОН)30 на основные клинические проявления БА – обучаемость и память животных. В литературе представлены данные о положительных эффектах фуллеренов и их производных на эти показатели. Так, в [24] одновременное введение пептида Аβ25–35 и фуллерена С60 в мозг крыс предотвращало нейродегенерацию, вызываемую введением одного Аβ25–35, и улучшало их способность к обучению и память. Наблюдаемые различия могут быть обусловлены методом введения наночастиц в организм. Так, фуллерен С60 вводился непосредственно внутрь гиппокампа. В проведенном эксперименте С60(ОН)30 добавлялся в корм животным.
Таким образом, фуллерены и их производные могут рассматриваться в качестве лекарственных препаратов для терапии БА благодаря их основным свойствам: эти молекулы обладают антиоксидантной активностью и, взаимодействуя с Аβ, препятствуют его агрегации.
ЗАКЛЮЧЕНИЕ
Методом атомно-силовой микроскопии установлено, что инкубация Aβ42 с фуллеренолом С60ОН30 в течение 24 ч при температуре 37°C снижает агрегацию Aβ42, что указывает на его антиамилоидогенную активность.
Эксперименты in vivo показали, что добавление данного фуллеренола в концентрации 2.0 мг/мл в корм мух, в нервных клетках которых синтезировался Aβ42, приводит к достоверному увеличению 50%-ной выживаемости животных и снижению уровня дегенерации фоторецепторных клеток и активных форм кислорода. В то же время не было обнаружено влияния применения данного вещества на такие параметры, как обучение и память животных. Следовательно, фуллеренол С60(ОН)30 является перспективных агентом для разработки комплексной терапии БА.
Авторы выражают благодарность Алине Борисенковой за предоставленные образцы фуллеренола.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований (проект № 15-29-01350).
Список литературы
Tiwari S., Atluri V., Kaushik A. et al. // Int. J. Nanomedicine. 2019. V. 14. P. 5541.
Lane C.A., Hardy J., Schott J.M. // Eur. J. Neurol. 2018. V. 25. P. 59.
Marešová P., Mohelská H., Dolejš J., Kuča K. // Curr. Alzheimer Res. 2015. V. 12. P. 903.
Selkoe D.J. // Behav Brain Res. 2008 . V. 192. P. 106.
Chen X.Q., Mobley W.C. // Front Neurosci. 2019 V. 13. P. 659.
Koseoglu E. //World J. Clin. Cases. 2019. V. 7. P. 1764.
Бобылёв А.Г., Марсагишвили Л.Г., Шпагина М.Д. и др. // Биофизика. 2010. Т. 55. № 3. С. 394.
Бобылёв А.Г., Шаталин Ю.В., Вихлянцев И.М. и др. // Биофизика. 2014. Т. 59. № 5. С. 843.
Bednarikova Z., Huy P.D.Q., Mocanu M.M. et al. // Phys. Chem. Chem. Phys. 2016. V. 18. P. 18855.
Pandey U.B., Nichols C.D. // Pharmacol. Rev. 2011. V. 63. P. 411.
McGurk L., Berson A., Bonini N.M. // Genetics. 2015. V. 201. P. 377.
Tsuda L., Lim Y.M. // Adv. Exp. Med. Biol. 2018. V. 1076. P. 25.
Bolshakova O., Borisenkova A., Suyasova M. et al. // Mater. Sci. Eng. C. 2019. V. 104. P. 109945.
Hirohata M., Ono K., Takasaki J. et al. // Biochim. Biophys. Acta. 2012. V. 1822. P. 1316.
Iijima K., Liu H.P., Chiang A.S. et al. // Proc. Natl. Acad. Sci. U S A. 2004. V. 101. P. 6623.
Brand A.H., Perrimon N. // Development. 1993. V. 118. № 2. P. 401.
Tully T., Quinn W.G. // J. Comp. Physiol. 1985. V. 157. № 2. P. 263.
Kim J.E., Lee M. // Biochem. Biophys. Res. Commun. 2003. V. 303. P. 576.
Chen Z., Zhong C. // Neurosci Bull. 2014. V. 30. P. 271.
Tönnies E., Trushina E. // J. Alzheimers Dis. 2017. V. 57. P. 1105.
Cassidy L., Fernandez F., Johnson J.B. et al. // Theor Med. 2020. V. 49. P. 102294.
Подлубная З.А., Подольский И.Я., Шпагина М.Д., Марсагишвили Л.Г. // Биофизика. 2006. Т. 51. № 5. С. 795.
Марусенко И.М., Авдеева Я.А., Польская И.И. // Современная ревматология. 2009. № 3. С. 50.
Gordon R., Podolski I., Makarova E. et al. // J. Alzheimers Dis. 2017. V. 58. P. 711.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии



