Российские нанотехнологии, 2020, T. 15, № 2, стр. 137-151
ПЕРСПЕКТИВНЫЕ ПОДХОДЫ К КОЛИЧЕСТВЕННОМУ ОПРЕДЕЛЕНИЮ ИОНОВ МЕДИ В БИОЛОГИЧЕСКИХ СИСТЕМАХ
Р. В. Тимошенко 1, *, А. Н. Ванеев 1, 2, Н. А. Савин 1, Н. Л. Клячко 2, Ю. Н. Пархоменко 1, С. В. Салихов 1, А. Г. Мажуга 1, 2, П. В. Горелкин 1, А. С. Ерофеев 1, 2
1 Национальный исследовательский технологический университет “МИСиС”
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: timoshenkoroma@mail.ru
Поступила в редакцию 04.05.2020
После доработки 01.06.2020
Принята к публикации 02.06.2020
Аннотация
В обзоре приведены и классифицированы современные аналитические методы количественного определения ионов меди, ориентированные преимущественно на возможность или перспективу их применения в биологических системах. Проведен сравнительный анализ спектроскопических, электрохимических, флуоресцентных методов по ключевым критериям: предел обнаружения метода, возможность применения in vivo/in vitro, возможность проведения измерений в режиме реального времени.
ОГЛАВЛЕНИЕ
1. Роль меди в живых организмах
1.1. Медь в биохимических процессах
1.2. Нарушение регуляции меди в организме
1.3. Лекарственные препараты на основе меди
2. Количественное определение ионов меди в биологических системах
2.1. Спектроскопические и спектрометрические методы анализа
2.2. Сенсоры на основе микрокантилеверов
2.3. Сенсоры на основе транзисторов
2.4. Хемосенсоры
2.5. Электрохимические методы
2.6. Сенсоры на основе нанокапилляров и нанопор
Выводы
1. РОЛЬ МЕДИ В ЖИВЫХ ОРГАНИЗМАХ
1.1. Медь в биохимических процессах
В организме человека медь является третьим по распространенности микроэлементом после железа и цинка [1]. Ее содержание в организме взрослого человека варьируется в диапазоне от 75 до 100 мг [2]. При этом большая часть меди находится в скелете и костном мозге (~46 мг), скелетных мышцах (~26 мг), печени (~10 мг), мозге (~8.8 мг), крови (~6 мг) [3–5]. Значительное количество ферментов, ответственных за метаболизм, функционирует должным образом благодаря ионам меди [6]. Ионы меди участвуют в производстве гемоглобина, меланина, миелина, тироксина, а также являются компонентами таких ферментов, как лизилоксидаза, церулоплазмин, супероксиддисмутаза, цитохром с-оксидаза и т.д. [7, 8]. В биологических системах ионы меди в зависимости от заряда могут выступать как антиоксиданты и прооксиданты [9, 10].
В организме человека медь находится преимущественно в двух формах Cu+ (восстановленная форма) и Cu2+ (окисленная форма), образуя многочисленные комплексы как с органическими, так и неорганическими лигандами [11, 12].
1.2. Нарушение регуляции меди в организме
Помимо обеспечения жизненно важных процессов ионы меди в организме человека могут инициировать нежелательные реакции, например окислительно-восстановительные, взаимодействуя с активными формами кислорода (АФК), наиболее распространенными из которых являются пероксид водорода (H2O2) и супероксидный радикал ($O_{2}^{{\centerdot - }}$). Впервые уравнение реакции превращения перекиси водорода и супероксид-аниона в присутствии ионов переходных металлов, в том числе ионов меди, было описано Габером и Вейссом [13] и имеет следующий вид:
(1)
${\text{O}}_{2}^{{\centerdot - }} + {{{\text{H}}}_{2}}{{{\text{O}}}_{2}}\xrightarrow{{{\text{F}}{{{\text{e}}}^{{3 + }}}{\text{/F}}{{{\text{e}}}^{{2 + }}}{\text{или\;C}}{{{\text{u}}}^{ + }}}}{\text{\;}}{{{\text{O}}}_{2}}\, + \,{\text{\;O}}{{{\text{H}}}^{\centerdot }}\, + {\text{\;}}\,{\text{O}}{{{\text{H}}}^{ - }}.$Результатом этой реакции являются высокореакционноспособные гидроксильные радикалы, которые, как и АФК, могут реагировать практически с любым типом биомолекул [14]. Также в процессе реакции (1) могут образовываться другие виды АФК, например синглетный кислород [15]. Кроме того, уравнение Габера–Вейсса показывает, что метаболизм АФК тесно связан с метаболизмом металлов, в том числе меди, обладающих различными степенями окисления.
Для всех биологических систем характерен баланс между образованием АФК и их нейтрализацией за счет антиоксидантных систем. Увеличение скорости образования АФК или недостаточная эффективность антиоксидантных систем приводят к окислительному стрессу в клетках организма [16]. Увеличение концентрации меди и окислительный стресс являются отличительными признаками ряда злокачественных новообразований. Медь участвует в процессе канцерогенеза. Вызывая пролиферацию и миграцию эндотелиальных клеток путем активации различных ангиогенных факторов (например, эндотелиальный фактор роста, основной фактор роста фибробластов, фактор некроза опухоли), медь приводит к образованию новых кровеносных сосудов и росту опухоли [17]. Кроме того, доказано, что повышенный уровень меди напрямую коррелирует с прогрессированием рака [18].
Окислительный стресс, вызванный чрезмерным образованием АФК, может способствовать развитию нейродегенеративных заболеваний. Один из ярких примеров – болезнь Альцгеймера. При заболевании Альцгеймера функция, отвечающая за связывание и транспортировку меди по всей длине нейрона, нарушается. Параллельно происходят его агрегация и фрагментация. Кроме того, медь накапливается в амилоидных бляшках, что приводит к уменьшению активности цитохром с-оксидазы и супероксиддисмутазы. Последствиями всех этих процессов являются повреждение нейронов и ослабление основных метаболических и защитных механизмов [19].
Как было отмечено ранее, медь является кофактором для некоторых ферментов, поэтому нарушение ее регуляции может приводить к неправильному функционированию ферментов. Примером заболевания, связанного с нарушением регуляции меди в организме человека, является болезнь Вильсона, при которой нарушается работа аденозинтрифосфатазы (АТФазы) Вильсона из-за наличия мутаций в гене ATP7B, экспрессирующем в основном в клетках печени [20, 21]. Это ведет к затруднению процесса выведения меди вместе с желчью, что в дальнейшем приводит к ее накоплению в гепатоцитах. Когда гепатоцеллюлярная емкость хранилища переполнена, свободная медь медленно выделяется в кровь и откладывается в различных органах [22]: в мозге [23], почках [24] и роговице [22]. В отдельных случаях может происходить резкое выделение большого количества меди, приводящее к печеночной недостаточности [25], обширному внутрисосудистому гемолизу [26] и почечной дисфункции [27]. Еще одним примером является болезнь Менкеса [28], для которой характерны изогнутые, ломкие и бесцветные волосы, гипопигментация, дряблая кожа, нарушение роста, умственная отсталость и поражение нервной системы, что обусловлено нарушением транспорта ионов меди в клетках. Одной из причин заболевания является мутация в гене ATP7A, который кодирует АТФазу Р-типа, отвечающую за транспорт Cu+ через клеточную мембрану в клетках, что приводит к отклонениям в распределении меди в организме: одни ткани испытывают дефицит этого микроэлемента, в то время как другие страдают от токсических эффектов ее избытка [29].
Таким образом, большое значение имеет разработка чувствительных и селективных методов обнаружения ионов меди с целью понимания механизмов, лежащих в основе заболеваний Вильсона и Менкеса, и контролирования уровня меди в биологических системах.
1.3. Лекарственные препараты на основе меди
На сегодняшний день противоопухолевые препараты на основе меди доказали свою перспективность в терапии рака [30, 31]. Один из эффективных методов противоопухолевой терапии заключается в фототермической индукции апоптоза опухолевых клеток путем увеличения образования АФК, приводящих к деструкции ДНК и белков в раковых клетках [32]. Лекарственные препараты на основе меди приводят к высокой степени повреждения опухолевых образований [33–37]. Широкое распространение получила иммунотерапия с применением соединений меди [38–40].
Помимо противоопухолевых препаратов разработаны противомикробные средства на основе наночастиц меди [41, 42], которые доказали свою высокую эффективность [43]. При этом не прекращаются исследования, направленные на разработку новых лекарственных средств подобного рода [44, 45]. При разработке данных препаратов важно изучение распределения меди в клетках и тканях. Поэтому методы, которые позволят быстро и селективно определять ионы меди в живых системах, в дальнейшем ускорят разработку и последующие доклинические испытания лекарственных препаратов на основе меди. Это откроет возможности для дальнейшего изучения фармакокинетики новых перспективных препаратов, оценки их эффективности и определения механизмов действия.
2. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ИОНОВ МЕДИ В БИОЛОГИЧЕСКИХ СИСТЕМАХ
2.1. Спектроскопические и спектрометрические методы анализа
Существует большое количество физических методов определения ионов металлов: атомно-абсорбционная спектроскопия (AAS), атомно-абсорбционная спектрометрия с пламенной ионизацией (FAAS) [46–48], атомно-абсорбционная спектрометрия с электротермической атомизацией в графитовой печи (GF-AAS) [49, 50], масс-спектрометрия с индуктивно-связанной плазмой (ICP-MS) [51–53], атомно-эмиссионная спектроскопия с индуктивно-связанной плазмой (ICP-AES) [54], рентгеновский флуоресцентный анализ, основанный на возбуждении излучения протонами (PIXE) [55]. Некоторые из них демонстрируют возможность определения ионов меди в единичных клетках и имеют внушительные пределы обнаружения (до 0.20–0.40 фг) [56]. Недостатками данных методов являются невозможность проведения измерений непосредственно в живых системах, трудоемкая пробоподготовка, отсутствие возможности получения информации в режиме реального времени в живых системах, высокая стоимость проведения анализа и сложность эксплуатации измерительных приборов.
Возможными альтернативами атомно-абсорбционной спектроскопии или масс-спектрометрии различных типов стали метод рентгеновской флуоресценции с полным отражением (TXRF) [57, 58] и метод рентгеновской флуоресцентной микроскопии (XFM) с синхротронным источником (Advanced Photon Source, Аргоннская национальная лаборатория, США), позволяющий получать информацию по распределению меди в клетках [59]. В последнем исследовании живые ооциты иммобилизировали на нагретую до 37°C подложку из нитрида кремния с минимальным количеством питательной среды, после чего проводили измерения с получением распределения меди в ооците, при этом ооцит оставался морфологически неизменным. Таким образом, описанные методы обладают возможностью проведения элементного анализа в биологических системах с минимальной пробоподготовкой.
Спектроскопия гигантского комбинационного рассеяния (SERS) стала мощным инструментом для исследования живых клеток [60], обнаружения патогенов [61] и биомолекул [62]. Суть метода заключается в определении изменений спектра комбинационного рассеяния при взаимодействии органических лигандов, иммобилизированных на поверхности наночастиц золота, с ионами меди [63, 64]. Однако главный недостаток SERS – это невозможность применения в биологических системах. Учитывая тенденции в развитии области, можно предполагать появление новых подходов для применения в биологических системах.
2.2. Сенсоры на основе микрокантилеверов
Появление недорогих микрокантилеверов массового производства расширяет возможности в области разработки сенсоров. Принцип действия данных сенсоров основан на определении изгиба микрокантилевера, который обусловлен образованием поверхностного напряжения, вызванного адсорбцией молекул аналита на поверхность микрокантилевера [65]. Поскольку данные системы не обладают какой-либо химической селективностью, то для ее достижения часто используются различные агенты химической или биологической природы, иммобилизованные на поверхности микрокантилеверов [66, 67]. Такие функционализированные кантилеверы могут быть использованы в качестве платформ для разработки сенсоров [68–70].
В [71] информация, полученная при изгибе кантилевера, дополнена параллельными вольтамперометрическими измерениями. Таким образом, микрокантилевер выступал в качестве рабочего электрода. Когда на поверхности микрокантилеверного электрода протекает электрохимическая реакция (восстановление или окисление меди), возникает измеримое поверхностное напряжение, что приводит к изгибу кантилевера. Такой метод стремится объединить чувствительность обнаружения за счет изгиба микрокантилевера с химической селективностью, обеспечиваемой вольтамперометрией.
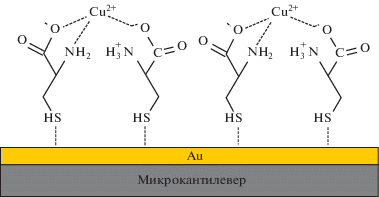
Микрокантилевер, модифицированный монослоем L-цистеина, был разработан для селективного определения Cu2+ в водном растворе (рис. 1) [72]. С использованием этой технологии в жидкостной ячейке обнаружена концентрация 10–10 М Cu2+. Показана селективность сенсоров в присутствии других катионов, таких как Ni2+, Zn2+, Pb2+ и т.д.
Рис. 1.
Схематическое представление молекулярной структуры самоорганизующегося монослоя L-цистеина на золотой поверхности микрокантилевера и его комплексообразование с Cu2+ [72].
С помощью модифицированного моноклональным антителом (mAb6A9) микрокантилеверного сенсора было продемонстрировано определение комплексов (в воде) Cu2+ с этилендиаминтетрауксусной кислотой до 1 × 10–6 М. К недостаткам сенсора можно отнести отсутствие возможности многоразового использования сенсора [73].
Таким образом, в перспективе возможно количественное определение ионов меди в биологических жидкостях селективными кантилеверными сенсорами. Описанные выше сенсорные системы обладают пределами обнаружения, схожими с физиологическими концентрациями меди в биологических системах, однако на текущий момент использование предложенного подхода довольно трудоемко.
2.3. Сенсоры на основе транзисторов
Наиболее перспективным транзистором для определения ионов меди является электролитически-управляемый полевой транзистор, также называемый жидкостным. Он представляет собой тонкопленочный транзистор на основе органических полупроводников, где между затвором и полупроводником проводящим материалом являются электролиты [74–76]. В отличие от оптических устройств такие транзисторы способны работать при очень низком напряжении и не содержат хрупких элементов.
Транзистор такого типа изготовлен для определения ионов меди в образцах воды [77]. Схематическое изображение модифицированного электролитически-управляемого полевого транзистора показано на рис. 2. Затвор транзистора был модифицирован пептидом (глицил–глицил–гистидин), который специфично образует комплекс с ионами Cu2+. Комплексообразование Cu2+ приводит к положительному сдвигу порогового напряжения транзистора. Предел обнаружения такого транзистора составляет 10–12 М. К недостаткам относят большую площадь поверхности и дрейф тока при проведении измерений.
Рис. 2.
Схематическое представление модифицированного электролитически-управляемого полевого транзистора [77].

Одна из первых работ по изготовлению транзисторов такого типа опубликована относительно недавно [78]. Учитывая развитие технологии нанолитографии, в дальнейшем возможно появление работ по исследованию реализации сенсоров в наноразмерном масштабе.
Перспективы применения электролитически-управляемых полевых транзисторов связаны с изучением возможных областей применений и разработкой новых путей модификации транзисторов.
2.4. Хемосенсоры
В последнее десятилетие появилось большое количество хемосенсоров (сенсоров, способных изменять свойства системы при селективном и необратимом связывании с молекулой анализируемого вещества), базирующихся на тех или иных особенностях: на свойствах квантовых точек [79], на переносе заряда [80] и т.д.
Большую часть хемосенсоров распределяют на три группы: хромогенные, флуоресцентные и фотопереключаемые.
Принцип работы хромогенных (колориметрических) хемосенсоров [81] основан на изменении спектра раствора при взаимодействии с аналитом, что вводит соответствующие ограничения на применение такого вида хемосенсоров. Современные работы показали возможность определения наномолярных концентраций ионов меди (предел обнаружения 0.8 × 10–9 М) в биологических жидкостях [82]. Сенсор на основе нанолистов оксида молибдена использовался для определения ионов меди в образцах сыворотки крови и волос человека. Принцип работы такого сенсора основан на восстановлении Mo(VI) в Mo(V). В отсутствие Cu2+ аскорбиновая кислота не может эффективно восстанавливать Mo(VI), поскольку этот процесс требует как восстановителей, так и H+. Однако при введении в эту систему Cu2+ происходит реакция между аскорбиновой кислотой и Cu2+, что заметно увеличивает скорость реакции с образованием нанолистов MoO3 –x. В нанолистах MoO3 – x (богатых кислородными вакансиями) возникает локальный плазмонный резонанс, приводящий к значительному увеличению поглощения. Данные сенсоры на основе оксида молибдена лишены недостатков, свойственных сенсорам на основе наночастиц благородных металлов (нестабильность агрегатов наночастиц [83], воздействие экспериментальных условий, приводящее к нежелательной модификации поверхности, и высокая стоимость реактивов [84]).
Молекулярная визуализация с помощью флуоресцентных сенсоров позволяет в реальном времени исследовать процессы накопления, переноса, функционирования или токсичности металлов в клетках [85] и в организме [86, 87]. Дополнительными преимуществами являются простота эксплуатации, высокая селективность и низкая стоимость, что делает флуоресцентное обнаружение достаточно перспективным подходом [88]. Однако большинство сенсоров имеет недостатки, проявляющиеся в низкой растворимости в воде или тушении флуоресценции при связывании с ионами Cu2+, медленном отклике, плохой химической стабильности, тушении люминесценции в водных средах, необратимости и короткого срока службы [89].
Флуоресцентные сенсоры условно разделяют на две большие группы: генетически кодируемые сенсоры (флуоресцентные белки) [90] и синтетические флуоресцентные сенсоры [91]. Основные преимущества генетически кодируемых сенсоров – это возможность применения их в качестве прижизненных маркеров и способность образовывать хромофор без участия вспомогательных веществ, а также низкая токсичность по отношению к клеткам. Экспрессию таких белков (сенсоров) в клетке можно легко контролировать, что позволяет локализовать данные сенсоры внутри любых клеточных структур. Созданы конструкции, состоящие из белков YFP и CFP, которые были связаны между собой медьсвязывающим доменом. При взаимодействии с медью возникали конформационные изменения, что приводило к изменению интенсивности излучения. Главное отличие от синтетических флуоресцентных сенсоров – слабое влияние на гомеостаз внутриклеточных металлов [92]. Основными недостатками являются неприменимость сенсоров для анализа содержания ионов меди при динамическом изменении концентрации, медленное время отклика [93], отсутствие возможности применения в моделях, где нельзя допустить генетическую модификацию клеток, трудности при получении сенсоров [94].
В качестве основы для синтетических флуоресцентных сенсоров может выступать множество соединений: различные синтетические пептиды [95], нанокластеры [96] и т.д.
В работе [95] методом твердофазного пептидного синтеза получен сенсор, позволяющий визуализировать ионы меди в микромолярных концентрациях. Возможности сенсора были продемонстрированы на клеточной линии HeLa. Флуорофор обладает хорошей проникающей способностью сквозь клеточную мембрану и пригоден для применения в живых системах.
Третья группа хемосенсоров – фотопереключаемые [97, 98]. Они способны к обратимому “включению–выключению” своих сенсорных свойств под действием электромагнитного излучения.
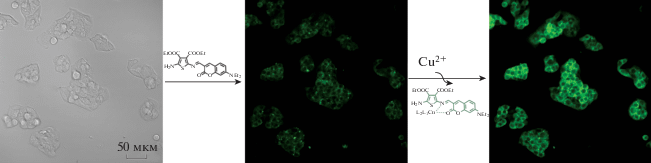
С помощью азометинов на основе тиофена была показана возможность визуализации ионов меди в микромолярных концентрациях на примере нескольких клеточных линий, таких как HepG2 (рис. 3), BV2, A549, MH-S и HeLa [97].
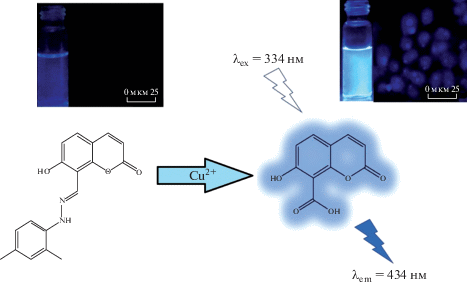
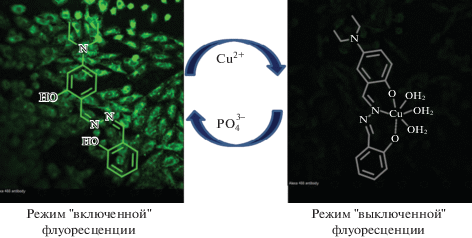
На примере клеточной линии А549 с помощью сенсора на основе 5-диэтиламино-2-[(2-гидрокси-бензилиден)гидразонометил]фенола показано селективное количественное определение ионов Cu2+. Было установлено, что предел обнаружения Cu2+ составляет ~10–7 М. Кроме того, комплекс использовали для обнаружения фосфат-ионов в микромолярных концентрациях на основе восстановления флуоресценции благодаря связыванию Cu2+ с фосфат-ионами. Схематическое представление работы сенсора показано на рис. 4. При разработке комплекса удалось добиться отсутствия излучения, индуцированного агрегацией, сильной флуоресценции как в органическом, так и в водном растворе, минимального воздействия ионов других металлов на определение Cu2+ [99]. Флуоресцентный сенсор фотопереключаемого типа разработан для быстрого селективного обнаружения Cu2+ в растворах и биологических системах (рис. 5) [100]. В присутствии Cu2+ наблюдается излучение при длине волны 425 нм, обусловленное Cu2+-индуцированным окислением имина с образованием карбоксилат-аниона. Предел обнаружения сенсора составил 10–9 М. Возможности сенсора подтверждены на нескольких клеточных линиях (RAW 264.7, HeLa и HT-29).
Рис. 4.
Схематичное представление сенсора на основе азина для определения Cu2+ и его медного комплекса для определения фосфата в физиологических условиях [99].
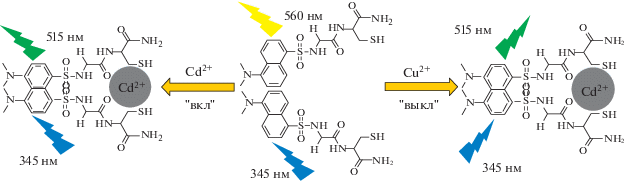
Селективный фотопереключаемый сенсор на основе пептида (Gly-Cys-NH2) с дансилхлоридом был синтезирован [101] для визуализации и количественного определения ионов Cu2+ и Cd2+ в растворах и биологических системах. Механизм связывания пептида с ионами Cu2+/Cd2+ показан на рис. 6. Предел обнаружения для Cu2+ составлял 26.3 × 10–9 М. К преимуществам сенсора можно отнести относительно высокую чувствительность, широкий рабочий диапазон pH 7–12. Что еще более важно, эксперименты с флуоресцентной визуализацией показали, что использованный флуорофор обладает хорошей проницаемостью сквозь мембраны и низкой токсичностью по отношению к клетке.
Фотопереключаемые и флуоресцентные хемосенсоры хорошо зарекомендовали себя в качестве одного из мощных инструментов для визуализации, а также изучения процессов переноса, функционирования или токсичности ионов меди в живых системах с дальнейшей перспективой расширения возможностей применения таких сенсоров. На текущий момент нет единого комплексного решения для устранения всех приведенных выше недостатков хемосенсоров, что накладывает ограничение на их использование.
2.5. Электрохимические методы
Вольтамперометрия является одним из самых распространенных электрохимических методов анализа для определения ионов меди в растворе и биологических системах [102–104]. Одно из преимуществ вольтамперометрических измерений заключается в вариации способов развертки потенциала в зависимости от поставленных задач. Так, для измерений в реальном времени чаще используют вольтамперометрию с высокой скоростью развертки. При необходимости определения малых концентраций аналита применяют дифференциальную импульсную вольтамперометрию (ДИВ) или квадратно-волновую вольтамперометрию. В последнее время стали актуальны всевозможные комбинации вольтамперометрических методик [105].
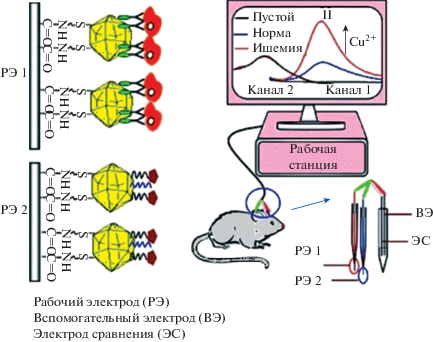
В [106] разработан селективный и чувствительный сенсор для электрохимического определения (с помощью циклической вольтамперометрии и ДИВ) Cu2+ на наномолярных уровнях в биологических системах. Электроды из стеклоуглеродного волокна (электроды 10 мкм в диаметре) были функционализированы модифицированной супероксиддисмутазой E2Zn2SOD, где Е – свободный от меди активный центр. E2Zn2SOD и Cu2+ взаимодействуют с высокой специфичностью, что обеспечивает высокую чувствительность, селективность и точность (с пределом обнаружения до 3 × 10–9 М и рабочим диапазоном от 0.01 × 10–6 до 35 × 10–6 М). Сенсорная система была применена для надежного обнаружения Cu2+ в мозге крысы (рис. 7). Концентрация ионов Cu2+ в мозге крысы до и после церебральной ишемии составила ~2 × 10–6 и ~9 × 10–6 М соответственно. Настоящим исследованием разработана методика создания сенсоров и был установлен надежный подход для мониторинга in vivo.
В [107] разработан сенсор, способный работать в режиме реального времени in vivo, для определения ионов Cu2+ методом ДИВ. Продемонстрирована селективность, достигнутая иммобилизацией разветвленного полиэтиленимина на предварительно функционализированной (последовательно: цистеином, золотыми наночастицами, 3-меркаптопропионовой кислотой) поверхности стеклоуглеродного электрода (рис. 8). Экспериментально подтверждена стабильная чувствительность к ионам Cu2+ после нескольких циклов измерений. Предел обнаружения составил 1.3 × 10–8 М. Концентрация ионов Cu2+ в мозге крысы до и после глобальной церебральной ишемии составила ~1.7 × 10–6 и ~ 5 × 10–6 М соответственно. К недостаткам можно отнести высокую инвазивность применяемых сенсоров из-за их физических размеров (~3 мкм).
Еще одним электрохимическим методом анализа является потенциометрия. Потенциометрические измерения с использованием ионоселективных электродов являются простыми, точными, селективными, экономичными и быстрыми методами анализа, применяемыми для определения ионов меди в том числе [108, 109].
С помощью сенсоров на основе угольно-пастовых электродов было продемонстрировано потенциометрическое количественное определение ионов Cu2+ в воде и биологических пробах мочи больных с заболеванием Вильсона. Сенсоры просты в изготовлении и показывали высокую селективность, чувствительность, широкий диапазон рабочих концентраций (10–6–10–2 М), относительно быстрый отклик на ионы меди (6 с). К технологическим преимуществам сенсора можно отнести возможность массового производства с минимальными затратами; легкая модификация поверхности сенсора, селективность. Однако есть существенный функциональный недостаток, выраженный в относительно низкой чувствительности метода [110].
Среди многих методов обнаружения ионов меди электрохимические являются одними из самых многообещающих благодаря хорошей чувствительности, простоте в эксплуатации, низкой стоимости изготовления сенсоров и хорошему соотношению сигнал/шум. Однако не все электрохимические сенсоры имеют возможность применения в биологических системах. Для большей части электродов отсутствует возможность малоинвазивного вмешательства из-за их физических размеров и конструктивных особенностей измерительных установок [111, 112].
2.6. Сенсоры на основе нанокапилляров и нанопор
Сенсоры на основе нанопор/нанокапилляров являются перспективным устройством для обнаружения аналитов в режиме реального времени с чувствительностью на уровне одной молекулы и возможностью применения в биологических системах [113–117]. Чтобы достичь высокой специфичности к конкретным мишеням, таким как ионы металлов [118–120], ДНК [121], аминокислоты [122], белки [123], а также органические молекулы [124], используются два типа подходов.
Часть подходов заключается в иммобилизации специфичного лиганда на внутренней поверхности нанопор/нанокапилляра, с которым впоследствии происходит связывание анализируемого вещества, что в итоге приводит к изменению протекающего ионного тока через нанопоры/нанокакапилляр [125–127]. Другой подход предполагает специфическое взаимодействие молекулы-мишени и сенсора без связывания на внутренней области нанокапилляра [128].
Оценка процесса транслокации полигистидина (используемого в качестве хелатирующего агента меди) через нанопору α-гемолизина легла в основу создания селективного сенсора [129]. Без ионов Cu2+ этот процесс имеет постоянные характеристики (например, время пребывания хелатирующего агента внутри нанопоры или степень ее закупорки) (рис. 9а). После добавления Cu2+ ионы взаимодействуют с молекулами медьхелатирующего агента. Взаимодействие между образованными медными комплексами и белковой нанопорой при транслокации приводит к значительным различиям в специфических сигналах, что в конечном итоге позволяет легко распознавать медные комплексы (рис. 9б). С помощью данного метода возможно обнаружить следовые количества ионов меди с пределом обнаружения 4 × 10–8 М.
Рис. 9.
Схематическое представление процесса обнаружения Cu2+ с помощью белковой нанопоры [129]: а – в отсутствие Cu2+, б – в присутствии Cu2+.

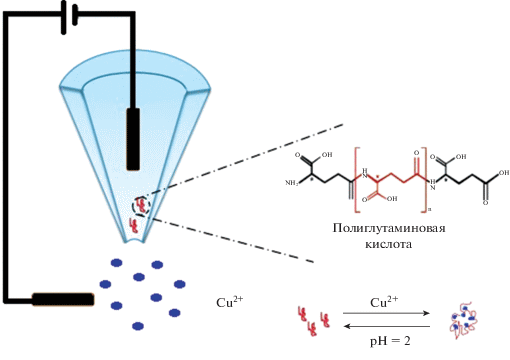
На основе нанокапилляров из кварца с неиммобилизованной полиглутаминовой кислотой разработан сенсор для селективного обнаружения ионов меди в растворах (рис. 10) [130]. В исследовании была продемонстрирована сенсорная система для быстрого и избирательного обнаружения ионов меди (до 7.5 × 10–6 М) через значительное уменьшение ионного тока, проходящего через нанокапилляр. Датчик показывает высокую специфичность обнаружения для ионов меди из-за высокого сродства полиглутаминовой кислоты к Cu2+.
Рис. 10.
Схематическое представление сенсора на основе нанокапилляра с неиммобилизированной полиглутаминовой кислотой для определения ионов меди [130].
В [125] исследовано обратимое связывание Cu2+ на поверхности нанокапилляров, модифицированных хитозаном и полиакриловой кислотой в водных растворах (рис. 11). К недостаткам можно отнести низкую чувствительность (предел обнаружения составил 10–6 М) и узкий рабочий диапазон измеряемых концентраций (4 × 10–6–10–4 М).
Рис. 11.
Схематическое представление электролитической ячейки и обратимого связывания ионов меди на нанокапилляре, модифицированного хитозаном и полиакриловой кислотой [122].

Примером специфического взаимодействия молекулы-мишени и сенсора без связывания на внутренней области нанокапилляра является патент [128], где на заполненный углеродом стеклянный нанокапилляр электрохимическим путем осаждено золото, которое впоследствии было модифицировано лигандом на основе трипептида (глицил-L-гистидил-L-лизин-SH) для селективного связывания Cu2+ (электрохимический сенсор). Был проведен сравнительный анализ концентрационных кривых, полученных модифицированным сенсором и сенсором без лиганда. Установлено, что дополнительная стадия модификации позволяет существенно повысить чувствительность сенсора. Предел обнаружения сенсорной системы с лигандом составил 3 × 10–7 М. Показано применение сенсоров in vitro на клеточной линии MCF-7.
В заключение приведем результаты сравнительного анализа способов количественного определения ионов меди (табл. 1).
Таблица 1.
Сравнительный анализ способов количественного определения ионов меди
| Способы количественного определения [Cu+], [Cu2+] | Сmin*, М | Применение | ||||
|---|---|---|---|---|---|---|
| Раствор | in vitro | in vivo | Измерения в реальном времени | Литература | ||
| Сенсоры на основе транзисторов | 10–12 | + | – | – | – | [77] |
| Спектроскопические и спектрометрические методы анализа (AAS, FAAS, GF-AAS, ICP-MS, ICP-AES, PIXE, TXRF, SXFM, SERS) | 10–11 | + | + | – | – | [46, 49–54, 56–58, 63, 64 |
| Сенсоры на основе микрокантилеверов | 10–10 | + | – | – | – | [71–73] |
| Колориметрические хемосенсоры | ~10–9 | + (б.ж.) | – | – | – | [82] |
| Флуоресцентные хемосенсоры | 10–9 | + (б.ж.) | + | + | – | [95, 96] |
| Электрохимические сенсоры | ~10–9 | + | + | + | + | [106, 107, 110] |
| Фотопереключаемые хемосенсоры | 8 × 10–9 | + | + | + | – | [97, 99–101] |
| Сенсоры на основе нанопор | ~10–8 | + | – | – | – | [129] |
| Сенсоры на основе нанокапилляров | ~10–8 | + | + | – | + | [125, 128, 130] |
ВЫВОДЫ
В обзоре рассмотрены современные подходы к качественному и количественному определению ионов меди с возможностью или перспективой применения для биологических систем. Проведен сравнительный анализ спектроскопических, электрохимических, флуоресцентных методов, а также сенсоров на основе нанотранзисторов, кантилеверов, нанопор, нанокапилляров. Большая часть представленных сенсоров позволяет определять с высокой точностью и селективностью ионы меди только в растворах. Количественное определение ионов меди в “живых” системах возможно лишь некоторыми из них, которые, как правило, имеют большое количество недостатков. Флуоресцентные сенсоры, преимущественно направленные на определение меди в “живых” системах, почти не имеют возможности определения концентрации меди в режиме реального времени. Спектроскопические и спектрометрические методы анализа обладают высокой чувствительностью (~10–11 М), однако проведение измерений in vivo/in vitro невозможно. Область применения сенсоров на основе микрокантилеверов и нанотранзисторов ограничена растворами. Электрохимические сенсоры при их высокой чувствительности (~10–9 М) обладают наименьшим количеством недостатков, выраженных в физических размерах электродов и многостадийных процессах изготовления сенсоров. Однако сравнительно недавно появившиеся электроды на основе нанокапилляров позволяют уменьшить инвазивность при электрохимических измерениях и существенно упростить методику их изготовления, а также открывают новые возможности для создания различных электрохимических сенсоров.
Таким образом, из представленного экспертно-аналитического обзора открытой информации за последние 10 лет можно сделать вывод, что растет интерес к созданию сенсоров, позволяющих проводить измерения в режиме реального времени в живых системах, происходит ежегодное улучшение существующих методов анализа, выраженное в повышении чувствительности, селективности, снижении времени отклика и уменьшении инвазивности при изучении биологических систем.
Работа выполнена при поддержке Российского научного фонда (грант № 19-74-10059).
Список литературы
Lewińska-Preis L., Jabłońska M., Fabiańska M., Kita A. // Environ. Geochem. Health. 2011. V. 33. № 6. P. 595. https://doi.org/10.1007/s10653-011-9373-7
Willis M.S., Monaghan S.A., Miller M.L. et al. // Am. J. Clin. Pathol. 2005. V. 123. № 1. P. 125. https://doi.org/10.1309/V6GVYW2QTYD5C5PJ
Minoia C., Sabbioni E., Apostoli P. et al. // Sci. Total Environ. 1990. V. 95. P. 89. https://doi.org/10.1016/0048-9697(90)90055-Y
Osredkar J., Sustar N. // J. Clinic. Toxicol. 2011. V. 3. № 1. P. 2161. https://doi.org/10.4172/2161-0495.S3-001
Linder M.C., Wooten L., Cerveza P. et al. // Am. J. Clin. Nutr. 1998. V. 67. № 5. P. 965S. https://doi.org/10.1093/ajcn/67.5.965S
Harris E.D. // Nutrition Rev. V. 59. № 9. P. 281. https://doi.org/10.1111/j.1753-4887.2001.tb07017.x
Bhattacharya P.T., Misra S.R., Hussain M. // Scientifica (Cairo). 2016. V. 2016. P. 1. https://doi.org/10.1155/2016/5464373
Araya M., Pizarro F., Olivares M. et al. // Biol. Res. 2006. V. 39. № 1. P. 183. https://doi.org/10.4067/S0716-97602006000100020
Davis C.D. // J. Nutr. 2003. V. 133. № 2. P. 522. https://doi.org/10.1093/jn/133.2.522
Christen Y. // Am. J. Clin. Nutr. 2000. V. 71. № 2. P. 621S. https://doi.org/10.1093/ajcn/71.2.621s
Rubino J.T., Franz K.J. // J. Inorg. Biochem. 2012. V. 107. № 1. P. 129. https://doi.org/10.1016/j.jinorgbio.2011.11.024
Tisato F., Marzano C., Porchia M. et al. // Med. Res. Rev. 2009. V 30. P. 708. https://doi.org/10.1002/med.20174
Haber F., Weiss J. // Proc. R. Soc. London. A. 1934. V. 147. № 861. P. 332. https://doi.org/10.1098/rspa.1934.0221
Valko M., Leibfritz D., Moncol J. et al. // Int. J. Biochem. Cell. Biol. 2007. V. 39. № 1. P. 44. https://doi.org/10.1016/j.biocel.2006.07.001
Khan A.U., Kasha M. // Proc. Natl. Acad. Sci. 1994. V. 91. № 26. P. 12365. https://doi.org/10.1073/pnas.91.26.12365
Sies H. // Exp. Physiol. 1997. V. 82. № 2. P. 291. https://doi.org/10.1113/expphysiol.1997.sp004024
Tisato F., Marzano C., Porchia M. et al. // Med. Res. Rev. 2009. № 4. P. 708. https://doi.org/10.1002/med.20174
Gupte A., Mumper R. // Cancer Treat. Rev. 2009. V. 35. № 1. P. 32. https://doi.org/10.1016/j.ctrv.2008.07.004
Pavelková M., Vysloužil J., Kubová K., Vetchý D. // Ces. Slov. Farm. 2018. V. 2018. № 4. P.143.
Roberts E.A. // Medicine (Baltimore). 2011. V. 39. № 10. P. 602. https://doi.org/10.1016/j.mpmed.2011.08.006
Bull P.C., Thomas G.R., Rommens J.M. et al. // Nat. Genet. 1993. V. 5. № 4. P. 327. https://doi.org/10.1038/ng1293-327
Scheinberg I. // Major Probl. Intern. Med. 1984. V. 23. P. 9.
Scheiber I.F., Mercer J.F.B., Dringen R. // Prog. Neurobiol. 2014. V. 116. P. 33. https://doi.org/10.1016/j.pneurobio.2014.01.002
Fenu M., Liggi M., Demelia E. et al. // Eur. J. Intern. Med. 2012. V. 23. № 6. P. e150. https://doi.org/10.1016/j.ejim.2012.04.005
Datar S., Wijdicks E.F.M // Handbook of Clinical Neurology. 2014. V. 120. P. 645. https://doi.org/10.1016/B978-0-7020-4087-0.00044-9
Lenartowicz M., Starzyński R.R., Jończy A. et al. // Biochim. Biophys. Acta. Mol. Basis Dis. 2017. V. 1863. № 6. P. 1410. https://doi.org/10.1016/j.bbadis.2017.02.020
Galhardi C.M., Diniz Y.S., Faine L.A. et al. // Food Chem. Toxicol. 2004. V. 42. № 12. P. 2053. https://doi.org/10.1016/j.fct.2004.07.020
Strausak D., Mercer J.F., Dieter H.H. et al. // Brain Res. Bull. 2001. V. 55. № 2. P. 175. https://doi.org/10.1016/S0361-9230(01)00454-3
DiDonato M., Sarkar B. // Biochim. Biophys. Acta. Mol. Basis Dis. 1997. V. 1360. № 1. P. 3. https://doi.org/10.1016/S0925-4439(96)00064-6
Majouga A.G., Zvereva M.I., Rubtsova M.P. et al. // J. Med. Chem. 2014. V. 57. № 14. P. 6252. https://doi.org/10.1021/jm500154f
Ceramella J., Mariconda A., Iacopetta D. et al. // Bioorg. Med. Chem. Lett. 2020. V. 30. № 3. P. 126905. https://doi.org/10.1016/j.bmcl.2019.126905
Simon H.U., Haj-Yehia A., Levi-Schaffer F. // Apoptosis. 2000. V. 5. № 5. P. 415. https://doi.org/10.1023/A:1009616228304
Tian Q., Tang M., Sun Y. et al. // Adv. Mater. 2011. V. 23. № 31. P. 3542. https://doi.org/10.1002/adma.201101295
Li Y., Lu W., Huang Q. et al. // Nanomedicine. 2010. V. 5. № 8. P. 1161. https://doi.org/10.2217/nnm.10.85
Zhou M., Zhang R., Huang M. et al. // J. Am. Chem. Soc. 2010. V. 132. № 43. P. 15351. https://doi.org/10.1021/ja106855m
Goel S., Chen F., Cai W. // Small. 2014. V. 10. № 4. P. 631. https://doi.org/10.1002/smll.201301174
Huang X., Xu C., Li Y. et al. // Mater. Sci. Eng. C. 2019. V. 96. P. 129. https://doi.org/10.1016/j.msec.2018.10.062
Yang Y. // J. Clin. Invest. 2015. V. 125. № 9. P. 3335. https://doi.org/10.1172/JCI83871
Lee A., Sun S., Sandler A., Hoang T. // Curr. Opin. Chem. Biol. 2018. V. 44. P. 56. https://doi.org/10.1016/j.cbpa.2018.05.006
Zhou P., Qin J., Zhou C. et al. // Biomaterials. 2019. V. 195. P. 86. https://doi.org/10.1016/j.biomaterials.2019.01.007
Leont’ev V.K., Pogorel’skii I.P., Frolov G.A. et al. // Nanotechnologies Russ. 2018. V. 13. № 3–4. P. 195. https://doi.org/10.1134/S1995078018020040
Mamonova I.A., Matasov M.D., Babushkina I.V. et al. // Nanotechnologies Russ. 2013. V. 8. № 5–6. P. 303. https://doi.org/10.1134/S1995078013030142
Ingle A.P., Duran N., Rai M. // Appl. Microbiol. Biotechnol. 2014. V. 98. № 3. P. 1001. https://doi.org/10.1007/s00253-013-5422-8
Mokhtar A., Djelad A., Bengueddach A., Sassi M. // Int. J. Biol. Macromol. 2018. V. 118. P. 2149. https://doi.org/10.1016/j.ijbiomac.2018.07.058
Rajeshkumar S., Rinitha G. // OpenNano. 2018. V. 3. P. 18. https://doi.org/10.1016/j.onano.2018.03.001
Litwin T., Gromadzka G., Szpak G.M. et al. // J. Neurol. Sci. 2013. V. 329. № 1–2. P. 55. https://doi.org/10.1016/j.jns.2013.03.021
Colon M., Todolí J.L., Hidalgo M., Iglesias M. // Anal. Chim. Acta. 2008. V. 609. № 2. P. 160. https://doi.org/10.1016/j.aca.2008.01.001
Hill S.J., Fisher A.S. // Encyclopedia of Spectroscopy and Spectrometry. UK: Elsevier, 2017. 3584 p. https://doi.org/10.1016/B978-0-12-803224-4.00099-6
White A.R., Reyes R., Mercer J. F. et al. // Brain Res. 1999. V. 842. № 2. P. 439. https://doi.org/10.1016/S0006-8993(99)01861-2
Giese A., Buchholz M., Herms J., Kretzschmar H.A. // J. Mol. Neurosci. 2005. V. 27. № 3. P. 347. https://doi.org/10.1385/JMN:27:3:347
Goullé J.-P., Mahieu L., Castermant J. et al. // Forensic Sci. Int. 2005. V. 153. № 1. P. 39. https://doi.org/10.1016/j.forsciint.2005.04.020
Hasegawa S., Koshikawa M., Takahashi I. et al. // J. Trace Elem. Med. Biol. 2008. V. 22. № 3. P. 248. https://doi.org/10.1016/j.jtemb.2008.05.001
Jones L.C., Beard J.L., Jones B.C. // Hippocampus. 2008. V. 18. № 4. P. 398. https://doi.org/10.1002/hipo.20399
Rahil-Khazen R., Bolann B.J., Myking A., Ulvik R.J. // J. Trace Elem. Med. Biol. 2002. V. 16. № 1. P. 15. https://doi.org/10.1016/S0946-672X(02)80004-9
Lindh U., Johansson E., Gille L. // Nucl. Instrum. Methods Phys. Res. B. 1984. V. 3. № 1–3. P. 631. https://doi.org/10.1016/0168-583X(84)90451-8
Cao Y., Feng J., Tang L. et al. // Talanta. 2020. V. 206. P. 120174. https://doi.org/10.1016/j.talanta.2019.120174
Szoboszlai N., Réti A., Budai B. et al. // Spectrochim. Acta. B. 2008. V. 63. № 12. P. 1480. https://doi.org /https://doi.org/10.1016/j.sab.2008.10.025
Jeffery J., Frank A.R., Hockridge S. et al. // Ann. Clin. Biochem. Int. J. Lab. Med. 2019. V. 56. № 1. P. 170. https://doi.org/10.1177/0004563218793163
Kim A.M., Vogt S., O’Halloran T.V., Woodruff T.K. // Nat. Chem. Biol. 2010. V. 6. № 9. P. 674. https://doi.org/10.1038/nchembio.419
Cialla-May D., Zheng X.-S., Weber K., Popp J. // Chem. Soc. Rev. 2017. V. 46. № 13. P. 3945. https://doi.org/10.1039/C7CS00172J
Lee J.-H., Kim B.-C., Byeung-Keun O., Choi J.-W. // J. Biomed. Nanotechnol. 2015. V. 11. № 12. P. 2223. https://doi.org/10.1166/jbn.2015.2117
Avella-Oliver M., Puchades R., Wachsmann-Hogiu S., Maquieira A. // Sensors Actuators. B. Chem. 2017. V. 252. P. 657. https://doi.org/10.1016/j.snb.2017.06.058
Wang Y., Su Z., Wang L. et al. // Anal. Chem. 2017. V. 89. № 12. P. 6392. https://doi.org/10.1021/acs.analchem.6b05106
Dugandžić V., Kupfer S., Jahn M. et al. // Sensors Actuators. B. Chem. 2019. V. 279. P. 230. https://doi.org/10.1016/j.snb.2018.09.098
Gorelkin P.V., Kiselev G.A., Mukhin D.S. et al. // Polym. Sci. A. 2010. V. 52. № 10. P. 1023. https://doi.org/10.1134/S0965545X10100044
Gorelkin P.V., Erofeev A.S., Kiselev G.A. et al. // Analyst. 2015. V. 140. № 17. P. 6131. https://doi.org/10.1039/C5AN01102G
Beloglazkina E.K., Majouga A.G., Zyk N.V. et al. // Thin Solid Films. 2007. V. 515. № 11. P. 4649. https://doi.org/10.1016/j.tsf.2006.12.131
Wu G., Ji H., Hansen K. et al. // Proc. Natl. Acad. Sci. 2001. V. 98. № 4. P. 1560. https://doi.org/10.1073/pnas.98.4.1560
Peng R., Xing L., Wang X. et al. // Anal. Sci. 2016. V. 32. № 10. P. 1065. https://doi.org/10.2116/analsci.32.1065
Du Y., Dong S. // Anal. Chem. 2017. V. 89. № 1. P. 189. https://doi.org/10.1021/acs.analchem.6b04190
Bange A.F., Brown G.M., Senesac L.R., Thundat T. // Surf. Sci. 2009. V. 603. № 21. P. L125. https://doi.org/10.1016/j.susc.2009.09.009
Xu X., Zhang N., Brown G.M. et al. // Appl. Biochem. Biotechnol. 2010. V. 183. P. 555. https://doi.org/10.1007/s12010-017-2511-7
Zhao H., Xue C., Nan T. et al. // Anal. Chim. Acta. 2010. V. 676. № 1–2. P. 81. https://doi.org/10.1016/j.aca.2010.07.041
Taniguchi M., Kawai T. // Appl. Phys. Lett. 2004. V. 85. № 15. P. 3298. https://doi.org/10.1063/1.1801167
Bäcklund T.G., Sandberg H.G.O., Österbacka R., Stubb H. // Appl. Phys. Lett. 2004. V. 85. № 17. P. 3887. https://doi.org/10.1063/1.1811798
Panzer M.J., Frisbie C.D. // Adv. Funct. Mater. 2006. V. 16. № 8. P. 1051. https://doi.org/10.1002/adfm.200600111
Nguyen T.T.K., Tran H.V., Vu T.T. et al. // Biosens. Bioelectron. 2019. V. 127. P. 118. https://doi.org/10.1016/j.bios.2018.12.005
Kergoat L., Herlogsson L., Piro B. et al. // Proc. Natl. Acad. Sci. 2012. V. 109. № 22. P. 8394. https://doi.org/10.1073/pnas.1120311109
Chen J., Li Y., Lv K. et al. // Sensors Actuators. B. Chem. 2016. V. 224. P. 298. https://doi.org/10.1016/j.snb.2015.10.046
Fan J., Zhan P., Hu M. et al. // Org. Lett. 2013. V. 15. № 3. P. 492. https://doi.org/10.1021/ol3032889
Upadhyay S., Singh A., Sinha R. et al. // J. Mol. Struct. 2019. V. 1193. P. 89. https://doi.org/10.1016/j.molstruc.2019.05.007
Li M., Huang X., Yu H. // Mater. Sci. Eng. C. 2019. V. 101. P. 614. https://doi.org/10.1016/j.msec.2019.04.022
Guo L., Xu Y., Ferhan A.R. et al. // J. Am. Chem. Soc. 2013. V. 135. № 33. P. 12338. https://doi.org/10.1021/ja405371g
Yaling Y., Yi H. // Anal. Sci. 2019. V. 35. № 2. P. 159. https://doi.org/10.2116/analsci.18P345
Feng S., Gao Q., Gao X. et al. // Inorg. Chem. Commun. 2019. V. 102. P. 51. https://doi.org/10.1016/j.inoche.2019.01.012
Xue X., Fang H., Chen H. et al. // Dye. Pigment. 2016. V. 130. P. 116. https://doi.org/10.1016/j.dyepig.2016.03.017
Xu Z., Wang H., Chen Z. et al. // Spectrochim. Acta. A. 2019. V. 216. P. 404. https://doi.org/10.1016/j.saa.2019.03.062
Ko K.C., Wu J.-S., Kim H.J. et al. // Chem. Commun. 2011. V. 47. № 11. P. 3165. https://doi.org/10.1039/C0CC05421F
Jung H.S., Kwon P.S., Lee J.W. et al. // J. Am. Chem. Soc. 2009. V. 131. № 5. P. 2008. https://doi.org/10.1021/ja808611d
Carter K.P., Young A.M., Palmer A.E. // Chem. Rev. 2014. V. 114. № 8. P. 4564. https://doi.org/10.1021/cr400546e
Domaille D.W., Que E.L., Chang C.J. // Nat. Chem. Biol. 2008. V. 4. № 3. P. 168. https://doi.org/10.1038/nchembio.69
McGhee C.E., Loh K.Y., Lu Y. // Curr. Opin. Biotechnol. 2017. V. 45. P. 191. https://doi.org/10.1016/j.copbio.2017.03.002
Liang J., Guo L., Ding Y. et al. // Biochem. Biophys. Res. Commun. 2014. V. 443. № 3. P. 894. https://doi.org/10.1016/j.bbrc.2013.12.101
Hao Z., Zhu R., Chen P.R. // Curr. Opin. Chem. Biol. 2018. V. 43. P. 87. https://doi.org/10.1016/j.cbpa.2017.12.002
Hao C., Li Y., Fan B. et al. // Microchem. J. 2020. V. 154. P. 104658. https://doi.org/10.1016/j.microc.2020.104658
Zhang N., Si Y., Sun Z. et al. // Anal. Chem. 2014. V. 86. № 23. P. 11714. https://doi.org/10.1021/ac503102g
Luo Q., Bandi K.R., Dong Y. et al. // Spectrochim. Acta. A. 2019. V. 214. P. 146. https://doi.org/10.1016/j.saa.2019.02.013
Zhao X., Gao C., Li N. et al. // Tetrahedron Lett. 2019. V. 60. № 21. P. 1452. https://doi.org/10.1016/j.tetlet.2019.04.049
Tiwari K., Kumar S., Kumar V. et al. // Spectrochim. Acta. A. 2018. V. 191. P. 16. https://doi.org/10.1016/j.saa.2017.09.072
Wei L.-F., Chen C.-Y., Lai C.-K. et al. // Methods. 2019. V. 168. P. 18. https://doi.org/10.1016/j.ymeth.2019.04.023
Wang P., Wu J., Zhao C. // Spectrochim. Acta. A. 2020. V. 226. P. 117600. https://doi.org/10.1016/j.saa.2019.117600
Prasad B.B., Fatma S. // Sensors Actuators. B. Chem. 2016. V. 229. P. 655. https://doi.org/10.1016/j.snb.2016.02.028
Liu T., Luo Y., Kong L. et al. // Sensors Actuators. B. Chem. 2016. V. 235. P. 568. https://doi.org/10.1016/j.snb.2016.05.116
Pathirathna P., Yang Y., Forzley K. et al. // Anal. Chem. 2012. V. 84. № 15. P. 6298. https://doi.org/10.1021/ac301358r
Holmes J., Pathirathna P., Hashemi P. // TrAC Trends Anal. Chem. 2019. V. 111. P. 206. https://doi.org/10.1016/j.trac.2018.11.003
Chai X., Zhou X., Zhu A. et al. // Angew. Chem. Int. Ed. 2013. V. 52. № 31. P. 8129. https://doi.org/10.1002/anie.201302958
Gu H., Hou Q., Liu Y. et al. // Biosens. Bioelectron. 2019. V. 135. P. 111. https://doi.org/10.1016/j.bios.2019.03.014
Mahajan R.K., Kaur I., Lobana T.S. // Talanta. 2003. V. 59. № 1. P. 101. https://doi.org/10.1016/S0039-9140(02)00473-3
Ding J., Qin W. // TrAC Trends Anal. Chem. 2020. V. 124. P. 115803. https://doi.org/10.1016/j.trac.2019.115803
Frag E.Y., El Badry Mohamed M., Fahim E.M. // Biosens. Bioelectron. 2019. V. 131. P. 309. https://doi.org/10.1016/j.bios.2019.02.034
Singh V.K., Kushwaha C.S., Shukla S.K. // Int. J. Biol. Macromol. 2020. V. 147. P. 250. https://doi.org/10.1016/j.ijbiomac.2019.12.209
Romero-Cano L.A., Zárate-Guzmán A.I., Carrasco-Marín F., González-Gutiérrez L.V. // J. Electroanal. Chem. 2019. V. 837. P. 22. https://doi.org/10.1016/j.jelechem.2019.02.005
Karhanek M., Kemp J.T., Pourmand N. et al. // Nano Lett. 2005. V. 5. № 2. P. 403. https://doi.org/10.1021/nl0480464
Howorka S., Siwy Z. // Chem. Soc. Rev. 2009. V. 38. № 8. P. 2360. https://doi.org/10.1039/B813796J
He H., Xu X., Jin Y. // Anal. Chem. 2014. V. 86. № 10. P. 4815. https://doi.org/10.1021/ac404168s
Vilozny B., Actis P., Seger R.A. et al. // Anal. Chem. 2011. V. 83. № 16. P. 6121. https://doi.org/10.1021/ac201322v
Erofeev A., Gorelkin P., Garanina A. et al. // Sci. Rep. 2018. № 2. P. 1. https://doi.org/10.1038/s41598-018-25852-4
Sa N., Fu Y., Baker L.A. // Anal. Chem. 2010. V. 82. № 24. P. 9963. https://doi.org/10.1021/ac102619j
Zhai Q., Wang J., Jiang H. et al. // Talanta. Elsevier. 2015. V. 140. P. 219. https://doi.org/10.1016/j.talanta.2015.03.035
Kaya D., Kececi K. // Bulgarian Chem. Commun. 2017. V. 49. P. 37. https://www.semanticscholar.org/paper/Preparation-of-nanopores-and-their-application-for-Kaya-Keçeci/7211e19fc2bef6de60ad87b0bf0aa5db22d133c2
Steinbock L.J., Bulushev R.D., Krishnan S. et al. // ACS Nano. 2013. V. 7. № 12. P. 11255. https://doi.org/10.1021/nn405029j
Han C., Hou X., Zhang H. et al. // J. Am. Chem. Soc. 2011. V. 133. № 20. P. 7644. https://doi.org/10.1021/ja2004939
Umehara S., Karhanek M., Davis R.W., Pourmand N. // Proc. Natl. Acad. Sci. 2009. V. 106. № 12. P. 4611. https://doi.org/10.1073/pnas.0900306106
He H., Xu X., Wang P. et al. // Chem. Commun. 2015. V. 51. № 10. P. 1914. https://doi.org/10.1039/C4CC09185J
Actis P., Vilozny B., Seger R.A. et al. // Langmuir. 2011. V. 27. № 10. P. 6528. https://doi.org/10.1021/la2005612
Gornall J.L., Mahendran K.R., Pambos O.J. et al. // Nano Lett. 2011. V. 11. № 8. P. 3334. https://doi.org/10.1021/nl201707d
Papp S., Jágerszki G., Gyurcsányi R.E. // Angew. Chem. Int. Ed. 2018. V. 57. № 17. P. 4752. https://doi.org/10.1002/ange.201800954
Erofeev A.S., Gorelkin P.V., Majouga A.G. et al. pat. WO2017/116267AI USA. Russia, 2017. P. 1–25.
Wang G., Wang L., Han Y. et al. // Biosens. Bioelectron. 2014. V. 53. P. 453. https://doi.org/10.1016/j.bios.2013.10.013
Chen L., He H., Xu X., Jin Y. // Anal. Chim. Acta. 2015. V. 889. P. 98. https://doi.org/10.1016/j.aca.2015.06.051
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии