Российские нанотехнологии, 2020, T. 15, № 2, стр. 194-204
МИКРОБНЫЙ СИНТЕЗ НАНОЧАСТИЦ СУЛЬФИДА КАДМИЯ. ВЛИЯНИЕ БАКТЕРИЙ РАЗЛИЧНЫХ ВИДОВ НА ХАРАКТЕРИСТИКИ БИОГЕННЫХ НАНОЧАСТИЦ
Т. А. Воейкова 1, 2, *, Е. И. Кожухова 1, 3, О. А. Журавлева 1, 2, В. М. Ретивов 1, 3, Е. А. Чигорина 1, 3, В. С. Кулигин 1, 2, В. Г. Дебабов 1, 2
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 НИЦ “Курчатовский институт” – ГосНИИгенетика
Москва, Россия
3 НИЦ “Курчатовский институт” - ИРЕА
Москва, Россия
* E-mail: voeikova.tatyana@yandex.ru
Поступила в редакцию 10.06.2020
После доработки 10.06.2020
Принята к публикации 15.06.2020
Аннотация
Предложена оптимизация экологически безопасного, природоподобного метода микробного синтеза наночастиц сульфида кадмия (NPsCdS) в присутствии бактериальных клеток Shewanella oneidensis MR-1 и Bacillus subtilis 168, увеличивающая выход и концентрацию нанокристаллов в образцах. Биогенные NPsCdS охарактеризованы как квантовые точки размером 5 ± 1 нм, флуоресцирующие в синей области спектра. Проведена сравнительная оценка состава белкового покрытия биогенных NPsCdS, величины их гидродинамического диаметра, ζ-потенциала, полидисперсности и показана зависимость ряда параметров от применяемого при биосинтезе вида бактерии. Исследовано влияние вида бактерий на спектры поглощения наночастиц, длину волны и уровень интенсивности флуоресценции. Рассмотрено влияние на электрофоретические и оптические свойства биогенных наночастиц методик центрифугирования и ультразвуковой обработки как способов увеличения монодисперсности коллоидных систем. Представленные результаты подтверждают перспективность применения биогенных NPsCdS наряду с химически синтезированными наноструктурами.
ВВЕДЕНИЕ
Наноразмерные материалы могут быть получены с использованием различных физических и химических методов. Однако последние два десятилетия стали свидетелями революционного открытия биосинтеза неорганических наночастиц с использованием биологических ресурсов – клеток бактерий, грибов или экстрактов растений в водных растворах соответствующих солей [1, 2]. Процессы биосинтеза наночастиц реализуются в жидкой среде при температуре, оптимальной для биологического объекта, при нормальном атмосферном давлении, чаще в аэробных условиях. Биогенный, “зеленый” синтез экологически безопасен, дешев, обладает значительным потенциалом для увеличения производства наночастиц без использования агрессивных, токсичных и дорогостоящих химических веществ, обычно используемых в физических и химических процессах.
За прошедший 2019 г. в научной литературе появились публикации, обобщающие примеры использования различных биосубстратов для получения биогенных наночастиц, анализа механизмов их образования, характеристики свойств, поиска возможных областей применения [3, 4]. Следует отметить, что в настоящее время происходит переход от лабораторных исследований к масштабированию процессов биосинтеза наночастиц металлов, их оксидов, сульфидов и более сложных многослойных структур, включающих в себя различные химические элементы [5–8], а также изучению свойств таких уникальных наносистем с возможностью дальнейшей интеграции в реальные области применения [9–11].
Одним из наиболее востребованных широкозонных полупроводниковых наноматериалов, получаемых физико-химическими методами, является сульфид кадмия. Наночастицы сульфида кадмия (NPsCdS) имеют энергию запрещенной зоны 2.42 эВ и малый размер (до 10 нм), что характеризует их как квантовые точки (КТ), которые вследствие уникальных оптоэлектронных свойств и хорошей химической стабильности находят применение в области создания солнечных батарей, светодиодов, газовых и биологических сенсоров, оптоэлектронных устройств, транзисторов, медицинской визуализации и т.д. [12–14]. Стратегия промышленного синтеза квантовых точек NPsCdS очень сложна, во многих случаях требует специализированного оборудования, использования энергоемких методов [15–18], применения для предотвращения агломерации NPsCdS агрессивных химических поверхностно-активных веществ, представляющих опасность для окружающей среды [19]. Показано, что свойства NPsCdS, синтезированных физико-химическими методами, значительно зависят от условий получения, размера, формы [22, 23]. Так, в зависимости от способа получения квантовых точек NPsCdS происходит формирование тех или иных дефектов кристаллической структуры, что вызывает изменение спектров поглощения и флуоресценции наночастиц [24, 25]. Обнаружено, что квантовые точки NPsCdS, вопреки распространенному представлению, имеют неупорядоченную структуру, а не характерную для монокристаллов, что определяет вариабельность оптических свойств [26]. Показано влияние концентрации КТ на спектры поглощения и флуоресценции коллоидных растворов и, следовательно, на возможность применения NPsCdS в тех или иных областях. Обнаружен феномен тушения интенсивности флуоресценции при увеличении концентрации NPsCdS в коллоидном растворе [27]. Не выявлено строгой корреляции между гидродинамическими размерами наночастиц и дзета (ζ)-потенциалом их коллоидных растворов [22, 24]. Как видно из приведенных примеров, даже в области многолетних исследований NPsCdS, полученных физико-химическими методами, существуют нерешенные вопросы и сложные корреляции между характеристиками наночастиц и способами их получения, концентрационными зависимостями и оптическими свойствами, размерами и оптоэлектронными параметрами.
В связи с этим значительный интерес представляет “зеленый” синтез биогенных NPsCdS с использованием различных биосубстратов и, в частности, микроорганизмов. Так, при микробном синтезе NPsCdS и других халькогенидов металлов в реакционную среду, содержащую клетки микроорганизмов, вводят соли – источники ионов металла и серы, что приводит к образованию частиц халькогенида металла. При этом бактерии активно синтезируют и выделяют в реакционную среду белки, полисахариды и аминокислоты, которые адсорбируются на поверхности наночастиц, стабилизируют их и предотвращают агломерацию в водных суспензиях. Таким образом, биогенные способы получения NPsCdS могут стать дополнением и альтернативой физико-химическим методам [3, 9, 20, 21].
Большой интерес представляет анализ оптических, фотокаталитических и электрофоретических свойств биогенных NPsCdS по сравнению с аналогами, полученными традиционными способами. Последние 10–15 лет активно исследуются характеристики биогенных наночастиц. Показано, что от условий биосинтеза наночастиц зависят такие параметры, как размер, форма, электрофоретические свойства, оптические характеристики, состав биомолекул, покрывающий наночастицы [28]. При оптимизации условий культивирования можно получать наночастицы с контролируемыми параметрами и повышать производительность процесса биосинтеза [29, 30]. Диаметр биогенных NPsCdS, определенный методом просвечивающей электронной микроскопии, варьирует в пределах 2–10 нм, однако величина гидродинамического диаметра зависит от применяемого штамма и условий биосинтеза [31, 32]. Большое внимание при биосинтезе наночастиц уделяется выбору микроорганизмов. В [33] сообщается об эффективном использовании для получения NPsCdS бактерий, выделенных из антарктических образцов, с высоким уровнем устойчивости к кадмию и теллуру. Это позволило повысить выход NPsCdS при очень высоких концентрациях CdCl2, что свидетельствует об огромном потенциале бактерий, резистентных к высоким концентрациям солей тяжелых металлов, как мощных продуцентах КТ.
В научной литературе представлены данные о том, что у биогенных наночастиц оптические спектры поглощения, ширина запрещенной зоны и интенсивность флуоресценции могут превышать аналогичные показатели для химически синтезированных частиц [34]. Показано, что оптические характеристики биогенных NPsCdS различаются в зависимости от использованного для биосинтеза штамма и фазы роста бактерий [34–36], гидродинамического диаметра [31], продолжительности реакции биосинтеза наночастиц [32]. Однако при всех вариациях спектры флуоресценции NPsCdS принадлежат синей зоне [21, 37].
Таким образом, представленные в научной литературе материалы свидетельствуют о значительном потенциале биогенного способа получения наночастиц халькогенидов металлов, его экологической безопасности, разнообразии и уникальности характеристик наноматериала, что делает их подходящими кандидатами для применения в различных областях наравне с физико-химическими аналогами.
В настоящей работе биосинтез NPsCdS в присутствии бактерий различных видов осуществлен с использованием разработанной авторами модификации микробного синтеза наночастиц, позволяющей получать концентрированные образцы наноматериала в аэробных условиях при температуре, оптимальной для микроорганизмов, с упрощенной системой выделения нанокристаллов. Проведены комплексные исследования биологических, физических и электрофоретических характеристик NPsCdS с целью выявления зависимости свойств наночастиц от использованных в биосинтезе бактерий различных систематических групп – Shewanella oneidensis MR-1 и Bacillus subtilis 168 – и возможности использования биогенных наночастиц в различных областях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культивирование штаммов микроорганизмов. Бактерии S. oneidensis MR-1 (№ В-9861) и B. subtilis 168 (№ В-7360), полученные в Национальном биоресурсном центре Всероссийской коллекции промышленных микроорганизмов НИЦ “Курчатовский институт” – ГосНИИгенетика, стерильно выращивали в колбах на круговой качалке (220 об./мин, 30°С, 24 ч) на жидкой питательной среде Luria–Bertani (LB), приготовленной по методике [38]. Все рабочие растворы готовили на деионизированной воде Milli Q (Millipore, CША). Культуральную жидкость (КЖ), содержащую клетки бактерий и метаболиты, синтезированные микроорганизмами, использовали для биосинтеза NPsCdS.
Микробный синтез NPsCdS. Биогенные NPsCdS получали в соответствии с методикой [30] с модификациями. В 100 мл КЖ бактерий S. oneidensis MR-1 или B. subtilis 168 вносили по 5 мл водного раствора Na2S ⋅ 9H2O (ч. д. а., 48 мг, 2 мМ) и CdCl2 ⋅ ⋅ 2.5H2O (ч. д. а., 46 мг, 2 мМ) и инкубировали на круговой качалке (220 об./мин, 30°С, 24 ч). Реакционная смесь солей и бактериальных клеток практически сразу приобретала ярко-желтый цвет, что свидетельствовало об образовании химического соединения CdS [39]. После 24 ч инкубации реакционной смеси клеточную фракцию отделяли центрифугированием (8000 об./мин, 30 мин), а надосадочную жидкость, содержащую NPsCdS, проводили через обеззоленные фильтры “Синяя лента” (диаметр пор 2–3 мкм). Затем NPsCdS осаждали центрифугированием фильтрата (32 000 об./мин, 1 ч) и двукратно промывали стерильной деионизированной водой Milli Q (32 000 об./мин, 1 ч). Промытый желтый осадок NPsCdS ресуспендировали в 1 мл деионизированной воды и хранили в микропробирках “Eppendorf” при 4°С.
Для NPsCdS, полученных с использованием данных бактерий, введено обозначение: NPsCdS/S. oneidensis MR-1 и NPsCdS/B. subtilis 168.
МЕТОДЫ ИССЛЕДОВАНИЯ СВОЙСТВ БИОГЕННЫХ NPsCdS
Анализ белков, адсорбированных на поверхности наночастиц. Для экстракции белковых молекул с поверхности NPsCdS разработан метод “снятия” белков с поверхности наночастиц с последующим анализом методом денатурирующего электрофореза в 12.5%-ном полиакриламидном геле (ПААГ) [40]. Образцы наночастиц центрифугировали при 16 400 об./мин в течение 20 мин. Надосадок удаляли и к осадку наночастиц добавляли 30 мкл двукратного буфера Sample Buffer, после чего образцы кипятили и вносили в лунку геля по 4 мкл. В качестве стандартов молекулярной массы использовали предокрашенные белковые маркеры № 26612 (Thermo Fisher Scientific, США). Идентификацию белков из полос геля проводили на тандемном времяпролетном масс-анализаторе Autoflex III (Bruker, Германия) методом MALDI-TOF/TOF.
Электрофоретические и оптические характеристики NPsCdS. Пробоподготовку образцов наночастиц проводили двумя способами:
– исходную суспензию наночастиц разводили деионизированной водой Milli Q в 20 раз и обрабатывали в течение 1 мин ультразвуком в УЗ-ванне “Сапфир” (частота 35 кГц, 200 Вт);
– исходную суспензию наночастиц центрифугировали (3000 об./мин, 5 мин) и анализировали надосадочную жидкость, разведенную деионизированной водой Milli Q в 20 раз.
Гидродинамический диаметр (ГД), ζ-потенциал NPsCdS и полидисперсность (ПДИ) их водных суспензий оценивали методом динамического рассеяния света с использованием прибора Zetasizer Nano ZS (Malvern Panalytical, Великобритания) и стандартных и U-образных кювет. Гидродинамический диаметр биогенных наночастиц, определяющий диаметр частицы с учетом белкового покрытия, рассчитывали усреднением максимальных (пиковых) значений размеров частиц в каждой отдельной фракции или усреднением всех зафиксированных в процессе измерения размеров NPsCdS. По величине ПДИ оценивали возможный разброс разноразмерных частиц в водном растворе.
Регистрацию УФ-видимых спектров поглощения биогенных NPsCdS проводили на двухлучевом сканирующем спектрофотометре Specord 250 PLUS (Analytik Jena AG, Германия) в диапазоне длин волн 190–1100 нм. Концентрацию NPsCdS в различных образцах уравнивали до 1 мг/мл. Спектры люминесценции NPsCdS регистрировали до и после центрифугирования образцов посредством спектрофлуориметра “Флюорат-02-Панорама” (Люмэкс, Россия) в диапазоне длин волн возбуждения (λв) 240–300 нм, соответствующих выявленному пику поглощения (248–250 нм), и затем строили в 3D-координатах: диапазон λв – длина волны люминесценции – интенсивность люминесценции.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Варианты оптимизации биосинтеза NPsCdS с использованием штаммов Shewanella oneidensis MR-1 и Bacillus subtilis 168. С целью повышения выхода биогенных NPsCdS и их концентрации стандартный протокол биосинтеза, представленный в [9, 41], был существенно модифицирован по двум параметрам.
Во-первых, был изменен подход к проведению реакции образования наночастиц: этап введения в водную смесь солей бактериальных клеток, отмытых от белковых молекул, был заменен на непосредственное внесение растворов солей в КЖ, содержащую бактерии в стационарной фазе роста и обогащенную белками и другими метаболитами, синтезированными клетками в процессе их культивирования. В результате количество белка в среде для биосинтеза наночастиц было увеличено в 5 раз и составляло 0.1 и 0.05 мг/мл для S. oneidensis MR-1 и B. subtilis 168 соответственно. Этот прием позволил повысить концентрацию солей в реакционном растворе с 1 до 3 мМ, увеличить выход NPsCdS на 15–20%, получить образцы водных суспензий NPsCdS с концентрацией 3–4 мг/мл, существенно сократить время и упростить схему получения наночастиц.
Во-вторых, была изменена процедура фильтрации реакционной смеси, содержащей NPsCdS и повышенное количество белка, поскольку мембранные фильтры с диаметром пор 0.2 мкм, используемые для этой цели в стандартном протоколе, задерживали на своей поверхности большое количество белок-покрытых наночастиц, что снижало их выход. Проблема была решена заменой фильтра с большим диаметром пор (2–3 мкм), что позволило увеличить концентрацию биогенных NPsCdS в водной суспензии до 7–8 мг/мл.
Возможность применения модифицированной методики биосинтеза наночастиц без изменения таких характеристик, как состав белкового покрытия, подтверждена анализом белков с поверхности NPsCdS/S. oneidensis и NPsCdS/B. subtilis методом электрофореза в ПААГ. Показано, что составы белкового покрытия NPsCdS не различались как при использовании стандартной, так и модифицированной методик, что говорит об успешном подходе к оптимизации процесса биосинтеза с сохранением характеристик биогенных наночастиц.
Оценка свойств NPsCdS/S. oneidensis MR-1 и NPsCdS/B. subtilis 168. На данный момент в научной литературе недостаточно информации о сравнительной оценке состава белкового покрытия биогенных наночастиц, величины их ГД, ζ-потенциала и полидисперсности в зависимости от конкретного вида бактерии, использованного в биосинтезе. Эти характеристики чрезвычайно важны для понимания причин стабильности/нестабильности наноматериала, увеличения срока хранения, предотвращения агрегации, повышения концентрации наночастиц при сохранении стабильности системы и возможности их использования в практических целях.
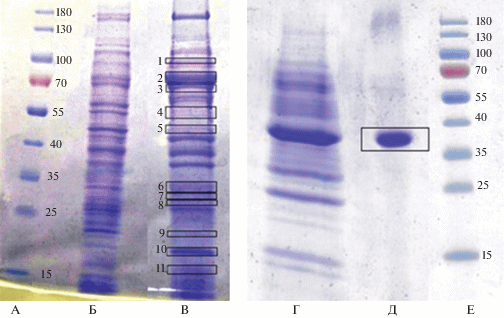
Анализ белкового покрытия наночастиц. Показано, что NPsCdS/S. oneidensis MR-1 и NPsCdS/B. subtilis 168 имеют форму, близкую к сферической, характеризуются кристаллической структурой и узким распределением по размеру, 5 ± 1 нм [42]. Методами ПААГ и MALDI-TOF/TOF выявлено, что при использовании S. oneidensis MR-1 и B. subtilis 168 на поверхности NPsCdS формируются принципиально различные по составу слои белкового покрытия. Установлено, что из всего разнообразия белков, синтезированных штаммом S. oneidensis, на поверхность наночастиц адсорбируются ~15 видов белковых молекул с молекулярной массой от 20 до 170 кДа, которые принадлежат к белкам внешней оболочки или цитоплазматической мембраны бактерии и представлены белками семейства TonB-зависимых рецепторов, рецепторов наружной мембраны семейства FadL, системы секреции TolC, поринов наружной мембраны – Omp A, Omp C, Omp K, Omp W, Omp X, Omp 35, флагеллином (рис. 1, трек В). При использовании B. subtilis на поверхности NPsCdS обнаруживается только один белок флагеллин FliC c молекулярной массой 35 кДа, входящий в состав жгутиков данной бактерии (рис. 1, трек Д). Аналогичные результаты были ранее получены для NPsAg2S/S. оneidensis и NPsAg2S/B. subtilis [43], что подтверждает избирательность адсорбции определенных белков, составляющих на поверхности наночастиц уникальный биослой, который определяется штаммом и при этом не зависит от химического состава бинарных неорганических частиц. Таким образом, показано влияние штаммов на состав белков, адсорбированных на поверхности наночастиц. Полученные результаты открывают возможность создания биогенных наночастиц методом микробного синтеза с определенным набором белков на их поверхности, которые могут быть использованы в качестве модели для исследования границы между живой и неживой материей, а также объяснения причин адсорбции определенных белков на поверхность наночастиц, для применения в медицине, для создания новых нанокомпозитных материалов.
Рис. 1.
Электрофореграммы белков, выделенных из КЖ бактерий и сорбированных на поверхности биогенных NPsCdS: А, Е – треки маркеров молекулярной массы белков (кДа); Б, Г – белки из КЖ S. oneidensis MR-1 и КЖ B. subtilis 168 соответственно; В, Д – белки с поверхности NPsCdS/S. oneidensis MR-1 и с поверхности NPsCdS/B. subtilis 168 соответственно. Цифрами обозначены полосы, белки из которых были идентифицированы методом MALDI-TOF/TOF.
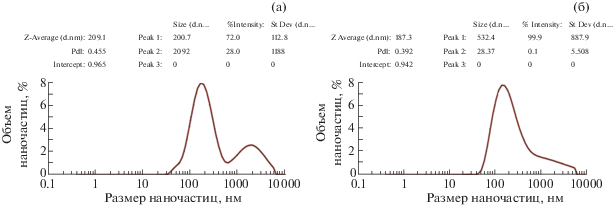
Электрофоретические характеристики биогенных NPsCdS (ГД, ζ-потенциал и ПДИ). Известно, что наночастицы в водной среде склонны к агрегации, в результате которой изменяются их размер и величина удельной поверхности. В случае биогенных наночастиц, для которых еще не полностью изучены механизмы избирательной адсорбции белков на их поверхность, конформация белковых молекул, количество слоев на поверхности и возможность образования агломератов, является актуальным определение величины ПДИ коллоидной системы и связанным с ним значением ГД белок-покрытых наночастиц. Гидродинамический диаметр наночастиц в растворе может в сотни раз отличаться от “истинного” диаметра наночастиц, измеренного с помощью просвечивающей электронной микроскопии. Распределение наночастиц по размерам (ГД) в образце является важным показателем коллоидной системы, а также может быть использовано для оценки центрифугирования и УЗ-обработки суспензии наночастиц как способов повышения монодисперсности образцов.
Так, при значении ПДИ < 0.5 корректно учитывать показатель среднего ГД (Z-average) наночастиц, указываемый на графике распределения наночастиц по размерам (рис. 2а). Однако если ПДИ > 0.5, для анализа ГД наночастиц необходимо использовать гистограмму распределения, т.е. величину пика(ов) при наличии нескольких фракций, различающихся по размерам. Показатель Z-average можно считать корректным только в случае монодисперсных, мономодальных систем со сферическими частицами в растворителе (в водном растворе). Во всех остальных случаях ПДИ является усредненным значением интенсивности сигнала. На рис. 2 представлено распределение по размерам NPsCdS/S. оneidensis (образец № 1) до центрифугирования. Для водной суспензии NPsCdS/S. оneidensis № 1 параметр ПДИ < < 0.5, что позволяет оперировать показателем Z-average и его значением ~170 нм. Основные пики содержат более 90% наночастиц, близких по величине диаметра, ~200 нм. Также наблюдается наличие крупной фракции размером ~3 мкм (5.7%), что может свидетельствовать о регистрации агломератов наночастиц. Значение ζ-потенциала образца № 1 имеет отрицательную величину –16.7 мВ, что свидетельствует об отрицательном заряде поверхности NPsCdS/S. оneidensis и, по общепринятым данным [39], характеризует данную водную суспензию как метастабильную, склонную к частичной агломерации и осаждению. Наличие незначительной доли (0.1%) крупных фракций агрегированных NPsCdS подтверждается проявлением ζ-потенциала со значением 64 мВ. После центрифугирования образца № 1 значения ГД и ζ-потенциала незначительно отличались от этих параметров до центрифугирования (~200 нм, –17.7 мВ), поэтому для таких образцов данный вид пробоподготовки может не применяться. Таким образом, использование бактерии S. oneidensis для биосинтеза NPsCdS приводит к образованию однородной по распределению размеров наночастиц системы с незначительным содержанием крупных фракций.
Рис. 2.
Электрофоретические характеристики NPsCdS/S. oneidensis № 1 до центрифугирования: а – распределение наночастиц по размерам, нм; б – значение ζ-потенциала наночастиц, мВ.
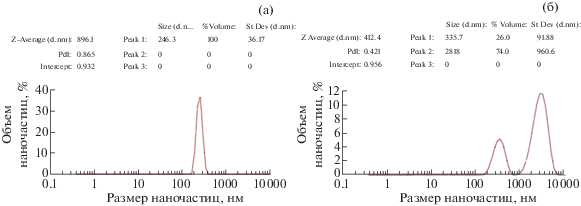
На рис. 3 представлены данные распределения по размерам наночастиц NPsCdS/B. subtilis (образец № 2), полученных в одном эксперименте с NPsCdS/S. оneidensis № 1. Видно, что до/после центрифугирования образца ПДИ < 0.5, что позволяет ориентироваться на величину Z-average, ~190 нм. Однако до центрифугирования на гистограмме (рис. 3а) наблюдается наличие двух пиков с размером наночастиц ~200 нм (72%) и структур размером 2092 нм (28%), которым соответствуют значения ζ-потенциала –26.6 (100%) и –17.5 мВ (36.4%), что подтверждает наличие крупных фракций агрегированных NPsCdS в метастабильной суспензии образца № 2. После центрифугирования (рис. 3б) содержание таких агрегатов не регистрируется – на гистограмме присутствует единственный пик с размером наночастиц ~532 нм (99.9%), значение ζ-потенциала которого –25.5 мВ, что свидетельствует об осаждении значительной доли агломератов наночастиц и увеличении монодисперсности суспензии. Применение центрифугирования для таких образцов целесообразно. Из представленных данных следует, что применение штамма B. subtilis для биосинтеза NPsCdS приводит к образованию не однородных по распределению размеров наночастиц, с бóльшим ГД по сравнению с S. oneidensis.
Анализ большого количества образцов NPsCdS/B. subtilis, полученных в различных экспериментах, показал, что параметр ПДИ в ряде случаев превышает 0.5. Поэтому для оценки профиля основного распределения частиц по размерам и фракционного состава водных суспензий NPsCdS/B. subtilis был использован метод УЗ-обработки образцов как возможный способ предотвращения образования крупных агломератов наночастиц. На рис. 4 представлены результаты анализа NPsCdS/B. subtilis (образец № 3) до и после УЗ-обработки. Как видно из графика, до УЗ величина ПДИ > 0.5 (рис. 4а), поэтому оценку размеров наночастиц требуется проводить не по Z-averagе, а по величине пика 1, которая составляла 246.3 нм, что не соответствует параметрам ПДИ и Z-averagе. В случае таких сложных систем необходимо дополнительное воздействие на коллоидную суспензию. УЗ-обработка образца № 3 привела к снижению ПДИ (рис. 4б) и изменению профиля первоначального распределения частиц с образованием двух фракций (пиков) – наночастиц размером 335 нм (26%) и крупных агломератов NPsCdS величиной 2818 нм (74%). Последующие пятикратные УЗ-обработки суспензии NPsCdS/B. subtilis № 3 сократили доли крупных агломератов вплоть до образования монодисперсной фракции NPsCdS размером 250–300 нм. Таким образом, УЗ-обработка водных суспензий биогенных NPsCdS может применяться как метод анализа для корректной оценки электрофоретических показателей образца, определения размеров наночастиц в образцах, снижения фракций крупных агломератов наночастиц и увеличения показателя монодисперсности. По показателям ζ-потенциала NPsCdS/S. oneidensis и NPsCdS/B. subtilis относятся к метастабильным коллоидным системам.
Таким образом, выявлено влияние различных штаммов бактерий на такие параметры наночастиц NPsCdS, как показатели полидисперсности и ГД. В табл. 1 суммированы данные по вариациям электрофоретических показателей NPsCdS/S. oneidensis и NPsCdS/B. subtilis.
Таблица 1.
Характеристики NPsCdS/S. оneidensis и NPsCdS/B. subtilis
| Параметры наночастиц | Наночастицы | |
|---|---|---|
| NPsCdS/S. оneidensis | NPsCdS/B. subtilis | |
| Диаметр, нм | 5 ± 1 | 5 ± 1 |
| Состав белкового покрытия NPsCdS | Более 15 различных белков внешней оболочки или цитоплазматической мембраны бактерии | Один белок – флагеллин, входящий в состав жгутиков бактерии |
| Гидродинамический диаметр, нм | 160–210 | 200–550 |
| ζ-потенциал, мВ | от –16 до −22 | от −20 до −27 |
| Параметры флуоресценции при λв 270 нм | ||
| Длина волны (нм) максимума полосы флуоресценции | 340 | 300–330 |
| Относительная интенсивность флуоресценции | 0.05–0.12 | 0.0075–0.0090 (фоновая интенсивность) |
| Параметры флуоресценции при λв 248–250 нм | ||
| Длина волны (нм) максимума полосы флуоресценции | 440 | 435 |
| Относительная интенсивность флуоресценции | 0.52 | 0.18 |
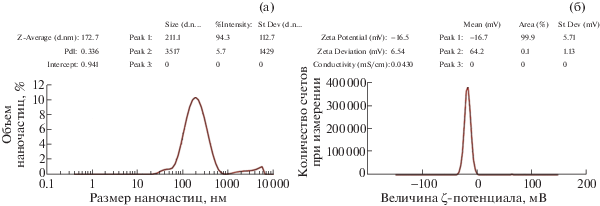
Спектры флуоресценции биогенных NPsCdS. На рис. 5 представлены спектры флуоресценции образцов NPsCdS/S. oneidensis № 1 и NPsCdS/B. subtilis № 2, полученные до центрифугирования, поскольку до/после обработки суспензий пики флуоресценции NPsCdS были зафиксированы в близких значениях синей области спектра: 445 и 440 нм соответственно, при λв 248–250 нм. Способность данных NPsCdS к флуоресценции, а также малый размер (5 ± 1 нм) позволяют отнести их к КТ.
Рис. 5.
Оптические характеристики биогенных NPsCdS до центрифугирования. NPsCdS/S. oneidensis № 1: а – спектр поглощения, б – спектр флуоресценции; при λв 248–250 нм, пик флуоресценции 440 нм, интенсивность 0.52. NPsCdS/B. subtilis № 2: в – спектр поглощения, г – спектр флуоресценции; при λв 248–250 нм, пик флуоресценции 435 нм, интенсивность 0.18.

Для регистрации спектров флуоресценции биогенных NPsCdS (рис. 5б, 5г) была использована λв 270 нм, соответствовавшая длине волны наибольшего поглощения. При этом вне зависимости от бактерии, определяющей белковое покрытие NPsCdS, для всех образцов наблюдается максимум полосы флуоресценции в схожем диапазоне длин волн синей области спектра (300–450 нм), что свидетельствует об отсутствии явного влияния штаммов на параметры спектров поглощения и длины волны пика флуоресценции NPsCdS.
Обнаружено значительное влияние штаммов на уровень интенсивности флуоресценции синтезированных NPsCdS. При λв 248–250 нм значение интенсивности флуоресценции для NPsCdS/S. oneidensis № 1 составляло 0.52 (рис. 5б), для NPsCdS/ B. subtilis № 2 – 0.18 (рис. 5г). При λв 270 нм интенсивность флуоресценции NPsCdS/B. subtilis заметно снижается (табл. 1).
Отметим, что анализ различных образцов NPsCdS, полученных с использованием данных штаммов, показал устойчивое снижение значений интенсивности флуоресценции для NPsCdS/B. subtilis. При этом оценивали как суспензии с различными концентрациями NPsCdS, так и образцы, полученные до/после центрифугирования и УЗ-обработки, при воздействии различных λв.
Таким образом, показана зависимость интенсивности флуоресценции биогенных NPsCdS от штаммов, использованных для биосинтеза. Причинами снижения интенсивности флуоресценции при использовании B. subtilis могут быть “гашение” флуоресценции белком флагеллином, покрывающим поверхность наночастиц NPsCdS/B. subtilis, его конформационные особенности, значительный ГД наночастиц. Диссоциированный на отдельные мономеры флагеллин способен к самосборке в спиральные полые структуры в условиях in vitro. В какой конформации этот белок присутствует на поверхности наночастиц, пока неизвестно. Механизм “гашения” флуоресценции NPsCdS/B. subtilis требует дополнительных исследований.
ЗАКЛЮЧЕНИЕ
В работе предложен природоподобный, экологически безопасный и технологически простой метод синтеза NPsCdS с использованием штаммов бактерий S. oneidensis MR-1 и B. subtilis 168, проводимый в аэробных условиях при нормальном давлении и температуре, оптимальной для бактерий, без искусственных стабилизаторов. Разработана эффективная модификация процесса биосинтеза, повышающая на 15–20% выход биогенных NPsCdS и увеличивающая их концентрацию в водной суспензий до 7–8 мг/мл с сохранением основных характеристик наночастиц.
Диаметр NPsCdS составляет 5 ± 1 нм и не зависит от использованного при биосинтезе штамма. Подтверждено наличие белковых молекул на поверхности биогенных NPsCdS, стабилизирующих наночастицы в водных суспензиях. Доказано влияние штамма на состав белков, адсорбированных на наночастицах. Проведена идентификация белковых молекул, установлена их избирательная адсорбция на наночастицы в зависимости от бактериального штамма. Показано, что электрофоретические показатели NPsCdS – полидисперсность и гидродинамический диаметр, зависят от использованного при их получении штамма. Так, применение S. oneidensis приводит к образованию более монодисперсных систем по сравнению с B. subtilis, для которого характерно образование наночастиц с бóльшим ГД и крупных фракций. Дзета-потенциал NPsCdS имеет отрицательный заряд, а его величина характеризует водные суспензии наночастиц как метастабильные. Доказана целесообразность применения центрифугирования и УЗ-обработки суспензий NPsCdS как способов повышения монодисперсности коллоидных систем.
Обнаружена зависимость уровня интенсивности флуоресценции NPsCdS от S. oneidensis и B. subtilis, однако на другие оптические свойства биогенных наночастиц – спектры поглощения и длину волны пика флуоресценции – влияния штаммов не выявлено.
Результаты исследования открывают возможность создания NPsCdS с модифицируемой по составу белков поверхностью, не уступающих по своим свойствам химически синтезированным наночастицам. Флуоресцирующие биогенные КТ, покрытые слоем белковых молекул, могут быть использованы в качестве самостоятельных носителей различных биологических молекул, биолигандов и лекарственных веществ или в составе специализированных полимерных систем для практических целей клинической биомедицины, применяться в качестве нанонаполнителей при создании композиционных материалов. Фотокаталитические свойства NPsCdS как квантовых точек открывают возможность использовать дешевые и доступные в производстве наноматериалы в качестве экологически безопасных катализаторов для очистки и обесцвечивания окрашенных промышленных стоков предприятий. Фундаментальные исследования по выявлению корреляции физико-химических свойств биогенных наночастиц с антибактериальными характеристиками, цито- и генотоксичностью, уровнем биодоступности позволят оценить область применения в прикладной медицине при разработке диагностикумов, терапии как антибактериальных агентов нового поколения.
Авторы выражают благодарность Национальному биоресурсному центру Всероссийской коллекции промышленных микроорганизмов НИЦ “Курчатовский институт” – ГосНИИгенетика за предоставление бактериальных штаммов.
Исследование выполнено при частичной финансовой поддержке Российского фонда фундаментальных исследований (проект № 19-04-00088).
Список литературы
Pantidos N., Horsfall L.E. // J. Nanomed. Nanotechnol. 2014. V. 5. № 5. P. 1. https://doi.org/10.4172/2157-7439.1000233
Salunke B.K., Sawant S.S., Lee S., Kim B.S. // World J. Microbiol. Biotechnol. 2016. V. 32. № 88. P. 1. https://doi.org/10.1007/s11274-016-2044-1
Prasad R. Nanotechnology in the Life Science. Switzerland: Springer Nature Switzerland AG, 2019. 332 p. https://doi.org/10.1007/978-3-030-16383-9_3
Gour A., Jain N.K. // Artif. Cells, Nanomed. Biotechnol. 2019. V. 47. № 1. P. 844. https://doi.org/10.1080/21691401.2019.1577878
Kitching M., Ramani M., Marsili E. // Microbial Biotechnology. 2014. V. 8. № 6. P. 904. https://doi.org/10.1111/1751-7915.12151
Dahoumane S.A., Wujcik E.K., Jeffryes C. // Enzyme and Microbial Technology. 2016. V. 95. P. 13. https://doi.org/10.1016/j.enzmictec.2016.06.008
Salouti M., Zonooz N.F. Nanoscience and Plant-Soil System. Switzerland: Springer Nature Switzerland AG, 2017. 70 p. https://doi.org/10.1007/978-3-319-46835-8_2
Kim T.-Y., Kim M.G., Lee J.-H., Hur H.-G. // Front. Microbial. 2018. V. 9. P. 1. https://doi.org/10.3389/fmicb.2018.02817
Hosseini M.R., Sarvi M.N. // Mater. Sci. Semicond. Process. 2015. V. 40. P. 293. https://doi.org/10.1016/j.mssp.2015.06.003
Gebre S.H., Sendeku M.G. // SN Applied Sciences. 2019. V. 1. № 928. P. 1. https://doi.org/10.1007/s42452-019-0931-431
Aenishanslins N.Ó., Ostuni G.A., Quezada C.P. et al. // Front. Microbiol. 2019. V. 11. P. 1. https://doi.org/10.3389/fmicb.2019.01587
Santra P.K., Kamat P.V. // J. Am. Chem. Soc. 2013. V. 135. № 2. P. 877. https://doi.org/10.1021/ja310737m
Salimia A., Rahmatpanah R., Hallaj R., Roushani M. // Electrochim. Acta. 2013. V. 95. P. 60. https://doi.org/10.1016/j.electacta.2013.01.154
Zhu L., Feng C., Li F., Zhang D. et al. // RSC Adv. 2014. V. 4. P. 61691. https://doi.org/10.1039/C4RA11010B
Zhang L.J., Shen X.C., Liang H. et al. // J. Colloid Interface Sci. 2010. V. 342. № 2. P. 236. https://doi.org/10.1016/j.jcis.2009.10.030
Dalvand P., Mohammadi M.R., Fray D.J. // Mater. Lett. 2011. V. 65. № 9. P. 1291. https://doi.org/10.1016/j.matlet.2011.01.055
Mahdi M.A., Hassan Z., Ng S.S. et al. // Thin Solid Films. 2012. V. 520. № 9. P. 3477. https://doi.org/10.1016/j.tsf.2011.12.059
Senasu T., Hemavibool K., Nanan S. // RSC Adv. 2018. V. 8. P. 22592. https://doi.org/10.1039/C8RA02061B
Xaba T., Moloto M.J., Moloto N. // Mater. Lett. 2015. V. 146. P. 91. https://doi.org/10.1016/j.matlet.2015.01.153
Rao M.D., Pennathur G. // Mater. Res. Bull. 2017. V. 85. P. 64. https://doi.org/10.1016/j.materresbull.2016.08.049
Bhadwal A.S., Tripathi R.M., Gupta R.K. et al. // RSC Adv. 2014. V. 4. P. 9484. https://doi.org/10.1039/C3RA46221H
Ремпель С.В., Левин А.Д., Садагов А.Ю., Ремпель А.А. // ФТТ. 2015. Т. 57. С. 1087.
Solanki R.G., Rajaram P. // Nano-Structures Nano-Objects. 2017. V. 12. P. 157. https://doi.org/10.1016/j.nanoso.2017.10.003
Kuznetsova Y.V., Letofsky-Papst I., Sochor B. et al. // Colloids and Surfaces A. 2019. V. 581. P. 1. https://doi.org/10.1016/j.colsurfa.2019.123814
Li X., Xu J. // Mater. Today Commun. 2018. V. 24. P. 1. https://doi.org/10.1016/j.mtcomm.2020.101108
Rempel A., Magerl A. // Acta Cryst. 2010. V. 66. P. 479. https://doi.org/10.1107/S010876731001250X
Ремпель С.В., Подкорытова А.А., Ремпель А.А. // ФТТ. 2014. Т. 56. С. 549.
Dahoumane S.A., Jeffryes C., Mechouet M., Agathos S.N. // Bioengineering. 2017. V. 4. № 14. P. 1. https://doi.org/10.3390/bioengineering4010014
Shakouri V., Salouti M., Mohammadi B., Zonooz N.F. // Synth. React. Inorgan. Met.-Org. Nano-Met. Chem. 2016. V. 46. P. 1468. https://doi.org/10.1080/15533174.2015.1137021
Воейкова Т.А., Журавлева О.А., Грачева Т.С. и др. // Биотехнология. 2017. Т. 33. № 3. С. 38. https://doi.org/10.21519/0234-2758-2017-33-3-38-46
Qi P., Zhang D., Zeng Y., Wan Y. // Talanta. 2016. V. 147. P. 142. https://doi.org/10.1016/j.talanta.2015.09.046
Dunleavy R., Lu L., Kiely C.J., McIntosh S. et al. // PNAS. 2016. V. 113. P. 5275. https://doi.org/10.1073/pnas.1523633113
Plaza D.O., Gallardo C., Straub Y.D. // Microbial. Cell Factories. 2016. V. 15. № 76. P. 1. https://doi.org/10.1186/s12934-016-0477-8
Yue L., Qi S., Wang J. // Mater. Sci. Semicond. Process. 2016. V. 56. P. 115. https://doi.org/10.1016/j.mssp.2016.07.015
Feng H., Liu S., Huang X. et al. // Int. J. Electrochem. Sci. 2017. V. 12. P. 618. https://doi.org/10.20964/2017.01.57
Prasad K., Jha A.K. // J. Colloid Interface Sci. 2010. V. 342. P. 68. https://doi.org/10.1016/j.jcis.2009.10.003
Yu X., Yu J., Cheng B., Huang B. // Chem. Eur. J. 2009. V. 15. P. 6731.
Маниатис Т., Фрич Э., Сэмбрук Д. Методы генетической инженерии. Молекулярное клонирование: методическое руководство. М.: Мир, 1984. 479 с.
Садовников С.И., Гусев А.И., Ремпель А.А. Полупроводниковые наноструктуры сульфидов свинца, кадмия и серебра. М.: Физматлит, 2018. 428 с.
Laemmli U.K. // Nature. 1970. V. 227. P. 680.
Suresh A.K., Doktycz M.J., Wang W. et al. // Acta Biomater. 2011. V. 7. P. 4253. https://doi.org/10.1016/j.actbio.2011.07.007
Журавлева О.А., Воейкова Т.А., Хаддаж М.Х. и др. // Молекулярная генетика, микробиология, вирусология. 2018. Т. 36. № 4. С. 191. https://doi.org/10.17116/molgen201836041191
Воейкова Т.А., Журавлева О.А., Булушова Н.В. и др. // Молекулярная генетика, микробиология, вирусология. 2017. Т. 35. № 4. С. 151. https://doi.org/10.18821/0208-0613-2017-35-4-151-156
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии