Российские нанотехнологии, 2020, T. 15, № 4, стр. 451-460
РАДИОИЗОТОПЫ РЕНИЯ – ПОЛУЧЕНИЕ, СВОЙСТВА И НАПРАВЛЕННАЯ ДОСТАВКА С ПОМОЩЬЮ НАНОСТРУКТУР
Р. А. Алиев 1, *, Е. С. Кормазева 1, Е. Б. Фуркина 1, А. Н. Моисеева 1, В. А. Загрядский 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: ramiz.aliev@gmail.com
Поступила в редакцию 06.08.2020
После доработки 27.08.2020
Принята к публикации 04.09.2020
Аннотация
Два изотопа рения – 186Re и 188Re – представляют интерес для ядерной медицины. Многочисленность степеней окисления и разнообразная координационная химия рения открывают широкие возможности для синтеза различных биоконъюгатов, в том числе на основе наноразмерных носителей – липосом, дендримеров, неорганических наночастиц. В обзоре проанализированы ядерные реакции, приводящие к образованию изотопов рения, методы выделения из мишеней, а также различные варианты применения рения в ядерной медицине.
ОГЛАВЛЕНИЕ
Введение
1. Методы получения радиоизотопов рения
1.1. Рений-186
1.2. Рений-188
2. Выделение рения из вольфрамовых мишеней
3. Радиофармпрепараты на основе радиоизотопов рения
4. Направленная доставка с помощью наноструктур
Заключение
ВВЕДЕНИЕ
Два изотопа рения – 186Re (T1/2 = 3.72 сут, Eβmax = 1069 кэВ, Eγ = 137 кэВ, 9.42%) и 188Re (T1/2 = 17.0 ч, Eβmax = 2120 кэВ, Eγ = 155 кэВ, 15.1%) – представляют интерес для ядерной медицины. Во многом интерес обусловлен близостью химических свойств рения и технеция – наиболее широко применяемого металла в ядерной медицине: 80% всех процедур ядерной медицины проводятся с использованием изотопа технеция-99m (99mTc) [1]. Популярность 99mTc объясняется его благоприятными ядерно-физическими свойствами: он быстро распадается после проведения процедуры (T1/2 = 6.0 ч), испускает низкоэнергетические гамма-кванты (140.5 кэВ, 89%), которые легко регистрировать, в то же время они не создают значительной радиационной опасности для персонала. Основной метод производства – генераторный, что делает 99mTc доступным для большинства медицинских учреждений. Наиболее часто применяющийся генератор – 99Mo/99mTc был впервые использован в 1961 г. [2]: в ядерном реакторе получают изотоп молибдена-99 (99Mo) с периодом полураспада 65.9 ч. Затем 99Mo фиксируют на хроматографической колонке. В результате его радиоактивного распада накапливается 99mTc, его смывают с колонки изотоническим раствором и применяют для диагностики. Процедуру выделения технеция можно повторять многократно, пока не распадется основная часть молибдена.
Хорошо изученная химия технеция открывает возможности для разработки рениевых аналогов многочисленных радиофармпрепаратов (РФП), первоначально созданных на основе 99mTc. Изотопы рения можно применять как терапевтический аналог в паре с диагностическими на основе 99mTc. При этом оба изотопа рения могут рассматриваться как тераностические, поскольку наличие мягкой гамма-линии позволяет визуализировать распределение радионуклида в организме методом однофотонной эмиссионной компьютерной томографии (ОФЭКТ).
Изотоп рения-186 (186Re) обладает рядом преимуществ в сравнении с рением-188 (188Re), в частности, его более длительный период полураспада лучше подходит для применений в таргетной эндорадиотерапии. Бета-частицы 186Re имеют меньший пробег в биологической ткани в сравнении с 188Re (3.6 и 11 мм соответственно), что позволяет поражать объекты меньшего размера.
Интерес к изотопам рения остается высоким на протяжении многих лет. Помимо упомянутой аналогии с технецием, он обусловлен тем, что 188Re – один из немногочисленных терапевтических радионуклидов, получаемых в изотопном генераторе. Одним из наиболее перспективных применений радиоактивного рения является создание РФП на основе наноструктур – липосом, дендримеров, функционализированных наночастиц оксида железа.
1. МЕТОДЫ ПОЛУЧЕНИЯ РАДИОИЗОТОПОВ РЕНИЯ
1.1. Рений-186
186Re можно получать в атомном реакторе, облучая тепловыми нейтронами стабильного изотопа рения-185 (185Re). Однако сечение реакции относительно невелико и составляет 112 барн. С помощью (n, γ)-реакции можно получить продукт лишь с относительно невысокой удельной активностью, недостаточной для таргетной эндорадиотерапии. Так, облучением перрената алюминия, обогащенного по изотопу 185Re, в реакторе университета Миссури потоком нейтронов ~4 · 1014 нейтронов/см2/с в течение двух недель был получен продукт с удельной активностью 3 Ки/мг, что составляет менее 2% от теоретической величины [3].
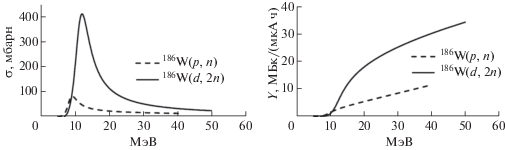
Получить радионуклид без носителя можно в реакциях под действием заряженных частиц. Наиболее распространенный способ – облучение изотопа вольфрама-186 (186W) протонами [4] или дейтронами [5]. Сечения реакций 186W(p, n)186Re и 186W(d, 2n)186Re хорошо изучены. Согласно компиляции имеющихся экспериментальных данных, сделанной МАГАТЭ [6], максимальное сечение для первой из них, равное ~80 мбарн, достигается при 9 МэВ, для второй – ~400 мбарн при 12 МэВ. Близкие величины приводятся и в более поздней обобщающей работе [7]. При облучении протонами необходимо удерживать энергию ниже 15.3 МэВ, чтобы не протекала побочная реакция 186W(p, 3n)184Re, приводящая к образованию долгоживущего радиоактивного изотопа 184Re. Выход целевого продукта при этом составляет 3.7 МБк/(мкА ч). При облучении дейтронами энергию нужно удерживать ниже 17.6 МэВ. Выход реакции на дейтронах примерно в 4 раза выше – 14.6 МБк/(мкА ч) (рис. 1), в этом случае облучаемого материала нужно меньше, поскольку пробег дейтронов меньше, чем протонов.
Кроме вольфрамовых мишеней, предложено [8] облучать мишени осмия-192 (192Os) протонами средних энергий. Максимальное сечение реакции 192Os(p, α3n)186Re составляет примерно 80 мбарн при 25 МэВ. Но и в этом случае невозможно использовать весь полезный энергетический диапазон и приходится ограничивать энергию порогом побочной реакции 192Os(p, α5n)184Re, равным 27.3 МэВ. Выход 186Re при этом составляет 7.76 МБк/(мкА ч). В табл. 1 приведены основные эксперименты, в которых исследовались ядерные реакции, приводящие к 186Re.
Таблица 1.
Описанные в литературе исследования ядерных реакций, приводящих к 186Re
| Материал мишени | Частицы | Энергия, МэВ | Литература |
|---|---|---|---|
| natW | p | 99 → 46 | [9] |
| natW | p | 9.9 → 6.6 | [10] |
| natW | p | 33.4 → 5.7 | [11] |
| natW | p | 64.9 → 32 | [12] |
| natW | p | 17.8 → 7.5 | [13] |
| natW | p | 31.1 → 5.6 | [14] |
| natW | p | 21.6 → 4.7 | [15] |
| natW | p | 69.9 → 52.1 | [16] |
| natW | d | 49.2 → 7 | [17] |
| natW | d | 34.1 → 22.8 | [18] |
| natW | d | 37.8 → 4.9 | [19] |
| natW | d | 17.4 → 6.6 | [20] |
| natW | d | 35 → 8 | [21] |
| natW | d | 33.4 → 8.9 | [22] |
| 186W | p | 17.6 → 6.5 | [23] |
| 186W | p | 21.6 → 4.7 | [15] |
| 186W | p | 19.8 → 5.5 | [24] |
| 186W | 3He | 31.6 | [25] |
| 186W | α | 43.4 | [26] |
| natRe | α | 60 → 24.4 | [26] |
| natRe | p | >78 | [27] |
| natRe | d | 40 → 25 | [28] |
| natRe | p | 69.5 → 2.8 | [29] |
| 192Os | p | 66.5 → 16.8 | [8] |
В качестве материала мишени используется как вольфрам природного изотопного состава, так и обогащенный по изотопу 186W в виде металла [30], оксида [24] и сульфида [31].
В [32] изотопно обогащенный (96.8%) металлический вольфрам растворяли в соляной кислоте с добавлением H2O2. Раствор упаривали досуха, полученный оксид вольфрама(VI) (200 мг) помещали в алюминиевую капсулу и прессовали под давлением 700 кг/см2. Полученная мишень выдерживала облучение пучком 13.8 МэВ протонов интенсивностью 20–25 мкА в течение 12 ч.
В [31] в качестве материала мишени использовали сульфид вольфрама WS2. Материал мишени наносили на алюминиевую подложку толщиной 16 мкм при помощи пресса с последующей герметизацией эпоксидной смолой. Облучения проводили при энергиях протонов до 14 МэВ и силой тока 10 мкA/ч.
В исследовании, проведенном в Лос-Аламосской национальной лаборатории [33], в качестве мишени использовали спрессованный в таблетку (5.1 см × 2.54 мм) WO3 с природным изотопным составом массой 25.19 г. Таблетку спекали на воздухе при 1000°С, а затем герметизировали ее внутри капсулы из ниобия (толщина 0.6 мм спереди и 1.4 мм сзади) в вакууме с помощью электронно-лучевой сварки. Мишень облучали в течение суток пучком протонов энергией до 26 МэВ со средним током 18.5 мкА. В последующих работах мишень из обогащенного WO3 массой ~10 г в ниобиевой оболочке облучали током 230 мкА в течение 16.5 ч. Энергия пучка в мишени составляла 20.7 → → 13.3 МэВ. Из мишени было выделено 4.4 ГБк целевого радионуклида с удельной активностью ~0.8 ГБк/мкг [4]. Тем самым была показана практическая возможность наработки на ускорителях заряженных частиц медицинских количеств 186Re с высокой удельной активностью.
1.2. Рений-188
188Re без носителя обычно получают в изотопном генераторе при радиоактивном распаде 188W (T1/2 = 69.8 сут). Последний получают двойным нейтронным захватом из 186W по пути 186W(n,γ)187W(n,γ)188W. Сечения обеих реакций относительно невелики (38 и 64 барн соответственно), поэтому требуются длительные времена облучения (десятки дней). При двойном нейтронном захвате наработка целевого продукта пропорциональна квадрату плотности потока нейтронов, поэтому для получения значимых количеств 188W необходимы плотности потока тепловых нейтронов не менее 1014 нейтронов/(см2 с). Типичные величины удельной активности составляют 4–10 Ки/г для высокопоточного реактора в Окридже (1.8 · 1015 нейтронов/(см2 с)) [34]. Еще два реактора – реактор СМ-3 в Димитровграде (3 · 1015 нейтронов/(см2 с)) и BR2 в Моле, Бельгия (1 · 1015 нейтронов/(см2 с)), производят 188W с приемлемой удельной активностью [35]. Применяемый для зарядки генераторов 188W имеет удельную активность около 5 Ки/г (185 ГБк/г), т.е. представляет собой смесь радиоактивного и стабильного изотопов. Производительность одного медицинского генератора составляет 0.25–3 Ки, это означает, что количество вольфрама, загружаемого в генератор, измеряется десятыми долями грамма. Эта ситуация радикально отличается от традиционных генераторов 99Mo/99mTc, где радиоактивный молибден не содержит значимых примесей стабильного изотопа, поскольку получается не в реакции захвата нейтрона, а при делении урана. Поэтому в вольфрам-рениевых генераторах часто используют двухстадийный процесс с дополнительным концентрированием раствора, полученного из первой колонки, заполненной оксидом алюминия [36]. Рассматриваются и альтернативные варианты генераторов, в частности основанные на геле вольфрамата титана [37]. Предложено [38] использование наночастиц оксида циркония в качестве сорбента для 188W/188Re-генераторов. Емкость нанокристаллического ZrO2 составила 325 мг/г.
2. ВЫДЕЛЕНИЕ РЕНИЯ ИЗ ВОЛЬФРАМОВЫХ МИШЕНЕЙ
И вольфрам, и рений в водных растворах устойчивы в анионной форме в высших степенях окисления (+6 и +7 соответственно), поэтому для их разделения чаще всего используют методы анионообменной хроматографии. Разделение этой пары элементов во многом основывается на подходах, разработанных для технеция и молибдена.
Как правило, сначала элементы переводят в высшие степени окисления, растворяя облученные мишени из WO3 в 1–2 M NaOH при нагревании. Металлический вольфрам и WS2 растворяют в перекиси водорода, затем добавлением щелочи переводят вольфрам и рений в анионную форму.
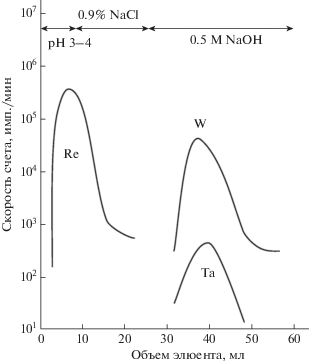
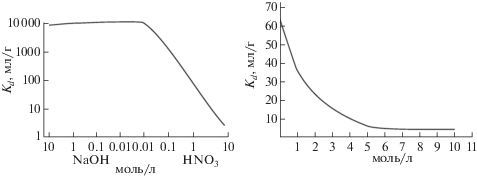
Большинство схем разделения основано на том, что рений прочно удерживается на сильноосновных анионообменных смолах (Dowex 1 или аналогах), в то время как вольфрам и примесный тантал-183 (183Ta), образующийся по реакции 186W(p,α)183Ta, легко смываются с колонки разбавленной щелочью или кислотой [24, 33, 31] (рис. 2). Смыть рений с колонки можно крепкой азотной кислотой (4–7 M). Метод позволяет достичь коэффициентов разделения до 108 [33]. Коэффициенты распределения вольфрама и рения между хроматографической сильноосновной анионообменной смолой (AG 1 × 8) и водными растворами NaOH и HNO3 были определены в [39] (рис. 3).
Рис. 2.
Кривые элюирования вольфрама, тантала и рения [22]. Сорбент – сильноосновной анионообменник.
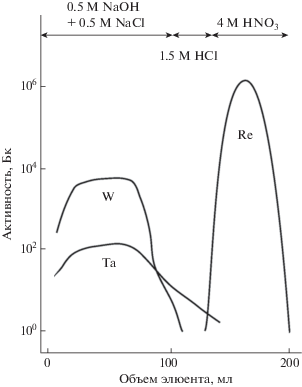
Рис. 3.
Коэффициенты распределения (Kd) рения (а) и вольфрама (б) при разных концентрациях щелочи и кислоты [39].
Вольфрам и рений также разделяют на сорбенте на основе оксида алюминия. Он применяется как в изотопных генераторах, так и при выделении рения из облученных вольфрамовых мишеней [13]. Разделение проводят в среде 0.9%-ного NaCl. При этом вольфрам и тантал сорбируются, а рений проходит сквозь колонку (рис. 4).
Подобно технецию рений может быть выделен в виде $\operatorname{Re} {\text{O}}_{4}^{{\text{--}}}$ кстракцией кислородсодержащими растворителями, например метилэтилкетоном. Экстракция количественно происходит из 2 M NaOH. Вольфрам, присутствующий в виде вольфрамата, при этом остается в водной фазе [32].
3. РАДИОФАРМПРЕПАРАТЫ НА ОСНОВЕ РАДИОИЗОТОПОВ РЕНИЯ
В водных растворах рений наиболее устойчив в виде перрената. Однозарядный анион $\operatorname{Re} {\text{O}}_{4}^{{\text{--}}}$ по свойствам несколько напоминает йодид и способен накапливаться в щитовидной железе. Для получения РФП рений используют в низших степенях окисления, чаще всего (I) и (V). Восстановление рения происходит существенно сложнее, чем технеция, поэтому методы синтеза РФП, подходящие для технеция, не всегда могут быть использованы для рения.
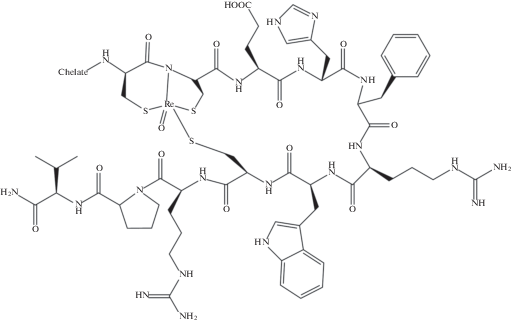
Как правило, рений вводят в комплекс в пятивалентном состоянии, ядро комплекса чаще всего составляет оксокатион [Re=O]3+, и в координационную сферу входит лиганд, имеющий четыре донорных атома, часто N и S. Координационное число технеция в таких комплексах – 5, они имеют строение тетрагональной пирамиды. Также получили распространение комплексы с ядром [Re≡N]2+ (рис. 5).
Особенно интересны трикарбонильные комплексы рения (I), содержащие ядро [Re(CO)3]+, поскольку трикарбонильное ядро отличается стабильностью, в то же время за счет транс-эффекта лабилизирует остальные лиганды в октаэдрической координационной сфере. Остальные координационные места могут занимать, например, ароматические амины. Существенным достижением стала разработка [40, 41] нового реагента – боранокарбоната K2[H3BCO2], позволившего одновременно восстанавливать ${\text{ReO}}_{4}^{ - }$ (или ${\text{TcO}}_{4}^{ - }$) и служить источником монооксида углерода с образованием стабильного катиона [Re(H2O)3(CO)3]+. В результате появилась возможность реализовать синтез подобных РФП в виде коммерчески доступных наборов.
Обзор координационной химии рения можно найти в [42, 43].
Для паллиативного лечения костных метастазов разработан остеотропный препарат 188Re-HEDP (гидроксиэтилиден дифосфонат рения-188) [44]. Два препарата на основе дифосфонатов 188Re – фосфорен и золерен – разработаны и успешно применяются в России. Изотопы рения также предлагается использовать для радиоиммунотерапии [45] и таргетной пептидной терапии [46]. Сообщалось о синтезе комплексов рения, содержащих один или два фрагмента, связывающихся с простат-специфическим мембранным антигеном [47, 48]. Сами по себе комплексы рения могут проявлять противораковые свойства. В частности, ряд трикарбонильных комплексов рения(I) способен к интеркаляции (обратимое включение в структуру) с ДНК [49].
Необычные пептидные комплексы с рением были получены путем циклизации аминокислотных фрагментов вокруг ядра [Re=O]3+ (рис. 6). Так, был получен синтетический циклический ренийсодержащий аналог α-меланоцитстимулирующего гормона (α-MSH). Показано, что вещество способно накапливаться в опухоли и имеет потенциал для визуализации и терапии меланомы [50]. Впоследствии этот комплекс, но уже со стабильным рением, был функционализирован с помощью хелаторов, и получен целый ряд ренийсодержащих пептидов для визуализации меланомы, меченных различными радионуклидами, в том числе 62Cu- NOTA-GGG-Re(Arg11)CCMSH [51], 64Cu- и 86Y-DOTA-ReCCMSH(Arg11) [52]. В экспериментах на животных показана эффективность аналогичного препарата на основе α-излучателя 212Pb против меланомы [53].
Радиофармпрепаратам на основе 188Re для лечения рака посвящен обзор [35].
4. НАПРАВЛЕННАЯ ДОСТАВКА С ПОМОЩЬЮ НАНОСТРУКТУР
Радиоколлоиды давно применяются в ядерной медицине, в частности частицы микронного размера, содержащие радиоактивный рений, исследовали в качестве средства для терапии хронических заболеваний суставов методом радиосиновэктомии [54, 55]. Микросферы на основе человеческого сывороточного альбумина размером 20–35 мкм были загружены 188Re в виде трикарбонильного комплекса [56]. Их предлагается использовать при радиоэмболизации при раке печени.
РФП, меченные 188Re, предлагается использовать в терапии карциномы печени [57]. В качестве транспортирующего агента применяется липиодол (йодированный и этерифицированный липид масла мака), используемый для эмболизации сосудов, питающих опухоль. Рассматривается ряд бифункциональных хелатирующих агентов (N2S2), которые могут связываться с липиодолом и удерживать рений.
К радиоколлоидам близки по размерам нанообъекты, чьи размеры лежат в диапазоне 1–100 нм по одному из измерений. Они могут быть различными по своей природе: липосомы, дендримеры, оксидные, полупроводниковые наночастицы, углеродные нанотрубки и пр.
Еще в 1986 г. было установлено, что кровеносные сосуды опухоли более проницаемы для больших молекул по сравнению со здоровыми [58]. Кроме того, большие молекулы накапливаются в опухоли из-за замедленного клиренса [59]. Этот эффект получил название эффекта повышенной проницаемости и удержания (Enhanced Permeability and Retention (EPR) effect).
Эффект EPR стал обоснованием большинства работ в области наномедицины рака, но в то же время его значимость остается предметом дискуссий [60]. По мнению некоторых авторов, эффект выражен на моделях лабораторных животных, но у людей по причине высокой гетерогенности рака заметен значительно меньше [61]. По-видимому, его не следует считать общим правилом, эффект может быть значительным в некоторых опухолях, но незначительным в других.
Первое поколение наночастиц в основном накапливалось в опухоли именно вследствие эффекта EPR. Однако они обладали рядом недостатков, в частности значительным накоплением в печени и селезенке. Отчасти этот недостаток удалось преодолеть за счет модификации поверхности частиц полиэтиленгликолем, который, будучи инертным и гидрофильным, понижает иммуногенность наночастиц, препятствует их фагоцитозу, продлевая циркуляцию в кровотоке [62]. Следующее поколение наноносителей имеет функционализированную поверхность в результате биоконъюгации со специфическими антителами или пептидами, имеющими сродство к специфическим опухолям или тканям (активный таргетинг) [63].
Одним из наиболее часто применяемых наноразмерных средств доставки лекарств являются липосомы. Лекарственные средства и радионуклиды, инкапсулированные в липосоме, могут находиться в одном из трех отсеков: водорастворимые вещества – в центральном водном ядре липосомы; жирорастворимые агенты переносятся в мембране; пептиды и мелкие белки имеют тенденцию концентрироваться на границе раздела липидного бислоя и водной фазы [63].
В [64] обсуждается возможность внутриопухолевого введения препаратов 186Re, инкапсулированных в липосомы размером 100 нм, для нано-брахитерапии глиобластомы. В качестве лиганда используется BMEDA (N,N-бис(2-меркаптоэтил)-N',N'-диэтилэтилендиамин) (рис. 7). В контрольной группе животных медианная выживаемость составила 49 дней, в группе, получавшей препарат, – 126, причем большая часть животных в итоге была умерщвлена в связи с завершением эксперимента. Также в экспериментах на животных была показана эффективность липосом с комплексом 188Re-SSS (рис. 7) против глиомы. Было установлено, что рений, введенный в мозг в виде перрената, выводится из организма значительно быстрее, чем инкапсулированный в липосомы [65].
Внутриопухолевое введение липосом, загруженных 186Re-BMEDA, применялось в экспериментах на животных, которым были привиты в область головы и шеи раковые клетки линии SCC, выделенные из рака языка человека [66]. Трем контрольным группам были внутривенно введены немеченные липосомы, неинкапсулированный 186Re-перренат или неинкапсулированное промежуточное соединение 186Re-BMEDA. Средний объем опухоли в группе животных, получивших 186Re-липосомы на 14-й день после лечения, снизился до 87.7 ± 20.1%, тогда как в трех контрольных группах увеличился в среднем до 395.0–514.4%. 186Re-липосомы обеспечивали более длительное удержание 186Re в опухоли, что приводило к средней поглощенной дозе облучения опухоли 526.3 ± 93.3 Гр, в то время как в группах, получивших 186Re-перренат и 186Re-BMEDA, доза в опухоли составила 3.3 ± 1.2 и 13.4 ± 9.2 Гр соответственно.
В [67] использовали липосомы средним размером ~75 нм, загруженные комплексом (S3CPh)2(S2CPh)188Re. На поверхности липосом находились антитела 12g5, направленные на хемокиновые рецепторы CXCR4. На каждую частицу приходилось 13 ± 3 молекул антител. Проведенный эксперимент на мышах с имплантированными клетками злокачественной глиобластомы человека клеточной линии U87MG продемонстрировал, в том числе, замедление роста опухоли и увеличение клинической медианной выживаемости.
В [68] обсуждаются доклинические испытания препарата от рака печени на основе рения. В качестве носителя используют поли-L-лизин дендример (Colcom, Франция), смешанный с нитроимидазол-метил-1,2,3-триазол-метил-ди-(2-пиролил)-амином. Рений связывался в виде трикарбонильного комплекса. В экспериментах на животных показано, что меченный 186Re дендример обладает противоопухолевой активностью, причем рост опухоли замедляется с увеличением дозы. В то же время ни сам дендример, ни рений в виде перрената такой активности не показали. В этом случае речь также идет о радиоэмболизации.
Наночастицы позволяют создавать комбинированные препараты для химиотерапии и радиотерапии. Так, в [69] на крысах проводили испытания комплексного препарата для лечения плоскоклеточного рака головы и шеи на основе липосом, меченных 186Re, в которые был загружен препарат для химиотерапии доксорубицин.
В [70] были получены наночастицы на основе функционализированного оксида железа Fe3O4. К поверхности был присоединен рений в виде трикарбонильного комплекса с фенантролином или бипиридином. Средний размер частиц составил около 10 нм. Частицы создавались как мультимодальный агент для МРТ (за счет магнитных свойств оксида железа) и оптической визуализации люминесценции рениевого комплекса. Эксперимент проводили со стабильным рением, однако авторы отмечают, что замена на радиоактивный изотоп позволит использовать препарат для ОФЭКТ и радиотерапии.
Наночастицы магнетита, покрытые диоксидом кремния, были функционализированы N-[3-(триметоксисилил)пропил]-этилендиамином, и на их поверхности был ковалентно связан гистидин. Далее гистидин выступал в роли лиганда, связывающего 188Re в виде трикарбонила рения(I). Наночастицы показали хорошую устойчивость in vitro по отношению к плазме крови [71].
Частицы магнетита Fe3O4 бактериального происхождения (магнитосомы) также представляют интерес в качестве нанотранспортеров [72]. Магнитосомы снаружи покрыты липидами и белками, что делает возможной их функционализацию. В [73] сообщалось о синтезе магнитосом, меченных 188Re для целей таргетной терапии рака.
ЗАКЛЮЧЕНИЕ
Радиоизотопы рения имеют значительный потенциал для их применения в терапии рака. Во многом их использование на сегодня ограничивается малой доступностью. Сырье для генераторов 188Re может быть произведено лишь на нескольких реакторах в мире, что лимитирует внедрение этого радионуклида в повсеместную клиническую практику. Проблемы, связанные с масштабированием циклотронного производства 186Re, в целом решены. Развитие координационной химии рения и близкое сходство Re и Tc открывают широкие возможности для синтеза кинетически устойчивых комплексов, представляющих интерес для ядерной медицины. В частности, синтезированы комплексы рения направленные на связывание с рецепторами соматостатина, α-MSH, PSMA, CXCR4. В настоящее время несколько таргетных препаратов с радиоизотопами рения проходят клинические испытания. В частности, препарат Nimotuzumab (моноклональные антитела, направленные против рецепторов эпидермального фактора роста, меченные 188Re) был испытан на пациентах с анапластической астроцитомой и мультиформной глиобластомой в рамках первой фазы клинических испытаний [74]. Авторы определили побочные эффекты и безопасную для использования дозу, подчеркнув перспективность данного подхода для лечения злокачественных глиом. Обнадеживающие результаты получены в клинических испытаниях препаратов на основе 188,186Re-HEDP против костных метастаз различной природы [75].
Особый интерес представляет применение изотопов рения, связанных с наноносителями. На сегодня чаще всего используются липосомы с инкапсулированными комплексами рения. Как правило, их вводят непосредственно в опухоль, что позволяет увеличить время удерживания за счет эффекта EPR. Важным преимуществом наноносителей является мультимодальность – сочетание на одной платформе компонентов, позволяющих совмещать различные типы молекулярной визуализации и терапии. В частности, присутствие контрастных агентов позволяет сочетать МРТ с бета-радиотерапией, а введение позитронных эмиттеров – сочетать терапию и позитронно-эмиссионную томографию. Перспективной также представляется одновременная загрузка наночастиц химиотерапевтическими препаратами и бета-излучателями.
Список литературы
Hoedl S.A., Updegraff W.D. // Sci. Global Security. 2015. V. 23. P. 121.
Qaim S.M. // Radiochim. Acta. 2012. V. 100. P. 635. https://doi.org/10.1524/ract.2012.1966
Ehrhardt G.J., Blumer M.E., Su F.M. et al. // Appl. Radiat. Isot. 1997. V. 48. № 1. P. 1. https://doi.org/10.1016/S0969-8043(96)00124-8
Mastren T., Radchenko V., Bach H.T. et al. // Nucl. Med. Biol. 2017. V. 49. P. 24. https://doi.org/10.1016/j.nucmedbio.2017.02.006
Balkin E.R., Gagnon K., Dorman E. et al. // Radiochim. Acta. 2017. V. 105. № 12. P. 1071. https://doi.org/10.1515/ract-2017-2780
Nuclear Data for the Production of Therapeutic Radionuclides / Eds. Qaim S.M. et al. Technical Reports Series. V. 473. Vienna: IAEA, 2011. 395 p.
Ali S.K.I., Khandaker M.U., Kassim H.A. // Appl. Radiat. Isot. 2018. V. 135. P. 239. https://doi.org/10.1016/j.apradiso.2018.01.035
Szelecsényi F., Steyn G.F., Kovács Z. et al. // J. Radioanal. Nucl. Chem. 2009. V. 282. № 1. P. 261. https://doi.org/10.1007/s10967-009-0147-y
Titarenko Y.E., Batyaev V.F., Titarenko A.Y. et al. // Physics of Atomic Nuclei. 2011. V. 74. № 4. P. 551. https://doi.org/10.1134/s1063778811040181
Khandaker M.U., Uddin M.S., Kim K.L. et al. // Nucl. Instrum. Methods Phys. Res. B. 2008. V. 266. № 7. P. 1021. https://doi.org/10.1016/j.nimb.2008.02.037
Tárkányi F., Takács S., Szelecsényi F. et al. // Nucl. Instrum. Methods Phys. Res. B. 2006. V. 252. № 2. P. 160. https://doi.org/10.1016/j.nimb.2006.09.010
Tárkányi F., Ditrói F., Takács S., Hermanne A. // Nucl. Instrum. Methods Phys. Res. B. 2017. V. 391. P. 27. https://doi.org/10.1016/j.nimb.2016.11.027
Zhang X., Li W., Fang K. et al. // Radiochim. Acta. 1999. V. 86. № 1–2. P. 11. https://doi.org/10.1524/ract.1999.86.12.11
Tárkányi F., Hermanne A., Takács S. et al. // Nucl. Instrum. Methods Phys. Res. B. 2007. V. 264. № 2. P. 389. https://doi.org/10.1016/j.nimb.2007.09.026
Bonardi M., Groppi F., Persico E. et al. // Radiochim. Acta. 2011. V. 99. № 1. P. 1. https://doi.org/10.1524/ract.2011.1789
Miah M.H., Kuhnhenn J., Herpers U. et al. // J. Nucl. Sci. Technol. 2002. V. 39 sup 2. P. 369. https://doi.org/10.1080/00223131.2002.10875117
Tárkányi F., Takács S., Szelecsényi F. et al. // Nucl. Instrum. Methods Phys. Res. B. 2003. V. 211. № 3. P. 319. https://doi.org/10.1016/S0168-583X(03)01389-2
Ochiai K., Nakao M., Kubota N. et al. // International Conference on Nuclear Data for Science and Technology. 2007. P. 3. https://doi.org/10.1051/ndata:07663
Khandaker M.U., Nagatsu K., Minegishi K. et al. // Nucl. Instrum. Methods Phys. Res. B. 2017. V. 403. P. 51. https://doi.org/10.1016/j.nimb.2017.04.087
Manenti S., Persico E., Abbas K. et al. // Radiochim. Acta. 2014. V. 102. № 8. P. 669. https://doi.org/10.1515/ract-2013-2194
Ishioka N.S., Watanabe S., Osa A. et al. // J. Nucl. Sci. Technol. 2002. V. 39. № October 2014. P. 1334. https://doi.org/10.1080/00223131.2002.10875351
Duchemin C., Guertin A., Haddad F. et al. // Appl. Radiat. Isot. 2015. V. 97. P. 52. https://doi.org/10.1016/j.apradiso.2014.12.011
Lapi S., Mills W.J., Wilson J. et al. // Appl. Radiat. Isot. 2007. V. 65. № 3. P. 345. https://doi.org/10.1016/j.apradiso.2006.08.015
Shigeta N., Matsuoka H., Osa A. et al. // J. Radioanal. Nucl. Chem. 1996. V. 205. № 1. P. 85. https://doi.org/10.1007/BF02040553
Scott N.E., Cobble J.W., Daly P.J. // Nucl. Phys. A. 1968. V. 119. P. 131.
Ismail M. // Pramana. 1993. V. 40. № 3. P. 227. https://doi.org/10.1007/BF02900190
Issa S.A.M., Uosif M.A. M., Michel R. et al. // Nucl. Instrum. Methods Phys. Res. B. 2013. V. 298. P. 19. https://doi.org/10.1016/j.nimb.2013.01.001
Ditrói F., Tárkányi F., Takács S. et al. // Nucl. Instrum. Methods Phys. Res. B. 2013. V. 296. P. 92. https://doi.org/10.1016/j.nimb.2012.11.020
Ditrói F., Tárkányi F., Takács S. et al. // Appl. Radiat. Isot. 2013. V. 77. P. 103. https://doi.org/10.1016/j.apradiso.2013.02.024
Zhang X., Li Q., Li W. et al. // Appl. Radiat. Isot. 2001. V. 54. № 1. P. 89. https://doi.org/10.1016/S0969-8043(00)00268-2
Gott M.D., Hayes C.R., Wycoff D.E. et al. // Appl. Radiat. Isot. 2016. V. 114. P. 159. https://doi.org/10.1016/j.apradiso.2016.05.024
Moustapha M.E., Ehrhardt G.J., Smith C.J. et al. // Nucl. Med. Biol. 2006. V. 33. № 1. P. 81. https://doi.org/10.1016/j.nucmedbio.2005.09.006
Fassbender M.E., Ballard B., Birnbaum E.R. et al. // Radiochim. Acta. 2013. V. 101. № 5. P. 339. https://doi.org/10.1524/ract.2013.2031
Knapp F.F. (Russ), Mirzadeh S., Beets A.L., Du M. // J. Radioanal. Nucl. Chem. 2005. V. 263. № 2. P. 503. https://doi.org/10.1007/s10967-005-0083-4
Lepareur N., Lacœuille F., Bouvry C. et al. // Frontiers in Medicine. 2019. V. 6. P. 132. https://doi.org/10.3389/fmed.2019.00132
Boschi A., Uccelli L., Pasquali M. et al. // J. Chem. 2014. V. 2014. P. 529406. https://doi.org/10.1155/2014/529406
Dadachov M., Van So L., Lambrecht R., Dadachova E. // Appl. Radiat. Isot. 2002. V. 57. № 5. P. 641. https://doi.org/10.1016/S0969-8043(02)00178-1
Chakravarty R., Shukla R., Tyagi A.K. et al. // Appl. Radiat. Isot. 2010. V. 68. № 2. P. 229. https://doi.org/10.1016/j.apradiso.2009.10.031
Gott M.D., Ballard B.D., Redman L.N. et al. // Radiochim. Acta. 2014. V. 102. № 4. P. 325. https://doi.org/10.1515/ract-2013-2144
Alberto R., Ortner K., Wheatley N. et al. // J. Am. Chem. Soc. 2001. V. 123. № 13. P. 3135. https://doi.org/10.1021/ja003932b
Alberto R. // Eur. J. Nucl. Med. Mol. Imaging. 2003. V. 30. № 9. P. 1299. https://doi.org/10.1007/s00259-003-1292-0
Donnelly P.S. // Dalton Trans. 2011. V. 40. № 5. P. 999. https://doi.org/10.1039/c0dt01075h
Abram U., Alberto R. // J. Brazilian Chem. Soc. 2006. V. 17. № 8. P. 1486. https://doi.org/10.1590/S0103-50532006000800004
Liepe K. // World J. Nucl. Med. 2018. V. 17. № 3. P. 133. https://doi.org/10.4103/wjnm.WJNM_85_17
Kinuya S., Yokoyama K., Izumo M. et al. // Cancer Lett. 2005. V. 219. № 1. P. 41. https://doi.org/10.1016/j.canlet.2004.08.033
Makris G., Kuchuk M., Gallazzi F. et al. // Nucl. Med. Biol. 2019. V. 71. P. 39. https://doi.org/10.1016/j.nucmedbio.2019.04.004
Banerjee S.R., Foss C.A., Castanares M. et al. // J. Med. Chem. 2008. V. 51. № 15. P. 4504. https://doi.org/10.1021/jm800111u
Frei A., Fischer E., Childs B.C. et al. // Dalton Trans. 2019. V. 48. № 39. P. 14600–14605. https://doi.org/10.1039/C9DT02506E
Konkankit C.C., Marker S.C., Knopf K.M., Wilson J.J. // Dalton Trans. 2018. V. 47. № 30. P. 9934. https://doi.org/10.1039/C8DT01858H
Giblin M.F., Wang N., Hoffman T.J. et al. // Proc. Nat. Acad. Sci. 1998. V. 95. № 22. P. 12814. https://doi.org/10.1073/pnas.95.22.12814
Zhang X., Yue Z., Lu B.-Y. et al. // Curr. Radiopharm. 2012. V. 5. № 4. P. 329. https://doi.org/10.2174/1874471011205040329
McQuade P., Miao Y., Yoo J. et al. // J. Med. Chem. 2005. V. 48. № 8. P. 2985. https://doi.org/10.1021/jm0490282
Miao Y. // Clinical Cancer Research. 2005. V. 11. № 15. P. 5616. https://doi.org/10.1158/1078-0432.CCR-05-0619
Ures M.C., Savio E., Malanga A. et al. // BMC Nucl. Med. 2002. V. 2. № 1. P. 1. https://doi.org/10.1186/1471-2385-2-1
Liepe K. // World J. Nucl. Med. 2015. V. 14. № 1. P. 10. https://doi.org/10.4103/1450-1147.150509
Ni H.-C., Yu C.-Y., Chen S.-J. et al. // Appl. Radiat. Isot. 2015. V. 99. P. 117. https://doi.org/10.1016/j.apradiso.2015.02.020
Banka V.K., Moon S.-H., Jeong J.M. et al. // Nucl. Med. Biol. 2015. V. 42. № 3. P. 317. https://doi.org/10.1016/j.nucmedbio.2014.11.013
Gerlowski L.E., Jain R.K. // Microvascular Res. 1986. V. 31. № 3. P. 288. https://doi.org/10.1016/0026-2862(86)90018-X
Matsumura Y., Maeda H. // Cancer Res. 1986. V. 46. № 12. Pt 1. P. 6387.
Nichols J.W., Bae Y.H. // J. Control. Release. 2014. V. 190. P. 451. https://doi.org/10.1016/j.jconrel.2014.03.057
Danhier F. // J. Control. Release. 2016. V. 244. P. 108. https://doi.org/10.1016/j.jconrel.2016.11.015
Li S.-D., Huang L. // Mol. Pharm. 2017. V. 5. № 4. P. 496. https://doi.org/10.1016/B978-0-08-100557-6.00009-2
Ting G., Chang C.-H., Wang H.-E., Lee T.-W. // J. Biomed. Biotechnol. 2010. V. 2010. P. 1. https://doi.org/10.1155/2010/953537
Phillips W.T., Goins B., Bao A. et al. // Neuro-Oncology. 2012. V. 14. № 4. P. 416. https://doi.org/10.1093/neuonc/nos060
Allard E., Hindre F., Passirani C.L. et al. // Eur. J. Nucl. Med. Mol. Imaging. 2008. V. 35. № 10. P. 1838. https://doi.org/10.1007/s00259-008-0735-z
French J.T., Goins B., Saenz M. et al. // J. Vasc. Interv. Radiol. 2010. V. 21. № 8. P. 1271. https://doi.org/10.1016/j.jvir.2010.02.027
Séhédic D., Chourpa I., Tétaud C. et al. // Theranostics. 2017. V. 7. № 18. P. 4517. https://doi.org/10.7150/thno.19403
Yang G., Sadeg N., Tahar H.B. // Drug Designing: Open Access. 2017. V. 06. № 01. P. 1. https://doi.org/10.4172/2169-0138.1000144
Soundararajan A., Bao A., Phillips W.T. et al. // Cancer Biotherapy and Radiopharmaceuticals. 2011. V. 26. № 5. P. 603. https://doi.org/10.1089/cbr.2010.0948
Carron S., Bloemen M., Vander Elst L. et al. // J. Mater. Chem. B. 2015. V. 3. № 21. P. 4370. https://doi.org/10.1039/C5TB00460H
Cao J., Wang Y., Yu J. et al. // J. Magn. Magn. Mater. 2004. V. 277. № 1–2. P. 165. https://doi.org/10.1016/j.jmmm.2003.10.022
Alphandéry E. // Frontiers in Bioengineering and Biotechnology. 2014. V. 2. https://doi.org/10.3389/fbioe.2014.00005
Akbari-Karadeh S., Aghamiri S.M.R., Tajer-Mohammad-Ghazvini P., Ghorbanzadeh-Mashkani S. // Appl. Biochem. Biotechnol. 2020. V. 190. № 2. P. 540. https://doi.org/10.1007/s12010-019-03079-x
Casaco A., López G., García I. et al. // Cancer Biology Therapy. 2008. V. 7. № 3. P. 333. https://doi.org/10.4161/cbt.7.3.5414
Finlay I. G., Mason M. D., Shelley M. // Lancet Oncology. 2005. V. 6. № 6. P. 392. https://doi.org/10.1016/S1470-2045(05)70206-0
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии