Российские нанотехнологии, 2020, T. 15, № 4, стр. 470-476
ДЕСОРБЦИОННЫЕ СВОЙСТВА, БАКТЕРИЦИДНАЯ И ФУНГИЦИДНАЯ АКТИВНОСТЬ НАНОСТРУКТУРИРОВАННЫХ ПОКРЫТИЙ НА ОСНОВЕ ГЕКСАГОНАЛЬНОГО НИТРИДА БОРА, НАСЫЩЕННЫХ ТЕРАПЕВТИЧЕСКИМИ ПРЕПАРАТАМИ
К. Ю. Гудзь 1, *, Е. С. Пермякова 1, А. Т. Матвеев 1, А. М. Ковальский 1, С. Ю. Филиппович 2, П. В. Слукин 3, С. Г. Игнатов 3, Д. В. Штанский 1
1 Национальный исследовательский технологический университет “МИСиС”
Москва, Россия
2 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” РАН
Москва, Россия
3 Государственный научно-исследовательский центр прикладной микробиологии и биотехнологии
Оболенск, Россия
* E-mail: kristinkagudz@mail.ru
Поступила в редакцию 29.06.2020
После доработки 17.09.2020
Принята к публикации 20.09.2020
Аннотация
Исследование направлено на создание наноструктурированных покрытий на основе гексагонального нитрида бора с высокой сорбционной способностью в отношении различных терапевтических препаратов и пролонгированным антибактериальным действием за счет их постепенного высвобождения в физиологической среде. Покрытия получены путем взаимодействия газообразного аммиака с прекурсором из наночастиц аморфного бора. В качестве бактерицидных агентов использовали антибиотики гентамицина сульфат, ципрофлоксацин и противогрибковый препарат амфотерицин В. Кинетику высвобождения антибиотиков исследовали при различном значении рН. Антибактериальные исследования показали, что все типы покрытий оказывают бактерицидное действие против антибиотико-резистентного штамма Escherichia coli K-261. Покрытия, насыщенные амфотерицином В, оказали противогрибковое действие против различных штаммов аскомицета Neurospora crassa – дикого типа wt-987 и мутантов по азотному метаболизму – nit-2 и nit-6.
ВВЕДЕНИЕ
Разработка антибактериальных покрытий всегда являлась важной задачей в области биомедицинской инженерии, так как патогенные бактерии и вызываемые ими инфекции являются одной из основных причин отторжения имплантатов. Одной из перспективных стратегий подавления бактериальных инфекций является введение антибактериальных агентов в состав имплантата. Материалы, насыщенные терапевтическими препаратами, проявляют свою бактерицидную активность за счет постепенного их выхода в биологическую среду. Преимущество данного подхода состоит в локальности терапевтического воздействия и низкой дозе бактерицидного агента по сравнению с традиционными методами лекарственной терапии. Важно обеспечить интенсивный выход достаточного количества бактерицида в первые часы после хирургического вмешательства для подавления острой воспалительной реакции и последующее, более медленное высвобождение, для антибактериальной защиты ослабевшего организма.
К настоящему времени были разработаны различные покрытия, содержащие бактерицидный агент. Например, покрытие на основе хитозана, насыщенное гентамицином, показало способность высвобождать антибиотик в нейтральной среде (рН = 7.4) в течение 168 ч [1]. Покрытие на основе магния, пропитанное ципрофлоксацином, продемонстрировало медленное высвобождение антибиотика в нейтральной среде в течение 192 ч [2]. Выход антибиотика из многослойных покрытий Ti/Van-гидроксиапатит, Ti/Van-гидро-ксиапатит–коллаген и Ti/Van/TiO2, насыщенных ванкомицином, наблюдался в нейтральной среде в течение 30 ч [3]. Выход гепарина из многослойного покрытия Ti/полидопамин/(хитозан-гепарин) в кислой среде (рН = 4.3) происходил в течение 320 ч [4]. Эти работы показали возможность относительно длительного (от десятков часов до нескольких дней) высвобождения терапевтического препарата. В то же время низкая сорбционная способность покрытий и повышенная токсичность, особенно в случае поверхностной иммобилизации антибиотика, сдерживают дальнейшее развитие этого подхода [5–8].
В последние годы большое внимание уделяется изучению различных наноструктур на основе гексагонального нитрида бора (h-BN), которые находят применение в качестве носителей каталитически активных частиц [9], наноконтейнеров для адресной доставки лекарств [10], упрочняющей фазы в легких композиционных материалах [11–13], функциональных и супергидрофобных покрытий [14]. Такой широкий спектр применения связан с уникальным сочетанием физических и химических свойств этого материала, таких как низкая удельная плотность, высокая термическая стабильность, стойкость к окислению и высокая сорбционная способность. Недавние исследования показали, что наноструктуры BN имеют более низкую цитотоксичность и лучшую биосовместимость по сравнению с их аналогами на основе углеродных наноструктур [15–18]. В частности, наночастицы BN при концентрации <100 мг/л не оказывали негативного воздействия на клетки HPAEpiC [19]. Наночастицы BN при концентрации 40 мкг/мл не оказывали токсического воздействия на клетки IAR-6-1 [10]. При концентрации <10 мкг/мл наночастицы BN являются потенциально биосовместимым материалом [20]. Было показано, что покрытие, содержащее h-BN, ускоряет вживление имплантата, предотвращает появление инфекции и может быть использовано, в том числе, для пациентов с риском развития остеомиелита [21]. Нанотрубки BN не цитотоксичны для остеобластов ATCC CRL-11372 и макрофагов и безопасны для применения в материалах ортопедических каркасов [22]. Также было показано, что нанотрубки BN не цитотоксичны для клеток эмбриональных почек человека (HEK-293) [23]. В настоящее время наномодифицированные поверхности все более активно используются как бактерицидные инструменты при переходе к персонализированной медицине и технологиям для продолжительности и качества жизни. Наночастицы BN интенсивно исследуются благодаря их низкой токсичности, высокой химической стойкости и биосовместимости [24]. Однако помимо риска бактериальных инфекций существует риск возникновения грибковой инфекции [25], поэтому помимо бактерицидной активности следует изучать фунгицидную активность.
Целью настоящей работы были получение и изучение наноструктурированного покрытия на основе h-BN в качестве эффективной платформы для создания бактерицидных и фунгицидных поверхностей с высокой сорбционной и десорбционной способностью.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение покрытий. Покрытия на основе гексагонального нитрида бора были получены на кремневых подложках в результате взаимодействия газообразного аммиака (Horst, Москва, 99.98%) с прекурсором из наночастиц аморфного бора (99%, Авиабор, Россия) [26]. Синтез проводили в горизонтальном трубчатом реакторе (Термокерамика, Россия) при температуре 1300°С в течение 1 ч. Насыщение покрытий проводили путем нанесения растворов антибиотиков на поверхность образцов и последующей сушки в вакууме в течение 120 мин. Концентрация антибиотиков была выбрана на основе имеющихся данных для гентамицина (Белмедпрепараты, Республика Беларусь) [27] (BN/Gent = 300 мкг/см2) и амфотерицина В (Синтез, Россия) [28] (BN/Amp = = 20 мкг/см2). Концентрация ципрофлоксацина (Dr.Reddy’s, Индия) была такой же (BN/Cip), как и гентамицина, так как оба препарата относятся к общему классу антибиотиков.
Методы исследования поверхности. Морфология поверхности покрытий была изучена методом сканирующей электронной микроскопии (СЭМ) на сканирующем электронном микроскопе JSM-7600F (JEOL Ltd., Япония). Присоединение антибиотиков к поверхности нитрида бора изучали методом ИК-фурье-спектроскопии в режиме полного внутреннего отражения (ATR) с использованием вакуумного спектрометра Vertex 70v (Bruker, Германия) в диапазоне 400–4000 см–1 с разрешением 4 см–1. Краевой угол смачивания (КУС) измеряли методом лежащей капли (5 мкл) на установке CAM 101 (KSV), оборудованной видеокамерой. Для изучения кинетики выхода терапевтического препарата из покрытий BN образцы помещали в буферные растворы и отбирали пробы с регулярным интервалом 1, 3, 6, 12 ч и 1, 3, 5, 7, 9, 11 и 14 дней. Объем среды в течение всего эксперимента поддерживали постоянным путем доведения буферного раствора до исходного уровня. Кинетику высвобождения бактерицидного компонента изучали с помощью УФ-спектрофотометра Flame UV-VIS (Ocean Optics, США). Для построения калибровочной кривой предварительно измеряли поглощение растворов с концентрациями антибиотиков в диапазоне 0.005–4 мг/мл.
Антибактериальные и противогрибковые исследования. Для определения антибактериальной активности покрытий использовали госпитальный бактериальный штамм E. coli K-261, устойчивый к целому ряду антибиотиков, и штамм Bacillus F, выделенный из вечной мерзлоты [29]. В лунки с исследуемыми образцами сначала добавляли по 0.5 мл стерильного физиологического раствора (9 г/л), а потом 0.03 мл суспензии ночной культуры тест-штаммов с концентрацией клеток порядка 104–105 колониеобразующих единиц (КОЕ) на миллилитр. Определение концентрации КОЕ проводили методом 10-кратных разведений в 0.3 мл физраствора. Из каждого разведения высевали бактериальную суспензию по 0.01 мл на чашку Петри с питательной средой Mueller Hinton Agar (HiMedia, Индия) и культивировали при температуре 37°С в течение 24 ч.
Противогрибковую активность образцов изучали методом диффузии амфотерицина В с поверхности наноструктурированных покрытий на основе h-BN в агар в отношении штаммов N. crassa (Fungal Genetics Stock Center, США) дикого типа wt-987 и его мутантов nit-2 (без нитритредуктазы и нитратредуктазы) и nit-6 (без нитритредуктазы).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ, СТРУКТУРНЫЕ ИССЛЕДОВАНИЯ
СЭМ-исследование показало, что покрытие BN состоит из округлых наночастиц со средним диаметром 150–200 нм (рис. 1а). Поверхность наночастиц образована многочисленными нанолистами и наноиглами BN. Методом энергодисперсионной рентгеновской спектроскопии показано, что наночастицы состоят из бора и азота с небольшим количеством примесей кислорода. ИК-спектр покрытий (рис. 1б) состоит из пиков, соответствующих плоскостным валентным колебаниям B–N (1370 см–1), внеплоскостным деформационным колебаниям B–N–B (780 см–1) и связи О–В–О (690 см–1).
Результаты ИК-спектроскопии после иммобилизации антибиотиков представлены на рис. 2а. Гентамицин имеет в составе аминосодержащие молекулы, поэтому его наличие в образце проявляется в виде пика 1550 см–1, соответствующего деформационным колебаниям ${\text{NH}}_{3}^{ + }$. Отличительной чертой ципрофлоксацина является наличие карбоксильных групп, которые наблюдаются на ИК-спектре BN/Cip при 2900 см–1 (О–H), 1710 см–1 (C=O) и 1430 см–1 (С–О). Амфотерицин В также имеет аминосодержащие молекулы. Пик 1600 см–1 в образце BN/Amp соответствует деформационным колебаниям ${\text{NH}}_{3}^{ + }$.
Рис. 2.
ИК-спектры покрытий, загруженных антибиотиками (а). Изображение капли на поверхности покрытия BN (б) и BN/Gent (в) и соответствующие величины краевого угла смачивания.
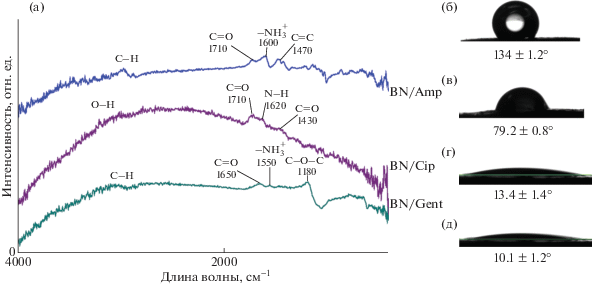
Известно, что иммобилизация антибиотиков приводит к изменению смачиваемости поверхности. Измерения КУС показали, что пропитка поверхности покрытия BN антибиотиками способствует улучшению смачиваемости поверхности, а степень смачиваемости зависит от типа антибиотика (рис. 2б–2д): значения КУС уменьшаются с 133.4° (BN) до 79.2° (BN/Gent), 13.4° (BN/Cip) и 10.1° (BN/Amp). Эти результаты подтверждают, что антибиотики были успешно привиты к поверхности BN.
КИНЕТИКА ВЫХОДА АНТИБИОТИКОВ ИЗ ПОКРЫТИЙ
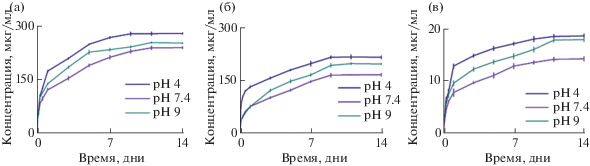
Результаты исследования кинетики выхода антибиотиков при различном рН из покрытий BN представлены на рис. 3. Кинетика высвобождения антибиотиков была изучена в нейтральной, кислой и щелочной средах, чтобы выявить чувствительность покрытия BN к изменению pH. Согласно полученным данным все образцы показали максимальный выход бактерицидного компонента в течение первых 24 ч и дальнейшее постепенное высвобождение антибиотиков в течение последующих 11 дней. Концентрация высвобожденного гентамицина в первые 24 ч составила 52.8 мкг/мл (рН = 4.0), 43.3 мкг/мл (рН = 7.4) и 49.2 мкг/мл (рН = 9.0), а максимальная концентрация была 279.3 мкг/мл (рН = 4.0), 240 мкг/мл (рН = 7.4) и 252.7 мкг/мл (рН = 9.0). При увеличении кислотности среды содержание ципрофлоксацина в растворе через 24 ч выдержки образцов уменьшалось с 69.1 мкг/мл (рН = 4.0) до 30.4 мкг/мл (рН = 7.4) и 27.3 мкг/мл (рН = 9.0). Максимальная концентрация высвобожденного ципрофлоксацина составила 217.9 мкг/мл (рН = 4.0), 168.4 мкг/мл (рН = 7.4) и 199.3 мкг/мл (рН = 9.0). Концентрация амфотерицина В в первые 24 ч составляла 2.9 мкг/мл (рН = 4.0), 1.5 мкг/мл (рН = 7.4) и 2.5 мкг/мл (рН = 9.0) и увеличивалась до 18.8 мкг/мл (рН = 4.0), 14.4 мкг/мл (рН = 7.4) и 18.1 мкг/мл (рН = 9.0) к концу испытаний. Как видно из полученных результатов, более высокая концентрация антибиотиков наблюдается в кислотной и щелочной средах. Это может быть связано с pH-зависимой структурой антибиотиков, так как гентамицин и амфотерицин В имеют в своем составе NH2-группы, а ципрофлоксацин – СООН-группы, которые в результате погружения в физиологический раствор протонируются группами ОН. Известно, что протонированная молекула теряет связь с подложкой и лучше десорбируется [30]. Также важно отметить, что полученные наноструктурированные покрытия h-BN демонстрируют высокую степень адсорбции терапевтического препарата. Это, в первую очередь, связано с развитой поверхностью покрытия h-BN, образованного многочисленными нанолистами, расстояние между которыми составляет несколько нанометров. Кроме того, наночастицы h-BN обладают отрицательным зарядом [31], что способствует электростатическому присоединению положительно-заряженного антибиотика. В пользу последнего утверждения свидетельствуют данные, представленные на рис. 3. Видно, что загрузка терапевтического агента снижается с 240–279 мкг/мл (положительно заряженный гентамицин) до 168–217 мкг/мл (ципрофлоксацин, имеющий почти нейтральный заряд) и 20 мкг/мл (отрицательно заряженный амфотерицин). Таким образом, полученные результаты свидетельствуют о том, что разработанные покрытия BN обладают высокой адсорбционной и десорбционной способностью.
АНТИБАКТЕРИАЛЬНАЯ И ПРОТИВОГРИБКОВАЯ АКТИВНОСТЬ
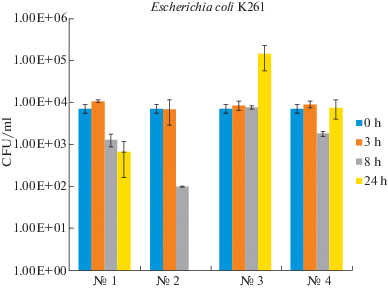
Антибактериальную активность образцов против штамма E. coli К-261 оценивали путем подсчета КОЕ (рис. 4). В качестве контролей использовали бактериальные культуры без образцов (№ 4) и с пластиной кремния (образец № 3). В обоих тестах снижения КОЕ не наблюдалось. При исследовании образцов, насыщенных гентамицином, наблюдалось снижение численности КОЕ на 2 порядка через 8 ч и до нуля через 24 ч. При использовании ципрофлоксацина антибактериальный эффект был менее выраженным, но также заметным и составлял 80% (8 ч) и 92% (24 ч).
Рис. 4.
Антибактериальная активность покрытий против штамма E. coli K-261: № 1 – BN/Cip, № 2 – BN/Gent, № 3 – Si, № 4 – контроль.
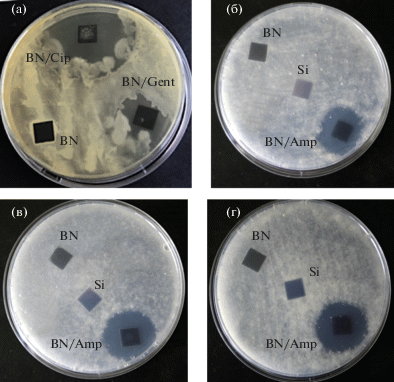
На рис. 5а показаны результаты исследований антибактериальной активности покрытий BN, BN/Gent и BN/Cip против Bacillus F, которая является бактерией, сохранившейся в толще вечной мерзлоты и обладающей высокой устойчивостью к неблагоприятным внешним факторам [32]. Полученные результаты свидетельствуют о том, что рост Bacillus F подавляется в присутствии покрытий нитрида бора, насыщенных ципрофлоксацином и гентамицином, причем зона лизиса для образца с гентамицином составляла 31 ± 3 мм, а для образца с ципрофлоксацином 9 ± 6 мм. Для оценки фунгицидной активности (рис. 5б–5г) образцы BN и BN/Amp были помещены в суспензии спор N. crassa дикого типа wt-987, мутанта, дефектного по основному азотрегулирующему гену nit-2, и мутанта по ассимилирующему структурному гену нитритредуктазы nit-6. Согласно полученным результатам образцы BN/Amp эффективно подавляют рост всех трех видов культур.
ЗАКЛЮЧЕНИЕ
Разработаны и получены наноструктурированные покрытия h-BN, обладающие высокой сорбционной способностью в отношении различных терапевтических препаратов. Методом ИК-спектроскопии и путем измерения краевого угла смачивания показано, что покрытия h-BN были успешно насыщены гентамицином, ципрофлоксацином и амфотерицином В. Показано, что высвобождение антибиотиков из покрытий в буферные растворы разной кислотности среды происходит в течение длительного промежутка времени (11 дней). Образцы, насыщенные гентамицином и ципрофлоксацином, эффективно подавляют рост устойчивого к антибиотикам штамма E. coli K-261 и штамма Bacillus F. Образец, насыщенный амфотерицином В, оказывает противогрибковое действие против штаммов wt-987 и мутантов nit-2 и nit-6 гриба N. crassa.
Работа выполнена при поддержке Российского научного фонда (договор 20-19-00120), а также Министерства образования и науки Российской Федерации (программа повышения конкурентоспособности НИТУ “МИСиС” № К2А-2018-038) в части исследований методом ИК-спектроскопии (К.Ю. Гудзь).
Список литературы
Liu Y., Ji P., Lv H. et al. // Int. J. Biol. Macromol. 2017. V. 98. P. 550. https://doi.org/10.1016/j.ijbiomac.2017.01.121
Bakhsheshi-Rad H.R., Hadisi Z., Hamzah E. et al. // Mater. Lett. 2017. V. 207. P. 179. https://doi.org/10.1016/j.matlet.2017.07.072
Ionita D., Bajenaru-Georgescu D., Totea G. et al. // Int. J. Pharm. 2017. V. 517. P. 296. https://doi.org/10.1016/j.ijpharm.2016.11.062
Zhou W., Jia Z., Xiong P. et al. // Mater. Sci. Eng. C. 2018. V. 90. P. 693. https://doi.org/10.1016/j.msec.2018.04.069
Glinel K., Thebault P., Humblot V. et al. // Acta Biomaterialia. 2012. V. 8. P. 1670. https://doi.org/10.1016/j.actbio.2012.01.011
Bhardwaj M., Singh B.R., Sinha D.K. et al. // Pharm. Anal. Acta. 2016. V. 7. P. 523. https://doi.org/10.4172/2153-2435.1000523
Giedraitiene A., Vitkauskiene A., Naginiene R. et al. // Medicina (Kaunas). 2011. V. 47. № 3. P. 137. https://doi.org/10.3390/medicina47030019
Woodford N., Johnson A.P., Morrison D. et al. // Clin. Microbiol. Rev. 1995. V. 8. P. 585.
Konopatsky A.S., Leybo D.V., Firestein K.L. et al. // J. Catal. 2018. V. 368. P. 217. https://doi.org/10.1016/j.jcat.2018.10.016
Sukhorukova I.V., Zhitnyak I.V., Kovalskii A.M. et al. // ACS Appl. Mater. Interfaces. 2015. V. 7. P. 17217. https://doi.org/10.1021/acsami.5b04101
Yamaguchi M., Tang D.M., Zhi C. et al. // Acta. Mater. 2012. V. 60. P. 6213. https://doi.org/10.1016/j.actamat.2012.07.066
Firestein K.L., Shteinman A.E., Golovin I.S. et al. // Mater. Sci. Eng. A. 2015. V. 642. P. 104. https://doi.org/10.1016/j.msea.2015.06.059
Yamaguchi M., Bernhardt J., Firestein K. et al. // Acta. Mater. 2013. V. 61. № 20. P. 7604. https://doi.org/10.1016/j.actamat.2013.08.062
Pakdel A., Bando Y., Shtansky D. et al. // Surf. Innov. 2013. V. 1. № 1. P. 32. https://doi.org/10.1680/si.12.00007
Chen X., Wu P., Rousseas M., Okawa D. et al. // J. Am. Chem. Soc. 2009. V. 131. P. 890. https://doi.org/10.1021/ja807334b
Li L., Li L.H., Ramakrishnan S. et al. // J. Phys. Chem. C. 2012. V. 116. P. 18224. https://doi.org/10.1021/jp306148e
Ciofani G., Danti S., Genchi G.G. et al. // Small. 2013. V. 9. P. 1672. https://doi.org/10.1002/smll.201201315
Emanet M., Sen O., Culha M. // Nanomedicine. 2017. V. 12. P. 797. https://doi.org/10.2217/nnm-2016-0322
Türkez H., Arslan M.E., Sönmez E. et al. // Cytotechnology. 2019. V. 71. P. 351. https://doi.org/10.1007/s10616-019-00292-8
Wang N., Wang H., Tang C. et al. // Int. J. Nanomedicine. 2017. V. 12. P. 5941. https://doi.org/10.2147 / ijn.s130960
Ferah I. The Effects of Boron Nitride and/or Hydroxyapatite Compounds on Experimentally Induced Osteomyelitis Following Open Femoral Fracture in Rats, Health Sciences Institute, Atatürk Üniversity, Erzurum, Turkey. 2015.
Lahiri D., Rouzaud F., Richard T. et al. // Acta Biomater. 2010. V. 6. P. 3524. https://doi.org/10.1016/j.actbio.2010.02.044
Chen X., Wu P., Rousseas M. et al. // J. Am. Chem. Soc. 2009. V. 131. P. 890. https://doi.org/10.1021/ja807334b
Ikram M., Jahan I., Haider A. et al. // Appl Nanosci. 2020. V. 10 P. 2339. https://doi.org/10.1007/s13204-020-01412-z
Sardi J.C.O., Scorzoni L., Bernardi T. et al. // J. Med. Microbiol. 2013. V. 62. P. 10. https://doi.org/10.1099/jmm.0.045054-0
Matveev A.T., Firestein K.L., Steinman A. E et al. // Nano Res. 2015. V. 8. № 6. P. 2063. https://doi.org/10.1007/s12274-015-0717-y
Tiana B., Tang Sh., Wang Ch.-D. et al. // Colloids Surfaces B. 2014. V. 123. P. 403. https://doi.org/10.1016/j.colsurfb.2014.09.050
Sukhorukova I.V., Sheveyko A.N., Manakhov A. et al. // Mater. Sci. Eng. C. 2018. V. 90. P. 289. https://doi.org/10.1016/j.msec.2018.04.068
Fursova O., Potapov V., Brouchkov A. et al. // Probiotics Antimicro. Prot. 2012. V. 4. P. 145. https://doi.org/10.1007/s12602-012-9105-z
Permyakova E.S., Antipina L.Y., Kovalskii A.M. et al. // J. Phys. Chem. C. 2018. V. 122. P. 26409. https://doi.org/10.1021/acs.jpcc.8b07531
Permyakova E.S., Antipina L.Yu., Kiryukhantsev-Korneev P.V. et al. // Nanomaterials. 2019. V. 9. P. 1658. https://doi.org/10.3390/nano9121658
Brouchkov A., Melnikov V., Kalenova L. et al. // Psychrophiles: From Biodiversity to Biotechnology. 2017. P. 541. https://doi.org/10.1007 / 978-3-319-57057-0_23
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии