Российские нанотехнологии, 2020, T. 15, № 4, стр. 550-556
НОВЫЕ ДАННЫЕ О ВЛИЯНИИ “РАННЕГО” БЕЛКА ВПЧ16 Е2, ПОЛУЧЕННОГО В РАСТИТЕЛЬНОЙ ЭКСПРЕССИОННОЙ НАНОСИСТЕМЕ, НА ОПУХОЛЕВЫЕ РАЗРАСТАНИЯ ТКАНЕЙ У САМОК МЫШЕЙ, ВЫЗВАННЫХ ИНЪЕКЦИЕЙ В БЕДРЕННУЮ МЫШЦУ РАКОВЫХ КЛЕТОК HeLa
Р. К. Саляев 1, *, Н. И. Рекославская 1, **, А. С. Столбиков 1
1 Сибирский институт физиологии и биохимии растений СО РАН
Иркутск, Россия
* E-mail: salyaev@sifibr.irk.ru
** E-mail: rekoslavskaya@sifibr.irk.ru
Поступила в редакцию 03.07.2020
После доработки 14.08.2020
Принята к публикации 14.08.2020
Аннотация
Исследована перспектива создания терапевтической противораковой вакцины путем использования регуляторного гена ВПЧ16 Е2. Для получения вакцинного материала синтезировали растительную экспрессионную наноструктурную систему на основе плодов томата, трансгенного по гену ВПЧ16 Е2. Для индукции опухолевой трансформации тканей самкам мышей в возрасте 6 мес вводили суспензию раковых клеток HeLa в бедренную мышцу. Через месяц у половины мышей брали кровь, выделяли спленоциты из селезенки, изучали также изменение внутренних органов, в том числе легких. Другую половину группы инъецированных HeLa мышей перорально вакцинировали вакцинным материалом плодов томата, содержащим ВПЧ16 Е2 (500 мг белка Е2 на мышь). Через один месяц у вакцинированной группы мышей также брали кровь на анализ, выделяли спленоциты и изучали изменения внутренних органов. У мышей после инъекции раковых клеток HeLa легкие увеличились в размере, на них появились разнообразные разрастания. У второй группы мышей, которые после введения HeLa были перорально вакцинированы ВПЧ16 Е2, особенных нарушений в размерах и морфологии легких не наблюдалось. Сравнение содержания интерферона, Т-лимфоцитов CD4 и CD8, а также клеток, реагирующих с антителами на гранзим В и перфорин, показало, что после вакцинирования ВПЧ16 Е2 в крови и спленоцитах мышей возрастает на 1.5–2 порядка количество клеток, реагирующих с антителами на интерферон, Т-лимфоциты СD4 и СD8, гранзим В и перфорин. Белок ВПЧ16 Е2 в значительной степени способен блокировать размножение раковых клеток и может быть использован в дальнейшей работе при создании терапевтической вакцины против рака, вызываемого наиболее высокоонкогенным типом папилломавируса ВПЧ16.
ВВЕДЕНИЕ
Вирус папилломы является одним из наиболее древних и имеет широкое распространение [1]. Его обнаруживают у всех представителей млекопитающих, птиц, рептилий, рыб и других представителей земноводных [2, 3]. У людей обнаружено около 200 генотипов папилломавируса, из них примерно 40 типов (16, 18, 31, 45 и др.) имеют высокий риск онкогенеза [4]. Но даже неонкогенные типы папилломавирусов (6 и 11) вызывают достаточно опасные папилломатозы аногенитального типа [5], а также возвратные респираторные папилломатозы [6, 7].
Полагают, что население Земли до 100% инфицировано папилломавирусами [8–11], но канцерогенез развивается далеко не у всех. Более подвержены папилломавирусной инфекции люди с ослабленным иммунитетом, перенесшие травмы и поранения, а также пожилые пациенты. Папилломавирус у инфицированных людей с высоким иммунитетом может исчезнуть в течение двух лет вследствие индукции клеточного иммунного ответа (если нет повторного инфицирования) или в результате клиринга (от англ. clearing – очищение). После инфицирования вирус может находиться также в латентном состоянии длительное время [1, 12] вплоть до 20 лет. Поэтому значительные усилия исследователей направлены на создание профилактических и терапевтических вакцин против папилломавирусной инфекции [13, 14].
В основе профилактических вакцин лежит иммуногенность антигенного “главного” белка оболочки вируса L1 (от англ. large), способного вызывать высокий гуморальный иммунный ответ и синтез нейтрализующих антител [15]. Продолжительность эффективного срока действия этих вакцин составляет примерно 4–5 лет. Но в реальности трудно предугадать, когда именно и на какой период профилактическая вакцина окажет свое действие. К сожалению, профилактические вакцины не способны оказывать сопротивление папилломавирусам, когда патология уже достаточно развита. “Наивные” Т-лимфоциты, т.е. “не заряженные” под определенного возбудителя, синтезируются в тимусе, циркулируют в крови, формируются в виде специфического депо в селезенке или других иммуногенных структурах, но если в тканях не находят индуктора, окисляются или разрушаются [16]. При наличии индуктора инфекции происходит бурный синтез и клональное размножение соответствующих специфических типов Т-лимфоцитов (в основном, CD4-хелперов и CD8-киллеров), узнающих и уничтожающих данный агент. Некоторая часть Т-лимфоцитов остается в виде клеток “памяти”, циркулирующих в крови или депонированных в селезенке как резервный иммунореактивный пул для более быстрой защиты от повторной инфекции [17]. При таком иммуногенезе происходит активация патогенраспознающих рецепторов [18], индукция синтеза интерферона [19, 20] и других цитокинов [19], активизирующих рецепцию, сигнальную трансдукцию, стимулирующих до 2000 генов [20].
Однако к настоящему времени, несмотря на положительные клинические испытания, пока не зарегистрировано ни одной терапевтической вакцины против папилломавирусов, хотя диапазон исследований достаточно широк [13].
Белки папилломавируса имеют разнообразный спектр действия и осуществляют многочисленные взаимодействия как друг с другом, так и с клеточными белками [21]. В развитии онкогенеза решающая роль принадлежит регуляторному “раннему” белку Е2 (от англ. early – ранний), блокирующему экспрессию синтеза онкогенных “ранних” белков Е6 и Е7, которые обнаруживаются в больших количествах в опухолях, но в них белок Е2 деградирован [22]. Поэтому его использование при создании терапевтической противораковой вакцины является целесообразным и может представлять более естественный подход для регуляции онкогенеза, вызываемого папилломавирусами.
Ранее [23] было установлено, что пероральное вакцинирование самцов мышей вакцинным материалом на основе плодов томата, трансгенного по гену ВПЧ16 Е2, приводит к регрессии опухолей семенников. При этом происходит высокая индукция синтеза интерферона и Т-лимфоцитов CD4/CD8 [19].
В настоящей работе проведен анализ состояния легких у самок мышей после инфицирования раковыми клетками HeLa, изучен эффект перорального вакцинирования вакцинным материалом, содержащим белок ВПЧ16 Е2. Кроме этого, выполнены анализы содержания интерферона, Т-лимфоцитов CD4/CD8, а также гранзима В и перфорина, которые являются компонентами комплекса апоптоза опухолевых клеток.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Культуры клеток и плазмиды. Раковая (иммортализованная) культура клеток HeLa получена от фирмы “БИОЛОТ” (Санкт-Петербург, Россия), выращивание проводили на среде DМЕМ (“БИОЛОТ”) с добавлением в cоотношении 10:1 сыворотки эмбриона (плодов) коровы (“БИОЛОТ”) и антибиотиков: 1000 ед/мл пенициллина и 5.0 мг/мл стрептомицина на 10 мл среды DMEM (по прописи “БИОЛОТа”). До начала эксперимента клетки HeLa хранили при –62°С в низкотемпературном морозильнике в режиме криоконсервации (по прописи “БИОЛОТа”) с добавлением глицерина или диметилсульфоксида. Затем клетки HeLa оттаивали на водяной бане при температуре 37°С. После высева клеток HeLa в пропорции 1:10 на питательную среду DMEM наблюдали появление клеточного монослоя в течение 5–10 мин на дне флакона, который через сутки давал полное зарастание поверхности дна.
Перед экспериментами проверяли жизнеспособность и функциональную активность клеток HeLa путем окрашивания 0.2%-ным раствором нитротетразолия синего, а также регистрировали отсутствие погибших клеток с помощью 0.4%-ного раствора трипанового синего [23].
В работе использовали штаммы A. tumefaciens EHA105 и E. coli DH5α с pBluescript для клонирования и хранения генетической конструкции, а также для генетической трансформации томата [25].
Создание высокопролиферативной растительной экспрессионной наносистемы. Для получения вакцинного препарата с высоким содержанием белка ВПЧ16 Е2 использовали генетическую конструкцию, приведенную в предыдущих исследованиях [24, 25]. Для создания высокопролиферативной экспрессионной наносистемы использовали репликазу вируса мозаики огурца (CMV – Cucumber mosaic virus). Генотип CMV New Delhi [26] выделен из растений томата, у которого данный подтип CMV вызывает те же симптомы, что и у растений огурца. Последовательность репликазы расположена в сегменте РНК2 CMVи включает в себя перекрывающиеся матрицы для синтеза белков 2а и 2b, из которых белок 2а представляет собой репликазу или РНК-зависимую РНК-полимеразу (RdRP), а белок 2b выполняет функцию суперсупрессора РНК-интерференции, индуцируемой вследствие инфицирования вирусом и накопления вирусных мРНК в растительных клетках хозяина. Высокая природная репликативная активность RdRP CMV обеспечивает создание эффективного нанопула реплисом, количество которого может достигать до 200 реплисом на клетку.
Согласно [27–29] выход целевого белка нередко составляет до 80% от общего растворимого белка (ОРБ).
Получение вакцинного препарата ВПЧ16 Е2 в плодах трансгенного томата. Трансформация бактерий бинарным вектором pBINPLUSARS с генетической конструкцией и методика трансформации растений томата приведены в [24, 25, 30]. Количественное определение белка ВПЧ16 Е2 в растительном материале проводили с помощью метода [24]. Содержание ВПЧ16 Е2 достигало 20% от ОРБ плода трансгенного томата, что было вполне достаточно для выполнения планируемых экспериментов.
Инфицирование мышей клетками HeLa. Для внутримышечной инъекции мышей использовали суточную суспензию клеток HeLa в среде выращивания из расчета 100 мкл на одну мышь.
Для перорального вакцинирования был взят гомогенат сырых плодов томата, трансгенного по гену ВПЧ16 E2, c высоким содержанием антигенного белка Е2. Вакцинный материал хранили в замороженном состоянии при –20°С. Гомогенат оттаивали при комнатной температуре, наносили на ломтики свежего белого хлеба для кормления мышей в течение 2 сут. При такой вакцинации мыши получали не менее 500 мг белка ВПЧ16 E2 на каждую самку.
Выделение легких, забор крови и получение спленоцитов. 22 Мыши-самки в возрасте 6 мес были инъецированы в бедренную мышцу суспензией раковых клеток HeLa дважды с интервалом в 1 мес. Затем у половины мышей брали кровь для анализа, выделяли селезенку и легкие вместе с сердцем. Другую половину группы инъецированных HeLa мышей перорально вакцинировали вакцинным материалом плодов томата, содержащим ВПЧ16 Е2 (500 мг белка Е2 на мышь). Через 1 мес у вакцинированной группы мышей также брали кровь на анализ, выделяли спленоциты и изучали изменения внутренних органов.
Размер легких регистрировали фотографированием и подсчетом массы бумажных эквивалентов, изготовленных с фотографий легких. Этот метод был избран вследствие исключительной клейкости и быстрой высыхаемости свежевыделенных легких и способности приклеиваться к любой поверхности, что значительно затрудняло манипуляции с ними.
Анализ крови, выделение спленоцитов и индукцию образования Т-лимфоцитов осуществляли по методу [19] с той лишь разницей, что для выращивания спленоцитов и клеток крови использовали 24-луночные полистирольные планшеты 24 Well Cell Culture plate with Flat Bottom and Lid (Corning Incorporated Costar, USA), помещая на дно лунок диски нитроцеллюлозной мембраны для выращивания клеток. Процедуру выращивания проводили по протоколу набора AB64029 – Murine IFNγ ELISPOT KIT (ABCAM, UK). В экспериментах использовали в качестве первичных антитела фирмы ABCAM (UK) на интерферон Rabbit monoclonal to interferon gamma [EPR1108] to interferon gamma (AB133566), на лиганды CD4 и CD8 Т-лимфоцитов – Rabbit monoclonal Anti-CD4 antibody [EPR19514] (AB183685), Rabbit monoclonal Anti-CD8 alpha (SP16) antibody [EPR21769] (AB217344), а также антитела на гранзим В – Rabbit polyclonal Anti-Granzyme B (AB53097) и перфорин Rat monoclonal Anti-Perforin antibody [CB5.4] (AB16074). Вестерн блот-гибридизацию осуществляли по методу [15, 19, 24, 25, 30], используя в качестве вторичных антител Goat Polyclonal Secondary Antibody to Mouse IgG-H&L (AP) (AB97020) (ABCAM,UK) и субстрат SIGMAFASTTMBCIP®/NBT (SIGMA, USA).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Две инъекции раковых клеток HeLa с интервалом в 1 мес (суммарно 2 мес инкубации) приводили к значительному увеличению размеров легких и изменению их морфологии в виде различных разрастаний (рис. 1).
Рис. 1.
Действие ВПЧ16 Е2 на развитие регрессии опухолевых разрастаний легких у самок мышей, инфицированных клетками HeLa. Первый ряд – № 1–6 – легкие контрольных неинфицированных мышей, второй ряд – № 7–12 – легкие мышей, инфицированных HeLa, третий и четвертый ряды № 13–23 – легкие мышей, инфицированных HeLa и затем перорально вакцинированных ВПЧ16 Е2. Отчетливо видна регрессия разрастаний.
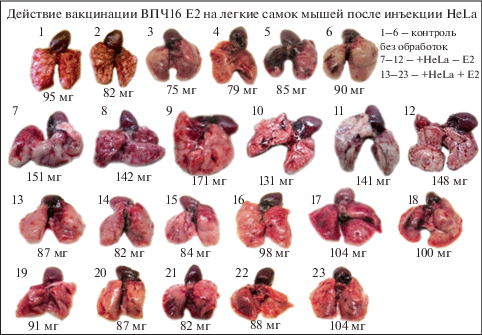
В табл. 1 представлены результаты измерения проекций изображений легких с фотографий. Как можно видеть из таблицы, легкие у самок после инъекции в среднем увеличились в 1.8 раза по сравнению с контролем. После вакцинирования произошла регрессия разрастаний, и размеры легких стали отличаться от контроля всего в 1.1 раза. У ряда мышей легкие брали для выяснения активности формирования монослоя клеток HeLa при высеве на среду DMEM. В результате этого эксперимента было отмечено, что, если из легких мышей, инъецированных HeLa, высев клеток происходил сразу, то после вакцинации из легких инъецированных мышей высев наблюдался только через 5–6 сут, что, очевидно, свидетельствует о значительном уменьшении количества жизнеспособных клеток HeLa.
Таблица 1.
Относительные массовые характеристики фотографических изображений легких у самок мышей в контроле, после инъекции клеток HeLa (HeLa – E2) и у мышей, вакцинированных Е2 после инъекции HeLa (HeLa + E2) (цифрами показана масса бумажных проекций в мг)
| Вариант | Мыши, взятые в анализ | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | Среднее | |
| Контроль | 95 | 82 | 75 | 79 | 85 | 90 | 0 | 0 | 0 | 0 | 0 | 84.3 ± 6.7 |
| HeLa – Е2 | 151 | 142 | 171 | 131 | 141 | 148 | 0* | 0* | 0* | 0* | 0* | 147.3 ± 12.3 |
| HeLa + E2 | 87 | 82 | 84 | 98 | 104 | 100 | 91 | 87 | 82 | 88 | 104 | 91.6 ± 8.1 |
Инъецированные клетками HeLa, но не вакцинированные мыши, продолжили жить более полугода. Но у них был понижен аппетит и замедлена жизненная активность. Кроме этого, невакцинированные самки были более худощавыми.
В [23] наблюдали весьма активное опухолеобразование у самцов мышей в области семенников после инъекции клеток HeLa в бедренную мышцу. Возможно, это обусловлено наличием в радиальной части сперматозоидов рецепторного белка синдекана-1, который специфически связывает белок оболочки ВПЧ L1 [31]. После пероральной вакцинации ВПЧ16 Е2 наблюдалась активная деградация опухолей, практически до размера семенников у контрольных мышей.
В настоящей работе самок мышей дважды инъецировали клетками HeLa с интервалом в 1 мес. После этого вакцинирование проводили также дважды: через месяц после второго инъецирования клетками HeLa и через месяц после первого вакцинирования. Кроме того, у мышей брали кровь на анализ и выделяли спленоциты через месяц после второго инъецирования через месяц после второй вакцинации. Клетки крови и спленоциты выращивали в течение недели на среде DMEM в ячейках 24-х луночного планшета, на дно которых помещали нитроцеллюлозный мембранный фильтр. При просмотре в световой микроскоп было обнаружено, что препарат спленоцитов содержал крупные мононуклеарные клетки с характерным периферийным расположением цитоплазмы, т.е. лимфоциты [23].
За период инкубации лимфоциты сохраняли свою жизнеспособность, функциональную активность и успешно размножались [23]. Процедуру вестерн блот-гибридизации выполняли по протоколу ELISPOT, с той лишь разницей, что использовали 24-х луночные планшеты, в которые помещали диски диаметром 15 мм, позволяющие вырастить большое количество клеток.
На рис. 2 представлена вестерн блот-гибридизация препаратов клеток крови у самок мышей в контроле, после инъекции HeLa, а также у мышей, которых после инъекции HeLa вакцинировали ВПЧ16 Е2. Можно видеть, что в контроле почти нет Т-лимфоцитов, секретирующих интерферон, нет и сродства к антителам на лиганды CD4/CD8 Т-лимфоцитов, гранзим В и перфорин. У клеток мышей, инфицированных HeLa, присутствуют клетки, секретирующие интерферон в небольших количествах.
Рис. 2.
Вестерн блот-гибридизация (ELISPOT) Т-лимфоцитов крови самок мышей в контроле, инфицированных клетками HeLa (HeLa – E2), инфицированных HeLa с последующим вакцинированием (HeLa + E2) с антителами на интерферон (IFN), CD4/CD8 Т-лимфоцитов (CD4, CD8), гранзим В (GrnB) и перфорин (Perf). Крайний диск с буквой К во втором ряду – контроль, “пустой” диск без нанесения клеток.
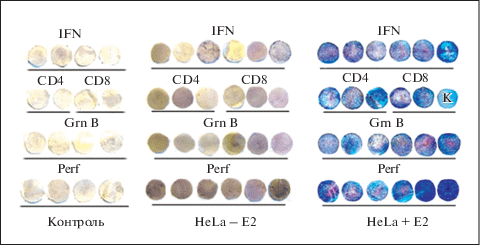
Как видим, в клетках крови мышей, вначале инфицированных HeLa, а затем вакцинированных ВПЧ16 Е2, обнаруживается весьма большое количество клеток, секретирующих интерферон и имеющих сродство к антителам на CD4/CD8 Т-лимфоцитов, а также с антителами на гранзим В и перфорин.
Селезенка представляет собой депо иммуногенных клеток, Т- и В-лимфоцитов, макрофагов, стареющих эритроцитов и т.д. Содержание иммунореактивных Т-лимфоцитов в селезенке может достигать 40% от общего количества Т-лимфоцитов в организме. Взаимодействие спленоцитов (Т-лимфоцитов) селезенки с соответствующими антителами показано на рис. 3.
Рис. 3.
Вестерн блот-гибридизация (ELISPOT) Т-лимфоцитов в контроле, из селезенки самок мышей, инфицированных клетками HeLa (HeLa – E2), инфицированных HeLa с последующим вакцинированием (HeLa + E2), с антителами на интерферон (IFN), CD4/CD8 Т-лимфоцитов, с антителами на гранзим В (GrnB) и перфорин (Perf).

Как видно из рисунка, контрольные диски практически неокрашены, в варианте после инъекции HeLa (HeLa-E2) присутствуют выросшие клетки, но их окрашивание слабое и форма пятен менее отчетлива. В варианте спленоцитов мышей, инъецированных HeLa, а затем вакцинированных E2 (HeLa + E2), присутствует большое количество интенсивно окрашенных клеток (спленоцитов) (рис. 3).
Подсчет количества Т-лимфоцитов, прореагировавших с антителами, приведен в табл. 2. Из таблицы видно, что количество иммуногенных клеток возрастает на 1.5–2 порядка по сравнению с контролем или вариантом без вакцинирования. Соотношение CD4/CD8 также сбалансировано (1:1), что свидетельствует о нормальном жизненном функционировании мышей после вакцинации. Значительный прирост иммуногенных структур и клеток свидетельствует о том, что в результате вакцинирования ВПЧ16 Е2 происходит мощная иммунная активация, сопровождающаяся формированием большого количества CD4/CD8 Т-лимфоцитов (хелперов и киллеров), приводящая к регрессии опухолевых разрастаний, а также активации апоптоза, на что указывает высокая степень гибридизации с антителами на гранзим В и перфорин, которые являются компонентами ферментативного комплекса апоптоза. Высокое содержание интерферона в клетках вакцинированных мышей также способствует активизации экспрессии генов, приводящих к разрушению раковых клеток HeLa, и другим процессам нормализации структуры легких у мышей.
Таблица 2.
Терапевтическое действие ВПЧ16 Е2 на содержание интерферона, количество CD4 и CD8 Т-лимфоцитов, гранзима В и перфорина в крови и селезенке самок мышей, предварительно внутримышечно инъецированных HeLa
| Вариант | Интерферон | CD4 | CD8 | Гранзим В | Перфорин |
|---|---|---|---|---|---|
| Кровь (300 мкл от каждой мыши) | |||||
| Контроль | 5, 20, 17, 14 | 8, 9, 0 | 5, 4, 0 | 6, 7, 10, 7 | 0, 2, 5, 14 |
| HeLa – E2 | 6, 10, 22, 3, 0, 51 | 7, 8, 4 | 12, 4, 14 | 8, 2, 8, 17, 9, 5 | 41, 6, 4, 7, 5, 8 |
| HeLa + E2 | 420, 840, 584, 512, 576, 460 | 615, 1232, 615 | 646, 1104 | 688, 924, 672, 840, 749, 720 | 760, 666, 1007, 552, 491, 354 |
| Селезенка | |||||
| Контроль | 0, 6, 12, 0 | 1, 5 | 7, 0 | 6, 0, 0, 0 | 0, 6, 6, 0 |
| HeLa – E2 | 9, 7, 0, 14, 43, 53 | 57, 25, 16 | 9, 21, 7 | 14, 44, 36, 28, 0, 5 | 30, 15, 10, 11, 14, 11 |
| HeLa + E2 | 448, 568, 664, 280, 680, 572 | 600, 642, 595 | 511, 504, 336 | 570, 384, 540, 590, 564, 264 |
435, 485, 528, 618, 612, 552 |
В настоящее время разрабатывается много терапевтических вакцин против рака, вызываемого папилломавирусами. В их основе рассматривают индукцию иммуногенеза и выработку Т-клеточного ответа при использовании онкогенов белков Е6 и Е7 папилломавируса. В настоящей работе выполнено исследование противораковой активности белка ВПЧ16 Е2 на модели легких у мышей.
“Ранний” белок ВПЧ16 Е2 привлекал внимание и других исследователей. Например, в [32] получены интересные результаты. Изучая структуру и активность белка Е2, авторы установили, что этот белок является сильным репрессором транскрипции с промотора белков онкогенов ВПЧ16 Е6 и ВПЧ16 Е7. По их данным структура белка Е2 включает в себя два домена: трансактивационный N-домен и С-домен связывания с ДНК. Внутри белка Е2 со стороны N-домена ближе к зоне перешейка расположен ген белка Е8, а вся эта зона обозначается как Е2С-домен. Авторами установлено [32], что домен Е2С белков Е8^Е2 связан с общим комплексом ядерного репрессора в клетках хозяина. Дисрегуляция репрессорного комплекса приводит к различным типам канцерогенеза [33]. Было также изучено терапевтическое действие Е2 белка бычьего папилломавируса в клинических испытаниях [34]. Оно продемонстрировало на 1172 женщинах и 180 мужчинах, что вектор, содержащий бычий белок Е2 папилломавируса, введенный путем инъекции, устранял интраэпителиальные и аногенитальные нарушения в течение двух лет.
ЗАКЛЮЧЕНИЕ
Представленные результаты указывают на эффективное действие ВПЧ16 Е2 на легочную ткань мышей, предварительно инъецированных внутримышечно раковыми клетками HeLa. Сопоставление полученных результатов с некоторыми литературными данными свидетельствует о том, что ВПЧ16 Е2 может оказаться белком более широкого спектра действия и может проявлять свою активность репрессора не только по отношению к цервикальному раку, но и к другим папилломатозам. Поэтому дальнейшее исследование белка ВПЧ16 Е2, получаемого на базе растительных экспрессионных систем с целью разработки терапевтической вакцины против опасных папилломатозов, достаточно перспективно.
Список литературы
Syrjanen S. // Eur. J. Oral Sci. 2018. V. 126. P. 49. https://doi.org/10.1111/eos.12538
Upadhyay M., Vivekanandon P. // Plos One. 2015. V. 10. № 11. P. e0142368. https://doi.org/10.1371/journal.pone.0142368
Doorslaer Van K., Ruoppolo V., Schmidt A. et al. // Virus Evolution. 2017. V. 3. № 2. vex027. https://doi.org/10.1093/ve/vex027
Menon S., Wusiman A., Boily M.C. et al. // Plos One. 2016. V. 11. № 10. P. e0163965. https://doi.org/10.1371/journal.pone.0163965
Egawa N., Doorbar J. // Virus Res. 2017. V. 231. P. 119. https://doi.org/10.1016/j.virusres. 2016.12.017
Venkatesan N.N., Pine H.S., Underbrink M.P. // Otolaryngol. Clin. North Am. 2012. V. 45. P. 671-ix.https://doi.org/10.1016/j.otc.2012.03.006
Seedat R.Y. // Pediatric Health, Medicine and Therapeutics. 2020. V. 11. P. 39. https://doi.org/10.2147/PHMT.S200186
Touze A., de Sanjose S., Coursaget P. et al. // J. Clinical Microbiol. 2001. V. 39. P. 4344. https://doi.org/10.1128/jcm.39.12.4344-4348.2001
Bosch F.X., Broker T.R., Forman D. et al. // Vaccine. 2013. V. 31. P. I1-31. https://doi.org/10.1916/j.vaccine.2013.07026
Ferlay J., Bray F., Pisany P. et al. GLOBOCAN 2002: cancer incidence, mortality and prevalence worldwide, version 2.0. Lyon, France: International Agency for Research on Cancer, 2004 (IARC CancerBase№ 5).
Markowitz L.E., Dunne E.F., Saraiya M. et al. // Morbidity and Mortality Weekly Report. Recommendations and Reports. 2014. V. 63. P. 1.
Taylor S., Bunge E., Bakker M., Castellsague X. // BMC Infectious Diseases. 2016. V. 16. P. 293. https://doi.org/10.1186/S12879-016-1633-9
Dadar M., Chakraborty S., Dhama K. et al. // Frontiers in Immunol. 2018. V. 9. Article 2478. https://doi.org/10.3389/fimmu.2018.02478
Yang A., Jeang J., Cheng K. et al. // Expert Rev. Vaccines. 2016. V. 15. P. 989. https://doi.org/10.1586/14760584.2016.1157477
Salyaev R.K., Rekoslavskaya N.I., Stolbikov A.S., Tretyakova A.V. // Doklady Biochem. Biophys. 2017. V. 474. P. 186.https://doi.org/10.1134/S1607672917030140
Mold J., Reu P., Olin A. et al. // PLOS Biology. 2019. V. 17. P. e3000383. https://doi.org/10.1371/journal.pbio.3000383
McFarland H.J., Berkson J.D., Lee J.P. et al. // Vaccine. 2015. V. 33 (32). P. 3865. https://doi.org/10.1016/j.vaccine.2015.06.070
Muller L., Aigner P., Stoiber D. // Frontiers in Immunol. 2017. V. 8. Article 304. https://doi.org/10.3389/fimmu.2017.00304
Salyaev R.K., Rekoslavskaya N.I., Stolbikov A.S. // Doklady Biochem. Biophys. 2019. V. 488. P. 316. https://doi.org/10.1134/S1607672919050077
Schneider W.M., Chevillotte M.D., Rice C.M. // Annu. Rev. Immunol. 2014. V. 32. P. 513. https://doi.org/10.1146/annurev-immunol-032713-120231
De Smet M., Kanginakudru S., Rietz A. et al. // PLOS Pathogens. 2016. V. 12. P. e1005934. https://doi.org/10.1371/journal.ppat.1005934
Alazawi W., Pett M., Strauss S. et al. // British J. Cancer. 2004. V. 91. P. 2063. https://doi.org/10.1038/sj.bjc.6602237
Salyaev R.K., Rekoslavskaya N.I., Stolbikov A.S. // Doklady Biochem. Biophys. 2019. V. 488. P. 296. https://doi.org/10.1134/S1607672919050028
Salyaev R.K., Rekoslavskaya N.I., Stolbikov A.S. // Doklady Biochem. Biophys. 2018. V. 482. P. 271. https://doi.org/10.1134/S1607672918050113
Salyaev R.K., Rekoslavskaya N.I., Stolbikov A.S. // Doklady Biochem. Biophys. 2019. V. 484. P. 52. https://doi.org/10.1134/S1607672919010150
Koundal V., Mohd Q., Haq R., Praveen S. // Biochem. Genet. 2011. V. 49. P. 25. https://doi.org/10.1007/S10528-010-9382-8
Chichester J.A., Jones R.M., Green B.J. et al. // Viruses. 2012. V. 4. P. 3227. doi: 10.3390/v4113227
Phoolcharoen W., Dye Q., Kilbourne J. et al. // Proc. Natl. Acad. Sci. U.S.A. 2011. V. 108. P. 20695. https://doi.org/10.1073/pnas.1117715108/-/DCSupplemental
Marillonnet S., Giritch A., Gils M. et al. // Proc. Natl. Acad. Sci. U.S.A. 2004. V. 101. P. 6852. https://doi.org/10.1073/pnas.0400149101
Salyaev R.K., Rekoslavskaya N.I., Stolbikov A.S., Tretyakova A.V. // Doklady Biochem. Biophys. 2016. V. 468. P. 187.https://doi.org/10.1134/S1607672916030078
Foresta C., Patassini C., Bertoldo A. et al. // PLoS ONE. 2011. V. 6. P. e15036. https://doi.org/10.1371/journal.pone.0015036
Dreer M., Fertey J., van de PoelS. et al. // PLOS Pathogens. 2016. V. 12. P. e1005556. https://doi.org/10.1371/journal.ppat.1005556
Wong N., Major P., Kapoor A. et al. // Oncotarget. 2016. V. 7. P. 83115.
Rosales R., Lopez-Countreras M., Rosales C. et al. // Human Gene Therapy. 2014. V. 25. P. 1035. https://doi.org/10.1089/hum.2014.024
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


