Российские нанотехнологии, 2020, T. 15, № 4, стр. 540-549
ВКЛАД СТАБИЛИЗАТОРА В ЦИТОТОКСИЧНОСТЬ НАНОЧАСТИЦ СЕРЕБРА В ЭКСПЕРИМЕНТЕ НА ЭНДОТЕЛИАЛЬНЫХ И ФИБРОБЛАСТОПОДОБНЫХ КЛЕТКАХ
С. И. Каба 1, Е. М. Егорова 1, *
1 Научно-исследовательский институт общей патологии и патофизиологии
Москва, Россия
* E-mail: emenano@mail.ru
Поступила в редакцию 26.06.2020
После доработки 26.06.2020
Принята к публикации 17.09.2020
Аннотация
В исследованиях механизма цитотоксичности наночастиц серебра (НЧС), стабилизированных анионным поверхностно-активным веществом (ПАВ) бис(2-этилгексил)сульфосукцинатом натрия (АОТ), определены вклады мономеров и мицелл стабилизатора в токсический эффект водных растворов наночастиц. Эксперименты проводили на эндотелиальных (EA.hy926) и фибробластоподобных (FRSN) клетках по разработанной авторами ранее методике разделения вкладов двух форм стабилизатора. НЧС получали методом биохимического синтеза в водной среде (Патент РФ № 2618270), препарат содержал 108 мкг/мл серебра и 3 ммоль/л АОТ. Цитотоксичность раствора НЧС оценивали с помощью тетразолиевого (МТТ) теста после 24-часовой инкубации клеток с 1–7 мкг/мл НЧС. Вклад разных форм АОТ оценивали по снижению жизнеспособности клеток после инкубации с контрольными растворами АОТ с концентрацией 1.7 ммоль/л (только мономеры) и 3 ммоль/л (мономеры и мицеллы) в тех же разведениях, что и раствор НЧС. Для обеспечения равенства значений критической концентрации мицеллообразования АОТ в растворе НЧС и растворах АОТ последние готовили в 8 ммоль/л KNO3. Для EA.hy926 найдены зависимости отдельных вкладов мономеров и мицелл АОТ в общую токсичность раствора НЧС от концентрации наночастиц в исследованном диапазоне. Для FRSN подобные зависимости получить не удалось, так как не было возможности обеспечить необходимый уровень воспроизводимости значений жизнеспособности, которые менялись в зависимости от используемого номера пассажа клеток. Полученные результаты дают представление о влиянии мицелл и мономеров ПАВ на эффекты НЧС in vitro, а также показывают, что используемая авторами методика оценки цитотоксичности ПАВ чувствительна к специфическим особенностям клеточных линий.
ВВЕДЕНИЕ
Наночастицы серебра (НЧС) в настоящее время являются одним из наиболее широко используемых наноматериалов, что обусловлено их выраженной биоцидной активностью. НЧС могут вызывать угнетение жизнедеятельности и гибель множества болезнетворных агентов, что делает эти частицы привлекательным объектом для разработки лекарственных препаратов, различных материалов и медицинских приборов с антимикробной активностью [1–4]. Имеются сведения и о неспецифической активности НЧС по отношению к опухолевым клеткам [5–7]. Вместе с тем уже накоплен обширный пул данных о токсическом действии НЧС по отношению как к клеткам in vitro, так и к животным in vivo; примеры обзоров таких токсикологических исследований можно найти в [8–10]. При массовом и слабо контролируемом использовании НЧС в различных областях хозяйственной деятельности серьезной проблемой становится недостаток систематизированной информации об условиях их безопасного применения.
Использование поверхностно-активных веществ (ПАВ) в качестве стабилизаторов наночастиц позволяет добиться их высокой устойчивости к агрегации. Однако в этом случае взаимодействие наночастиц с живыми системами и его возможные последствия могут осложняться собственными биологическими эффектами ПАВ; последние давно являются предметом изучения в связи с их применением в косметике, бытовой химии [11, 12] и в медицинской практике, например для борьбы с герпесом, гонореей и другими инфекциями [13–15]. В случае стабилизации наночастиц поверхностно-активными веществами их присутствие в растворах наночастиц может вносить собственный вклад в токсическое действие этих растворов [16–20]. Поэтому возникает необходимость контролировать биологические (в том числе токсические) эффекты стабилизаторов и выяснять, какой вклад они вносят в действие наночастиц на биологические объекты.
Ранее [21, 22] нами было обнаружено, что присутствующий в растворе НЧС стабилизатор (АОТ), будучи анионным ПАВ, способен в значительной степени снижать жизнеспособность исследуемых клеток в культуре. Для выяснения механизма токсичности АОТ была разработана методика, позволяющая определить отдельные вклады мономеров и мицелл этого ПАВ в общую цитотоксичность растворов НЧС. Для этого использовались имеющиеся в литературе, а также собственные результаты измерений критической концентрации мицеллообразования (ККМ) АОТ в водных растворах. Детальное описание методики и результаты, полученные с ее применением в экспериментах на культуре клеток Т-лимфобластной лейкемии человека (линия Jurkat) приведены в [23]; общая схема исследования описана в учебном пособии [24].
Оказалось, что с изменением концентрации НЧС вклады мономеров и мицелл изменяются различным образом, причем вклад мицелл заметно превышает вклад мономеров в области высоких концентраций НЧС в исследованном диапазоне. Далее встала задача выяснить, зависят ли эти результаты от индивидуальных свойств клеточных линий, т.е. апробировать предложенную методику на культурах клеток другого типа.
Цель настоящей работы – определить вклады различных форм АОТ в цитотоксичность исследуемых растворов НЧС на культурах нормальных клеток человека: эндотелиальных (линия EA.hy926) и фибробластоподобных (линия FRSN). Такой выбор обусловлен тем, что это клетки нормальные адгезионного типа, тогда как клетки Jurkat злокачественные суспензионного типа; таким образом, сравнение полученных результатов позволяет выяснить, насколько предложенный подход к исследованию действия на клетки разных форм ПАВ зависит от природы клеток (злокачественные или нормальные) и (или) от их типа (суспензионные или адгезионные).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез и характеристика наночастиц серебра. Синтез НЧС проводили в водном растворе по процедуре, описанной ранее [26, 27]. Вначале готовили раствор АОТ (бис(2-этилгексил)сульфосукцината натрия, 96%, “Merck”, Германия) в дистиллированной воде, затем в него вводили последовательно раствор кверцетина в этаноле и раствор диамминнитрата серебра. Контроль формирования и стабильности НЧС, а также определение их концентрации проводили на спектрофотометре “Shimadzu U2600” (“Shimadzu”, Япония). Значения ζ-потенциала определяли методом фотонной корреляционной спектроскопии на приборе “ZetaPALS” (“Brookhaven Instruments”, США). Изображения наночастиц получали с помощью просвечивающей электронной микроскопии на приборе “LEO912 AB OMEGA” (“Carl Zeiss”, Германия). Концентрация наночастиц в растворе составляла 108 мкг/мл (1 ммоль/л); концентрация АОТ – 1 ммоль/л (1-НЧС) и 3 ммоль/л (3-НЧС).
Приготовление растворов стабилизатора. Растворы АОТ готовили в трех вариантах в зависимости от цели эксперимента. Для контроля токсичности стабилизатора в экспериментах, поставленных с целью проверить, имеется ли на эндотелии и фибробластах различие цитотоксичности растворов 1-НЧС и 3-НЧС, наблюдавшееся ранее на начальной стадии исследований на клетках Jurkat [23, 24], готовили растворы АОТ 1 и 3 ммоль/л в дистиллированной воде. Поскольку критическая концентрация мицеллообразования АОТ как заряженного (анионного) ПАВ зависит от ионной силы (например, [28]), которая в растворе НЧС выше, чем в воде, ранее было показано, что для контроля токсичности стабилизатора следует использовать растворы АОТ не в воде, а в растворе нитрата калия с ионной силой, равной таковой в растворе наночастиц [23–25]. Поэтому в настоящей работе для коррекции контроля токсичности АОТ в опытах с НЧС на эндотелии и фибробластах готовили растворы 3 ммоль/л АОТ в 8 ммоль/л KNO3 (х.ч., “Реахим”, Россия), а для определения вклада мономеров в цитотоксичность АОТ готовили раствор в 8 ммоль/л KNO3 с концентрацией АОТ 1.7 ммоль/л, равной его ККМ в растворе 3-НЧС.
Культуры клеток. Клетки линии Ea.hy926 – эндотелиоциты пупочной вены человека (далее “эндотелий”) получены из Американской коллекции типовых культур (American Type Culture Collection, США). Условия субкультивирования: 37°С в увлажненной атмосфере 5%-ного CO2 с использованием инкубатора “New Brunswick Galaxy 48 R” (“Eppendorf”, Германия). Клетки культивировали в среде DMEM, содержащей 10% эмбриональной бычьей сыворотки, 2 ммоль/л глутамина, смесь HAT (0.1 ммоль/л гипоксантина, 0.4 ммоль/л аминоптерина и 0.016 ммоль/л тимидина), заменимые аминокислоты (по 0.1 ммоль/л каждая), а также 50 мкг/мл гентамицина (все компоненты производства “Thermo Fisher Scientific”, США). Клетки пассировали дважды в неделю, при этом их открепляли с помощью 0.25%-ного раствора трипсина в этилендиаминтетрауксусной кислоте и ресуспендировали в свежей среде. Концентрацию и жизнеспособность клеток оценивали путем подсчета в камере Горяева, окрашивали клетки 0.1%-ным трипановым синим. Определенная данным методом жизнеспособность клеток, используемых для дальнейшей работы, составляла не менее 95%.
Мезенхимные стволовые клетки фибробластоподобной морфологии, выделенные из крайней плоти человека, линии FRSN (далее клетки FRSN или фибробластов) были получены из Российской коллекции клеточных культур (Институт цитологии РАН). Клетки культивировали в среде DMEM, содержащей 10% эмбриональной бычьей сыворотки в инкубаторе при 37°С в увлажненной атмосфере 5%-ного СО2. Пассирование проводили раз в 3 дня по той же методике, что и клетки эндотелия. Для экспериментов использовали клетки, начиная с 19-го пассажа, с жизнеспособностью не ниже 95%. Оценку жизнеспособности и концентрации проводили так же, как и для эндотелиальных клеток.
Определение жизнеспособности клеток (МТТ-тест). Инкубацию обоих типов клеток с растворами НЧС и АОТ проводили в 96-луночных микропланшетах. В лунки планшета вносили суспензию клеток объемом 200 мкл и концентрацией 5 ⋅ 104 клеток/мл (по 10 тыс. клеток на лунку). После внесения в лунки планшета клетки инкубировали перед экспериментом 24 ч при 37°С в увлажненной атмосфере 5%-ного СО2. Затем в одни лунки с клетками вносили исходные растворы НЧС с концентрацией 108 мкг/мл, разбавляя их до концентраций в диапазоне 1–7 мкг/мл с шагом 1 мкг/мл (в разведениях 108, 54, 36, 27, 21.6, 18, 15.4). В другие лунки с клетками вносили растворы АОТ с концентрацией 1, 3 или 1.7 ммоль/л в тех же разведениях. Такие разведения использовали во всех экспериментах с клетками, далее они обозначены как стандартные разведения. Во всех экспериментах в качестве отрицательного контроля использовали дистиллированную воду; в экспериментах с растворами АОТ, приготовленными в нитрате калия, в качестве дополнительного контроля использовали раствор 8 ммоль/л KNO3. Клетки инкубировали 24 ч.
После инкубации клетки однократно отмывали в фосфатно-солевом буфере с pH 7.4 (“ПанЭко”, Россия), затем к ним вносили свежую культуральную среду DMEM и раствор 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолия бромида (МТТ) до концентрации 500 мкг/мл и до объема 200 мкл. Через 4 ч инкубации с МТТ из лунок аккуратно отбирали среду, вносили по 100 мкл диметилсульфоксида и оставляли планшеты на 20–30 мин в темноте при комнатной температуре. Оптическую плотность полученного раствора формазана в лунках измеряли на фотометре “Chameleon V” (“Hidex”, Финляндия) при 544 нм. Жизнеспособность клеток вычисляли как долю оптической плотности испытуемых клеток от оптической плотности контрольных клеток (инкубированных с дистиллированной водой), выраженную в процентах. Все эксперименты выполняли не менее чем в трех повторениях.
Оценка вкладов мономеров и мицелл АОТ в общую цитотоксичность раствора наночастиц (3-НЧС). При оценке влияния мономеров и мицелл АОТ на жизнеспособность клеток применяли методику, описанную в [23, 25]. Изменения жизнеспособности после инкубации со стандартными разведениями 3 ммоль/л раствора АОТ (общая токсичность, ΔVобщ) оценивали как разность между значениями жизнеспособности клеток в контроле (принятой за 100%) и опыте: ΔVобщ = 100% – Vn, где Vn – жизнеспособность клеток при данном разведении. Аналогично оценивали изменения жизнеспособности под воздействием стандартных разведений раствора мономеров АОТ, т.е. с исходной концентрацией 1.7 ммоль/л (ΔVмон). С учетом того, что ΔVобщ можно представить как сумму токсических вкладов мономерной и мицеллярной форм АОТ, рассчитывали вклад мицелл: ΔVмиц = ΔVобщ – ΔVмон. Все указанные величины ΔV вычисляли для каждой точки стандартных разведений растворов НЧС и АОТ. Как было показано ранее [23], расход АОТ на стабилизацию наночастиц порядка сотых долей миллимоля, так что концентрация АОТ в растворе 3-НЧС практически равна таковой в 3 ммоль/л растворе стабилизатора; поэтому равны и соответствующие вклады мономеров и мицелл.
Статистическая обработка результатов. Статистические данные МТТ-теста представляли как среднее ± стандартное отклонение из шести независимых измерений. Значимость различий между экспериментальными группами и контролем оценивали однофакторным дисперсионным анализом (ANOVA) с последующей проверкой тестом Тьюки, используя программу StatPlus версии 6.5 (Analyst Soft, США), уровень p < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В работе следовали общей схеме, разработанной для клеток Jurkat, с некоторыми сокращениями, возможными благодаря полученным ранее результатам по значениям критической концентрации мицеллообразования АОТ в воде и в модельных растворах нитрата калия, используемых для определения критической концентрации мицеллообразования АОТ в растворах НЧС, а также соответствующей коррекции состава контрольных растворов стабилизатора при измерениях жизнеспособности клеток [23, 25]. Вначале получали два раствора НЧС с концентрацией АОТ 1 и 3 ммоль/л. Далее, используя МТТ тест, (1) определяли жизнеспособность клеток при изменении концентрации наночастиц и соответствующих контрольных растворов АОТ, (2) интерпретировали различия в токсичности двух исследуемых растворов как следствие различия в биологической активности мономеров и мицелл АОТ, (3) находили вклады отдельных форм АОТ, используя значения его ККМ в воде и растворах НЧС с 3 ммоль/л АОТ (в последних с учетом зависимости ККМ от ионной силы), и (4) получали зависимости вкладов в цитотоксичность мономеров и мицелл от общей концентрации АОТ и НЧС в исследуемых растворах.
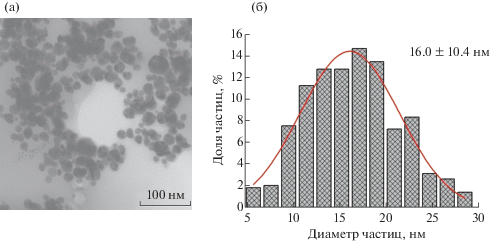
Использованные НЧС в растворах с концентрацией АОТ 1 ммоль/л (1-НЧС) и 3 ммоль/л (3-НЧС) имели одинаковые средний размер (~16 нм) и значения ζ-потенциала (–32 ± 2 мВ) и отличались друг от друга только концентрацией стабилизатора. Для примера на рис. 1 показаны электронная микрофотография и гистограмма распределения по размерам наночастиц в растворе с концентрацией АОТ 3 ммоль/л.
Эксперименты с этими растворами наночастиц проводили вначале на клетках эндотелия, затем на клетках фибробластов. Ниже приведена последовательность экспериментов на клетках эндотелия, которая позволила разделить вклады мономеров и мицелл АОТ в цитотоксичность растворов НЧС и определить характер их зависимости от общей концентрации наночастиц и АОТ. Затем следуют результаты, полученные в опытах на фибробластах, в которых проявились особенности этой линии клеток, не позволяющие провести полную последовательность экспериментов и получить подобные зависимости вкладов в цитотоксичность двух форм стабилизатора.
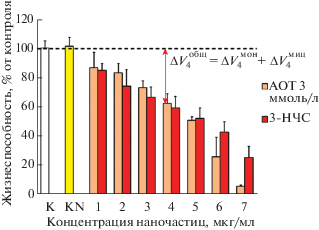
Результаты экспериментов на эндотелии. Тест на жизнеспособность этих клеток выявил существенные различия цитотоксичности двух исследуемых препаратов НЧС (рис. 2). При инкубации с раствором 1-НЧС цитотоксический эффект отсутствовал, тогда как раствор 3-НЧС вызывал снижение жизнеспособности в культуре, тем более значительное, чем выше концентрация наночастиц. В последнем случае наблюдалось также резкое увеличение цитотоксичности стабилизатора при разведениях, соответствующих области высоких концентраций НЧС в исследованном диапазоне; отсюда следует, что стабилизатор может вносить заметный вклад в цитотоксичность растворов наночастиц.
Рис. 2.
Изменение жизнеспособности клеток EA.hy926 после 24-часовой инкубации с растворами НЧС, стабилизированными АОТ: а – 1-НЧС, 1 ммоль/л АОТ; б – 3-НЧС, 3 ммоль/л АОТ. К – контроль (дистиллированная вода). Указаны статистически достоверные отличия от контроля: * – при p < 0.05; ** – при p < 0.01. Здесь и на следующих рисунках разведения растворов АОТ соответствуют указанным концентрациям наночастиц.

Качественно подобные результаты были получены на культуре клеток Jurkat [23]: отсутствие токсического действия растворов НЧС с 1 ммоль/л АОТ и явное снижение жизнеспособности клеток после инкубации с НЧС, полученными с 3 ммоль/л АОТ. Однако в последнем случае токсический эффект самого стабилизатора не был столь сильно выражен в области высоких концентраций наночастиц, что говорит о меньшей чувствительности клеток Jurkat. Как уже было объяснено в исследовании механизма токсического действия этого стабилизатора на клетки Jurkat [23, 24], в свете имеющихся в литературе данных о резком увеличении цитотоксичности некоторых ПАВ при увеличении их концентрации до значений, превышающих ККМ [14], наблюдаемое на эндотелии увеличение токсичности АОТ можно рассматривать как следствие появления мицелл этого ПАВ, обладающих большей токсичностью, чем мономеры.
Для проверки правильности такой точки зрения определяли концентрации мономеров и мицелл, во-первых, в водном 3 ммоль/л растворе АОТ, используемом в контрольных экспериментах на клетках, и, во-вторых, в растворах 1-НЧС и 3-НЧС, измеряя соответствующие значения ККМ кондуктометрическим методом. Соответствующие зависимости и полученные результаты приведены в [23]. Найденное нами значение ККМ АОТ в дистиллированной воде составляет 2.81 ммоль/л, т.е. в растворе 1-НЧС (при концентрации ниже ККМ) присутствуют только мономеры, а в растворе 3-НЧС (при концентрации выше ККМ) – как мономеры, так и мицеллы АОТ. Оказалось, однако, что раствор АОТ в дистиллированной воде в данном случае не может служить контролем токсичности стабилизатора, присутствующего в растворах НЧС, поскольку критическая концентрация мицеллообразования АОТ как ионного ПАВ зависит от ионной силы раствора [28], а ионная сила в растворах НЧС (как было установлено при измерениях ζ-потенциала) существенно выше, чем в дистиллированной воде. Поэтому были внесены коррективы на изменение критической концентрации мицеллообразования АОТ в растворах наночастиц по сравнению с раствором в воде путем измерения ККМ в модельных растворах нитрата калия с ионной силой, равной таковой в соответствующих растворах НЧС; обоснование выбора этой соли, определение ионной силы в растворах НЧС и результаты измерений критической концентрации мицеллообразования АОТ в растворах нитрата калия разной ионной силы даны в [23, 25, 29]. Для раствора 3-НЧС в качестве корректного контрольного раствора стабилизатора был выбран 3 ммоль/л раствор АОТ в 8 ммоль/л растворе KNO3; для этого раствора значение критической концентрации мицеллообразования АОТ составляло 1.7 ммоль/л.
Сравнение жизнеспособности клеток Jurkat после инкубации с 3 ммоль/л растворами АОТ в воде и в 8 ммоль/л растворе KNO3 показало [29], что в модельном растворе нитрата калия токсичность АОТ превышает таковую для его раствора в воде во всем диапазоне концентраций наночастиц (1–7 мкг/мл). Поскольку в модельном растворе критическая концентрация мицеллообразования АОТ ниже (соответственно, концентрация мицелл выше), чем в воде, увеличение токсичности АОТ может быть обусловлено увеличением вклада мицелл в общую токсичность раствора 3-НЧС. Подобный вывод можно сделать из сопоставления результатов инкубации клеток эндотелия с растворами АОТ 3 ммоль/л в воде и в модельном растворе KNO3 (рис. 3); в последнем случае средние значения жизнеспособности (Vn) в том же диапазоне концентраций наночастиц ниже, причем отсутствует какой-либо эффект от инкубации с самим раствором нитрата калия (KN). Соответствующие величины изменений жизнеспособности по сравнению с контролем по воде (ΔVn) для одинаковых разведений 3 ммоль/л растворов АОТ приведены в табл. 1. Явное увеличение токсичности АОТ в растворе нитрата калия, опять-таки, указывает на больший вклад мицелл в токсичность раствора наночастиц.
Рис. 3.
Жизнеспособность клеток EA.hy926 после 24-часовой инкубации со стандартными разведениями 3 ммоль/л раствора АОТ в воде и в 8 ммоль/л KNO3 . Указаны статистически достоверные отличия от контроля: * – при p < 0.05; ** – при p < 0.01. Контроли здесь и на следующих рисунках: К – дистиллированная вода, KN – 8 ммоль/л KNO3.

Таблица 1.
Изменения жизнеспособности клеток EA.hy926 после инкубации с растворами АОТ в воде и в 8 ммоль/л KNO3 (KN) при стандартных разведениях, соответствующих концентрациям НЧС 1–7 мкг/мл
| Концентрация наночастиц серебра (3-НЧС), мкг/мл | |||||||
|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| ΔVn (3 ммоль/л АОТ в воде) | 3.3 | 9.9 | 15.4 | 19.2 | 30.5 | 72.8 | 90.2 |
| ΔVn (3 ммоль/л АОТ в KN) | 13.3 | 16.5 | 26.9 | 37.8 | 49.2 | 74.2 | 94.6 |
| $\Delta V_{n}^{{{\text{мон}}}}$ (1.7 ммоль/л АОТ в KN) | 7.7 | 17.9 | 21.9 | 30.1 | 34.9 | 35.8 | 41.3 |
| $\Delta V_{n}^{{{\text{миц}}}}$ (3 ммоль/л АОТ в KN) | 5.6 | –1.3 | 5.0 | 7.7 | 14.4 | 35.5 | 53.3 |
Примечание. ΔVn – изменение жизнеспособности клеток относительно контроля по воде; $\Delta V_{n}^{{{\text{мон}}}}$ – изменение жизнеспособности (вклада мономеров) после инкубации с раствором 1.7 ммоль/л АОТ; $\Delta V_{n}^{{{\text{миц}}}}$ – вклад мицелл АОТ в изменения жизнеспособности после инкубации с раствором 3 ммоль/л АОТ.
При использовании растворов АОТ в 8 ммоль/л KNO3 здесь и далее в качестве отрицательного контроля, помимо инкубации клеток в дистиллированной воде, вводили дополнительный контроль – инкубацию в 8 ммоль/л KNO3.
В настоящей работе стояла задача определить вклады в цитотоксичность мономеров и мицелл в растворе НЧС, стабилизированном 3 ммоль/л АОТ; при этом для клеток эндотелия следовали той же логике, которая была апробирована на клетках Jurkat. Вначале оценивали вклад мономеров. Для этого измеряли жизнеспособность клеток после инкубации с раствором АОТ в 8 ммоль/л KNO3 при исходной концентрации АОТ, равной его ККМ (1.7 ммоль/л); поскольку значение критической концентрации мицеллообразования ПАВ равно концентрации его мономеров в растворе, очевидно, что в этом 1.7 ммоль/л растворе присутствуют только мономеры АОТ. Результаты, полученные с таким раствором для эндотелия, приведены на рис. 4.
Рис. 4.
Жизнеспособность клеток EA.hy926 после 24-часовой инкубации со стандартными разведениями 1.7 ммоль/л раствора АОТ в 8 ммоль/л KNO3. $\Delta V_{4}^{{{\text{мон}}}}$ – снижение жизнеспособности клеток при разбавлении, соответствующем концентрации НЧС 4 мкг/мл. * – значения, достоверно отличающиеся от контроля по воде (p < 0.05).

Видно, что жизнеспособность клеток в этом случае не демонстрирует резкого падения в области больших концентраций наночастиц, как это наблюдалось в эксперименте с раствором 3-НЧС. Снижение жизнеспособности клеток при данном разведении (Vn) по сравнению с контролем (по воде) позволяет оценить цитотоксичность только мономеров АОТ; в качестве примера на рисунке показано изменение жизнеспособности клеток после инкубации с раствором АОТ в разведении, соответствующем концентрации наночастиц 4 мкг/мл: $\Delta V_{4}^{{{\text{мон}}}}$ = 100% – V4.
Далее повторяли исследование цитотоксичности раствора 3-НЧС с корректным контролем токсичности стабилизатора, т.е. используя 3 ммоль/л раствор АОТ в 8 ммоль/л KNO3 (АОТ–KN). Результаты для клеток эндотелия показаны на рис. 5. Видно, что общий характер изменения жизнеспособности клеток с концентрацией АОТ при действии AOT–KN не изменился (ср. с рис. 2б), но абсолютные значения жизнеспособности стали меньше, что указывает на бóльшую токсичность этого стабилизатора. Контрольные эксперименты с 8 ммоль/л KNO3 не выявили какой-либо токсичности этого раствора во всем исследованном диапазоне. Поэтому можно предположить, что увеличение токсичности АОТ вызвано изменением соотношения между мономерами и мицеллами в исходном растворе AOT–KN.
Рис. 5.
Жизнеспособность клеток EA.hy926 после 24-часовой инкубации с 3-НЧС и с раствором 3 ммоль/л АОТ в 8 ммоль/л KNO3 (AOT–KN). На примере концентрации НЧС 4 мкг/мл показан вклад стабилизатора в общую токсичность раствора ($\Delta V_{4}^{{{\text{общ}}}}$) как сумма вкладов мономеров ($\Delta V_{4}^{{{\text{мон}}}}$) и мицелл ($\Delta V_{4}^{{{\text{миц}}}}$ ) АОТ. Все значения в опыте достоверно отличались от контроля по воде (p < 0.01).
Теперь возможно определить вклад мицелл, ΔVмиц, используя данные, полученные при корректном контроле действия раствора АОТ (рис. 5). Для каждой концентрации наночастиц вклад мицелл АОТ можно найти как разность между суммарным эффектом раствора АОТ и эффектом только мономеров, найденным из данных рис. 4. В примере, показанном на рис. 5, вклад мицелл при концентрации наночастиц 4 мкг/мл (3 ммоль/л АОТ, разбавленный в 27 раз), равен $\Delta V_{4}^{{{\text{миц}}}}$ = $\Delta V_{4}^{{{\text{общ}}}}$ – $\Delta V_{4}^{{{\text{мон}}}}$. Найденные подобным образом вклады мономеров и мицелл для всех исследованных концентраций наночастиц приведены в табл. 1. Зависимости этих вкладов от концентрации наночастиц (и соответствующих концентраций стабилизатора) представлены на рис. 6.
Рис. 6.
Вклады мономеров и мицелл АОТ в токсический эффект АОТ по отношению к клеткам EA.hy926 при различных концентрациях НЧС. Использованы данные из табл. 1; ΔV – общий вклад АОТ в токсичность НЧС при стандартных разведениях; ΔVмон и ΔVмиц – вклад соответственно мономеров и мицелл АОТ в общую токсичность раствора НЧС.
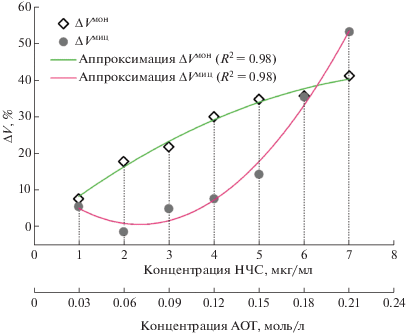
Отметим, что изменения жизнеспособности клеток под действием мономеров и мицелл имеют разный вид, что указывает на возможное различие в механизме их взаимодействия с клетками. Точнее говоря, эти два набора экспериментальных точек аппроксимируются экспонентами, причем в случае мицелл экспонента имеет явную тенденцию к резкому подъему в области высоких концентраций АОТ, тогда как в случае мономеров в той же области наблюдается постепенное увеличение значений ΔVмон и экспонента имеет тенденцию к выполаживанию. По нашему мнению, этот результат можно рассматривать как указание на различие в механизме действия на клетки между этими двумя формами ПАВ. Подобный же вид имели аналогичные зависимости для клеток Jurkat [23], но абсолютные величины вкладов каждой формы отличались от найденных для эндотелия, что может быть обусловлено зависимостью механизмов действия мономеров и мицелл от индивидуальных свойств клеточных линий.
Результаты экспериментов на фибробластах (линия FRSN). Основываясь на результатах исследований цитотоксичности 1-НЧС и 3-НЧС, проведенных ранее на клетках Jurkat, а также полученных в настоящей работе на клетках эндотелия, в экспериментах на фибробластах для определения вкладов мономеров и мицелл стабилизатора использовали раствор НЧС с концентрацией АОТ выше ККМ, а также изначально вводили описанную выше коррекцию контроля токсичности стабилизатора на увеличение ионной силы раствора наночастиц по сравнению с дистиллированной водой. Поэтому здесь использовали только раствор 3-НЧС и все измерения токсичности стабилизатора проводили на растворах АОТ в 8 ммоль/л растворе KNO3.
В процессе исследования действия растворов наночастиц и АОТ на жизнеспособность фибробластов после проведения нескольких серий экспериментов выяснилось, что здесь не удается получить необходимый уровень воспроизводимости средних значений жизнеспособности во всем диапазоне концентраций НЧС, поскольку для данной концентрации наночастиц и АОТ эти значения могут варьировать для клеток, взятых после разного числа пассажей. Для примера на рис. 7 показаны результаты измерений жизнеспособности фибробластов, взятых на 23-м и 25-м пассажах, после инкубации с растворами 3-НЧС и 3 ммоль/л АОТ, содержащими как мономеры, так и мицеллы стабилизатора.
Рис. 7.
Жизнеспособность клеток FRSN после 24-часовой инкубации со стандартными разведениями растворов 3-НЧС и 3 ммоль/л АОТ на 23-м (а) и 25-м пассаже клеток (б).
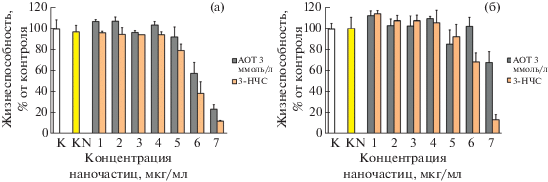
Из рисунка видно, что клетки, исследованные на 25-м пассаже, при тех же концентрациях реагентов демонстрируют меньшую чувствительность, чем взятые на два пассажа раньше. Различие в жизнеспособности клеток здесь наиболее выражено в области больших концентраций в исследованном диапазоне. Подобный результат получен также в измерениях жизнеспособности этих клеток при инкубации с раствором АОТ 1.7 ммоль/л, содержащим только мономеры (рис. 8).
Рис. 8.
Жизнеспособность клеток FRSN после 24-часовой инкубации со стандартными разведениями раствора мономеров АОТ (1.7 ммоль/л) на 23-м (а) и 25-м пассаже клеток (б).

Таким образом, согласно данным проведенных нами экспериментов реакция этих клеток на действие как наночастиц, так и стабилизатора зависит от их “возраста” – возможно, что при старении клеток их чувствительность к действию исследованных токсических агентов снижается. Для окончательного вывода планируется провести дополнительные исследования с использованием наночастиц с другими характеристиками и с другими концентрациями стабилизатора. На сегодняшний день можно лишь предположить, что, если зависимость чувствительности клеток от числа пассажей подтвердится, причиной ее могут быть комплексные изменения метаболизма клеток, которые сопутствуют старению фибробластоидных клеток в культуре; такие изменения были подробно описаны авторами этой клеточной линии [30]. Из результатов для клеток FRSN, имеющихся в настоящее время, следует, что они, возможно, в среднем менее чувствительны к действию растворов наночастиц и стабилизатора, чем клетки эндотелия, что видно, например, из сравнения соответствующих значений жизнеспособности на рис. 7 и 5. Однако это наблюдение носит предварительный характер и должно быть проверено в ходе дальнейших исследований на фибробластах при достаточно высокой воспроизводимости экспериментальных данных.
ЗАКЛЮЧЕНИЕ
В согласии с полученными ранее результатами для клеток Jurkat для нормальных эндотелиальных клеток человека (EA.hy926) найдено подобное же различие в характере изменений токсичности мономеров и мицелл АОТ с изменением его общей концентрации в растворе, что подтверждает вывод о различии механизмов токсического действия двух разных форм этого поверхностно-активного вещества. Таким образом, в исследовании действия растворов наночастиц на культивируемые клетки разного типа предложенная нами методика позволила выявить отдельные вклады разных форм существования ПАВ в водном растворе и тем самым расширить набор факторов, которые следует учитывать в исследованиях механизма цитотоксичности растворов наночастиц.
Для фибробластоидных клеток линии FRSN наблюдаются изменения жизнеспособности клеток со временем; возможно, такой эффект обусловлен специфическими свойствами данной клеточной линии, которые описаны ее авторами. Поскольку для определения отдельных вкладов мономеров и мицелл по используемой здесь методике существенную роль играет воспроизводимость результатов измерения жизнеспособности клеток, на данном этапе для клеток FRSN оказалось невозможным определить вклады разных форм стабилизатора. Планируется продолжить апробацию предложенного способа разделения вкладов разных форм ПАВ на этой и других клеточных культурах, что позволит, как мы полагаем, продвинуться в понимании механизмов токсического действия растворов наночастиц, стабилизированных поверхностно-активными веществами, на клетки in vitro.
В целом результаты нашей работы подтверждают важность высказанных ранее соображений [23, 24] о необходимости учета действия мицелл ПАВ в исследованиях механизмов цитотоксичности как растворов наночастиц, стабилизированных ПАВ, так и водных растворов самих ПАВ, применяемых в практической медицине.
Список литературы
Lara H.H., Garza-Treviño E.N., Ixtepan-Turrent L., Singh D.K. // J. Nanobiotechnology. 2011. V. 9. № 1. P. 30. https://doi.org/10.1186/1477-3155-9-30
Monteiro D.R., Gorup L.F., Takamiya A.S. et al. // Int. J. Antimicrobial Agents. 2009. V. 34. № 2. P. 103. https://doi.org/10.1016/j.ijantimicag.2009.01.017
Rai M., Yadav A., Gade A. // Biotechnol. Adv. 2009. V. 27. № 1. P. 76. https://doi.org/10.1016/j.biotechadv.2008.09.002
Егорова Е.М., Кубатиев А.А., Швец В.И. Биологические эффекты наночастиц металлов. М.: Наука, 2014. 350 с.
Conde J., Doria G., Baptista P. // J. Drug Delivery. 2012. V. 2012. ID 751075. https://doi.org/10.1155/2012/751075
Ong C., Lim J.Z.Z., Ng C.-T. et al. // Curr. Med. Chem. 2013. V. 20. № 6. P. 772. https://doi.org/10.2174/0929867311320060003
Wei L., Lu J., Xu H. et al. // Drug Discovery Today. 2015. V. 20. № 5. P. 595. https://doi.org/10.1016/j.drudis.2014.11.014
Johnston H.J., Hutchison G., Christensen F.M. et al. // Crit. Rev. Toxicol. 2010. V. 40. № 4. P. 328. https://doi.org/10.3109/10408440903453074
Hadrup N., Lam H.R. // Regul. Toxicol. Pharm. 2014. V. 68. № 1. P. 1. https://doi.org/10.1016/j.yrtph.2013.11.002
Ahmed K.B.R., Nagy A.M., Brown R.P. et al. // Toxicol. In Vitro. 2017. V. 38. P. 179. https://doi.org/10.1016/j.tiv.2016.10.012
Lémery E., Briançon S., Chevalier Y. et al. // Colloids Surf. A. 2015. V. 469. P. 166. https://doi.org/10.1016/j.colsurfa.2015.01.019
Seweryn A. // Adv. Colloid Interface Sci. 2018. V. 256. P. 242. https://doi.org/10.1016/j.cis.2018.04.002
Gong Y., Wen A., Cheung D. // Antiviral Res. 2001. V. 52. № 1. P. 25. https://doi.org/10.1016/S0166-3542(01)00156-5
Inácio Â.S., Mesquita K.A., Baptista M.et al. In vitro surfactant structure-toxicity relationships: Implications for surfactant use in sexually transmitted infection prophylaxis and contraception. PLoS One. 2011. V. 6. № 5. e19850. https://doi.org/10.1371/journal.pone.0019850
Inácio Â.S., Nunes A., Milho C. et al. // Antimicrobial Agents and Chemotherapy. 2016. V. 60. № 6. P. 3323. https://doi.org/10.1128/AAC.00166-16
Wang S., Lu W., Tovmachenko O. et al. // Chem. Phys. Lett. 2008. V. 463. № 1–3. P. 145. https://doi.org/10.1016/j.cplett.2008.08.039
Ying E., Hwang H.-M. // Sci. Total Environ. 2010. V. 408. № 20. P. 4475. https://doi.org/10.1016/j.scitotenv.2010.07.025
Vrček I.V., Pavičića I., Crnković T. et al. // RSC Advances. 2015. V. 5. № 87. P. 70787. https://doi.org/10.1039/C5RA14100A
Zhang Y., Newton B., Lewis E. et al. // Toxicol. In Vitro. 2015. V. 29. № 4. P. 762. https://doi.org/10.1016/j.tiv.2015.01.017
Zhang Y., Li X., Yu H. // J. Environ. Sci. Health. C. 2016. V. 34. № 3. P. 204. https://doi.org/10.1080/10590501.2016.1202762
Egorova E.M., Kaba S.I., Tlupova S.A. // Adv. Nanotechnology. New York, Nova Science Publishers, 2016. V. 15. P. 25.
Каба С.И., Соколовская А.А., Тлупова З.А., Егорова Е.М. // Патогенез. 2016. Т. 14. № 3. С. 31.
Egorova E.M., Kaba S.I. // Toxicol. In Vitro. 2019. V. 57. P. 24. https://doi.org/10.1016/j.tiv.2019.03.006
Егорова Е.М., Кубатиев А.А. Нанотехнологии: методология исследований действия наночастиц металлов на биологические объекты. М.: Юрайт, 2020. 188 с.
Каба С.И., Егорова Е.М. // Патогенез. 2019. Т. 17. № 4. С. 63. https://doi.org/10.25557/2310-0435.2019.04.63-68
Егорова Е.М., Кубатиев А.А., Швец В.И. // Биологические эффекты наночастиц металлов. М.: Наука, 2014. С. 159.
Егорова Е.М., Сосенкова Л.С. Способ получения водных растворов наночастиц серебра с природным восстановителем. Патент РФ № 2618270, приоритет от 01.06.2016 г.
Tanford C. The hydrophobic effect. Formation of micelles and biological membranes. New York: Wiley, 1980. 232 p.
Егорова Е.М., Каба С.И. // Патологическая физиология и экспериментальная терапия. 2018. Т. 62. № 4. С. 269.
Крылова Т.А., Мусорина А.С., Кольцова А.М. и др. // Цитология. 2018. Т. 60. № 4. С. 262. https://doi.org/10.31116/tsitol.2018.04.04
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии