Российские нанотехнологии, 2020, T. 15, № 6, стр. 824-832
СИНЕРГИЗМ ЦИТОПАТИЧЕСКОГО ДЕЙСТВИЯ СИНХРОТРОННОГО ИЗЛУЧЕНИЯ И НАНОЧАСТИЦ ОКСИДА МАРГАНЦА НА РОСТ in vitro КЛЕТОК ГЛИОБЛАСТОМ ЧЕЛОВЕКА
И. А. Разумов 1, 4, *, С. Ю. Троицкий 2, Е. Л. Завьялов 1, 4, О. И. Соловьева 1, 4, Б. Г. Гольденберг 3, А. А. Легкодымов 3, А. Г. Лемзяков 3, К. Е. Купер 3
1 ФИЦ Институт цитологии и генетики СО РАН
Новосибирск, Россия
2 Институт катализа им. Г.К. Борескова СО РАН
Новосибирск, Россия
3 Институт ядерной физики им. Г.И. Будкера СО РАН
Новосибирск, Россия
4 Новосибирский государственный университет
Новосибирск, Россия
* E-mail: razumov@bionet.nsc.ru
Поступила в редакцию 08.09.2020
После доработки 08.09.2020
Принята к публикации 01.10.2020
Аннотация
Исследовано in vitro бинарное цитопатическое действие (ЦПД%) синхротронного излучения (СИ) и наночастиц оксида марганца (НЧ MnO) на клеточные линии U87MG, U-251MG и A-172 глиобластом человека. После инкубации клеток с НЧ MnO в концентрации 5 и 50 мкмоль в течение 18–24 ч проводилось облучение клеток глиобластом на источнике СИ ВЭПП-4. Использовались дозы облучения рентгеновскими лучами 0, 1, 2, 4 Гр. Результаты оценивали с помощью световой микроскопии, определения ЦПД% на счетчике (Countess, Invitrogen) и клоногенного теста. Выявлено, что предварительная инкубация клеточных линий глиобластом с НЧ MnO вызывает увеличение ЦПД внешнего СИ в дозе 1, 2 и 4 Гр на клетки глиобластом на 25, 50, 100%. Этот эффект позволяет снизить дозу облучения в 2–3 раза, сохранив эффективность воздействия. При этом период жизнедеятельности опухолевых клеток при совместном воздействии СИ и НЧ сокращается на 18–36 ч. Синергизм комбинации НЧ MnO и СИ, вероятно, предоставит новые возможности для разработки модели лечения опухолей головного мозга.
ВВЕДЕНИЕ
Радиотерапия является необходимым общепринятым методом лечения онкологических заболеваний, хотя избыточное радиационное воздействие остается пагубным для людей. В случае глиобластомы – злокачественной агрессивной опухоли головного мозга – применяется адъювантная радиохимиотерапия [1, 2]. Однако эффективность существующей схемы лечения остается недостаточной, а заболевание – неизлечимым [3, 4]. При этом стоимость лечения опухолей головного мозга имеет самые высокие значения по сравнению с расходами на медицинскую помощь при любой другой опухоли [5]. Насущная необходимость разработки и внедрения новых диагностических подходов и препаратов для лечения глиом не вызывает сомнения.
Методы лучевой терапии [6, 7] получили существенный импульс к развитию благодаря созданию источников высокоэнергетического излучения, а также разработке инструментов, обеспечивающих точную локализацию и строгое дозирование времени радиотерапевтического воздействия. Кроме того, активно развивается такое направление оптимизации лучевых методов, как разработка способов искусственного управления радиочувствительностью здоровых и опухолевых тканей с помощью различных модифицирующих агентов избирательного действия [8], и наибольшей эффективности радиотерапия пока достигает при ее сочетании с химиотерапией [9].
Вместе с тем аналогичные результаты были показаны при применении лучевой терапии на фоне введения наночастиц (НЧ) оксида золота или серебра в культуру опухолевых клеток U251 и в мышей в модели ортотопической ксенотрансплантации [10–12]. Причем наибольшей эффективности и увеличения сроков жизни животных удалось достичь при сочетании облучения и введения НЧ Ag. Однако негативные эффекты высоких доз облучения остаются актуальными.
В последнее время нанотехнологии рассматриваются в качестве нового инструмента для применения в диагностике и лечении злокачественных опухолей благодаря способности раковых клеток активно захватывать и аккумулировать НЧ [13]. Наночастицы также используются в разработке новых подходов по адресной доставке лекарственных средств в опухолевые клетки, что может служить платформой для разработки новых вариантов тераностики и комбинированной терапии с последующим мониторингом заболевания [14]. Большой интерес представляют частицы оксидов марганца, НЧ которых и их коньюгаты могут быть использованы в качестве контрастных агентов для обнаружения и диагностики опухолей, а также доставки и распределения препаратов в организме и опухолях и улучшенной in vivo химиотерапии опухолей [15, 16].
В [17] были получены предварительные данные по использованию синхротронного излучения (СИ) против линии клеток U-87MG в сочетании с насыщением этих клеток НЧ MnO. Эти НЧ использовались в магнитно-резонансной томографии при визуализации ксенографтов-U-87MG у иммунодефицитных животных [18]. Согласно [19] НЧ MnO обладают высокой избирательной цитотоксичностью против клеток глиобластом in vitro. Исходя из анализа результатов предполагаем, что такая комбинация НЧ и СИ может вызвать синергический эффект, основанный на образовании активных радикалов при введении НЧ MnO, чей окислительный эффект будет усилен СИ в малых дозах. Наличие такого эффекта, вероятно, позволит снизить дозу облучения для уничтожения опухолевых клеток.
В связи с этим цель данной работы – изучение in vitro совместных цитотоксических эффектов воздействия СИ и НЧ MnO на клеточные линии глиобластом человека U87MG, U-251MG и A-172.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клеточные линии глиобластомы человека, U87MG (ATCC HTB 14), U-251MG, A-172 (КККП, Санкт-Петербург), и диплоидный штамм ФЭЧ-15 (ККК ГНЦВБ Вектор), которые поддерживались и хранились в криобанке ЦКП “SPF-виварий” ИЦиГ СО РАН, размораживали и культивировали в течение 5–7 пассажей на среде DМЕМ\F12 с 10%-ной фетальной сывороткой (FBS) фирмы “Invitrogen”.
Синтез НЧ MnO и определение концентрации моноядерных соединений Mn2+в растворе. Наночастицы MnO (ФИЦ “Институт катализа им. Г.К. Борескова СО РАН”) синтезировали методом гидролиза солей марганца путем медленного добавления в водный раствор MnSO4 (0.5 М) раствора NaOH (1 M) при температуре 20°С и энергичном перемешивании на магнитной мешалке. Вливание щелочи прекращали при достижении значения pH = 8.4 и сохранении этого значения в течение 5 мин при отклонениях рН не более 0.1. Конечная концентрация соединений марганца(II) в водной суспензии НЧ MnO составляла 0.4 M. Измерение концентрации соединений марганца проводили методом атомной эмиссионной спектроскопии на приборе Optima 4300 DV (Perkin Elmer). Анализ содержания моноядерных соединений Mn2+ проводили после отделения суспензии НЧ MnO от раствора центрифугированием с последующим разбавлением аликвоты маточного раствора разбавленной серной кислотой.
Определение размеров НЧ MnO методом малоуглового рентгеновского рассеяния (МУРР). Для получения данных МУРР использовали дифрактометр S3 MICRO (HECUS) с точечной коллимацией и медным излучением (CuKα, 50W). Измерения рентгенограмм проводили в интервале векторов q от 0.01 до 0.6 Å–1, где q = 4πsinθ/λ. Для обработки экспериментальных данных и распределения частиц по размерам применяли пакет программ ATSAS [20], где использовали описание малоугловых данных набором полидисперсных сфер.
Наночастицы. В работе использовали и коммерческие препараты, НЧ SiO2 (как отрицательный контроль на токсичность НЧ) и НЧ Mn2O3 (US Research Nanomaterials, Inc), а также раствор хлорида марганца MnCl2 (Sigma-Alderich) как источник ионов Mn2+ и позитивный контроль на токсичность.
Облучение клеток с использованием СИ. Экспозицию клеток проводили на станции “Фазово-контрастной рентгеновской микроскопии и томографии”, использующей СИ из семиполюсного вигглера, установленного на ускорителе заряженных частиц ВЭПП-4М (ИЯФ СО РАН, Новосибирск) [21]. Для измерения поглощенной дозы в исследуемых клетках использовали рентгеночувствительную пленку GAFCHROMIC HD-810. Калибровочная кривая для прозрачности дозиметрической пленки GAFCHROMIC HD-810 при СИ приведена в [17]. Для привязки полученных результатов к абсолютным значениям интенсивности СИ использовали колориметр полного внутреннего поглощения, позволяющий измерять мощность рентгеновского излучения с точностью не хуже 1% [22].
Определение цитопатического действия (ЦПД) синхротронного облучения и НЧ MnO на культуры клеток. Изучение цитотоксической активности проводили, руководствуясь данными [23]. Для определения цитотоксических эффектов в ростовую среду культур клеток вносили пробы НЧ в соответствующих разведениях, используя среду DМЕМ\F12 в качестве разбавителя. Клетки культивировали с НЧ в течение 18–24 ч при 37°С. Определение ЦПД% различных факторов на клетки проводили через 1, 18, 36, 54, 72, 90 и 108 ч после воздействий. ЦПД оценивали в результате визуального осмотра с использованием светового микроскопа Zeiss Primo Vert и подсчета доли погибших клеток на счетчике (Countess, Invitrogen), согласно инструкции производителя, после чего вычисляли среднее значение. При достижении ЦПД в контрольных образцах (без воздействия НЧ и облучения) больше 15% эксперимент прекращали.
Клоногенный тест. После облучения клетки отмывали буфером, снимали трипсином и высевали по 200 клеток в четыре ряда 96-луночного планшета (шесть клеток в лунку) в трех повторах. Планшеты инкубировали в CO2-инкубаторе и контролировали состояние и количество клеток в колониях. На 21-е сутки, когда колонии достигали достаточного размера (не менее 50 клеток), их фиксировали 10%-ным формалином (Panreac AppliChem, Германия) и окрашивали раствором Гимза (Sigma, США) [24]. Эффективность клонирования клеток в контрольной группе принимали за 100%. В экспериментальных группах эффективность клонирования определяли как процент от клонирования в контрольной группе. Подсчет проводили при помощи светового инвертированного микроскопа Zeiss Primo Vert (Германия). В связи с низкой эффективностью клонирования клеток A-172 провести клоногенный тест для этой линии было невозможно.
Статистический анализ. Разницу между опытными группами проводили с использованием непараметрических методов анализа данных в программе STATISTICA 10 StatSoft Inc.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Свойства используемого препарата НЧ MnО. Оценку содержания ионов Mn2+ в препарате НЧ MnО, используемом в работе, проводили методом атомной эмиссионной спектроскопии. В результате было обнаружено, что раствор содержит свободные моноядерные соединения Mn в концентрации менее 2 × 10–4 М, т.е. в следовых количествах, недостаточных для проявления токсического эффекта.
Размеры НЧ играют значительную роль в проявлении биологических эффектов. Результаты анализа спектра МУРР суспензии НЧ MnO представлены на рис 1. Как видно на рисунке, наибольшее количество НЧ имело диаметр ~8–10 нм (8 ± 3 нм). Второй максимум в распределении НЧ наблюдался в районе 30 нм, что соответствует агрегированным частицам, в которых одна НЧ диаметром около 10 нм окружена, по-видимому, слоем таких же частиц, как наблюдалось в полиядерных комплексах Pd(II) [25]. При этом максмальный размер таких комплексов из НЧ MnOx не превышал 38 нм.
Определение ЦПД на клетки глиобластомы U87MG под воздействием СИ. На первом этапе клетки глиобластом U87MG облучали без обработки НЧ при дозах СИ от 1 до 160 Гр, результаты представлены на рис. 2. Цитопатические эффекты в группе клеток с поглощенной дозой 160 Гр наблюдались практически сразу. Так, в первый час после СИ было выявлено ЦПД 25% (χ2 = = 12.36, р < 0.001), далее через 36 ч обнаружено ЦПД 50% (χ2 = 45.85, р < 0.001)) и ЦПД 100% (χ2 = = 169.70, р < 0.001) через 72 ч после облучения. При поглощенной дозе 40 Гр через 72 ч обнаружено ЦПД 25% (χ2 = 12.36, р < 0.001) и ЦПД 50% (χ2 = 32.00, р < 0.001) через 90 ч после облучения. Для СИ в дозе 4 Гр цитопатические эффекты имели следующую динамику: ЦПД 15% (χ2 = 3.40, р = = 0.064) через 72 ч и ЦПД 25% через 90 ч (χ2 = = 4.77, р = 0.028). При дозе 1 Гр цитопатические эффекты облучения и скорость гибели клеток глиобластомы U87 практически не отличались от контроля без облучения в течение периода наблюдения.
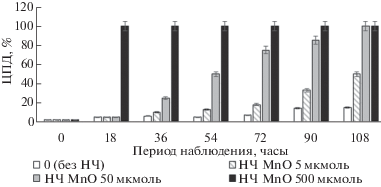
Оценка ЦПД препарата НЧ MnO на клетки U87MG. Первоначально проводили оценку токсичности препарата НЧ MnO на клетки U-87MG. Как видно на рис. 3, при оценке роста опухолевых клеток U-87MG in vitro было обнаружено ЦПД 100% (χ2 = 173.25, р < 0.001) через 18 ч при наличии в ростовой среде 500 мкмоль НЧ MnO, а при дозе НЧ 50 мкмоль выявлено ЦПД 85% (χ2 = 98.00, р < < 0.001) через 90 ч культивирования после добавления НЧ. В момент закрытия эксперимента, через 108 ч, количество погибших клеток составило ЦПД 100% (χ2 = 140.53, р < 0.001) при дозе 50 мкмоль, ЦПД 50% (χ2 = 26.34, р < 0.001) при дозе 5 мкмоль и ЦПД 15% в контроле без облучения. Исходя из полученных результатов, дозы 5 и 50 мкмоль НЧ MnO можно обозначить как НЧ-ЛД 50% и НЧ-ЛД 100%, т.е. летальные дозы, вызывающие соответственно гибель 50 и 100% клеток через 108 ч после введения в ростовую среду клеточной линии U-87MG.
Определение ЦПД на клетки глиобластомы U-87MG и нетрансформированные клетки ФЭЧ-15 при низких дозах СИ с применением НЧ. Так как синергизм наиболее полно выражается при комбинации веществ в малых дозах, а также при низких дозах облучения, СИ использовали в дозах 1, 2 и 4 Гр, чтобы более наглядно выявить наличие или отсутствие этого эффекта. Исследование совместных эффектов НЧ и доз облучения 1, 2 и 4 Гр на рост U-87MG показано на рис. 4. Так, было выявлено, что при дозе 4 Гр (рис. 4б) и концентрации НЧ MnO 50 мкмоль (НЧ-ЛД 100%) цитопатические эффекты достигали для U-87MG ЦПД 100% (χ2 = 60.63, р < 0.001) через 72 ч, когда в контроле без СИ наблюдали ЦПД 50%. При дозе СИ 1 и 2 Гр выявлено ЦПД 100% (χ2 = 23.38, р < 0.001) опухолевых клеток через 90 ч, когда в контроле без СИ наблюдали ЦПД 75%.
Рис. 4.
Определение совместного ЦПД на опухолевые клетки U87MG низких доз СИ и инкубации клеток с НЧ MnO в дозах 5 и 50 мкмоль.
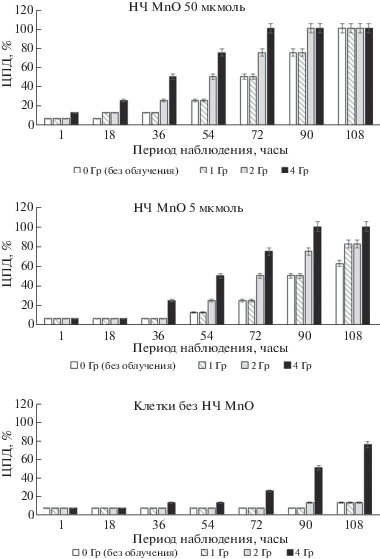
При уменьшении концентрации НЧ MnO до 5 мкмоль (НЧ-ЛД 50%) цитопатические эффекты совместного действия были выражены более наглядно. Так, при дозе 4 Гр и 5 мкмоль НЧ MnO (НЧ-ЛД 50%) наступало ЦПД100% (χ2 = 60.63, р < 0.001) через 90 ч (в контроле без СИ ЦПД 50%). А при дозе 2 Гр и 5 мкмоль НЧ MnO наблюдали ЦПД 75% (χ2 = 12.28, р < 0.001) через 90 ч (в контроле без СИ ЦПД 50%). При дозе 1 Гр и 5 мкмоль НЧ MnO через 108 ч также была выявлена разница в эффектах: ЦПД 75% (χ2 = 4.46, р = = 0.034) при совместном воздействии и в контроле без СИ ЦПД 60%.
При выявлении совместных эффектов НЧ и облучения (при дозах 2 и 4 Гр) на клетки с нормальным генотипом ФЭЧ-15 (рис. 5) обнаружено, что НЧ MnO в концентрации 50 мкмоль не оказывали выраженного токсического действия на эти клетки. В результате при дозах облучения 2 и 4 Гр* и при совместных воздействиях НЧ и облучения скорость или динамика гибели клеток ФЭЧ-15 практически не отличались от контроля. Кроме того, при проведении подобных экспериментов с применением коммерческих НЧ Mn2O3 (100 мкмоль), НЧ SiO2 (1000 мкмоль) и раствора солей MnCl2 (500 мкмоль) в дозах, превышающих используемые концентрации НЧ MnO, эффекта усиления ЦПД при облучении U87 клеток не обнаружено.
Рис. 5.
Определение ЦПД на нормальные клетки ФЭЧ-15 при дозах облучения 2 и 4 Гр и инкубации клеток с НЧ MnO в дозе 50 мкмоль.

Итак, в опытах in vitro установлено отсутствие цитотоксического воздействия изученных НЧ MnO на нормальные клетки человека ФЭЧ-15 при введении в среду для культивирования 50 мкмоль (ЛД100% для клеток U-87) этих НЧ. Данный факт позволяет надеяться на минимальный цитотоксический эффект НЧ MnO на нормальные или нетрансформированные клетки.
Определение ЦПД при совместном действии НЧ MnO и СИ на клетки U-87, A-172 и U-251 глиобластом человека. В последующих экспериментах спектр облучаемых культур клеток расширили и использовали клетки трех глиобластом человека U-87, A-172 и U-251. Кроме того, несколько изменили процесс определения цитолиза клеток при инкубации с НЧ и последующего облучения синхротроном. После предварительной инкубации клеток с НЧ MnO в течение 18–24 ч до облучения удаляли среду с НЧ, проводили однократную промывку клеток раствором Дульбекко и добавляли свежую ростовую среду (содержание сыворотки 5%) без НЧ. Как видно из полученных данных (рис. 6), на клетках всех трех линий глиобластом, U-87, A-172 и U-251, выявлен эффект усиления воздействия на цитолиз опухолевых клеток СИ при предварительном добавлении в среду НЧ MnO. Вместе с тем выявлены некоторые особенности цитолиза (относительно U-87) клеток глиобластом A-172 и U-251 при совместном воздействии СИ и НЧ. Так, для клеток A-172 выявлен ускоренный эффект совместного воздействия НЧ MnO (50 мкмоль) и дозы СИ 4 Гр, когда ЦПД 100% (χ2 = 149.73, р < 0.001) клеток было обнаружено через 72 ч, тогда как отдельные эффекты НЧ MnO (50 мкмоль) и дозы СИ 4 Гр оказали ЦПД 50% (χ2 = 32.00, р < 0.001) на клетки. Для клеток U-251 также была выявлена повышенная чувствительность к совместному воздействию. Так, после инкубации с НЧ и СИ (НЧ+, СИ+) в той же дозе эффект ЦПД 100% (χ2 = = 149.73, р < 0.001) был обнаружен через 90 ч, тогда как эффект СИ 4 Гр в пробе (СИ+, НЧ–) ЦПД составил приблизительно 50% (χ2 = 32.00, р < < 0.001), а при воздействии НЧ MnO (50 мкмоль) ЦПД составило 37% (χ2 = 15.56, р < 0.001) за этот период.
Рис. 6.
Определение суммарного влияния облучения и предварительной инкубации клеток с НЧ MnO на цитолиз опухолевых клеток глиом U-87, A-172 и U-251.
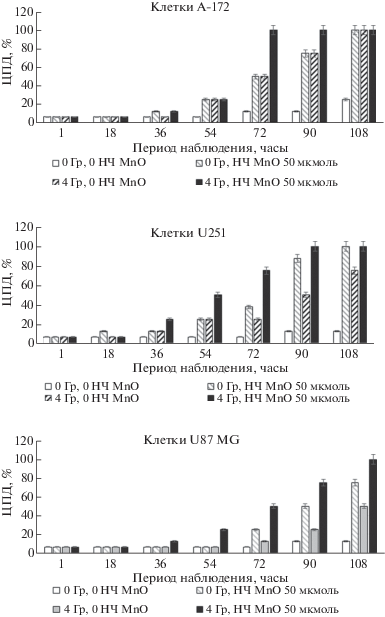
По-видимому, имеет место усиленный цитотоксический эффект на клетки глиом U-87, A-172 и U-251, вызванный совместным воздействием СИ и предварительного введения НЧ MnO в ростовую среду.
Клоногенный тест позволяет определять жизнеспособность и репродуктивную функцию клеток спустя продолжительное время (10–21 день) после воздействия на клетки [24]. Результаты (рис. 7), полученные методом клонирования в течение трех недель, показали, что оба исследуемых воздействия, СИ и НЧ MnO, раздельно оказывали значительное влияние на жизнеспособность и пролиферативную активность клеток глиобластом U87 и U251 (рис. 7). Так, после облучения клеток глиобластомы U87, поглощенная доза СИ для которых была равна 4, 2 и 1 Гр, доля выживших клеток через 21 сутки после облучения составила 12.2% (χ2 = 149.73, р < 0.001), 49.0% (χ2 = = 62.39, р < 0.001) и 85.7% (χ2 = 11.48, р < 0.001) (рис. 7) соответственно. Определение клоногенной активности клеток U-251 после обработки СИ в дозе 4 Гр выявило 14.5% (χ2 = 39.25, р < < 0.001) выживших опухолевых клеток, образующих колонии. Введение в ростовую среду клеток U-87 наночастиц MnO в дозе 50 и 5 мкмоль также не вызывало 100%-ной гибели клеток, доля пролиферирующих клеток U87 составила 4.1% (χ2 = = 176.87, р < 0.001) и 18.4% (χ2 = 131.80, р < 0.001) соответственно.
Рис. 7.
Определение методом клонирования влияния минимальных доз облучения и предварительной инкубации клеток с НЧ MnO на выживаемость опухолевых клеток глиом U-87 (а) и U-251(б).

Вместе с тем в результате совместного воздействия при облучении клеток U87 дозой 4 Гр доля выживших клеток, предварительно проинкубированных с НЧ MnO 50 и 5 мкмоль в среде, снизилась более чем в 4 и 3 раза (относительно воздействия НЧ MnO) соответственно. Относительно результатов воздействия СИ доля выживших клеток уменьшилась более чем в 12 и 6 раз и составила 0% (χ2 = 8.22, р = 0.004) и 2% (χ2 = 6.22, р = 0.012).
Аналогичная ситуация наблюдалась при облучении (СИ 4 Гр) клеток U251, которые также предварительно инкубировались с НЧ MnO 50 мкмоль в среде, доля выживших клеток снизилась более чем в 6.5 раза и составила 0% (χ2 = 2.36, р = 0.123) относительно воздействия НЧ MnO и в 14.5 раза и составила 0% (χ2 = 10.37, р = 0.001) относительно СИ.
Итак, в результате совместного воздействия на эти клетки СИ в дозе 4 Гр и наночастиц в дозе 50 мкмоль выявлена 100%-ная летальность клеток U-87 (χ2 = 8.22, р = 0.004) и U-251 (χ2 = 9.27, р = 0.001). Полученные данные клоногенного теста также указывают, что совместное влияние СИ и НЧ MnO вызывает эффект синергизма (усиления) цитотоксического воздействия на клеточные линии глиом головного мозга человека.
Отметим, что онкогенез мозга, в частности, при развитии глиом, как правило, связывают с окислительным стрессом, который отражается в дисбалансе между продукцией свободных радикалов и антиоксидантными механизмами. Когда существующее равновесие окислителей и антиоксидантов в опухолевой клетке нарушается, свободные радикалы запускают перекисное окисление липидов клеточных мембран, окисление белков и ДНК, что вызывает цитолиз опухолевых клеток [26]. Исходя из этого, предполагаем, что НЧ MnO запускают окислительный стресс, а СИ даже при малых дозах 1–2 Гр вызывает полный дисбаланс между продукцией свободных радикалов и антиоксидантными механизмами, что усиливает различные патологические реакции в опухолевых клетках и при некоторых условиях вызывает 100%-ную летальность. Вероятно, выявленный эффект синергизма позволит воздействовать на опухолевые стволовые клетки и добиться 100%-ной летальности этих клеток. В популяции опухоли они представлены 2–10% клеток, считаются устойчивыми к облучению и химиотерапии и являются источником рецидивов [27].
ЗАКЛЮЧЕНИЕ
На клетках всех трех линий глиобластом, U-87, A-172 и U-251, выявлен эффект усиления воздействия на цитолиз опухолевых клеток СИ при предварительном добавлении в среду НЧ MnO. Эффект усиления или синергизма совместного воздействия выражался в более раннем выявлении 50 или 100%-ного ЦПД на опухолевые клетки или обнаружении такого цитолиза при более низких дозах СИ. Так, в ходе работы было выявлено, что при низких дозах (1–2 Гр) облучения клеток глиом U-87, A-172 и U-251, предварительно культивируемых 18–24 ч с НЧ MnO, эффект ЦПД был на 25–100% больше и проявлялся на 18–36 ч раньше. Данный суммарный эффект, по-видимому, подтверждает, что, используя предварительную инкубацию клеточных линий глиобластом с цитотоксичными НЧ MnO, можно снизить дозу облучения с 4 Гр до 1–2 Гр при том же эффекте ЦПД на опухолевые клетки глиом. Отметим, что выявленный in vitro высокий уровень цитотоксического воздействия на клетки злокачественных опухолей головного мозга человека совместного действия СИ и введения НЧ MnO указывает на перспективность использования полученных данных для разработки нового комбинированного подхода для противоопухолевой терапии глиом человека. Для выяснения всех возникающих вопросов необходимы дальнейшие исследования. Разработка и оценка выявленного эффекта на модели подкожной и ортотопической ксенотрансплантации клеток глиобластом человека иммунодефицитным SCID мышам будут продолжены.
Исследования выполнены при поддержке Мин-обрнауки РФ (проект № 0324-2019-0041, уникальный идентификатор проекта RFMEFI62119X0023) с использованием оборудования ЦКП “Центр генетических ресурсов лабораторных животных” ФИЦ ИЦиГ СО РАН.
Исследования НЧ MnO выполнены с использованием оборудования Центра коллективного пользования “Национальный центр исследования катализаторов”.
Список литературы
Frosina G. // Crit. Rev. Oncol. Hematol. 2015. V. 96. № 2. P. 257. https://doi.org/10.1016/j.critrevonc.2015.05.013
Young R.M., Jamshidi A., Davis G., Sherman J.H. // Ann. Transl. Med. 2015 V. 9. P. 121. https://doi.org/10.3978/j.issn.2305-5839.2015.05.10
Ostrom Q.T., Gittleman H., Liao P. et al. // Neuro Oncol. 2014. V. 16. P. 1. https://doi.org/10.1093/neuonc/nou223
Ostrom Q.T., Gittleman H., Truitt G. et al. // Neuro Oncol. 2018. V. 20. P. 1. https://doi.org/10.1093/neuonc/noy131
Mariotto A.B., Yabroff K.R., Shao Y. et al. // J. Natl. Cancer. Inst. 2011. V. 103. № 2. P. 117. https://doi.org/10.1093/jnci/djq495
Noda S.E., El-Jawahri A., Patel D. et al. // Semin. Radiat. Oncol. 2009. V. 19. № 3. P. 171. https://doi.org/10.4103/0971-5851.103142
Khan L., Soliman H., Sahgal A. et al. // Cochrane Database Syst. Rev. 2016. V. 19. № 8. P. 1. https://doi.org/10.1002/14651858.CD011475.pub2
Calugaru V., Magné N., Hérault J. et al. // Bull. Cancer. 2015. V. 102. № 1. P. 83. https://doi.org/10.1016/j.bulcan.2014.10.002
Stepanovic A., Nikitovic M. // J. BUON. 2018. V. 23. № 1. P. 7.
Yamada M., Foote M., Prow T.W. // Wiley Interdiscip Rev. Nanomed. Nanobiotechnol. 2015. V. 7. № 3. P. 428. https://doi.org/10.1002/wnan.1322
Liu P., Jin H., Guo Z. et al. // Int. J. Nanomed. 2016. V. 11. P. 5003. https://doi.org/10.2147/IJN.S115473
Wu H., Lin J., Liu P. et al. // Biomaterials. 2016. V. 101. P. 1. https://doi.org/10.1016/j.biomaterials.2016.05.031
Raliya R., Singh C.T., Haddad K., Biswas P. // Curr. Pharm. Des. 2016. V. 22. № 17. P. 2481. https://doi.org/10.2174/1381612822666160307151409
Aftab S., Shaha A., Nadhman A. et al. // Int. J. Pharm. 2018. V. 540. P. 132. https://doi.org/10.1016/j.ijpharm.2018.02.007
Ozada C., Tekin V., Barlas F.B. et al. // Chemistry Select. 2020. V. 5. P. 1987. https://doi.org/10.1002/slct.201901620
Cai X., Zhu Q., Zeng Y. et al. // Int. J. Nanomed. 2019. V. 14. P. 8321. https://doi.org/10.2147/IJN.S218085
Kuper K.E., Zavjalov E.L., Razumov I.A. et al. // Phisics Procedia. 2016. V. 84. P. 252. https://doi.org/10.1016/j.phpro.2016.11.043
Завьялов Е.Л., Разумов И.А., Герлинская Л.А., Ромащенко А.В. // Вавиловский журнал генетики и селекции. 2015. Т. 19. № 4. С. 77. https://doi.org/10.18699/VJ15.061
Разумов И.А., Завьялов Е.Л., Троицкий С.Ю. и др. // Клеточные технологии в биологии и медицине. 2017. № 2. С. 114. https://doi.org/10.1007/s10517-017-3849-0
Petoukhov M.V., Konarev P.V., Kikhneya A.G., Svergun D.I. // J. Appl. Cryst. 2007. V. 40. P. 223. https://doi.org/10.1107/S0021889807002853
Baranov G., Borin V., Zhuravlev A. et al // J. Surface Investigation: X-ray, Synchrotron and Neutron Techniques. 2020. V. 14. P. 150. https://doi.org/10.1134/S1027451020020032
Evdokov O., Titov V., Tolochko B., Sharafutdinov M. // Nucl. Instrum. Methods. 2009. V. 603. P. 194. https://doi.org/10.1016/j.nima.2009.03.001
Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ // Ред. совет Фисенко В.П. (пред.) и др. М. ЗАО “ИИА “Ремедиум” 2000. 398 с.
Franken N.A.P., Rodermond H.M., Stap J. et al. // Nature Protocols. 2006. V. 1. № 5. P. 2315. https://doi.org/10.1038/nprot.2006.339
Troitskii S.Y., Chuvilin A.L., Kochubei D.I. et al. // Russ. Chem. Bull. 1995. V. 44. № 10. P. 1822. https://doi.org/10.1007/BF00707203
Ramírez-Expósito M.J., Martínez-Martos J.M. // Curr Neuropharmacol. 2019. V. 17. № 4. P 342. https://doi.org/10.2174/1570159X16666180302120925
Basati G., Khaksarian M., Abbaszadeh S. et al. // Stem Cell Investig. 2019. V. 6. № 38. P. 1. https://doi.org/10.21037/sci.2019.10.07
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии