Российские нанотехнологии, 2020, T. 15, № 6, стр. 757-763
НАНОРАЗМЕРНЫЕ ГЕТЕРОКЛАСТЕРЫ Pt–SnO2 В СОСТАВЕ ЭЛЕКТРОКАТАЛИЗАТОРОВ ДЛЯ РЕАКЦИЙ ВОССТАНОВЛЕНИЯ КИСЛОРОДА И ОКИСЛЕНИЯ МЕТАНОЛА
Д. Д. Спасов 1, 2, *, Р. М. Меншарапов 1, 3, А. А. Засыпкина 1, Н. А. Иванова 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Национальный исследовательский университет “Московский энергетический институт”
Москва, Россия
3 Национальный исследовательский университет “Московский физико-технический институт”
Долгопрудный, Россия
* E-mail: spasovdd@outlook.com
Поступила в редакцию 09.06.2020
После доработки 24.08.2020
Принята к публикации 24.08.2020
Аннотация
Исследованы наноструктурированные электрокатализаторы на основе платины, модифицированные диоксидом олова (SnO2), для высокоэффективного окисления спиртовой добавки (метанола) в потоке водорода для топливных элементов с твердым полимерным электролитом, эксплуатируемых в условиях низких температур до –50°С. Электрокатализаторы исследованы в реакциях восстановления кислорода (РВК) и электроокисления метанола с использованием метода вращающегося дискового электрода. Катализаторы Pt20/10wt%–SnO2/C и Pt20/C продемонстрировали более высокую активность в РВК, удельная активность составила около 0.25 мA/cм2 по сравнению с Pt40/C в 0.1 М растворе HClO4. Активность для Pt20/10wt%–SnO2/C возросла почти вдвое в растворе с концентрацией метанола 4 мас. %, что характеризует его высокую активность в реакции электроокисления метанола. Значение удельной электрохимически активной поверхности платины для Pt20/10wt%–SnO2/C составляет 58 м2/г и превышает это значение для Pt40/C (43 м2/г). Наноразмерные гетерокластеры Pt–SnO2 в составе электрокатализатора Pt20/10wt%–SnO2/C обеспечивают его высокую активность в реакции электроокисления как метанола, так и водорода, а также эффективны в качестве катализатора для анода. Высокая активность в РВК совместно с повышенной долговечностью по сравнению с катализаторами Pt40/C и Pt20/C обеспечивает их эффективность в качестве катализатора для катода топливного элемента.
ВВЕДЕНИЕ
Интенсивное развитие Арктических регионов Российской Федерации требует соответствующего обеспечения их электроэнергией [1]. Для изолированных от общероссийской электросети районов значительную роль может сыграть “зеленая” энергетика, основанная на местных источниках энергии [2]. Однако развитие автономной и возобновляемой энергии требует эффективных систем хранения/преобразования электрохимической энергии, которые способны работать при низких температурах вплоть до –50°С. Наиболее привлекательными в данных условиях являются водородно-воздушные топливные элементы с твердым полимерным электролитом (ТЭ с ТПЭ). Однако данный тип ТЭ ограничен температурой холодного пуска до –20°С [1].
В литературе широко представлены ТЭ с ТПЭ с прямым окислением метанола и этанола, работающие в условиях низких температур. Однако они обладают существенными недостатками, такими как низкие характеристики и ресурс работы по сравнению с водородно-воздушными ТЭ с ТПЭ [3–7]. Отметим, что для ТЭ с прямым окислением метанола также требуются несколько другие катализаторы и мембранно-электродные блоки (МЭБ), чем для водородно-воздушных ТЭ с ТПЭ. Для ТЭ c прямым окислением метанола наиболее традиционными являются многокомпонентные катализаторы на основе сплавов Pt–Ru [8, 9].
Новейшие исследования направлены на расширение температурного диапазона работы водородно-воздушного ТЭ за счет добавления метанола в водородное топливо для предотвращения разрушения компонентов МЭБ, связанного с замерзанием воды в мембране и толще каталитического слоя [10]. Использование спиртового компонента в качестве добавки к основному топливу (водороду) позволяет сохранить высокие характеристики водородно-воздушного ТЭ и расширить температурный диапазон пуска ТЭ вплоть до –50°С. Однако это приводит к необходимости разработки и исследования многокомпонентных гибридных электрокатализаторов, способных к эффективному окислению как спиртовой добавки, так и основного потока водорода без потери в электрохимических характеристиках ТЭ, поскольку эффективность ТЭ значительно зависит от эффективности электрокатализатора и каталитического слоя в целом.
Наиболее перспективным модифицирующим компонентом гибридных электрокатализаторов является диоксид олова [11–16]. Несмотря на интенсивное изучение катализаторов такого состава, в настоящее время уделяется недостаточно внимания разработке платиновых катализаторов для ТЭ на носителе, модифицированном SnО2. Равномерно распределенное покрытие SnО2 на поверхности углеродного носителя может также значительно повысить долговечность каталитических слоев [17–21]. Высокую прочность и активность катализаторов на основе Pt–SnO2 связывают с сильным взаимодействием металл–носитель [19–21]. Однако если углеродная поверхность полностью покрыта оксидной фазой олова, полупроводниковые свойства SnО2 резко снижают электропроводность носителя [17]. Формирование кластеров Pt–SnO2 [18] на поверхности углеродного носителя может улучшить активность катализатора в реакции восстановления кислорода (РВК) и повысить стойкость к каталитическим ядам [14].
В [22] разработали и изучили в реакции окисления этанола катализаторы на основе Pt, нанесенные на углеродную сажу, модифицированную SnO2. Использование SnО2 позволило повысить в 3 раза эффективность окисления этанола по сравнению с Pt-электрокатализаторами [23].
Основная цель представленного исследования – изучение гибридных электрокатализаторов с нанокластерами Pt–SnO2 в качестве активных центров в РВК и окисления метанола и водорода. Такие бифункциональные электрокатализаторы позволят обеспечить высокоэффективное окисление как потока водорода и спиртовой добавки на аноде ТЭ, так и долговечность катода в РВК по сравнению с катализаторами Pt/C (где С – аморфная сажа).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез электрокатализаторов. В работе синтезированы электрокатализаторы состава Pt40/C и Pt20/C (40 и 20 мас. % Pt соответственно, С – аморфная сажа марки Vulcan XC–72) и гибридный электрокатализатор состава Pt20/10wt%–SnO2/C, где добавка диоксида олова составляет 10 мас. %. Синтез электрокатализаторов Pt40/C и Pt20/C проводили методом химического восстановления H2PtCl6 в этиленгликоле (ЭГ) [24]. Синтез электрокатализатора с содержанием 10 мас. % SnO2 проводили в три стадии: первая – синтез частиц SnO2/Sn золь-гель-методом в объеме ЭГ, вторая – синтез композитного носителя SnO2(Sn)/С путем добавления в объем полученного коллоида частиц SnO2/Sn смеси углеродной сажи с бидистилированной водой и изопропиловым спиртом. Третья стадия заключается в синтезе электрокатализатора Pt20/10 wt%–SnO2/C методом восстановления хлорплатиновой кислоты в ЭГ аналогично катализаторам состава Pt/С. Подробно синтез представлен в [11].
Структурные исследования. Синтезированные электрокатализаторы исследовали методом просвечивающей электронной микроскопии (ПЭМ) с использованием микроскопа марки Titan™ 80–300 S/TEM (FEI, США) (80–300 кВ, пространственное разрешение по точкам 0.07–0.08 нм).
Методика приготовления тонкопленочных электродов. Каталитические чернила готовили по следующей методике: в бюкс добавляли 10 мг электрокатализатора и 1 мг иономера, далее добавляли водно-спиртовой раствор (2 мл бидистилированной воды и 4 мл изопропилового спирта). Полученные каталитические чернила диспергировали в ультразвуке в течение 15 мин. Электрод устанавливали в вакуумный сушильный шкаф (BINDER GmbH, Германия). Каталитические чернила наносили с помощью дозированной пипетки. Капля высушивалась под вакуумом при температуре 20°С в течение 3 мин. Масса электрокатализатора в одной капле составляла 0.06 мг.
Равномерность нанесенных пленок исследовали с помощью цифрового оптического микроскопа Levenhuk DTX 90 (Россия).
Электрохимические исследования. Электрохимические измерения проводили на установке с вращающимся дисковым электродом (ВДЭ) ВЭД-06 (Вольта, Санкт–Петербург, Россия) в стандартной трехэлектродной ячейке (рис. 1а). Площадь поверхности рабочего электрода составляла 0.12 см2. В качестве электролита использовали 0.1 М HClO4 (стандартный раствор), электрода сравнения – насыщенный хлорсеребрянный электрод Ag\AgCl\KCl, вспомогательного электрода – Pt-проволока. Измерения также проводили в 4 мас. % растворе метанола, в качестве сопутствующего электролита использовали 0.1 М HClO4. Измерения проводили с помощью потенциостата Solartron 1285 (AMETEK, Inc., Berwyn, PA, USA).
Рис. 1.
Стандартная трехэлектродная ячейка с ВДЭ (а). Оптические микрофотографии каталитической пленки на поверхности стеклоуглеродного электрода (б).
Циклические вольтамперограммы (ЦВА) регистрировали при 25 ± 2°С и скорости развертки 20 мВ/с в растворе, насыщенном N2, при атмосферном давлении аналогично методике, представленной в [11]. С помощью ЦВА рассчитывали электрохимически активную поверхность (ЭАП). Методика расчета ЭАП представлена в [25].
Регистрацию поляризационных кривых РВК проводили при различных скоростях вращения дискового электрода (500, 900, 1600 об./мин) и скорости развертки 10 мВ/с.
Расчет активности электрокатализаторов. Для измерения кинетического тока и активности электрокатализаторов использовали уравнение Коутецкого–Левича [26, 27] для поляризационного тока. Поляризационный ток складывается из кинетической и диффузионной составляющей и рассчитывается по уравнению
(1)
$\frac{1}{i} = \frac{1}{{{{i}_{k}}}} + \frac{1}{{{{i}_{d}}}} = - \frac{1}{{n{\text{F}}kC_{{{{{\text{O}}}_{2}}}}^{b}}} - \frac{1}{{0.62n{\text{F}}D_{{{{{\text{O}}}_{2}}}}^{{\frac{2}{3}}}{{\nu }^{{ - \frac{1}{6}}}}C_{{{{{\text{O}}}_{2}}}}^{b}{{{{\omega }}}^{{\frac{1}{2}}}}}}$ ,С помощью поляризационного тока рассчитывали удельную (SA) и массовую (MA) активность катализатора:
где mPt – плотность нанесения платины на электрод, мг · см–2.Вычисления проводили в программе, написанной на языке программирования Python3.7, с использованием пакетов numpy, pandas, scipy, matplotlib. Сглаживание регистрируемых поляризационных кривых проводили аппроксимацией полинома методом наименьших квадратов. Для экстраполяции графика была проведена линейная аппроксимация.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Равномерность каталитической пленки оказывает значительное влияние на форму поляризационных кривых и, как следствие, на точность определения активности электрокатализатора в РВК [27]. На рис. 1б представлены изображения каталитической пленки на основе электрокатализатора Pt40/C. Предложенная методика приготовления тонкопленочных электродов позволила получить тонкую равномерную пленку, воспроизводимую для всех исследуемых электрокатализаторов, в которой отсутствуют крупные агломераты частиц, поры и дефекты.
Результаты структурных исследований. На рис. 2 представлены ПЭМ-изображения для образцов Pt20/C и Pt20/10 wt%–SnO2/C. Средний размер Pt-частиц составляет 3.1 нм для Pt20/C и 3.5 нм для Pt20/10 wt%–SnO2/C, средний размер частиц SnO2 ~ 4.5 нм. Морфология всех образцов характеризуется наличием агломератов. Структура катализатора Pt20/10 wt%–SnO2/C характеризуется равномерным распределением наноразмерных гетерокластеров Pt–SnO2 на поверхности углеродного носителя.
Результаты электрохимических исследований. На рис. 3а изображены ЦВА образцов Pt40/C, Pt20/C и Pt20/10 wt%–SnO2/C, зарегистрированные в стандартном растворе. ЭАП платины для образцов Pt40/C и Pt20/С составляет 43 и 80 м2/г соответственно. Данные значения соотносятся с результатами исследований коммерческих катализаторов аналогичного состава [29, 30]. Это гарантирует достаточную эффективность синтезированных образцов в сравнении с мировыми аналогами. Поскольку ЭАП также зависит от качества приготовления электрода [30], ее высокие значения для электрокатализаторов являлись дополнительным подтверждением равномерности нанесенной каталитической пленки. На кривых ЦВА для Pt40/C и Pt20/C наблюдаются четкие пики десорбции водорода (рис. 3а).
Рис. 3.
ЦВА для электрокатализаторов в различных условиях. В стандартном растворе (а) и в растворе с концентрацией метанола 4 мас. % (б).
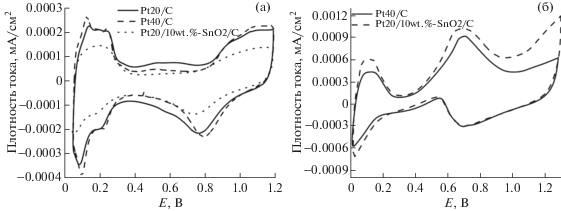
Для модифицированного электрокатализатора ЭАП составляет 58 м2/г Pt20/10 wt%–SnO2/C, что говорит о его высокой активности в реакции окисления водорода. Литературные данные показывают большой разброс в значениях ЭАП для электрокатализаторов, модифицированных SnO2 [31], что затрудняет оценку полученных в настоящей работе значений. На ЦВА в области десорбции водорода не наблюдается четких пиков (рис. 3б), что говорит об образовании нанокластеров металл–оксид металла (Pt–SnO2), что приводит к изменению структуры кристаллической решетки платины и сглаживает пики десорбции водорода с ее граней [11].
При исследовании в 4 мас. % растворе метанола согласно рис. 3б все образцы демонстрируют три волны тока при ~0.8–1.0 В и при потенциалах > 1.1 В при прямом сканировании и ~0.3–0.8 В при обратном сканировании [31]. Катализатор Pt20/10 wt%–SnO2/C продемонстрировал более высокую активность, чем Pt40/C, из-за более высоких токов при потенциалах > 0.8 В. Область адсорбции/десорбции водорода менее выражена в случае Pt/C из-за более сильного отравления активных центров Pt в растворе метанола по сравнению со стандартным раствором (рис. 3а).
Результаты определения активности электрокатализаторов. На рис. 4 изображены поляризационные кривые для Pt40/C (а), Pt20/C (б) и Pt20/10 wt%–SnO2/C (в) в РВК в стандартном растворе, Pt40/C (д) и Pt20/10 wt%–SnO2/C (е) в растворе с концентрацией метанола 4 мас. % (сопутствующий электролит 0.1 М HClO4), а также график Коутецкого–Левича в стандартном растворе при потенциале 0.9 В (г).
Рис. 4.
Поляризационные кривые (скорость разверстки 10 мВ/с), зарегистрированные при скорости вращения электрода 500, 900 и 1600 об./мин в насыщенном кислородом 0.1 М HClO4 для Pt20/C (а), Pt40/C (б), Pt20/10 wt%–SnO2/C (в), в растворе с концентрацией метанола 4 мас. % (д, е) и график Коутецкого–Левича для РВК в стандартном растворе (г).
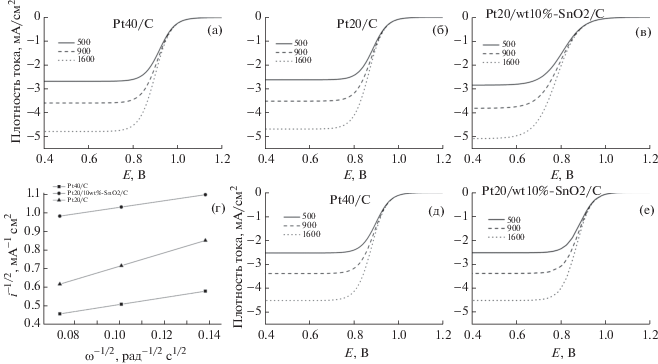
В табл. 1 представлены результаты расчета активности в РВК и реакции окисления метанола синтезированных электрокатализаторов, а также литературные данные. Катализаторы Pt20/10 wt%–SnO2/C и Pt20/C продемонстрировали более высокую активность в РВК, чем Pt40/C (рис. 4г). Значение удельной активности составило около 0.25 мA/cм2 для Pt20/10 wt%–SnO2/C и Pt20/C против 0.20 мA/cм2 для Pt40/C. Полученные данные согласуются с результатами [28, 30]. В исследовании [11] было показано, что при содержании диоксида олова (10 мас. %) в электрокатализаторе его долговечность увеличивается на 30–40% по сравнению с Pt40/C и на 60–70% по сравнению с Pt20/С. Электрокатализатор состава Pt20/10 wt%–SnO2/C может эффективно применяться для катода ТЭ, обеспечивая высокую эффективность в РВК и улучшенную долговечность по сравнению с Pt/C.
Таблица 1.
Активность электрокатализаторов
| Электрокатализатор | ЭАП, м2/г | m, мг/см2 | ik, мA/cм2 | SA, мA/cм2 | MA, мA/мг |
|---|---|---|---|---|---|
| Результаты исследований электрокатализаторов в стандартном растворе | |||||
| Pt20/C | 80 | 0.2 | 3.1 | 0.26 ± 0.02 | 154 ± 5 |
| Pt40/C | 43 | 0.2 | 3.24 | 0.20 ± 0.02 | 65 ± 3 |
| Pt20/10wt%–SnO2/C | 58 | 0.2 | 1.2 | 0.25 ± 0.02 | 132 ± 5 |
| 20 wt%–Pt/C [28] | 65 | 0.0143 | 0.26 | 190 | |
| 20 wt%–Pt/C [29] | 55 | 0.33 | 180 | ||
| 40 wt%–Pt/C [28] | 36 | 0.14 | 0.31 | 110 | |
| 40 wt%–Pt/C [29] | 49 | 0.54 | 260 | ||
| Pt/SnO2/C [30] | 45 | 0.002 | 0.24 | 0.27 | 122 |
| Результаты исследований электрокатализаторов в растворе с метанолом | |||||
| Pt/10 wt%–SnO2/C | 55 | 0.2 | 2.00 | 0.43 ± 0.04 | 222 ± 5 |
| Pt40/C | 43 | 0.2 | 3.96 | 0.25 ± 0.06 | 79 ± 3 |
| 20 wt%–Pt/C [32] | 62 | 0.24 | |||
| Pd:Pt = 1:2 [32] | 40 | 0.39 | |||
| Pt0.7Cr0.3/C [33] | 54 | 0.11 | 62 | ||
Были получены поляризационные кривые для катализаторов Pt20/10 wt%–SnO2/C и Pt20/C в 4 мас. % растворе метанола (рис. 4д, 4е), 0.1 М раствор HClO4 использовался в качестве сопутствующего электролита. Активность для Pt40/C незначительно возросла с добавлением в раствор метанола до 0.25 мА/см2, однако в процессе окисления метанола на платине наблюдается постепенное снижение активности из-за отравления Pt-центров побочными продуктами окисления метанола, преимущественно СО. Активность для Pt20/10 wt%–SnO2/C возросла почти в 2 раза до 0.43 мА/см2 по сравнению с активностью в стандартном растворе, что связано с высокой каталитической активностью SnO2 в реакции электроокисления метанола. Полученные данные сравнимы со значениями активности в реакции окисления метанола для электрокатализаторов, используемых в ТЭ с прямым окислением метанола [32, 33], и даже превышают значения активности таких катализаторов, как Pd:Pt и Pt0.7Cr0.3/C [33]. В данном случае модифицирование электрокатализатора SnO2 позволяет преимущественно окислять метанол на активных центрах Sn/SnO2, что предотвращает отравление платиновых активных центров. Использование электрокатализатора состава Pt20/10 wt%–SnO2/C обеспечивает высокую эффективность окисления как основного потока водорода, так и добавки метанола (антифриза) в поток водорода на аноде ТЭ, что позволяет применять его в качестве электрокатализатора для анода в ТЭ, эксплуатируемых в условиях низких температур вплоть до –50°С.
ВЫВОДЫ
Синтезирован и исследован гибридный модифицированный электрокатализатор состава Pt20/10 wt%–SnO2/C в сравнении с электрокатализаторами Pt40/C и Pt20/C. Электрокатализаторы исследовались в реакциях восстановления кислорода и электроокисления метанола и водорода с использованием метода вращающегося дискового электрода. Предложенная методика приготовления тонкопленочных электродов позволила получить воспроизводимые электрокаталитические пленки для всех исследуемых электрокатализаторов, что обеспечило высокую точность результатов по определению активности электрокатализаторов в РВК и реакциях окисления метанола и водорода.
Катализаторы Pt20/10 wt%–SnO2/C и Pt20/C продемонстрировали более высокую активность в РВК, удельная активность составила около 0.25 мA/cм2 по сравнению с Pt40/C в 0.1 М растворе HClO4. Активность для Pt20/10 wt%–SnO2/C возросла почти вдвое в растворе с концентрацией метанола 4 мас. %, при этом активность катализатора Pt40/C не изменилась. Значение удельной электрохимически активной поверхности платины для Pt20/10 wt%–SnO2/C составило 58 м2/г и превысило это значение для Pt40/C (43 м2/г), что обеспечивает его высокую активность в реакции окисления водорода. Наноразмерные гетерокластеры Pt–SnO2 обеспечивают высокую активность в реакциях электроокисления метанола и водорода, а значит, Pt20/10 wt%–SnO2/C эффективен в качестве электрокатализатора анода ТЭ. А высокая активность в РВК совместно с повышенной долговечностью по сравнению с катализаторами Pt/C обеспечивает его эффективность в качестве электрокатализатора катода ТЭ.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проекты № 20-08-00927, 18-29-23030).
Список литературы
Autonomous Non–Commercial Organization “International Sustainable Energy Development Centre” under the auspices of UNESCO. http://www.isedc–u.com/1248–dostup–k–energii.html.
Golubchikov S. // Energy. 2002. V. 11. P. 35.
Debe MK. // Nature. 2012. V. 486. P. 43. https://doi.org/10.1038/nature11115
Amjadi M., Rowshanzamir S., Peighambardoust S.J., Sedghi S. // J. Power Sources. 2012. V. 210. P. 350. https://doi.org/10.1016/j.jpowsour.2012.03.011
Pan Z.F., An L., Wen C.Y. // Appl. Energy. 2019. V. 240. P. 473. https://doi.org/10.1016/j.apenergy.2019.02.079
Banham D., Ye S. // ACS Energy Lett. 2017. V. 2. P. 629. https://doi.org/10.1021/acsenergylett.6b00644
Anwar M.T., Yan X., Asghar M.R. et al. // Int. J. Energy Resource. 2018. V. 43. P. 1.
Chakraborty D., Bischoff H., Chorkendorff I., Johannessen T. // J. Electrochem. Soc. 2005. V. 152. P. 2357. https://doi.org/10.1149/1.2109547
Jung E.H., Jung U.H., Yang T.H. et al. // Int. J. Hydrogen Energy. 2007. V. 32. P. 903. https://doi.org/10.1016/j.ijhydene.2006.12.014
Knorr F., Sanchez D.G., Schirmer J. et al. // Appl. Energy. 2019. V. 238. P. 1. https://doi.org/10.1016/j.apenergy.2019.01.036
Spasov D.D., Ivanova N.A., Pushkarev A.S. et al. // Catalysts. 2019. V. 9. P. 803. https://doi.org/10.3390/catal9100803
Nakazato Y., Kawachino D., Noda Z. et al. // J. Electrochem. Soc. 2018. V. 165. P. 1154. https://doi.org/10.1149/2.0311814jes
Du L., Shao Y., Sun J. et al. // Nano Energy. 2016. V. 29. P. 314. https://doi.org/10.1016/j.nanoen.2016.03.016
Frolova L.A., Dobrovolsky Y.A., Bukun N.G. // Rus. J. Electrochem. 2011. V. 47. P. 697. https://doi.org/10.1134/S1023193511060024
Zhang K., Feng C., He B. et al. // J. Electroanal. Chem. 2016. V. 781. P. 198. https://doi.org/10.1016/j.jelechem.2016.11.002
Jiang L., Sun G., Zhou Z. et al. // J. Phys. Chem. 2005. V. 109. P. 8774. https://doi.org/10.1021/jp050334g
Labbé F., Asset T., Chatenet M. et al. // Electrocatalysis. 2019. V. 10. P. 156.
Kowal A., Gojkovi’c S.L., Lee K.-S. et al. // Electrochem. Commun. 2009. V. 11. P. 724. https://doi.org/10.1016/j.elecom.2009.01.022
Zhang N., Zhang S. Du C. et al. // Electrochim. Acta. 2014. V. 117. P. 413. https://doi.org/10.1016/j.electacta.2013.11.139
Hussain S., Kongi N., Erikson H. et al. // Electrochim. Acta. 2019.V. 316. P. 162. https://doi.org/10.1016/j.electacta.2019.05.104
Jiménez-Morales I., Cavaliere S., Jones D., Rozière J. // Phys. Chem. Chem. Phys. 2018. V. 20. P. 8765. https://doi.org/10.1039/C8CP00176F
Yin M., Xu J., Li Q. et al. // Appl. Catalysis A. 2014. V. 144. P. 112. https://doi.org/10.1016/j.apcatb.2013.07.007
Yang G., Namin L.M., Aaron Deskins N., Teng X. // J. Catalysis. 2017. V. 353. P. 335. https://doi.org/10.1016/j.jcat.2017.07.033
Grigoriev S.A., Millet P., Fateev V.N. // J. Power Sources 2008. V. 177. P. 281. https://doi.org/10.1016/j.jpowsour.2007.11.072
Ivanova N.A., Alekseeva O.K., Fateev V.N. et al. // Int. J. Hydrogen Energy. 2019. V. 44. P. 29529. https://doi.org/10.1016/j.ijhydene.2019.04.096
Коутецкий Я., Левич В.Г. // Докл. РАН. 1957. Т. 117. С. 441.
Garsany Y., Baturina O.A., Swider-Lyons K.E. // ACS Publications. 2010. P. 6321. https://doi.org/10.1021/ac100306c
Gasteiger H.A., Kocha S.S., Sompalli B., Wagner F.T. // Appl. Catalysis B. 2005. V. 56. P. 9. https://doi.org/10.1016/j.apcatb.2004.06.021
Garsany Y., Singer I.L., Swider-Lyons K.E. // J. Electroanal. Chem. 2011. V. 662. P. 396 https://doi.org/10.1016/j.jelechem.2011.09.016
Zhang N., Zhang S., Du C. et al. // Electrochim. Acta. 2014. V. 117. P. 413. https://doi.org/10.1016/j.electacta.2013.11.139
Pushkarev A.S., Pushkareva I.V., Ivanova N.A. et al. // Catalysts. 2019. V. 9 (3). P. 271. https://doi.org/10.3390/catal9030271
He W., Liu J., Qiao Y., et al. // J. Power Sources. 2010. V. 195. P. 1046. https://doi.org/10.1016/j.jpowsour.2009.09.006
Koffi R.C., Coutanceau C., Garnier E. et al. // Electrochim. Acta. 2005. V. 50. P. 4117. https://doi.org/10.1016/j.electacta.2005.01.028
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии



