Российские нанотехнологии, 2021, T. 16, № 1, стр. 50-79
КОМПОЗИТЫ НА ОСНОВЕ НАНОЧАСТИЦ ХИТИНА И БИОРАЗЛАГАЕМЫХ ПОЛИМЕРОВ ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ: ПОЛУЧЕНИЕ И СВОЙСТВА
О. И. Богданова 1, 2, *, А. П. Истомина 1, 2, С. Н. Чвалун 1, 2
1 Институт синтетических полимерных материалов им. Н.С. Ениколопова РАН
Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: pishi.olge@gmail.com
Поступила в редакцию 21.09.2020
После доработки 21.12.2020
Принята к публикации 21.12.2020
Аннотация
Нанокристаллы и нанофибриллы хитина обладают привлекательными механическими и биологическими свойствами, что делает их перспективными для использования в различных областях. Обзор посвящен применению наночастиц хитина в качестве наполнителя в композитах на основе биоразлагаемых полимеров. Рассмотрены различные полимерные матрицы: синтетические, полусинтетические и природные (белки и полисахариды). Так как нанокристаллы и нанофибриллы хитина обладают высоким характеристическим отношением и модулем Юнга, основное внимание уделено механическим свойствам композитов. Благодаря высокой биологической активности хитина композиционные материалы на его основе обладают интересными биологическими свойствами.
ОГЛАВЛЕНИЕ
Введение
1. Композиты на основе синтетических биоразлагаемых полимеров
1.1. Полиэфиры
1.1.1. Полилактид
1.1.2. Поликапролактон
1.1.3. Полидиоксанон
1.2. Полиуретаны
2. Композиты на основе полусинтетических биоразлагаемых полимеров
3. Композиты на основе природных полимеров
3.1. Природные протеиновые полимеры
3.1.1. Коллаген
3.1.2. Фиброин шелка
3.2. Природные полисахариды
3.2.1. Хитозан и его производные
3.2.2. Целлюлоза и ее производные
3.2.3. Крахмал
3.2.4. Альгинаты
3.2.5. Гиалуроновая кислота
Заключение
ВВЕДЕНИЕ
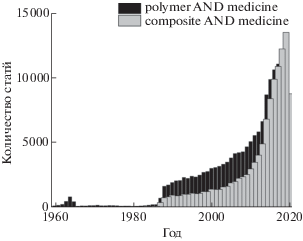
Полимеры и полимерные композиты играют значительную роль в технологическом развитии нашего общества [1]. Количество исследовательских работ, посвященных полимерам и композитам для медицинского применения, непрерывно растет (рис. 1), это отражает интерес и потребность во внедрении в клиническую практику новых полимерных и композиционных изделий, систем для доставки лекарств и многих других материалов.
Рис. 1.
Количество работ, опубликованных в различное время по поисковому запросу “polymer AND medicine” и “composite AND medicine”, согласно данным базы PubMed.
Организм человека обладает определенным потенциалом для регенерации тканей [2, 3], и при различных повреждениях, если самостоятельное заживление возможно, задача врачей обеспечить оптимальные условия регенерации: зафиксировать поврежденные части, обеспечить подходящие условия для формирования функциональной, а не рубцовой ткани и т.д. [4]. Также современная регенеративная медицина, используя клетки различных тканей человека, открывает новые возможности лечения травм и болезней, когда регенеративного потенциала человека недостаточно [2, 5, 6]. Во всех этих случаях востребованными являются материалы из биоразлагаемых полимеров, способных распадаться на безопасные продукты после выполнения необходимой функции и выводиться из организма, что исключает необходимость повторного хирургического вмешательства [7]. Такие материалы должны быть биосовместимыми, т.е. они сами и продукты их метаболизма не должны вызывать яркого иммунного ответа. К материалам для медицинского применения предъявляют и ряд других требований: соответствующие механические характеристики; открытая пористая трехмерная структура, схожая с внеклеточным матриксом; подходящая для прикрепления, пролиферации и дифференциации клеток поверхность матрикса; наличие биологически активных молекул, таких как цитокины и факторы роста [6]. Приоритет указанных характеристик зависит прежде всего от области применения конкретного изделия и материала.
В области медицинских изделий интенсивно исследуют композиты, так как использование нескольких компонентов позволяет придать материалу новые свойства или устранить недостатки полимерной матрицы. Так, зачастую синтетические полимерные материалы и природные полимеры после необходимых процедур очистки уступают тканям человека по механическим характеристикам, таким как жесткость, прочность и ударная вязкость, особенно при сравнении удельных характеристик [8–10]. Одна из возможностей скорректировать этот недостаток – использование усиливающего наполнителя. Высокую эффективность усиливающего действия на полимерную матрицу показывают наноразмерные наполнители по сравнению с частицами большего размера. Это явление связывают как с достижением порога перколяции при низком содержании наполнителя, так и с образованием значительной объемной доли межфазного полимерного слоя [11–13]. Свойства межфазного слоя отличаются от полимерной матрицы “в массе” по температуре стеклования, вязкоупругим и диэлектрическим характеристикам вследствие ограниченной подвижности цепей около развитой удельной поверхности наполнителя [13, 14].
В материалах для медицинского назначения применяют нанокристаллы и нанофибриллы целлюлозы, слоистые силикаты, углеродные нанотрубки, графен, частицы гидроксиаппатита (ГАП), полиэдрические олигомерные силсесквиоксаны [15–18]. Наряду с нанокристаллами и нанофибриллами целлюлозы в качестве усиливающего наполнителя выступают наночастицы хитина (НЧХ). Оба наполнителя имеют анизометричную морфологию с характеристическим отношением от 10 до нескольких сотен, а также обладают впечатляющим модулем упругости (41–220 ГПа) [19]. Также эти структурные полисахариды встречаются в широком спектре природных источников [20, 21]. При этом небольшое отличие, а именно, присутствие у хитина ацетилированной или свободной аминогруппы в С2-положении вместо гидроксильной группы у целлюлозы [22], определяет различия в ряде свойств, в том числе наличие выраженной биологической активности хитина. Данный полисахарид оказывает противовоспалительное действие, ускоряет ранозаживление, а также ограничивает размножение бактерий [23–26], что может служить дополнительным преимуществом при использовании НЧХ в качестве наполнителя для материалов медицинского назначения. В данном обзоре рассмотрены композиты медицинского назначения на основе различных биоразлагаемых полимеров, наполненных нанокристаллами или нанофибриллами хитина, особое внимание уделено способам получения материалов, их механическим и биологическим свойствам.
1. КОМПОЗИТЫ НА ОСНОВЕ СИНТЕТИЧЕСКИХ БИОРАЗЛАГАЕМЫХ ПОЛИМЕРОВ
1.1. Полиэфиры
Полиэфиры – это гидрофобные, алифатические полимеры, способные разлагаться до мономеров за счет гидролиза сложноэфирной группы и таким образом выводиться из организма естественным путем [27]. Поскольку между сложноэфирными связями находятся достаточно короткие алифатические цепи, полиэфиры могут разлагаться в течение времени, необходимого для биомедицинской области. Уникальность данного класса полимеров заключается в огромном разнообразии и синтетической универсальности. Полиэфиры могут быть получены из множества мономеров посредством реакции раскрытия цикла и конденсационной полимеризации [28]. Однако при получении композитов с полиэфирами в качестве полимерной матрицы, наполненных частицами с гидрофильной поверхностью, такими как нанофибриллы и нанокристаллы хитина и целлюлозы, остро встает вопрос о равномерном распределении частиц в композите [29–31]. Решением данной проблемы может стать предварительная модификация поверхности частиц [32, 33], однако поверхностная модификация может препятствовать формированию перколяционной сетки наполнителя через образование водородных связей между частицами [34].
1.1.1. Полилактид (ПЛА). Полилактид является одним из наиболее используемых полиэфиров, получаемым из возобновляемых источников, который при гидролизе разлагается до молочной кислоты. Данный полимер нашел применение в различных областях (упаковка, текстильные волокна). В настоящее время известны медицинские изделия на основе ПЛА: шовные нити, крепежные изделия для хирургии и ортопедии [35].
Существуют две оптические формы ПЛА: D-лактид и L-лактид, их физические свойства можно регулировать, варьируя относительное содержание D- и L-форм. Кристаллический полимер поли-L-лактид (L-ПЛА) представляет собой твердый прозрачный полимер с пределом прочности на разрыв 45–70 МПа и модулем 4.8 ГПа. Поли-DL-лактид (DL-ПЛА) является аморфным полимером со значительно меньшей прочностью на разрыв около 20 МПа и модулем 1.9 ГПа [36, 37]. Скорость деградации ПЛА зависит от степени кристалличности и пористости материала.
Одним из потенциальных применений ПЛА является использование его в качестве материла для замещения костных дефектов по причине его хорошей биосовместимости, биоразлагаемости и нетоксичных продуктов разложения [38], однако недостаточные механические характеристики материла ограничивают применение полимера в данной области. Одним из вариантов устранения данного недостатка является усиление (армирование) ПЛА-матрицы различными наполнителями, например, частицами ГАП, целлюлозы [36]. Хитин, используемый для армирования в различных матрицах, также привлекает внимание исследователей, особенно в аспекте биоразлагаемой упаковки [39–42].
В сфере биомедицинского применения большинство работ посвящено созданию материалов на основе ПЛА и хитина для восстановления костной ткани. В [43] приготовлены композиты на основе ПЛА, наполненные нанокристаллами α-хитина, полученные кислотным гидролизом, которые были поверхностно ацетилированы уксусным ангидридом в присутствии пиридина. Протекание реакции ацетилирования фиксировали по изменениям в ИК- и 13С ЯМР-спектрах. ПЛА и модифицированный хитин диспергировали в дихлорметане, пленки композита получали методом полива. Содержание наполнителя в композитах варьировали от 1 до 10 мас. %. Температура стеклования, как и температура плавления у композитов (55 и 149.3°С соответственно при 4% хитина), незначительно ниже, чем у чистого полимера (57.5 и 149.6°С). Значения прочности и модуля Юнга нанокомпозитов постепенно возрастали с увеличением загрузки наполнителя до тех пор, пока его содержание не достигло 4 мас. %. При данной концентрации прочность и модуль Юнга достигали максимальных значений, превышающих таковые для чистой ПЛА-пленки на 45 и 37% соответственно (табл. 1).
Таблица 1.
Механические характеристики композитов на основе синтетических биоразлагаемых полимеров и наночастиц хитина
| Матрица | Наполнитель | d, нм | l, нм | Вид изделия | Метод получения | Опти-мальная концент-рация, мас. %а | Модуль Юнга, композит/ матрица ГПаа | Предел прочности, композит/ матрица, МПаа | Относи-тельное удлиннение, композит/ матрица ,% | Лите-ратура |
| ПЛА | НК, Ac-α-хитин, Г(HCl) | 8–17 | 114–320 | Пленка | Полив из раствора | 4 | 1.6/1.1 | 36.3/25.1 | 6/31 | [43] |
| L-ПЛА | НК, α-хитин-g-L-ПЛА, Г(HCl) | 5–55 | 150–400 | Пленка | Полив из раствора | 5 | 1.4/0.6 | 30.5/18.7 | 11/6 | [30] |
| L-ПЛА | НК, α-хитин-g-L-ПЛА, Г(HCl) | 5–55 | 150–400 | Нетканый материал | Электроспининг | 5 | 2.0/0.8 | 4.3/2.6 | 48/62 | [44] |
| DL-ПЛА | НК, α-хитин, Г(HCl) |
40 | 220 | Пленка | Полив из раствора, вертикальное нанесение суспензии хи-тина на поленку |
5 | 2.552 ± 0.097/ 0.754 ± 0.053 | 30.02 ± 1.05/ 7.18 ± 0.82 | 12.5/130 | [46] |
| ПЛА | НК, α-хитин, Г(HCl) |
11 ± 5 | 300 ± 150 | Пленка | Экструзия, горячее прессование | 3, хитин 5, ТЭЦ |
1.94 ± 0.02/ 1.86 ± 0.10 | 54.4 ± 1.7/ 60.6 ± 0.6 | 4.6 ± 0.1/ 7.9 ± 0.4 | [48] |
| ПЛА | НФ, α-хитин | 90 | 20 000 (20 мкм) | Лопатка | Экструзия, литье под давлением | 2, хитин 1, ПЭГ |
3.2 ± 0.8/ 3.5 ± 0.1 | 52 ± 6/ 60.4 ± 0.3 | 10 ± 2/ 4.1 ± 0.5 | [49] |
| ПКЛ | НК, β-хитин, Г(HCl) | 18 | 2200 (2.2 мкм) | Пленка | Полив из раствора | 2.5 | 590/350 МПа | [69] | ||
| Пленка | Горячее прессование | 10 | 930/320 МПа | |||||||
| ПКЛ | НК, α-хитин, Г(HCl) |
20 | 300 | Пленка | Полив из раствора | 20 | 0.5/0.2 | 24/22 | 550/700 | [71] |
| Нетканый материал |
Электроспининг | 25 | 18/12 МПа | 17/4 | 250/670 | |||||
| ПДО | НК, α-хитин, Г(HCl) |
20 | 300 | Нетканый материал | Электроспининг | 10–15 | 61/18 МПа | 13/5 | 100/250 | [74] |
| ПУ (ПКЛ/МДИ) | НК, α-хитин, Г(HCl) |
20 ± 10 | 250 ± 50 | Пленка | Полив из раствора | 3 | 6.5/3 МПа | 20.8/11.3 | 575.4/800 | [80] |
| ПУ (Касторовое масло/ТДИ) | НК, Ac-α-хитин, Г(HCl) | 12.2 ± 3.4 | 211.6 ± 67.4 | Пленка | Полив из раствора | 6 | 1.8/0.98 МПа | 5.7/2.7 | 290/200 | [82] |
| СТПУ (ГМДИ/ПБСД) |
НК, α-хитин, Г(HCl) |
11.1 ± 1.4 | 176 ± 34 | Пленка | Полив из раствора | 1 | 288.8 ± 7.6/ 238.8 ± 6.7 МПа | 14.2 ± 1.3/ 26.5 ± 2.3 | 420/762 | [84] |
| ПУ (ЛДИ/ПБСД) | НК, α-хитин, Г(HCl) | 10 ± 1 | 222 ± 31 | Пленка | Полив из раствора | 3 | 256 ± 26/ 135 ± 5 МПа | 7.2 ± 0.5/ 8.1 ± 0.3 | 249/1018 | [85] |
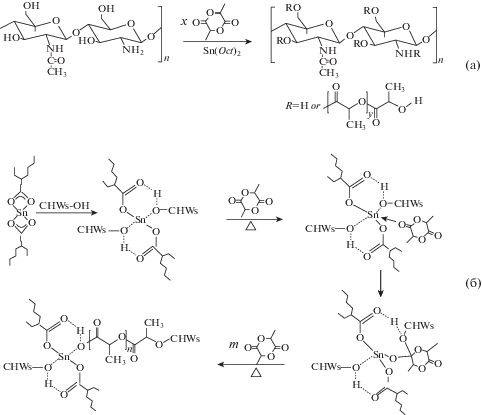
В [30] модифицировали нанокристаллы α-хитина (l = 150–400 нм, d = 5–55 нм), полученные кислотным гидролизом, прививкой олигомерных цепей L-ПЛА на поверхность частиц посредством полимеризации L-лактида с раскрытием цикла (рис. 2). Далее синтезировали композиты на основе L-ПЛА, армированные в одном случае модифицированным, в другом – немодифицированным полисахаридом, содержание наполнителя варьировалась от 1.25 до 10 мас. %. Количество привитых цепей по данным 13С ЯМР-спектроскопии составило 35.33–42.45 мас. %. Исследование механических свойств материалов показало, что предел прочности и модуль упругости полученных нанокомпозитов зависят от содержания наполнителя. При этом максимальная прочность и модуль упругости наблюдались при 5%-ном наполнении. Отметим, что пленки с модифицированным хитином показали лучшие результаты по сравнению с материалами с немодифицированным хитином, что связано с более однородным распределением привитого хитина в матрице и лучшей адгезией на границе фаз. При концентрациях полисахарида выше 5% проявляется агрегация полисахарида в матрице и, как следствие, происходит снижение механических свойств нанокомпозитов. Для исследования биологических свойств оценивали пролиферацию и жизнеспособность преостеобластов мыши линии MC3T3-E1 на полученных материалах, в качестве контрольного образца использовали чистую пленку ПЛА. Оценка цитосовместимости материалов, основанная на подсчете количества живых клеток клеточной культуры в течение 7 дней, показала, что добавление НЧХ увеличивает скорость пролиферации клеток линии MC3T3-E1. В [44] этот же материал был использован для получения методом электроспининга матрикса, диаметр волокон которого составил 400–800 нм. Содержание полисахарида 5% оказалось оптимальным для достижения максимального модуля упругости и прочности материала. Матриксы, наполненные модифицированным хитином, демонстрируют повышенную цитосовместимость по сравнению с чистым ПЛА для клеток преостеобластов MC3T3‑E1. Также было показано, что включение модифицированного хитина значительно улучшает адгезию и распространение клеток MC3T3-E1 на начальной стадии роста.
Рис. 2.
Схема модификации хитина (а); механизм полимеризации L-лактида с раскрытием цикла в присутствии катализатора Sn(Oct)2 и гидроксильных групп хитина (б) [30].
В другой работе синтезировали пленки DL-ПЛА, на которые после их выдерживания в растворе дофамина в Трис-HCl-буфере методом вертикального покрытия наносили слой водной суспензии α-хитина. Так как дофамин подвержен самопроизвольной окислительной полимеризации [45], его предварительная обработка раствором приводит к модификации поверхности пленки DL-ПЛА гидрофильным полимером – полидофамином. Концентрация наночастиц в суспензии хитина была достаточной для образования хиральной нематической фазы, что при вертикальном нанесении приводило к ориентации частиц полисахарида на поверхности пленки ПЛА [46]. При исследовании методом сканирующей электронный микроскопии (СЭМ) пленки, содержащей 5 мас. % наполнителя, было установлено, что более 90% наночастиц ориентированы вдоль направления течения суспензии. Выдерживание композитов в фосфатно-солевом буферном растворе в течение 2 нед не вызывает ни изменения морфологии пленок, ни уменьшения массы образцов. Несмотря на то что модуль упругости и прочность материала с 5% хитина превосходят показатели чистой ПЛА-пленки и композитной пленки, полученной смешением ПЛА и α-хитина, и составляют 2.5 ГПа и 30 МПа соответственно, они не достигают значений, характерных для трубчатых костей. Так, для бедренной кости человека модули упругости составляют 17–27 и 6–13 ГПа, предел прочности – 80–150 и 50–60 МПа в продольном и поперечном направлениях соответственно [47]. При этом данные материалы могут служить для восстановления губчатых костей, для которых характерны модуль упругости и предел прочности при растяжении в диапазоне 0.05–0.5 ГПа и 1–20 МПа соответственно [47]. Кроме улучшения цитосовместимости у разработанных многослойных материалов наблюдали более высокую остеогенную активность по сравнению с ненаполненной пленкой.
Одним из методов облегчения диспергирования хитина в ПЛА-матрице является добавление пластификаторов. В [48] в качестве пластификатора использовали триэтилцитрат (ТЭЦ). Полученные кислотным гидролизом суспензии нанокристаллов α-хитина смешивали с ТЭЦ и этанолом (растворитель ТЭЦ). Полученные дисперсии вводили вместе с ПЛА в экструдер для получения композитов с 3 мас. % полисахарида, из которых затем с помощью горячего пресса получали пленки. Количество пластификатора в композите составляло 2.5, 5 и 7.5 мас. %. Также экструзией был получен чистый ПЛА, ПЛА с пластификатором (2.5, 5 и 7.5 мас. %), композит без пластификатора с 3% хитина. По данным СЭМ в композитах без пластификатора наблюдаются значительные агрегаты, число и размер которых значительно уменьшаются при добавлении пластификатора. ИК-спектроскопия показывает, что пик валентных колебаний O–H при 3510 см–1 чистого ПЛА при добавлении хитина и ТЭЦ становится шире и смещается на 3494 см–1, что говорит об образовании водородных связей между матрицей и наполнителем. Температура стеклования и плавления предсказуемо снижается при использовании пластификатора. Модуль Юнга композитов возрастает по сравнению с чистым ПЛА при введении частиц хитина как с пластификатором, так и без него (табл. 1). Однако прочность с добавлением наполнителя падает, что может быть связано с гидролизом ПЛА при экструзии и с присутствием небольшого количества агломератов. Если сравнивать ПЛА, синтезированный с пластификатором, то введение хитина увеличивает прочность при той же концентрации ТЭЦ.
В [49] в качестве пластификатора использовали полиэтиленгликоль (ПЭГ) при экструзии композитов на основе ПЛА и нанофибрилл хитина. Сначала были подготовлены смеси хитин–ПЭГ, которые демонстрировали отсутствие агломератов при сушке в отличие от водных суспензий полисахарида. В экструдированных образцах также не наблюдали агломератов. После экструзии литьем под давлением были получены пластины. Добавление ПЭГ и полисахарида значительно влияет на цвет и прозрачность исследуемых материалов. Выяснено, что наиболее прозрачный и бесцветный композит получается при самом низком содержании хитина (2 мас. %) и максимально высоком содержании ПЭГ (10 мас. %). При пластификации ПЛА наблюдается как сильное уменьшение модуля Юнга и напряжения при разрыве, так и увеличение удлинения при разрыве (до 180%). При этом добавление нанофибрилл хитина к уже пластифицированному ПЛА не оказывает усиливающего эффекта, несмотря на улучшение дисперсии хитина в матрице. Это может быть связано с тем, что ПЭГ, имеющий высокое сродство с полисахаридом, “покрывает” поверхность НЧХ, препятствуя его взаимодействию с ПЛА. Это подтверждается и тем, что модуль Юнга композита с 2% хитина без пластификатора (2.9 ГПа) выше, чем у композитов с пластификатором, и только композит с 1% ПЭГ и 2% хитина обладает большим модулем (3.2 ГПа), т.е. малого количества пластификатора достаточно для обеспечения распределения наполнителя, но в то же время не хватает для препятствования взаимодействию нанофибрилл с матрицей. Отметим, что композит с более высокомолекулярным ПЭГ демонстрировал более высокий модуль Юнга и напряжение при разрыве.
Также отметим, что ПЛА в форме микро- и наночастиц интенсивно исследуется как система для доставки лекарств [50–52]. Для получения устойчивых частиц ПЛА-суспензий зачастую необходимо использовать амфифильные стабилизаторы: низкомолекулярные поверхностно-активные вещества (ПАВ), полимеры, такие как ПЭГ, поливинилацетат (ПВА), декстраны [52, 53]. Кроме этого, при получении частиц на основе ПЛА активно используются диблок- или триблок-сополимеры ПЛА с ПЭГ [54, 55], декстраном [56]. Существует еще один способ получения водной дисперсии гидрофобных частиц с использованием твердых частиц в качестве стабилизатора, такие дисперсии называются эмульсиями Пикеринга. В [57] были получены микрочастицы ПЛА (диаметр основной фракции 100–200 мкм), стабилизированные нанокристаллами хитина. Выход микрочастиц более 50% наблюдался при применении 1%-ной суспензии частиц полисахарида, в то время как для достижения данного показателя при применении ПВА как стабилизатора используется 2.5%-ный раствор полимера.
Таким образом, основным применением композитов ПЛА–хитин является восстановление костной ткани. Хотя композиционные материалы на основе ПЛА с хитином могут представлять большой интерес в качестве хирургических шовных материалов, исследовательских работ в этой области сравнительно немного [58]. К наиболее используемым методам получения композитов относятся электроспининг, экструзионный метод и получение пленок из раствора.
1.1.2. Поликапролактон (ПКЛ). Поликапролактон – востребованный кристаллический полиэфир, который легко перерабатывается, поскольку растворим в широком спектре органических растворителей, имеет низкую температуру плавления (55–60°С) и температуру стеклования (–60°С). Полимер обладает, с одной стороны, относительно низким пределом прочности на разрыв (23 МПа), с другой – чрезвычайно высоким удлинением при разрыве (>700%) [59]. ПКЛ деградирует довольно медленно (2–3 года), поэтому используется для разработки долгосрочных имплантов [60], однако матриксы из чистого ПКЛ демонстрируют низкую адгезию и пролиферацию клеток [61, 62]. Для устранения данных недостатков часто применяют введение наполнителя как неорганического – биокерамика [63], ГАП [64], фостерит [65], углеродные нанотрубки [66], так и органического – поверхностно-модифицированные нанокристаллы целлюлозы [67], хитозан [68].
В [69] впервые были описаны нанокомпозиционные материалы на основе ПКЛ и нанофибрилл β-хитина (lср = 2.2 мкм, dср = 18 нм). Пленки композитов были приготовлены либо смешением водной дисперсии ПКЛ, стабилизированной сополимером полиэтиленоксида и полипропиленоксида, и суспензии хитина с последующим испарением воды при 75°С, либо горячим прессованием смеси предварительно лиофилизованных суспензий полимера и полисахарида. Содержание наполнителя в первом случае варьировалось от 0.5 до 2.5 мас. %, во втором – от 0.5 до 10 мас. %. Механические свойства приготовленных композитов были исследованы методом динамического механического анализа. Для обоих методов получения материала при содержании хитина 5% и меньше характерны падение модуля и разрушение образца при температуре выше 50°С вследствие плавления ПКЛ вне зависимости от содержания хитина. Однако модуль 10%-ного композита, полученного горячим прессованием, выше 50°С выходит на плато около 42 МПа вплоть до 190°С. Переход матрицы при данных температурах в вязко-текучее состояние можно объяснить образованием устойчивой сетки наполнителя. Для пленок, полученных испарением, модуль упругости при комнатной температуре увеличивается от 0.35 ГПа для незаполненной матрицы до 0.59 ГПа для 2.5%-ного композита. Модуль упругости материалов, полученных горячим прессованием, составил 0.32 ГПа для чистой матрицы и 0.93 ГПа при 10%-ном наполнении при комнатной температуре. При одинаковой концентрации хитина (2.5 мас. %) модуль выше у пленок, полученных методом полива. Вероятно, разница модулей упругости возникает изначально из-за более высокой степени кристалличности матрицы для образцов, полученных методом полива.
В [70] были поверхностно модифицированы лиофилизованные нанокристаллы α-хитина прививкой цепей ПКЛ путем полимеризации полимера с раскрытием цикла. После модификации длина частиц полисахарида становилась заметно меньше, около 100 нм по сравнению с частицами после гидролиза длиной несколько сотен нанометров. Методом литья под давлением были получены композиционные пластины. Содержание привитых цепей ПКЛ составило 89.60, 91.20 и 94.78 мас. %. С увеличением доли привитых цепей ПКЛ возрастают прочность и удлинение при разрыве, поскольку переплетение цепей ПКЛ облегчает перенос напряжения на полисахарид. Так, прочность образца с 89.60% прививки составила 19 МПа, а образца с 94.78% прививки – 29.7 МПа. Модуль Юнга, наоборот, снижается с ростом массовой доли привитых цепей ПКЛ с 400 (89.60 мас. %) до 300 МПа (94.78 мас. %). Также по мере увеличения содержания ПКЛ в композите возрастает гидрофобность материала.
В [71] применяли 2,2,2-трифторэтанол (ТФЭ) как растворитель для получения композиционных материалов на основе ПКЛ. Нанокристаллы α-хитина (lср = 300 нм, dср = 20 нм), полученные кислотным гидролизом и лиофилизованные, диспергировали в ТФЭ, используя ультразвук (УЗ). К данной системе добавляли растворенный в ТФЭ поликапролактон, перемешивали, подвергали УЗ-обработке. Методом полива были получены пленки, а с помощью электроспининга – матриксы, диаметр волокна которых составил 200–400 нм. Содержание наполнителя в обоих случаях варьировали от 5 до 30 мас. %. По данным СЭМ наполнитель в пленке распределен равномерно, однако на ИК-спектрах композитов не происходит значительных изменений характерного пика эфирной группы 1724 см–1 по сравнению с чистой пленкой ПКЛ, что свидетельствует о слабой адгезии полисахарида и ПКЛ. Возможно, это является причиной того, что прочность композиционных пленок при введении наполнителя изменяется незначительно. Так, для чистой пленки ПКЛ прочность составляет 22 МПа, для 5%-ного композита – 18 МПа, для 30% – 25 МПа. При этом модуль упругости пленок с возрастанием количества хитина увеличивается по сравнению с чистой пленкой (0.2 ГПа), максимальный модуль наблюдается у 20%-ной пленки (0.5 ГПа). Наличие наполнителя заметно снижает удлинение при разрыве: для чистой пленки оно составляет 700%, для пленок, наполненных хитином, – 400–550%. Матриксы демонстрируют несколько другое поведение. Для них характерно возрастание прочности с увеличением концентрации хитина: 4 МПа для ненаполненной матрицы, 18 МПа при 30% хитина. Введение полисахарида приводит к росту модуля упругости, а также в 2 раза уменьшает удлинение при разрыве. В [72] при исследовании данных матриксов было замечено, что добавление хитина сильно уменьшает диаметр волокон матрикса. Так, при нулевом содержании хитина диаметр волокон составляет ~1 мкм, при наполнении – 200–400 нм. Влияние хитина на пролиферацию клеток было оценено на примере культивирования дермальных фибробластов человека на полученных материалах в течение 14 дней. На изображениях флуоресцентной микроскопии поперечного среза матриксов видно, что клетки распространяются не только по поверхности, но и мигрируют на 14-й день внутрь матриксов. Для образца из чистого ПКЛ подобной инфильтрации клеток в образец не наблюдали (рис. 3). Таким образом, наполнение хитином матриксов на основе ПКЛ значительно улучшает клеточную инфильтрацию и миграцию.
Рис. 3.
Изображения флуоресцентной микроскопии поперечного сечения 30%-ного матрикса хитин–ПКЛ на первый (а) и 14-й день (б) посева дермальных фибробластов; изображения флуоресцентной микроскопии поперечного сечения матрикса из чистого ПКЛ на первый (в) и 14-й день (г) посева дермальных фибробластов. На вставках изображения при естественном освещении [64].

1.1.3. Полидиоксанон (ПДО). Полидиоксанон представляет собой бесцветный кристаллический полимер (степень кристалличности достигает 55%), который с 80-х годов используют в качестве моноволокнистого шовного материала. Модуль чистого ПДО составляет 1.5 ГПа [60]. Кроме шовных материалов ПДО применяется в ортопедии как материал для крепежных винтов для мелких костных и остеохондральных фрагментов [73].
Анализ литературы показал, что на данный момент практически не исследованы возможности приготовления композитов ПДО–хитин. Так, нам известна только одна работа [74], где получены нанокомпозитные матриксы ПДО–хитин. Для этого нанокристаллы α-хитина (lср = 300 нм, dср = 20 нм), полученные кислотным гидролизом и лиофилизованные после очистки, диспергировали с помощью УЗ-обработки в ТФЭ и смешивали с растворенным в ТФЭ полидиоксаноном, используют УЗ. Методом электроспининга были получены матриксы, содержание наполнителя в которых варьировали от 5 до 20 мас. %. Для всех матриксов характерно однородное распределение наполнителя, при этом с увеличением загрузки полисахарида получаемое волокно истончалось: диаметр волокна без наполнителя – 500 нм, при 5–20% хитина – 100–300 нм (рис. 4). Включение полисахарида значительно улучшило механические свойства по сравнению с чистым ПДО. Модуль композита с 15%-ным содержанием хитина в 3.4 раза больше, чем модуль чистого полимера: 61 и 18 МПа соответственно. Максимальная прочность 13 МПа была достигнута при 10%-ном наполнении, что превосходило прочность матрикса из ПДО в 2.6 раза (табл. 1). При этом удлинение при разрыве уменьшилось до 80–100% по сравнению с ненаполненным матриксом (250%). Добавление хитина также способствует увеличению скорости пролиферации шванновских клеток RSC96 по сравнению с чистым ПДО. Предварительные результаты показали, что данные матриксы могут выступать в качестве материалов для регенерации нерва.
Рис. 4.
СЭМ-изображения матриксов ПДО–хитин с различным содержанием хитина: а – 0, б – 5, в – 10, г – 15, д – 20%; и распределение среднего диаметра волокна при различной загрузке хитина (е) [74].

1.2. Полиуретаны (ПУ)
Полиуретаны представляют собой широкий класс полимеров, которые исследуются в связи с перспективами их использования в медицинских целях, в частности для разработки медицинских имплантатов, таких как кардиостимуляторы и сосудистые трансплантаты. Полиуретаны обычно получают реакцией поликонденсации диизоцианатов с би- и полифункциональными гидроксилсодержащими производными. Для создания биоразлагаемых ПУ используются биосовместимые алифатические диизоцианаты, среди которых лизиндиизоцианат (ЛДИ) и 1,4-диизоцианатобутан (ДИБ) [60]. Механические свойства ПУ варьируются в широких пределах, поскольку зависят от таких факторов, как природа и длина участков цепи между уретановыми группами, степень кристалличности, структура (линейная или сетчатая). Разлагаемые полиэфирные уретаны были разработаны путем взаимодействия ЛДИ с полиэфирными диолами или триолами на основе D, L-лактида, капролактона и других сополимеров [75]. Алифатические полиэфиры в ПУ образуют мягкие сегменты. Биоразлагаемый эластичный полиэфир уретана DegraPol используется для разработки высокопористых каркасов для тканевой инженерии [76].
Применение биоразлагаемых материалов на основе ПУ в таких сферах, как ортопедия, требует высоких механических свойств, что вызывает необходимость использования наполнителей. Для усиления ПУ чаще всего применяют нанокристаллы или нанофибриллы целлюлозы [77] и ГАП [78, 79]. В последнее десятилетие существенно возросло количество исследований, посвященных армирующим свойствам НЧХ применительно к ПУ.
В [80] использовали нанокристаллы α-хитина (lср = 250 нм, dср = 20 нм), полученные кислотным гидролизом, для наполнения ПУ на основе ПКЛ и метилендифенилдиизоцианата (МДИ). Содержание полисахарида в отлитых пленках составило от 1 до 5 мас. %. Наполненные материалы демонстрируют улучшенные механические свойства по сравнению с исходной пленкой ПУ. Введение 3% хитина обеспечивает максимальную прочность 28.8 МПа, максимальный модуль упругости 9.6 МПа достигается при 5%-ном наполнении, что 1.8 и 3.2 раза выше показателей ПУ-пленки соответственно (табл. 1). С увеличением концентрации хитина уменьшается удлинение при разрыве, и для всех композитов его значения ниже, чем для чистой пленки. С помощью ИК-спектроскопии было показано, что взаимодействие между матрицей и наполнителем происходит за счет образования водородных связей главным образом в аморфной области. Несмотря на то что авторы не предлагают потенциального применения для полученных материалов, данная работа является перспективной в плане механизма усиления ПУ-матриц с помощью НЧХ и может быть полезна при создании материалов для биомедицинского применения.
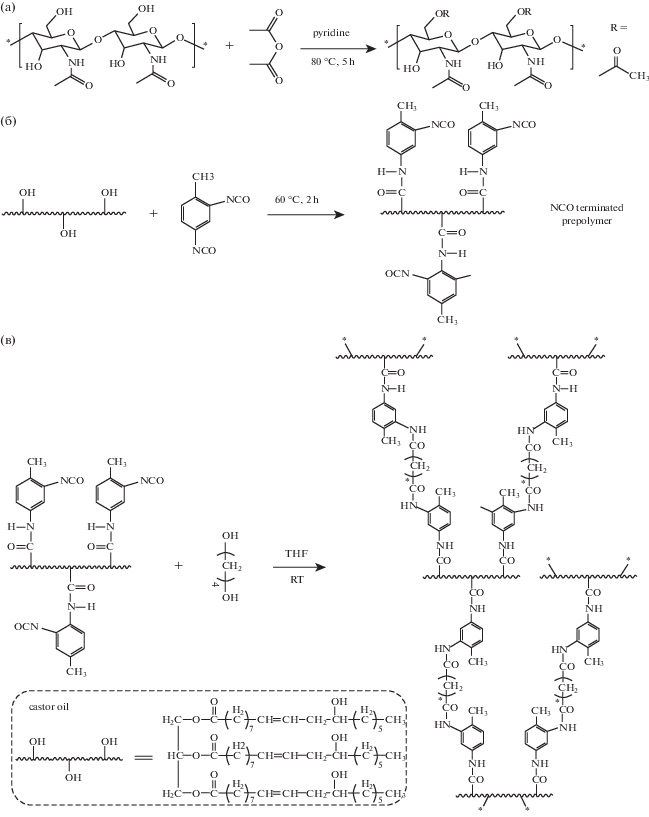
В последнее время возрос интерес к растительным маслам как к возобновляемым природным источникам полиолов для синтеза ПУ [81]. В [82] синтезированы биокомпозиционные материалы на основе высокоэластичного ПУ, полученного из касторового масла и толуилендиизоцианата (ТДИ), и α-хитина. Нанокристаллы полисахарида, выделенные кислотным гидролизом, были поверхностно ацетилированы с помощью уксусного ангидрида в присутствии пиридина (рис. 5а). Средняя длина и диаметр НЧХ после модификации составили 212 и 12 нм соответственно. Приготовленный заранее преполимер из касторового масла и ТДИ (рис. 5б) смешивали с нанокристаллами хитина и 1,4-бутандиолом в тетрагидрофуране (ТГФ) для получения композитов (рис. 5в). Гидрофобные ацетильные группы на поверхности модифицированных частиц хитина способствовали их однородному распределению в ТГФ, а значит, и в ПУ-пленках после испарения растворителя. Содержание наполнителя в пленках варьировали от 2 до 10 мас. %. Модуль Юнга нанокомпозитов постепенно увеличивается с возрастанием концентрации нанокристаллов, в частности с 0.98 для чистого ПУ до 4.01 МПа для композита с 10% хитина, максимальная прочность достигается при 6%-ном наполнении – 5.6 МПа (табл. 1). Относительное удлинение при разрыве по мере увеличения содержания наполнителя ведет себя неоднородно: для композитов с 2 и 4% хитина оно возрастает по сравнению с ненаполненной пленкой, однако при загрузке 6% и более данный показатель снижается. Повышение механических свойств обусловлено прежде всего формированием жесткой трехмерной сетки между ацетилированными нанокристаллами хитина при достижении порога перколяции (5.7%) за счет оставшихся гидроксильных групп. Однако при более высокой концентрации наполнителя может происходить агрегация частиц хитина, приводящая к снижению прочности, что видно на примере 10%-ного композита. Модуль при этом продолжает расти за счет образования жесткой сетки.
Рис. 5.
Схемы реакций ацетилирования поверхности нанокристаллов хитина (а), синтеза преполимера полиуретана (б) и синтеза полиуретана (в); на врезке химическая структура касторового масла [82].
В [83] исследовано влияние УЗ-обработки при получении композиционных пленок на основе ПУ, синтезированного из полиэтиленгликоль-адипината и ТДИ, и нанокристаллов α-хитина (l = = 100–650 нм, d = 10–70 нм), полученных кислотным гидролизом. В ходе работы было получено две серии пленок посредством выпаривания: в одном случае смесь дисперсий хитина и ПУ подвергали УЗ-воздействию, в другом – нет. Содержание полисахарида в твердой фазе композитов составило 5, 10, 20, 30 мас. %. На СЭМ-изображениях видно, что более равномерного распределения наполнителя в матрице можно достичь, используя УЗ-обработку. Прочность композитов обеих серий превосходила прочность ненаполненной пленки, при этом бóльшая концентрация хитина обеспечивала бóльшую прочность. Однако прочность композитов, подвергнутых УЗ-обработке, была выше, чем без нее: при 30%-ном наполнении она составляет 12.2 и 6.83 МПа соответственно. При добавлении наполнителя значение удлинения при разрыве последовательно снижается. Так, для чистой пленки оно составляет 1200%, при 30%-ной загрузке полисахарида в обеих сериях – около 200%.
Сегментированные термопластичные полиуретаны (СТПУ) относятся к полимерам с памятью формы. Данные сшитые кристаллические полимеры состоят из мягких, обычно образованных полиэфиром или макродиолом, и твердых сегментов, образованных в результате реакции диизоцианата с низкомолекулярным диолом. Из-за термодинамической несовместимости между мягкими и твердыми сегментами эти ПУ разделяются на фазы и являются хорошими кандидатами для материалов с памятью формы. Мягкий сегмент выступает в качестве переключающего сегмента (ответственного за фиксированную форму), от которого требуется, чтобы температуры стеклования и плавления лежали в подходящих температурных диапазонах. Твердые сегменты служат узлами сетки и обеспечивают эластичность, необходимую для восстановления формы. Полиуретаны с памятью формы, как правило, проявляют высокую биосовместимость, что вызывает значительный интерес к ним в связи с возможностью биомедицинского применения [81].
В [84] нанокристаллы α-хитина (lср = 176 нм, dср = 11 нм), полученные кислотным гидролизом, использовали для усиления СТПУ с жестким сегментом на основе 1,6-гексаметилендиизоцианата (ГМДИ) и мягким сегментом из полибутиленсебацинатдиола (ПБСД) из касторового масла. Содержание наполнителя в полученных пленках варьировалось от 0.25 до 2 мас. %. Нанокристаллы хитина, действуя как нуклеирующий агент для твердой фазы, увеличивали ее кристалличность, и, следовательно, жесткость материала, таким образом увеличивая модуль Юнга. С другой стороны, эффект нуклеации ограничивал ориентацию мягкого аморфного сегмента и кристаллизацию при деформации, тем самым снижая значения прочности при разрыве. При добавлении хитина удлинение при разрыве уменьшается с 762%, характерных для ненаполненной матрицы, до 400–460% при содержании наполнителя 1% и менее, однако при дальнейшем увеличении концентрации хитина до 2% происходит резкое падение удлинения до 68% (табл. 1). Форма чистой пленки ПУ после термомеханической деформации восстанавливалась на 52%. При добавлении хитина, способствовавшего увеличению физических сшивок между жесткими доменами, 1%-ные композиты восстанавливали свою форму до 70% на первом термомеханическом цикле и до 90% на втором цикле. При этом наполнитель не оказывает никакого влияния на стабильность формы, что связано с тем, что полисахарид практически не воздействует на мягкий сегмент полимера. Инкубирование клеток фибробластов мыши L-929 на образцах пленок чистого ПУ и 1%-ного композита при 37°С продемонстрировало цитосовместимость обоих материалов, причем после первых суток количество клеток на композиционной пленке было выше, чем на ненаполненном полимере.
В [85] синтезированы бионанокомпозиты СТПУ, наполненные нанокристаллами α-хитина (lср = 220 нм, dср = 10 нм), выделенными кислотным гидролизом. ПУ, полученный на основе ЛДИ и ПБСД из касторового масла, растворяли в ТГФ. В раствор добавляли хитин, предварительно диспергированный в ТГФ, и конечную смесь обрабатывали УЗ. Содержание наполнителя в пленках после испарения растворителя составило 1, 3, 5 мас. %. Как и в предыдущем случае частицы хитина играли роль зародышеобразователей, из-за чего с увеличением концентрации наполнителя увеличивалась степень кристалличности образцов и, соответственно, жесткость образца. При этом прочность и удлинение при разрыве композиционных материалов уменьшаются по сравнению с ненаполненным материалом. Чистая пленка ПУ восстанавливала свою форму на 82.3%. При добавлении 1% хитина данное значение увеличивается до 83.6%, при добавлении 3% полисахарида – до 85.5% при первом термомеханическом цикле. Это связано с тем, что, как и отмечалось ранее, первоначальная форма восстанавливается через кристаллическую структуру. Отметим, что композиты восстанавливают форму как в сухом, так и во влажном состоянии примерно за одинаковое время. При первом цикле значение стабильности формы 3%-ного композита (96.6%) выше, чем у 1%-ного материала (94.3%) и чистого ПУ (94.7%), однако при последующих циклах влияние наполнителя на стабильность формы не прослеживается. Композиционный материал с 3%-ным содержанием наполнителя является цитосовместимым, что было показано на примере фибробластов мыши L-929, и отличается гемосовместимостью.
Анализ литературы показал, что возможности получения композитов на основе ПУ и хитина для биомедицинской сферы исследованы довольно мало, в частности не удалость найти ни одной работы по созданию матриксов из данных материалов методом электроспининга. При этом композитные пленки ПУ–хитин являются перспективными для создания раневых покрытий, а композиты с СТПУ могут быть применены для изготовления стентов для сосудов и кава-фильтров.
Подводя итоги к разделу о композитах на основе НЧХ и синтетических полимерных матрицах, можно отметить следующее. Наиболее распространенным наполнителем для композитов являются нанокристаллы α-хитина, полученные кислотным гидролизом в соляной кислоте (табл. 1). Лишь в одной работе были использованы нанофибриллы α-хитина, а в другой нанокристаллы β-хитина. Ряд исследователей применяют поверхностную модификацию частиц полисахарида или используют низкомолекулярные или высокомолекулярные пластификаторы в целях улучшения распределения наполнителя в гидрофобной полимерной матрице. С помощью химической модификации поверхности нанокристаллов удается достичь большего усиливающего эффекта наполнителя на матрицу, однако влияние пластификатора не столь однозначно, поскольку усиливающий эффект и улучшение распределения наполнителя нивелируются влиянием самого пластификатора на механические свойства композита. Тем не менее в бóльшей части работ при использовании нанокристаллов хитина без предварительной модификации также наблюдали увеличение модуля упругости. Отметим, что в большинстве работ оптимальная концентрация наполнителя составляет менее 10 мас. %, что связано как с трудностями получения более высоконаполненных материалов, так и с негативным влиянием агрегации НЧХ. Все исследователи, изучавшие биологические свойства композитов на основе хитина и синтетических полимеров, отмечают, что введение в состав частиц полисахарида улучшает адгезию, распространение, увеличивает уровень пролиферации различных клеток тканей млекопитающих.
Заметим, что во многих работах при получении материалов на основе хитина и биоразлагаемых синтетических полимеров хитин растворяли в совместных растворителях для обоих компонентов (ионные жидкости, гексафторизопропанол) или растворителях для данного полисахарида (метанол/CaCl2). Таким образом, были получены материалы на основе хитина и ПЛА [86–89], ПКЛ [90], полигликолида [91], ПЛА-со-гликолида [92–94], полибутиленсукцината [95].
2. КОМПОЗИТЫ НА ОСНОВЕ ПОЛУСИНТЕТИЧЕСКИХ БИОРАЗЛАГАЕМЫХ ПОЛИМЕРОВ
К полусинтетическим биоразлагаемым полимерам можно отнести полигидроксиалканоаты (полиэфиры), так как, несмотря на бактериальный биосинтез полимеров, их химическая структура сильно зависит от состава питательной среды. Добавляя в среду метаболические предшественники необходимых мономеров, можно регулировать структуру и, следовательно, свойства получаемого полигидроксиалканоата. Разнообразие мономерных звеньев велико и включает в себя остатки 3-гидроксикислот: насыщенные и ненасыщенные, линейные и разветвленные, а также с различными функциональными группами. Количество атомов углерода в мономерном звене варьируется от 3 до 18 [96]. Тем не менее наиболее распространенными полиалканоатами являются поли-3-гидроксибутират (П3ГБ) и его сополимер с поли-3-гидроксивалериатом (П3ГБ-П3ГВ) [97]. Однако П3ГБ из-за высокой температуры плавления (173–180°С) обладает узким температурным окном переработки, кроме того, он хрупкий вследствие формирования сферолитов большого размера при кристаллизации [98]. Данные недостатки пытаются преодолеть использованием сополимеров П3ГБ, таких как П3ГБ-П3ГВ [98].
К слабым сторонам П3ГБ-П3ГВ относятся недостаточные предел прочности и модуль Юнга, основной причиной которых является более медленная скорость нуклеации и кристаллизации полимера по сравнению с чистым П3ГБ и, следовательно, низкая кристалличность [97]. Введение высокодисперсного наполнителя в качестве дополнительных центров кристаллизации – это один из способов устранить данный недостаток и вместе с тем придать новые свойства. Однако добавление немодифицированных нанокристаллов α-хитина и модифицированных привитыми олигомерными цепями П3ГБ-П3ГВ приводило наоборот к затруднению кристаллизации, что выражалось в снижении температуры кристаллизации материала и появлении низкотемпературного пика плавления полимера [99]. Возможно, данная особенность обусловлена водородными связями, возникающими между свободными гидроксильными группами α-хитина и карбонильными группами П3ГБ-П3ГВ, ограничивающими миграцию цепей полиэфира, необходимую для кристаллизации [99]. Тем не менее ускорения кристаллизации удалось добиться введением нанокристаллов α-хитина, в которых гидроксильные группы полисахарида были ацетилированы, причем эффект заметнее проявляется при использовании наполнителя с большей степенью замещения [100]. Добавление как немодифицированных, так и ацетилированных нанокристаллов α-хитина улучшило механические свойства материала (предел прочности и модуль Юнга) по сравнению с чистым П3ГБ-П3ГВ (табл. 2). При этом усиливающий эффект модифицированных нанокристаллов более ярко выражен: так, при содержании 5 мас. % модуль Юнга композитных пленок с модифицированными частицами – 2000 МПа, с немодифицированными – 1850 МПа, а чистой П3ГБ П3ГВ – 1200 МПа; предел прочности 26, 22 и 18 МПа соответственно [100]. Ацетилированные нанокристаллы α-хитина были использованы для приготовления трехмерного матрикса П3ГБ-П3ГВ/α-хитин комбинацией методов термоиндуцированного фазового разделения и высаливания (вымывания частиц соли после стабилизации матрикса) [101]. Данная комбинация методов позволила получить материал с микро- (~10 мкм) и макропорами (100–300 мкм) (рис. 6а, 6б) одновременно. Введение нанокристаллов полисахарида улучшило механические характеристики материала при сжатии (модуль сжатия 7 и 5.5 МПа для композита и чистого П3ГБ-П3ГВ соответственно), а также увеличило адгезию стволовых клеток жировой ткани человека по сравнению с чистым П3ГБ-П3ГВ (рис. 6в, 6г) [101].
Таблица 2.
Механические характеристики композитов на основе полусинтетических и природных биоразлагаемых полимеров и наночастиц хитина
| Матрица | Наполнитель | d, нм | l, нм | Вид изделия | Метод получения | Опти-мальная концент-рация, мас. %а | Модуль Юнга, композит/ матрица ГПаа | Предел прочности, композит/ матрица, МПаа | Относительное удлиннение, композит/ матрица ,% | Ли-те-рату-ра |
|---|---|---|---|---|---|---|---|---|---|---|
| П3ГБ-П3ГВ | НК, Ac-α-хитин, Г(HCl)+Ас | 20–40 | 150–400 | Пленка, пористый матрикс |
Полив из раствора; термоиндуцированное фазовое разделение и высаливание | 5 | 2.0/1.2 (пленка) | 26/18 | [100, 101] | |
| ПЛА/П3ГБ-П3ГВ (85/15) | НК, α-хитин, Г(HCl) | 18 ± 4 | 210 ± 25 | Пористый матрикс | Экструзия с введением суспензии, СО2 при 4.14 МПа | 0.5–2 | 650/550 МПа | 37/20 МПа/(г/см3) | 15/60 | [102] |
| Коллаген | НФ, α-хитин, ДА | 10–20 | 200–1000 | Волокна | Мокрое формование | 15–20 | 12.1/5.8 (сухой) 1.0/0.1 (мокрый) |
500/310 (сухой) 47.3/1.9 (мокрый) |
13/17 (сухой) 9/9 (мокрый) |
[115] |
| Фиброин | НК, α-хитин, Г(HCl) | 8–74 | 180–820 | Пористый матрикс | Лиофильная сушка | 50 | 3335/443.5 кПа см3/г | [127] | ||
| Хитозан | НК, α-хитин, Г(HCl) | 6–8 | 100–200 | Гидрогель | Ковалентная сшивка суспензии | 13.3 | 169/2.5 кПа | 0.135/0.0032 | [140] | |
| ГБХ | НК, α-хитин, Г(H2SO4), наночатицы КМХ | 17 ± 3 | 130 | Гидрогель | Физическая сшивка суспензии | 0.5 | [141] | |||
| КМХ/ДАД | НК, α-хитин, Г(H2SO4) | 15 | 150–250 | Гидрогель | Ковалентная сшивка компонентов матрикса | 0.5 | 67/43 кПа | [142] | ||
| Хитозан/ ПЭО (1/1) | НК, α-хитин, Г(HCl) | 10–30 | 400 | Нетканый материал | Электроспининг | 50 | 4.3/0.4 | 34.9/4.6 | 0.9/1.3 | [144] |
| Хитозан | НФ, α-хитин | 20 | 600–800 | Волокна | Мокрое формование | 0.1–0.3 | 1.2/0.75 | 290/220 | [139] | |
| Хитозан/ ПЭО (9:1) | НФ, α-хитин | 20 | 600–800 | Нетканый материал | Электроспининг | 20 | [146] | |||
| Хитозан/ ПВА/ГАП | НК, α-хитин, Г(HCl) | 35 | 500 | Нетканый материал | Электроспининг | 17 | 6/2 МПа (без ГА) (мокрый) 9/2 МПа (с ГА) (мокрый) |
1.3/0.8 (без ГА) (мокрый) 1.5/1.7 (с ГА) (мокрый) |
[147] | |
| Хитозан | НК, α-хитин, Г(HCl) | 5–70 | 150–800 | Пленка | Полив из раствора | 2.96 | 83.8 ± 2.9/ 64.9 ± 0.7 | 8/12 | [148] | |
| Хитозан | НФ, α-хитин, ДА | 6.2 ± 1.1 | 250 ± 140 | Пленка | Полив из раствора | 90 | 9/2.5 | 150/40 | [150] | |
| Хитозан | НК, α-хитин, Г(HCl) | 20 | 300 | Пленка | Полив из раствора | 3 | 1.3/1.0 | 110/40 | 12/8 | [151] |
| Хитозан | НФ, α-хитин, М | 10 | 1000 | Пленка | Полив из раствора | 70 | 5.4 ± 0.7/ 2.2 ± 0.2 | 141 ± 3/52 ± 5 | 8/42 | [152] |
| Хитозан | НК, НФ, α-хитин, Г(HCl), М | 30
(НК) 85 (НФ) |
200 (НК) 5000 (НФ) |
Пленка | Полив из раствора | 67 | 4/2 (НК) 4/2 (НФ) |
40/40 (НК) 100/40 (НФ) |
[153] | |
| Хитозан | НК, α-хитин, Г(HCl) | 24 ± 11 | 540 ± 250 | Пленка | Полив из раствора | 43 | 5.3 ± 1.3/ 2.01 ± 0.36 | [154] | ||
| Хитозан | НФ, α-хитин | 20 | 600–800 | Пленка | Полив из раствора | 1–5 | 5.1/4.1 | 150/130 | 34–38/27 | [155] |
| Хитозан | НК, α-хитин, Г(HCl) | 15 | 200–500 | Пористый матрикс | Лиофильная сушка | 67 | 747/77 кПа (сухой) 40/3 кПа (мокрый) |
[162] | ||
| Хитозан | НК, НФ, α-хитин, Г(HCl), М | 30 (НК) 85 (НФ) |
200 (НК) 5000 (НФ) |
Пленка пористый матрикс |
Полив из раствора, лиофилизация, ко-валентная сшивка суспензии | 67 | 5/2.5 (НК) (пленка) 4/2.5 (НФ) (пленка) 1.00/0.15 МПа (НК) (матрикс) 0.95/0.15 МПа (НФ) (матрикс) |
[157] | ||
| Хитозан | НК, α-хитин, Г(HCl) | 14 | 200 | Инъекционный гидрогель | Термоиндуцированная сшивка глицерофосфатом | 5%(71% по отношению к хитозану) | 4/1.3 | 250/160 | [143] | |
| КМХ/глицерин (70/30) | НК, α-хитин, АПС | 15 | 400–500 | Пленка | Полив из раствора | 10 | 2.7/0.8 | 75.9 ± 2.6/ 40.3 ± 2.4 | 13.6/38.9 | [172] |
| КМХ | НК, α-хитин, ИЖ | 20–60 | 100–400 | Пленка | Сорбция НК на по-верхности пленки | 26.5 мкг/см2 | 24.2/7.1 | 7.6/2.6 | [175] | |
| Целлюлоза НФ | НК, α-хитин, Г(HCl) | 60 | 300 | Пленка | Горячее прессование | 0 | –/2.73 | –/57 | –/7.5 | [178] |
| Альгинат Ca | НК, α-хитин, Г(HCl) | 46 | 343 | Волокна | Мокрое формование | 0.15 | 10.5/9 сН/волокно | 27/18 | [191] | |
| Альгинат Ca | НК, α-хитин, Г(H2SO4) |
20 | 200–500 | Гидрогель | Ионная сшивка | 50 | 13.7/5.1 МПа | 3.18/1.39 | 80.3/75.6 | [182] |
| Крахмал/глицерин (77/23) | НСф, α-хитин, Г(HCl) | 50–100 | 50–100 | Пленка | Полив из раствора | 3.85 | 7.79/2.84 (50% RH) | 20/60 (50% RH) | [183] | |
| Крахмал/глицерин (60/40) | НК, α-хитин, Г(HCl) НФ, α-хитин, М |
60 (НК) 90 (НФ) |
300 (НК) 5000 (НФ) |
Лопатка | Экструзия, прессование из расплава | 12(НК) 12(НФ) |
390/85 МПа(НК) 520/85 МПа(НФ) (50% RH) |
10.8/4.4 (НК) 15.0/4.4 (НФ) (50% RH) |
12/85 (НК) 8/85 (НФ) (50% RH) |
[185] |
| Крахмал/глицерин (70/30) | НК, α-хитин, Г(HCl) НФ, α-хитин, М |
60 (НК) 90 (НФ) |
300 (НК) 8000–10 000 (НФ) |
Пленка | Полив из раствора | 14(НК) 14(НФ) |
75/10 МПа (НК) 425/10 МПа(НФ) (50% RH) |
3/1.5 (НК) 11/1.5 (НФ) (50% RH) |
20/75 (НК) 5/75 (НФ) (50% RH) |
[128] |
| Крахмал/глицерин (70/30) | НК, α-хитин, Г(H2SO4) |
10−50 | 100–400 | Пленка | Полив из раствора | 0.7 | 3.7/1.6 (53% RH) |
75/75 (53% RH) |
[186] |
Примечание. НФ – нанофибриллы; НК – нанокристаллы; НСф – наносферы; Ac-α-хитин – ацетилированные частицы α-хитина; Г(HCl) – кислотный гидролиз соляной кислотой; Г(H2SO4) – кислотный гидролиз серной кислотой; Ас – ацетилирование; ДА – метод частичного деацетилирования; ТЕМПО – метод ТЕМПО-окисления; АПС – окисление аммоний-персульфатом; М – механические методы диспергированя (гриндер, УЗ, микрофлюидные методы и т.д.); ИЖ – метод получения нанокристаллов осаждением в метанол из раствора хитина в ионной жидкости.
Рис. 6.
СЭМ-изображения (а, б) трехмерного матрикса П3ГБ-П3ГВ/α-хитин с содержанием полисахарида 10%; конфокальная микроскопия стволовых клеток жировой ткани человека после семи дней культивирования на матриксе из чистого П3ГБ-П3ГВ (в) и матриксе из композита П3ГБ-П3ГВ/α-хитин (г) [101].

В [102] показано усиливающее действие нанокристаллов α‑хитина (l = 210 ± 25 нм, d = 18 ± ± 4 нм) на смесь полимеров ПЛА/П3ГБ-П3ГВ (соотношение 85/15). Композит получали смешением в расплаве, наночастицы полисахарида вводили в расплав в виде 20%-ной суспензии в N,N-диметилацетамиде, для улучшения совместимости полимерной матрицы и наполнителя первая была модифицирована малеиновым ангидридом. Полимерная смесь ПЛА/П3ГБ-П3ГВ была выбрана в качестве матрикса для композита, поскольку такая небольшая добавка П3ГБ-П3ГВ позволяет получать равномерную пористую структуру в материале при воздействии СО2 при повышенном давлении (4.14 МПа). Таким способом были получены композиционные материалы с содержанием наполнителя 0.5–5 мас. %. Введение нанокристаллов α‑хитина в количестве ≤2% уменьшало плотность материала с 0.75 г/см3, характерных для полимерной смеси без наполнителя, до 0.4–0.5 г/см3 у композита. Вместе со снижением плотности практически в 2 раза возрастала удельная прочность композита в сравнении с ненаполненной ПЛА/П3ГБ-П3ГВ (с 20 до 37 МПа/(г/см3)). Отметим, что размер пор данного материала в среднем составляет 1.5 мкм, что недостаточно для роста клеток млекопитающих [61].
3. КОМПОЗИТЫ НА ОСНОВЕ ПРИРОДНЫХ ПОЛИМЕРОВ
Природные полимеры обладают рядом преимуществ, которые делают их привлекательными для получения материалов медицинского назначения на их основе. Так, все природные полимеры биоразлагаемы, многие из них широко распространены и биосовместимы после необходимой очистки, кроме того, они обладают большим количеством и разнообразием функциональных групп [103, 104]. При этом недостатки данных полимеров накладывают определенные ограничения на способы получения материалов на их основе и их последующее применение. К примеру, природные полимеры не предназначены для функционирования при высоких температурах и потому зачастую могут быть переработаны лишь в узком температурном интервале [103]. Кроме того, большая часть кристаллических природных полисахаридов разлагается при более низкой температуре, чем плавится [105]. В связи с этими ограничениями на первый план выходят методы получения композитов на основе природных полимеров и НЧХ, где в качестве основы используются растворы и суспензии полимеров. Расплавные методики для получения композитов из природных полисахаридов применимы лишь там, где разработаны эффективные методы пластификации, например, при использовании в качестве полимерной матрицы композита термопластифицированного крахмала [106].
3.1. Природные протеиновые полимеры
3.1.1. Коллаген. Коллаген – это один из наиболее используемых материалов в тканевой инженерии, регенеративной медицине, косметологии, стоматологии и других медицинских областях [9, 107–110]. Он представляет собой белок, который формирует иерархически организованные тройные спирали и является ключевым компонентом экстрацеллюлярного матрикса различных тканей позвоночных [111]. Коллаген для медицинского применения обычно используют в виде ксенографтов (участков децелюляризированных тканей животного), выделенных из крупного рогатого скота и свиней; они нетоксичны, биосовместимы, быстро разлагаются в теле человека [9]. Однако, несмотря на прекрасные биологические свойства матрикса из чистого коллагена, его механические свойства и структурная стабильность недостаточны для адекватной замены участка ткани человека. Физическая и химическая обработка, межмолекулярная сшивка приводят к изменению свойств матрикса [9]. Для улучшения механических характеристик матриксов на основе коллагена в их состав вводят синтетические и природные полимеры, такие как ПЛА, поли-ε-капролактон, хитозан, целлюлоза [112–114]. Хитин также может выступать армирующим наполнителем в матрицах на основе коллагена.
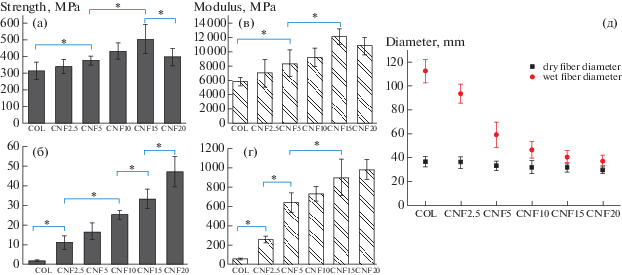
Так, методом мокрого формования из суспензии, содержащей коллаген и фибриллы α‑хитина, были получены волокна композиционного материала диаметром 35–100 мкм, содержание полисахарида в которых варьировалось от 2.5 до 20 мас. % [115]. Для данного композита частичным деацетилированием были получены фибриллы α-хитина диаметром 10–20 и длиной 200–1000 нм [116]. Особенностью метода было то, что осадителем для коллагена выступал 1%-ный раствор альгината натрия, что позволило мягко получать волокна без повреждения тройной спирали коллагена [115]. Введение нанофибрилл хитина способствовало значительному улучшению механических свойств композита относительно чистого коллагена как в сухом, так и во влажном состоянии, а также снижению степени набухания в фосфатном буфере (рис. 7). Максимальный усиливающий эффект частиц полисахарида в сухом состоянии наблюдался при их содержании 15 мас. %. Но наиболее ярко усиливающий эффект нанофибрилл хитина был заметен после выдерживания волокон с наполнением 20 мас. % в течение 90 мин в фосфатном буфере. Так, предел прочности волокна без наполнителя во влажном состоянии составлял до 1.9 МПа, а модуль – менее 100 МПа, тогда как предел прочности композита – 47.3 МПа, а модуль – 1000 МПа. Отметим, что при набухании диаметр волокна из чистого коллагена увеличивался в 3 раза, в то время как композиты с содержанием хитина ≥10 мас. % набухали незначительно. Цитотоксичность по отношению к фибробластам была оценена с помощью МТТ-теста. Жизнеспособность клеток на композитном материале несущественно отличалась от чистого коллагена.
Рис. 7.
Механические свойства чистого коллагена (COL) и композитов, наполненных фибриллами α-хитина (CNF№, где № – содержание фибрилл в композите в мас. %): предел прочности волокон композита в сухом состоянии (а) и после выдерживания 90 мин в фосфатном буфере (б); модуль Юнга в сухом состоянии (в) и после фосфатного буфера (г). Диаметры волокон материалов в сухом состоянии и после 90 мин в фосфатном буфере (д) [115].
Также существуют работы, в которых основным материалом композита является хитин, а коллаген покрывает хитиновый “каркас”, увеличивая биосовместимость материала и способствуя улучшению пролиферации и дифференциации культивируемых клеток. Так, в [117] показано, что коммерчески доступная мембрана из хитина (Hunan Yinghua Biomedical Co.), представляющая собой нетканый материал, полученный методом электроспининга (диаметр волокон 10–15 мкм), при обработке раствором коллагена становилась более комфортной средой для культивирования эпидермальных стволовых клеток мышей. На основе данного материала был создан матрикс, включающий в себя клеточные компоненты кожи для более эффективного заживления ран мышей. Отметим, что матрикс на основе хитина, покрытый коллагеном, также ускорял ранозаживление по сравнению с контрольной группой, в которой повреждения были обработаны чистым коллагеном.
3.1.2. Фиброин шелка. Фиброин шелка – это белок, выделяемый из куколок бабочек Bombyx mori и ряда пауков и давно используемый в медицине в качестве шовного материала. Однако его применение без детальной характеризации может быть сопряжено с нежелательным иммунным ответом, который связывают прежде всего с недостаточной очисткой от серицина и отходов шелковой промышленности [118, 119]. После соответствующей очистки фиброин демонстрирует уровень биосовместимости, сравнимый с ПЛА и коллагеном [120]. На материалах на его основе успешно культивируют мезенхимальные стволовые клетки [120], эндотелиальные клетки [121], кератиноциты, фибробласты [124, 125] и остео-бласты [126], что делает их перспективными для тканевой инженерии. Волокна шелка также отличаются высокой прочностью и ударной вязкостью в сочетании с эластичностью [118]. Но при переработке фиброин теряет свою надмолекулярную упаковку, при попытке восстановить β-складчатую структуру мягким методом, таким как отжиг в растворителе, материал усаживается. Это явление особенно характерно для высокопористых материалов, таких как губки [127]. Введение усиливающих наполнителей может повлиять на этот эффект.
В [127] методом лиофильной сушки получен материал на основе нанокристаллов α-хитина и фиброина шелка. Водный раствор фиброина, полученный диализом из раствора фиброина в смеси этанол/CaCl2, смешивали с суспензией нанокристаллов, а затем замораживали и лиофилизовали. Содержание хитина в губке варьировалось от 11 до 50 мас. %. Далее для восстановления структуры фиброина губки помещали в 90%-ный раствор метанола, а после отмывки в воде снова лиофилизовали. Введение нанокристаллов хитина уменьшало усадку материала при отжиге в растворителе, так, объем губки из чистого фиброина после обработки в метаноле уменьшался на 37%, в то время как для губок, наполненных 20–50 мас. % полисахарида, – меньше 10%. Исследование механических свойств материала при сжатии показало, что при нормировке модуля на плотность материала наблюдается монотонный рост модуля по мере увеличения наполнения, удельный модуль композита, наполненного 50% нанокристаллов, превышает модуль ненаполненной матрицы в 7.5 раза. Исследование биологических свойств матриксов показало, что при культивировании фибробластов мыши линии L929 уровень адгезии фибробластов у композитных губок не отличается от материала из чистого фиброина шелка. Однако после 24 ч культивации на губке, наполненной 50 мас. % хитина, доля фибробластов, имеющих типичную уплощенную и распластанную форму, составила 61%, в то время как у материала из чистого фиброина только 31%. Эти данные показывают, что нанокристаллы хитина в составе губок на основе фиброина шелка содействуют распространению фибробластов по материалу.
3.2. Природные полисахариды
Одно из достоинств использования полисахаридов в качестве матрицы для композитов, наполненных частицами хитина, – это их структурное сходство, которое может обеспечить сильное взаимодействие между компонентами композита и, соответственно, значительное усиливающее действие нанокристаллов и/или нанофибрилл [128]. Кроме того, природные полисахариды занимают лидирующее положение по доступности, так, к трем наиболее распространенным полимерам в природе относят целлюлозу, хитин и крахмал [104]. В связи с этим достаточно большое количество работ, как будет заметно ниже, посвящено композитам на основе полисахаридов, наполненных нанокристаллами или нанофибриллами хитина.
3.2.1. Хитозан и его производные. Хитозан – это N-деацетилированное производное хитина, используемое в различных областях медицины: регенерации костной ткани, стоматологии [129–131], системах для доставки лекарств [132, 133], реконструкции нервной ткани [134, 135], терапии ран и ожогов и тканевой инженерии [136–138]. Большой интерес к хитозану вызван тем, что он сочетает такие свойства, как биоразлагаемость, биосовместимость, нетоксичность, антибактериальная активность [131]. Однако в силу своей гидрофильной природы хитозан обладает недостаточными механическими свойствами во влажном состоянии, в связи с чем хитозан применяют, часто используя химические сшивающие агенты или смешивая с другими полимерами или усиливающим наполнителем [10, 139].
Композитные материалы на основе хитозана и НЧХ могут быть получены в форме гидрогелей [140–143], волокнистых материалов [139, 144–147], пленок [148–157], пористых матриксов [157–162], микрочастиц [163–165]. Композиты получают, используя водные растворы и суспензии: пленки получают методом полива [148–157]; волокнистые материалы – электроспинингом из раствора [144–147] или мокрым формованием суспензии в раствор осадителя [139]; пористые матриксы – лиофильной сушкой предварительно замороженной суспензии [157–162]. Для получения стабильных композитных гидрогелей необходимо создавать физические или ковалентные узлы зацеплений. Ковалентные узлы в гидрогелях на основе хитозана и НЧХ формируют с использованием различных сшивающих агентов: гексаметилен 1,6-диаминокарбоксисульфоната [140], диальдегид декстрана (ДАД) [142]. Ковалентную сшивку также используют для стабилизации структуры и/или ограничения степени набухания композитных пленок (глутаровый альдегид (ГА) [149], генепин [159–161]), пористых матриксов (генепин [157, 159–161]), нетканого материала (ГА [147]) и микрочастиц (ГА [163, 164]) на основе хитозана и хитина. Большая часть сшивающих агентов использует для сшивки свободные аминогруппы, а глутаровый альдегид дополнительно имидные и гидроксильные группы, поэтому ковалентные связи образуются как между молекулами хитозана, так и между ним и частицами хитина [140, 149, 157]. Формирование физических узлов зацеплений применяют при получении термоиндуцированных композитных гидрогелей. Для этого добавляют глицерофосфат [143] или используют в качестве матрицы гидроксибутилхитозан (ГБХ) [141] – производное хитозана, способное обратимо переходить из золя в гель при повышении температуры до физиологических значений. Введение НЧХ в состав термоиндуцированных гидрогелей может увеличивать скорость [143], уменьшать температуру гелеобразования и способствовать сохранению целостности раневого покрытия на основе гидрогеля [141]. Стабильность в водных средах материалов, полученных из хитина и хитозана, можно также увеличивать, проводя высокотемпературную обработку композита водяным паром, которая уменьшает равновесную степень набухания композита и долю вымываемого полимера при выдерживании в воде [148].
Часто к хитину и хитозану добавляют один или несколько других компонентов. Так, при получении композитов хитин/хитозан методом электроспининга добавляют волокнообразующие полимеры, такие как ПЭГ [144–146] и ПВА [147]. В большей части работ по получению композитов на основе хитина и хитозана методом электроспининга использовали большие концентрации волокнообразующих добавок по отношению к хитозану: 50 мас. % ПЭГ [144, 145], 30 мас. % ПВА [147]. Высокомолекулярные добавки ПЭГ и ПВА, несмотря на свою нетоксичность, не разлагаются в организме [166, 167], что является ограничением в случае материалов для биомедицинского применения. В [146] оптимизирован состав смеси для получения композиционного нетканого материала на основе хитозана и нанофибрилл α-хитина с добавкой ПЭГ. Установлено, что даже небольшое количество нанофибрилл хитина (около 1% по отношению к хитозану) значительно уменьшает поверхностное натяжение суспензии [146], что важно для получения материала методом электроспининга. Кроме того, при концентрации около 20% по отношению к хитозану (~1 мас. % в суспензии) в суспензии формируются кластеры нанофибрилл, которые сохраняются и ориентируются при электроспининге. Это приводит к сильным различиям в механических свойствах струи в продольном и поперечном направлении и способствует разделению струи на микроструи и формированию практически бездефектного нетканого материала с малой добавкой ПЭГ (10 мас. % по отношению к хитозану). Тем не менее отметим, что методом мокрого формования удается получать волокна, состоящие только из хитозана и нанофибрилл хитина [139]. Также в состав материалов на основе хитозана и НЧХ вводят различные функциональные добавки: фактор роста эпителиальных клеток, антибиотик линезолид [141], ГАП [159], желатин [161]. Композитные микрочастицы нагружали цисплатином [163] и метатрексатом [164]. В обеих работах по получению микрочастиц отмечается, что по мере увеличения содержания хитина в микрочастице возрастает и загрузка препарата, которая достигает для цисплатина 180 (мг Pt)/мг [163], а для метотрексата более 50 мас. % [164]. Введение хитина в микрочастицы замедляло выделение цисплатина, а также подавляло начальный взрывной эффект увеличения концентрации препарата [163].
Так как НЧХ анизометричны, обладают высоким модулем упругости, они способны оказывать усиливающее действие, которое исследовалось в широком спектре работ, посвященных композитам хитозан/хитин, где нанокристаллы и нанофибриллы хитина увеличивают модуль Юнга и/или предел прочности материала. В большинстве работ рост этих параметров происходит монотонно по мере роста концентрации наполнителя в исследуемом диапазоне [140, 142, 150, 152, 153, 155, 157, 162]. Причем данный эффект был показан на высоконаполненных материалах, где концентрация НЧХ достигает 67 [153], 70 [152] и даже 90 мас. % [150]. Однако в ряде работ модуль и/или предел прочности проходят через максимум при относительно небольшом содержании хитина: 0.1–0.3 [139], 2.96 [148], 3 [151] и 1–5 мас. % [155]. Отметим работу [154], где наблюдали уменьшение модуля Юнга при увеличении концентрации нанокристаллов хитина в композитных пленках от 43 до 75 мас. %. Кроме того, неоднозначно влияние наполнителя на относительное удлинение при разрыве: в части работ по мере увеличения концентрации хитина в композите уменьшается его относительное удлинение при разрыве [144, 148, 152], однако некоторые исследователи отмечают увеличение деформации материала при оптимальном содержании наполнителя в композите [143, 151, 155]. Заметим, что увеличение удлинения при разрыве характерно лишь для композитов с низким содержанием НЧХ (≤5 мас. %), что, возможно, связано с тем, что при данных концентрациях не достигается порог перколяции [139]. Введение хитина в материал на основе хитозана также может уменьшать равновесную степень набухания [140, 148, 149, 156], замедлять сорбцию воды [149], увеличивать силу адгезии гидрогеля к коже [142].
Спектр возможных применений композитов на основе хитозана и НЧХ включает материалы для терапии ран и ожогов [141, 143, 144, 155], для замещения дефектов хрящевой [158–161, 168] и костной ткани [147, 156, 162], тканевой клей [142], а также для систем доставки и пролонгированного действия лекарственных препаратов [163, 164]. Исследованные материалы показали отсутствие цитотоксичности в отношении жировой ткани, фибробластов [142–144, 157], остеобластов мыши [147, 162], стволовых клеток жировой ткани человека [157, 168] даже при использовании глутарового альдегида в качестве сшивающего агента [147]. Также на материалах из хитозана и хитина наблюдается высокий уровень адгезии хондроцитов [158], фибробластов [155, 157] и мезенхимальных стволовых клеток жировой ткани [157]. По мере увеличения содержания хитина в матриксах могут возрастать жизнеспособность и пролиферативная активность остеобластов [147]. На композитных пленках хитин/хитозан было показано, что применение более высокомолекулярного хитозана и его последующая нейтрализация способствуют формированию более соответствующего естественному цитоскелета стромальных клеток костного мозга крысы и увеличивают уровень их пролиферации [156]. На поверхности пористого матрикса из хитозана, наполненного 33 мас. % нанокристаллов α-хитина, в условиях гипоксии удалось дифференцировать мезенхимальные стволовые клетки жировой ткани в хондросфероиды и получить хондральный внеклеточный матрикс с высоким содержанием сульфатированного гликозаминогликана, который характерен для суставного хряща [168].
Помимо биосовместимости с клетками тканей животных материалы на основе хитина и хитозана могут оказывать ингибирующее действие на рост различных бактерий (S. aureus, E. coli [142, 151], C. michiganence [151]) и грибов (Alternaria alternata [150], A. niger [153]). В некоторых исследованиях активность против грибов связывают прежде всего с присутствием в композите хитозана [150]. В других, наоборот, отмечают, что ингибирующий эффект на рост грибов выше у композитов, чем у материала из чистого хитозана, причем композиты, наполненные нанофибриллами α-хитина, демонстрируют более сильное подавляющее действие на рост A. niger, чем наполненные нанокристаллами [153]. Ma et al. показывают, что бактерицидный эффект выше у композиционных пленок по сравнению с пленками из чистого хитозана [151], в то время как Pang et al. демонстрируют, что ингибирование роста бактерий в основном связано со сшивающим агентом гидрогеля – ДАД [142]. Таким образом, результаты по ингибирующей активности на жизнедеятельность микроорганизмов достаточно противоречивы, возможно, в силу малого количества исследований, поэтому в [141] для терапии хронических ран мышей использовали комплексный гидрогель, включающий ГБХ, нанокристаллы хитина и наночастицы карбоксиметилхитозана (КМХ), и нагружали его дополнительно антибиотиком линезолидом и фактором роста эпителиальных клеток. Они показали, что данная комбинация компонентов обеспечила более быстрое заживление ран, сопровождаемое формированием плотной коллагеновой и сосудистой сетки [141].
3.2.2. Целлюлоза и ее производные. Целлюлоза – самый распространенный полимер на Земле, она является компонентом клеточных стенок большинства растений, а также входит в состав наружных покровов некоторых хордовых животных – оболочников [19]. Целлюлоза – это высококристаллический полимер, не растворимый в большинстве стандартных растворителей, что усложняет переработку целлюлозы и ее использование в составе композитов. Однако данную проблему можно устранить с помощью следующих вариантов. Так, целлюлоза обладает большим количеством гидроксильных групп, удобных для модификации, посредством которой можно улучшить ее растворимость в различных растворителях, например, в воде [169]. Кроме того, для целлюлозы характерен ряд нетипичных растворителей, таких как ионные жидкости, растворы некоторых комплексных соединений в воде, расплавы гидратов неорганических солей, водные растворы щелочи и щелочи с мочевиной, растворы, содержащие тиоционат, различные соли имидазолия и органические растворители, содержащие соли лития [169]. Также для получения композитов целлюлозу часто используют в виде суспензий нанокристаллов и нанофибрилл, диспергированных различными способами [170]. Подобные подходы применимы при приготовлении различных композиционных материалов на основе целлюлозы и хитина.
Так, водорастворимая карбоксиметилцеллюлоза (КМЦ) может служить основой раневых покрытий [171]. Oun et al. использовали в качестве матрицы для композитов КМЦ, пластифицированную глицерином, и наполняли ее нанокристаллами α-хитина, полученными методом окисления аммоний персульфатом [172], в результате которого на поверхности стержнеобразных нанокристаллов образуются карбоксильные группы. Композитные пленки с содержанием наполнителя 1–10 мас. % были изготовлены методом полива. Исследование их механических свойств показало, что модуль Юнга и предел прочности увеличиваются по мере роста концентрации наполнителя, а удлинение при разрыве падает. Так, пленка, содержащая 10% хитина, демонстрирует более чем трехкратное увеличение модуля и почти двукратное увеличение предела прочности. Сравнение усиливающего действия нанокристаллов α-хитина, полученных окислением аммоний персульфатом и гидролизом в концентрированной серной кислоте, показало, что при наполнении 5% значимых различий во влиянии типа наполнителя не наблюдается [173]. Введение в состав композита 5 мас. % масла виноградной косточки не ухудшает исследуемые механические свойства материалов, но подавляет рост грамотрицательных (E. coli) и грамположительных бактерий (L. monocytogenes). Также в [174] в качестве антибактериальной добавки были использованы наночастицы ZnO–Ag, стабилизированные при синтезе нанокристаллами α-хитина. В [175] для создания композитов использовали электростатическое притяжение между кислотной формой КМЦ и нанокристаллами α-хитина. Композитные пленки получали методом сорбции нанокристаллов из суспензии на пленку КМЦ. Плотность получаемого слоя зависела от содержания нанокристаллов в суспензии метанола и составляла 13.9, 17.5 и 26.5 мкг/см2 при концентрации в суспензии 0.75, 1.50 и 3.00 мг/мл соответственно. Предел прочности и удлинение при разрыве возрастали по мере увеличения концентрации наночастиц на поверхности пленки. Так, для композита с содержанием хитина 26.5 мкг/см2 предел прочности и удлинение составляли 24.2 МПа и 7.6%, а для пленки КМЦ только 7.1 МПа и 2.6% соответственно.
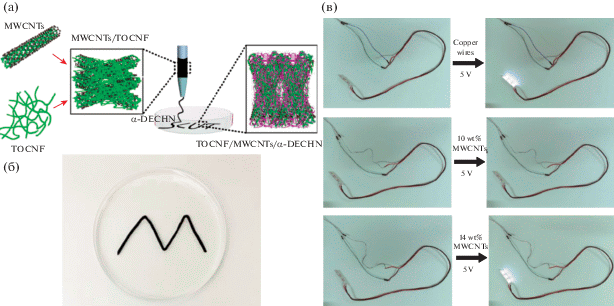
Зарядовые взаимодействия между карбоксильными группами нанофибрилл целлюлозы, полученными методом ТЕМПО-окисления, и аминогруппами поверхностно деацетилированных нанокристаллов α-хитина использовали в [176] для получения композитных волокон методом мокрого формования с соотношением полисахаридов 50/50. В качестве раствора-осадителя выступала суспензия нанокристаллов хитина, в которую через иглу диаметром 0.6 мм подавали суспензию нанофибрилл целлюлозы (рис. 8). Как функциональную добавку для придания композиту электропроводности использовали многослойные углеродные нанотрубки. Перколяционный порог проводимости был достигнут при концентрации нанотрубок в композите 14 мас. %, при которой проводимость композита достигла 1.6 мСм/см, что позволило подать питание на светодиод при напряжении 5 В (рис. 8в). Проводящие свойства этих материалов демонстрируют большой потенциал применения подобных композитов в качестве биосовместимых и/или биоразлагаемых проводящих материалов.
Рис. 8.
Схематическое изображение метода получения композитного волокна (а): MWCNTs – многослойные углеродные нанотрубки; TOCNF – нанофибриллы целлюлозы, полученные методом ТЕМПО-окисления; α-DECHN – поверхностно деацетилированные нанокристаллы α-хитина. Фотография композитного волокна в чашке Петри сразу после осаждения (б). Фотография светодиода, электропитание к которому подведено через медный провод (сверху), композит с содержанием углеродных нанотрубок 10 (посредине) и 14 мас. % (снизу) (в) [176].
При создании композитов на основе целлюлозы можно использовать ее способность необратимо агрегировать при сушке [177], так, на основе нанофибрилл целлюлозы I и нанокристаллов α-хитина методом горячего прессования были получены пленки с 1–10 мас. % хитина [178]. Данные пленки отличали высокая удельная площадь поверхности (~70–80 м2/г) и пористость около 30%, причем содержание хитина не оказало значимого влияния на эти параметры. Введение нанокристаллов не влияло на предел прочности и модуль Юнга, но практически в 2 раза снижало относительную деформацию при разрыве. При этом деформация уменьшалась при 1%-ной концентрации α-хитина и далее не изменялась при увеличении содержания этого полисахарида. Однако введение хитина в состав пленки способствовало подавлению роста грибов Aspergillus sp., чья жизнеспособность монотонно уменьшалась по мере увеличения концентрации хитина в композиционной пленке: с 40% для пленки из нанофибрилл целлюлозы до 18% для пленки, наполненной 10% хитина.
3.2.3. Крахмал. Крахмал – основной запасающий полисахарид большинства растений, он входит в тройку лидеров по распространенности среди полимерных материалов на Земле. Крахмал состоит из остатков глюкозы, соединенных в линейные (амилоза) и разветвленные цепи (амилопектин) [179, 180]. В отличие от многих других природных полисахаридов крахмал может быть переведен в термопластическое состояние при добавлении воды, сахаров, альдитолов, а также глицерина и этиленгликоля [181]. Благодаря своей биоразлагаемости, биосовместимости крахмал находит биомедицинское применение [180], однако его относительно плохие механические свойства и высокая гидрофильность ограничивают применение его как монокомпонентного материала и побуждают получать и исследовать его модификации и композиционные материалы [179]. НЧХ подходят для решения подобных задач и демонстрируют свою эффективность на примере других полисахаридных матриц [182].
Первой по получению и исследованию композитов крахмал/хитин стала работа [183]. Для наполнения термопластифицированного глицерином крахмала использовали наночастицы α-хитина, содержание которых варьировали от 0.77 до 3.85 мас. % (1–5 мас. % по отношению к крахмалу). Однако, несмотря на применение широко известного метода выделения нанокристаллов кислотным гидролизом, не удалось получить стержнеподобные нанокристаллы [184]. Выделенные частицы хитина обладали меньшей степенью кристалличности, чем исходный хитин, и имели скорее округлую форму. Тем не менее по мере увеличения содержания наполнителя кратно увеличивался предел прочности и уменьшалось относительное удлинение при разрыве.
Более комплексно нанокомпозиты на основе термопластифицированного крахмала и α-хитина исследованы в [128, 185], где варьировали как тип наполнителя (нанокристаллы или нанофибриллы), так и способ получения композита (экструзия или полив из раствора). В работах было показано, что для всех типов наполнителя наблюдаются монотонный рост модуля Юнга и предела прочности и уменьшение удлинения при разрыве по мере увеличения концентрации наполнителя до 12–14 мас. % (до 20 мас. % по отношению к крахмалу). При всех исследованных способах получения нанофибриллы, обладающие большим характеристическим отношением, показали себя более эффективным усиливающим наполнителем. Отметим, что способ получения оказывает существенное влияние на механические свойства как для чистого пластифицированного крахмала, так и для композитов. Так, более высокий модуль и предел прочности наблюдали у крахмала и композитов с ним, полученных методом экструзии. Однако переработка методом экструзии и последующее литье под давлением приводят к потемнению материалов [185], причем композиты окрашены сильнее, чем полимерная матрица.
В работе [186] показан несколько иной характер зависимости механических свойств композитов от содержания нанокристаллов α-хитина. В исследовании в композитах на основе термопластифицированного крахмала в диапазоне концентраций наполнителя 0.35–3.5 мас. % (0.5–5 мас. % по отношению к крахмалу) максимальный предел прочности наблюдался при содержании 0.7% (1% по отношению к крахмалу). Тем не менее удлинение при разрыве и степень набухания композита в воде монотонно уменьшались по мере увеличения концентрации нанокристаллов α-хитина.
Исследованные композиты показывают ингибирующее действие на рост грибов A. niger [128] и бактерий E. coli и L. monocytogenes [186], причем эффект возрастал по мере увеличения концентрации хитина.
3.2.4. Альгинаты. Альгинаты – это линейные водорастворимые гетерополисахариды, состоящие из остатков уроновых кислот (D-манноуроновой и α-L-гулуроновой), выделяемые в основном из бурых водорослей, таких как Laminaria sp. и Ascophyllum sp. Вследствие большого количества карбоксильных групп альгинаты легко сшиваются ионами двухвалентных металлов, например, Са2+. Это свойство, а также их биосовместимость и биоразлагаемость делают альгинаты перспективной основой для широкого спектра передовых биомедицинских изделий, особенно при терапии ран и ожогов [187]. Ряд компаний уже создал гидрогелевые (AlgiSite™, Kaltostat™, Tegagel™ и т.д.) и волокнистые (Algosteril™, Kaltostat™, Sorbsan™ и т.д.) раневые покрытия [188]. Материалы на основе альгинатов могут быть наполнены водорастворимыми лекарственнными средствами и ферментами, обеспечивая их пролонгированное действие [189, 190]. Для функциональной модификации и улучшения механических свойств альгинатные гели смешивают с другими полимерами или наполнителями [187]. В качестве усиливающего и функционального наполнителя могут быть использованы НЧХ.
Одна из первых работ по исследованию композиционных волокон альгинат/хитин представлена в [191]. Волокна получали методом мокрого формования из суспензии нанокристаллов α-хитина в растворе альгината натрия, пропуская через осадительную ванну с раствором CaCl2 в 50%-ном метаноле. Концентрацию нанокристаллов варьировали в диапазоне 0.05–2.00 мас. %. Исследование механических свойств показало, что в сухом состоянии композит с содержанием НЧХ 0.15% обладает максимальной прочностью и удлинением при разрыве. Дальнейшее увеличение концентрации приводит к агрегации наполнителя и, соответственно, ухудшению механических характеристик композитных волокон. Данный эффект наблюдается при смешении положительно заряженных НЧХ с отрицательно заряженной матрицей [182]. В [182] предложен способ устранения этого негативного эффекта. В качестве наполнителя были использованы нанокристаллы α-хитина, полученные гидролизом в H2SO4, приводящим к появлению некоторого количества сульфогрупп на поверхности нанокристалла. В результате суспензии наполнителя становятся стабильными не только в кислой, но и щелочной среде, в которой проводят смешение с раствором альгината. В щелочной среде аминогруппы хитина не заряжены, потому не происходит осаждения и агрегации при смешении частиц хитина и раствора альгината. Изменение pH среды проводят после фиксации структуры гидрогеля ионами Са2+. Данный подход позволил получить композитные альгинатные гидрогели с содержанием нанокристаллов хитина от 20 до 56 мас. %. Оптимальная концентрация наполнителя составила 50% и позволила увеличить в 2.3 раза прочность материала по сравнению с чистой полимерной матрицей и в 2.7 раза модуль Юнга при сохранении относительной деформации при разрушении на уровне ~75–80%. Механические характеристики гидрогеля таковы, что стержень гидрогеля с содержанием воды 96% и хитина 2% можно завязать узлом и развязать обратно (рис. 9). Отметим, что введение нанокристаллов хитина уменьшает скорость и предельную степень набухания с 35 до 15 раз. Кроме того, по мере увеличения содержания наполнителя возрастают адгезия и скорость пролиферации линии MC3T3-E1 преостеобластов мыши, что делает данные композиционные материалы перспективными в качестве матриксов для лечения дефектов костной ткани.
Рис. 9.
Фотография гидрогеля с содержанием хитина 50 мас. % (общее количество полимеров в гидрогеле 4%), завязанного узлом (а) и развязанного (б) [182].
3.2.5. Гиалуроновая кислота. Гиалуроновая кислота (ГК) – это природный водорастворимый линейный несульфатированный глюкозаминогликан, мономерным звеном которого является дисахарид, состоящий из остатков β-1,4-глюкуроновой кислоты и β-1,3-N-ацетилглюкозамина [192]. Этот полисахарид является компонентом межклеточного матрикса, участвует в передаче клеточных сигналов, заживлении ран и морфогенезе [193]. Гидрогели на основе ГК и ее производных исследуют в качестве раневых покрытий, систем для доставки лекарств, частиц и клеток, а также тканевой инженерии [192]. Так как ГК является полианионом, ее интенсивно исследуют в качестве компонента для получения микрочастиц в паре с поликатионами [194], поскольку данный подход показал свою перспективность по сравнению с применением однокомпонентных систем для доставки лекарств [195]. НЧХ могут выступать в качестве поликатиона вследствие присутствия свободных аминогрупп на поверхности.
В [196] сравнивали гидрогелевые микрочастицы на основе ГК в сочетании с хитозаном, аморфным хитином и нанофибриллами α-хитина, наполненные лютеином. Метод заключался в осаждении смеси катионного полимера с лютеином при капельном введении в раствор ГК. Композитные микрочастицы на основе фибрилл хитина показали наибольшую эффективность по выходу частиц (42% против 31–33% у остальных материалов) и загрузке действующим веществом – лютеином (35% против 18% у материала с аморфным хитином и 10% у частиц с хитозаном), а также более медленное его высвобождение. Причем скорость высвобождения лютеина из данных композитных частиц была практически постоянной в течение 45 ч. Данные результаты делают эти микрочастицы подходящей системой для доставки лекарств, например, при антивозрастной терапии в косметологии или при регенерации кожи. В [197] также использовали композит хитин/ГК в качестве материала для создания таблетированных лекарственных форм препаратов пролонгированного действия. Для получения таблеток суспензию поверхностно деацетилированных фибрилл α-хитина смешивали с раствором ГК, лиофилизовали, а затем прессовали. Модельным лекарственным препаратом для загрузки служил фамотидин, содержание которого в полученной таблетке составляло 90 мас. %. Таблетки на основе интерполиэлектролитоного комплекса хитин/ГК обеспечивают более длительное высвобождение лекарственного средства по сравнению с таблетками, состоящими только из нанофибрилл хитина. По данным мутности смеси и рентгеноструктурному анализу оптимальным соотношением нанофибрилл и ГК является 1: 1.
Подводя итоги к разделу о композитах на основе природных полимеров, наполненных нанокристаллами или нанофибриллами хитина, отметим следующее. Наиболее распространенным наполнителем, используемым при получении композиционных материалов, являются нанокристаллы α-хитина, полученные кислотным гидролизом, – их используют более чем в 60% работ. Заметим, что в тех работах, где были использованы как нанокристаллы, так и нанофибриллы, последние оказывают более выраженный усиливающий эффект на полимерную матрицу хитозана [153], крахмала [128, 185], если не применяется дополнительно сшивающий агент. При применении ковалентной сшивки усиливающий эффект этих двух видов наполнителя становится сравнимым [157]. Кроме того, в некоторых работах по получению материалов на основе матриц природного происхождения и хитина используют их совместные растворители, разрушая тем самым кристаллическую структуру последнего и получая смеси полимеров. Такой подход применяли при получении материала на основе хитина и коллагена [198], целлюлозы [199], пектина [200], фиброина шелка [201–205], ГК [206], но он не подходит под тематику данного обзора. Отметим, что нам не удалось найти работ по получению композитов на основе хитина и резилина, альбумина, декстрана. Всего лишь одна работа [207] посвящена сравнительному исследованию усиливающего действия нанокристаллов целлюлозы и α-хитина на матрицу гуара и гидроксипропилгуара. Также обнаружена только одна работа по получению композита на основе карагеннана и хитина, в которой исследовалась молекулярная динамика методом диэлектрической спектроскопии [208], что также выходит за рамки данного обзора. Все исследователи отмечают отличные характеристики материалов по отношению к клеточным культурам различных тканей млекопитающих: нетоксичность, цитосовместимость, высокую адгезию и скорость пролиферации, в большинстве случаев хитин оказывает положительное влияние на эти параметры композита. Кроме того, в ряде работ показано, что введение НЧХ сдерживает рост бактерий и грибов.
ЗАКЛЮЧЕНИЕ
Наночастицы хитина для получения композитов на основе биоразлагаемых полимеров выделяют из различных источников широким спектром методов, но наиболее часто применяемым является кислотный гидролиз в растворе соляной кислоты – простой в применении, позволяющий получить нанокристаллы полисахарида. Остальные методы, такие как частичное деацетилирование, механическое диспергирование, гидролиз в серной кислоте и поверхностное окисление, гораздо менее распространены в исследовательских работах. Также наиболее используемой при наполнении композитов полиморфной модификацией хитина является α-форма. Среди методов получения композитов заметно преобладают техники с использованием растворителя. Эти методы позволяют уменьшить вязкость среды при смешении с высокомолекулярным полимером, сохранить высокий уровень дисперсности наполнителя и тем самым способствуют его более равномерному распределению в материале. Кроме того, в случае применения природных полимеров в качестве матрицы растворные методы – единственно возможный вариант получения. Отметим, что необходимость создавать из биоразлагаемых композитов пористые или гидрогелевые материалы и микрочастицы предполагает использование растворителей. Экструзионные и литьевые методы более технологичны, но могут быть применены лишь к композитам, полимерная матрица которых может переходить в вязкотекучее состояние, таким как полиэфиры и термопластифицированный крахмал. Однако использование этих методов сопряжено с нагреванием композита до высоких температур и, соответственно, с возможной температурной деструкцией полисахаридов, а также не предполагает добавления различных термолабильных биологически активных веществ, таких как антибиотики и факторы роста. Тем не менее у данной технологии есть своя область применения в тех случаях, когда на первый план выступают механические свойства, например, при создании винтов, пинов и других изделий для лечения сложных переломов. Оптимальная концентрация хитина как усиливающего наполнителя сильно зависит от гидрофобности полимерной матрицы, так как чем более гидрофобен полимерный матрикс, тем при более низких концентрациях частиц хитина происходит его агрегация, что негативно сказывается на механических свойствах композита. Гидрофильность природных полимерных материалов, а также их структурное сходство при использовании в качестве матрицы полисахаридов позволяют даже при большом содержании нанокристаллов или нанофибрилл добиваться равномерного распределения наполнителя. Хорошее поверхностное взаимодействие между гидрофильными матрицами и частицами хитина также обеспечивает более эффективный перенос механических нагрузок на материал, что непосредственно сказывается на усиливающем эффекте наполнителя на полимер.
Все работы, в которых было исследовано влияние НЧХ на культивирование различных клеточных культур млекопитающих, отмечают положительное или нейтральное влияние этого наполнителя на биологическую активность композиционного материала в сравнении с чистой полимерной матрицей. В ряде работ отмечены увеличенная скорость и качество ранозаживления при применении композитов на основе хитина в экспериментах in vivo. Показана активность наночастиц в отношении грибов и бактерий, однако некоторые данные противоречивы.
Таким образом, спектр описанных в данной работе композитов на основе различных полимерных матриц демонстрирует большой интерес и перспективность применения НЧХ в качестве усиливающего и функционального наполнителя для биоразлагаемых материалов медицинского назначения. Тем не менее отметим, что далеко не все известные, применяемые в медицине биоразлагаемые полимеры стали основой для композитов, наполненных хитином, по-видимому, они еще ждут своих исследователей.
Первая глава работы выполнена при финансовой поддержке Гранта Президента Российской Федерации (МК-3627.2019.3). Вторая и третья главы написаны при поддержке тематического плана “Разработка технологических решений по созданию новых полимерных и гибридных материалов и изделий медицинского назначения на основе бионического дизайна, включая индивидуальные имплантаты”, НИЦ “Курчатовский институт”.
Список литературы
Dutta P.K., Dutta J. Multifaceted Development and Application of Biopolymers for Biology, Biomedicine and Nanotechnology. Springer, 2013. 346 p. https://doi.org/10.1007/978-3-642-40123-7
McCormick Z.L., Hooten M. // Pain Medicine. 2019. V. 20. P. 1459. https://doi.org/10.1093/pm/pny259
Stem Cell-Based Therapy for Lung Disease / Eds. Burgess J.K., Heijink I.K. Switzerland: Springer Nature Switzerland AG, 2019. 259 p. https://doi.org/10.1007/978-3-030-29403-8
Keane T.J., Horejs C-M., Stevens M.M. // Adv. Drug Deliv. Rev. 2018. V. 129. P. 407. https://doi.org/10.1016/j.addr.2018.02.002
Rhijn-Brouwer van F.C.C., Gremmels H., Fledderus J.O., Verhaar M.C. // Cell Transplantation. 2018. V. 27. № 5. P. 765. https://doi.org/10.1177/0963689717738257
Atala A., Lanza R., Mikos A.G., Nerem R. Principles of Regenerative Medicine. Burlington Academic Press, 2018. 1454 p.
Li C., Guo C., Fitzpatric V. et al. // Nat. Rev. Mater. 2020. V. 5. P. 61. https://doi.org/10.1038/s41578-019-0150-z
Wegst U.G.K., Ashby M.F. // Philos. Mag. 2004. V. 84. P. 2167. https://doi.org/10.1080/14786430410001680935
Dong C., Lv Y. // Polymers. 2016. V. 8. P. 42. https://doi.org/10.3390/polym8020042
Ahmed S., Annu, Ali A., Sheikh J. // Int. J. Biol. Macromol. 2018. V. 116. P. 849. https://doi.org/10.1016/j.ijbiomac.2018.04.176
Manias E. // Nature Mater. 2007. V. 6. P. 9.
Stone D.A., Korley L.T.J. // Macromolecules. 2010. V. 43. P. 9217. https://doi.org/10.1021/ma101661p
Benicewicz B.C., Vaia R.A., Winey K.I., Kumar S.K. // Macromolecules. 2017. V. 50. P. 714. https://doi.org/10.1021/acs.macromol.6b02330
Nguyen H.K., Liang X., Ito M., Nakajima K. // Macromolecules. 2018. V. 51. P. 6085. https://doi.org/10.1021/acs.macromol.8b01185
Sun J., Shen J., Chen S. et al. // Polymers. 2018. V. 10. P. 1. https://doi.org/10.3390/polym10050505
Dufresne A. // Curr. Opin. Colloid Interface Sci. 2017. V. 29. P. 1–8. https://doi.org/10.1016/j.cocis.2017.01.004
Kumar S., Chatterjee K. // ACS Appl. Mater. Interfaces. 2016. V. 8. № 40. P. 26431. https://doi.org/10.1021/acsami.6b09801
Wu J., Mather P.T. // Polym. Rev. 2009. V. 49. P. 37. https://doi.org/10.1080/15583720802656237
Bogdanova O.I., Chvalun S.N. // Polym. Sci. A. 2016. V. 58. № 5. P. 629. https://doi.org/10.1134/S0965545X16050047
Siró I., Plackett D. // Cellulose. 2010. V. 17. P. 459. https://doi.org/10.1007/s10570-010-9405-y
Kaur S., Dhillon G.S. // Crit. Rev. Biotechnol. 2015. V. 35. P. 44. https://doi.org/10.3109/07388551.2013.798256
Jayakumar R., Divya Rani V.V., Shalumon K.T. et al. // Int. J. Biol. Macromol. 2009. V. 45. P. 260. https://doi.org/10.1016/j.ijbiomac.2009.06.002
Azuma K., Osaki T., Ifuku S. et al. // Carbohydr. Polym. 2012. V. 90. P. 197. https://doi.org/10.1016/j.carbpol.2012.05.023
Wagener J., Malireddi R.K.S., Lenardon M.D. et al. // PLOS Patogens. 2014. V. 10. P. 1 https://doi.org/10.1371/journal.ppat.1004050
Singh R., Shitiz K., Singh A. // Int. Wound J. 2017. V. 14. P. 1276. https://doi.org/10.1111/iwj.12797
Dutta J., Tripathi S., Dutta P.K. // Food Sci. Technol. Int. 2012. V. 18. P. 3 https://doi.org/10.1177/1082013211399195
Bari S.S., Chatterjee A., Mishra S. // Polym. Rev. 2016. V. 56. P. 287. https://doi.org/10.1080/15583724.2015.1118123
Seyednejad H., Ghassemi A.H., Nostrum van C.F. et al. // J. Control. Release. 2011. V. 152. P. 168. https://doi.org/10.1016/j.jconrel.2010.12.016
Fujisawa S., Saito T., Kimura S. et al. // Biomacromolecules. 2013. V. 14. P. 1541. https://doi.org/10.1021/bm400178m
Li C., Liu H., Luo B. et al. // Eur. Polym. J. 2016. V. 81. P. 266. https://doi.org/10.1016/j.eurpolymj.2016.06.015
Mincea M., Negrulescu A., Ostafe V. // Rev. Adv. Mater. Sci. 2012. V. 30. P. 225.
Missoum K., Belgacem N.M., Bras J. // Materials (Basel). 2013. V. 6. P. 1745. https://doi.org/10.3390/ma6051745
Habibi Y. // Chem. Soc. Rev. 2014. V. 43. P. 1519. https://doi.org/10.1039/c3cs60204d
Nair K.G., Dufresne A., Gandini A., Belgacem N.M. // Biomacromolecules. 2003. V. 4. P. 1835. https://doi.org/10.1021/bm030058g
Chen Y., Geever L.M., Killion J.A. // Polym. Plast. Technol. Eng. 2016. V. 55. P. 1057. https://doi.org/10.1080/03602559.2015.1132465
Murariu M., Dubois P. // Adv. Drug Deliv. Rev. 2016. V. 107. P. 17. https://doi.org/10.1016/j.addr.2016.04.003
Maurus P.B., Kaeding C.C. // Oper. Tech. Sports Med. 2004. V. 12. P. 158. https://doi.org/10.1053/j.otsm.2004.07.015
Patrício T., Domingos M., Gloria A. et al. // Rapid Prototyp. J. 2014. V. 20. P. 145. https://doi.org/10.1108/RPJ-04-2012-0037
Herrera N., Salaberria A.M., Mathew A.P., Oksman K. // Compos. A. 2016. V. 83. P. 89. https://doi.org/10.1016/j.compositesa.2015.05.024
Rizvi R., Cochrane B., Naguib H., Lee P.C. // J. Cell. Plast. 2011. V. 47. P. 283. https://doi.org/10.1177/0021955X11402549
Herrera N., Roch H., Salaberria A.M. et al. // Mater. Des. 2016. V. 92. P. 846. https://doi.org/10.1016/j.matdes.2015.12.083
Salaberria A.M., Diaz R.H., Andr M.A. et al. // Materials (Basel). 2017. V. 10. P. 1. https://doi.org/10.3390/ma10050546
Zhang Q., Wei S., Huang J. et al. // J. Appl. Polym. Sci. 2014. V. 131. P. 2. https://doi.org/10.1002/app.39809
Liu H., Liu W., Luo B. et al. // Carbohydr. Polym. 2016. V. 147. P. 216. https://doi.org/10.1016/J.CARBPOL.2016.03.096
Lee H., Dellatore S.M., Miller W.M., Messersmith P.B. // Science. 2017. V. 318. P. 426. https://doi.org/10.1126/science.1147241
Liu W., Zhu L., Ma Y. et al. // Carbohydr. Polym. 2019. V. 212. P. 277. https://doi.org/10.1016/j.carbpol.2019.02.060
Cowin S.C. Bone Mechanics handbook, sec. ed. Boca Raton: CRC Press, 2001. 980 p.
Herrera N., Singh A.A., Salaberria A.M. et al. // Polymers (Basel). 2017. V. 9. P. 406. https://doi.org/10.3390/polym9090406
Coltelli M.B., Cinelli P., Gigante V. et al. // Int. J. Mol. Sci. 2019. V. 20. P. 504. https://doi.org/10.3390/ijms20030504
Krause H.J., Schwarz A., Rohdewald P. // Int. J. Pharm. 1985. V. 27. P. 145. https://doi.org/10.1016/0378-5173(85)90064-X
Tyler B., Gullotti D., Mangraviti A. et al. // Adv. Drug Deliv. Rev. 2016. V.107. P. 163. https://doi.org/10.1016/j.addr.2016.06.018
Lassalle V., Ferreira M.L // Macromol. Biosci. 2007. V. 7. P. 767. https://doi.org/10.1002/mabi.200700022
Rouzes C., Leonard M., Durand A., Dellacherie E. // Colloids Surf. B. 2003. V. 32. P. 125. https://doi.org/10.1016/S0927-7765(03)00152-8
Razuvaeva E.V., Kulebyakina A.I., Streltsov D.R. et al. // Langmuir. 2018. V. 34. P. 15470. https://doi.org/10.1021/acs.langmuir.8b03379
Zhu Z. // Biomaterials. 2013. V. 34 P. 10238. https://doi.org/10.1016/j.biomaterials.2013.09.015
Nouvel C., Raynaud J., Marie E. et al. // J. Colloid Interface Sci. 2009. V. 330. P. 337. https://doi.org/10.1016/j.jcis.2008.10.069
Demina T.S., Sotnikova Y.S., Istomin A.V. et al. // Adv. Mater. Sci. Eng. 2018. ID: 8518016. https://doi.org/10.1155/2018/8518016
Malafeev K.V., Moskalyuk O.A., Yudin V.E. et al. // J. Appl. Cosmetol. 2017. V. 35. P. 163.
Gunatillake P., Mayadunne R., Adhikari R. // Biotech. Annual Rev. 2006. V. 12. P. 301. https://doi.org/10.1016/S1387-2656(06)12009-8
Nair L.S., Laurencin C.T. // Prog. Polym. Sci. 2007. V. 32. P. 762. https://doi.org/10.1016/j.progpolymsci.2007.05.017
Oh S.H., Park I.K., Kim J.M., Lee J.H. // Biomacromolecules. 2007. V. 28. P. 1664. https://doi.org/10.1016/j.biomaterials.2006.11.024
Hoque M.E., San W.Y., Wei F. et al. // Tissue Eng. A. 2009. V. 15. № 10. P. 3013. https://doi.org/10.1089/ten.tea.2008.0355
Jo J.-H., Lee E.J., Shin D.S. et al. // J. Biomed. Mater. Res. B. 2009. V. 91. P. 213. https://doi.org/10.1002/jbm.b.31392
Chen J.P., Chang Y.S. // Colloids Surf. B. 2011. V. 86. P. 169. https://doi.org/10.1016/j.colsurfb.2011.03.038
Diba M., Fathi M.H., Kharaziha M. // Mater. Lett. 2011. V. 65. P. 1931. https://doi.org/10.1016/j.matlet.2011.03.047
Saeed K., Park S.Y., Lee H.J. et al. // Polymer. 2006. V. 47. P. 8019. https://doi.org/10.1016/j.polymer.2006.09.012
Zoppe J.O., Peresin M.S., Habibi Y. et al. // ACS Appl. Mater. Interfaces. 2009. V. 1. P. 1996. https://doi.org/10.1021/am9003705
Fadaie M., Mirzaei E., Geramizadeh B., Asvar Z. // Carbohydr. Polym. 2018. V. 199. P. 628. https://doi.org/10.1016/j.carbpol.2018.07.061
Morin A., Dufresne A. // Macromolecules. 2002. V. 35. P. 2190. https://doi.org/10.1021/ma011493a
Feng L., Zhou Z., Dufresne A. et al. // J. Appl. Polym. Sci. 2009. V. 112. P. 2830. https://doi.org/10.1002/app.29731
Ji Y.L., Wolfe P.S., Rodriguez I.A., Bowlin G.L. // Carbohydr. Polym. 2012. V. 87. P. 2313. https://doi.org/10.1016/j.carbpol.2011.10.066
Ji Y.L., Liang K., Shen X., Bowlin G.L. // Carbohydr. Polym. 2014. V. 101. P. 68. https://doi.org/10.1016/j.carbpol.2013.09.012
Prior T.D., Grace D.L., MacLean J.B. et al. // Foot. 1997. V. 7. P. 121. https://doi.org/10.1016/S0958-2592(97)90020-1
Zhu L., Liang K., Ji Y. // J. Mech. Behav. Biomed. Mater. 2015. V. 44. P. 35. https://doi.org/10.1016/j.jmbbm.2014.12.019
Storey R.F., Wiggins J.S., Puckett A.D. // J. Polym. Sci. 1991. V. 32. P. 2345. https://doi.org/10.1002/pola.1994.080321216
Yang L., Korom S., Welti M. et al. // Eur. J. Cardio-Thoracic Surgery. 2003. V. 24. P. 201. https://doi.org/10.1016/S1010-7940(03)00263-X
Benhamou K., Kaddami H., Magnin A. et al. // Carbohydr. Polym. 2015. V. 122. P. 202. https://doi.org/10.1016/j.carbpol.2014.12.081
Jackson B.K., Bow A.J., Kannarpady G. et al. // J. Biomater. Sci. Polym. Ed. 2018. V. 29. P. 1426. https://doi.org/10.1080/09205063.2018.1464264
Tetteh G., Khan A.S., Delaine-Smith R.N. et al. // J. Mech. Behav. Biomed. Mater. 2014. V. 39. P. 95. https://doi.org/10.1016/j.jmbbm.2014.06.019
Huang J., Zou J.W., Chang, P.R. et al. // Express Polym. Lett. 2011. V. 5. № 4. P. 362. https://doi.org/10.3144/expresspolymlett.2011.35
Akindoyo J.O., Beg M.D.H., Ghazali S. et al. // RSC Adv. 2016. V. 6. P. 114453. https://doi.org/10.1039/C6RA14525F
Lin N., Wei S., Xia T. et al. // RSC Adv. 2014. V. 4. P. 49098. https://doi.org/10.1039/c4ra07899c
Zeng M., Gao H., Wu Y. et al. // J. Macromol. Sci. A. 2010. V. 47. P. 37. https://doi.org/10.1080/10601325.2010.492277
Saralegi A., Fernandes S.C.M., Alonso-Varona A. et al. // Biomacromolecules. 2013. V. 14. P. 4475. https://doi.org/10.1021/bm401385c
Calvo-Correas T., Garrido P., Alonso-Varona A. et al. // J. Appl. Polym. Sci. 2019. V. 136. P. 47430. https://doi.org/10.1002/app.47430
Shamshina J.L., Zavgorodnya O., Berton P. et al. // ACS Sustain. Chem. Eng. 2018. V. 6. P. 10241. https://doi.org/10.1021/acssuschemeng.8b01554
Chakravarty J., Rabbi M.F., Chalivendra V. et al. // Int. J. Biol. Macromol. 2020. V. 151. P. 1213. https://doi.org/10.1016/j.ijbiomac.2019.10.168
Anitha A., Sowmya S., Kumar P.T.S. et al. // Prog. Polym. Sci. 2014. V. 39. P. 1644. https://doi.org/10.1016/j.progpolymsci.2014.02.008
Arunraj T.R., Rejinold N.S., Kumar N.A., Jayakumar R. // Colloids Surf. B. 2014. V. 113. P. 394. https://doi.org/10.1016/j.colsurfb.2013.09.023
Kim M.S., Park S.J., Gu B.K., Kim C.H. // J. Nanomater. 2012. V. 2012. P. 1. https://doi.org/10.1155/2012/635212
Park K.E., Kang H.K., Lee S.J. et al. // Biomacromolecules. 2006. V. 7. P. 635. https://doi.org/10.1021/bm0509265
Min B.M., You Y., Kim J.M. et al. // Carbohydr. Polym. 2004. V. 57. P. 285. https://doi.org/10.1016/j.carbpol.2004.05.007
Rejinold N.S., Biswas R., Chellan G., Jayakumar R. // Int. J. Biol. Macromol. 2014. V. 67. P. 279. https://doi.org/10.1016/j.ijbiomac.2014.03.037
Sivashanmugam A., Charoenlarp P., Deepthi S. et al. // ACS Appl. Mater. Interfaces. 2017. V. 9. P. 42639. https://doi.org/10.1021/acsami.7b15845
Deepthi S., Viha C.V.S., Thitirat C. et al. // Polymers. 2014. V. 6. P. 2974. https://doi.org/10.3390/polym6122974
Lu J., Tappel R.C., Nomura C.T. // Polym. Rev. 2009. V. 49. P. 37. https://doi.org/10.1080/15583720903048243
Laycock B., Halley P., Pratt S. et al. // Prog. Polym. Sci. 2013. V. 38. P. 536. https://doi.org/10.1016/j.progpolymsci.2012.06.003
Ten E., Jiang L., Zhang J., Wolcott M.P. // Biocomposites. 2015. P. 39. https://doi.org/10.1016/B978-1-78242-373-7.00008-1
Wang J., Wang Z., Li J. et al. // Carbohydr. Polym. 2012. V. 87. P. 784. https://doi.org/10.1016/j.carbpol.2011.08.066
Wang B., Li J., Zhang J. et al. // Carbohydr. Polym. 2013. V. 95. P. 100. https://doi.org/10.1016/j.carbpol.2013.02.055
Li H.Y., Li H., Wang B. et al. // Chinese Chem. Lett. 2014. V. 25. P. 1635. https://doi.org/10.1016/j.cclet.2014.06.019
Guan Q., Naguib H.E. // J. Polym. Environ. 2014. V. 22. P. 119. https://doi.org/10.1007/s10924-013-0625-8
Kaplan D.L. Biopolymers from Renewable Resources, 1st ed., Springer-Verlag Berlin Heidelberg, 1998. 420 p. https://doi.org/10.10007/978-3-662-04068-3
Dufresne A., Thomas S., Pothan L.A. Biopolymer Nanocompocites: Processing, Properties, and Applications. NY: John Wiley and Sons, 2013. 696 p.
Brandrup J., Immergut E.H., Grulke E.A. Polymer handbook, 4th ed. NY: John Willey and Sons, 1999. 2366 p.
Zhang Y., Rempel C., Liu Q. // Crit. Rev. Food Sci. Nutr. 2014. V. 54. P. 1353. https://doi.org/10.1080/10408398.2011.636156
Chieruzzi M., Pagano S., Moretti S. et al. // Nanomaterials. 2016. V. 6. P. 134. https://doi.org/10.3390/nano6070134
Rodríguez M.I.A., Rodríguez Barroso L.G., Sánchez M.L. // J. Cosmet. Dermatol. 2018. V. 17. P. 20. https://doi.org/10.1111/jocd.12450
Gaspar-Pintiliescu A., Stanciuc A.-M., Craciunescu O. // Int. J. Biol. Macromol. 2019. V. 138. P. 854. https://doi.org/10.1016/j.ijbiomac.2019.07.155
Tenchurin T.Kh., Belousov S.I., Kiryukhin Y.I. et al. // J. Biomed. Mater. Res. A. 2019. V. 107. P. 312. https://doi.org/10.1002/jbm.a.36459
Shoulders M.D., Raines R.T. // Annual Rev. Biochem. 2009. V. 78. P. 929. https://doi.org/10.1146/annurev.biochem.77.032207.120833
Haaparanta A.-M., Jarvinen E., Cengiz I.F. et al. // J. Mater. Sci.: Mater. Med. 2014. V. 25. P. 1129. https://doi.org/10.1007/s10856-013-5129-5
Chakrapani V.Y., Gnanamani A., Giridev V.R. et al. // J. Appl. Polym. Sci. 2012. V. 125. P. 3221. https://doi.org/10.1002/app.36504
Rodrigues A.P.H., Pereira I.M., Souza de S.D. et al. // Cellulose. 2017. V. 24. P. 1731. https://doi.org/10.1007/s10570-017-1218-9
Huang Y., Wang Y., Chen L., Zhang L. // J. Mater. Chem. B. 2018. V. 6. P. 918. https://doi.org/10.1039/C7TB02945D
Huang Y., Fang Y., Chen L. et al. // Chem. Eng. J. 2017. V. 315. P. 573. https://doi.org/10.1016/j.cej.2017.01.065
Shen Y., Dai L., Li X. et al. // PLOS One. 2014. V. 9. P. 1. https://doi.org/10.1371/journal.pone.0087557
Altman G.H., Diaz F., Jakuba C. et al. // Biomaterials. 2003. V. 24. P. 401. https://doi.org/10.1016/S0142-9612(02)00353-8
Soong H.K., Kenyon K.R. // Ophthalmology. 1984. V. 91. P. 479. https://doi.org/10.1016/S0161-6420(84)34273-7
Meinel L., Hofmann S., Karageorgiou V. et al. // Biomaterials. 2005. V. 26. P. 147. https://doi.org/10.1016/j.biomaterials.2004.02.047
Bondar B., Fuchs S., Motta A. et al. // Biomaterials. 2008. V. 29. P. 561. https://doi.org/10.1016/j.biomaterials.2007.10.002
Carrasco-Torres G., Valdés-Madrigal M.A., Vásquez-Garzón V.R. et al. // Polymers. 2019. V. 11. P. 451. https://doi.org/10.3390/polym11030451
Levin B., Redmond S.L., Rajkhowa R. et al. // J. Laryngology Otol. 2013. V. 127. P. 13. https://doi.org/10.1017/S0022215112001661
Hirata M., Kobayashi M., Matsumoto C. et al. // J. Health Sci. 2010. V. 56. № 6. P. 738. https://doi.org/10.1248/jhs.56.738
Yamada H., Igarashi Y., Takasu Y. // Biomaterials. 2004. V. 25. P. 467. https://doi.org/10.1016/S0142-9612(03)00540-4
Nisal A., Sayyad R., Dhavale P. et al. // Sci. Rep. 2018. V. 8. P. 7235. https://doi.org/10.1038/s41598-018-25643-x
Wongpanit P., Sanchavanakit N., Pavasant P. et al. // Eur. Polym. 2007. V. 43. P. 4123. https://doi.org/10.1016/j.eurpolymj.2007.07.004
Salaberria A.M., Diaz R.H., Labidi J. et al. // Food Hydrocoll. 2015. V. 46. P. 93. https://doi.org/10.1016/j.foodhyd.2014.12.016
Aguilar A., Zein N., Harmouch E. et al. // Molecules. 2019. V. 24. P. 3009. https://doi.org/10.3390/molecules24163009
Sultankulov B., Berillo D., Sultankulova K. et al. // Biomolecules. 2019. V. 9. P. 470. https://doi.org/10.3390/biom9090470
Stępniewski M., Martynkiewicz J., Gosk J. // Polym. Med. 2017. V. 47. P. 49. https://doi.org/10.17219/pim/76517
Quiñones J.P., Peniche H., Peniche C. // Polymers. 2018. V. 10. P. 325. https://doi.org/10.3390/polym10030235
Ali A., Ahmed S. // Int. J. Biol. Macromol. 2017. V. 109. P. 273. https://doi.org/10.1016/j.ijbiomac.2017.12.078
Bąk M., Gutkowska O.N., Wagner E., Gosk J. // Polym. Med. 2017. V. 47. P. 43. https://doi.org/10.17219/pim/75653
Gnavi S., Barwig Ch., Freier Th. et al. // Int. Rev. Neurobiology. 2013. V. 109. P. 1. https://doi.org/10.1016/B978-0-12-420045-6.00001-8
Azuma K., Ifuku S., Osaki T. et al. // J. Biomed. Nanotech. 2014. V. 10. № 10. P. 2891. https://doi.org/10.1166/jbn.2014.1882
Rodríguez-Vázquez M., Vega-Ruiz B., Ramos-Zúñiga R. et al. // BioMed Res. Int. 2015. V. 2015. P. 1. https://doi.org/10.1155/2015/821279
Wan A.C.A., Tai B.C.U. // Biotechnol. Adv. 2013. V. 31. P. 1776. https://doi.org/10.1016/j.biotechadv.2013.09.007
Yudin V.E., Dobrovolskaya I.P., Neelov I.M. et al. // Carbohydr. Polym. 2014. V. 108. P. 176. https://doi.org/10.1016/j.carbpol.2014.02.090
Araki J., Yamanaka Y., Ohkawa K. // Polym. J. 2012. V. 44. P. 713. https://doi.org/10.1038/pj.2012.11
Xia G., Liu Y., Tian M. et al. // J. Mater. Chem. B. 2017. V. 5. № 17. P. 3172. https://doi.org/10.1039/C7TB00479F
Pang J., Bi S., Kong T. et al. // Carbohydr. Polym. 2020. V. 237. P. 116138. https://doi.org/10.1016/j.carbpol.2020.116138
Wang Q., Chen S., Chen D. // J. Mech. Behav. Biomed. Mater. 2017. V. 65. P. 466. https://doi.org/10.1016/j.jmbbm.2016.09.009
Naseri N., Algan C., Jacobs V. et al. // Carbohydr. Polym. 2014. V. 109. P. 7. https://doi.org/10.1016/j.carbpol.2014.03.031
Naseri N., Mathew A.P., Oksman K. // Carbohydr. Polym. 2016. V. 147. P. 464. https://doi.org/10.1016/j.carbpol.2016.04.018
Dobrovolskaya I.P., Yudin V.E., Popryadukhin P.V. et al. // Carbohydr. Polym. 2018. V. 194. P. 260. https://doi.org/10.1016/j.carbpol.2018.03.074
Pangon A., Saesoo S., Saengkrit N. et al. // Carbohydr. Polym. 2016. V. 144. P. 419. https://doi.org/10.1016/j.carbpol.2016.02.053
Sriupayo J., Supaphol P., Blackwell J., Rujiravanit R. // Carbohydr. Polym. 2005. V. 62. P. 130. https://doi.org/10.1016/j.carbpol.2005.07.013
Mathew A.P., Laborie M.-P.G., Oksman K. // Biomacromolecules. 2009. V. 10. P. 1627. https://doi.org/10.1021/bm9002199
Ifuku S., Ikuta A., Egusa M. et al. // Carbohydr. Polym. 2013. V. 98. P. 1198. https://doi.org/10.1016/j.carbpol.2013.07.033
Ma B., Qin A., Li X. et al. // Int. J. Biol. Macromol. 2014. V. 64. P. 341. https://doi.org/10.1016/j.ijbiomac.2013.12.015
Mushi N.E., Utsel S., Berglund L.A. // Front. Chem. 2014. V. 2. P. 1. https://doi.org/10.3389/fchem.2014.00099
Salaberria A.M., Diaz R.H., Labidi J., Fernandes S.C.M. // React. Funct. Polym. 2015. V. 89. P. 31. https://doi.org/10.1016/j.reactfunctpolym.2015.03.003
João C.F.C., Echeverria C., Velhinho A. et al. // Carbohydr. Polym. 2017. V. 155. P. 372. https://doi.org/10.1016/j.carbpol.2016.08.039
Smirnova N. V., Kolbe K.A., Dresvyanina E.N. et al. // Mater. 2019. V. 12. P. 1874. https://doi.org/10.3390/ma12111874
Kiroshka V.V., Petrova V.A., Chernyakov D.D. et al. // J. Mater. Sci. Mater. Med. 2017. V. 28. P. 1. https://doi.org/10.1007/s10856-016-5822-2
Zubillaga V., Salaberria A.M., Palomares T. et al. // Biomacromolecules. 2018. V. 19. P. 3000. https://doi.org/10.1021/acs.biomac.8b00570
Suzuki D., Takahashi M., Abe M. et al. // J. Mater. Sci. Med. 2008. V. 19. P. 1307. https://doi.org/10.1007/s10856-007-3245-9
Kuo Y.C., Lin C.Y. // Biotech. Bioeng. 2006. V. 95. P. 132. https://doi.org/10.1002/bit.21007
Kuo Y.C., Ku I.N. // Biomacromolecules. 2008. V. 9. P. 2662. https://doi.org/10.1021/bm800651r
Kuo Y.C., Lin C.C. // Colloids Surf. B. 2013. V. 103. P. 595. https://doi.org/10.1016/j.colsurfb.2012.11.001
Liu M., Zheng H., Chen J. // Carbohydr. Polym. 2016. V. 152. P. 832. https://doi.org/10.1016/j.carbpol.2016.07.042
Nishioka Yu., Kyotani S., Okamura M. et al. // Chem. Pharm. Bull. 1990. V. 38. P. 2871. https://doi.org/10.1248/cpb.38.2871
Singh U.V., Udupa N. // J. Microencapsul. 1998. V. 15. P. 581. https://doi.org/10.3109/02652049809008242
Su X., Tan M., Duan B. et al. // J. Mater. Chem. B. 2019. V. 7. P. 5190. https://doi.org/10.1039/c9tb01046g
Alves M.-H., Jensen B.E.B., Smith A.A.A., Zelikin A.N. // Macromolecular Biosci. 2011. V. 11. P. 1293. https://doi.org/10.1002/mabi.201100145
Chiellini E., Corti A., Antone S.D., Solaro R. // Prog. Polym. Sci. 2003. V. 26. P. 963. https://doi.org/10.1016/S0079-6700(02)00149-1
Zubillaga V., Alonso-Varona A., Fernandes S.C.M. et al. // Int. J. Mol. Sci. 2020. V. 21. P. 1004. https://doi.org/10.3390/ijms21031004
Liebert T. Cellulose Solvents – Remarkable History, Bright Future. Ch. 1. 2010. Washington: American Chemical Society, 2010. P. 3. https://doi.org/10.1021/bk-2010-1033.ch001
Klemm D., Kramer F., Moritz S. et al. // Angew. Chem. Int. Ed. 2011. V. 50. P. 5438. https://doi.org/10.1002/anie.201001273
Capanema N.S.V., Mansur A.A.P., de Jesus A.C. et al. // Int. J. Biol. Macromol. 2018. V. 106. P. 1218. https://doi.org/10.1016/j.ijbiomac.2017.08.124
Oun A.A., Rhim J.-W. // Carbohydr. Polym. 2017. V. 175. P. 712. https://doi.org/10.1016/j.carbpol.2017.08.052
Oun A.A., Rhim J.-W. // Int. J. Biol. Macromol. 2020. V. 152. P. 1038. https://doi.org/10.1016/j.ijbiomac.2019.10.191
Oun A.A., Rhim J.-W. // Carbohydr. Polym. 2017. V. 169. P. 467. https://doi.org/10.1016/j.carbpol.2017.04.042
Hatanaka D., Yamamoto K., Kadokawa J. // Int. J. Biol. Macromol. 2014. V. 69. P. 35. https://doi.org/10.1016/j.ijbiomac.2014.05.022
Xu J., Zhou Z., Cai J., Tian J. // Int. J. Biol. Macromol. 2019. V. 156. P. 1183. https://doi.org/10.1016/j.ijbiomac.2019.11.154
Diniz J.M.B.F., Gil M.H., Castro J.A.A.M. // Wood Sci. Technol. 2004. V. 37. P. 489. https://doi.org/10.1007/s00226-003-0216-2
Robles E., Salaberria A.M., Herrera R. et al. // Carbohydr. Polym. 2016. V. 144. P. 41. https://doi.org/10.1016/j.carbpol.2016.02.024
Torres F.G., Commeaux S., Troncoso O.P. // Starch. 2013. V. 65. P. 543. https://doi.org/10.1002/star.201200259
Hemamalini T., Giri Dev V.R. // Int. J. Biol. Macromol. 2018. V. 106. P. 712. https://doi.org/10.1016/j.ijbiomac.2017.08.079
BeMiller J.N., Whistler R.L. Starch: Chemistry and Technology. US: Academic Press, 2009. 894 p. https://doi.org/10.1016/S1082-0132(08)X0009-3
Huang Y., Yao M., Zheng X. et al. // Biomacromolecules. 2015. V. 16. P. 3499. https://doi.org/10.1021/acs.biomac.5b00928
Chang P.R., Jian R., Yu J., Ma X. // Carbohydr. Polym. 2010. V. 80. P. 420. https://doi.org/10.1016/j.carbpol.2009.11.041
Nair K.G., Dufresne A. // Biomacromolecules. 2003. V. 4. P. 657. https://doi.org/10.1021/bm020127b
Salaberria A.M., Labidi J., Fernandes S.C.M. // Chem. Eng. J. 2014. V. 256. P. 356. https://doi.org/10.1016/j.cej.2014.07.009
Qin Y., Zhang S., Yu J. // Carbohydr. Polym. 2016. V. 147. P. 372. https://doi.org/10.1016/j.carbpol.2016.03.095
Varaprasad K., Jayaramudu T., Kanikireddy V. et al. // Carbohydr. Polym. 2010. V. 236. P. 116025. https://doi.org/10.1016/j.carbpol.2020.116025
Aderibigbe B.A., Buyana B. // Pharmaceutics. 2018. V. 10. P. 42. https://doi.org/10.3390/pharmaceutics10020042
Wang D., Lv R., Ma X. et al. // Food Hydrocoll. 2018. V. 83. P. 1. https://doi.org/10.1016/j.foodhyd.2018.04.021
Chen Y., Qiu H., Dong M. et al. // Carbohydr. Polym. 2019. V. 206. P. 435. https://doi.org/10.1016/j.carbpol.2018.10.068
Watthanaphanit A., Supaphol P., Tamura H. et al. // J. Appl. Polym. Sci. 2008. V. 110. P. 890. https://doi.org/10.1002/app.28634
Prestwich G.D. // J. Control. Release. 2011. V. 155. P. 193. https://doi.org/10.1016/j.jconrel.2011.04.007
Toole B.P. // Nat. Rev. Cancer. 2004. V. 4. P. 528. https://doi.org/10.1038/nrc1391
Xu X., Jha A.K., Harrington D.A. et al. // Soft Matter. 2012. V. 8. P. 3280. https://doi.org/10.1039/c2sm06463d
Hiorth M., Skøien T., Sande S.A. // Eur. J. Pharm. Biopharm. 2010. V. 75. P. 245. https://doi.org/10.1016/j.ejpb.2010.02.012
Morganti P., Palombo M., Tishchenko G. et al. // Cosmetics. 2014. V. 1. P. 140. https://doi.org/10.3390/cosmetics1030140
Anraku M., Tabuchi R., Ifuku S. // Int. J. Molecular Sci. 2015. V. 16. P. 24707. https://doi.org/10.3390/ijms161024707
Moon H., Choy S., Park Y. et al. // Mar. Drugs. 2019. V. 17. P. 318. https://doi.org/10.3390/md17060318
Duan Y., Freyburger A., Kunz W., Zollfrank C. // Carbohydr. Polym. 2018. V. 192. P. 159. https://doi.org/10.1016/j.carbpol.2018.03.045
Khorasani A.C., Shojaosadati S.A. // Int. J. Biol. Macromol. 2017. V. 94. P. 131. https://doi.org/10.1016/j.ijbiomac.2016.10.011
Eun K.E., Jung S.Y., Lee S.J. et al. // Int. J. Biol. Macromol. 2006. V. 38. P. 165. https://doi.org/10.1016/j.ijbiomac.2006.03.003
Jin J., Hassanzadeh P., Perotto G. et al. // Adv. Mater. 2013. V. 25. P. 4482. https://doi.org/10.1002/adma.201301429
Yoo C.R., Yeo I.-S., Park K.E. et al. // Int. J. Biol. Macromol. 2008. V. 42. P. 324. https://doi.org/10.1016/j.ijbiomac.2007.12.004
Mehrabani M.G., Karimian R., Rakhshaei R. et al. // Biol. Macromol. 2018. V. 116. P. 966. https://doi.org/10.1016/j.ijbiomac.2018.05.102
Azidi M., Teimouri A., Mahranzadeh G. // RCS Adv. 2016. V. 6. P. 7048. https://doi.org/10.1039/C5RA22987A
Ashwinkumar N., Maya S., Jayakumar R. // RSC Adv. 2014. V. 4. P. 49547. https://doi.org/10.1039/C4RA06578F
Sotnikova Yu.S., Demina T.S., Istomin A.V. et al. // Fibre Chem. 2007. V. 49. P. 188. https://doi.org/10.1007/s10692-017-9867-x
Carsi M., Sanchis M.J., Gómez C.M. // Polymers (Basel). 2019. V. 11. P. 1083. https://doi.org/10.3390/polym11061083
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


