Российские нанотехнологии, 2021, T. 16, № 1, стр. 4-22
БИОРАЗЛАГАЕМЫЕ НАНОСТРУКТУРИРОВАННЫЕ КОМПОЗИТЫ ДЛЯ ХИРУРГИИ И РЕГЕНЕРАТИВНОЙ МЕДИЦИНЫ
В. А. Демина 1, 2, *, Н. Г. Седуш 1, 2, Е. Н. Гончаров 3, 4, С. В. Крашенинников 2, А. Е. Крупнин 2, 5, Н. Г. Гончаров 2, С. Н. Чвалун 1, 2
1 Институт синтетических полимерных материалов им. Н.С. Ениколопова РАН
Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
3 Центральная клиническая больница РАН
Москва, Россия
4 Российская медицинская академия непрерывного профессионального образования Минздрава РФ
Москва, Россия
5 Московский государственный технический университет им. Н.Э. Баумана
Москва, Россия
* E-mail: demina.varvara@yandex.ru
Поступила в редакцию 05.10.2020
После доработки 26.10.2020
Принята к публикации 26.10.2020
Аннотация
Композиционные материалы со свойствами биорезорбции перспективны для использования в травматолого-ортопедической практике в качестве материала для изготовления различных крепежных имплантов для остеосинтеза, а также с целью замещения костных дефектов. В обзоре описаны методы получения, физико-химические и биологические свойства биоразлагаемых композитов на основе полиэфиров и кальций-фосфатных наполнителей, а также проектирование и изготовление имплантатов на основе данных композитов.
ОГЛАВЛЕНИЕ
Введение
1. Структура, свойства и методы получения композиционных материалов
2. Проектирование и изготовление имплантатов
3. Биодеградация композитов
4. Исследования изделий in vivo
Заключение
ВВЕДЕНИЕ
Применение имплантатов является эффективным и наиболее распространенным инструментом для лечения повреждений костной ткани, вызванных травмой, мышечно-скелетными расстройствами, различными патологиями или хирургическим вмешательством. Для скрепления отломков костей при лечении переломов в основном используют фиксаторы на основе металлов (стали и сплавов титана), а для восстановления костных дефектов – скаффолды из различных материалов синтетического и природного происхождения. Однако используемые материалы не лишены ряда существенных недостатков. Основной недостаток металлических имплантатов – необходимость повторного хирургического вмешательства для их удаления, которое нужно для предотвращения долгосрочных осложнений, таких как боль, местное раздражение и деградация кости, вызванная эффектом “stress-shielding” [1]. Это явление заключается в адаптивном ремоделировании костной ткани, возникающем из-за разницы модулей упругости металла и нативной костной ткани, вследствие чего кость перестает нести механическую нагрузку и ее плотность уменьшается согласно закону Вольфа. Помимо этого, наличие металлического имплантата приводит к проблеме визуализации мягких тканей с помощью магнитно-резонансной томографии.
Возможное решение данной проблемы заключается в использовании биологических имплантатов, которыми являются алло- и аутографты. Аллографты – это термически обработанная ткань донора, а аутографты – ткань самого пациента. Применение первых несет риск инфицирования и возникновения иммунного ответа. Кроме того, число доноров очень ограничено. При использовании аутографтов возникает необходимость дополнительных хирургических вмешательств для извлечения здоровой кости, что невозможно в случае обширных дефектов. Таким образом, существует острая необходимость создания синтетических имплантатов, которые должны обладать комплексом следующих свойств:
– биосовместимостью с тканью, т.е. не вызывать отторжения и воспаления как инородное тело [2, 3];
– биоактивностью, т.е. проявлять остеокондуктивность (способность к адгезии и связыванию остеогенных клеток, поддержанию процессов пролиферации и дифференцировки клеток из окружающей живой ткани с образованием непосредственной связи с костной тканью или быть постепенно замещаемым новообразующейся тканью) и остеоиндуктивность (способность индуцировать дифференцировку клеток в остеообразующие – хондроциты, остеобласты – из некостных тканей на его поверхности) [4];
– обладать механическими свойствами, соответствующими костной ткани, и сохранять их в течение времени, достаточного для консолидации костной ткани, а также иметь скорость деградации, соответствующую скорости регенерации дефектной ткани [5];
– продукты деградации должны быть нетоксичными и не вызывать отрицательных иммунных реакций [6].
При разработке материалов для тканевой инженерии необходимо опираться в первую очередь на строение кости и ее химический состав. Основные компоненты кости – это фосфаты кальция (65 мас. %), коллаген (25 мас. %) и вода (10 мас. %). Кроме указанных веществ присутствуют другие органические соединения и ионы в малых количествах. По структуре кость представляет собой природный композит [7].
Специфическое композиционное строение определяет высокую несущую способность костной ткани. Органическим компонентом кости является коллаген. Это спиральные полипептидные нити, стабилизированные водородными связями. Коллаген представлен в костной ткани волокнами длиной от 100 до 2000 нм [8]. Неорганический компонент кости составляют кристаллические и/или аморфные фосфаты кальция, в частности гидроксиапатит (ГА) с анионными и катионными замещениями [9]. Относительное соотношение кристаллической и аморфной фаз является переменной величиной. Размеры кристаллов биоапатита в кортикальной кости человека таковы: длина ≤200 Å, ширина от 30 до 150 Å, толщина до 16 Å [10]. Состав минеральной составляющей постоянно изменяется, т.е. в костных тканях организма человека непрерывно протекают процессы ремоделирования – удаления старой кости (резорбции), вслед за которой происходит формирование новой ткани [8].
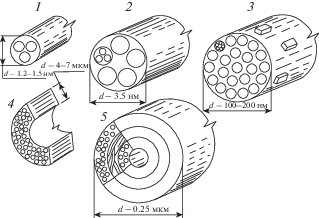
Компактную костную ткань следует рассматривать как материал с пятью структурными уровнями (рис. 1) [11]. Первый структурный уровень состоит из макромолекул коллагена и неорганических кристаллов. Второй – составлен коллагеновыми микрофибриллами из пяти спирально расположенных коллагеновых молекул и неорганических кристаллов ГА. Диаметр микрофибрилл – 3.5 нм. Третий уровень составляют волокна, образованные микрофибриллами и связанными с ними стереохимическими связями кристаллами, при этом последние ориентированы вдоль продольной оси и расположены как внутри, так и снаружи микрофибрилл [11]. Четвертый структурный уровень – это ламели толщиной от 4 до 12 мкм, состоящие из коллагеново-минеральных волокон. Структурная единица кости – остеон, включающий в себя систему костных трубок, – пятый уровень костной ткани. Остеон состоит из концентрически расположенных ламелей, количество которых в остеоне меняется от 5 до 20, и образуются они вокруг кровеносных сосудов. Ламели соединяются между собой при помощи связующего вещества. Средний диаметр остеонов 150 мкм. Последние два уровня – это уже самостоятельные конструкционные элементы кости, поэтому при рассмотрении плотной костной ткани как сплошной среды принимается третий структурный уровень как основной.
Таким образом, композитная многоступенчатая структура костной ткани обеспечивает ее высокую несущую способность. Медицинское изделие, предназначенное для имплантации в кость, должно соответствовать физико-механическим характеристикам натуральной костной ткани.
Для изготовления биоразлагаемых имплантатов были предложены различные материалы: фосфаты кальция, сплавы магния, биостекла, различные полимеры и их композиты [12–14]. Ортофосфаты кальция (ОФК) применяются в восстановительной медицине более 50 лет. Однако улучшение их физико-механических и биохимических свойств до сих пор является актуальным. Условно ОФК делят на низко- и высокотемпературные. К первым относят синтезированные при относительно низкой температуре и не подверженные термообработке, например аморфный кальцийфосфат, монокальциевый фосфат моногидрат. Ко вторым – кристаллические ОФК, прошедшие термическую обработку [15], такие как α- и β-трикальцийфосфат, ГА, тетракальцийфосфат.
Резорбируемость ОФК зависит от их растворимости в водных средах. В физиологических условиях (pH = 7) растворимость ортофосфатов повышается в следующем ряду: ГА Ca10(PO4)6(OH)2 < β-трикальцийфосфат Ca3(PO4)2 < < дикальцийфосфат ангидрат CaHPO4 < дикальцийфосфат дигидрат CaHPO4 ⋅ 2H2O < тетракальцийфосфат Ca4P2O9 < α-трикальцийфосфат Ca3(PO4)2 < монокальцийфосфат моногидрат Ca(H2PO4)2 ⋅ H2О. При взаимодействии со средой могут происходить фазовые превращения, что сказывается на резорбируемости материала [8]. Различные методы синтеза позволяют получать частицы с различной морфологией, стехиометрическим составом и степенью кристалличности [16].
Введением различных анионных и катионных замещений можно контролировать биологическое поведение ГА. Присутствие марганца в кристаллической структуре ГА влияет на адгезию костных клеток [17]. Ионы цинка необходимы для синтеза коллагена и дифференцировки клеток, обладают антибактериальным эффектом, а серебро является иммуномодулирующим веществом [18]. Биологическая активность цинк-замещенного ГА в 2 раза выше по сравнению с серебро-замещенным [19]. Введение карбонат-иона ускоряет биорезорбцию, но карбонат-замещенный ГА термически нестабилен, что ограничивает область его применения [20]. Благодаря повышению механических свойств, а также способности адсорбировать белки, необходимые для жизнедеятельности клеток, представляет интерес переход от микро- к наноструктурированной ГА-керамике [21].
Механические характеристики ГА-керамики сильно зависят от ее морфологии, например пористости и плотности. Пределы прочности при испытаниях на изгиб и сжатие для плотной керамики лежат в диапазонах 38–250 и 120–150 МПа соответственно [22]. Разброс значений связан с наличием примесей, остаточной микропористости, размером зерен керамики и т.д. Прочность увеличивается при увеличении соотношения Ca/Р и достигает максимального значения при Ca/Р = 1.67. Механические свойства пористой керамики сильно зависят от формы и концентрации пор. Прочность на сжатие варьируется в пределах от 2 до 100 МПа, а предел прочности на изгиб от 2 до 11 МПа [8].
Несмотря на обилие способов модификации керамики, не удалось достичь гибкости, эластичности и механической прочности, присущих костной ткани. Из-за хрупкости ОФК используются ограниченно – при лечении костей, не несущих большой физической нагрузки. Другой недостаток керамики – низкая резорбируемость.
Перспективными материалами для создания костных имплантатов являются синтетические и природные полимеры, характеризующиеся пластичностью, способностью к разложению и биосовместимостью. Наиболее распространенные биоразлагаемые полимеры, применяемые в травматологии и ортопедии, – полигликолид, полимолочная кислота, полилактид-со-гликолид, коллаген и хитозан [2, 23–25]. Особое место среди материалов для биоматриц занимает коллаген. Этот фибриллярный белок является одним из основных компонентов соединительной, костной и хрящевой тканей [26]. Недостаток коллагена – нерегулируемое время биодеградации и ограниченный период функционирования в условиях живого организма (не более месяца). Кроме того, коллаген является продуктом животного происхождения, поэтому существует опасность инфицирования, а свойства материала во многом зависят от источника и могут быть непостоянными. Крайне ограничен и выбор методов, используемых для формования массивных изделий, поэтому из коллагена получают в основном различные пористые губки.
Синтетические полимеры характеризуются воспроизводимой и контролируемой молекулярной структурой, которая не является иммуногенной [27]. Так, полиметилметакрилат используют в качестве костного цемента при замене суставов – паста является связующим между металлическим протезом и трубчатой костью. Однако в процессе полимеризации выделяется тепло, что может привести к некрозу окружающих тканей [28]. Полиуретаны благодаря своей гемосовместимости используют для изготовления имплантатов, контактирующих с кровью, а также для заполнения костных дефектов [29].
Широко распространенными синтетическими биоразлагаемыми полимерами являются поли(α-гидроксикислоты), такие как полилактид, полигликолид, и поли-ε-капролактон, а также их сополимеры [28, 30]. Они одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для использования в медицине. Некоторые характеристики используемых материалов приведены в табл. 1. Существуют два основных способа получения полиэфиров: поликонденсация и полимеризация с раскрытием цикла [31]. При прямой поликонденсации мономеров получают полиэфиры с низкой молекулярной массой (ММ), в то время как полимеризация с раскрытием цикла позволяет получить полимеры с высокими ММ и низкой полидисперсностью. Последний способ синтеза является контролируемым и предпочтительным для получения полиэфиров биомедицинского назначения. Следует отметить, что полимеризация циклических сложных эфиров очень чувствительна к присутствию воды, содержание которой в реакции необходимо строго контролировать, иначе характеристики полимера могут меняться от партии к партии.
Таблица 1.
| Материал | Модуль Юнга, ГПа | Прочность, МПа | Время деградации, мес |
|---|---|---|---|
| Кость кортикальная | 7–40 | 90–120 | |
| Титановый сплав | 110–127 | 900 | |
| Нержавеющая сталь | 180–205 | 500–1000 | |
| Магний | 41–45 | 65–100 | <12 |
| Гидроксиапатит | 80–110 | 500–1000 | >24 |
| Поли(L-лактид) | 4.8 | 28–230 | 24–68 |
| Поли(D,L-лактид) | 1.9 | 29–150 | 12–16 |
| Полигликолид | 7 | 350–920 | 6–12 |
| Поли(ε-капролактон) | 0.4 | 23 | >24 |
| Поли(L-лактид-со-гликолид) 85/15 | 2 | 41–55 | 5–6 |
| Поли(L-лактид-со-гликолид) 50/50 | 2 | 41–55 | 1–2 |
| Поли(D,L-лактид-со-гликолид) | 2 | 40–55 | 1–12 |
Благодаря высоким физико-механическим свойствам полигликолид используется для изготовления биоразлагаемых хирургических нитей. Недостатками данного полимера являются сложность переработки и высокая степень кристалличности, приводящая к хрупкости, поэтому чаще используют его сополимеры [28, 36].
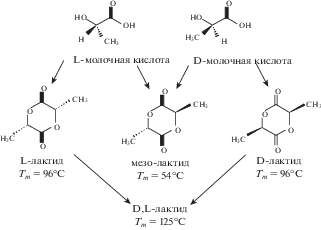
Особое место среди биоразлагаемых полимеров занимает полилактид – оптически активный полимер, стереохимическая структура которого может быть легко модифицирована за счет контролируемого изменения соотношения звеньев L- и D-изомеров (рис. 2) с получением аморфного или высококристаллического полимера [37]. Полилактид нетоксичен и в условиях организма разлагается до молочной кислоты путем гидролиза сложноэфирных связей. Затем молочная кислота выводится через цикл Кребса с образованием воды и углекислого газа. Скорость деградации зависит от размера и формы изделия, соотношения L- и D-стереоизомеров, ММ, надмолекулярной структуры, содержания низкомолекулярных примесей, а также внешних условий (pH, температура, ферменты). Полилактид является термопластом, отличающимся хорошей прочностью и высоким модулем упругости. Термодеструкция полилактида происходит при температурах выше 200°С [38]. Его получение возможно из возобновляемых растительных ресурсов, что является большим достоинством [31]. Все это делает данный полимер столь популярным при создании широкого спектра биомедицинских изделий, в том числе крепежных имплантатов и скаффолдов, используемых в ортопедии.
Недостатком полимерных крепежных изделий является недостаточно высокий (по сравнению с костью) модуль упругости, что существенно ограничивает их область применения переломами костей, несущими небольшие механические нагрузки [40]. Данная проблема может быть решена путем создания полимерных композиционных материалов, содержащих функциональные наполнители.
В данной работе проведен обзор методов получения, физико-химических и биологических свойств, а также применений биоразлагаемых композитов на основе полиэфиров и кальцийфосфатных наполнителей.
1. СТРУКТУРА, СВОЙСТВА И МЕТОДЫ ПОЛУЧЕНИЯ КОМПОЗИЦИОННЫХ МАТЕРИАЛОВ
Главное препятствие в развитии тканевой инженерии состоит в том, что большинство материалов не обладают необходимым набором свойств, а именно достаточной механической прочностью, биоактивностью и способностью к биоразложению одновременно. Как правило, прочные материалы биоинертны, в то время как биологически активные и биоразлагаемые материалы обладают неоптимальными физико-механическими характеристиками [41, 42]. Решением данной проблемы является создание полимерных композиционных материалов, сочетающих биоразлагаемую полимерную матрицу и биоактивный функциональный наполнитель.
Известно, что даже небольшое количество частиц, хорошо диспергированных в полимерной матрице, может кардинально изменить физические свойства полученного композита [43, 44]. Такие материалы могут сочетать в себе достоинства обоих компонентов [45]. Например, биоактивная керамика может усилить прочность полимерного каркаса и обеспечить улучшенные биологические свойства [42]. Кроме того, различные комбинации наполнителей и полимерных матриц могут быть использованы для создания материалов с ранее недостижимыми свойствами.
Биоразлагаемые полимеры и биокерамика, обладающие способностью деградировать в естественных условиях, являются перспективными кандидатами для создания композитных каркасов, которые постепенно деградируют по мере формирования новой костной ткани. Наполнитель придает композиту жесткость и биологическую активность, которая не свойственна полимерам. Кроме того, буферный эффект, создаваемый наполнителем, помогает предотвратить образование неблагоприятной кислой среды и воспалений, возникающих вследствие накопления продуктов деградации полимера [46].
Плотность и некоторые другие характеристики композиционного материала описываются простым законом смесей:
где X – характеристика композита, φ – объемная доля компонента, а индексы c, m и f относятся к композиту, матрице и наполнителю соответственно.Однако большинство свойств композита не подчиняются аддитивному закону из-за синергетического характера взаимодействия компонентов. Характеристики зависят от большого количества параметров, таких как форма, размер, характер распределения наполнителя, ММ матрицы, межфазное взаимодействие между наполнителем и матрицей и др. Из-за разницы в модулях упругости матрицы и наполнителя при деформации композита возникают перенапряжения на границе фаз. Чем больше размер частиц наполнителя, тем более высокое напряжение возникает в полимерной матрице около этих частиц, вследствие чего трещины возникают уже при небольших нагрузках. В отличие от микроразмерных наполнителей диспергированные на наноразмерном уровне частицы имеют более высокую площадь поверхности и лучшее взаимодействие с полимерной матрицей, что приводит к увеличению механической прочности и жесткости композитов [47, 48]. Таким образом, для упрочнения материала целесообразно использовать высокодисперсный наполнитель. Но необходимо учитывать, что при уменьшении размера частиц возрастает их склонность к агрегации. Ключевую роль играет морфология частиц. Малый диаметр и высокое характеристическое соотношение положительно отражаются на прочности композита [49].
Метод создания композиционного материала во многом определяет свойства будущего материала. Наиболее распространенными методами получения полимерных композиционных материалов являются смешение раствора полимера с наполнителем, смешение в расплаве и in situ-полимеризация в присутствии наполнителя. При использовании первого метода зачастую сложно добиться хорошего диспергирования наполнителя. Для уменьшения размера агрегатов эффективно применение шаровых и бисерных мельниц, а также ультразвуковых диспергаторов. Недостатком растворного метода является необходимость удаления растворителя, что делает процесс получения композита длительным и дорогим. Поэтому данный способ используют только в случаях, когда растворитель необходим для придания определенных свойств композиту.
В [50] описан многоступенчатый процесс изготовления композитов с прочностью на изгиб 187 МПа и модулем 9.2 ГПа. Сначала поверхность ГА модифицировали цетилтриметиламмоний бромидом. Далее полилактидное волокно дважды покрывали суспензией ГА в растворе поликапролактона в метилэтилкетоне и методом пултрузии получали пластины.
Популярным способом создания композиционного материала является полимеризация в присутствии наполнителя, так называемый метод in situ-полимеризации [51, 52]. Например, данным способом получают синтетическую зубную эмаль, где в качестве наполнителя используют ГА [53]. Основное преимущество данного метода состоит в обеспечении высокой степени гомогенности композита благодаря низкой вязкости мономера, однако существует высокая вероятность агрегации частиц. В [54] была проведена полимеризация лактонов в присутствии катализатора и ГА (CaO/P2O5 = 1.32), гидроксильные группы которого выступали в роли инициаторов. ГА демонстрировал низкую эффективность в качестве инициатора. При увеличении концентрации наполнения степень полимеризации уменьшается более чем в 2 раза. Для материалов биомедицинского назначения существуют строгие требования к содержанию остаточного катализатора, поэтому существенным недостатком метода in situ является необходимость его удаления после синтеза. Также ограничено содержание наполнителя в полученном композите, поскольку его OH-группы в высокой концентрации препятствуют полимеризации лактида. В [55] смесь D,L-лактид и наногидроксиапатита плавили при 140°С, затем добавляли катализатор (октоат олова) и проводили полимеризацию в течение 30 ч. Реакция не протекала уже при наполнении 4%.
Одним из перспективных способов, позволяющих создавать композиционные материалы даже из термодинамически несовместимых компонентов, является введение наполнителей в пористый материал, полученный деформированием по механизму крейзинга [56]. Наноструктурированный фибриллярно-пористый материал создается путем деформирования аморфных или частично кристалличных полимеров в жидкой адсорбционно активной среде. Первый метод введения наполнителя предполагает импрегнирование растворенного в среде вещества в образованные поры, происходящее непосредственно в процессе крейзинга. Второй метод заключается в синтезе наполнителя в порах полимера, предварительно деформированного по механизму крейзинга. Этот подход был успешно применен для создания нанокомпозитов на основе поли(L-лактида) и фосфатов кальция [57, 58]. Пористые матрицы с объемной пористостью 45% получали на основе пленок полилактида, деформированных в смесях воды и этанола (содержание этанола до 75 мас. %). Исследование структуры полученных материалов методом рентгеновского рассеяния в малых углах показало, что на кривых рассеяния деформированных на 25–200% полимеров имеется максимум за счет регулярного расположения фибрилл в крейзах. Рассчитанное из положения максимума расстояние между центрами фибрилл составляет ~40 нм. Далее для синтеза различных форм фосфатов кальция в порах деформированной полилактидной пленки использовали реакцию обмена между водными растворами нитрата кальция и гидрофосфата аммония, применяя метод противоточной диффузии. С помощью рентгеновского анализа было показано, что основными продуктами реакции являются дигидрат гидрофосфата кальция и аморфизованный фосфат кальция – предшественник ГА. Рассчитанный размер кристаллитов дигидрата гидрофосфата кальция в пленке полилактида составил ~30 нм, а содержание обоих форм фосфатов кальция – 30 мас. %. На микрофотографиях наблюдали достаточно плотное заполнение пористой структуры крейзов, формирование взаимопроникающей структуры наночастиц наполнителя и фибрилл крейзов. Проведенные в [59] биологические испытания композитов на основе поли(L-лактида), содержащего 11 мас. % дигидрата гидрофосфата кальция, показали низкую цитотоксичность и высокую биологическую активность материала по отношению к процессам пролиферации и дифференциации остеобластов. Таким образом, метод крейзинга является эффективным для получения биоразлагаемых полимерных нанокомпозитов, содержащих функциональные наполнители различной природы, в том числе с плохой термодинамической совместимостью с матрицей. Это преимущество является особенно актуальным при создании композитов на основе гидрофобного полилактида и гидрофильных фосфатов кальция. Морфологию композита и размер частиц наполнителя можно контролировать путем регулирования фибриллярно-пористой структуры полимерного материала.
Самым распространенным методом получения полимерных композиционных материалов на данный момент является смешение в расплаве – компаундирование. Наиболее универсальными приборами являются двухшнековые экструдеры. Разнообразие сменных элементов, однонаправленное и встречное вращение шнеков позволяют добиться эффективного смешения с полимерной матрицей наполнителей различной формы и плотности. Сложный характер движения материала в экструдере затрудняет теоретические расчеты параметров смешения. Под действием температуры и сдвиговых напряжений возникают неравномерное распределение внутренних напряжений и разрыв ковалентных связей, что может приводить к изменению ММ-распределения полимера, образованию разветвлений и т.д. Вторичные реакции сложно предсказать, так как их протекание зависит от большого количества факторов. Для разрушения агломератов наполнителя необходимо, чтобы сила вязкого трения, приложенная к его поверхности, была больше силы взаимодействия между частицами. При напряжении ниже критического напряжения сдвига диспергирования не происходит. В [60] показано, что процесс разрушения не случайный – сначала разрушаются большие агломераты, причем наибольшее разрушение происходит в начале процесса смешения, когда наполнитель контактирует с гранулами твердого еще не расплавленного полимера.
В [61] композиционный материал изготавливали смешением в двушнековом экструдере в атмосфере аргона для предотвращения термоокислительной деструкции. Были получены композиты на основе двух видов полимерных матриц (поли-L-лактид и поли-L-лактид-со-гликолид) и трех видов наполнителей (ГА с размером частиц до 50 мкм, ГА с размером частиц 5 мкм, а также трикальцийфосфат (ТКФ) с размером частиц до 50 мкм). Физико-механические испытания проводили на прутках диаметром 2 мм, полученных экструзией. Введение 30 мас. % ГА с размером частиц 5 мкм приводило к увеличению модуля упругости до 4.5 ГПа и снижению прочности при изгибе до 120 МПа. Следует отметить, что процесс ориентации полимерных цепей в процессе экструдирования стренгов не был рассмотрен.
В [62] изучали свойства композита из сополимера лактида и этиленгликоля, наполненного ГА. Наблюдалось увеличение модуля сдвига нанокомпозита в 2 раза при добавлении глутаминовой кислоты в качестве сшивающего агента. Вместе с тем при добавлении глутаминовой кислоты к микрокомпозиту никаких значительных изменений механических свойств не наблюдалось. Это исследование показывает, что размер добавленных частиц играет важную роль в модуляции механических свойств.
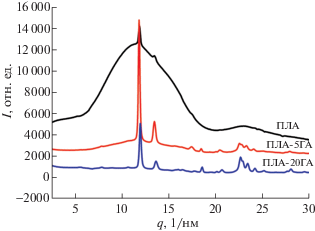
Нами предложена многостадийная методика смешения в двушнековом экструдере, которая позволила добиться распределения кальцийфосфатного наполнителя в полилактидной матрице на субмикронном уровне без использования компатибилизаторов [63]. Повышение модуля упругости до 7 ГПа и прочности до 140 МПа обусловлено как введением жесткого наполнителя, так и возрастанием степени кристалличности полимера вследствие нуклеирующего эффекта фосфатов кальция. На рис. 3 приведены большеугловые дифрактограммы образцов поли(L-лактида) и композита с 5 и 20 мас. % ГА. Видно, что с ростом содержания наполнителя заметно растет степень кристалличности полимерной матрицы.
Рис. 3.
Кривые распределения интенсивности рентгеновского рассеяния поли(L-лактида) и композита с 5 и 20 мас. % содержанием гидроксиапатита.
Особое внимание следует уделить прочности границы раздела наполнитель/матрица. Адгезионная связь должна быть достаточно прочной для передачи нагрузок от матрицы к наполнителю и одновременно не излишне прочной, что подавляет диссипацию энергии и приводит к хрупкости материала [19].
Межфазная связь может иметь различную природу [64]. На образование механической связи благоприятно влияют наличие неровностей на границе раздела, усадка матрицы. Электростатическая связь образуется при условии разноименного заряда поверхностей матрицы и наполнителя и эффективна на расстояниях порядка атомного радиуса. Сила химического взаимодействия зависит от количества и типа связей, образуемых между группами на поверхности наполнителя и соответствующими группами в матрице. Также важную роль играет взаимодиффузия наполнителя и матрицы, зависящая от температуры переработки.
Гидрофобный полилактид плохо смачивает гидрофильный ГА. Увеличить смачиваемость можно путем повышения температуры при смешении материала за счет снижения вязкости полимера. Допустимый диапазон увеличения температуры ограничен температурой деструкции полимера.
Другой подход связан с увеличением совместимости минерального наполнителя и органической матрицы. Например, в [51] поверхность частиц ТКФ активировали разбавленным водным раствором фосфорной кислоты. В результате последующего смешения L-лактида и ε-капролактона с активированным ТКФ при 150°С (в отсутствие катализатора) наблюдалось образование олиголактонов. Анализ поверхности сколов с помощью сканирующей электронной микроскопии указал на сильное межфазное взаимодействие компонентов по сравнению с композитами с немодифицированным ТКФ, хотя повышения механических свойств композитов на основе сополимера L-лактида с D-лактидом и модифицированного ТКФ не наблюдали.
В [65] для повышения механических свойств композитов ГА/полилактид на поверхность фосфата прививали полилактид. Получали композит смешением модифицированного гидроксиапатита с полилактидом. При низком содержании модифицированного гидроксиапатита (4%) нанокомпозит демонстрировал более высокие значения прочности на изгиб и ударной прочности. При более высоких содержаниях модифицированного ГА (около 20 мас. %) значительно возрастал модуль упругости композита. Улучшенная биосовместимость материала наблюдалась благодаря частицам ГА, которые облегчают адгезию и пролиферацию хондроцитов на пленке композиционного материала.
Для увеличения адгезии наполнителя к полилактидной матрице иногда используют два различных модификатора. Так, в [66] тетракальцийфосфат, получаемый высокотемпературной обработкой ТКФ [67], покрывали смесью N-(2-аминоэтил)-3-аминопропилтриметоксисилана с пиромеллитовым диангидридом, вследствие чего наблюдалось улучшение дисперсного распределения наполнителя, а также повышение прочности композиционного материала на разрыв при степени наполнения 20 мас. % с 51.5 до 68.4 МПа.
В [68] вискеры карбоната кальция модифицировали путем создания суспензии в диметилформамиде с добавлением гексаметилендиизоцианата и катализатора. Реакцию проводили в течение 8 ч, после чего добавляли этиленгликоль и продолжали модификацию еще 12 ч. Полученные частицы карбоната кальция добавляли в раствор молочной кислоты в ксилоле с катализатором и проводили поликонденсацию 24 ч при 120°С. Непрореагировавшую молочную кислоту удаляли избытком хлороформа. Таким образом получили карбонат кальция, модифицированный этиленгликолем и поли(L-лактидом) (рис. 4).
В качестве полимерной матрицы при создании композита использовали тройной сополимер L-лактида, триметиленкарбоната и гликолида состава 90/5/5. При использовании модифицированного наполнителя как модуль Юнга, так и прочность на разрыв для 2 мас. % композита увеличились с 1.27 ГПа и 27.4 МПа до 1.58 ГПа и 33.2 МПа соответственно. Для ненаполненного сополимера модуль Юнга был равен 1.18 ГПа, а прочность при разрыве 23.8 МПа. Таким образом, увеличение сродства наполнителя к полимерной матрице благоприятно сказывается на физико-механических характеристиках получаемого композиционного материала.
Похожие результаты по модификации поверхности ГА методом полимеризации L-лактида в присутствии катализатора октаноата олова были получены в [52] и [69]. При 10 мас. % наполнении поли(L-лактида) в [52] получено увеличение прочности при разрыве от 55 до 60 МПа, а Li и соавт. [69] от 40 до 55 МПа. Молекулярные массы полилактида, используемого в работах, составляли 200 и 100 кДа соответственно. Другие примеры модификации ГА различными методами и физико-механические характеристики получаемых композитов приведены в табл. 2.
Таблица 2.
Сравнение способов модификации фосфатов кальция и характеристики полученных композитов
| Материал/наполнитель | Метод модифика- ции наполнителя | Основные характеристики |
|---|---|---|
| Поли(L-лактид)/ГА | Переэтерификация олиголактида | Максимальный модуль Юнга 2.1 ГПа, прочность 68.7 МПа, степень наполнения 15 мас. % [70] |
| Поли(этиленгликоль-со-бутилентерефталат)/ГА | Модификация полиакриловой кислотой 5 кДа | Прочность на разрыв до 75 МПа [71] |
| Поли(ε-капролактон)/ГА | Модификация молочной кислотой, этиленгликолем, полимеризация ε-капролактона | Максимальная прочность при растяжении – 28.2 МПа при содержании наполнителя 10%, максимальное значение модуля Юнга 5.5 ГПа [72] |
| Поли(L-лактид)/ГА | Модификация молочной кислотой в среде тетрагидрофурана при нагревании до 150°С | Композит получен методом смешения в экструдере. Прочность увеличивалась с 60 до 70 МПа при на-полнении 15 мас. % [73] |
| Поли(L-лактид)/ГА | Полимеризации L-лактида в присутствии катализатора | Максимальная прочность при растяжении 75 МПа, при изгибе 125 МПа, ударная вязкость 4.5 кДж/м2 при наполнении 4 мас. %. Кристалличность матрицы увеличивалась с увеличением содержания наполнителя до 10%, а далее уменьшалась. Температуры стеклования и плавления не зависели от степени наполнения [65] |
В [74] проведена модификация порошка ГА синтезированными олигомерами D-лактида с ММ 5, 10 и 20 кДа. По-видимому, при модификации длина цепей уменьшалась из-за разрыва сложноэфирных связей. Композиционный материал получали путем смешения в растворе поли(L-лактида) и полученных порошков. Модифицированный ГА независимо от длины привитого олигомера был распределен в полимерной матрице более равномерно. При этом образовывался стереокомплекс между поли(L-лактидом) и привитым олиго(D-лактидом), что благоприятно сказывалось на физико-механических свойствах композита. Наибольшее увеличение прочности при растяжении было достигнуто при модификации олиголактидом с ММ 20 кДа и составило более 70 МПа при содержании ГА 10 мас. %.
Таким образом, свойства композиционных материалов определяются множеством различных факторов, таких как форма, степень дисперсности, ориентация наполнителя, ММ матрицы, прочность границы раздела наполнитель/матрица и т.д. Обилие этих факторов усложняет теоретические расчеты. Основополагающим из них является прочность межфазной границы. Существует множество способов усиления межфазной связи, основанных на различных способах введения наполнителя в матрицу и использовании аппретов. Все модификаторы имеют те или иные недостатки, например нестабильность полученного результата, низкая технологичность, токсичность и т.д. Несмотря на некоторые успехи в данной тематике, разработка опытно-промышленных подходов создания композиционных материалов на основе полилактида и кальцийфосфатных наполнителей остается актуальной задачей.
2. ПРОЕКТИРОВАНИЕ И ИЗГОТОВЛЕНИЕ ИМПЛАНТАТОВ
Хирургические нити Dexon и Vicryl, разработанные в 70-х годах, являются первыми внедренными в клиническую практику биоразлагаемыми материалами на основе полигликолида и его сополимера с лактидом. Эти шовные нити до сих пор популярны и активно используются хирургами. Для создания нитей применяли материалы на основе гликолида, которые обладают высокими физико-механическими характеристиками, но быстро разлагаются (менее 1 мес.). Поэтому длительное время, кроме усовершенствованных хирургических нитей, новых видов биоразлагаемых имплантатов не появлялось. Разработка широкого спектра различных биоразлагаемых изделий на замену металлическим аналогам стала возможна благодаря развитию технологий контролируемого синтеза полимеров на основе разных циклических сложных эфиров – лактида, гликолида, ε-капролактона и др. Сополимеризация этих мономеров позволила на молекулярном уровне “конструировать” функциональные биоразлагаемые материалы, заранее обеспечивая заданные физико-механические свойства и сроки деградации, регулируемые в широком диапазоне. Это привело к скачку популярности этих полимеров, и в настоящее время имплантаты на их основе начинают применяться в травматологии, ортопедии и челюстно-лицевой хирургии (крепежные и интерферентные винты, пластины, пины, якоря и др.), эндоваскулярной хирургии (стенты, искусственные сосуды), регенеративной медицине (пористые каркасы, мембраны) [75–77] и многих других областях. Первые разработанные биоразлагаемые крепежные винты часто приводили к осложнениям, вызванным накоплением кислых продуктов деградации в месте имплантации. К тому же невысокие физико-механические характеристики ограничивали область их применения. Для решения указанных проблем перспективными оказались композиционные материалы, наполненные фосфатами кальция – натуральными компонентами кости. Контролируемая деградация, биоактивность и повышенные физико-механические характеристики открывают широкие перспективы применения этих материалов не только для создания нового поколения крепежных имплантатов, но и для восстановления костной ткани в регенеративной медицине.
Разработка эффективного биодеградируемого имплантата является сложной междисциплинарной задачей, включающей в себя выбор полимерного материала и наполнителя, оптимизацию дизайна изделия и способа его производства, выбор метода пост-обработки и стерилизации, разработку метода имплантации изделия, проведение многочисленных испытаний in vitro и in vivo. На всех этапах цикла разработки и впоследствии при производстве медицинских изделий важно контролировать характеристики сырья, полупродуктов и готовой продукции. Требования к ним регламентируются стандартами ASTM [78–80]. Особенно важно контролировать содержание остаточного мономера и воды в полимерах. Высокая концентрация мономера (более 3 мол. %) может привести к неконтролируемому ускорению деградации в организме. Необходимо тщательно сушить материалы, поскольку даже небольшое содержание воды может вызвать преждевременную деградацию материала при хранении, особенно это актуально для полимеров с высоким содержанием гликолидных мономерных звеньев. Стандарты ограничивают и максимальное содержание олова в биоразлагаемых материалах для биомедицинских применений. Источником этой примеси является октоат олова, широко используемый в качестве катализатора полимеризации циклических сложных эфиров [81]. Поэтому актуальной задачей является разработка новых катализаторов на основе более легких и нетоксичных металлов, например цинка [82].
Первым этапом в цикле разработки медицинского изделия являются выбор наиболее подходящего полимерного материала и создание трехмерной модели изделия. Необходимо оптимизировать множество параметров имплантата для надлежащего выполнения им своей функции. При проектировании крепежных изделий для травматологии, ортопедии и челюстно-лицевой хирургии важно учитывать анатомию и биомеханику места установки изделия, обеспечивать необходимый уровень прочности при минимальных габаритах, добиваться надежной фиксации отломков костей. Эффективным современным инструментом при проектировании имплантатов является математическое моделирование методом конечных элементов (МКЭ). Применение аппарата МКЭ позволяет имитировать механические процессы, происходящие не только в имплантате, но и в окружающих тканях. В качестве входных параметров задачи выступают механические константы материалов, силы, действующие на систему, и закрепления. Величина и направление прикладываемой нагрузки отражают физиологические условия, при которых будет функционировать имплантат. В результате решения задачи определяется напряженно-деформированное состояние (НДС) биомеханической системы. Общепринятой является оценка эквивалентных по Мизесу напряжений, которые не должны превышать критических значений, приводящих к пластической деформации имплантата и его разрушению. Применяя МКЭ, в [83] была проведена топологическая оптимизация моделей пластин для остеосинтеза на основе полилактида и композита полилактид/ГА. Результаты исследования НДС пластин различной конструкции позволили идентифицировать области низких напряжений и исключить их из модели. Оптимизированная пластина стала на 50% легче исходного классического варианта, важно, что при этом уменьшилась ее площадь, а значит, и возможная травматизация надкостницы в месте контакта. Аппарат МКЭ был использован для расчета напряжений в системе “имплантат–кость” при действии физиологических нагрузок. На рис. 5 приведена построенная конечно-элементная модель перелома локтевой кости, зафиксированного с помощью пластины и винтов из полилактида, а также распределение напряжений, возникающих в пластине при действии биомеханических нагрузок, приложенных к кости в различных направлениях. Во всех расчетных случаях наибольшие напряжения в пластине возникали в областях у ближайших к перелому отверстий с прилегающей к кости стороны.
Рис. 5.
Конечно-элементная модель скрепления перелома локтевой кости биоразлагаемой пластиной с винтами и распределение напряжений в пластине при действии физиологической нагрузки.

Результаты численного расчета показали, что при приложении нагрузки в 100 Н перемещения отломков в области перелома не превысили 0.5 мм. Таким образом, результаты моделирования подтверждают достаточный уровень физико-механических характеристик разработанных пластин для их использования при данном виде операций по остеосинтезу. В [84] было проведено исследование НДС имплантатов для челюстно-лицевой хирургии. МКЭ применяли для оценки максимальных напряжений в пластинах и винтах, изготовленных из поли(L-лактида), композита поли(L-лактид)/ГА 60/40 и металлов. НДС анализировали при приложении силы 132 Н, эквивалентной допускаемой нагрузке при жевании в первые недели после проведения операции. Был сделан вывод о том, что в целом данные материалы и имплантаты на их основе являются перспективными для фиксации перелома челюсти, при этом были выявлены наиболее нагруженные области изделия, требующие усиления.
Следующим этапом в цикле разработки имплантата является разработка способа его изготовления. Для переработки как ненаполненных полимеров лактида, так и композиционных материалов могут быть использованы традиционные для полимеров методы: экструзия, литье под давлением, прессование, раздув и др. Для изготовления высококачественных биомедицинских изделий переработку проводят в чистых помещениях с использованием оборудования класса GMP. Это позволяет исключить контаминацию и выпускать имплантаты с одинаковыми характеристиками от партии к партии. Ориентация и кристаллизация полимерного материала в процессе переработки являются важными факторами, приводящими к повышению физико-механических характеристик [85]. Отдельно отметим технологию “самоармирования”, которая заключается в получении материалов на основе поли(L-лактида) с внедренными предварительно ориентированными волокнами из этого же полимера. Винты, изготовленные таким способом, характеризовались высокими физико-механическими характеристиками на изгиб: прочность 200 МПа и модуль упругости 7 ГПа [86]. При армировании стержней полилактида более жестким полимером полигликолидом возможно создание изделий с еще более высоким модулем упругости. В зависимости от сложности конструкции крепежный имплантат (винт, пластина и т.п.) может быть произведен в одну стадию, например методом литья под давлением, либо в несколько стадий, включающих в себя получение заготовки и ее последующую механическую обработку.
Для изготовления каркасов для тканевой инженерии и регенеративной медицины важно создать в материале пористую структуру для хорошей адгезии и пролиферации клеток. Получить такие материалы можно методами электроформования, лиофилизации, вспенивания, а также с помощью вымывания различных агентов-порообразователей. Нетканые материалы, изготовленные методом электроформования, характеризуются высокодисперсной структурой и состоят из микро- и нановолокон (рис. 6), диаметр и ориентация которых контролируются технологическими параметрами процесса [87]. Использование приемных электродов различной формы позволяет получать плоские материалы для ожоговых повязок [88], создания искусственной кожи [89], трубчатые каркасы для создания искусственных сосудов [90], скаффолды для восстановления диафрагмы [91]. Создание нетканых композиционных материалов на основе полилактида и фосфатов кальция актуально для изготовления скаффолдов, применяемых при восстановлении повреждений костной ткани. Например, такие скаффолды с содержанием ГА 5 и 20 мас. % получены в [92]. Исследование каркасов на клетках линии MC3T3-E1 показало их высокую жизнеспособность и пролиферацию в течение 21 дня, что делает эти материалы перспективными для культивирования предшественников остеобластов.
Рис. 6.
Микрофотографии нетканого материала, полученного методом электроформования (а) и пористого губчатого материала, полученного лиофилизацией (б).

Метод лиофилизации применяют для изготовления трехмерных пористых скаффолдов путем сублимации замороженных растворов полимерного материала с диспергированным в нем фосфатом кальция. Варьирование концентрации раствора и условий заморозки позволяет регулировать пористость изделия и задавать ориентацию пор (рис. 6). В [92] описаны получение и исследование скаффолдов на основе полимеров лактида и ГА или ТКФ с пористостью до 90% и средним размером пор от 1 до 100 мкм.
В последнее десятилетие для изготовления персонализированных скаффолдов сложной формы активно используются методы аддитивного производства. Послойное “выращивание” объекта может быть реализовано многими методами, такими как наплавление, селективное лазерное спекание, стереолитография и др. Параметры создаваемого скаффолда (геометрия, микро- и макропористость) проектируются на этапе создания трехмерной модели. Персонализированный имплантат может быть смоделирован и изготовлен на основе данных компьютерной томографии конкретного пациента, имеющего дефект кости вследствие заболевания или травмы. Благодаря развитию технологий 3D-печати в настоящее время достигнута высокая точность процесса, позволяющая контролировать дизайн имплантата на микромасштабе. Печать сразу несколькими материалами открывает уникальные возможности изготовления каркасов сложного неравномерного строения. В [93] описано создание трехмерного гетерогенного скаффолда для восстановления хряща с варьируемыми в объеме параметрами: составом, пористостью и архитектурой. Верхняя часть изделия с пористостью 90% состояла из поли(L-лактида) и поли(D,L-лактид-со-гликолида) с расположенными в шахматном порядке макроканалами для облегчения засевания клеток в объем изделия. Функция нижней части скаффолда с пористостью 55%, изготовленной из композиционного материала поли(L-лактид-со-гликолид)/ТКФ в форме листа клевера, состояла в том, чтобы обеспечить врастание в нее костной ткани пациента. Переход между этими зонами реализован в виде градиентного изменения состава материала с целью исключения расслаивания скаффолда. Культивирование хондроцитов показало, что они росли преимущественно в нижней более пористой части конструкции и сформировали хрящ через 6 нед in vitro. Учитывая, что физико-механические характеристики нижней зоны в форме клевера были близки к параметрам губчатой кости, напрашивается вывод о перспективности применения разработанных имплантатов для восстановления связок. Аддитивные методы становятся все более доступными и точными, они позволяют преодолевать ограничения классических подходов и являются эффективными для изготовления широкого спектра имплантатов для восстановления не только кости и хряща, но и многих других тканей и органов [94].
Финальным этапом при производстве полимерных имплантатов является стерилизация. Современные методы включают в себя γ-облучение, стерилизацию электронным пучком, газовую стерилизацию окисью этилена и обработку низкотемпературной плазмой. Благодаря высокой проникающей способности γ-лучей и отсутствию нагревания стерилизация γ-облучением дозой 25 кГр является наиболее универсальным методом и подходит практических для любых видов имплантатов. Однако ионизирующее излучение высокой энергии приводит к разрыву химических связей в полилактиде, вследствие чего снижается ММ полимера. Это необходимо учитывать, поскольку снижение исходной ММ приводит к сокращению срока деградации. Так, в [95] было установлено, что при стерилизации скаффолдов на основе поли(лактид-со-гликолида) γ-облучением с дозой 25 кГр средневесовая ММ снижается в 2 раза. Электронный пучок характеризуется более низкой энергией (обычно от 1 до 10 МэВ) и более низкой проникающей способностью. Данный метод применятся для стерилизации тонких материалов либо для стерилизации только поверхности имплантата. Несмотря на то что электронная стерилизация является более мягкой, чем γ-облучение, она также приводит к разрыву полимерных цепей, изменению теплофизических характеристик полимеров на основе лактида, а также кристалличности и морфологии материалов [96]. При стерилизации скаффолдов низкотемпературной плазмой наблюдали возрастание ММ поли(лактид-со-гликолида) на 36%, которое было вызвано протеканием реакций сшивания. Незначительное снижение ММ-характеристик характерно при стерилизации этиленоксидом, однако процесс происходит при температуре от 37 до 60°С – в области температуры стеклования полилактида и его сополимеров. Стерилизация пористых имплантатов при температуре выше их температуры стеклования приведет к значительной усадке и изменению пористости скаффолда. Таким образом, идеального метода стерилизации имплантатов на основе полилактида и композиционных материалов не существует. В зависимости от дизайна имплантата и химического состава полимера можно выделить предпочтительные методы стерилизации. Однако это не отменяет необходимости детально изучать влияние вида стерилизации и параметров процесса на характеристики, структуру и кинетику деградации каждого разрабатываемого медицинского изделия.
3. БИОДЕГРАДАЦИЯ КОМПОЗИТОВ
Временные медицинские изделия функционируют в организме в течение определенного срока, после чего разлагаются без вреда для организма. Скорость разложения имплантата, используемого в регенеративной медицине, должна быть близка к скорости роста новой ткани. Кинетику биоразложения полимеров сложно прогнозировать с высокой точностью из-за обилия влияющих на нее факторов. Изучение процессов деградации полимеров и композитов на их основе поможет более точно выбирать материалы в зависимости от области их применения и задач.
Химический гидролиз является основным механизмом деградации полиэфиров [97]. Деградация полимерного композиционного материала может происходить двумя путями: на поверхности (эрозия) или во всем объеме имплантата [98]. В первом случае деградации подвергается только область, доступная для проникновения воды, так называемый диффузионно-кинетический слой. Поверхностная эрозия протекает слой за слоем и образец “истончается” по мере деградации, а ММ полимера при этом остается неизменной. Эрозия по поверхности является наиболее распространенным путем деградации. Второй случай встречается у материалов, легко набухающих в биологических средах, когда скорость диффузии жидостей в имплантант больше скорости образования водорастворимых продуктов деградации полимера. Форма и размер имплантанта остаются неизменными, в то время как ММ полимера уменьшается.
Ранее полагали, что многие синтетические полимеры, в том числе полилактид, деградируют исключительно за счет гидролиза, но было доказано, что в деградации принимают участие и ферменты, например протеиназы [99, 100]. Ферменты – это полипептиды с ММ от нескольких тысяч до нескольких миллионов г/моль, поэтому высокомолекулярные ферменты не могут проникнуть в имплантат и ферментативное разрушение происходит постепенно от поверхности внутрь материала. Ферментативный гидролиз активнее в природных полимерах, чем в синтетических [98]. Введение в полимер фрагмента, чувствительного к определенному ферменту, позволяет добиться селективности ферментативной деградации [101].
На скорость разложения влияют различные параметры [102, 103]. Важную роль играет температура стеклования полимера. Например, в [104] показано, что липаза Rh. Delemar активнее гидролизует полиэфиры с более низкой температурой стеклования. Помимо этого, сложноэфирная связь между различными мономерами обладает различной чувствительность к гидролизу. Так, поликапролактон деградирует значительно медленнее, чем полилактид (табл. 1). Диффузия воды и низкомолекулярных продуктов деградации легче проходит в аморфных полимерах, чем в частично кристаллических [105]. Ключевым параметром является ММ полимера, ведь чем длиннее полимерная цепь, тем больше сложноэфирных связей требуется разорвать, поэтому время разложения низкомолекулярных полимеров меньше, чем высокомолекулярных [104].
Гидролиз сложноэфирной связи полимера может протекать на концах цепи или в случайном месте. В [106] на основании литературных данных пришли к выводу, что деградация биоразлагаемых полимеров представляет собой комбинацию случайных и концевых разрывов цепи. Только концевые разрывы не объясняют быстрое снижение ММ. В то время как только случайные не всегда могут объяснить наблюдаемую потерю веса образца. Концы цепи более восприимчивы к расщеплению, что приводит к образованию мономеров, вымывание которых уменьшает вес имплантата. А снижение ММ является следствием случайных разрывов полимерной цепи.
При деградации полилактида и полигликолида может происходить автокаталитическое ускорение, ведь продуктами их деградации являются кислоты [107]. Данное явление особенно выражено в крупных имплантатах толщиной несколько миллиметров ввиду накопления продуктов деградации в глубине изделия.
Изменение со временем среднечисловой и средневесовой ММ при деградации объемно разлагающихся полимеров могут быть выражены как [108]:
где М0 и М – молекулярные массы до начала и во время разложения соответственно; k – кажущаяся константа скорости разложения, которая может быть определена экспериментально, t – время разложения. Несмотря на монотонное уменьшение ММ разлагающихся полимеров со временем, экспериментально наблюдалось, что модуль упругости материала увеличивается на ранних стадиях деградации, далее наступает фаза плато с дальнейшим резким снижением [108]. Считается, что такое поведение является результатом усадки полимера, происходящей в начале разложения, что приводит к возрастанию модуля упругости. Снижение модуля на поздних стадиях разложения является прямым результатом значительного уменьшения ММ полимерных цепей [109].Исследования in vitro в солевом растворе Хенкса на протяжении 1, 10 и 20 дней высоконаполненных композитов на основе поли(L-лактида) показали, что деградация происходит быстрее при большем содержании ГА [110]. За 20 дней деградации прочность на изгиб уменьшалась от 130 до 70 МПа у 70%-ного композита, что ниже прочности нативной костной ткани.
В настоящее время неинвазивную визуализацию объемной микроструктуры в полимерах можно осуществить только двумя методами: рентгеноструктурным анализом и ультразвуковым (УЗ) методом исследования. При изучении деградации полимеров особый интерес представляют УЗ-методы благодаря хорошей чувствительности к воздушным пустотам и неоднородностям, которые являются типичными образованиями деградации полимера. Они практически прозрачны для рентгеновского излучения. УЗ-методы исследования позволяют определить такие характеристики полимера, как температура стеклования, механические и вязкоупругие свойства, кристалличность и ориентацию [111], путем как количественной (измерения скорости звука, затухания, амплитуды обратно рассеянных сигналов и т.д.), так и качественной (акустическая визуализация внутренней структуры) оценки образцов. Этот неразрушающий метод позволяет наблюдать за процессом разложения одного и того же образца. Однако немного работ посвящено УЗ-исследованиям биоразлагаемых полимеров [112–116], и систематические данные для упругих свойств и изменений внутренней микроструктуры с высоким разрешением, полученные на одних образцах полимера в течение всего периода деградации, практически отсутствуют.
Одна из немногих работ, посвященная исследованию внутренней микроструктуры в процессе гидролиза методом высокочастотной импульсной акустической микроскопии, выполнена Мороковым и соавторами [117]. В работе исследовали биоразлагаемые полимеры и сополимеры на основе L,L-лактида, D,L-лактида и ε-капролактона на протяжении 6 мес деградации в воде при температуре 37°C. Акустические изображения демонстрируют эволюцию внутренних неоднородностей в одном и том же образце во время деградации (рис. 7). Измерения упругих свойств (скоростей продольных и поперечных звуковых волн) сравнивали с изменениями внутренней микроструктуры и кристалличности полимеров в процессе гидролиза, а также уменьшением ММ полимеров.
Рис. 7.
Изменения внутренней структуры аморфного и частично кристалличного поли(L-лактида) при гидролизе. Изображения получены методом ультразвуковой микроскопии в работе [117].

Таким образом, анализ работ показал, что время деградации меняется в широком диапазоне, от месяцев до нескольких лет, что можно регулировать, изменяя не только химический состав материала имплантата, но и степень кристалличности полимерной матрицы и наполнителя, их соотношение и т.д.
4. ИССЛЕДОВАНИЯ ИЗДЕЛИЙ in vivo
Любое хирургическое вмешательство, в том числе имплантация биоразлагаемого изделия, приводит к воспалительному процессу, активирующему деятельность ферментов и клеток, таких как макрофаги и гигантские клетки инородного тела, стремящихся резорбировать имплантант [98]. Молодые клетки новой растущей ткани образуют соединительнотканную капсулу вокруг имплантата, в случае низкой способности к деградации последнего организм стремится изолировать инородное тело, и толщина капсулы увеличивается. Место введения имплантата играет важную роль, так как от этого зависят количество и состав выделяемых ферментов и клеток. Смоделировать реакцию живого организма на инородное тело в экспериментах in vitro не представляется возможным. Только исследования in vivo могут дать ответ на вопрос “Какими свойствами должен обладать материал для тканевой инженерии?”.
В ряде работ было отмечено преимущество нанокомпозитных материалов перед микрокомпозитными. В [118] наблюдали значительное увеличение адсорбции белка и адгезии остеобластов на нанокерамических материалах по сравнению с микроразмерными. Схожие результаты наблюдали в [119]. Было показано, что при использовании наночастиц в композите поли(L-лактид)/ГА улучшается адгезия белка по сравнению с микрокомпозитом. В другом исследовании показано, что форма частиц наполнителя играет немаловажную роль, так наностержни ГА имеют большую биологическую активность из-за схожести с нативной костной тканью [120]. Армирование наноразмерными аморфными кальций фосфатами поли(лактида-со-гликолида) благоприятно сказывается на скорости биоразложения и механических свойствах [121].
В некоторых работах показано, что биосовместимость микро- и нанокомпозитов примерно одинакова. Композиционный материал из полилактида и микросфер ТКФ (около 100 мкм) продемонстрировал улучшенную биосовместимость и хорошо взаимосвязанную пористую структуру, которая облегчала врастание ткани [122]. Полученные биоактивность и гидрофильность были повышены до уровней, сопоставимых с уровнями композита полимолочной кислоты, содержащего порошок ТКФ. Исследования in vitro методом ускоренного 30-дневного теста выявили успешное образование открытой пористой структуры с 98%-ной взаимосвязью. Остеоинтеграция также оценивалась in vivo с использованием модели бедренного дефекта кролика. После 16 недель имплантации отношение контакта кости с имплантатом композита микросферы полимолочной кислоты и ТКФ было улучшено благодаря врастанию ткани через поры, образованные вблизи поверхности.
На кинетику биодеградации и остеоинтеграцию оказывают влияние не только химический состав и физико-механические свойства имплантата, но и его структура, форма и размер [123]. Поэтому исследование биодеградации скаффолдов является необходимой стадией разработки изделий для тканевой инженерии.
Матриксы для замещения дефектов тканей должны быть пористыми со связанной системой пор для обеспечения клеточной инфильтрации, транспортировки питательных веществ и удаления метаболитов [124, 125]. В [126] методом электроформования изготовлен пористый волокнистый каркас из коллагена и наногидроксиапатита, обладающий остеобластной адгезией и пролиферативной активностью. Считается, что для прорастания тканей и сосудов размер пор должен быть более 300 мкм, а размер соединяющих пор более 100 мкм [127].
В [128] изучали влияние наполнителя на остеоинтеграцию винтов из чистого поли(L-лактида) и композитов с 25 мас. % ГА. Исследования проводили на овцах. Каждому животному в берцовую кость было имплантировано по два винта из композитного материала или ненаполненного полимера. Исследования проводили через 6 и 12 мес. Воспалительная реакция была меньше выражена при использовании композиционных винтов благодаря наличию ГА, нейтрализующего образующуюся при деградации полимера кислую среду (рис. 8, рис. 9). Прирост новой костной ткани был больше на обоих сроках исследования в случае имплантации композиционных винтов.
Рис. 8.
Винт HA/PLLA через 12 мес после имплантации, сухожилие надколенника находится вверху изображения, а коленный сустав – слева. Новая кость присутствует в каждой винтовой резьбе как рядом с костным туннелем, так и с сухожилием.
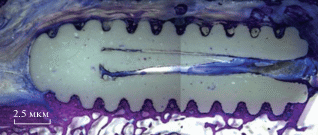
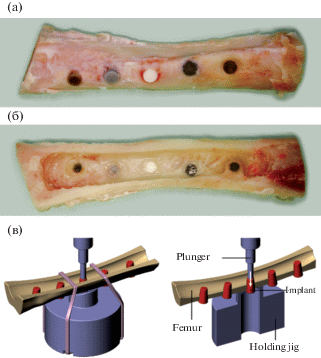
Рис. 9.
Испытания на выдавливание конических имплантатов. Передне-задний (a) и задне-передний (б) виды передней коры бедренной кости бедра, подготовленной для испытаний на выталкивание. Схематическое изображение испытания на выдавливание (в) [132].
В [129] сравнивали деградацию in vivo композитов на основе сополимера D,L-лактида и гликолида состава 50/50, наполненных микро- и наноразмерным ТКФ. Композиты изготавливали методом смешения в растворе, степень наполнения достигала 30 мас. %. Исследования проводили на овцах из-за их сходства с людьми по структуре костей и суставов, а также регенерации костной ткани [130]. Пины длиной 12 мм и шириной 6 мм иплантировали в дистальный мыщелок бедренной кости на 6, 12, 18, 24 нед. Достоверность результатов обеспечивалась статистикой по 6 пинов на каждый срок разложения. Рост кости происходил с одинаковой скоростью как для композита, так и для ненаполненного полимера. Скорость деградации in vivo в нанокомпозите ниже, чем в микрокомпозите, что более точно соответствует скорости роста новой кости. Возможно, это связано с тем, что нанокомпозит набухает меньше, чем микрокомпозит, как было показано в аналогичных исследованиях in vitro [131]. Следует отметить, что в течение первых 6 недель скорость деградации in vivo соответствует скорости деградации in vitro, но отстает при больших сроках.
В [132] проводили тест на остеоинтеграцию имплантатов через 8 нед после введения в бедренную кость минипига методом выдавливания конических образцов из отверстий. Объектом исследования выступал композиционный материал на основе поли(L-лактида-со-гликолида), наполненный микро- и наноразмерным ТКФ. Степень наполнения составляла 16 мас. % в обоих случаях. Для сравнения использовали титановый сплав и ненаполненный полимер. Имплантаты, изготовленные из наноструктурированного композита PLGA/β-TCP, не продемонстрировали улучшенной остеоинтеграции по сравнению с имплантатами, изготовленными из микроструктурного композита PLGA/β-TCP. Проведенные испытания показали, что сила выдавливания композитных образцов составила 35–60% от титанового имплантата. В то же время сила выталкивания образца из ненаполненного сополимера составила лишь 16–40% от титанового. По данным компьютерной микротомографии и гистологии имплантат не повлиял на структуру новой кости, окружающей имплантат.
Механизм деградации полимерного материала определяется большим количеством различных факторов, и на данный момент существует значительная неопределенность при сопоставлении скорости деградации материала с этими переменными, что делает практически невозможным теоретические расчеты. Испытание различных материалов и вариантов конструкции биоразлагаемых имплантатов в экспериментах in vitro и in vivo является длительным и трудоемким процессом. Исследования in vitro дают базовые знания основных принципов деградации, на которых основывается дизайн имплантата. Однако природа деградации имплантата in vivo все еще не до конца ясна. Разнообразие материалов и отсутствие единой системы постановки экспериментов затрудняют сопоставление полученных данных. Ожидается, что экспериментальные исследования будут продолжать играть доминирующую роль в обозримом будущем.
ЗАКЛЮЧЕНИЕ
На протяжении всего периода развития медицины человечество ищет способы лечения травм опорно-двигательного аппарата. Использование имплантата позволяет зафиксировать отломки кости в правильном положении и не допустить их смещения во время срастания. Наиболее распространенными являются неразлагаемые металлические крепежные изделия, однако необходимость повторного хирургического вмешательства существенно удлиняет срок лечения травмы. Биоразлагаемые крепежные изделия после остеосинтеза деградируют до простых метаболитов, которые выводятся из организма естественным путем. Для изготовления биоразлагаемых имплантатов были предложены различные виды керамики, полимеров и композиционных материалов. Несмотря на обилие способов модификации керамики, не удалось достичь гибкости, эластичности и механической прочности, присущей костной ткани. Область применения полимерных крепежных изделий из-за невысокого модуля упругости ограничена переломами костей, не несущими больших механических нагрузок. В последние годы полимерные композиционные материалы привлекают все больше внимания для использования в травматологии и ортопедии. Характер распределения наполнителя в полимерной матрице влияет на свойства материала и во многом определяется способом создания композита. Несмотря на прогресс последних лет в данной тематике, поиск промышленно применимых подходов производства биоразлагаемых композиционных материалов актуален и по сей день.
Список литературы
Ridzwan M.I.Z., Shuib S., Hassan A.Y. et al. // J. Med. Sci. 2007. V. 7. № 3. P. 460. https://doi.org/10.3923/jms.2007.460.467
Burg K.J., Porter S., Kellam J.F. // Biomaterials. 2000. V. 21. № 23. P. 2347.
Jones J.R. // Mater. Today. 2006. V. 9. № 12. P. 34. https://doi.org/10.1016/S1369-7021(06)71741-2
Cancedda R., Dozin B., Giannoni P., Quarto R. // Matrix Biol. 2003. V. 22. № 1. P. 81. https://doi.org/10.1016/S0945-053X(03)00012-X
Middleton J.C., Tipton A.J. // Biomaterials. 2000. V. 21. № 23. P. 2335. https://doi.org/10.1016/S0142-9612(00)00101-0
Agrawal C.M., Ray R.B. // J. Biomed. Mater. Res. 2001. V. 55. № 2. P. 141.
Путляев В.И. // Соросовский образовательный журнал. 2004. Т. 8. № 1.
Баринов С.М., Комлев В.С. Биокерамика на основе фосфатов кальция. М.: Наука, 2005. 204 с.
Silva G.A., Coutinho O.P., Ducheyne P., Reis R.L. // J. Tissue Eng. Regen. Med. 2007. V. 1. № 2. P. 97. https://doi.org/10.1002/term.1
Suvorova E.I., Petrenko P.P., Buffat P.A. // Scanning. 2007. V. 29. № 4. P. 162. https://doi.org/10.1002/sca.20058
Кнетс И.В. // Механика композитных материалов. 1979. V. 2. P. 338.
Bohner M. // Injury. 2000. V. 31. P. D37. https://doi.org/10.1016/S0020-1383(00)80022-4
Gogolewski S. // Injury. 2000. V. 31. P. D28. https://doi.org/10.1016/S0020-1383(00)80020-0
Staiger M.P., Pietak A.M., Huadmai J., Dias G. // Biomaterials. 2006. V. 27. № 9. P. 1728. https://doi.org/10.1016/j.biomaterials.2005.10.003
Cölfen H. // Nat. Mater. 2010. V. 9. № 12. P. 960. https://doi.org/10.1038/nmat2911
Рассказова Л.А. Дис. “Технология получения магний- и кремний-модифицированных гидроксиапатитов и биорезорбируемых композиционных материалов с использованием полимеров молочной кислоты” к-та техн. наук. Томск: ТГУ, 2015. 137 с.
Paluszkiewicz C., Ślósarczyk A., Pijocha D. et al. // J. Mol. Struct. 2010. V. 976. № 1–3. P. 301. https://doi.org/10.1016/j.molstruc.2010.04.001
Фадеева И.В., Бакунова Н.В., Комлев В.С. и др. // Докл. РАН. 2012. Т. 442. № 6. С. 780.
Matthews F.L., Rawlings R.D. Composite Materials: Engineering and Science. 1999. 480 p.
Choi S., Coonrod S., Estroff L., Fischbach C. // Acta Biomater. 2015. V. 24. P. 333. https://doi.org/10.1016/j.actbio.2015.06.001
Kalita S.J., Bhardwaj A., Bhatt H.A. // Mater. Sci. Eng. C. 2007. V. 27. № 3. P. 441. https://doi.org/10.1016/j.msec.2006.05.018
Suchanek W., Yoshimura M. // J. Mater. Res. 1998. V. 13. № 01. P. 94. https://doi.org/10.1557/JMR.1998.0015
Engelberg I., Kohn J. // Biomaterials. 1991. V. 12. № 3. P. 292. https://doi.org/10.1016/0142-9612(91)90037-B
Laurencin C.T., Ambrosio A.M.A., Borden M.D., Cooper J.A. // Annu. Rev. Biomed. Eng. 1999. V. 1. P. 19. https://doi.org/10.1146/annurev.bioeng.1.1.19
Agrawal C.M., Ray R.B. // J. Biomed. Mater. Res. 2001. V. 55. № 2. P. 141. https://doi.org/10.1002/1097-4636(200105)55:2<141::AID-JBM1000>3.0.CO;2-J
Martin R.B. // Mater. Sci. Forum. 1999. V. 293. P. 5. https://doi.org/10.4028/www.scientific.net/MSF.293.5
Eglin D., Alini M. // Eur. Cells Mater. 2008. V. 16. P. 80. https://doi.org/10.22203/eCM.v016a09
Хенч Л.Л., Джонс Д.Р. Биоматериалы, искусственные органы и инжиниринг тканей / Пер. с англ. Цвирко Ю.Л., Лушникова А.А. М.: РИЦ Техносфера, 2007. 304 с.
Gogolewski S., Gorna K. // J. Biomed. Mater. Res. A. 2007. V. 80. № 1. P. 94. https://doi.org/10.1002/jbm.a.30834
Tereshchenko V.P., Larionov P.M., Kirilova I.A. et al. // Hir. Pozvonočnika. 2016. V. 13. № 1. P. 72. https://doi.org/10.14531/ss2016.1.72-81
Zhang C. // Biodegrad. Polyesters. 2015. P. 1. https://doi.org/10.1002/9783527656950.ch1
Bozentka D.J. // J. Hand Surg. Am. 1993. V. 18. № 6. P. 1130. https://doi.org/10.1016/0363-5023(93)90416-Z
Wu S., Liu X., Yeung K.W.K. et al. // Mater. Sci. Eng. R Reports. 2014. V. 80. P. 1. https://doi.org/10.1016/j.mser.2014.04.001
Garg P., Nagarth H., Pahuja M. et al. // J. Adv. Med. Dent. Sci. 2013. V. 1. № 2. P. 83.
Trincă L.C., Fântânariu M., Solcan C. et al. // Appl. Surf. Sci. 2015. V. 352. P. 140. https://doi.org/10.1016/j.apsusc.2015.03.136
Chatani Y., Suehiro K., Ôkita Y. et al. // Macromolecular. 1968. V. 113. № 1. P. 215. https://doi.org/10.1002/macp.1968.021130119
Lasprilla A.J.R., Martinez G.A.R., Lunelli B.H. et al. // Biotechnol. Adv. 2012. V. 30. № 1. P. 321. https://doi.org/10.1016/j.biotechadv.2011.06.019
Garlotta D. // J. Polym. Environ. 2002. V. 9. № 2. P. 63. https://doi.org/10.1023/A:1020200822435
Kalb B., Pennings A.J. // Polymer (Guildf). 1980. V. 21. № 6. P. 607. https://doi.org/10.1016/0032-3861(80)90315-8
Агаджанян В.В., Пронских А.А., Демина В.А. и др. // Политравма. 2016. № 4. С. 85.
Hench L.L., Polak J.M. // Science. 2002. V. 295. № 5557. P. 1014. https://doi.org/10.1126/science.1067404
Rezwan K., Chen Q.Z., Blaker J.J., Boccaccini A.R. // Biomaterials. 2006. V. 27. № 18. P. 3413. https://doi.org/10.1016/j.biomaterials.2006.01.039
Giannelis E.P. // Adv. Mater. 1996. V. 8. № 1. P. 29. https://doi.org/10.1002/adma.19960080104
Paul D.R., Robeson L.M. // Polymer (Guildf). 2008. V. 49. № 15. P. 3187. https://doi.org/10.1016/j.polymer.2008.04.017
Wu C.-J., Gaharwar A.K., Schexnailder P.J., Schmidt G. // Materials (Basel). 2010. V. 3. № 5. P. 2986. https://doi.org/10.3390/ma3052986
Allo B.A., Costa D.O., Dixon S.J. et al. // J. Funct. Biomater. 2012. V. 3. № 2. P. 432. .https://doi.org/10.3390/jfb3020432
Jo J.-H., Lee E.-J., Shin D.-S. et al. // J. Biomed. Mater. Res. B. Appl. Biomater. 2009. V. 91. № 1. P. 213. https://doi.org/10.1002/jbm.b.31392
Cho J., Joshi M.S., Sun C.T. // Compos. Sci. Technol. 2006. V. 66. № 13. P. 1941. https://doi.org/10.1016/j.compscitech.2005.12.028
Roeder R.K., Sproul M.M., Turner C.H. // J. Biomed. Mater. Res. A. 2003. V. 67. № 3. P. 801. https://doi.org/10.1002/jbm.a.10140
Heimbach B., Grassie K., Shaw M.T. et al. // J. Biomed. Mater. Res. B. Appl. Biomater. 2017. V. 105. № 7. P. 1963. https://doi.org/10.1002/jbm.b.33713
Kunze C., Freier T., Helwig E. et al. // Biomaterials. 2003. V. 24. № 6. P. 967. https://doi.org/10.1016/S0142-9612(02)00433-7
Hong Z., Qiu X., Sun J. et al. // Polymer (Guildf). 2004. V. 45. № 19. P. 6699. https://doi.org/10.1016/j.polymer.2004.07.036
Atsuta M., Turner D.T. // Polym. Compos. 1982. V. 3. № 2. P. 83. https://doi.org/10.1002/pc.750030206
Helwig E., Sandner B., Gopp U. et al. // Biomaterials. 2001. V. 22. № 19. P. 2695. https://doi.org/10.1016/S0142-9612(01)00015-1
Ren J., Zhao P., Ren T. et al. // J. Mater. Sci. Mater. Med. 2008. V. 19. № 3. P. 1075.
Волынский А.Л., Бакеев Н.Ф. Роль поверхностных явлений в структурно-механическом поведении твердых полимеров. М.: Физматлит, 2013. 536 с.
Трофимчук Е.С., Ефимов А.В., Москвина А.М. и др. // Высокомолекулярные соединения А. 2018. Т. 60. № 8. С. 3.
Trofimchuk E.S., Moskvina M.A., Ivanova O.A. et al. // Mendeleev Commun. 2020. V. 30. № 2. P. 171. https://doi.org/10.1016/j.mencom.2020.03.013
Fadeeva I.V., Trofimchuk E.S., Giretova M. et al. // Biomed. Phys. Eng. Express. 2015. V. 1. № 4. P. 045011. https://doi.org/10.1088/2057-1976/1/4/045011
Fisa B., Sanschagrin B., Favis B. // Polym. Compos. 1984. V. 5. № 4. P. 264. https://doi.org/10.1002/pc.750050406
Damadzadeh B., Jabari H., Skrifvars M. et al. // J. Mater. Sci. Mater. Med. 2010. V. 21. № 9. P. 2523. https://doi.org/10.1007/s10856-010-4110-9
Sarvestani A.S., He X., Jabbari E. // Eur. Biophys. J. 2008. V. 37. № 2. P. 229. https://doi.org/10.1007/s00249-007-0198-3
Demina V.A., Krasheninnikov S.V., Buzin A.I. et al. // Mater. Sci. Eng. C. 2020. V. 112. P. 110813. https://doi.org/10.1016/j.msec.2020.110813
Баженов С.Л. Полимерные композиционные материалы. Прочность и технологии. Долгопрудный: Издательский Дом “Интеллект”, 2010. 347 с.
Hong Z., Zhang P., He C. et al. // Biomaterials. 2005. V. 26. № 32. P. 6296. https://doi.org/10.1016/j.biomaterials.2005.04.018
Dong Q., Chow L.C., Wang T. et al. // Colloids Surf. A. 2014. V. 457. P. 256. https://doi.org/10.1016/j.colsurfa.2014.05.047
Takagi S., Chow L.C., Ishikawa K. // Biomaterials. 1998. V. 19. № 17. P. 1593. https://doi.org/10.1016/S0142-9612(97)00119-1
Wang J., Fan Z., Li S. et al. // Polym. Adv. Technol. 2017. V. 28. № 12. P. 1892. https://doi.org/10.1002/pat.4078
Li J., Lu X.L., Zheng Y.F. // Appl. Surf. Sci. 2008. V. 255. № 2. P. 494. https://doi.org/10.1016/j.apsusc.2008.06.067
Qiu X., Hong Z., Hu J. et al. // J. Polym. Sci. A. 2005. V. 43. № 21. P. 5177. https://doi.org/10.1002/pola.21006
Liu Q., De Wijn J.R., Bakker D., Van Blitterswijk C.A. // J. Mater. Sci. Mater. Med. 1996. P. 551. https://doi.org/10.1007/BF00122178
Lee H.J., Choi H.W., Kim K.J., Lee S.C. // Chem. Mater. 2006. V. 18. № 21. P. 5111. https://doi.org/10.1021/cm061139x
Qiu X., Hong Z., Hu J. et al. // Biomacromolecules. 2005. V. 6. № 3. P. 1193. https://doi.org/10.1021/bm049502l
Huang G., Du Z., Yuan Z. et al. // J. Mech. Behav. Biomed. Mater. 2018. V. 78. P. 10. https://doi.org/10.1016/j.jmbbm.2017.10.036
Farah S., Anderson D.G., Langer R. // Adv. Drug Deliv. Rev. 2016. V. 107. P. 367. https://doi.org/10.1016/j.addr.2016.06.012
Гомзяк В.И., Демина В.А., Разуваева Е.В. и др. // Тонкие химические технологии. 2017. Т. 12. № 5. С. 5.
Малафеев К.В., Москалюк О.А., Юдин В.Е. и др. // Высокомол. соединения А. 2017. № 1. С. 47. https://doi.org/10.7868/S2308112017010096
ASTM F1925 – Virgin poly(L-lactic acid) resin for surgical implants.
ASTM F2313 – Virgin poly(glycolide) and poly(glycolide-co-lactide) resins for surgical implants with mole fractions greater than or equal to 70% glycolide.
ASTM F2579 – Amorphous poly(lactide) and poly(lactide-co-glycolide) resins for surgical implants.
Седуш Н.Г., Стрелков Ю.Ю., Чвалун С.Н. // Высокомол. соединения. Б. 2014. Т. 56. № 1. С. 39. https://doi.org/10.7868/S2308113914010100
Sedush N.G., Izraylit V.V., Mailyan A.K. et al. // Mendeleev Commun. 2017. V. 27. № 3. P. 281. https://doi.org/10.1016/j.mencom.2017.05.021
Гайнетдинова А.А., Крупнин А.Е., Сорокин Ф.Д. и др. // XXX Междунар. инновационная конф. молодых ученых и студентов (МИКМУС-2018). 2018. С. 378.
Park B., Jung B.T., Kim W.H. et al. // Materials (Basel). 2020. V. 13. № 1. P. 228. https://doi.org/10.3390/ma13010228
Sakaguchi M., Kobayashi S. // Adv. Compos. Mater. 2015. V. 24. № 1. P. 103. https://doi.org/10.1080/09243046.2014.951197
Suuronen R., Pohjonen T., Taurio R. et al. // J. Mater. Sci. Mater. Med. 1992. V. 3. № 6. P. 426. https://doi.org/10.1007/BF00701239
Malakhov S.N., Chvalun S.N. // Russ. J. Appl. Chem. 2019. V. 92. № 11. P. 1487. https://doi.org/10.1134/S107042721911003X
Lukanina K.I., Grigoriev T.E., Tenchurin T.K. et al. // Fibre Chem. 2017. V. 49. № 3. P. 205. https://doi.org/10.1007/s10692-017-9870-2
Romanova O.A., Grigoriev T.E., Goncharov M.E. et al. // Bull. Exp. Biol. Med. 2015. V. 159. № 4. P. 557. https://doi.org/10.1007/s10517-015-3014-6
Gorodkov A.Y., Zhorzholiani Sh.T., Agafonov A.V. et al. // Fibre Chem. 2019. V. 50. № 6. P. 556. https://doi.org/10.1007/s10692-019-10028-1
Gubareva E.A., Sjöqvist S., Gilevich I.V. et al. // Biomaterials. 2016. V. 77. P. 320. https://doi.org/10.1016/j.biomaterials.2015.11.020
Jeong S.I., Ko E.K., Yum J. et al. // Macromol. Biosci. 2008. V. 8. № 4. P. 328. https://doi.org/10.1002/mabi.200700107
Sherwood J.K., Riley S.L., Palazzolo R. et al. // Biomaterials. 2002. V. 23. № 24. P. 4739. https://doi.org/10.1016/S0142-9612(02)00223-5
Park J.Y., Gao G., Jang J., Cho D. // J. Mater. Chem. B. 2016. V. 4. № 47. P. 7521. https://doi.org/10.1039/C6TB01662F
Holy C.E., Cheng C., Davies J.E., Shoichet M.S. // Biomaterials. 2000. V. 22. № 1. P. 25. https://doi.org/10.1016/S0142-9612(00)00136-8
Loo J.S.C., Ooi C.P., Boey F.Y.C. // Biomaterials. 2005. V. 26. № 12. P. 1359. https://doi.org/10.1016/j.biomaterials.2004.05.001
Li S. // J. Biomed. Mater. Res. 1999. V. 48. № 3. P. 342. https://doi.org/10.1002/(SICI)1097-4636(1999)48:3<342::AID-JBM20>3.0.CO;2-7
Shtilman M.I. // J. Sib. Fed. Univ. Biol. 2015. V. 8. № 2. P. 113. https://doi.org/10.17516/1997-1389-2015-8-2-113-130
Williams D.F. // Eng. Med. 1981. V. 10. № 1. P. 5. https://doi.org/10.1243/EMED_JOUR_1981_010_004_02
Gu J.D., Ford T.E., Mitton D.B., Mitchell R. // Uhlig’s Corrosion Handbook: Third Edition. John Wiley and Sons, 2011. P. 421. https://doi.org/10.1002/9780470872864.ch30
Rockwood D.N., Woodhouse K.A., Fromstein J.D. et al. // J. Biomater. Sci. Polym. Ed. 2007. V. 18. № 6. P. 743. https://doi.org/10.1163/156856207781034115
Li S., Garreau H., Vert M. // J. Mater. Sci. Mater. Med. 1990. V. 1. № 4. P. 198. https://doi.org/10.1007/BF00701077
Vert M. // Biomacromolecules. 2005. V. 6. № 2. P. 538. https://doi.org/10.1021/bm0494702
Tokiwa Y., Suzuki T. // Nature. 1977. V. 270. № 5632. P. 76. https://doi.org/10.1038/270076a0
Tokiwa Y., Calabia B.P. // Biotechnol. Lett. 2004. V. 26. № 15. P. 1181. https://doi.org/10.1023/B:BILE.0000036599.15302.e5
Gleadall A., Pan J., Kruft M.-A., Kellomäki M. // Acta Biomater. 2014. V. 10. № 5. P. 2223. https://doi.org/10.1016/j.actbio.2013.12.039
Cha Y., Pitt C.G. // J. Control. Release. 1989. V. 8. № 3. P. 259. https://doi.org/10.1016/0168-3659(89)90047-3
Wu L., Ding J. // Biomaterials. 2004. V. 25. № 27. P. 5821. https://doi.org/10.1016/j.biomaterials.2004.01.038
Lin C.-C., Anseth K.S. // Biomaterials Science. Elsevier, 2013. P. 716.
Russias J., Saiz E., Nalla R.K. et al. // Mater. Sci. Eng. C. 2006. V. 26. № 8. P. 1289. https://doi.org/10.1016/j.msec.2005.08.004
Perepechko I. Acoustic Method of Investigating Polymers. M.: Mir Publishers, 1975.
Wu H. // Biomaterials. 2003. V. 24. № 22. P. 3871. https://doi.org/10.1016/S0142-9612(03)00135-2
Park D.W., Ye S.H., Jiang H.B. et al. // Biomaterials. 2014. V. 35. № 27. P. 7851. https://doi.org/10.1016/j.biomaterials.2014.05.088
Ruland A., Gilmore K.J., Daikuara L.Y. et al. // Acta Biomater. 2019. V. 91. P. 173. https://doi.org/10.1016/j.actbio.2019.04.055
Morokov E.S., Demina V.A., Sedush N.G. et al. // 9th Int. Conf. “Times of Polymers and Composites ”, 2018. P. 020138. https://doi.org/10.1063/1.5046000
Hong X., Annamalai R.T., Kemerer T.S. et al. // Biomaterials. 2018. V. 178. P. 11. https://doi.org/10.1016/j.biomaterials.2018.05.057
Morokov E.S., Demina V.A., Sedush N.G. et al. // Acta Biomater. 2020. V. 109. P. 61. https://doi.org/10.1016/j.actbio.2020.04.011
Webster T.J., Ergun C., Doremus R.H. et al. // J. Biomed. Mater. Res. 2000. V. 51. № 3. P. 475.
Wei G., Ma P.X. // Biomaterials. 2004. V. 25. № 19. P. 4749. https://doi.org/10.1016/j.biomaterials.2003.12.005
Mohandes F., Salavati-Niasari M. // New J. Chem. 2014. V. 38. № 9. P. 4501. https://doi.org/10.1039/C4NJ00649F
Loher S., Reboul V., Brunner T.J. et al. // Nanotechnology. 2006. V. 17. № 8. P. 2054.
Shin D.Y., Kang M.-H., Kang I.-G. et al. // J. Biomater. Appl. 2018. V. 32. № 10. P. 1360. https://doi.org/10.1177/0885328218763660
Hutmacher D.W. // Biomaterials. 2000. V. 21. № 24. P. 2529. https://doi.org/10.1016/S0142-9612(00)00121-6
O’Brien F.J. // Mater. Today. 2011. V. 14. № 3. P. 88. https://doi.org/10.1016/S1369-7021(11)70058-X
Chan B.P., Leong K.W. // Eur. Spine J. 2008. V. 17. № S4. P. 467. https://doi.org/10.1007/s00586-008-0745-3
Venugopal J., Low S., Choon A.T. et al. // J. Mater. Sci. Mater. Med. 2008. V. 19. № 5. P. 2039.
Habibovic P., Yuan H., van der Valk C. et al. // Biomaterials. 2005. V. 26. № 17. P. 3565. https://doi.org/10.1016/j.biomaterials.2004.09.056
Hunt J.A., Callaghan J.T. // Knee Surgery, Sport. Traumatol. Arthrosc. 2008. V. 16. № 7. P. 655. https://doi.org/10.1007/s00167-008-0528-8
Bennett S.M., Arumugam M., Wilberforce S. et al. // Acta Biomater. 2016. V. 45. P. 340. https://doi.org/10.1016/j.actbio.2016.08.046
Nuss K.M., Auer J.A., Boos A., Rechenberg B. // BMC Musculoskelet. Disord. 2006. V. 7. № 1. P. 67. https://doi.org/10.1186/1471-2474-7-67
Yang Z., Best S.M., Cameron R.E. // Adv. Mater. 2009. V. 21. P. 3900. https://doi.org/10.1002/adma.200901093
Kulkova J., Moritz N., Suokas E.O. et al. // J. Mech. Behav. Biomed. Mater. 2014. V. 40. P. 190. https://doi.org/10.1016/j.jmbbm.2014.08.028
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии