Российские нанотехнологии, 2021, T. 16, № 1, стр. 118-124
ПРИМЕНЕНИЕ ПОЛИМЕРНЫХ МИКРОСФЕР ДЛЯ РАЗРАБОТКИ ПОДХОДОВ К ОЦЕНКЕ КОЛИЧЕСТВА НЕЙТРОФИЛЬНЫХ ВНЕКЛЕТОЧНЫХ ЛОВУШЕК
Е. В. Войнова 1, *, Л. Ю. Басырева 1, А. А. Сиваев 2, С. А. Гусев 1, И. А. Грицкова 2, С. Н. Чвалун 2
1 Федеральный научно-клинический центр физико-химической медицины Федерального медико-биологического агентства России
Москва, Россия
2 МИРЭА – Российский технологический университет
Москва, Россия
* E-mail: ek.vl.voinova@gmail.com
Поступила в редакцию 06.10.2020
После доработки 27.10.2020
Принята к публикации 27.10.2020
Аннотация
Нейтрофильные внеклеточные ловушки (НВЛ) играют важную роль в антимикробной защите организма. Однако их чрезмерное образование приводит к развитию различных патологических процессов в организме. Поэтому количественная оценка содержания НВЛ в цельной крови человека очень важна в клинической практике. Предложен подход, позволяющий использовать полимерные микросферы (ПМС), поверхность которых модифицирована гепарином, в качестве сорбентов для выделения из цельной крови и количественного определения НВЛ. Для решения поставленной задачи синтезированы полистирольные микросферы со средним диаметром 140 мкм, содержащие аминогруппы, проведена ковалентная иммобилизация гепарина на их поверхность, продемонстрирована зависимость, близкая к линейной, между количеством НВЛ и количеством ДНК-гистоновых комплексов, связывающихся с поверхностью синтезированных ПМС. Полученные данные свидетельствуют о том, что предложенный подход может оказаться перспективным для применения как в фундаментальных исследованиях, так и в клинической практике.
ВВЕДЕНИЕ
Нейтрофилы, также известные как полиморфноядерные лейкоциты (ПМЛ), являются одними из самых распространенных лейкоцитов в организме человека. У взрослых приблизительно от 1 × 1011 до 2 × 1011 нейтрофилов генерируется в костном мозге каждый день. Они попадают в кровоток, где циркулируют в течение 4–10 ч, после чего элиминируются [1, 2].
Нейтрофилы являются первыми клетками, которые проникают в очаг повреждения, принимают участие в удалении из очага микроорганизмов и поврежденных клеток. Немаловажную роль нейтрофилы играют в процессе заживления ран в зоне повреждения. Понимание роли нейтрофилов в процессах, реализующихся в очаге повреждения, базируется на анализе механизмов, регулирующих процессы активации нейтрофилов.
В 2004 г. группа доктора А. Зычлинского обнаружила, что нейтрофилы могут убивать патогены вне клеток, выбрасывая сетеподобные структуры, которые они назвали нейтрофильными внеклеточными ловушками (НВЛ) [3]. Процесс образования НВЛ был назван нетозом. Основными компонентами НВЛ являются ДНК, гистоны, антимикробные пептиды и ферменты, такие как эластаза и миелопероксидаза. Процесс образования НВЛ начинается с активации нейтрофила под действием различных индукторов, например бактерий, грибов, простейших или вирусов. При этом изменяется структура ядра и цитоплазматических гранул клетки. После стимуляции хроматин ядра нейтрофилов подвергается деконденсации. Этот процесс происходит под действием ферментов, таких как нейтрофильная эластаза (НЭ) и миелопероксидаза (MПO). Впоследствии мембрана ядра повреждается, распадаясь на множество мелких пузырьков, и деконденсированный хроматин попадает в цитоплазму. Далее гранулы нейтрофила растворяются, и внутриклеточные компоненты распределяются по всему объему цитоплазмы [4–6].
Предполагается, что НВЛ связывают микроорганизмы благодаря электростатическим взаимодействиям между отрицательно заряженными фибриллами хроматина и положительно заряженной бактериальной поверхностью [7].
Однако формирование НВЛ может играть не только положительную, но и отрицательную роль в организме. Чрезмерное образование НВЛ в кровотоке или нарушение клиренса НВЛ может приводить к образованию тромбов, вызывать ишемию и являться причиной развития полиорганной недостаточности [8, 9]. Показано, что чрезмерное образование НВЛ играет существенную роль в развитии осложнений при атеросклерозе, муковисцидозе, диабете, системной красной волчанке, пародонтите, сепсисе, тромбозе и т.д. В настоящее время известно большое количество методов, которые используются для количественного определения НВЛ в крови [10–15]. Однако ни один из них не нашел широкого применения в клинической практике. В связи с этим цель настоящего исследования – разработать подходы к применению функциональных полистирольных микросфер (ПМС) диаметром 140 мкм для количественного определения НВЛ в крови, которые в перспективе можно было бы применить в клинической практике.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Вещества. Стирол (Ст), дивинилбензол (ДВБ), перекись бензоила (ПБ), триметиламин (ТМА), хлороводородная кислота, форбол-12-миристат-13-ацетат (ФМА) производства фирмы “Sigma-Aldrich”, диоктилсульфосукцинат натрия (АОТ) – “ХимРеакт” и “Acros” (Geel, Бельгия), динитрил азобисизомасляной кислоты (ДАК) – “ЛДХим”, монохлордиметиловый эфир (МХДМЭ) – “Merck”, поливиниловый спирт (ПВС) – “Kuraray”, этанол – “СпиртМед”. Все химические вещества марки ХЧ, их использовали без дополнительной очистки. Все растворители и компоненты буферных растворов были аналитического качества и использовались без дополнительной очистки.
Синтез ПМС со средним диаметром частиц 140 мкм. Дисперсионную полимеризацию стирола проводили в этаноле (этанол, 60 мл) в присутствии инициатора (ДАК, 0.6 г) и стабилизатора (ПВП, 3.0 г и АОТ, 2.0 г) при медленном механическом перемешивании при 50°С и единовременном добавлении стирола (20 мл). Процесс проводили 6.5 ч, постепенно увеличивая температуру до 70°С. Частицы выделяли центрифугированием, промывали этиловым спиртом и редиспергировали в водной среде. В результате были получены монодисперсные ПМС диаметром 2.5 мкм, которые использовали в последующей затравочной полимеризации, состоящей из шести стадий.
В первых пяти стадиях использовали полистирольные частицы (14 г), стирол (100 г), ПБ (1.5 г), водную фазу (500 мл). После каждой стадии полимеризации микросферы промывали водой на фильтре Шотта. На шестой стадии в мономерную фазу добавляли ДВБ (95 г) и ПВС (0.9 г). После окончания полимеризации частицы промывали водой на фильтре Шотта, экстрагировали ацетоном и дихлорметаном, просеивали на ситах и сушили.
Хлорметилирование проводили, добавляя в реактор предварительно высушенные полимерные частицы (100 г), МХДМЭ (300 мл) и катализатор, хлорид олова(IV) (60 г). Процесс проводили в течение 6 ч при температуре 25°C. Полученную смесь промывали на фильтре Шотта этанолом (2 раза) и ацетоном (2 раза). После удаления остатков катализатора частицы двукратно промывали этанолом и сушили при температуре 60°С.
Аминирование проводили при температуре 80°С, добавляя к хлорметилированному полимеру ТМА (40%-ный водный раствор, 200 мл), выдерживали 6 ч при перемешивании при температуре 40°С, промывали водой на фильтре Шотта до нейтральной реакции воды. Частицы переводили в хлорированную форму, используя раствор соляной кислоты (10%, 400 мл).
Полимерную суспензию подвергали очистке от непрореагировавших компонентов реакционной системы путем обработки суспензии ультразвуком в течение 3 мин при 60 у.е. (условная единица) на ультразвуковом диспергаторе Sonic Dismembrator Model 300 фирмы “Fisher” (Германия) c последующей заменой супернатанта после осаждения полимерных частиц. Полистирольные микросферы ресуспендировали в чистой дистиллированной воде. Цикл очистки повторяли 3 раза.
Все дальнейшие опыты с микросферами проводили после обработки их ультразвуком.
Распределения ПМС по размерам определяли методом микроскопии (микроскоп Motic B3 (Мotic Asisa, Hong Kong), а анализ размеров проводили с помощью программы ImageJ. Среднечисловой (Dn) и средневесовой (Dw) диаметры частиц и коэффициент полидисперсности (PDI) рассчитывали по формулам:
Для подтверждения наличия функциональных групп в ПМС использовали реакцию Майяра с глюкозой, которую проводили при температуре 60°С в течение 5 ч [16]. Для этого глюкозу растворяли в фосфатно-солевом буфере (PBS), суспензию ПМС трехкратно промывали дистиллированной водой, раствор глюкозы (30%) и 4%-ную суспензию ПМС смешивали в соотношении 1:2.
Ковалентная иммобилизация гепарина на поверхность ПМС. Суспензию полистирольных микросфер со средним диаметром 140 мкм и концентрацией полимера 10% смешивали с водным раствором карбодиимида (10 мг/мл) в соотношении 10:1 и инкубировали в течение 1 ч при комнатной температуре и постоянном перемешивании на ротаторе Multi Bio RS-24 фирмы BIOSAN. Полученную суспензию отмывали от карбодиимида раствором Хенкса 3 раза и добавляли раствор гепарина с концентрацией 5000 МЕ/мл. Инкубировали в течение 1.5 ч при комнатной температуре и постоянном перемешивании на ротаторе. Далее отмывали гепарин раствором Хенкса 3 раза, полученные ПМСгеп хранили при 4°С для дальнейшего использования.
Определение гепарина, иммобилизованного на поверхность ПМС, проводили по методике, предложенной в [17].
Для этого готовили 0.005%-ный раствор красителя толуидинового голубого и смешивали его с 4%-ной суспензией ПМС в соотношении 1:1. Добавляли равный объем н-гексана и инкубировали при комнатной температуре в течение 30 мин.
Оценку наличия гепарина проводили по конечной окраске ПМС: фиолетовая окраска свидетельствует об отсутствии гепарина на поверхности, голубая – о его наличии.
В качестве контроля использовали исходные ПМС и полимерные микросферы с адсорбированным гепарином.
Регистрация количества НВЛ. Венозную кровь забирали в вакутейнеры с цитратом натрия в качестве антикоагулянта. Затем 50 мкл крови добавляли к 100 мкл суспензии ПМС и инкубировали 30 мин в термостате при 37°С в двух режимах: в стационарном и при мягком постоянном перемешивании в мешалке Biosan.
Из каждого образца, а также из крови сразу после ее взятия готовили стандартизированные мазки и окрашивали их по Романовскому. Количественную оценку НВЛ проводили в соответствии с предложенным в [18] методом, основанном на подсчете лейкоцитов и НВЛ в средней части мазков. Для подсчета клеток на мазках и в камере Горяева использовали световой микроскоп Motic B3 (Мotic Asisa, Hong Kong). На основе полученных данных рассчитывали количество НВЛ в 1 мкл.
Статистическую обработку результатов проводили с использованием пакета программ STATISTICA 6.0. Достоверность различий оценивали с помощью t-критерия Стьюдента и U-критерия Манна–Уитни.
Методика определения количества ДНК, сорбированного на ПМСгеп. 10 мкл крови смешивали с 50 мкл ПМСгеп и инкубировали в течение 2 ч при 40°С. После этого ПМСгеп трижды промывали PBS и фиксировали 0.5%-ным раствором параформальдегида в течение 30 мин. Окрашивали ДНК на ПМСгеп раствором этидиум бромида (50 мкг/мл) в течение 20 мин при комнатной температуре. Окрашенные ПМСгеп трижды промывали дистиллированной водой, флуоресценцию регистрировали с помощью конфокального микроскопа Nikon Eclipse E800 (Япония). Анализ интенсивности флуоресценции проводили с помощью программы ImageJ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтезированные ПМС имели круглую форму и сравнительно ровную поверхность (рис. 1а), средний диаметр 137 мкм и узкое распределение по размерам (PDI = 1.08) (рис. 1б).
Рис. 1.
Электронная микрофотография и гистограмма распределения ПМС с аминогруппами на поверхности по размерам.

Для подтверждения наличия реакционно способных функциональных групп на поверхности ПМС была проведена реакция Майяра между аминогруппами ПМС и глюкозой. Продукты этой реакции имеют коричневый цвет. На рис. 2 представлены фотографии полимерных суспензий до и после проведения реакции Майяра. Хорошо видно, что до проведения реакции Майяра ПМС имеют белый цвет, а после проведения реакции цвет ПМС становится коричневым. Эти данные указывают на то, что на поверхности ПМС имеются реакционноспособные аминогруппы, которые можно использовать для ковалентной иммобилизации биолигандов.
Рис. 2.
Фотографии суспензий ПМС и результатов тонкослойной хроматографии исходных ПМС, содержащих поверхностные аминогруппы (а), и ПМС после проведения реакции Майяра (б).

В качестве биолиганда для специфического связывания НВЛ из цельной крови был выбран гепарин. Выбор основан на исследованиях, в которых было показано, что гепарин способен связываться с гистонами [19]. Тот факт, что гистоны входят в состав НВЛ, позволил предположить, что ПМСгеп будут связывать НВЛ в цельной крови.
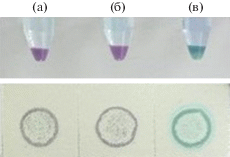
Ковалентную иммобилизацию гепарина на поверхность аминосодержащих ПМС проводили с помощью карбодиимида. Для подтверждения наличия ковалентно иммобилизованного гепарина на поверхности ПМС использовали качественную реакцию с толуидиновым голубым. На рис. 3 представлены фотографии ПМС до ковалентной иммобилизации гепарина, после иммобилизации гепарина карбодиимидным методом и после адсорбции гепарина. На фото видно, что синяя окраска ПМС, свидетельствующая о наличии гепарина на поверхности, наблюдается только у ПМСгеп, в то время как образцы ПМС до ковалентной иммобилизации и ПМС после адсорбции гепарина были фиолетового цвета. Полученные данные свидетельствуют о том, что на поверхности ПМСгеп присутствует только ковалентно иммобилизованный гепарин.
Рис. 3.
Фотографии суспензий ПМС и результатов тонкослойной хроматографии после окрашивания толуидиновым голубым исходных ПМС, содержащих поверхностные аминогруппы (а), ПМС с адсорбированным гепарином (б) и ПМС с ковалентно иммобилизованным гепарином (в).
Полученные ПМСгеп инкубировали с цельной кровью, отмывали от компонентов крови 3 раза физиологическим раствором и окрашивали этидиум бромидом. На рис. 4 представлены фотографии ПМСгеп и ПМСгеп после инкубации с цельной кровью. На рисунке видно, что после инкубации на поверхности ПМСгеп появляется ободок яркой флуоресценции шириной несколько десятков микрон.
Рис. 4.
Флуоресценция ПМСгеп (а, в, д) и флуоресценция ПМСгеп после взаимодействия с кровью (б, г, д).
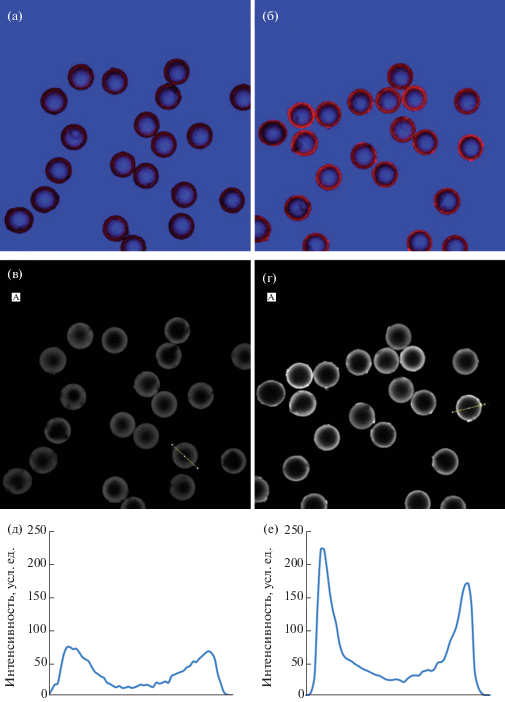
Анализ профилей интенсивности флуоресценции ПМСгеп, выделенных на рис. 4в, 4г, показывает, что интенсивность флуоресценции в краевой зоне ПМСгеп до инкубации с цельной кровью (рис. 4д) составляет 75 у.е., что приблизительно в 3 раза меньше, чем интенсивность флуоресценции ПМСгеп после инкубации с цельной кровью (рис. 4е), которая равна 225 у.е. Полученные данные свидетельствуют о том, что на поверхности ПМСгеп после инкубации с цельной кровью закрепляются гистонсодержащие нити ДНК. Отметим, что в цельной крови помимо НВЛ могут присутствовать другие гистонсодержащие фрагменты ДНК, в том числе образованные при деградации НВЛ. Учитывая сказанное выше, необходимо было оценить соотношение между количеством НВЛ и интенсивностью флуоресценции ПМСгеп после инкубации с кровью.
Для этого из цельной крови донора были приготовлены четыре образца с различным содержанием НВЛ. Первый образец представлял собой плазму крови. Второй образец представлял собой кровь, которая была разведена плазмой в соотношении 1:1. Третий образец – цельная кровь, которая была использована в нативной форме. Четвертый образец – кровь после двухчасовой инкубации со стимулятором образования НВЛ – ФМА.
Таким образом, были получены три образца крови донора, которые различаются по количеству НВЛ, и плазма донора, в которой ловушки должны отсутствовать.
На рис. 5 представлены результаты определения количества НВЛ в четырех приготовленных образцах, рассчитанные на основании анализа мазков крови.
Рис. 5.
Концентрация нейтрофильных внеклеточных ловушек (НВЛ/мкл), определенная традиционным методом анализа мазков, в образцах плазмы крови (плазма), крови, разведенной плазмой в соотношении 1:1 (кровь/2), цельной крови (кровь) и крови после инкубации со 100 нМ ФМА (кр + ФМА).
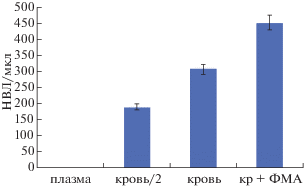
Действительно, в плазме крови НВЛ обнаружить не удалось. В образце крови, разведенной собственной плазмой в соотношении 1:1, количество НВЛ составило 188 НВЛ/мкл, в цельной крови количество НВЛ – 306 НВЛ/мкл, а в крови после инкубации со стимулятором образования НВЛ их количество составило 451 НВЛ/мкл.
Параллельно с анализом мазков крови была измерена флуоресценция ПМСгеп после инкубации со всеми четырьмя приготовленными образцами.
Анализ результатов показал, что средняя интенсивность флуоресценции, выраженная в у.е., в пересчете на 1 ПМСгеп – для плазмы составила 20 у.е., для образца крови, разведенного плазмой в соотношении 1:1, – 380 у.е., для цельной крови – 750 у.е. и для образца крови, инкубированного с ФМА, – 1200 у.е. (рис. 6).
Рис. 6.
Интенсивность флуоресценции ПМСгеп после их инкубации с образцами плазмы крови (плазма), крови, разведенной плазмой в соотношении 1:1 (кровь/2), цельной крови (кровь) и крови, после инкубации с 100 нМ ФМА (кр + ФМА).
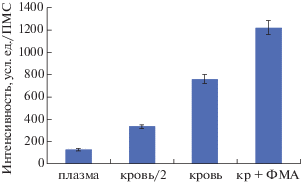
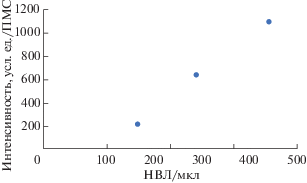
На рис. 7 видно, что по мере увеличения количества НВЛ в образце возрастает интенсивность флуоресценции ПМСгеп.
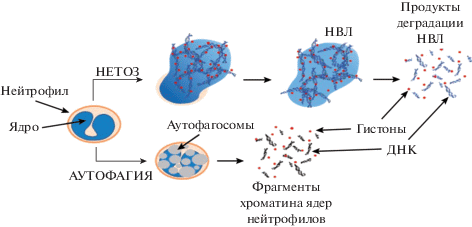
Однако следует принимать во внимание тот факт, что интенсивность флуоресценции ПМСгеп в исследованных образцах может быть обусловлена различными ДНК-гистоновыми комплексами. На рис. 8 представлена схема, иллюстрирующая образование различных ДНК-гистоновых комплексов в крови. В результате запуска внутрисосудистого нетоза в крови образуются НВЛ, которые со временем под действием ДНКазы-1 расщепляются на небольшие растворимые фрагменты, состоящие из ДНК-гистоновых комплексов. Таким образом, в цельной крови находятся как НВЛ, так и их растворимые фрагменты. Инкубация плазмы крови с ПМСгеп должна приводить к связыванию растворимых фрагментов НВЛ. Поэтому интенсивность флуоресценции ПМСгеп после взаимодействия с плазмой крови донора обусловлена только наличием растворимых фрагментов НВЛ. Интенсивность флуоресценции ПМСгеп после инкубации с образцами крови, разведенной собственной плазмой в соотношении 1:1, и цельной кровью будет обусловлена как НВЛ, так и их растворимыми фрагментами. В образце крови, полученном после инкубации со 100 нМ ФМА, в нейтрофилах активируется нетоз, в результате которого увеличивается образование НВЛ. Кроме того, у части нейтрофилов запускается процесс аутофагии, в результате которого нейтрофилы разрушаются и внутриклеточные компоненты нейтрофилов, в том числе фрагменты хроматина, оказываются в плазме крови. Это приводит к тому, что интенсивность флуоресценции ПМСгеп после инкубации с этим образцом крови будет определяться наличием НВЛ, присутствием растворимых фрагментов НВЛ и фрагментов хроматина ядра нейтрофилов, подвергшихся аутофагии. Дальнейшие исследования, проведенные на крови доноров и пациентов с различными заболеваниями, должны установить точные количественные соотношения между количеством НВЛ и интенсивностью флуоресценции ПМСгеп.
ЗАКЛЮЧЕНИЕ
Результаты проведенного исследования показали, что полистирольные микросферы со средним диаметром 140 мкм и ковалентно иммобилизованным на их поверхности гепарином могут быть использованы в качестве сорбента для выделения и анализа гистон-содержащих ДНК-структур (нейтрофильных внеклеточных ловушек, фрагментов деградации НВЛ и фрагментов хроматина ядра нейтрофилов, подвергшихся аутофагии). Продемонстрировано наличие зависимости, близкой к линейной, между количеством НВЛ, содержащихся в цельной крови, и интенсивностью флуоресценции ПМСгеп.
Благодаря простоте выполнения предложенный подход может оказаться перспективным при разработке методов количественного анализа НВЛ в цельной крови как в фундаментальных исследованиях, так и в клинике.
Работа выполнена при финансовой поддержке Минобрнауки России (грант № 13.1902.21.0011).
Список литературы
Meijer M., Przemyslaw M., Arazna M., Demkaw U. // Centr. Eur. J. Immunol. 2012. V. 37. № 4. P. 321.
Коротина О.Л., Генералов И.И. // Иммунопатология, аллергология, инфектология. 2012. № 3. С. 23.
Brinkmann V., Reichard U., Goosmann C. et al. // Science. 2004. № 303. P. 1532.
Neeli I., Khan S.N., Radic M. // J. Immunology. 2008. № 180. P. 1895.
Gupta A.K., Hasler P., Holzgreve W. et al. // Hum. Immunol. 2005. V. 66. № l. P. 146.
Zawrotniak M., Rapala-Kozik M. // Acta Biochim. Pol. 2013. 60 № (3). P. 277.
Brinkmann V. // J. Innate Immunol. 2018. V. 10. № 5–6. P. 414.
Воробьева Н.В., Пинегин Б.В. // Биохимия. 2014. Т. 79. № 12. С. 1580.
Nel J.G., Theron A.J., Pool R., Durandt Ch. // South African J. Sci. 2016. P. 1.
Cohen J., Vincent J., Adhikari N. et al. // Lancet Infect Dis. 2015. № 15. P. 581.
Yu X., Tan J., Diamond S. L. // J. Thromb Haemost. 2018. V. 16. № 2. P. 316.
Demers M., Wagner D.D. // OncoImmunology. 2013. V. 2. № 2. P. e22946.
Pruchniak M., Araźna M., Demkow U. // Centr. Eur. J. Immunol. 2014. V. 39. № 1. P. 116.
Yu Y., Su K. // J. Clin. Cell. Immunol. 2013. V. 13. P. 1.
Beinikova I.V., Nurgaliyeva A.S., Demidchik L.A., Hendrikson V. // Вестн. АГИУВ. 2016. № 3. Р. 29.
Dang Q., Li Ch.-G., Jin X.-X. et al. // Carbohydrate Polymers. 2019. № 205. P. 89.
Gritskova I.A., Sivaev A.A., Gusev S.A. et al. // Russian Chemical Bulletin. 2019. V. 68. № 11. P. 2075.
Basyreva L.Y., Brodsky I.B., Gusev A.A. et al. // Hum. Antibodies. 2016. V. 24. № 3–4. P. 39.
Longstaff C., Hogwood J., Grayl E. et al. // Thrombosis and Haemostasis. 2016. V. 115 (3). P. 591.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии