Российские нанотехнологии, 2021, T. 16, № 2, стр. 149-174
НАНО- И МИКРОРАЗМЕРНЫЕ ФОРМЫ СИЛИМАРИНА И СИЛИБИНА
Ю. И. Полтавец 1, *, С. Л. Кузнецов 1, И. А. Тубашева 1, А. И. Муравьева 1, Н. В. Гукасова 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: poltavets_yi@nrcki.ru
Поступила в редакцию 02.07.2020
После доработки 02.07.2020
Принята к публикации 19.08.2020
Аннотация
Современные препараты расторопши пятнистой применяются с 60–70-х годов ХХ века. По химической природе активные вещества расторопши являются флавоноидами (флавонолигнанами). В качестве препаратов используются как комплекс флавонолигнанов расторопши (силимарин), так и наиболее активное индивидуальное вещество (силибин). Препараты на основе силимарина и силибина востребованы в клинике как гепатопротекторы, однако их серьезными недостатками являются низкие растворимость в воде и биодоступность, что значительно снижает терапевтический потенциал. В связи с этим активно разрабатываются нано- и микроформы силимарина/силибина. В обзоре представлена информация об источниках получения, химической структуре и биологической активности силимарина и силибина. Рассмотрены основные известные нано- и микроформы силимарина и силибина, описаны способы их получения. Данные формы получают с помощью одного или комбинации нескольких технологических приемов: диспергирования, растворения в подходящих растворителях, формирования комплексов включения и твердых дисперсий, химической модификации и др. Разработанные формы силимарина/силибина представляют собой нанокристаллы, твердые дисперсии, твердые липидные системы, комплексы включения, дендрисомы, липосомы, нано- и микроэмульсии, полимерные частицы, нанокомпозиты. Каждая из перечисленных форм обладает рядом преимуществ, к которым в целом можно отнести повышение растворимости и биодоступности силибина, пролонгированное/контролируемое высвобождение из нано- и микроструктур, повышение стабильности. Разработка нано- и микроформ силимарина и силибина позволила получить композиции с улучшенными физико-химическими характеристиками, биофармацевтическими свойствами и более высокой специфической активностью, в том числе гепатопротекторной, противоопухолевой, противовирусной и антимикробной, что дает основание к расширению терапевтической области применения препаратов данной группы.
ОГЛАВЛЕНИЕ
Введение
1. Силимарин и его компоненты
2. Биологическая активность силимарина и силибина
3. Основные направления в разработке нано- и микроформ силимарина и силибина
4. Нанокристаллы
5. Твердые дисперсии
6. Твердые липидные системы
7. Комплексы включения
8. Липосомы и фитосомы
9. Дендрисомы
10. Нано- и микроэмульсии
11. Полимерные частицы
12. Силибинсодержащие композиты
Заключение
ВВЕДЕНИЕ
Современные препараты расторопши пятнистой известны с 60–70-х годов ХХ века. До настоящего времени активно применяются суммарный препарат – экстракт плодов расторопши (Легалон, Карсил и др.), комплекс флавонолигнанов (силимарин, СМ) и наиболее активное индивидуальное соединение (силибин, силибинин, СБ). Препараты в основном используются при лечении поражений печени различной этиологии. Они хорошо зарекомендовали себя в клинике, однако не лишены ряда недостатков [1, 2].
Основная проблема повышения эффективности терапии поражений печени даже в случае индивидуального вещества СБ состоит в том, что ввиду своей структуры вещество практически нерастворимо в воде и имеет низкую биодоступность [3].
Повышение биодоступности СБ является одним из основных направлений биофармацевтических исследований. Это в равной мере справедливо по отношению к СМ. Результат достигается либо за счет повышения растворимости в водных средах, либо за счет облегчения адсорбции препарата в желудочно-кишечном тракте (ЖКТ) путем придания ему необходимых для этого свойств [4]. В клинике применяется лишь одна водорастворимая форма силибина – это препарат Legalon® SIL, вводимый парентерально при острых токсических поражениях печени [5]. Инъекционная форма применяется только при состояниях, требующих немедленного вмешательства. В остальных случаях назначается поддерживающая гепатопротекторная терапия, которая проводится длительно и предполагает пероральный прием достаточно высоких доз препарата. Поэтому усилия исследователей направлены в большей мере на создание лекарственных форм силибина с высокой биодоступностью при пероральном приеме. Известно и разрабатывается большое количество препаратов СБ, где он представлен в микроформе либо в составе наноструктурированных систем. Возрастание биодоступности обеспечивается двумя основными путями: уменьшением размеров частиц СБ до десятков–сотен нанометров, а также свойствами используемых вспомогательных веществ, повышающих седиментационную устойчивость наноформ СБ и облегчающих их взаимодействие с клеточными мембранами. В результате улучшается абсорбция, увеличиваются количество препарата в кровотоке и период его циркуляции, замедляется экскреция, что приводит к оптимизации биофармацевтических характеристик [6, 7].
В данном обзоре описаны основные направления получения нано- и микроформ силимарина/силибина и их характеристики.
1. СИЛИМАРИН И ЕГО КОМПОНЕНТЫ
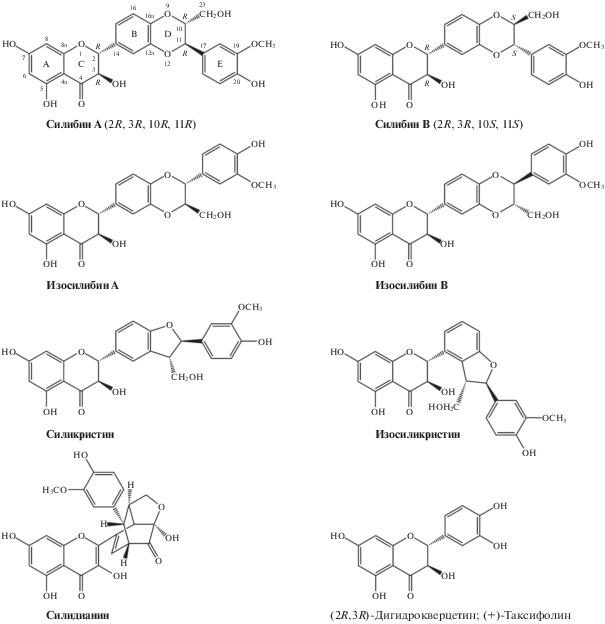
Расторопша пятнистая – Silibum marianum (L.) Gaertneri семейства Астровых (Asteraceae), или Сложноцветных (Compositeae) – широко применяется в медицине. Из растительного сырья расторопши получают экстракт, в котором содержится комплекс биологически активных соединений в количестве 65–85% от массы сухого экстракта. Стандартизированный сухой экстракт называется силимарином. Его выход из плодов (семян) расторопши обычно колеблется от 1 до 3.5%, иногда достигает 6% [8–12]. В число основных компонентов СМ входят флавонолигнаны: силибин, изосилибин, силикристин, изосиликристин, силидианин, а также в небольшом количестве флавоноид (+)-таксифолин (транс-2,3-дигидрокверцетин). Наиболее высокого содержания среди флавонолигнанов СМ-комплекса чаще всего достигает СБ (до 75%) [1, 8, 12–15]. Природный силибин (силибинин) представляет собой смесь транс-диастереоизомеров силибина А и силибина В в соотношении ~1: 1. Подобная изомерия наблюдается для изосилибина [16, 17]. Известны диастереоизомеры для силикристина и изосиликристина [18–20], однако в СМ преобладают А-конфигурации этих флавонолигнанов. На рис. 1 представлены структурные формулы основных компонентов СМ [8, 12].
Сухой экстракт расторопши пятнистой, согласно требованиям Европейской фармакопеи и Фармакопеи США [21, 22], должен содержать от 90 до 110% СМ, в пересчете на СБ (C25H22O10; Mr 482.4), указанного на этикетке. Номинальное содержание СМ в сухом экстракте находится в пределах от 30 до 65% мас./мас. В СМ с учетом его общего количества нормируется содержание основных компонентов (все C25H22O10; Mr 482.4): сумма силикристина и силиадианина от 20 до 45%, сумма силибинина А и силибинина В от 40 до 65%, сумма изосилибинина А и изосилибинина B от 10 до 20%. Для идентификации (качественного анализа) компонентов применяется метод тонкослойной хроматографии, для количественного определения – метод высокоэффективной жидкостной хроматографии. Обычно в фармацевтических продуктах, содержащих СМ, концентрация СБ находится в диапазоне 20–40% [1].
Состав флавонолигнанов СМ зависит от популяций S. marianum [10, 23, 24]. В лиловоцветковой популяции расторопши пятнистой, которая является основным источником сырья при производстве гепатопротекторных препаратов, всегда присутствуют СБ и силидианин. На содержание компонентов СМ-комплекса влияют и другие факторы, среди которых географический регион произрастания. Содержание флавонолигнанов в различных частях растения существенно различается [19, 24, 25].
В экстрактах расторопши кроме перечисленных флавонолигнанов обнаружены силигермин, неосилигермин, 1,2-дегидросилибин, 1,2-дегидросиликристин, их диастереоизомеры и другие компоненты. Кроме флавоноида (+)-таксифолина, который наряду с конифериловым спиртом является биологическим предшественником большинства флаволигнанов [3, 19, 24], в экстрактах расторопши найдены флавоноиды кверцетин, кемпферол, дигидрокемпферол, апигенин, нарингин, эриодиктиол, хризоэриол [19, 26, 27].
Силибин является одним из самых изученных флавонолигнанов (и полифенолов), подробно исследованы его строение и физико-химические характеристики [3, 14]. В частности, изучена растворимость СБ в воде и ряде органических растворителей. Установлено, что при 25°C растворимость СБ в воде при рН 1.86–5.38 составляет около 12–20 мг/л и возрастает до 55 мг/л при рН 6.15, увеличение температуры также повышает его растворимость [3, 28]. Растворимость СБ в тетрагидрофуране при 25°C составляет не менее 140–150 мг/мл [29].
Известные данные по растворимости СМ в различных растворителях при 25°C представлены в табл. 1 [30].
Таблица 1.
Растворимость силимарина при 25°C [32]
| Растворитель | Раствори- мость, мг/мл |
|---|---|
| Этоксидигликоль (Transcutol®) | 350.1 ± 10.4 |
| Полиэтиленгликоль 200 | 345.9 ± 9.5 |
| Этанол | 225.2 ± 5.4 |
| Пропиленгликоль | 162.4 ± 3.6 |
| Полисорбат 20 | 131.3 ± 6.3 |
| Пропиленкарбонат | 59.1 ± 3.3 |
| Глицерилмоноолеат | 33.2 ± 2.8 |
| Токоферол | 20.0 ± 1.9 |
| Касторовое масло | 7.1 ± 1.2 |
| Этиллинолеат | 2.1 ± 0.8 |
| Рыбий жир | 0.5 ± 0.2 |
| Вода | 0.4 ± 0.1 |
На основе экстрактов плодов расторопши пятнистой, СМ и СБ разработан широкий спектр отечественных и зарубежных лекарственных препаратов, но особое место занимает препарат Legalon®, производимый фармацевтической компанией Rottapharm/Madaus. Его часто используют как препарат сравнения в экспериментах in vivo, in vitro и клинических исследованиях [31].
Препараты СМ/СБ отличаются безопасностью и хорошей переносимостью, что подтверждено в исследованиях при их длительном применении как у животных, так и у людей [32, 33].
Так как СБ является основным и наиболее активным компонентом СМ-комплекса, фармакокинетические параметры СМ приводятся в пересчете на СБ. При применении внутрь СМ (СБ) характеризуется низкой (20–50%) и медленной абсорбцией: Cmax достигается через 4–6 ч, T1/2 составляет 1–3 ч для СМ и 6–8 ч для его метаболитов. В результате отмечается низкая биoдоступность СБ: в опыте на крысах при пероральном применении она составила лишь 0.73% [34].
Предложен ряд подходов по увеличению биодоступности СМ/СБ [1, 4, 35–38]. Однако наиболее перспективным подходом для повышения эффективности препаратов СМ/СБ является разработка нано- и микроформ.
2. БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ СИЛИМАРИНА И СИЛИБИНА
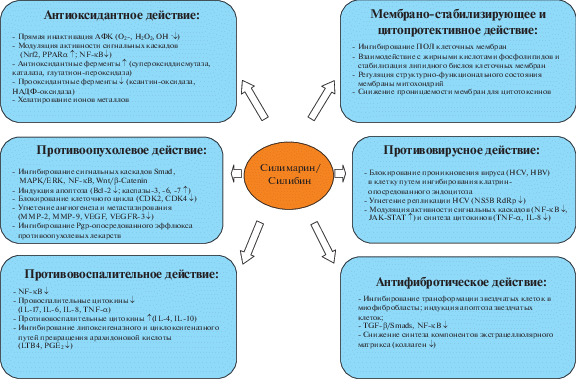
Литературные данные доказывают присутствие у СМ и СБ широкого спектра биологических эффектов: гепатопротекторного, противовирусного, противоопухолевого и других [2, 31, 39–41]. СБ известен, в первую очередь, гепатопротекторной активностью, которая реализуется за счет антиоксидантного, мембраностабилизирующего, противовоспалительного, антитоксического, антифибротического и регенеративного действия. На рис. 2 представлены молекулярные механизмы действия СМ/СБ [39].
Силибин проявляет антиоксидантное действие несколькими путями: за счет собственной антирадикальной активности; за счет регуляции экспрессии генов, контролирующих ферментативные анти- и прооксидантные системы, а также путем хелатирования ионов металлов. Собственная антирадикальная активность СБ обусловлена полифенольной структурой с наличием гидроксилов в молекуле, благодаря чему СБ взаимодействует с активными формами кислорода, такими как супероксид анион-радикал, пероксид водорода, гидроксил радикал, а также с перекисями липидов и тем самым ингибирует процессы перекисного окисления липидов, разрушения клеточных мембран, окислительного повреждения белков и ДНК [42]. СБ влияет на внутриклеточные редокс-чувствительные сигнальные каскады и их мишени (факторы транскрипции Nrf2, PPARα, NF-κB), через которые происходит регуляция экспрессии генов ферментов: повышается активность антиоксидантных ферментов (супероксиддисмутазы, каталазы, глутатионредуктазы), ингибируется активность прооксидантных ферментатов (ксантиноксидазы, НАДФН-оксидазы) [42–44]. СБ оказывает регуляторное влияние на полиферментные системы мембран митохондрий, уменьшая генерацию свободных радикалов в цепи электронного транспорта [42]. CБ способен к комплексообразованию с ионами металлов, в частности с ионами железа (Fe2+), участвующими в радикальных процессах [43]. Кроме того, СБ обладает мембраностабилизирующей активностью – проникая в гидрофобную область мембран, он взаимодействует с жирными кислотами, снижает подвижность липидов и в итоге повышает их устойчивость к радикалообразованию [45].
СБ ингибирует прогрессирование воспалительных процессов в печени за счет снижения уровня провоспалительных цитокинов (TNF-α, IL-17, IL-6, IL-8) и повышения уровня противовоспалительных цитокинов (IL-4 и IL-10) [46, 47]. Молекулярным механизмом действия СБ является ингибирование активности транскрипционного фактора NF-κВ, регулирующего экспрессию генов, ответственных за формирование воспалительного ответа [48, 49]. СБ за счет супрессии фосфорилирования и деградации IκBα подавляет активацию и транслокацию NF-κB в ядро. СБ ингибирует липоксигеназный и циклоoксигеназный пути превращения арахидоновой кислоты, приводя к снижению уровня лейкотриена B4 и простагландина Е2 [50].
СМ и СБ обладают антитоксическим действием в отношении широкого ряда гепатотоксинов: четыреххлористого углерода (CCl4), D-галактозамина, этанола, микотоксинов, бактериальных токсинов, ионов тяжелых металлов, некоторых лекарственных препаратов (цитостатиков, антибиотиков, парацетамола) [47, 51, 52]. Антитоксическое действие реализуется за счет антиоксидантного, мембраностабилизирующего и противовоспалительного эффектов. СБ снижает уровень токсичных метаболитов, образующихся при биотрансформации токсинов за счет снижения активности цитохрома Р450 и увеличения активности ферментов II фазы метаболизма, в частности глюкуронилтрансферазы [53]. Выявлено антитоксическое действие СБ в отношении аманитотоксина, токсина бледной поганки (Amanita phalloides), подтвержденное в клинических исследованиях. Показано, что СБ препятствует проникновению в гепатоциты токсина путем конкурентного связывания с рецепторами и ингибирования мембранных транспортных систем, в частности семейства полипептидов транспортеров органических анионов (OATP) [52, 54].
СБ обладает регенеративным действием – стимулирует активность ДНК-зависимой РНК-полимеразы I, повышает синтез рРНК, рибосом, ДНК и белка [55]. Данный эффект связан с тем, что СБ имеет структурное сходство с эстрогенами и может конкурировать за места связывания с соответствующим рецептором, оказывая эстрогеноподобное действие, в том числе усиливая синтез белков [56]. Регенеративное действие СБ выявлено в гепатоцитах при гепатэктомии и токсических повреждениях [53, 55].
Антифибротическое действие СБ проявляется в его способности к ингибированию ключевых элементов в развитии фиброза: снижению степени активации звездчатых клеток печени и подавлению процесса накопления внеклеточного матрикса. Исследования на животных моделях с CCl4-индуцированным фиброзом печени показали, что СБ способен ингибировать процесс трансформации звездчатых клеток в миофибро-бласты, индуцировать их апоптоз, а также подавлять фиброгенез посредством снижения экспрессии генов, ответственных за синтез компонентов экстрацеллюлярного матрикса, в том числе коллагена [51]. Антифибротическое действие СБ реализуется за счет ингибирования сигнальных путей TGF-β/Smads и NF-κB, снижения уровня экспрессии провоспалительных цитокинов и хемокинов (IL-8, MCP-1), а также антиоксидантной активности [48, 49, 51]. В клинических исследованиях при терапии СБ выявлены снижение степени фиброза и стеатоза печени, улучшение показателей липидного метаболизма и биохимических показателей, в частности снижение уровня АСТ и АЛТ [44, 57, 58].
Показано, что СМ/СБ проявляет противовирусную активность в отношении вирусов гепатита C и B (HCV, HВV), гриппа, вируса иммунодефицита человека [41, 58–60]. Так, в экспериментах in vitro были продемонстрированы блокирование силибином проникновения HCV в клетку и угнетение репликации вируса [58]. На клеточной линии гепатоцитов HepG2-NTCP-C4 силибин ингибировал проникновение HBV в клетки путем блокирования клатрин-опосредованного эндоцитоза вирусных частиц [59]. Под воздействием СБ в инфицированных HCV клетках усиливаются противовоспалительные и антиоксидантные механизмы – активируется сигнальный каскад JAK-STAT, ингибируется активность транскрипционного фактора NF-κВ, снижается уровень TNF-α, IL-8 [61]. СБ оказывает прямое противовирусное действие, влияя на РНК-зависимую РНК-полимеразу HCV (NS5B RdRp) [58]. В клинических испытаниях на пациентах с HCV применение Legalon® SIL приводило к подавлению виремии [62].
Выявлена противоопухолевая активность СМ и СБ в отношении рака простаты, молочной железы, легкого, шейки матки, толстой кишки и других видов рака [40, 63–69]. Продемонстрирована способность СБ воздействовать на разные стадии канцерогенеза, в том числе на регуляцию клеточного цикла, апоптоз, ангиогенез и метастазирование. СБ блокирует молекулярные каскады, запускаемые факторами роста (TGF-β и EGF), в частности сигнальные пути Smad и MAPK/ERK [49, 64]. СБ ингибирует сигнальные каскады NF-κВ и Wnt/β-Catenin [65]. Показано, что СБ блокирует клеточный цикл в фазах G1, S и G2 за счет индукции активности белков-ингибиторов циклин-зависимых киназ p21/Cip1 и p27/Kip1 и угнетения активности циклин-зависимых киназ CDK2 и CDK4 [66]. СБ вызывает апоптоз по р53-зависимому механизму посредством ингибирования антиапоптотического белка Bcl-2, высвобождения цитрохрома C из митохондрий в цитоплазму, активации каспазы-3, -6, -7 [67]. В экспериментах in vivo на модели рака молочной железы MDA-MB-468 показано, что СБ угнетает опухолевый ангиогенез за счет ингибирования синтеза матриксных металлопротеиназ MMP-2 и ММР-9, а также снижения уровня секреции сосудистого эндотелиального фактора роста (VEGF) и уменьшения уровня экспрессии рецептора VEGF (VEGFR-3) [68]. Антиметастатический эффект СБ обусловлен вовлечением сигнальных механизмов Wnt/β-Catenin, JNK/AP-1/MMP-2, EGFR/LOX [68, 70]. Показано, что СБ является ингибитором мембранных белков-транспортеров, ассоциированных с множественной лекарственной устойчивостью, в частности P-gp, и усиливает накопление противоопухолевых препаратов в клетках [71]. СБ проявляет синергизм при совместном использовании с цисплатином и доксорубицином в отношении опухолевых клеток молочной железы и простаты [72, 73].
3. ОСНОВНЫЕ НАПРАВЛЕНИЯ В РАЗРАБОТКЕ НАНО- И МИКРОФОРМ СИЛИМАРИНА И СИЛИБИНА
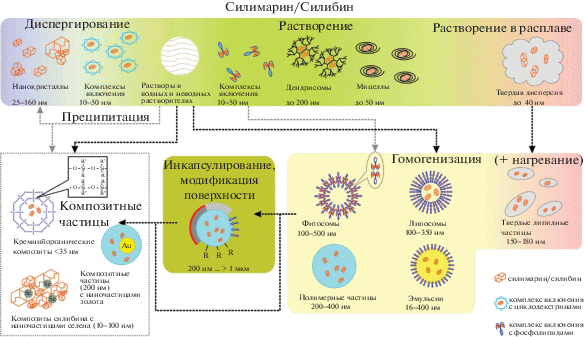
Основные пути получения нано- и микроформ СБ и последовательность формирования сложных по составу композиций представлены на рис. 3. Размеры объектов на этом рисунке отражают наилучшие результаты. Получение микро- и наноформ СБ начинается с его диспергирования (растворения).
Диспергирование проводится путем механического измельчения СБ в одну или несколько стадий. Измельчение может проводиться как в сухом виде, так и в водной среде (в том числе с добавлением поверхностно-активного вещества, ПАВ). В результате получаются микронные или субмикронные кристаллические частицы СБ [74], комплексы включения с циклодекстринами [75]. Готовый продукт (при влажном диспергировании) может подвергаться сушке с образованием лиофилизата либо частиц микронного размера (распылительная сушка) [76], содержащих более мелкие частицы СБ в объеме вещества-носителя.
Существует промежуточный между диспергированием и растворением вариант, когда СБ частично растворяется в среде, в которой затем происходит его механическое диспергирование.
Растворение СБ проводится гораздо чаще, чем его непосредственное диспергирование. СБ может быть растворен в подходящем органическом растворителе [77] или буферном растворе. Далее растворы СБ используются для получения комплексов включения (циклодекстрины, фосфолипиды) [75, 78], включения СБ в полости дендримеров [79], формирования мицелл [80], либо выделения СБ в нанокристаллической форме методом преципитации [81]. В случае использования водных растворов обязательным условием является изменение значения величины рН растворов в ходе получения готового продукта. Повышение рН необходимо для растворения СБ, а понижение – для обеспечения его включения в образуемые комплексы или поры неорганических структур [82].
Растворение СБ в расплаве полиэтиленгликоля (ПЭГ) после охлаждения расплава позволяет получить твердую дисперсию СБ, содержащую наносилибин (около 40 нм). Образование твердой дисперсии связано со значительным изменением растворимости СБ при повышении температуры от комнатной (при которой получают большинство растворов СБ) до температуры расплава ПЭГ-6000 (около 60°C). Последующее охлаждение приводит к кристаллизации СБ из расплава [83].
Препарат Legalon® SIL [5] получают путем химической модификации СБ янтарной кислотой (этерификация). Динатриевая соль полученного эфира (силибина дигемисукцинат) выпускается в виде порошка для приготовления инфузионных растворов. Порошок представляет собой комплексную соль СБ, размеры частиц порошка находятся в микронном диапазоне. С помощью химической модификации с образованием продуктов присоединения СБ получают и его наноформы, например, модифицируя силибином поверхность углеродных нанотрубок [84] и графена [85].
Для получения наноформ СБ из неводных растворов в большинстве случаев прибегают к гомогенизации, представляющей собой частный случай диспергирования, применяемый в отношении смеси жидких фаз. Условно можно выделить две задачи, решаемые с помощью гомогенизации. Во-первых, получение однородной по составу тонкой эмульсии из грубой – это происходит при получении эмульсий неводных растворов СБ в водной среде. В результате получают собственно эмульсии неводных растворов СБ и дисперсии в виде полимерных частиц с СБ (после удаления из эмульсий органического растворителя). Твердые липидные частицы получают эмульгированием расплавов, содержащих СБ в горячей водной фазе (“горячая” гомогенизация) [86]. Во-вторых, гомогенизация обеспечивает получение более однородной по фракционному составу дисперсной наносистемы. Данный подход применяется при получении липосом и фитосом несколькими методами: гидратация бислоя с последующей экструзией через пористую пластину, осаждение липидной пленки на удаляемом носителе, выпаривание в обращенной фазе [87–90]. Полученные таким образом липосомы могут подвергать дополнительной гомогенизации [91].
Помимо основных технологических приемов получения наноформ СБ могут быть применены вспомогательные операции – инкапсулирование и химическая модификация поверхности частиц, которые применяются для придания полученным частицам особых свойств. Целью обычно является управление высвобождением или создание транспортных систем для одной или нескольких активных субстанций [6, 85, 92, 93].
Композитные частицы, содержащие СБ, можно выделить в отдельную группу объектов. Способы их получения обычно предполагают предварительное растворение СБ в подходящем растворителе. После удаления растворителя СБ может быть включен в полимерные частицы сложного состава, металлoорганические структуры, нанотрубки адсорбцией или осаждением СБ из растворов в порах носителя при изменении рН среды (частный случай преципитации). Отличительным признаком композитов является их гетерогенность: объект представляет собой матрицу, содержащую включения. СБ (СМ) может быть распределен в объеме матрицы (полимерной), которая содержит металлические наночастицы золота, серебра, оксида железа и т.п. [94–96], либо сам может выступать в качестве матрицы [97]. В первом случае размер частиц, как правило, не превышает сотен нанометров, во втором – может доходить до единиц микрометров. Композиты с использованием высокопористых неорганических носителей, содержащие нанокристаллы комплексы СБ или ковалентно связанный СБ по своей структуре напоминают конструкционные композиты. Варьированием условий получения матрицы можно управлять размером образуемых частиц [98]. В зависимости от используемых носителей размеры получаемых объектов колеблются от десятков нанометров [82, 85, 99] до единиц микрометров [93, 100]. Свойства композитных структур позволяют управлять высвобождением включенного в них СБ под действием рН окружающей среды или другого внешнего воздействия.
Помимо размеров важными характеристиками для всех препаратов СБ являются содержание активного вещества в частицах (лекарственная нагрузка – Drug loading, DL) и эффективность включения (Entrapment efficiency, ЕЕ). Второй из показателей отражает количество активного вещества, включенного в состав частиц, по отношению к исходно взятому. В табл. 2 приведены основные характеристики некоторых нано- и микроформ СМ/СБ, описанных в обзоре [99, 100].
Таблица 2.
Основные характеристики некоторых нано- и микроформ силимарина и силибина
| Компоненты | Метод получения | Размер частиц, нм | ЕЕ, % | DL, % | Биологическая активность композиции | Дополнительные сведения | Литера-тура |
|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Нанокристаллы | |||||||
| Силибин Полоксамер 188 (0.1%) |
Гомогенизация под высоким давлением | 637 ± 9.4 | Повышение гепатопротекторной активности in vivo на модели CCl4-гепатита у собак при парентеральном введении | Увеличение растворимости силибина не менее чем в 2 раза | [101, 102] | ||
| Силибин Лецитин (0.2%) |
Гомогенизация под высоким давлением | 132 ± 4.8 | Повышение гепатопротекторной активности in vivo на модели CCl4-гепатита у собак при пероральном введении | Увеличение растворимости силибина не менее чем в 2 раза | [101, 102] | ||
| Силибин ДСН Маннит |
Гомогенизация под высоким давлением | 482.2 ± 0.95 | Увеличение биодоступности в 4.9 раза (по AUC) in vivo на крысах при пероральном введении | Увеличение растворимости силибина в 4 раза | [103] | ||
| Силибин МетоксиПЭГ-хитозан |
Преципитация | 157.28 ± 3.43 | Повышение биодоступности в 5.5 разa (по AUC) in vivo (кролики) при парентеральном введении | Увеличение растворимости силибина | [104] | ||
| Твердые дисперсии | |||||||
| Силибин ПЭГ 6000 |
Сплавление с последующим быстрым охлаждением | ~1000 | Повышение гепатопротекторной активности in vivo на модели CCl4-гепатита у мышей при пероральном введении | [83] | |||
| Силибин Касторовое масло ПВП; Транскутол НР® Твин 80 |
Получение эмульсии (o/w) с последующей распылительной сушкой | 214.3 ± 1.9 | Повышение гепатопротекторной активности in vivo на модели CCl4-гепатита у крыс при пероральном введении | Увеличение растворимости силибина в 1300 раз | [106] | ||
| Твердые липидные системы | |||||||
| Силибин Compritol 888 ATO Соевый лецитин Полоксамер 188; Вода |
Гомогенизация при комнатной температуре Гомогенизация при нагревании |
170.7 ± 12.4 155.0 ± 12.2 |
87.3 ± 3.1 42.6 ± 1.5 |
2.82 ± 0.10 1.5 ± 0.05 |
Повышение относительной пероральной биодоступности по сравнению с суспензией силимарина | Дзета-потенциалы: –39.1 ± 0.08 мВ; –34.2 ± 1.6 мВ |
[111] |
| Силимарин Precirol ATO-5 Олеиновая кислота Lipoid E 100 (лецитин) Твин 80 |
Гомогенизация под высоким давлением | ~79 | ~88 | 8.32 | Увеличение относительной пероральной биодоступности у собак (бигль) | Дзета-потенциал: –65.3 мВ. Высвобожение силимарина in vitro было не более 25% за 12 ч |
[112] |
| Комплексы включения и дендрисомы | |||||||
| Силибин β-Циклодекстрин |
Совместное измельчение, соосаждение, получение методом удаления растворителя | 30–60 мкм (агломераты более мелких частиц) |
91–99 | Исследования не проводились | Повышение растворимости и скорости растворения силибина (силимарина) | [75] | |
| Силибин PAMAM-G4 дендример с цепями ПЭГ 0.55 и 2.0 кДа |
Комплексообразование в процессе сорастворения в воде с избытком ЛВ | Исследования in vitro выявили, что 2.0 кДа цепочки ПЭГ индуцировали более длительное вре-мя высвобождения по сравнению с 0.5 кДа ПЭГ цепью | Конъюгирование с цепью ПЭГ 2 кДа увеличивало растворимость силибина пятикратно | [79] | |||
| Силибин PAMAM дендримеры генерации G1.5, G2, G2.5, G3 |
Комплексообразование растворением в этаноле с последующим удалением растворителя | 220 | Увеличение пероральной биодоступности до 178% на крысах | Увеличение растворимости и уменьшение времени высво-бождения силибина | [131] | ||
| Силибин Пептидный дендример с аргининовыми группами |
Комплексообразование с соосаждением | 450 | Увеличение проницаемости при трансдермальной доставке на крысах в 3.96 раза. Уровень удержания в коже: 183.25 ± ± 6.96 мкг/см2 | [135] | |||
| Фитосомы | |||||||
| Силибин/ФХ | Получение комплексов силибин+ФХ в растворителе с последующей распылительной сушкой | 100–200 | 97.6 | Повышение относительной биодоступности (по AUC) в 4 раза in vivo на крысах при пероральном введении | ДСК-термограммы подтвердили формирование фитосомального комплекса силибин+ФХ | [123] | |
| Силибин/ФХ | Получение методом удаления растворителя | ~150 (в водной фазе) | Повышение биодоступности in vivo и на здоровых добровольцах при парентеральном введении | [124, 125] | |||
| Липосомы | |||||||
| Силимарин/ФХ/Маннит | Получение пролипосом осаждением липидной пленки на носителе | 196.4 | 92.6 | Повышение относительной биодоступности (по AUC) в 3 раза in vivo на собаках при пероральном введении | Высокая стабильность при хранении в течение 3 мес при 40°C | [87] | |
| Силимарин/ФХ/ХОЛ/ ДЦФ | Метод инжекции этанола | 390 (56–1270) |
94.7 | Повышение гепатопротекторной активности in vivo на модели CCl4-гепатита у мышей при пероральном введении | Высвобождение силибина из липосом 39.7% за 28 дней in vitro | [88] | |
| Силимарин/ФХ/ХОЛ/ СА/Твин 20 | Метод выпаривания в обращенной фазе | ~800 | ~70 | Повышение трансэпителиального (буккального) проникновения in vivo на куриной модели | Разработана лекарственная форма в виде спрея для буккального введения | [89] | |
| Силимарин/ХОЛ/ФХ/ ПЭГ/СГ | Метод гидратации тонкослойной липидной пленки | 145–168 | ~60 | Повышенная селективность проникновения векторизированных липосом в клетки линии HepG2 in vitro | Снижение уровня абсорбции белка на липосомах | [90] | |
| Нано- и микроэмульсии | |||||||
| Силимарин (2% мас.
в эмульсии) Глицерилмоноолеат Labrasol®; HCO-40® Transcutol® |
Эмульгирование (механическое диспергирование, гомогенизация под высоким давлением) | ~1000 (микро-эмульсия) |
Для наружного (накожного) при-менения показано накопление до 0.1% силибина в образце кожи in vitro | Высокая стабильность эмульсии | [139] | ||
| Силибин Labraflac CC Кремофор RH Transcutol (или Labrasol) |
Растворение силибина в неводной фазе при на- гревании. Эмульсия формируется добавлением воды и встряхиванием | 49.6 | 100** | Повышение скорости адсорбции и биодоступности силибина в 3 раза при пероральном способе введения | Простота получения эмульсии | [141] | |
| Силибин Глицерилмоно-каприлат Вода |
Гомогенизация (ультразвук) | 35.8–64.3 | 100** | Повышение биодоступности силибина in vivo на крысах при пероральном введении в 1.6 раза по сравнению с нанокристаллами и в 4 раза по сравнению с порошком субстанции силибина | Высокая стабильность эмульсии (40 дней при 4°С) | [143] | |
| Полимерные частицы | |||||||
| Силимарин; Хитозан Поли-γ-глютаминовая кислота |
Ионотропное гелеобразование | 200–380 ~1200 |
Повышение антимикробной активности in vitro | Увеличение в 7.7 раза растворимости (до 0.75 мг/мл) | [92] | ||
| Силимарин Eudragit RS 100 Eudragit LS ПВС |
Нанопреципитация, эмульгирование с упариванием растворителя | 84.70 | 83.45 | Увеличение гепатозащитного действия in vivo на модели CCl4-гепатита у крыс при оральном введении | Высвобождение си-лимарина in vitro достигало 100% че-рез 12 ч | [146] | |
| Силибин Поли-ε-капролактон ПВС |
Эмульгирование (ультразвук) с упариванием растворителя | 135–425 | 91.0–95.3 | Увеличение гепатопротекторной активности in vivo на модели CCl4-гепатита у крыс и влияния на уровень ферментов при внутривенном введении | Дзета-потенциал: от –31 до –37 мВ. Высвобождение си-либина in vitro и invivo в течение 10 дней |
[147] | |
| Силибин PLGA 85:15 Полиэтилентерефталат |
Термопрессование | 223 | 88 | Повышение пероральной абсор-бции и биодоступности in vivo на мышах с ксенотрансплантантами карциномы яичников человека линии SKOV-3 | Дзета-потенциал: –25 мВ |
[148] | |
| Силибин PLGA 50:50 Плюроник F-127 |
Нанопреципитация | 229.7 | 92.11 | Противодиабетическое действие in vivo на крысах после 28-дневного лечения при внутрибрюшинном введении | Дзета-потенциал: +21 мВ |
[149] | |
| Силибин Хитозан Триполифосфат Трегалоза |
Ионотропное гелеобразование | 263.7 ± 4.1 | 82.94 | Возрастание цитотоксической активности in vitro в отношении клеток рака простаты человека (DU145) | Инкапсулированный в частицы хитозана силибин пока-зал повышенную растворимость по сравнению с силибином | [152] | |
| Силибин PLGA 50:50 Натрия хлорид ПВС |
Эмульгирование (ультразвук) с упариванием растворителя | 202.2 | 96.8 | 5.15 | Гепатопротекторное действие in vivo на модели CCl4-гепатита у крыс при оральном введении | Дзета-потенциал: –4.7 мВ |
[154] |
| Композиты | |||||||
| Силибин Карбоксилированные многослойные углеродные нанотрубки |
Конъюгация силибина с нанотрубками | диаметр
10–25 нм; длина 0.5–2.0 мкм |
~34**** | 35.1 | Эффективное ингибирование пролиферации опухолевых клеток линии HepG2 и A549 in vitro | рН-зависимое выс-вобождение силибина (увеличение высвобождения при повышении рН) | [84] |
| Силибин Пропилоксибензо-илграфен |
Конъюгация алкилированного графена с азидометилсилибином | 100–200*** | Биосовместимость конъюгатов | Содержание активных групп для конъюгирования до 0.8 ммоль/г графена | [85] | ||
| Силибин Al2O3 PAMAM-G3 |
Образование комплексов включения силибина в водной среде | 12 × 84 | Цитотоксичность in vitro практически отсутствует | Время 80% высвобождения – около 70 ч. Содержание силибина 0.17–0.18 ммоль/г | [93] | ||
| Силибин ПЭГ-PLGA (5:50) Коллоидное золото (~2%) |
Эмульгирование с последующим удалением растворителя | 200 20–23 (Au) |
89 | 8.8 | Исследования не проводились | Концентрация силибина 2–56 мкг/мл. Увеличение скорости высвобождения силибина на 75% в течение 5 ч и до 30% в течение 48 ч при облучении ИК-лазером | [94] |
| Силибин Ag |
Синтез наночастиц се-ребра восстановлением нитрата серебра силибином | 15–20 (Ag) | Антиангиогенный эффект in vivo на куриных эмбрионах при введении на хориоаллантоисную оболочку | Концентрация силибина в препарате 25–200 мг/мл | [95] | ||
| Силибин Хитозан Fe2O3 |
Совместная преципитация силимарина и хитозана на частицах Fe2O3 | 18 | 95 | 10 | Исследования не проводились | Увеличение скорости высвобождения при понижении рН | [96] |
| Силибин Частицы из мезопористого стекла |
Включение силибина в водной среде при изменении рН | 120 ± 10 | Противоопухолевая активность in vitro – угнетение пролиферации (MCF-7, MDA-MB-231) | Размер пор 4–10 нм | [158] | ||
| Силибин Ca3(PO4)2 |
Включение силибина в носитель адсорбцией из водно-этанольной среды | 3.54 ± 0.32 мкм | 44.6 ± 1.2 | Увеличение относительной биодоступности (по AUC) в 1.6 раза in vivo (собаки) при пероральном введении | [159] | ||
| Силибин TiO2 PAMAM-G3 |
Образование комплексов включения силибина в водной среде | 8.5 × 57 | Низкая цитотоксичность in vitro | Увеличение времени высвобождения: около 90% за 300 ч. Содержание силибина: 1–5 ммоль/г нанотрубок | [164] | ||
| Силибин Fe3O4 PAMAM-G3 |
Образование комплексов включения сили-бина в водной среде | 151–159 × 282–286 | Противоопухолевая активность in vitro (HEK 293) | Содержание силибина 675–824 мг/г нанотрубок | [167] | ||
4. НАНОКРИСТАЛЛЫ
Наиболее простой и доступный способ получения наноформ СБ – это получение его нанокристаллов, покрытых ПАВ. Диапазон размеров нанокристаллов находится обычно в пределах от 10 до 1000 нм. Получение нанокристаллов СБ осуществляется двумя основными способами: гомогенизацией под высоким давлением [101–103] и преципитацией [104]; в последнем случае возможно получение кристаллов размером менее 100 нм. Гомогенизация и преципитация проводятся в среде с присутствием ПАВ, обеспечивающим стабилизацию получаемой наносуспензии, которая является готовой лекарственной формой [101, 102, 104]. Высушенные нанокристаллы могут быть введены в состав гранулята для получения таблеток [103] и гранул [105].
В [101, 104] СБ диспергировали в водном растворе ПАВ, содержащем 0.2% лецитина и 0.1% полоксамера 188. Полученную суспензию гомогенизировали с помощью погружного гомогенизатора, а затем обрабатывали на гомогенизаторе высокого давления при 800 и 1800 бар. В результате получали две композиции наносуспензии СБ – для перорального и парентерального применения. Размер частиц составил около 127 и 641.8 нм соответственно. Растворимость СБ в виде частиц увеличивалась примерно в 2 раза. В экспериментах in vitrо нанокристаллы показали эффективное проникновение в клетки Caco-2. Было выявлено увеличение биодоступности in vivo на собаках. Также нанокристаллы СБ индуцировали апоптоз в клетках рака предстательной железы линии РС-3 in vitro. В [102] нанокристаллы СБ получали по аналогичной технологии, за исключением дополнительного добавления гидроксипропилметилцеллюлозы в водный раствор ПАВ. Размеры частиц составили около 132 нм для перорального применения и около 637 нм – для парентерального. Полученные нанокристаллы были исследованы на гепатопротекторную активность на модели CCl4-индуцированного гепатита in vivo на собаках и показали высокую эффективность, в том числе снижение активности трансаминаз в сыворотке крови.
В [103] нанокристаллы получали методом гомогенизации высокого давления с варьированием вида стабилизатора и его концентрации, а также комбинаций стабилизаторов. Частицы характеризовались размерами от 400 до 1000 нм. Биодоступность наносуспензии СБ с использованием 0.1% додецилсульфата натрия (ДСН) в качестве ПАВ на крысах увеличивалась в 4.9 раза по сравнению с субстанцией СБ. На основе наносуспензии была получена лекарственная форма в виде таблетки.
Очевидным недостатком нанокристаллов, применяемых в виде наносуспензий, является десорбция ПАВ с поверхности частиц при восстановлении суспензии после длительного хранения в высушенном виде, в связи с чем некоторые работы направлены на совершенствование покрытия нанокристаллических частиц СБ. В [104] описано получение нанокристаллов методом преципитации с использованием метокси-ПЭГ-хитозана в качестве стабилизатора. СБ диспергировали в растворе этанола, который затем вводили в раствор метокси-ПЭГ-хитозана, добавляли сшивающий линкер сополимер метокси-ПЭГ-ПКЛ (поликапролактон) и подвергали ультразвуковой гомогенизации. Полученные нанокристаллы демонстрировали более высокую стабильность по сравнению с нанокристаллами, метод получения которых не включал в себя добавления сшивающего линкера. Было показано увеличение биодоступности на кроликах в 2 и 5.5 раза по сравнению с нанокристаллами без сшивающего линкера и субстанцией СБ соответственно.
5. ТВЕРДЫЕ ДИСПЕРСИИ
Близкими к нанокристаллическим формам СБ являются образованные им твердые дисперсии. Для СБ (СМ) известны способы получения твердых дисперсий как с удалением летучего растворителя, так и путем сплавления компонентов дисперсии. В первом случае в качестве вещества-носителя использовался поливинилпирролидон, растворителя – этанол, а полученная композиция наносилась на поверхность сахарных пеллет в псевдоожиженном слое [76]. Исходный размер частиц использованного СМ не превышал 5 мкм, а размер полученных пеллет – 1 мм. Отмечалось резкое повышение скорости растворения полученных образцов. Во втором случае проводилось сплавление СБ с ПЭГ-6000 с последующим быстрым охлаждением системы [83]. Целью получения твердых дисперсий было повышение растворимости СБ, что подтверждалось опытами in vitro с использованием сред, содержащих ПАВ для имитации процессов растворения образцов при приеме внутрь.
Одним из наиболее технологичных вариантов является получение твердой дисперсии методом распылительной сушки. В [106] описано получение твердой дисперсии из предварительно полученной эмульсии, содержащей СМ, касторовое масло, поливинилпирролидон, Транскутол НР®, Твин 80 при массовом соотношении 5:3:3:1.25:1.25. Было достигнуто повышение растворимости СМ в 1300 раз по сравнению с субстанцией. Размер частиц эмульсии ~170 нм. После распылительной сушки получалась твердая дисперсия наночастиц размером ~210 нм. Твердые дисперсии СБ демонстрировали более высокую по сравнению с СБ гепатопротекторную актиность на модели гепатита, индуцированного CCl4 у грызунов [83, 106].
6. ТВЕРДЫЕ ЛИПИДНЫЕ СИСТЕМЫ
В области разработки коллоидных систем доставки лекарственных веществ (ЛВ) на основе липидов [107] выделяют направления исследований по твердым липидным наночастицам (Solid-Lipid Nanoparticles, SLNs, SLN) [108] и наноструктурированным липидным носителям (Nanostructured Lipid Carriers, NLCs, NLC) [109]. Композиции с NLCs в отличие от SLNs содержат жидкие липиды, что улучшает некоторые свойства систем доставки ЛВ, NLCs относят ко второму поколению липидных частиц. Среди большого количества липидов [110] при получении лекарственных форм используются: жирные кислоты (стеариновая, пальмитиновая), триглицериды (трилаурин-, тристеарин-, тримиристин-), моноглицериды (бегенат), сложные эфиры (цетилпальмитат) [108].
В [111] c использованием методов холодной и горячей гомогенизации были получены два вида липидных препаратов с СБ: “холодные” SLNs и “горячие” SLNs. Типичный препарат (дисперсия в воде) состоял из СМ, Compritol 888 ATO, соевого лецитина, полоксамера 188 и дважды дистиллированной воды. Полученные препараты “холодные” SLNs и “горячие” SLNs с СБ имели соответственно следующие характеристики: средний размер частиц 170.7 и 155.0 нм; индекс полидисперсности 0.34 и 0.24; ζ-потенциал –39.1 и –34.2 мВ; ЕЕ 87.3 и 42.6%; DL 2.82 и 1.5%; количество ЛВ, адсорбированное на поверхности SLNs, 7.6 и 54.3%. При хранении обоих препаратов при 4°C в течение месяца изменений в размере частиц не наблюдалось. Суммарное высвобождение СМ из “горячих” и “холодных” SLNs в течение 2 ч составляло 31.5 и 23.5% соответственно. Скорость высвобождения СМ из “горячих” SLNs была выше, чем из “холодных” SLNs. В течение 36 ч было высвобождено 72% от общего количества СМ для “горячих” SLNs и 54% для “холодных” SLNs. Относительная биодоступность “холодных” SLNs была в 2.79 раза выше по сравнению с суспензией СБ.
В [112] проведено получение серии наноструктурированных липидных носителей на основе бинарных липидов, нагруженных силимарином (SM-NLCs), с использованием метода гомогенизации под высоким давлением. В качестве твердого липида использовался дистеарат глицерина (Precirol ATO-5), жидкого – олеиновая кислота. Эмульгаторами выступали лецитин (Lipoid E 100) и Твин 80. Полученные в оптимальных условиях SM-NLCs имели сферическую форму со средним размером частиц ~79 нм, величина ЕЕ составляла ~88%, величина DL – 8.32% и ζ-потенциал – ‒65.3 мВ. Высвобождение из SM-NLCs in vitro при 37°C в воде проходило медленно – через 12 ч вышло не более 25% СМ, тогда как липолиз in vitro показал быстрое расщепление липидных носителей в течение 1 ч. Относительная пероральная биодоступность SM-NLCs у собак была в 2.54 и 3.10 раза выше, чем у таблетированной формы препарата Legalon® и твердой дисперсии СМ соответственно.
7. КОМПЛЕКСЫ ВКЛЮЧЕНИЯ
Одним из подходов, с помощью которого возможно повысить растворимость в воде и биологическую доступность СБ, является комплексообразование. В молекуле носителя, с которым образуется комплекс, имеется гидрофобная полость или полости, где обеспечиваeтся микроокружение для неполярных молекул включаемого ЛВ соответствующего размера и, таким образом, образуется комплекс включения. Комплексы включения с СБ в виде отдельных частиц могут образовывать циклодекстрины, фосфолипиды, аминосахара (в том числе хитозан), дендримеры и некоторые другие вещества. Известны четыре основных метода получения комплексов включения: простое физическое смешивание, совместное диспергирование, соосаждение и испарение растворителя (лиофилизация).
Циклодекстрины (ЦД) при использовании в качестве носителей ЛВ способны повысить их растворимость, стабильность и биодоступность [113, 114]. Эффективные гидродинамические радиусы составляют 0.67, 0.77 и 0.85 нм для α-, β- и γ-ЦД соответственно [115]. После образования комплекса включения ЛВ с ЦД происходят изменения морфологии частиц ЦД. Частицы β-ЦД образуют кластеры [116–118], и тенденция к агломерации увеличивается со временем комплексообразования [117]. В результате агрегации размер частиц может увеличиваться до микронных размеров.
Комплексы включения силимарина с β-ЦД, описанные в [75], полученные с использованием различных методов (совместное диспергирование, соосаждение), показали повышение растворимости, а также гепатопротекторной активности. Определение фазовой растворимости показало образование молярного комплекса силибина с β-ЦД 1:1. Полученные как совместным диспергированием, так и соосаждением системы демонстрировали однородность, что указывает на образование комплексов включения. Отмечается склонность полученных комплексов к агломерации: сухие образцы представляли собой агломераты размером 30–60 мкм из более мелких частиц.
В [119] методом лиофилизации получен комплекс СБ с 2-гидроксипропил-β-циклодекстрином (ГП-β-ЦД). Был выполнен комплекс физико-химических исследований на молекулярном уровне и подтверждено комплексообразование силибинина с ГП-β-ЦД. Наблюдалось увеличение растворимости СБ в 10–100 раз при комплексообразовании с ГП-β-ЦД по сравнению с чистым СБ, а также быстрое и более чем 50% его растворение из лиофилизированного продукта при рН 2.0–6.8 и 37°C.
В [120] описаны комплексы включения СМ c водорастворимыми ГП-β-ЦД и метилированным β-ЦД, полученные методом совместного диспергирования. Было показано, что СМ имеет более высокую растворимость в комплексах по сравнению с физическими смесями с β-ЦД.
8. ЛИПОСОМЫ И ФИТОСОМЫ
Липосомы представляют собой сферические частицы, ограниченные одним или несколькими липидными бислоями. СБ встраивается в гидрофобную часть фосфолипидного бислоя мембраны липосом, образованную жирнокислотными хвостами молекул фосфолипидов. Для получения липосом с СМ или СБ используют следующие основные методы и их комбинации: метод гидратации липидной пленки; группа методов, основанных на смене растворителя (метод инжекции растворителя, метод выпаривания в обращенной фазе); группа методов получения однослойных липосом из многослойных (экструзия, метод ультразвуковой обработки, метод гомогенизациии/микрофлюидизации) и их сочетания. Кроме того, липосомы получают из пролипосом – композиций, которые в водной фазе самопроизвольно образуют липосомы [87].
В [88] описано получение однослойных липосом методом инжекции этанола. В их состав кроме СМ входили липидные компоненты – L-α-фосфатидилхолин (ФХ) и холестерин (ХОЛ), а также дицетилфосфат (ДЦФ) в качестве индуктора отрицательного заряда. Показатель ЕЕ, равный 94.7%, достигался в случае композиции состава СМ:ФХ:ХОЛ:ДЦФ при соотношении 2: :10:2:1. Средний размер частиц составил ~390 нм. На модели CCl4-индуцированного гепатита у мышей показано, что липосомы обладали большим гепатопротекторным эффектом (55.6%) в сравнении со свободным СМ (33.08%).
В [89] описаны подходы к получению гибридных липосом с включением СМ методом выпаривания в обращенной фазе. В качестве органической фазы использовали хлороформ. Липидный состав липосом подбирался так, чтобы обеспечить максимальный показатель ЕЕ силимарина при оптимальных характеристиках его высвобождения. Введение в липосомы индуктора положительного заряда стеариламина (СА) при молярном соотношении ФХ:ХОЛ:СА, равном 9:1:1, повышало ЕЕ препарата. Присутствие в составе Твин 20 с (соотношение ФХ:ХОЛ:СА:Твин 20 – 9:1:1:0.5) приводило к увеличению эффективности включения препарата, что достигалось путем образования отдельных везикулярных структур на основе ХОЛ и Твин 20 с дополнительным включением СМ и формированием так называемых гибридных липосом. Средний размер таких липосом 800 нм, а показатель ЕЕ ~70%. На основе липосом разработана лекарственная форма для буккального введения в виде спрея, показавшая более высокое по сравнению с СБ трансэпителиальное проникновение на куриной модели.
В [87] предложены способы получения пролипосом с СМ путем осаждения липидной пленки на носителе, в качестве которого использовали порошок маннита, при выпаривании из органической фазы (смесь метанол–хлороформ), в которой растворяли и СМ, и фосфолипиды. Для таких пролипосом показатель ЕЕ был равен 92.6%, содержание СМ – 9.73%, средний размер частиц – 196.4 нм. Отмечалась достаточно быстрая кинетика высвобождения СМ из суспензии пролипосом: и в кислой среде (рН 1.2), и в PBS (pH 6.8), полное растворение СМ проходило за 20 мин. Пролипосомы характеризовались высокой стабильностью при хранении в течение трех месяцев при 40°С. При пероральном введении собакам выявлено повышение относительной биодоступности пролипосом по сравнению с СМ (показатель AUC0-∞ был равен 2606.21 и 697 нг⋅мл-1⋅ч соответственно) за счет повышения растворимости и снижения метаболической деградации.
В [90] описан дизайн пэгилированных липосом, функционализированных лигандом для направленной доставки к гепатоцитам. В качестве лиганда использован β-ситостерол-β-D-глюкозид (СГ), который специфически связывается с асиалогликопротеиновыми рецепторами гепатоцитов и подвергается рецептор-опосредованному эндоцитозу. Липосомы получали методом гидратации тонкослойной липидной пленки. Показатель ЕЕ силимарина достигал 60%, а средний размер частиц – 145–168 нм. Липосомы показали высокую стабильность при хранении в течение двух месяцев при 4°С. Выявлено уменьшение степени абсорбции альбумина в 3.7 раза по сравнению с непэгилированными липосомами, что свидетельствует о формировании стерического барьера, препятствующего процессу опсонизации (“стелс-эффект”, stealth-effect) и позволяющего им избежать захвата клетками ретикуло-эндотелиальной системы, что удлиняет период циркуляции липосом в кровотоке. ПЭГ-СГ-липосомы демонстрировали замедление высвобождения СМ (на 20–30%) в сравнении с непэгилированными липосомами в системе in vitro. Введение лиганда в липосомы способствовало увеличению в 3 раза уровня накопления в клетках гепатобластомы человека линии HepG2, что свидетельствует о повышении селективности доставки.
Отдельным направлением являются фитосомы, состоящие из комплексов фосфолипида и СБ. В отличие от липосом, в которых СБ встраивается в гидрофобную часть фосфолипидного бислоя мембраны, в фитосоме образуется комплекс между СБ и гидрофильной головкой фосфолипида [121]. В комплексе молекулы связаны не ковалентно, а при участии водородных связей и ван-дер-ваальсовых взаимодействий. В водных средах фитосомы группируются в мицеллы [122].
Известно несколько способов получения фитосом на основе СБ, различающихся в основном по составу органической фазы, мольному соотношению СБ:фосфолипид и способу высушивания комплекса. Так, в [123] фитосомы получали путем растворения СБ и ФХ (1:1) в тетрагидрофуране, затем раствор комплекса подвергали распылительной сушке и последующему досушиванию порошка под вакуумом. Показатель ЕЕ составил 97.65%, а размер фитосом – 100–200 нм. Исследование фармакокинетики при пероральном введении крысам показало повышение относительной биодоступности СБ в составе фитосом в 4 раза по сравнению с раствором СБ. Показатель AUC0–∞ для фитосом составил 1020.33 нг⋅мл–1⋅ч, а для раствора СБ – 235.81 нг⋅мл–1⋅ч.
В [124] получены СБ-фосфолипидные комплексы с содержанием силибина 49.73% (мас./мас.). Было показано, что СБ и фосфолипиды в комплексе связаны нековалентно. СБ-фосфолипидный комплекс показал увеличение биодоступности после перорального применения у крыс. Комплекс СБ и фосфатидилхолина IdB 1016 показал на животных моделях высокую пероральную биодоступность и фармакологическую активность по сравнению с СБ и СМ [125]. Изучение на добровольцах показало, что IdB 1016 характеризуется повышением пероральной биодоступности СБ, что связано с улучшением проникновения через слизистую оболочку ЖКТ.
Фитосомы на основе СБ существуют как коммерческие препараты (SiliphosТМ, SilipideТМ), показавшие свою эффективность на пациентах с заболеваниями печени [126, 127]. Так, на пациентах с хроническими вирусными гепатитами B и C было показано, что прием препарата SilipideТМ в дозировке 120 мг приводил к снижению уровня малонового диальдегида в сыворотке крови на 36%, а также к статистически значимому снижению уровня трансаминаз – АСТ на 17%, АЛТ на 16%.
В [91, 128] фитосомы получали выпариванием растворителя и гидратацией тонких пленок с дополнительной обработкой ультразвуком. Оптимальные характеристики частиц составили: размер – ~133 нм, индекс полидисперсности – 0.34 ± 0.08, величина ЕЕ – ~97%, содержание СБ – 12.2 ± 0.3%. Препарат оставался стабильным после испытания на замораживание–оттаивание. Фитосомный комплекс заметно повышал биодоступность СБ у собак [129].
В [130] описано получение комплексных липосом на основе фитосом с СБ (SiliphosТМ). Такие фитолипосомы получали методом выпаривания в обращенной фазе с последующей ультразвуковой обработкой дисперсии. В качестве органической фазы использован диэтиловый эфир, в котором растворяли фосфолипиды (смесь фосфолипидов из ФХ, фосфатидилэтаноламина, фосфатидилинозитола, фосфатидная кислота) и вносили туда фитосомы SiliphosТМ. Размер фитолипосом составил 165–400 нм. В исследовании in vitro показано интенсивное проникновение фитолипосом в клетки гепатомы человека линии Huh7.5.
9. ДЕНДРИСОМЫ
Дендримеры, представляющие собой разветвленные полимерные макромолекулы, могут образовывать конъюгаты и комплексы с ЛВ и активно использоваться в качестве нанотранспортных систем доставки. Так как дендримеры имеют полости в структуре, они способны образовывать комплексы включения с ЛВ и могут содержать большее количество включенного вещества. По сравнению с прочими комплексами включения частицы, образованные дендримерами (дендрисомы), имеют обычно большие размеры.
В [131] исследовано влияние полиамидоаминовых (PAMAM) дендримеров различных поколений (этилендиаминовое ядро; генерации G1.5, G2.5 с COOCH3-концевыми группами и генерации G2, G3 с NH2-концевыми группами) на растворимость СБ. Были изучены высвобождение лекарства in vitro и фармакокинетика СБ-дендримерного комплекса. Изучение растворимости показало, что при 37°C PAMAM-дендримеры поколений G1.5, G2, G2.5 и G3 с различными концентрациями при разных значениях pH улучшают растворимость СБ. Она повышалась практически линейно с увеличением концентрации дендримера, что может быть связано с возрастанием количества поверхностных аминов и внутренних полостей, которые могут улучшить взаимодействие с молекулами СБ или инкапсуляцию. Прочность и стабильность дендримерных комплексов PAMAM-G2-NH2 и РАМАМ-G3-NH2 с силибином были изучены в модели высвобождения in vitro в кислой среде (рН 1.2), близкой к нейтральной среде (рН 6.8) и деионизованной воде. Исследования показали, что по сравнению с субстанцией СБ высвобождение СБ из комплексов СБ–дендример значительно медленнее. При этом чем ниже значения pH, тем быстрее происходило высвобождение СБ. Таким образом, различия в скорости высвобождения СБ в различных средах могут быть комбинацией изменения растворимости СБ и структуры РАМАМ-дендримера при различных значениях рН среды. Следовательно, электростатическое взаимодействие играет важную роль в реализации контролируемого высвобождения СБ из комплекса с PAMAM-дендримером.
ПЭГилирование систем доставки, в том числе дендримеров, способствует увеличению времени удержания ЛВ, улучшает биораспределение, снижает иммуногенность, повышает растворимость и улучшает стабильность лекарства в физиологической среде [132, 133]. В [79] описаны новые способы повышения растворимости СБ с использованием пегилированных полиаминоамидных дендримеров четвертого поколения (PAMAM-G4). СБ-дендримерные комплексы с нативным и пегилированными PAMAM-G4 были получены в водном растворе согласно методике [134]. Установлено образование комплексов СБ со сложной стехиометрией типа 20:1, 64:1 и 71:1 с нативным и пегилированным PAMAM-G4 с цепями ПЭГ 0.55 и 2.0 кДа соответственно. Результаты показали, что ковалентное присоединение цепей ПЭГ к PAMAM-G4 увеличило нагрузочную способность этих систем.
В последние годы дендримеры рассматриваются как системы для усиления проникновения лекарств через кожу. В [135] проведена оценка способности пептидных дендримеров улучшать трансдермальную доставку СБ. Полифенолпептидные дендримерные комплексы СБ были получены методом соосаждения [136, 137]. Выявлено образование комплексов между СБ и пептидным дендримером в молярном соотношении 1:1. Установлено, что использование комплекса СБ–пептид–дендример приводило к повышению уровня удержания СБ в коже (183.25 ± 6.96 мкг/см2) по сравнению с пассивной диффузией СБ. Наблюдаемое увеличение удержания в коже СБ в составе комплекса было связано с увеличением скорости его проникновения [136, 138].
10. НАНО- И МИКРОЭМУЛЬСИИ
Возможность введения СБ (СМ) в состав эмульсий довольно ограничена. Были предложены эмульсии для наружного применения, содержащие СБ в неводной фазе. СБ растворяли в моноэфирах жирных кислот, так как он нерастворим в триглицеридах, для повышения стабильности эмульсий в обязательном порядке вводили ПАВ. Полученные эмульсии содержали ~2% СБ, повышение которого приводило к потере эмульсией стабильности. В силу особенностей состава и способа получения эмульсии (механическое диспергирование, гомогенизация под высоким давлением) размер ее частиц не превышал 1000 нм [139]. Использование метода двойных эмульсий (“вода–масло–вода”) позволяет получить частицы меньшего размера (500–600 нм) [140].
Кроме эмульсий, получаемых с использованием оборудования для диспергирования, для СБ (СМ) были получены самоформирующиеся прямые эмульсии, образующиеся при смешении водной и неводной фаз и легком встряхивании [141]. СБ растворяли при нагревании в неводной фазе, представляющей собой смесь триглециридов со средней длиной цепи (Labraflac CC) и ПАВ (Cremofor RH). В качестве дополнительного ПАВ (ко-сурфактанта) использовали Transcutol или Labrasol. Способ был оптимизирован для приготовления сверхнасыщенных (силибином) самоформирующихся эмульсий, для этого неводную фазу смешивали с водой при легком встряхивании. Полученные образцы состояли из частиц, средний размер которых 49.6 нм, ζ-потенциал равен –12.81 ± 0.95 мВ. Эмульсии были стабильны в течение 12 нед. В опыте in vivo на крысах для сверхнасыщенных эмульсий показаны более высокая скорость абсорбции и троекратное повышение биодоступности по сравнению с обычными самоформирующимися эмульсиями при пероральном приеме.
Самоформирующиеся эмульсии как системы хорошо изучены: они обладают высокой стабильностью и биодоступностью при приеме внутрь, но содержание неводной фазы в них невелико, что сильно ограничивает дозу вводимого активного ингредиента [142].
В эмульсиях Пикеринга стабильность достигается адсорбцией на границе раздела фаз частиц твердого вещества. СБ плохо смачивается водой, поэтому может выступать в качестве стабилизатора в эмульсиях Пикеринга. Была получена композиция, содержащая СБ в водной фазе в виде тонкой суспензии, которая обеспечивала стабильность неводной фазы, образующей эмульсию. Частицы СБ имели близкие к микронным размеры [143]. Отмечалось пролонгированное высвобождение СБ (до 80% в течение 6 ч) и значительное (в 2.5 раза и более) повышение биодоступности in vivo при пероральном приеме (крысы) по сравнению с нанокристаллами и порошком субстанции СБ. При этом компоненты стабилизируемой СБ эмульсии обеспечивали повышение его биодоступности.
11. ПОЛИМЕРНЫЕ ЧАСТИЦЫ
Использование биосовместимых полимеров для получения частиц, нагруженных СБ (СМ), является одним из наиболее перспективных путей для повышения их биодоступности и оптимизации биораспределения [4, 35–37, 144, 145]. Наиболее широко представлены композиции СМ/СБ на основе полимеров: Eudragit [146], поли-ε-капролактона [147], сополимеров молочной и гликолевой кислот (PLGA) [148–150], PLGA с альгинатом натрия [151], хитозана [152, 153], хитозана с поли-γ-глютаминовой кислотой [92].
Eudragit. В [146] для формирования наночастиц, нагруженных силимарином, использовалась смесь полимеров Eudragit RS 100 и Eudragit LS 100, применялся метод нанопреципитации с дополнительным эмульгированием и упариванием растворителя. Раствор СМ и смеси полимеров Eudragit (1:1 мас.) в ацетоне добавляли в водный раствор поливинилового спирта (ПВС) при перемешивании. После этого смесь гомогенизировали с помощью погружного гомогенизатора. Ацетон удаляли при комнатной температуре и перемешивании. Оптимальная композиция характеризовалась параметрами: средний размер частиц – 84.70 нм, индекс полидисперсности – 0.38, величина EE – 83.45%, высвобождение около 100% ЛВ через 12 ч в системе in vitro. Исследования in vivo на крысах по результатам биохимического и гистопатологического анализов показали у разработанной композиции больший гепатопротекторный эффект в отношении CCl4-индуцированного гепатита по сравнению с коммерческим препаратом Legalon®. Кроме того, пустые и нагруженные СМ наночастицы не вызывали токсических последствий для здоровья животных при дозе 50 мг/кг массы тела, вводимой в течение шести дней.
Поли-ε-капролактон. Для получения композиций полимерных частиц СБ с использованием поли-ε-капролактона в [147] применялся метод эмульгирования (o/w) с упариванием растворителя. Полученные композиции в зависимости от состава имели средний размер частиц – 135–425 нм; индекс полидисперсности – 0.13–0.35; ζ-потенциал – от минус 31 до минус 37 мВ; EE – 91.0–95.3%. Наночастицы, содержащие СБ, обеспечивали высвобождение препарата как in vitro (pH 7.4, 37°С), так и in vivo в течение 10 дней. Наблюдали увеличение гепатопротекторной активности in vivo на модели CCl4-гепатита у крыс и положительное влияние на уровень активности печеночных трансаминаз при внутривенном введении композиции по сравнению с внутривенно вводимой субстанцией СБ.
PLGA. В [148] представлены результаты получения полимерных частиц из сополимера молочной и гликолевой кислот PLGA (85:15), нагруженных СБ и имеющих монодисперсные размеры. Представленный способ включает в себя использование готовых форм из полиэтилентерефталатных листов, покрытых ПВС. Эффективность включения СБ – 88%, средний диаметр частиц – 223 нм, ζ-потенциал – –25 мВ, индекс полидисперсности – 0.194 ± 0.016.
В [149] при получении PLGA частиц, нагруженных СБ, использовалась методика диффузии органического растворителя в водную фазу (нанопреципитация), содержащую плюроник F-127. В результате получались частицы со средним размером 229.7 нм, индексом полидисперсности 0.124 и ζ-потенциалом +21 мВ. Значение величины EE силибина – 92.11%. Изучалось противодиабетическое действие полимерной композиции in vivo на крысах после 28-дневного лечения при внутрибрюшинном введении. Уровень инсулина в сыворотке крови восстанавливался после повреждения поджелудочной железы, индуцированного стрептозотоцином, от уровня 0.17 ± 0.01 до 0.57 ± 0.11 мкг/л после лечения наночастицами.
В [150] описано получение композиций СБ на основе различных сополимеров молочной и гликолевой кислот (PLGA 50:50, PLGA 75:25, PLGA‑COOH 50:50), а также полимолочной кислоты (PLA) методом нанопреципитации и последующей дополнительной обработкой смеси с помощью погружных механического или ультразвукового гомогенизаторов. Полученные композиции с СБ представляли собой лиофилизаты полимерных частиц. Общее содержание СБ в композициях – 4–11 мас. %, средний размер частиц (после ресуспендирования в воде) – 90–420 нм, ЕЕ силибина – 15–63%; ζ-потенциал – от минус 15 до минус 26 мВ. В экспериментах in vitro на клетках гепатомы человека HepG2 для полимерных композиций СБ было отмечено увеличение гепатопротекторной активности (в 1.5–2 раза) по сравнению с субстанцией СБ.
В [154] методом эмульгирования с последующим удалением летучего растворителя получена композиция СБ, включенного в частицы из PLGA 50:50. Неводная фаза была представлена раствором СБ и PLGA в смеси этилацетата и хлористого метилена; водная – раствором ПВС и хлорида натрия. Были получены частицы, содержащие 5.15 мас. % СБ, средний размер частиц (после ресуспендирования в воде) – 202 нм, ЕЕ силибина – 96.8%, ζ-потенциал – минус 4.7 мВ. В опыте in vivo было показано гепатопротекторное действие полученной композиции.
PLGA/альгинат натрия. В [151] описан подход на основе инкапсулирования в полимерные гидрогелевые матрицы, позволяющий улучшить растворимость и биодоступность СМ. На первом этапе методом одинарной эмульсии с испарением растворителя получали наночастицы PLGA, нагруженные СМ. Затем методом ионотропного гелеобразования с использованием раствора хлорида кальция в качестве жидкости для коагуляции их заключали в pH‑чувствительные микрочастицы гидрогеля на основе альгината натрия. Диаметр PLGA-частиц, нагруженных СМ, составил 266 ± 41 нм, средние геометрические диаметры лиофильновысушенных микрочастиц (альгинат–PLGA) с СМ – 1328–1760 мкм, а высушенных на воздухе – 946–1052 мкм, величина EE в микрочастицах – 71.4–88.7%. Содержание воды в лиофилизированных микрочастицах было больше (10.4–22.1%), чем в микрочастицах, высушенных на воздухе (1.1–4.1%).
Хитозан представляет собой линейный полисахарид, полученный N‑деацетилированием хитина. Это положительно заряженный, биосовместимый, нетоксичный и биоразлагаемый биополимер, перспективный в качестве системы доставки лекарств.
Для получения серии частиц хитозана, нагруженных СБ, в [152] применялся метод ионотропного гелеобразования. В процессе получения полимерных композиций использовались триполифосфат и трегалоза. Для оптимальной композиции показатель ЕЕ был равен ~83%, средний размер частиц ~264 нм, индекс полидисперсности – 0.243, ζ-потенциал ~ +37.4 мВ. Для наночастиц хитозана, нагруженных СБ, показано повышение растворимости по сравнению с субстанцией СБ. Была выявлена более высокая по сравнению с СБ цитотоксическая активность in vitro в отношении клеток рака простаты человека (DU145).
Хитозан/поли-γ-глютаминовая кислота. Исследование [92] посвящено получению наночастиц СМ ионотропным гелеобразованием между аминогруппами (–NH3+) водорастворимого хитозана и карбоксильными группами (–COOH–) γ-полиглютаминовой кислоты. Определялись размеры частиц в суспензиях и лиофилизатах в зависимости от условий получения. Так, в суспензиях размер частиц был ~200–380 нм для растворов с исходной концентрацией СМ 0.5, 0.75 мг/мл и резко увеличивался (примерно до 1200 нм) для раствора 1.0 мг/мл. В случае лиофилизированных частиц их размер был меньше, чем до сушки, и не превышал 450 нм (для раствора с концентрацией СМ 1.0 мг/мл). Изучение растворимости СМ в водной среде в виде полимерных частиц показало ее увеличение в 7.7 разa (до 0.75 мг/мл) по сравнению с суспензией СМ в воде. Антимикробная активность наноинкапсулированного СМ улучшилась по сравнению со свободным СМ.
12. СИЛИБИНСОДЕРЖАЩИЕ КОМПОЗИТЫ
СБ-содержащие композиты можно условно разделить на три подгруппы: композиты с включением металлических и неметаллических частиц; металлoорганические каркасные структуры; пространственные структуры, образованные неметаллами.
Композиты с включением металлических и неметаллических частиц, как правило, представляют собой полимерные композитные частицы, где в полимерной биодеградируемой матрице заключен СБ и наночастицы (золото, оксид железа) [94, 96]. Размеры частиц обычно не превышают 250 нм. Целью получения таких композитов является достижение локального высвобождения или адресного действия. В первом случае результат достигается путем локального облучения ИК-лазером, что приводит к мгновенному высвобождению СБ [94]. Во втором случае наночастицы оксида железа обеспечивают транспорт под действием внешнего магнитного поля, а также являются контрастным агентом для магнитно-резонансной томографии [96].
Описанные выше композиты были получены способами, широко применяемыми для получения органических наночастиц: эмульгирование, инкапсулирование и т.п. Особенностью биополимерных композитов являются свойства матрицы – она биосовместима, биоразлагаема и служит для формирования частицы. Причем для некоторых композитных частиц с СБ дополнительный компонент, формирующий матрицу, может отсутствовать. В случае композитных частиц, содержащих селен, СБ сам образует матрицу, в которой распределены наночастицы селена размером 20–40 нм [97]. При добавлении воды образуется коллоидный раствор частиц селена, стабилизированных СБ.
СМ способен восстанавливать золото и серебро из их соединений с образованием металлических наночастиц. В [155] золотые наночастицы с СМ получали путем восстановления золотохлористоводородной кислоты. Размеры частиц, полученных данным методом, находились в пределах 20–58 нм. Золотые наночастицы с препаратом были эффективны в качестве гепатопротектора, противоопухолевого агента, отмечалась также их антибактериальная активность, в том числе в отношении грамотрицательных бактерий. В качестве гепатопротектора и антифибротического агента частицы способствовали восстановлению печени крыс после окислительного повреждения и защищали от цирроза [156]. В [95] серебряные наночастицы с СМ были синтезированы из нитрата серебра. Средний размер частиц – 15–20 нм. Серебряные частицы с СМ ингибировали опухолевый ангиогенез и оказывали антиоксидантное действие.
Металлoорганические каркасные структуры (metal-organic frameworks, MOF) [100] представляют собой пространственные структуры, образованные ионами металлов, связанными между собой органическими лигандами. Чаще всего это соединения Zr или Fe, но могут использоваться и другие металлы, например Zn. Предложена гепатопротекторная композиция, где СБ включен в состав MOF [98]. Преимуществом данных структур является возможность синтеза биосовместимых каркасов различной протяженности (от десятков нанометров до долей миллиметра), что в свою очередь позволяет варьировать количеством включаемого внутрь каркаса вещества и управлять его высвобождением путем воздействия извне [157].
Пространственные структуры, образованные неметаллами, разнообразны по морфологии и обладают широким набором свойств. В первую очередь это могут быть графеновые композиции, кремнийорганические структуры и нанотрубки. В отличие от нанотрубок кремнийорганические структуры могут формировать глобулярные образования, размер которых сопоставим с мицеллами – около 50 нм [99].
Графеновые композиции СБ получают с использованием оксида графена, к которому посредством линкеров ковалентно присоединяют молекулы субстанции, в том числе СБ. Платформа представляет собой двумерную графеновую структуру (лист, плоскость) с максимальной длиной стороны ~100–200 нм, на поверхности которой находится активная субстанция. Показано, что оксид графена может быть использован как биосовместимая транспортная платформа [85], поскольку полученные графеновые композиции с СБ не обладали выраженной цитотоксичностью.
Неорганические пространственные структуры могут использоваться для транспорта активных субстанций, включая СБ. Примерами являются частицы из мезопористого стекла, размер которых составляет 120 ± 10 нм при размере пор 4–10 нм, и мезопористого оксида кремния с размером частиц 488 нм при размере пор 2.7 нм. По степени пористости такие материалы близки к MOF, но отличаются от них по составу. Получены композиции с СБ, обладающие гепатопротекторными свойствами и противоопухолевой активностью в отношении клеток рака молочной железы [158]. Помимо силикатов в качестве пористых носителей пригодны и другие соединения, в частности фосфат кальция. Получены частицы, содержащие СБ [159] с размером частиц в микронном диапазоне (порядка 3.5 мкм) [158, 160].
Нанотрубчатые структуры обладают рядом преимуществ для капсулирования и доставки ЛВ, в том числе СБ, бладаря их увеличенной способности к адсорбции лекарств и специфическим внутренней и внешней поверхностям, позволяющим включать функциональные фрагменты для модуляции их свойств [74, 160, 161]. Основной способ получения нанотрубок – гидротермальный синтез, позволяющий просто и воспроизводимо получать функционализированные наноструктуры [162, 163].
В [93] алюминиевые нанотрубки (Al2O3NT) были поверхностно конъюгированы с PAMAM-дендримерами третьего поколения (PAMAM-G3) с использованием силанового связующего агента в качестве линкера (PAMAM-Al2O3). СБ включали в PAMAM-Al2O3 путем смешивания диспергированных образцов нанотрубок в метанольном растворе СБ. Высушенный продукт содержал 3.23 мас. % конъюгированного PAMAM и сохранял мезопористую структуру нанотрубок Al2O3. Период высвобождения 80% инкапсулированного СБ составил ~75 ч как в случае нанотрубок, так и функционализированного носителя PAMAM-Al2O3. Это свидетельствует о способности СБ адсорбироваться преимущественно на поверхности нанотрубок Al2O3.
Нанотрубки TiO2 с привитым PAMAM (PAMAM-TiO2) и инкапсулированным СБ синтезировали аналогично описанной выше композиции [164]. Продукт содержал 2.6 мас. % конъюгированного PAMAM. Изучение профиля высвобождения показало, что часть молекул СБ была глубоко инкапсулирована в матрицу дендримера. Период высвобождения 80% препарата, адсорбированного в нанотрубки TiO2, составил 30 ч, тогда как высвобождение из PAMAM-модифицированных нанотрубкок происходило в течение 250 ч. Полученные результаты для композиций с СБ отличаются от известных данных для дендримера PAMAM-G3, время высвобождения других веществ из которого обычно колеблется от 6 до 12 ч [165, 166].
В [167] синтезировали магнитные нанотрубки из оксида железа (Fe3O4NT) с привитыми дендримерами третьего поколения (PAMAM-G3) и инкапсулированным СБ. Так как размеры нанотрубок Fe3O4NT значительно больше, чем средний диаметр PAMAM-G3 (3.6 нм), то проводили функционализацию как на внутренней, так и на внешней поверхности нанотрубкок с использованием силанового связующего агента. Для полученных структур методом просвечивающей электронной микроскопии подтверждена нанотрубчатая морфология, средняя длина структур составила 280, 286 нм, средний диаметр – 151, 159 нм для нанотрубок Fe3O4 и PAMAM-Fe3O4 соответственно. Содержание дендримеров PAMAM-G3 составило 16.8% или 24.3 мкмоль/г. В отличие от нанотрубок Al2O3 смешение диспергированных образцов нанотрубок на основе Fe3O4 проводилось в водном растворе СБ. Кинетические профили адсорбции показали, что инкапсуляция СБ в нанотрубки происходила с низкой скоростью и с уровнем адсорбции 675 мг/г, а в случае PAMAM-Fe3O4 происходило увеличение уровня адсорбции до 825 мг/г. Уровень адсорбции силибинина в PAMAM-Fe3O4 значительно превышал аналогичные показатели для PAMAM-Al2O3 и PAMAM-TiO2, которые имели потенциал загрузки 5–40 мг/г [93, 164]. В исследовании PAMAM-Fe3O4 с инкапсулированным СБ на клеточной линии эмбриональной почки человека 293 (НЕК 293) показана их низкая цитотоксичность, что свидетельствует о биосовместимости данного материала и перспективности его использования в качестве системы доставки аналогично ранее изученным магнитным наночастицам [168, 169].
Однослойные и многослойные углеродные нанотрубки способны обеспечивать замедленное высвобождение СБ из внутренних структур. В [84] СБ конъюгирован с многослойными углеродными нанотрубками диаметром 10–25 нм и длиной дo 2 мкм простым методом без использования сшивающего агента. Высвобождение СБ из наноносителя достигало 96.6 и 43.1% в течение 1000 мин при pH 7.4 и 4.8 соответственно. Углеродные нанотрубки с СБ проявляли повышенную по сравнению с СБ цитотоксическую активность in vitro в отношении клеток гепатоцеллюлярной и легочной карциномы человека.
ЗАКЛЮЧЕНИЕ
Комплекс природных флавонолигнанов (силимарин) и основное действующее вещество (силибин), выделенные из расторопши пятнистой, на протяжении многих лет подтверждают свою высокую клиническую эффективность. Этим объясняется неослабевающий к ним интерес и поиск новых областей применения: от заболеваний печени к противоопухолевым и противовирусным препаратам. Однако прогресс в исследованиях напрямую связан с решением задач по повышению биодоступности силибина (силимарина) и созданию максимальной концентрации препарата в органе-мишени. С учетом физико-химических свойств флаволигнанов наиболее оптимальным вариантом является получение наноструктурированных форм силибина (силимарина), обладающих более высокой растворимостью и биодоступностью по сравнению с субстанцией силибина. Представленные в обзоре технологические приемы получения нано- и микроформ позволяют создавать структуры, различающиеся набором физико-химических характеристик, главным образом размером.
Размер наименьших частиц, полученных методом преципитации и путем химической модификации (конъюгации), не превышал 100 нм. Частицы в основном представлены комплексами включения и химически связанным с носителем силибином (нанотрубки).
Частицы размером 100–300 нм могут быть получены любым из описанных выше способов. Наиболее часто применяются методы диспергирования (эмульгирования). В указанном размерном диапазоне наиболее широко представлены полимерные частицы, твердые липидные частицы, эмульсии, липосомы и нанокомпозиты, частицы из мезопористого стекла.
Частицы, размер которых превышает 300 нм и может достигать 1 мкм и больше, получают преимущественно методами диспергирования, адсорбцией или осаждением силибина из растворов в порах носителя при изменении значения рН среды (частный случай преципитации). В данном диапазоне широко представлены нанокристаллы силибина, твердые липидные частицы, эмульсии (в том числе эмульсии Пикеринга, стабилизированные силибином), металлоорганические структуры и пористые носители на основе фосфата кальция.
Каждая из полученных форм обладает рядом преимуществ, к которым в целом можно отнести повышение растворимости и биодоступности силибина, пролонгированное/контролируемое высвобождение из нано- и микроструктур, адресность действия, повышение стабильности разработанных форм, а также расширение спектра способов введения (пероральное, парентеральное, трансбуккальное, наружное, в том числе трансдермальное). Для многих из полученных нано- и микроформ силибина было выявлено повышение терапевтической активности по сравнению с исходной субстанцией; в то же время продемонстрированы высокие показатели биосовместимости.
Таким образом, разработка нано- и микроформ силимарина и силибина позволила получить композиции с улучшенными физико-химическими характеристиками, биофармацевтическими свойствами и более высокой специфической активностью, в том числе гепатопротекторной, противоопухолевой, противовирусной и антимикробной, что дает основание к расширению терапевтической области применения препаратов данной группы.
Список литературы
Bijak M. // Molecules. 2017. V. 22. № 11. P. 1942. https://doi.org/10.3390/molecules22111942
Federico A., Dallio M., Loguercio C. // Molecules. 2017. V. 22. № 2. P. 191. https://doi.org/10.3390/molecules22020191
Biedermann D., Vavříková E., Cvak L., Křen V. // Nat. Prod. Rep. 2014. V. 31 № 9. P. 1138. https://doi.org/10.1039/C3NP70122K
Di Costanzo A., Angelico R. // Molecules. 2019. V. 24. № 11. P. 2155. https://doi.org/10.3390/molecules24112155
Mengs U., Pohl R.-T., Mitchell T. // Curr. Pharm. Biotechnol. 2012. V. 13. № 10. P. 1964. https://doi.org/10.2174/138920112802273353
Faridi Esfanjani A., Jafari S.M. // Colloids Surf. B. 2016. V. 146. P. 532. https://doi.org/10.1016/j.colsurfb.2016.06.053
George A., Shah P.A., Shrivastav P.S. // Int. J. Pharm. 2019. V. 561. P. 244. https://doi.org/10.1016/j.ijpharm.2019.03.011
Ladas E., Kroll D.J., Kelly K.M. Milk Thistle. In Encyclopedia of Dietary Supplements. 2010. P. 550. https://doi.org/10.1201/b13959.
AbouZid S., Ahmed O.M. // Studies in Natural Products Chemistry. Ch. 14. 2013. V. 40. P. 469. https://doi.org/10.1016/B978-0-444-59603-1.00014-X
Куркин В.А. // Химико-фармацевтический журнал. 2003. Т. 37. № 4. С. 27. https://www.elibrary.ru/item.asp?id=22391014
Куркин В.А., Запесочная Г.Г., Авдеева Е.В. и др. Расторопша пятнистая: монография. Самара: ООО “Офорт”, 2010. 118 с. https://www.elibrary.ru/item.asp?id=23890344
Kroll D.J., Shaw H.S., Oberlies N.H. // Integr. Cancer Ther. 2007. V. 6. № 2. P. 110. https://doi.org/10.1177/1534735407301825
Kvasnička F., Bíba B., Ševčík R. et al. // J. Chrom. A. 2003. V. 990. № 1–2. P. 239. https://doi.org/10.1016/S0021-9673(02)01971-4
Kim N.-C., Graf T.N., Sparacino C.M. et al. // Org. Biomol. Chem. 2003. V. 1. № 10. P. 1684. https://doi.org/10.1039/b300099k
Lee J.I., Narayan M., Barrett J.S. // J. Chrom. B. 2007. V. 845. № 1. P. 95. https://doi.org/10.1016/j.jchromb.2006.07.063
Lee D.Y.-W., Liu Y. // J. Nat. Prod. 2003. V. 66. № 9. P. 1171. https://doi.org/10.1021/np030163b
Napolitano J.G., Lankin D.C., Graf T.N. et al. // J. Org. Chem. 2013. V. 78. № 7. P. 2827. https://doi.org/10.1021/jo302720h
Smith W.A., Lauren D.R., Burgess E.J. et al. // Planta Med. 2005. V. 71. № 9. P. 877. https://doi.org/10.1055/s-2005-864187
Chambers C.S., Holečková V., Petrásková L. et al. // Food Res. Int. 2017. V. 100. P. 339. https://doi.org/10.1016/j.foodres.2017.07.017
Diep T.T., Kiem P., Dong N.T. et al. // J. Chem. 2007. V. 45. № 1. P. 106. http://www.vjs.ac.vn/index.php/vjchem/article/view/4719
2071. Milk thistle dry extract, refined and standardized. European pharmacopoeia. Strasbourg: Council Of Europe: European Directorate for the Quality of Medicines and Healthcare; 2013. http://books.google.com/books?id=dnBI6yjClcEC
Powdered Milk Thistle Extract. USP 38–NF 33. The United States Pharmacopeia and National Formulary 2015 Main edition plus Supplements 1, 2. Stuttgart: Deutscher Apotheker Verlag, 2014. 6153 p.
Nyiredy S., Samu Z., Szucs Z. et al. // J. Chromatogr. Sci. 2008. V. 46. № 2. P. 93. https://doi.org/10.1093/chromsci/46.2.93
AbouZid S.F., Ahmed H.S., Moawad A.S. et al. // Fitoterapia. 2017. V. 119. P. 175. https://doi.org/10.1016/j.fitote.2017.04.002
Křenek K., Marhol P., Peikerová Ž. et al. // Food Res. Int. 2014. V. 65. P. 115. https://doi.org/10.1016/j.foodres.2014.02.001
Csupor D., Csorba A., Hohmann J. // J. Pharm. Biomed. Anal. 2016. V. 130. P. 301. https://doi.org/10.1016/j.jpba.2016.05.034
Abenavoli L., Capasso R., Milic N., Capasso F. // Phytother. Res. 2010. V. 24. № 10. P. 1423. https://doi.org/10.1002/ptr.3207
Bai T-C., Zhu J-J., Hu J. et al. // Fluid Phase Equilibria. 2007. V. 254. № 1–2. P. 204. https://doi.org/10.1016/j.fluid.2007.03.009
Di Fabio G., Romanucci V., Di Marino C. et al. // Planta Med. 2013. V. 79. № 12. P. 1077. https://doi.org/10.1055/s-0032-1328703
Woo J.S., Kim T.-S., Park J.-H., Chi S.-C. // Arch. Pharm. Res. 2007. V. 30. № 1. P. 82. https://doi.org/10.1007/BF02977782
Казюлин А.Н., Шестаков В.А., Гончаренко А.Ю. и др. // Экспериментальная и клиническая гастроэнтерология. 2018. № 7. С. 73. https://www.nogr.org/jour/article/view/956#
Fraschini F., Demartini G., Esposti D. // Clin. Drug Investig. 2002. V. 22. № 1. P. 51. https://doi.org/10.2165/00044011-200222010-00007
Abenavoli L., Izzo A.A., Milić N. et al. // Phytother. Res. 2018. V. 32. № 11. P. 2202. https://doi.org/10.1002/ptr.6171
Wu J.-W., Lin L.-C., Hung S.-C. et al. // J. Pharm. Biomed. Anal. 2007. V. 45. № 4. P. 635. https://doi.org/10.1016/j.jpba.2007.06.026
Javed S., Kohli K., Ali M. // Altern. Med. Rev. 2011. V. 16. № 3. P. 239. PMID https://www.ncbi.nlm.nih.gov/pubmed/21951025.21951025
Wang Y., Zhang L., Wang Q., Zhang D. // J. Biomed. Nanotechnol. 2014. V. 10. № 4. P. 543. https://doi.org/10.1166/jbn.2014.1798
Ahmad U., Faiyazuddin M., Hussain M.T. et al. // Acta Physiol. Plantarum. 2015. V. 37. № 11. Art. 253. https://doi.org/10.1007/s11738-015-2008-3
Piazzini V., D’Ambrosio M., Luceri C. et al. // Molecules. 2019. V. 24. № 9. P. 1688. https://doi.org/10.3390/molecules24091688
Neha, Jaggi A.S., Singh N. // Adv. Exp. Med. Biol. 2016. V. 929. P. 25. https://doi.org/10.1007/978-3-319-41342-6_2
Zhu X.-X., Ding Y.-H., Wu Y. et al. // Expert Rev. Clin. Pharm. 2016. V. 9. № 10. P. 1323. https://doi.org/10.1080/17512433.2016.1208563
Liu C.-H., Jassey A., Hsu H.-Y., Lin L.-T. // Molecules. 2019. V. 24. № 8. P. 1552. https://doi.org/10.3390/molecules24081552
Surai P.F. // Antioxidants (Basel). 2015. V. 4. № 1. P. 204. https://doi.org/10.3390/antiox4010204
Borsari M., Gabbi C., Ghelfi F. et al. // J. Inorgan. Biochem. 2001. V. 85. № 2–3. P. 123. https://doi.org/10.1016/S0162-0134(01)00198-2
Hajaghamohammadi A., Ziaee A., Rafiei R. // Hepatitis Monthly. 2008. V. 8. № 3. P. 191. https://www.sid.ir/en/Journal/ViewPaper.aspx?ID=117740
Куркин В.А., Рыжов В.М., Бирюкова О.В. и др. // Химико-фармацевтический журнал. 2009. Т. 43. № 2. С. 33. https://www.elibrary.ru/item.asp?id=23108233
Esmaeil N., Anaraki S.B., Gharagozloo M., Moayedi B. // Int. Immunopharmacol. 2017. V. 50. P. 194. https://doi.org/10.1016/j.intimp.2017.06.030
Das S.K., Mukherjee S. // Toxicol. Mech. Methods. 2012. V. 22. № 5. P. 409. https://doi.org/10.3109/15376516.2012.673090
Kim E.J., Lee M.Y., Jeon Y.J. // Korean J. Physiol. Pharmacol. 2015. V. 19. № 3. P. 211. https://doi.org/10.4196/kjpp.2015.19.3.211
Polachi N., Bai G., Li T. et al. // Eur. J. Med. Chem. 2016. V. 123. P. 577. https://doi.org/10.1016/j.ejmech.2016.07.070
Dehmlow C., Murawski N., de Groot H. // Life Sci. 1996. V. 58. № 18. P. 1591. https://doi.org/10.1016/0024-3205(96)00134-8
Clichici S., Olteanu D., Nagy A.-L. et al. // J. Med. Food. 2015. V. 18. № 3. P. 290. https://doi.org/10.1089/jmf.2013.0179
Münter K., Mayer D., Faulstich H. // Biochim. Biophys. Acta. Biomembranes. 1986. V. 860. № 1. P. 91. https://doi.org/10.1016/0005-2736(86)90502-X
Valenzuela A., Garrido A. // Biol. Res. 1994. V. 27. № 2. P. 105. PMID: https://pubmed.ncbi.nlm.nih.gov/8640239/.8640239
Trakulsrichai S., Sriapha C., Tongpoo A. et al. // Int. J. Gen. Med. 2017. V. 10. P. 395. https://doi.org/10.2147/IJGM.S141111
Sonnenbichler J., Zetl I. // Prog. Clin. Biol. Res. 1986. V. 213. P. 319. PMID: https://pubmed.ncbi.nlm.nih.gov/2424029/.2424029
Sonnenbichler J., Zetl I. // Prog. Clin. Biol. Res. 1988. V. 280. P. 369. PMID: https://pubmed.ncbi.nlm.nih.gov/3174701/.3174701
Kheong C.W., Mustapha N.R.N., Mahadeva S. // Clin. Gastroenterol. Hepatol. 2017. V. 15. № 12. P. 1940. https://doi.org/10.1016/j.cgh.2017.04.016
Wagoner J., Negash A., Kane O.J. et al. // Hepatology. 2010. V. 51. № 6. P. 1912. https://doi.org/10.1002/hep.23587
Umetsu T., Inoue J., Kogure T. et al. // Biochem. Biophys. Rep. 2018. V. 14. P. 20. https://doi.org/10.1016/j.bbrep.2018.03.003
McClure J., Margineantu D.H., Sweet I.R., Polyak S.J. // Virology. 2014. V. 449. P. 96. https://doi.org/10.1016/j.virol.2013.11.003
Polyak S.J., Morishima C., Shuhart M.C. et al. // Gastroenterology. 2007. V. 132. № 5. P. 1925. https://doi.org/10.1053/j.gastro.2007.02.038
Ferenci P., Scherzer T.-M., Kerschner H. et al. // Gastroenterology. 2008. V. 135. № 5. P. 1561. https://doi.org/10.1053/j.gastro.2008.07.072
Tiwari P., Mishra K.P. // Cancer Res. Front. 2015. V. 1. № 3. P. 303. https://doi.org/10.17980/2015.303
Kim S., Han J., Kim J.S. et al. // Anticancer Res. 2011. V. 31. № 11. P. 3767. PMID: https://pubmed.ncbi.nlm.nih.gov/22110198/.22110198
Lu W., Lin C., King T.D. et al. // Cell. Signall. 2012. V. 24. № 12. P. 2291. https://doi.org/10.1016/j.cellsig.2012.07.009
Mateen S., Tyagi A., Agarwal C. et al. // Mol. Carcinog. 2009. V. 49. № 3. P. 247. https://doi.org/10.1002/mc.20595
Zhang Y., Ge Y., Chen Y. et al. // Cell Biochem. Funct. 2012. V. 30. № 3. P. 243. https://doi.org/10.1002/cbf.1842
Kil W.H., Kim S.M., Lee J.E. et al. // Ann. Surg. Treat. Res. 2014. V. 87. № 4. P. 167. https://doi.org/10.4174/astr.2014.87.4.167
Lin C.-M., Chen Y.-H., Ma H.-P. et al. // J. Agric. Food Chem. 2012. V. 60. № 51. P. 12451. https://doi.org/10.1021/jf300964f
Hou X., Du H., Quan X. et al. // Front. Pharmacol. 2018. V. 9. Art. 21. https://doi.org/10.3389/fphar.2018.00021
Zhang S., Morris M.E. // Pharm. Res. 2003. V. 20. № 8. P. 1184. https://doi.org/10.1023/a:1025044913766
Dhanalakshmi S., Agarwal P., Glode L.M., Agarwal R. // Int. J. Canc. 2003. V. 106. № 5. P. 699. https://doi.org/10.1002/ijc.11299
Tyagi A.K., Agarwal C., Chan D.C.F., Agarwal R. // Oncol. Rep. 2004. V. 11. № 2. P. 493. https://doi.org/10.3892/or.11.2.493
Liu C.-H., Lin C.-C., Hsu W.-C. et al. // Gut. 2017. V. 66. № 10. P. 1853. https://doi.org/10.1136/gutjnl-2016-312019
Ghosh A., Biswas S., Ghosh T. // J. Young Pharm. 2011. V. 3. № 3. P. 205. https://doi.org/10.4103/0975-1483.83759
Sun N., Wei X., Wu B. et al. // Powder Tech. 2008. V. 182. № 1. P. 72. https://doi.org/10.1016/j.powtec.2007.05.029
Zhang Z.-B., Shen Z.-G., Wang J.-X. et al. // Int. J. Pharm. 2009. V. 376. № 1–2. P. 116. https://doi.org/10.1016/j.ijpharm.2009.04.028
Méndez-Sánchez N., Dibildox-Martinez M., Sosa-Noguera J. et al. // BMC Pharmacol. Toxicol. 2019. V. 20. № 1. Art. num. 5. https://doi.org/10.1186/s40360-018-0280-8
Diaz C., Guzmán J., Jiménez V.A., Alderete J.B. // Pharm. Dev. Technol. 2018. V. 23. № 7. P. 689. https://doi.org/10.1080/10837450.2017.1315134
Yu J., Zhu Y., Wang L. et al. // Acta Pharmacol. Sin. 2010. V. 31. № 6. P. 759. https://doi.org/10.1038/aps.2010.55
Cui G.-J., Xu L.-M., Zhou Y. et al. // Chem. Eng. J. 2013. V. 222. P. 512. https://doi.org/10.1016/j.cej.2013.02.101
Nasr S.S., Nasra M.M.A., Hazzah H.A., Abdallah O.Y. // Drug Deliv. Transl. Res. 2019. V. 9. № 5. P. 968. https://doi.org/10.1007/s13346-019-00640-3
Li F.-Q., Hu J.-H. // Chem. Pharm. Bull. (Tokyo). 2004. V. 52. № 8. P. 972. https://doi.org/10.1248/cpb.52.972
Tan J.M., Karthivashan G., Arulselvan P. et al. // J. Nanomaterials. 2014. V. 2014. Art. ID 439873. https://doi.org/10.1155/2014/439873
Neri G., Micale N., Scala A. et al. // FlatChem. 2017. V. 1. P. 34. https://doi.org/10.1016/j.flatc.2016.10.002
Jia L.-J., Zhang D.-R., Li Z.-Y. et al. // Drug Deliv. 2010. V. 17. № 1. P. 11. https://doi.org/10.3109/10717540903431586
Yan-yu X., Yun-mei S., Zhi-peng C., Qin-eng P. // Int. J. Pharm. 2006. V. 319. № 1–2. P. 162. https://doi.org/10.1016/j.ijpharm.2006.03.037
Maheshwari H., Agarwal R., Patil C., Katare O.P. // Arzneimittelforschung. 2011. V. 53. № 6. P. 420. https://doi.org/10.1055/s-0031-1297130
El-Samaligy M.S., Afifi N.N., Mahmoud E.A. // Int. J. Pharm. 2006. V. 308. № 1–2. P. 140. https://doi.org/10.1016/j.ijpharm.2005.11.006
Elmowafy M., Viitala T., Ibrahim H.M. et al. // Eur. J. Pharm. Sci. 2013. V. 50. № 2. P. 161. https://doi.org/10.1016/j.ejps.2013.06.012
Maryana W., Rachmawati H., Mudhakir D. // Mater. Today: Proceedings. 2016. V. 3. № 3. P. 855. https://doi.org/10.1016/j.matpr.2016.02.019
Lee J.-S., Hong D.Y., Kim E.S., Lee H.G. // Colloids Surf. B. 2017. V. 154. P. 171. https://doi.org/10.1016/j.colsurfb.2017.03.004
Campos C.H., Díaz C.F., Guzmán J.L. et al. // Macromol. Chem. Phys. 2016. V. 217. № 15. P. 1712. https://doi.org/10.1002/macp.201600136
Fazio E., Scala A., Grimato S. et al. // J. Mater. Chem. B. 2015. V. 3. № 46. P. 9023. https://doi.org/10.1039/C5TB01076D
Hajbabaei M., Baharara J., Iranbakhsh A., Ramezani T. // Razi J. Med. Sci. 2017. V. 23. № 152. P. 54 [in Arabic]. http://shafaorthoj.com/journalsys/rjms/article-1-4303-en.html
Khalkhali M., Sadighian S.S., Rostamizadeh K. et al. // Nanomed. J. 2015. V. 2. № 3. P. 223. https://doi.org/10.7508/nmj.2015.03.008
Староверов С.А., Дыкман Л.А., Меженный П.В. и др. // Сельскохозяйственная биология. 2017. Т. 52. № 6. С. 1206. https://doi.org/10.15389/agrobiology.2017.6.1206rus
Reineke J., Durymanov M., Permyakova A. Hepatoprotective particles and systems and methods of use thereof. U.S. Pat. Appl. Publ. US 2019/0015335 A1.
Hayashi K., Maruhashi T., Sakamoto W., Yogo T. // Adv. Funct. Mater. 2018. V. 28. № 13. Art. № 1706332. https://doi.org/10.1002/adfm.201870086
Liu Y., Zhao Y., Chen X. // Theranostics. 2019. V. 9. № 11. P. 3122. https://doi.org/10.7150/thno.31918
Wang Y., Zhang D., Liu Z. et al. // Nanotechnology. 2010. V. 21. Art. Id. 155104. https://doi.org/10.1088/0957-4484/21/15/155104
Wang Y., Wang L., Liu Z. et al. // J. Biomed. Nanotechnol. 2012. V. 8. № 5. P. 760. https://doi.org/10.1166/jbn.2012.1444
Xu D., Ni R., Sun W. et al. // Drug Dev. Ind. Pharm. 2015. V. 41. № 4. P. 552. https://doi.org/10.3109/03639045.2014.884123
Liu Y., Wang Y., Zhao J. // Int. J. Biol. Macromol. 2019. V. 124. P. 667. https://doi.org/10.1016/j.ijbiomac.2018.11.258
Luo K., Li X., Yang L. et al. // Chinese Traditional Patent Medicine. 2016. V. 38. № 5. http://en.cnki.com.cn/Article_en/CJFDTotal-ZCYA201605012.htm
Yang K.Y., Hwang D.H., Yousaf A.M. et al. // Int. J. Nanomed. 2013. V. 8. № 1. P. 3333. https://doi.org/10.2147/IJN.S50683
Souto E.B., Müller R.H. Drug Delivery. Handbook of Experimental Pharmacology. Berlin, Heidelberg: Springer, 2010. V. 197. P. 115. https://doi.org/10.1007/978-3-642-00477-3_4
Mehnert W., Mäder K. // Adv. Drug Deliv. Rev. 2012. V. 64 Supl. P. S83. https://doi.org/10.1016/j.addr.2012.09.021
Khan S., Baboota S., Ali J. et al. // Int. J. Pharm. Investig. 2015. V. 5. № 4. P. 182. https://doi.org/10.4103/2230-973X.167661
Fahy E., Subramaniam S., Brown H.A. et al. // J. Lipid Res. 2005. V. 46. № 5. P. 839. https://doi.org/10.1194/jlr.E400004-JLR200
He J., Hou S., Lu W. et al. // J. Biomed. Nanotechnol. 2007. V. 3. № 2. P. 195. https://doi.org/10.1166/jbn.2007.024
Shangguan M., Lu Y., Qi J. et al. // J. Biomater. Appl. 2014. V. 28. № 6. P. 887. https://doi.org/10.1177/0885328213485141
Uekama K., Hirayama F., Irie T. // Chem. Rev. 1998. V. 98. № 5. P. 2045. https://doi.org/10.1021/cr970025p
Arcari M., Brambilla A., Brandt A. et al. // Boll. Chim. Farm. 1992. V. 131. № 5. P. 205. [in Ital.]. PMID: 1445687. https://pubmed.ncbi.nlm.nih.gov/1445687/
Pavlov G.M., Korneeva E.V., Smolina N.A., Schubert U.S. // Eur. Biophys. J. 2010. V. 39. № 3. P. 371. https://doi.org/10.1007/s00249-008-0394-9
Nunes I.L., Mercadante A.Z. // Braz. Arch. Biol. Technol. 2007. V. 50. № 5. P. 893. https://doi.org/10.1590/S1516-89132007000500018
Chun J.-Y., You S.-K., Lee M.-Y. et al. // Int. J. Food Eng. 2012. V. 8. № 2. Art. 17. https://doi.org/10.1515/1556-3758.2590
Hill L.E., Gomes C., Taylor T.M. // LWT – Food Sci. Technol. 2013. V. 51. № 1. P. 86. https://doi.org/10.1016/j.lwt.2012.11.011
Kellici T.F., Ntountaniotis D., Leonis G. et al. // Mol. Pharm. 2015. V. 12. № 3. P. 954. https://doi.org/10.1021/mp5008053
Gharbia S., Balta C., Herman H. et al. // Front. Pharmacol. 2018. V. 9. Art. 883. https://doi.org/10.3389/fphar.2018.00883
Das M.K., Kalita B. // J. Appl. Pharm. Sci. 2014. V. 4. № 10. P. 51. https://doi.org/10.7324/JAPS.2014.401010
Karimi N., Ghanbarzadeh B., Hamishehkar H. et al. // Appl. Food Biotechnol. 2015. V. 2. № 3. P. 17. https://doi.org/10.22037/afb.v2i3.8832
Song Y., Zhuang J., Guo J. et al. // Pharmazie. 2008. V. 63. № 1. P. 35. PMID: https://pubmed.ncbi.nlm.nih.gov/18271301/.18271301
Yanyu X., Yunmei S., Zhipeng C., Qineng P. // Int. J. Pharm. 2006. V. 307. № 1. P. 77. https://doi.org/10.1016/j.ijpharm.2005.10.001
Barzaghi N., Crema F., Gatti G. et al. // Eur. J. Drug Metab. Pharmacokinet. 1990. V. 15. № 4. P. 333. https://doi.org/10.1007/BF03190223
Moscarella S., Giusti A., Marra F. et al. // Curr. Ther. Res. 1993. V. 53. № 1. P. 98. https://doi.org/10.1016/S0011-393X(05)80160-2
Kidd P., Head K. // Altern. Med. Rev. 2005. V. 10. № 3. P. 193. PMID: https://pubmed.ncbi.nlm.nih.gov/16164374/.16164374
Maryana W., Rahma A., Mudhakir D., Rachmawati H. // J. Biomimet. Biomater. Biomed. Eng. 2015. V. 25. P. 54. https://doi.org/10.4028/www.scientific.net/JBBBE.25.54
Filburn C.R., Kettenacker R., Griffin D.W. // J. Vet. Pharmacol. Ther. 2007. V. 30. № 2. P. 132. https://doi.org/10.1111/j.1365-2885.2007.00834.x
Angelico R., Ceglie A., Sacco P. et al. // Int. J. Pharm. 2014. V. 471. № 1–2. P. 173. https://doi.org/10.1016/j.ijpharm.2014.05.026
Huang X., Wu Z., Gao W. et al. // Drug Dev. Ind. Pharm. 2011. V. 37. № 4. P. 419. https://doi.org/10.3109/03639045.2010.518150
Jevprasesphant R., Penny J., Jalal R. et al. // Int. J. Pharm. 2003. V. 252. № 1–2. P. 263. https://doi.org/10.1016/S0378-5173(02)00623-3
Wang W., Xiong W., Wan J. et al. // Nanotechnology. 2009. V. 20. № 10. 105103. https://doi.org/10.1088/0957-4484/20/10/105103
Barraza L.F., Jiménez V.A., Alderete J.B. // Macromol. Chem. Phys. 2016. V. 217. № 4. P. 605. https://doi.org/10.1002/macp.201500342
Shetty P.K., Manikkath J., Tupally K. et al. // AAPS Pharm. Sci. Tech. 2017. V. 18. № 6. P. 2346. https://doi.org/10.1208/s12249-017-0718-0
Devarakonda B., Otto D.P., Judefeind A. et al. // Int. J. Pharm. 2007. V. 345. № 1–2. P. 142. https://doi.org/10.1016/j.ijpharm.2007.05.039
Yao W., Sun K., Mu H. et al. // Drug Dev. Ind. Pharm. 2010. V. 36. № 9. P. 1027. https://doi.org/10.3109/03639041003610799
Sadekar S., Ghandehari H. // Adv. Drug Deliv. Rev. 2012. V. 64. № 6. P. 571. https://doi.org/10.1016/j.addr.2011.09.010
Panapisal V., Charoensri S. Tantituvanont A. // AAPS Pharm. Sci. Tech. 2012. V. 13. № 2. P. 389. https://doi.org/10.1208/s12249-012-9762-y
Abrol S., Trehan A., Katare O.P. // Drug Deliv. 2004. V. 11. № 3. P. 185. https://doi.org/10.1080/10717540490433958
Wei Y., Ye X., Shang X. et al. // Colloid. Surface. Physicochem. Eng. Aspect. 2012. V. 396. P. 22. https://doi.org/10.1016/j.colsurfa.2011.12.025
Singh B., Bandopadhyay S., Kapil R. et al. // Crit. Rev. Ther. Drug Carrier Syst. 2009. V. 26. № 5. P. 427. https://doi.org/10.1615/CritRevTherDrugCarrierSyst.v26.i5.10
Yi T., Liu C., Zhang J. et al. // Eur. J. Pharm. Sci. 2017. V. 96. P. 420. https://doi.org/10.1016/j.ejps.2016.08.047
Alexander A., Ajazuddin, Patel R.J. et al. // J. Control. Release. 2016. V. 241. P. 110. https://doi.org/10.1016/j.jconrel.2016.09.017
Desai P.P., Date A.A., Patravale V.B. // Drug Discov. Today Tech. 2012. V. 9. № 2. P. e87. https://doi.org/10.1016/j.ddtec.2011.12.001
El-Nahas A.E., Allam A.N., Abdelmonsif D.A., El-Kamel A.H. // AAPS Pharm. Sci. Tech. 2017. V. 18. № 8. P. 3076. https://doi.org/10.1208/s12249-017-0799-9
Bonepally C.R., Gandey S.J., Bommineni K. et al. // Trop. J. Pharm. Res. 2013. V. 12. № 1. P. 1. https://doi.org/10.4314/tjpr.v12i1.1
Guan X.-L., Zhao S.-Z., Hou R.-J. et al. // Int. J. Clin. Exp. Med. 2015. V. 8. № 10. P. 17406. PMID. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4694231/.26770331
Das S., Roy P., Pal R. et al. // PloS One. 2014. V. 9. № 7. P. e101818. https://doi.org/10.1371/journal.pone.0101818
Терещенко О.Г., Никольская Е.Д., Жунина О.А. и др. // Изв. PАН. Сер. хим. 2018. № 12. С. 2290. https://www.elibrary.ru/item.asp?id=36818310
El-Sherbiny I.M., Abdel-Mogib M., Dawidar A.-A.M. et al. // Carbohydr. Polymers. 2011. V. 83. № 3. P. 1345. https://doi.org/10.1016/j.carbpol.2010.09.055
Pooja D., Bikkina D.J.B., Kulhari H. et al. // Int. J. Biol. Macromol. 2014. V. 69. P. 267. https://doi.org/10.1016/j.ijbiomac.2014.05.035
Nguyen M.H., Yu H., Dong B., Hadinoto K. // Eur. J. Pharm. Sci. 2016. V. 89. P. 163. https://doi.org/10.1016/j.ejps.2016.04.036
Гукасова Н.В., Кузнецов С.Л., Тубашева И.А. и др. Способ получения полимерсодержащей композиции силибина. Пат. 2716706 (Россия). 2019.
Islan G.A., Das S., Cacicedo M.L. et al. // J. Drug Deliv. Sci. Tech. 2019. V. 53. Art. Num. 101181. https://doi.org/10.1016/j.jddst.2019.101181
Kabir N., Ali H., Ateeq M. et al. // RSC Adv. 2014. V. 4. № 18. P. 9012. https://doi.org/10.1039/C3RA46093B
Cai W., Wang J., Chu C. et al. // Adv. Sci. 2019. V. 6. № 1. Art. num. 1801526. https://doi.org/10.1002/advs.201801526
Nawaz Q., Fuentes M.A., Tharmalingam V. et al. // SSRN El. J. 2019. https://doi.org/10.2139/ssrn.3473993
Zhu Y., Wang M., Zhang Y. et al. // AAPS Pharm. Sci. Tech. 2016. V. 17. № 5. P. 1232. https://doi.org/10.1208/s12249-015-0460-4
Goldberg M., Langer R., Jia X. // J. Biomater. Sci. Polym. Ed. 2007. V. 18. № 3. P. 241. https://doi.org/10.1163/156856207779996931
Li X., Wang L., Fan Y. et al. // J. Nanomater. 2012. V. 2012. Art. ID 548389. https://doi.org/10.1155/2012/548389
Horst M.F., Lassalle V., Ferreira M.L. // Front. Environ. Sci. Eng. 2015. V. 9. № 5. P. 746. https://doi.org/10.1007/s11783-015-0814-x
Keerthana D.S., Namratha K., Byrappa K., Yathirajan H.S. // J. Magn. Magn. Mater. 2015. V. 378. P. 551. https://doi.org/10.1016/j.jmmm.2014.10.176
Torres C.C., Campos C.H., Diáz C. et al. // Mater. Sci. Eng. C. 2016. V. 65. P. 164. https://doi.org/10.1016/j.msec.2016.03.104
Ma M., Cheng Y., Xu Z. et al. // Eur. J. Med. Chem. 2007. V. 42. № 1. P. 93. https://doi.org/10.1016/j.ejmech.2006.07.015
Hui H., Xiao-dong F., Zhong-lin C. // Polymer. 2005. V. 46. № 22. P. 9514. https://doi.org/10.1016/j.polymer.2005.07.034
Chávez G., Campos C.H., Jiménez V.A. et al. // J. Mater. Sci. 2017. V. 52. № 16. P. 9269. https://doi.org/10.1007/s10853-017-1140-4
Xu S., Yin B., Guo J., Wang C. // J. Mater. Chem. B. 2013. V. 1. № 33. P. 4079. https://doi.org/10.1039/c3tb20238k
Efthimiadou E.K., Tapeinos C., Chatzipavlidis A. et al. // Int. J. Pharm. 2014. V. 461. № 1–2. P. 54. https://doi.org/10.1016/j.ijpharm.2013.11.037
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии