Российские нанотехнологии, 2021, T. 16, № 2, стр. 175-194
ТОКСИЧЕСКОЕ ДЕЙСТВИЕ НАНОМАТЕРИАЛОВ НА ОСНОВЕ МЕТАЛЛОВ НА ПРЕДСТАВИТЕЛЕЙ МОРСКИХ ЭКОСИСТЕМ
И. А. Васюкова 1, *, О. В. Захарова 1, В. В. Чайка 2, К. С. Пикула 2, 3, К. С. Голохваст 2, 3, 4, А. А. Гусев 1, 5, 6
1 Тамбовский государственный университет им. Г.Р. Державина
Тамбов, Россия
2 Дальневосточный федеральный университет
Владивосток, Россия
3 Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова
Санкт-Петербург, Россия
4 Тихоокеанский институт географии ДВО РАН
Владивосток, Россия
5 Национальный исследовательский технологический университет “МИСиС”
Москва, Россия
6 Воронежский государственный лесотехнический университет им. Г.Ф. Морозова
Воронеж, Россия
* E-mail: vasyukovaia@gmail.com
Поступила в редакцию 16.11.2020
После доработки 20.01.2021
Принята к публикации 16.02.2021
Аннотация
Представлены результаты многочисленных исследований последних лет, направленных на оценку токсичности наночастиц (НЧ) металлов и их оксидов, включая Ag, Au, Cu и CuO, нульвалентное железо, TiO2, ZnO, по отношению к морским организмам с учетом размерных эффектов и физико-химических свойств НЧ. Имеющиеся данные показывают, что металлические НЧ могут негативно влиять на организмы таких систематических групп, как водоросли, бактерии, моллюски, черви, членистоногие, иглокожие, хордовые и др. Токсические эффекты варьируются от нарушений репродукции до летального исхода. Данные о влиянии НЧ на морских позвоночных (например, морских рыб) носят единичный характер. Факторами, влияющими на токсичность НЧ в водной среде, являются физико-химические свойства самих НЧ, видовые особенности тест-объекта, а также параметры водной среды (в том числе соленость, температура, pH), однако точные закономерности, связывающие указанные факторы и токсичность НЧ, до конца не выяснены. В частности, нет однозначного мнения о характере влияния солености водной среды на токсичность НЧ в ней. К предполагаемым механизмам нанотоксичности относят окислительный стресс, нарушение целостности клеточной мембраны, воспалительные процессы, приводящие к дисфункции клеток, а также повреждение ДНК и генетические мутации. Имеющиеся данные указывают на высокий потенциал биоаккумуляции НЧ в морских пищевых цепях, поскольку они могут легко сохраняться внутри организмов. Отсутствие стандартизированной методологии обнаружения металлических и металлооксидных НЧ и недостаточно разработанное законодательство затрудняют проведение экотоксикологической оценки нанозагрязнений морских экосистем. Все это подтверждает необходимость проведения дальнейших исследований безопасности НЧ металлов по отношению к морским организмам, особенно представителям подтипа Позвоночные, оценки отдаленных эффектов, связанных с переходом и биоаккумуляцией НЧ в пищевых цепях морских экосистем, а также унификации используемых при этом научно-методических подходов. Важными задачами будущих исследований являются уточнение роли факторов среды в усилении или ослаблении токсичности НЧ и определение механизмов нанотоксичности.
ОГЛАВЛЕНИЕ
Введение
1. Области применения металлических и металлооксидных НЧ как потенциальные источники их поступления в водные экосистемы
2. Влияние металлических и металлооксидных НЧ на биологические объекты морских экосистем
3. Механизмы токсического действия металлических и металлооксидных НЧ
Заключение
ВВЕДЕНИЕ
В последние годы наночастицам (НЧ) уделяется большое внимание из-за их уникальных физических, химических, биологических свойств и потенциального воздействия на различные природные экосистемы и человека [1].
Металлические НЧ и их оксиды – это искусственные наноматериалы, широко используемые в различных технологических процессах, создании косметических средств, пищевой промышленности и фармакологии. Эта группа наноматериалов является наиболее разнообразной по количеству типов. Поскольку области применения НЧ быстро расширяются, ожидается, что их глобальная рыночная стоимость вскоре достигнет 30 млрд. долларов США [2], а объемы производства – более 350 000 тонн/год [3]. При этом не менее 80% производимых НЧ представляют собой нанопорошки оксидов металлов. В связи с широким использованием промышленной нанопродукции возрастают масштабы воздействия искусственных НЧ на обитателей водной среды как в результате производственных процессов, так и прямого захоронения или сброса отходов наноиндустрии. В итоге растет концентрация металлических частиц [4, 5], в том числе в наноформе, в морской воде, попадая в океан напрямую или через речные системы [6].
Основными источниками попадания металлических и металлоoксидных НЧ в водные экосистемы являются (рис. 1):
Рис. 1.
Потенциальные источники попадания, возможные механизмы трансформации в условиях морских экосистем и основные объекты воздействия металлических НЧ.

– использование продуктов, содержащих НЧ (композитные материалы при судостроении и строительстве околоводных объектов, составы для обработки бортов водных судов против обрастания биопленкой, антикоррозийные покрытия погружных металлических конструкций и др.) и применение морских нанобиотехнологий для синтеза НЧ [7–10];
– в составе сточных вод после технологических и бытовых процессов;
– использование НЧ непосредственно для очистки сточных вод от поллютантов [11].
НЧ достаточно быстро агрегируют в водных средах, в том числе морской воде, однако даже небольшое количество поверхностно-активных веществ способно существенно увеличить время нахождения данных объектов в наноформе [12–14]. Также в водной среде благодаря высокой реакционной способности, наноразмеру, большой площади поверхности и сильной адсорбционной способности возможны взаимодействия между НЧ и другими поллютантами, такими как тяжелые металлы [15, 16] и органические загрязнители [15, 17]. Кроме того, наличие веществ, загрязняющих водную среду, может влиять на трансформацию НЧ металлов и кинетику их переноса, изменяя тем самым уровень их токсичности [18]. Присутствие дополнительных загрязнителей изменяет биодоступность металлических НЧ за счет гетероагрегации, агломерации, сорбции и/или комплексообразования [19]. Немаловажными факторами выступают pH и химический состав воды, а также температура и освещенность [20].
Потенциальными путями проникновения НЧ в организмы обитателей водной среды могут быть контакт или проглатывание фитопланктоном/зоопланктоном, накопление в донных отложениях и поглощение бентосными организмами с последующим переходом по пищевым цепям вплоть до более крупных позвоночных [21–23] либо прямое попадание внутрь с пищей; также возможно проникновение через эпителиальные барьеры, такие как жабры, обонятельные органы или стенка тела (рис. 1) [24, 25]. Токсические эффекты, вызываемые металлическими НЧ, могут иметь как общий характер [26], так и органо- и тканеспецифические особенности [21, 27–29]. На токсичность НЧ может влиять разнообразие физико-химических свойств, таких как размер, форма, покрытие и химический состав [28]. Особую настороженность вызывает попадание НЧ в морские экосистемы, поскольку pH, ионная сила и растворимость в водной среде определяют размер, скорость агрегации НЧ, а также генерацию ионов из металлических НЧ, что также может влиять на их токсичность [30–34].
В связи с различной соленостью, кислотностью, температурой и освещенностью, а также наличием специфических примесей, поведение металлических НЧ в морской среде отличается от поведения в пресноводных средах, а степень токсичности для пресноводных организмов не может быть экстраполирована на морские организмы [35, 36]. Исследований влияния металлических НЧ на морские организмы немного, а имеющиеся работы довольно сильно разнятся как методически, так и в плане получаемых результатов.
1. ОБЛАСТИ ПРИМЕНЕНИЯ МЕТАЛЛИЧЕСКИХ И МЕТАЛЛООКСИДНЫХ НЧ КАК ПОТЕНЦИАЛЬНЫЕ ИСТОЧНИКИ ИХ ПОСТУПЛЕНИЯ В ВОДНЫЕ ЭКОСИСТЕМЫ
Быстрое развите нанотехнологий привело к активному использованию искусственных металлических и металлооксидных НЧ в производимых товарах [37]. Исследования показывают, что в общей сложности на мировом рынке продается более 1800 коммерческих продуктов, содержащих НЧ, использование которых становится источником загрязнения НЧ окружающей среды [38]. Увеличение использования наноматериалов влечет за собой рост выбросов НЧ в окружающую среду, их накопление (табл. 1) и воздействие на экосистемы [39]. Незначительное количество металлических НЧ всегда присутствовало в природных экосистемах [40], однако аккумуляция и трансформация искусственных НЧ могут представлять потенциальную опасность для водных экосистем, в том числе микроорганизмов, растений и животных.
Таблица 1.
Прогнозируемые концентрации в окружающей среде производимых и используемых НЧ в различных водных системах [45]
Некоторую озабоченность вызывают разработки для диагностики и лечения патогенов рыб на основе металлсодержащих НЧ. В настоящее время активно разрабатываются антимикробные препараты на основе НЧ CuO, ZnO и Ag для борьбы с антибиотикорезистентными бактериями в аквакультуре [41–43], есть данные о создании наноструктурных систем для специфического обнаружения патогенов рыб [44].
НЧ металлов. Широко производимыми и применяемыми признаны НЧ серебра. Они входят в состав потребительских товаров, а также применяются в сельскохозяйственных целях из-за их высокой бактерицидной, фунгицидной и противовирусной активности широкого спектра действия [50]. НЧ Ag используются при производстве текстиля, средств для стирки, бытовой техники, систем очистки воды, красок, средств личной гигиены, контейнеров для хранения продуктов, а также в качестве пищевых добавок [51]. Отдельно можно выделить высокий потенциал их использования в медицине, ветеринарии и гигиене благодаря ярко выраженным антибактериальным [52, 53], противовирусным [54] и противогрибковым [55, 56] свойствам. НЧ Ag все чаще используются в качестве добавок в покрытиях медицинского инструментария и инвентаря, а также при создании перевязочных материалов и фармпрепаратов [57–60].
Область применения НЧ золота также достаточно обширна благодаря их особым характеристикам – высокому коэффициенту поглощения рентгеновских лучей, простоте синтетических манипуляций, позволяющих точно контролировать физико-химические свойства частиц [61], сильному сродству к тиолам, дисульфидам и аминам, уникальным настраиваемым оптическим [62] и хорошим электронным свойствам [63]. В составе различных нанокомпозитных материалов, включая биметаллические НЧ, нанокомпозиты оксид металла–золото и полимер–золото, антитело–золото используются в области создания биосенсоров [64] и электрохимических сенсоров малых молекул, сенсоров ДНК и иммуносенсоров [65, 66]. Регулируемые оптические и химические свойства НЧ Au в зависимости от их формы и размера позволяют использовать их для зондирования, визуализации [67], доставки лекарств [62, 68], биомедицинской терапии [69], нелинейной оптики, фотовольтаики и областей катализа [70]. Подобно НЧ Ag они также используются в качестве антибиотических, противогрибковых и антимикробных добавок в пластмассы, покрытия, нановолокна и текстиль [45].
Перспективным направлением для НЧ меди является биомедицина, поскольку медь – важный микроэлемент, необходимый в качестве кофактора для нормального функционирования различных метаболических ферментов [71]. Это свойство можно использовать для синтеза противоопухолевых препаратов, которые вызывают гибель опухолевых/больных клеток путем изменения внутриклеточного уровня ионов меди, а за счет наноразмеров достигается высокая биодоступность [72, 73]. НЧ Cu также обладают антибактериальными, противогрибковыми и противовоспалительными свойствами, что делает их подходящим кандидатом для создания устойчивых к микробам медицинских устройств, мазей и повязок [74, 75].
В последние несколько десятилетий нульвалентное железо в наномасштабе (nZVI, nanoscale zero-valent iron) стало одним из наиболее интенсивно изучаемых материалов для очистки окружающей среды. Свежеприготовленное nZVI обладает высокой реакционной способностью из-за большой удельной поверхности и сильных восстановительных свойств, а также способности адсорбировать ряд важных загрязнителей, таких как тяжелые металлы и металлоиды [14].
Большинство исследований сосредоточено на тестировании nZVI в качестве агента для очистки сточных вод [76, 77] и восстановлении загрязненной почвы и грунтовых вод путем прямой доставки стабилизированного nZVI в загрязненные недра [77–79].
Еще одним направлением применения в обозримом будущем может стать использование nZVI в медицине и фармацевтике в качестве катализатора для разложения фармацевтических препаратов, присутствующих в различных водных матрицах, поскольку оно может выделять растворенные частицы железа, активировать молекулярный кислород и реагировать с окислителями. Кроме того, благодаря небольшому размеру частиц и большой площади поверхности nZVI может обеспечить лучшие результаты деструкции по сравнению с традиционными процессами [80].
Предполагается возможность использования nZVI при производстве биогаза (например, H2S, NH3 и CH4), добавление nZVI во время анаэробного сбраживания помогает снизить содержание H2S в биогазе и увеличить производство метана [81–83].
НЧ оксидов и сульфидов металлов. НЧ диоксида титана (TiO2) представляют собой один из наиболее часто применяемых наноматериалов, ожидаемое годовое производство которых к 2025 г. может достичь 2.5 миллионов тонн [84]. Используются НЧ TiO2 в основном в качестве пигмента за счет высокого показателя преломления, яркости и устойчивости к обесцвечиванию. Почти 70% всех производимых НЧ TiO2 используется в качестве пигментов в красках, глазури, эмалях, пластмассах, бумаге, волокнах, пищевых продуктах. Существенная доля произведенных НЧ TiO2 находит применение в косметике и фармацевтических продуктах, включая зубные пасты, солнцезащитные средства, шампуни, дезодоранты и кремы для бритья, а также в качестве пищевых добавок [85]. Кроме того, НЧ TiO2 применяются в качестве антимикробного агента и катализатора для очистки воздуха и воды. Среднее количество НЧ TiO2 в средствах личной гигиены составляет 1–10% от общего состава, достигая максимальных значений в обычных солнцезащитных кремах и даже в продуктах, предназначенных для детей, таких как сладости, конфеты или жевательные резинки [86]. Попадание НЧ TiO2 в воду может оказать пагубное влияние на общее состояние экосистем, особенно с учетом того, что их концентрации могут быть достаточно велики.
Следующим металлооксидным наноматериалом для ряда применений после TiO2 являются НЧ ZnO, широко использующиесяся в производстве пигментов, полупроводников, резиновых солнечных элементов, химических волокон, солнцезащитных средств, пищевых добавок [87–89]. Потенциальным направлением является создание добавок на основе ZnO в краски, препятствующих образованию биопленок на бортах морских судов за счет их высокой антибактериальной активности даже против антибиотикоустойчивых бактерий [90, 91]. Предполагаемым направлением является использование НЧ ZnO для очистки сточных вод, образующихся в результате расширения текстильной, кожевенной, бумажной и чернильной промышленности [89]. Несмотря на широкие перспективы, НЧ ZnO обладают высоким риском загрязнения воды, могут достигать высоких концентраций в поверхностных водах, представляющих значительную угрозу для водных экосистем [18], а также токсичны для клеток животных и человека даже в очень низких дозировках [92, 93].
НЧ CuO особенно привлекательны из-за высокого природного содержания меди и ее низкой стоимости, из-за практичных и простых способов получения наноматериалов на основе меди. Cu является 3d-переходным металлом и обладает некоторыми интересными физическими и химическими свойствами [94]. Материалы на его основе могут вступать в различные реакции из-за широкого диапазона доступных степеней окисления Cu, обеспечивающих реактивность через одно- и двухэлектронные пути [95]. Отличительными характеристиками НЧ CuO являются высокая электрохимическая активность и стабильность в суспензиях. Благодаря своим уникальным характеристикам и свойствам нанокатализаторы на основе меди нашли множество применений в нанотехнологиях, включая каталитические органические превращения, электрокатализ и фотокатализ [96–100]. На основе НЧ CuO создаются биосенсоры [101–103] и иммуносенсоры [104, 105], разрабатываются составы, препятствующие обрастанию биопленкой различных объектов [106, 107].
НЧ CdS и ZnS обладают хорошей электропроводностью, большой удельной поверхностью и способностью к фотокатализу в видимом свете, что позволяет им выступать катализаторами в гибридных микробно-фотоэлектрохимических процессах [108, 109] или фотосенсибилизаторами в металлооксидных электродах для улучшения их эффективности при фотоэлектрохимическом производстве водорода из воды [110].
2. ВЛИЯНИЕ МЕТАЛЛИЧЕСКИХ И МЕТАЛЛООКСИДНЫХ НЧ НА БИОЛОГИЧЕСКИЕ ОБЪЕКТЫ МОРСКИХ ЭКОСИСТЕМ
Эколого-биологические эффекты НЧ TiO2. Несмотря на активное использование НЧ TiO2 при производстве косметической продукции, достаточно большое количество работ указывает на негативные последствия их влияния на представителей морских экосистем. Имеются экспериментальные данные, что НЧ TiO2 непосредственно или в форме агрегатов в водных средах могут вызывать иммунотоксическое, нейротоксическое и генотоксическое действие, а также поведенческие и физиологические изменения при концентрациях, значительно меньших, чем его микроразмерный аналог [15].
Для оценки влияния НЧ TiO2 на морские диатомовые водоросли были проведены эксперименты на Phaeodactylum tricornutum. Поскольку НЧ TiO2 являются фотоактивными, их токсичность сравнивали в отношении тест-объектов при двух режимах освещенности – естественное освещение и с добавлением ближнего ультрафиолета (УФ-А). В работе использовали НЧ размером 38 ± ± 12 нм, экспонировали водоросли в течение 6, 24, 48 и 72 ч с концентрацией 0–400 мг/л TiO2. Результаты показали, что НЧ TiO2 вызывают генерацию активных форм кислорода (АФК), что приводит к повреждению клеточной мембраны. Также при УФ-А отмечался рост токсического действия на клетки, значения полумаксимальной эффективной концентрации (EC50) снижались с 132.0 ± 7.0 мг/л при воздействии видимого света до 1.98 ± 0.09 мг/л при воздействии УФ-А [111]. В [112] исследовали биологические эффекты НЧ TiO2 на морских микроводорослях Isochrysis galbana. Кинетику агрегации НЧ TiO2 в различных условиях исследовали, чтобы определить и понять эти эффекты. Результаты показали, что, хотя нет очевидного влияния НЧ TiO2 на размер и воспроизводимость клеток водорослей в условиях испытаний, они отрицательно влияли на хлорофилл водорослей, что приводило к снижению фотосинтеза. В другом исследовании оценивалось комбинированное воздействие НЧ TiO2 и фосфора на микроводоросль Chlorella ellipsoides. В результате оптическая плотность, хлорофилл уровня а и b, общий хлорофилл и антиоксидантная активность ферментов были значительно изменены под воздействием комбинированных соединений, в то время как биомасса значительно снизилась. Наблюдалось увеличение малонового диальдегида (MDA) со снижением супероксиддисмутазы (SOD) и глутатион-S-трансферазы (GST) в микроводорослях. Следовательно, смесь обоих соединений может быть вредной для микроводорослей [113]. В [114] провели изучение влияния различных концентраций (0.1, 1, 10, 50, 100 мг/л) НЧ TiO2 на водоросли Microcystis aeruginosa. НЧ TiO2 значительно снижали максимальную фотохимическую эффективность фотосистемы II (H2O-пластохиноноксидоредуктаза – функциональный комплекс электрон-транспортной цепи хлоропластов) и таким образом ингибировали фотосинтетическую активность M. aeruginosa. Они также увеличили содержание АФК и MDA, что указывает на окислительное повреждение водорослей. Кроме того, НЧ TiO2 в высоких концентрациях (50 и 100 мг/л) агрегируют на поверхности водорослей и блокируют свет, в данном случае ингибируют рост водорослей (16.03 и 54.13%), но индуцируют продукцию (25.02 и 114.43%) и высвобождение (20.96 и 12.10%) микроцистинов.
В то же время в [115] показано отсутствие замедления скорости роста популяций представителей морского фитопланктона Thalassiosira pseudonana, Skeletonema marinoi, Dunaliella tertiolecta и Isochrysis galbana при экспозиции TiO2 в течение 96 ч в концентрациях 0, 10, 100, 500 и 1000 мкг/л.
Отсутствие токсического эффекта показано на представителях морских грамотрицательных бактерий Vibrio fischeri даже при концентрации TiO2 до 20 г/л [116].
Противоречивые результаты наблюдались в экспериментах на морских беспозвоночных. Поскольку НЧ TiO2 склонны к седиментации [15, 117], особую встревоженность вызывает их влияние на придонные организмы. В [118] оценивали влияние НЧ TiO2 в концентрациях 0–64 мг/л на ранние стадии развития черноморской мидии Mytilus galloprovincialis. Исследование проводилось в двух режимах освещения – полной темноте и при естественном фотопериоде (свет/темнота) – для проверки наличия потенциальных фотокаталитических эффектов НЧ TiO2. Показано, что токсичность НЧ TiO2 в основном связана с его “нано”-состоянием. Выявлено увеличение уровня токсичности при естественном светопериоде. Наличие освещения усиливает экотоксикологические эффекты, увеличивая количество недоразвитых личинок по сравнению с полученными в полной темноте, особенно при концентрациях 4 и 8 мг/л. Кроме того, имеются различия в значениях EC50, в темноте EC50 равны 1.23 мг/л (0.00–4.15 мг/л) и 38.56 мг/л (35.64–41.47 мг/л) против 1.65 мг/л (0.00–4.74 мг/л) и 19.39 мг/л (13.31–19.48 мг/л) при естественном светопериоде.
Оценка биологического воздействия НЧ TiO2 проводилась на двустворчатых моллюсках Limnoperna fortunei, которые подвергались воздействию в дозах (1, 5, 10 и 50 мкг/мл). Результаты показывают, что НЧ TiO2 могут повредить ДНК гемоцитов через 2 ч воздействия, а генотоксическая активность значительно увеличилась после 4-часового воздействия при всех концентрациях. НЧ TiO2 не обладают мутагенным действием на клетки гемолимфы, но вызывают окислительный стресс у Limnoperna fortunei [119, 120].
В [121] исследовали влияние НЧ TiO2 размером 32 нм на гемоциты трех видов двустворчатых моллюсков – Crenomytilus grayanus, Modiolus modiolus и Arca boucardi. Исследования проводись при 2-, 4- и 6-часовой экспозиции с концентрациями НЧ 100, 250, 500 и 1000 мг/л. Результаты показывают выраженное токсическое действие НЧ TiO2 в отношении C. grayanus и M. modiolus во всех исследуемых концентрациях, проявляющееся снижением жизнеспособности клеток и мембранной гиперполяризацией. Такая реакция может быть вызвана генерацией АФК НЧ TiO2 и дальнейшим развитием окислительного стресса. Наименьший токсический эффект был зафиксирован в отношении гемоцитов A. boucardi, что, вероятно, связанно с отличительными особенностями работы их антиокислительной системы.
Еще одним немаловажным фактором, влияющим на восприимчивость к НЧ TiO2, является pH среды. Несколько исследователей изучили потенциальное влияние подкисления океана (снижения pH за счет растворения избытков атмосферного CO2) на биодоступность, накопление и токсичность НЧ TiO2 в экспериментах на мидиях M. coruscus [122–125] и трех представителях двустворчатых моллюсков [126]. Было обнаружено, что воздействие на M. coruscus НЧ TiO2 в течение 14 дней в концентрациях 2.5 и 10 мг/л в морской воде со значением рН 7.3 ухудшает гемоцитарную реакцию, включая повышение уровня АФК, снижение фагоцитоза и эстеразной активности с пониженным содержанием лизосом. Кроме того, отмечается увеличение восстановительного периода при воздействии максимальной исследуемой концентрации в совокупности с низким pH [123]. В аналогичном эксперименте [122] показано, что воздействие на мидий комбинации низкого pH (7.3) и НЧ TiO2 в дозах 2.5 и 10 мг/л в течение 14 дней приводило к нарушениям нескольких физиологических реакций. Экспозиция НЧ TiO2 приводила к повышению экскреции аммиака и снижению скорости клиренса, частоты дыхания, соотношения O:N и возможности роста по сравнению с воздействием НЧ TiO2 при нормальных значениях pH (8.1). Также сообщалось, что при воздействии НЧ TiO2 на M. coruscus в тех же концентрациях наблюдались повышенные уровни MDA наряду со сниженной активностью SOD и уровнем восстановленного глутатиона (GSH) [127]. Кроме того, синергетический эффект НЧ TiO2 и низкого значения pH могут отрицательно влиять на общий метаболизм [125] и оказывать негативное влияние на ферментную систему мидий, в том числе на уровень амилазы, пепсина, трипсина, липазы и лизоцима [124].
В [126] сообщалось, что моллюски T. granosa, Meretrix meretrix и Cyclina sinensis накапливали значительно большее количество TiO2 после воздействия в концентрации 100 мкг/л при низких значениях рН (в 1.34 раза при pH = 7.4 и в 1.18 раза при pH = 7.8) по сравнению с животными, содержавшимися при рН 8.1. Для оценки возможного негативного эффекта от потребления таких молюсков были проведены эксперименты на лабораторных мышах, получавших эквивалентную накопленной в моллюсках дозу НЧ TiO2. Результаты показали очевидный отек печени и развитие воспалительной клеточной инфильтрации. Кроме того, в почках мышей наблюдались воспалительная инфильтрация клеток и небольшое набухание эпителиальных клеток почечных канальцев. Следовательно, НЧ TiO2 при определенных условиях токсичны, а снижение pH среды будет стимулировать их накопление в двустворчатых моллюсках, что может увеличить риск для здоровья потребителей морепродуктов.
Эколого-биологические эффекты НЧ ZnO. Установлено, что сферические частицы ZnO размером 40–48 нм в концентрациях 50, 100, 200 и 300 мг/л оказывают токсическое действие на зеленые водоросли Chlorella vulgaris. Выявлено значительное снижение жизнеспособности на 10–75% в зависимости от дозы и времени воздействия ZnO [128]. Результаты показали, что воздействие НЧ ZnO привело к нарушению морфологии водорослей после 72-часовой обработки.
Токсический эффект НЧ ZnO подтвержден и на другом представителе морских зеленых водорослей. В исследовании влияния ZnO на рост и развитие Dunaliella tertiolecta полученное значение EC50 = 1.94 [0.78–2.31] мг/л указывает на то, что НЧ ZnO более токсичны, чем его объемный аналог (EC50 = 3.57 [2.77–4.80] мг/л ) [129].
При экспозиции Dunaliella tertiolecta и Tetraselmis suesica НЧ ZnO в концентрациях 0.081–810 мг/л в течение 96 ч наблюдалось дозозависимое ингибирование жизнеспособности колоний водорослей вплоть до нулевых значений уже при концентрациях 8.1 мг/л и выше. В концентрации 8.1 мг/л наблюдалось уменьшение размеров клеток на 20–30% от исходных значений [36].
В [130] оценивали токсическое влияние ZnO различных форм (наносферы диаметром 6.3 ± 1.1 и 15.7 ± 1.3 нм, наностержни длиной 242 ± 47 нм и диаметром 13.5 ± 2.7 нм, наноиглы длиной 862 ± 301 нм и диаметром 29.5 ± 7.1 нм ) на диатомовые водоросли T. pseudonana и P. tricornutum. Экспозицию проводили в течение 100 ч с концентрациями 10, 20, 40 и 80 мг/л ZnO различных форм. В результате скорости деления клеток значительно снизились после воздействия ZnO независимо от морфологии НЧ и их начальной концентрации. Напротив, P. tricornutum в присутствии ZnO демонстрировал хоть и относительно медленный, но непрерывный рост. Межвидовые различия в чувствительности к НЧ ZnO, вероятно, связаны с наследственно детерминированными особенностями физиологических реакций выбранных тест-объектов.
Негативное действие НЧ ZnO проявляется и на морских беспозвоночных. В [131] оценивали влияние НЧ ZnO размером < 100 нм в концентрациях 10 и 100 мг/л на оплодотворение и раннее развитие эмбрионов морского ежа Paracentrotus lividus. Для оценки влияния наноразмера параллельно проводили эксперимент с ионной формой Zn2+ (ZnCl2) в тех же концентрациях. Показано, что НЧ ZnO более токсичны, чем ионная форма Zn2+. При этом воздействие НЧ ZnO в малых концентрациях вызывало аномалии развития эмбрионов, а при увеличении концентрации – к эмбриональной гибели. Кроме того, было отмечено увеличение токсичности НЧ ZnO именно в морской воде, что связано с поверхностным взаимодействием НЧ со средой и формированием агрегатов меньшего размера. Подобные исследования проводились на морских беспозвоночных – моллюске Scrobicularia plana и черве Nereis diversicolor. НЧ ZnO экспонировались в дозе 3 мг/кг, так как предполагается, что такой уровень находится в донных отложениях. Биоаккумуляция Zn наблюдалась у обоих организмов, подвергнутых воздействию меченых НЧ ZnO. На биохимическом уровне воздействие меченых НЧ ZnO вызывало повышение активности GST в червях и активности каталазы в моллюсках [132].
Токсичность НЧ ZnO исследовалась на тихоокеанских устрицах Crassostrea gigas. Для оценки механизмов токсичности устриц обрабатывали дозой 4 мг/л в течение 6, 24 и 48 ч. НЧ ZnO накапливались в жабрах (24 и 48 ч) и пищеварительных железах (48 ч). Ультраструктурный анализ жабр показал электронно-плотные везикулы вблизи клеточной мембраны и потерю митохондриальных крист (6 ч). Опухание митохондрий и более заметная потеря митохондриальных крист наблюдались через 24 ч. Результаты показывают, что накопление НЧ ZnO приводит к раннему митохондриальному разрушению и окислительному стрессу [133].
Таким образом, в отношении НЧ ZnO, несмотря на значительную скорость агрегации НЧ в морской воде, в разных токсикологических исследованиях доказана высокая биологическая активность НЧ для морских организмов в сравнении с исходно более крупными объемными аналогами [129].
Эколого-биологические эффекты НЧ Ag. Известно, что благадаря небольшому размеру НЧ Ag могут проходить через биологические мембраны и проникать в клетки, вызывая токсичность на разных уровнях в зависимости от специфики пораженных организмов. Токсичность НЧ Ag может быть напрямую связана с их характеристиками, такими как форма, размер, концентрация, агрегация, химическое покрытие и поверхностный заряд [134, 135]. Токсичность НЧ Ag также зависит от видовых особенностей объектов воздействия, что связано с защитными механизмами, которые организм использует для устранения нежелательных соединений. Более того, на реакцию в тестах на токсичность будут влиять питательные среды, в которых находятся микроорганизмы [136].
В [137] исследовали токсическое действие НЧ Ag размером 50 нм на морские микроводоросли Dunaliella tertiolecta при экспозиции в течение 24 ч концентрациями 0–10 мг/л. Согласно результатам НЧ Ag оказывают негативное влияние на Dunaliella tertiolecta, что проявляется в сильном снижении содержания хлорофилла и количества жизнеспособных клеток водорослей (1 мг/л НЧ Ag вызвал уменьшение жизнеспособных клеток на 44%, которое достигало 96% при 10 мг/л), повышенном образовании АФК и перекисном окислении липидов (ПОЛ). Негативное влияние НЧ Ag на водоросли и указанные изменения могут иметь серьезные последствия для структуры и функционирования сообществ водных растений.
В отношении морских беспозвоночных также имеется ряд экспериментальных данных. В [138] исследовали токсичность НЧ Ag, покрытых поливинилпирролидоном (ПВП) и олеиновой кислотой, при 24-часовой экспозиции в концентрациях 1, 10 и 100 мкг/л в отношении Balanus amphitrite, Crepidula onyx и Hydroides elegans. Все тест-объекты эффективно накапливали НЧ Ag, депонирование которых наблюдалось в вакуолях эпителиальных клеток пищеварительного тракта. Результаты свидетельствуют о токсическом действии НЧ Ag на личиночную стадию трех различных видов морских беспозвоночных. Хроническое воздействие сублетальных концентраций НЧ Ag (10, 100 мкг/л) приводит к значительному замедлению роста и развития и снижению скорости оседания личинок B. amphitrite, C. onyx и H. elegans.
В [139] была оценена токсичность НЧ Ag различных размеров для двух видов микроводорослей из пресноводной и морской среды (Chlamydomonas reinhardtii и Phaeodactylum tricornutum соответственно). Как оказалось, процессы растворения влияют на форму и концентрацию НЧ Ag в обеих средах. Косвенные эффекты, в частности растворенные ионы Ag, по-видимому, контролируют токсичность для пресноводных микроводорослей, тогда как прямые эффекты, особенно прикрепление к поверхности клетки и интернализация НЧ Ag внутри клеток, по-видимому, определяют токсичность для изучаемых морских видов. Это исследование способствует получению знаний о роли внутренних и внешних факторов в определении поведения НЧ в различных водных средах и взаимодействия с микроводорослями [139]. Содержание хлорофилла показало, что НЧ Ag подавляли рост зеленых водорослей Chlorella vulgaris более заметно, чем AgNO3. НЧ Ag оказали большее токсическое воздействие на водоросли, чем ионы серебра [140].
НЧ Ag оказывают токсическое действие и на эмбриональное развитие морских ежей Arbacia lixula, P. lividus и Sphaerechinus granularis. Исследование НЧ Ag размером 60 нм в концентрациях 1–100 мкг/л при времени воздействия от 30 мин до 24 ч выявило определенную видоспецифичность. Самым чувствительным видом был A. lixula, у которого наблюдалось наибольшее количество патологий или задержек развития зародышей, проявляющихся даже при самых низких протестированных концентрациях НЧ Ag (1–10 мкг/л). Кроме того, сильное влияние на развитие было отмечено для тех эмбрионов, которые впервые подвергались воздействию НЧ через 6 и 24 ч после оплодотворения, что лежит в основе того, как время воздействия НЧ может представлять собой важный фактор в развитии аномалий. Эмбрионы S. granularis показали умеренное воздействие НЧ Ag, значительные аномалии развития отмечались в диапазоне концентраций 10–50 мкг/л. Для P. lividus подобные эффекты были отмечены при более высоких концентрациях НЧ Ag – 50 и 100 мкг/л [141].
В [142] оценивали влияние цитрат-стабилизированных НЧ Ag (cit-НЧ Ag) размером 16.5 ± 4.5 нм и стабилизированных гуминовой кислотой (HA-НЧ Ag) размером 13.1 ± 3.7 нм на яйца, личинки, молодые и взрослые особи многощетинковых червей P. dumerilii. Животные в различных жизненных формах подвергались экспозиции НЧ в концентрациях 0.1, 1, 10 и 100 мкг/л в течение 48 ч. Для сравнения с ионной формой Ag использовался AgNO3 в тех же концентрациях. В результате наблюдалось накопление HA-НЧ Ag и cit-НЧ Ag, приводящее к дозозависимому снижению жизнеспособности вплоть до 100% с увеличением концентрации НЧ на всех стадиях развития, кроме взрослой формы червя. При этом наименее защищеными оказались оплодотворенные яйца, в отношении которых токсичность HA-НЧ Ag и cit-НЧ Ag была сопоставима с ионной формой Ag. Взрослые особи оказались наиболее толерантны к воздействию HA-НЧ Ag и cit-НЧ Ag. Кроме того, у выживших представителей наблюдались высокие проценты аномалий развития (до 93%) даже при малых концентрациях НЧ Ag.
В [143] исследовали влияние радиоактивно меченых НЧ Ag размером до 40 нм на голубую мидию Mytilus edulis в концентрации 0.7 мкг/л. Результаты показывают отсутствие токсического эффекта в исследуемой концентрации, при этом бионакоплений серебра в органах моллюсков обнаружить не удалось.
НЧ Ag размером 15 ± 6 нм в концентрациях 0.0016–1.6 мкг/л вызывали нарушения развития эмбриона устрицы Crassostrea virginica. При этом задержка развития наблюдалась при концентрациях, аналогичных тем, которые вызывали как статистически, так и биологически значимое влияние на лизосомальную дестабилизацию в клетках взрослых особей. Значительное увеличение уровней экспрессии металлотионеина мРНК наблюдалось как у эмбрионов, так и у взрослых устриц [144].
Исследования, проведенные на рыбах Piaractus mesopotamicus, показывают, что НЧ Ag в концентрации 2.5–25 г/л водной среды накапливаются в жабрах, печени и головном мозге, что в конечном итоге приводит к окислительному повреждению мозга и печени [145].
Интересный факт обнаружили несколько групп ученых, в работах которых показано, что вырабатываемый микроводорослями при контакте с НЧ Ag водорастворимый органический углерод способствует снижению токсического эффекта НЧ в отношении окружающего зоопланктона [146, 147].
Для морских ракообразных НЧ Ag также токсичны, что подтверждено в эксперименте на Tisbe battagliai. 24- и 48-часовая экспозиция НЧ Ag-ПВП в диапазоне концентраций 5.6–100 мкг/л вызвала дозозависимое увеличение летальности животных. Максимально тестируемая концентрация вызывала смертность тест-объектов более чем в 80% случаев. Кроме того, в [33] отмечено, что уровень токсичности зависит от уровня солености окружающей воды, увеличиваясь с повышением солености. Аналогичный профиль токсичности описан с НЧ Ag, когда науплии Artemia salina подвергались воздействию концентраций от 0 до 100 мг/л [148]. Было продемонстрировано, что скорость иммобилизации A. salina значительно увеличивалась в зависимости от дозы после 72 ч воздействия. EC10 и EC50 составляли 1.48 и 10.7 мг/л соответственно. Более того, НЧ Ag вызвали продукцию АФК после 48 ч воздействия, а SOD значительно снизилась с увеличением концентрации НЧ. Низкое значение ЕС50 (0.055 мг/л) для A. salina определено при экспозиции НЧ Ag (2–18 нм) в концентрациях от 0 до 1.5 мг/л [149].
Работ по экспериментальному изучению влияния НЧ Ag на морских позвоночных крайне мало. В [150] изучали трофический перенос НЧ Ag от науплиусов морской креветки A. salina к морской медаке Oryzias melastigma. В работе показано, что агрегированные НЧ Ag (20 и 80 нм) и хорошо диспергированные 80 нм НЧ Ag (стабилизированные 20 мкМ Tween 20) при добавлении их в воду в концентрациях 200 и 1000 мкг/л могут легко накапливаться креветками (концентрация НЧ Ag в теле составила 28.2 и 181 мкг/г сухого веса соответственно). Эффективность ассимиляции НЧ Ag O. melastigma, питавшейся в течение 28 дней контаминированными НЧ Ag креветками, была низкой (<6%), что привело к низкой эффективности трофического переноса (0.01–0.04). Несмотря на это, попадание НЧ Ag в организм рыб с пищей может подавлять активность Na+/K+-АТФазы и SOD уже в первые две недели воздействия. Значительное (p < 0.05) ингибирование наблюдалось при поедании креветок с высоким содержанием НЧ Ag (181 мкг/г сухого веса). Снижение ростовых показателей и процентного содержания воды в тканях также наблюдалось у рыб, получавших большое количество креветок, контаминированных НЧ Ag. Таким образом, подтверждена возможность передачи НЧ Ag по трофической цепи с последующим развитием токсического действия [150].
Механизмы токсичности НЧ Ag все еще исследуются [134, 151, 152]. По сути предполагается, что как сами НЧ Ag, так и Ag+, высвобождаемые из НЧ, обладают токсичностью [153], способствуя повреждению мембран, образованию АФК, окислению и денатурации белков, дисфункции митохондрий, повреждению ДНК и ингибированию пролиферации клеток [151]. В [154] указано, что взаимодействие НЧ Ag с белками или другими серосодержащими макромолекулами является важным механизмом токсичности, обусловленным высоким сродством между серебром и серой. Кроме того, предполагается, что такие процессы, как взаимодействие НЧ Ag с клеточными мембранами и проникновение в них, а также накопление в цитоплазме, вызывающее повреждение клеток, объясняют антибактериальной активностью НЧ Ag .
Эколого-биологические эффекты НЧ Au. Золото считается довольно низкотоксичным металлом, но в наноразмерной области наблюдается значительное повышение его активности в результате взаимодействия биологических полимеров с НЧ Au [155, 156]. На примере различных биологических объектов показано, что НЧ Au могут взаимодействовать с липидными бислоями [157, 158], проявляя цитотоксическое, а также генотоксическое действие [159]. Не являются исключением и морские организмы. В эксперименте in vitro [121] исследовали влияние НЧ Au размером 60–80 нм на гемоциты трех видов двустворчатых моллюсков – Crenomytilus grayanus, Modiolus modiolus и Arca boucardi. Исследования проводись при 2, 4 и 6-часовой экспозиции с концентрациями НЧ 100, 250, 500 и 1000 мг/л. Результаты продемонстрировали цитотоксическое влияние НЧ Au на гемоциты M. modiolus и A. boucardi. Интересно, что гемоциты C. grayanus обнаруживали толерантность к НЧ Au после кратковременного воздействия, но мембраны клеток подвергались значительной деполяризации.
В [160] оценивали влияние cit-НЧ Au (d ~ 13 нм) на Mytilus edulis при 24-часовой экспозиции. Было показано, что НЧ в большей степени накапливались в пищеварительной железе, чем в жабрах, вызывая окислительный стресс. В [161] с использованием меньших НЧ Au (5 нм) показано, что 95% Au накапливалось в пищеварительной железе, где наблюдались усиление ПОЛ и уменьшение содержания тиолсодержащих белков. Более того, воздействие вызывало значительное снижение стабильности лизосомальной мембраны в гемоцитах.
В [35] изучали токсичность растворенных НЧ Au и cit-НЧ Au на пяти морских микроводорослях. Значения EC50 через 72 ч экспозиции составили 0.5 ± 0.15 мг/л для Chlorella autotrophyca, 0.1 ± ± 0.01 мг/л для C. closterium, 0.078 ± 0.013 мг/л для P. tricornutum, 0.11 ± 0.01 мг/л для Pleurochrysis pseudoroscoffensis и 0.052 ± 0.001 мг/л для Rhodomonas salina. Полученные данные намного превосходят значения, полученные для cit-НЧ Au.
Мидии Mytilus edulis экспонировали в резервуарах до 750 ppb Au НЧ (средний диаметр 5.3 ± 1 нм) в течение 24 ч. В основном НЧ Au накапливались в пищеварительной железе, в которой также наблюдалось более высокое ПОЛ. Это исследование показывает, что M. edulis являются подходящими модельными животными для исследований токсичности НЧ в окружающей среде [162]. Морские двустворчатые моллюски Ruditapes decussatus экспонировались в течение 14 дней в двух концентрациях НЧ Au–ZnO (50, 100 мкг/л), полученные результаты показывают, что НЧ Au–ZnO индуцируют биохимические и гистологические изменения в тканях пищеварительной железы и жабер при высокой концентрации. Гистологические изменения в жабрах и пищеварительной железе были более выражены при дозе 100 мкг/л [163].
Эколого-биологические эффекты НЧ оксида меди. Поскольку НЧ Cu2O рассматриваются в качестве перспективных компонентов против обрастания биопленкой различных агрегатов, образование которой приводит к биокоррозии трубопроводов, обрастанию различного технологического оборудования, корпусов судов, были проведены токсикологические исследования на диатомовых водорослях и моллюсках. В [164] оценивали влияние НЧ на адгезию водорослей к поверхности. Полученные результаты показывают, что НЧ Cu2O размером 9 нм оказывают ингибирующее действие на уровень адгезии водорослей уже в концентрации 0.1 г/л, а в концентрации 10 г/л адгезия клеток на третий день эксперимента равна нулю. Для сравнения обычный Cu2O достигает такого же эффекта только к шестому дню эксперимента.
Токсичность НЧ Cu показана и в отношении морских микроводорослей Skeletonema costatum. Коэффициент ингибирования роста увеличивался с увеличением концентрации частиц и времени инкубации. При этом показана возможность снижения токсичности НЧ Cu за счет присутствия в воде такого поллютанта, как микропластик. Было обнаружено, что адсорбция Cu2+ на микропластике и агрегация между НЧ Cu и микропластиком являются основными причинами снижения токсичности при добавлении микропластика [165].
В [166] оценивали влияние НЧ CuO в концентрациях 1, 2 и 3 мг/л в течение четырех недель на морских мидиях Mytilus galloprovincialis. В результате показатель клиренса у мидий, экспонированных НЧ CuO в максимально используемой концентрации, снизился на 48%, а скорость роста раковины на 68% в сравнении с контрольными животными. Концентрация Cu в жабрах контрольных животных на четвертой неделе эксперимента составляла 4.9 мкг/г, в то время как в жабрах мидий, подвергшихся воздействию 3 мг/л НЧ CuO, 121 мкг/г. Суммарная концентрация Cu в остальных тканях составила 6.7 мкг/г у контрольных животных и 79 мкг/г у мидиий, подвергшихся воздействию 3 мг/л CuO. Было отмечено, что НЧ CuO менее токсичны в сравнении с ионной формой Cu, что, вероятно, связано с меньшей скоростью растворения НЧ. Однако мидии, подвергающиеся воздействию НЧ CuO, выделяют продукты жизнедеятельности, содержащие высокие концентрации Cu, которые могут воздействовать на другие виды, населяющие ложе мидий и окружающие сообщества донных отложений, а также способствовать переносу НЧ вверх по пищевой цепи вплоть до человека.
В [167] оценивали поведенческие и биохимические ответы моллюсков Scrobicularia plana и червей Hediste diversicolor, подвергавшихся in vivo-воздействию CuO в концентрации 10 мкг/л в условиях природной морской воды. Показано, что НЧ CuO в морской воде имеют высокую скорость агрегации. Поведенческие нарушения в ходе эксперимента наблюдались только у S. plana. Не было выявлено заметных эффектов нейротоксичности, поскольку у обоих видов не было изменений холинэстеразной активности в ответ на воздействия НЧ CuO. Биомаркеры окислительно-стрессовой каталазы и глутатион-S-трансферазы были усилены у обоих видов, в то время как SOD увеличена только у S. plana, подвергшейся воздействию НЧ CuO. Металлотионеиноподобный белок увеличен в двустворчатых моллюсках. Полученные результаты подтверждают негативное влияние НЧ CuO на морских беспозвоночных.
В [168] изучали биоаккумуляцию металлических НЧ CuO на пяти объектах: устрицах Crassostrea gigas, мидиях Mytilus edulis, гребешках Chlamys farreri, моллюсках Ruditapes philippinarum и арках Scapharca subcrenata. Результаты показали, что исследуемые НЧ обнаружены у всех пяти моллюсков. Концентрация НЧ в тканях и органах былa намного выше, чем в морской воде, что подтверждает их биоаккумуляцию. Основными органами биоаккумуляции выделены жабры и пищеварительная железа.
После воздействия на сперматозоиды морских ежей Paracentrotus lividus НЧ CuO были оценены биомаркеры жизнеспособности, цитотоксичности, окислительного стресса и генотоксичности, а также морфологии сперматозоидов. Результаты показали, что воздействие CuO НЧ снижает жизнеспособность сперматозоидов, нарушает митохондриальную активность и увеличивает выработку АФК и ПОЛ. Кроме того, воздействие CuO НЧ вызвало повреждение ДНК и морфологические изменения [169]. В другом исследовании оценили потенциальную роль окислительного стресса в токсичности НЧ CuO, исследуя молекулярный ответ эмбрионов морского ежа Arbacia lixula на три концентрации НЧ CuO (0.7, 10, 20 мкг/л). Зависимые от времени и концентрации изменения в экспрессии генов были обнаружены у эмбрионов A. lixula, подвергнутых воздействию НЧ CuO, вплоть до стадии плутеуса (72 ч после оплодотворения), что указывает на то, что окислительный стресс является одним из механизмов токсичности для НЧ CuO [170].
Эколого-биологические эффекты НЧ nZVI. В [171] исследовали влияние нульвалентного железа в концентрациях 0.1–100 мг/л на представителей морского фитопланктона – микроводоросли Isochrysis galbana, зеленые водоросли Dunaliella tertiolecta и диатомовые водоросли Thalassiosira pseudonana. Показано, что nZVI токсично для всех трех представителей в концентрации 0.3–3 мг/л, что выражалось в снижении скорости роста клеток. С увеличением концентрации nZVI уровень токсичности увеличивался вплоть до нулевых значений исследуемого показателя при концентрации 100 мг/л.
Эколого-биологические эффекты НЧ сульфидов металлов. В отношении НЧ CdS (d = 5–9 нм) и ZnS (d = 2.6–5.6 нм) в эксперименте при 2–6-часовой экспозиции в концентрации НЧ 100, 250, 500 и 1000 мг/л гемоцитов трех видов двустворчатых моллюсков (Crenomytilus grayanus, Modiolus modiolus и Arca boucardi) зарегистрирована дозо- и времязависимая цитотоксичность для клеток всех трех видов двустворчатых моллюсков. Значительное увеличение токсичности НЧ ZnS можно было наблюдать при 6-часовых измерениях C. grayanus и A. boucardi. Наблюдаемый эффект, вероятно, связан с более низкой стабильностью нанокристаллов ZnS в воде по сравнению с CdS, что приводит к растворимости нанокристаллов и образованию ионной формы металла [121].
Подобные результаты описаны в [172] при исследовании влияния НЧ CdS (d = 6.3 нм) и ZnS (d = 3.9 нм) в концентрациях 1, 10 и 100 мг/л на микроводоросли A. ussuriensis, H. akashiwo, C. muelleri, P. purpureum при экспозиции в течение 3, 6, 24, 96 ч и 7 дней. Показано, что исследуемые НЧ оказывают токсическое действие на все микроводоросли. НЧ CdS вызывали более высокое ингибирование скорости роста C. muelleri и P. purpureum, тогда как НЧ ZnS были более токсичными для видов A. ussuriensis и H. akashiwo. Подобная зависимость связана с особенностями влияния химического состава НЧ и их способностью взаимодействовать с компонентами клеточной стенки микроводорослей. При этом отмечалась высокая биологическая активность CdS, основанная на их высокой фотоактивности при облучении видимым светом и меньшей диссоциации в воде, что позволяет им генерировать больше АФК и создавать более высокий риск окислительного стресса для водных организмов.
Эколого-биологические эффекты НЧ SnO2 и CeO2. Потенциальная токсичность НЧ диоксида олова (SnO2), диоксида церия (CeO2) и оксида железа (Fe3O4) в морской среде была исследована с использованием в качестве модели in vivo морского ежа Paracentrotus lividus. В качестве маркеров токсичности оценивали наличие НЧ в целомической жидкости и поглощение их иммунными клетками (целомоцитами), активность холинэстеразы и экспрессию связанных со стрессом белков HSC70 и GRP78, а также морфологические изменения в эндоплазматической сети (ЭПC) и лизосомах. Обнаружено, что через 5 дней пероральной экспозиции НЧ в водных растворах исследуемые НЧ накапливались внутри целомоцитов. Активность холинэстераз значительно снижена во всех образцах, подвергшихся воздействию НЧ. Уровни стрессовых белков были значительно ниже контрольных значений, что соответствовало наблюдаемым морфологическим изменениям в ЭПС и лизосомах. Предполагалось, что поглощение фагоцитарными целомоцитами НЧ является стратегией детоксикации, используемой, чтобы справиться с опасными материалами и способствовать выживанию организма. Поскольку было обнаружено, что биомаркеры врожденного иммунитета и ЭПС-стресса подавляются через 5 дней после воздействия, есть предположение, что подавление иммунной передачи сигналов может быть полезным ответом обратной связи, помогающим клеткам пережить повреждение ткани [173].
Для оценки возможности передачи НЧ по пищевой цепи было проведено исследование на личинках морского ежа Paracentrotus lividus, которые получали в течение 48 ч в качестве пищи микроводоросли Cricosphaera elongata, контаминированные НЧ SnO2 и CeO2 в концентрации 5 мг/л. У личинок ежей наблюдалось значительное снижение выживаемости, а также аномальное развитие, характеризовавшееся дегенерацией скелета и измененным ростом зародышевого диска [23].
Эколого-биологические эффекты квантовых точек CdTe и CdSe. В исследовании по оценке репродуктивной токсичности квантовых точек (Quantum dots, QDs) CdTe в концентрации 10 мкг/л на мидиях Mytilus galloprovincialis в 14-дневном эксперименте было показано, что QDs CdTe распределяются по всем тканям мидий. Как в мужских, так и в женских половых железах подавляют систему антиоксидантной защиты, что приводит к ПОЛ, при этом повреждения в женских гонадах носили более длительный характер. Полученные результаты свидетельствуют о возможных генетических изменениях, которые могут проявиться на клеточном уровне во время гаметогенеза, эмбриогенеза и развития личинок и потенциально могут оказать серьезное влияние на устойчивость популяции и здоровье экосистемы [174].
В [175] оценивали потенциальную токсичность QDs CdSe с использованием двух зеленых водорослей Chlorella pyrenoidosa и Scenedesmus obliquus. Также рассматривали и сравнивали влияние QDs CdSe и ионов кадмия на водоросли и их чувствительность к целевым соединениям. Результаты показали, что скорость роста водорослей и содержание хлорофилла снижались с увеличением концентраций и продолжительности воздействия. Был снижен уровень глутатиона, в то время как активность SOD увеличилась, демонстрируя развитие токсического действия. Увеличение уровней MDA показало, что QDs CdSe и ионы кадмия способствовали возникновению окислительного повреждения. Исследование показало, что влияние QDs CdSe сильнее, чем влияние Cd(NO3)2, и реакция водорослей видоспецифична [175].
Эколого-биологические эффекты НЧ на основе Co и Ni. Тесты на ингибирование роста водорослей проведены в [176] для изучения потенциальной токсичности НЧ Co на морских микроводорослях Platymonas subcordiforus, Chaetoceros curvisetus и Skeletonema costatum. Это один из первых случаев систематического изучения токсичности НЧ Co для морских водорослей. Эти результаты показали, что НЧ Co токсичны для всех тест-организмов.
В [177] рассмотрена стабильность НЧ NiO в морской воде, включая их способность к агрегации и высвобождению ионов, а также связь между этими свойствами и их токсичностью для морских водорослей Chlorella vulgaris. Результаты показали, что НЧ NiO ингибировали рост клеток водорослей и уменьшали содержание хлорофилла в них, что было связано с эффектом затенения при агрегации НЧ NiO в морской воде.
3. МЕХАНИЗМЫ ТОКСИЧЕСКОГО ДЕЙСТВИЯ МЕТАЛЛИЧЕСКИХ И МЕТАЛЛООКСИДНЫХ НЧ
Как видно из изложенного выше, НЧ металлов обладают разной токсичностью. Выявлены некоторые факторы, влияющие на ее уровень, в том числе размеры, химический состав, концентрация, степень растворения, агрегация НЧ [1]. Металлические и металлооксидные НЧ могут вызывать местную и системную токсичность, способствуя образованию свободных радикалов, особенно АФК, которые индуцируют окислительный стресс.
Наиболее подтвержденными механизмами токсического действия НЧ на сегодня считают:
– окислительный стресс;
– нарушение целостности клеточной мембраны за счет сильного электростатического взаимодействия, окисления или механического повреждения мембраны;
– воспалительные процессы, возникающие за счет высвобождения провоспалительных факторов, вызывающих дисфункцию клеток [178];
– повреждение ДНК и генетические мутации.
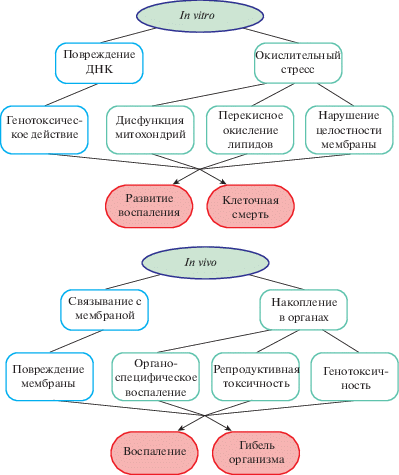
В зависимости от типа эксперимента выделяют несколько механизмов токсичности (рис. 2).
Варьируются возможные механизмы и в зависимости от уровня организации тест-объектов, что показано на примере НЧ TiO2 (рис. 3).
Рис. 3.
Механизмы токсического действия НЧ TiO2 на водоросли и растения (а), микроорганизмы (б), а также беспозвоночных и позвоночных (в) [179].
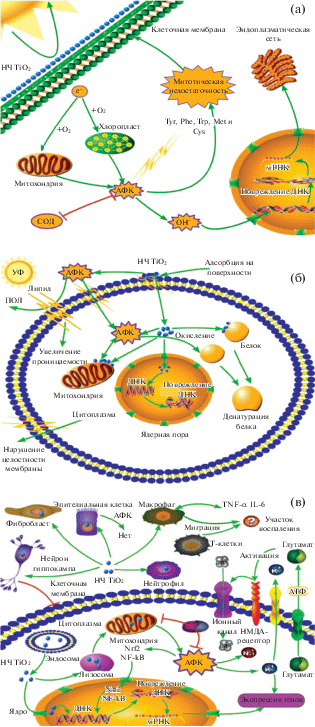
Как показано на рис. 3а, основной предполагаемый механизм токсичности НЧ для водорослей и растений, показанный на примере наноструктурного TiO2, выглядит следующим образом. АФК и свободные радикалы разрушают молекулу хлорофилла, увеличивают содержание MDA и снижают содержание хлорофилла а, фотосинтетическую эффективность и активность SOD, что приводит к усилению ПОЛ. Кроме того, АФК могут атаковать аминокислотные остатки белков с образованием карбонильных производных или приводить к разрывам цепей ДНК и повреждению белков.
НЧ TiO2, адсорбированные на бактериальной поверхности под действием электростатической силы, по-разному могут влиять на клетку микроорганизма (рис. 3б). Возможен механизм активации выработки АФК, что способствует ПОЛ клеточной мембраны и увеличению ее проницаемости. Либо может наблюдаться механическое нарушение целостности клеточной мембраны с последующим проникновением НЧ внутрь клеток. После проникновения в полость клетки НЧ прикрепляются к органеллам или связываются с биологическими макромолекулами, что приводит к денатурации белка и нарушению генетического материала.
Что касается механизма токсичности НЧ на организменном и органном уровнях (рис. 3в), то окислительный стресс и апоптоз, индуцированные АФК, здесь также считаются ключевыми факторами внутриклеточного повреждения органов и оказывают влияние на выживание, рост и физиологию как позвоночных, так и беспозвоночных морских животных.
Механизм и степень токсичности могут существенно изменяться в зависимости от различных факторов среды. Например, имеются данные об изменении токсичности НЧ металлов в зависимости от уровня солености водной среды, однако результаты довольно противоречивы. Так, в эксперименте по оценке токсичности НЧ Ag на морских микроводорослях Dunaliella salina при различных уровнях солености воды (35, 70 и 140 г/л) наблюдалось увеличение степени ингибирования роста микроводорослей с увеличением солености [180]. Подобная закономерность наблюдалась в экспериментах на Tisbe battagliai и Ceramium tenuicorne [33]. Однако при оценке острой токсичности НЧ Ag на мальках радужной форели Oncorhynchus Mykiss уровень солености оказал противоположный эффект. Эксперимент проводился при двух уровнях солености воды – 12 ± 0.2 ppt (солоноватая) и 0.4 ppt (пресная). Результаты 96‑часового эксперимента демонстрируют значение полулетальной концентрации в солоноватой воде в 12 раз меньше, чем в пресной воде [181]. Снижение уровня токсичности с увеличением солености характерно и для НЧ CuO, что было продемонстрировано на Vibrio anguillarum в 6-часовом эксперименте по определению EC50 при трех типах солености водной среды (5–20–35‰) [182] и на Tigriopus japonicus [183]. Это объясняется увеличением агрегации НЧ CuO и увеличением солености. Таким образом, токсичность различных НЧ металлов и их оксидов проявляется по-разному в зависимости от солености водной среды, однако требуется проведение дополнительных исследований, направленных на выявление детерминантов и механизмов токсичности НЧ в условиях соленой воды.
ЗАКЛЮЧЕНИЕ
Морские экосистемы содержат множество водных организмов и играют решающую роль в поддержании биологического разнообразия и круговорота питательных веществ. Такие экосистемы помогают регулировать глобальное распределение тепла и обеспечивают людей большим количеством морепродуктов [184]. Поэтому защита водных сред от загрязнения и токсикологическая оценка их состояния являются одними из наиболее важных направлений исследований [185].
Водные экосистемы состоят из водных организмов и абиотической среды. К первым относятся микроорганизмы, фитопланктон (водоросли), высшие водные растения, беспозвоночные и позвоночные, эти организмы выполняют многие экологические функции. Например, микроводоросли и цианобактерии являются важными первичными продуцентами и имеют фундаментальное значение для экологического баланса, круговорота веществ, потока энергии, фиксации азота и деградации загрязнения, а их чувствительность к загрязняющим веществам напрямую ведет к общему ухудшению многих экосистем [186].
В настоящей работе кратко описаны токсические эффекты наиболее распространенных НЧ металлов на различные таксоны микроорганизмов, водорослей и беспозвоночных (табл. 2). Токсичность НЧ металлов варьировалась в зависимости от вида, размера частиц и условий воздействия. Большинство токсических эффектов в экспериментах на водорослях были видоспецифичными и зависели от концентрации или времени экспозиции. Были описаны предполагаемые механизмы действия НЧ в зависимости от уровня организации тест-объектов, однако необходимы дальнейшие исследования токсических эффектов и механизмов действия НЧ металлов в сочетании с другими НЧ и органическими и неорганическими поллютантами окружающей среды. Помимо возможной передачи НЧ металлов по пищевой цепи, важно провести исследования репродуктивной и эмбриотоксичности для понимания отдаленных эффектов воздействия НЧ металлов на естественные морские экосистемы.
Таблица 2.
Токсическое действие металлических НЧ на различных представителей морской экосистемы
| Тест-объект | НЧ | Концентрация | Результаты | Литература |
|---|---|---|---|---|
| Водоросли | ||||
| Dunaliella tertiolecta | НЧ Ag | 0–10 мг / л | Снижение содержания хлорофилла и количества жизнеспособных клеток, повышенное образование АФК, ПОЛ | [137] |
| Chlorella autotrophyca, C. closterium P. tricornutum, Pleurochrysis pseudoroscoffensis | НЧ Au | EC50 через 72 ч = Chlorella autotrophyca – 0.5 ± 0.15 мг/л; C. closterium – 0.1 ± 0.01 мг/л; P. tricornutum – 0.078 ± ± 0.013 мг/л; Pleurochrysis pseudoroscoffensis – 0.11 ± ± 0.01 мг/л; Rhodomonas salina – 0.052 ± 0.001 мг/л | [35] | |
| Phaeodactylum tricornutum | TiO2 + УФ-А | 0–400 мг/л | ЕС50 = 1.98 ± 0.09 мг/л | [111] |
| Thalassiosira pseudonana, Skeletonema marinoi, Dunaliella tertiolecta, Isochrysis galbana | TiO2 | 0, 10, 100, 500, 1000 мкг/л | Не токсичен | [115] |
| Chlorella vulgaris | ZnO | 50, 100, 200, 300 мг/л | Дозозависимое снижение жизнеспособности на 10–75% | [128] |
| Dunaliella tertiolecta | ZnO | Токсичен. EC50 1.94 [0.78–2.31] мг/л | [129] | |
| Dunaliella tertiolecta, Tetraselmis suesica | ZnO | 0.081–810 мг/л | Ингибирование скорости роста клеток до 0 при максимальной концентрации НЧ | [36] |
| T. pseudonana и, P. tricornutum | ZnO | 10, 20, 40, 80 мг/л | Снижение скорости размножения | [130] |
| Skeletonema costatum | CuNPs | Ингибирование скорости роста клеток | [165, 187] | |
| Isochrysis galbana, Dunaliella tertiolecta, Th-alassiosira pseudonana | nZVI | 0.1–100 мг/л | Ингибирование скорости роста клеток | [171] |
| Бактерии | ||||
| Vibrio fischeri | TiO2 | 0–20 г/л | Не токсичен | [116] |
| Моллюски | ||||
| Balanus amphitrite, Crepidula onyx, Hydroides elegans (личинки) | НЧ Ag-ПВП | 1, 10, 100 мкг/л | Замедление роста и развития и снижение скорости оседания личинок | [138] |
| Mytilus edulis | НЧ Ag | 0.7 мкг/л | Не токсичен | [143] |
| Crenomytilus grayanus, Modiolus modiolus, Arca boucardi (гемоциты) | НЧ Au | 100, 250, 500, 1000 мг/л | Цитотоксичны для гемоцитов M. modiolus и A. boucardi. Вызывают деполяризацию мембран клеток у C. grayanus |
[121] |
| Mytilus edulis | cit-НЧ Au | Усиление ПОЛ и уменьшение содержания тиолсодержащих белков | [160, 161] | |
| Mytilus galloprovincialis | TiO2 | 0–64 мг/л | Увеличение количества недоразвитых личинок | [118] |
| Crenomytilus grayanus, Modiolus modiolus, Arca boucardi |
TiO2 | 100, 250, 500, 1000 мг/л | Снижение жизнеспособности, мембранная гиперполяризация | [121] |
| M. coruscus | TiO2 | 2.5, 10 мг/л | Повышение уровня АФК, снижение фагоцитоза и эстеразной активности с пониженным содержанием лизосом | [122–124, 127] |
| Mytilus galloprovincialis | CuO | 1, 2, 3 мг/л | Снижение скорости клиренса, скорости роста раковины | [166] |
| Scrobicularia plana | CuO | 10 мкг/л | Окислительный стресс | [167] |
| ZnO | 3 мг/кг | Повышение активности каталазы, снижение роющего поведения и скорости питания | [188] | |
| Черви | ||||
| Platynereis dumerilii | cit-НЧ Ag HA-НЧ Ag |
1, 10, 100 мкг/л | Дозозависимое снижение жизнеспособности вплоть до 100% с увеличением концентрации НЧ на всех стадиях развития, кроме взрослой формы червя | [142] |
| Hediste diversicolor | CuO | 10 мкг/л | Окислительный стресс | [167] |
| Brachionus plicatilis | TiO2 NiO Fe2O3 |
0, 8.2, 10.2, 12.8, 16.0, 20.0 мг/л | Не токсичны | [189] |
| Членистоногие | ||||
| Tisbe battagliai | НЧ Ag | 5.6–100 мкг/л | Увеличение летальности до 80% в максимальной концентрации | [33] |
| Artemia salina | НЧ Ag | 0–100 мг/л | Увеличение продукции АФК, снижение продукции SOD | [148, 149] |
| TiO2 NiO Fe2O3 |
0, 8.2, 10.2, 12.8, 16.0, 20.0 мг/л | Не токсичны | [189] | |
| Иглокожие | ||||
| Arbacia lixula, P. lividus Sphaerechinus granularis (зародыши) |
НЧ Ag | 1–100 мкг/л | Задержка развития зародышей и увеличение количества аномалий развития | [141] |
| Paracentrotus lividus | ZnO | 10, 100 мг/л | Аномалии развития эмбрионов, при увеличении концентрации –эмбриональная гибель | [131] |
| Хордовые | ||||
| Oryzias melastigma | ZnO | 4, 40 мг/л | Oкислительный стресс, клеточные повреждения | [32] |
Растет понимание угрозы, которую могут представлять НЧ для морской среды. Это подтверждают результаты многочисленных исследований последних лет, направленных на оценку токсичности НЧ металлов и их оксидов, включая Ag, Au, Cu и CuO, nZVI, TiO2, ZnO, по отношению к морским организмам с учетом размерных эффектов и физико-химических свойств НЧ. Имеющиеся данные показывают, что металлические НЧ могут негативно влиять на организмы различных систематических групп, таких как водоросли, бактерии, моллюски, черви, членистоногие, иглокожие, хордовые, наиболее часто исследования проводятся на водорослях и моллюсках. Токсические эффекты варьируются от нарушений репродукции до летального исхода. При этом информация о влиянии НЧ на морских позвоночных (например, морских рыб) крайне ограничена. Факторами, влияющими на токсичность НЧ в водной среде, являются физико-химические свойства самих НЧ, видовые особенности тест-объекта, а также параметры водной среды (в том числе соленость, температура, pH), однако точные закономерности, связывающие данные факторы и токсичность НЧ, до конца не выяснены. В частности, нет однозначного мнения о характере влияния солености водной среды на токсичность НЧ в ней. К предполагаемым механизмам нанотоксичности относят окислительный стресс, нарушение целостности клеточной мембраны, воспалительные процессы, приводящие к дисфункции клеток, а также повреждение ДНК и генетические мутации. Имеющиеся данные свидетельствуют о высоком потенциале биоаккумуляции НЧ в морских пищевых цепях, поскольку они могут легко сохраняться внутри организмов. Отсутствие стандартизированной методологии обнаружения металлических и металлооксидных НЧ и недостаточно разработанное законодательство затрудняют проведение экотоксикологической оценки нанозагрязнений морских экосистем. Все это указывает на необходимость проведения дальнейших исследований безопасности НЧ металлов по отношению к морским организмам, особенно представителям подтипа Позвоночные, оценки отдаленных эффектов, связанных с переходом и биоаккумуляцией НЧ в пищевых цепях морских экосистем, а также унификации используемых при этом научно-методических подходов. Важными задачами будущих исследований является уточнение роли факторов среды в усилении или ослаблении токсичности НЧ и определение механизмов нанотоксичности.
Работа выполнена при поддержке Тамбовского государственного университета им. Г.Р. Державина (грант для молодых ученых, приказ № 267 от 22 мая 2020 г.).
Список литературы
Yoganandham Suman T., Li W.-G., Pei D.-S. Ch. 5 – Toxicity of metal oxide nanoparticles // Nanotoxicity / Eds. Rajendran S. et al. Elsevier, 2020. P. 107.
Fu Y., Wan Q., Qin Z. et al. // Acta Geochimica. 2020. V. 39. P. 172.
Goswami L., Kim K.H., Deep A. et al.// J. Environ. Manage. 2017. V. 196. P. 297.
Mazur L.P., Cechinel M.A.P., de Souza S. et al. // J. Environ. Manage. 2018. V. 223. P. 215.
Zhang C., Hu Z., Deng B. // Water Res. 2016. V. 88. P. 403.
Baker T.J., Tyler C.R., Galloway T.S. // Environ. Pollut. 2014. V. 186. P. 257.
Asmathunisha N., Kathiresan K. // Colloids Surf. B. 2013. V. 103. P. 283.
Selvakumar P., Viveka S., Prakash S. et al. // Int. J. Pharma Bio Sci. 2012. V. 3. P. 188.
Rana A., Yadav K., Jagadevan S. // J. Cleaner Production. 2020. Art. № 122880.
Patil M., Kim G.-D. // Colloids Surf. B. 2018. V. 172. P. 487.
Hlongwane G., Sekoai P., Meyyappan M., Moothi K. // Sci. Total Environ. 2018. V. 656. P. 808.
Frank L.A., Onzi G.R., Morawski A.S. et al. // Reactive Funct. Polym. 2019. V. 147. Art. № 104459.
Shrestha S., Wang B., Dutta P. // Adv. Colloid Interface Sci. 2020. V. 279. Art. № 102162.
Zhao X., Liu W., Cai Z. et al. // Water Res. 2016. V. 100. P. 245.
Abdel-Latif H.M.R., Dawood M.A.O., Menanteau-Ledouble S., El-Matbouli M. // Ecotoxicol. Environ. Safety. 2020. V. 200. Art. № 110776.
Kühnel D., Böhme S., Altenburger R. // Sci. Total Environ. 2018. V. 635. P. 1170.
Wang Z., Zhang L., Zhao J., Xing B. // Environ. Sci. Nano. 2016. V. 3. P. 240.
Bakaraki T.N., Sari H., Onkal E.G., Bilgili M. // Process Safety Environ. Protection. 2019. V. 130. P. 238.
Joo S., Zhao D.E. // J. Hazardous Mater. 2016. V. 322. P. 29.
Zhang J., Guo W., Li Q. et al. // Environ. Sci. Nano. 2018. V. 5. P. 2482.
Kleiven M., Rosseland B.O., Teien H.C. et al. // Environ. Toxicol. Chem. 2018. V. 37. P. 2895.
Yoo-iam M., Chaichana R., Satapanajaru T. // Chem. Speciation Bioavailability. 2014. V. 26. P. 257.
Gambardella C., Gallus L., Gatti A.M. // Chem. Ecology. 2014. V. 30. P. 308.
Djearamane S., Ling S.W., Yang M.L., Lee P.F. // Pollut. Res. 2016. V. 35. P. 701.
Baun A., Hartmann N.B., Grieger K., Kusk K.O. // Ecotoxicology. 2008. V. 17. P. 387.
Vimercati L., Cavone D., Caputi A. et al. // Front. Public Health. 2020. V. 8. P. 192.
Canesi L., Corsi I. // Sci. Total Environ. 2016. V. 565. P. 933.
Canesi L., Ciacci C., Fabbri R. et al. // Mar. Environ. Res. 2011. V. 76. P. 16.
Minetto D., Volpi Ghirardini A., Libralato G. // Environ. Int. 2016. V. 92–93. P. 189.
French R., Jacobson A., Kim B. et al. // Environ. Sci. Technol. 2009. V. 43. P. 1354.
Quik J.T.K., Vonk J.A., Hansen S.F. et al. // Environ. Int. 2011. V. 37. P. 1068.
Wong S., Leung P., Djurisić A.B., Leung K. // Anal. Bioanal. Chem. 2009. V. 396. P. 609.
Macken A., Byrne H.J., Thomas K.V. // Ecotoxicol. Environ. Safety. 2012. V. 86. P. 101.
Kataoka C., Ariyoshi T., Kawaguchi H. et al. // Environ. Sci. Nano. 2015. V. 2. P. 94.
Moreno-Garrido I., Pérez S., Blasco J. // Mar. Environ. Res. 2015. V. 111. P. 60.
Aravantinou A.F., Tsarpali V., Dailianis S., Manariotis I.D. // Ecotoxicol. Environ. Safety. 2015. V. 114. P. 109.
Sripriya J., Anandhakumar S., Achiraman S. et al. // Int. J. Pharm. 2013. V. 457. P. 206.
Vance M.E., Kuiken T., Vejerano E.P. et al. // Beilstein J. Nanotechnol. 2015. V. 6. P. 1769.
Gottschalk F., Ort C., Scholz R.W., Nowack B. // Environ. Pollut. 2011. V. 159. P. 3439.
Sharma V., Filip J., Zboril R., Varma R. // Chem. Soc. Rev. 2015. V. 44. P. 8410.
Vaseeharan B., Ramasamy P., Chen J.C. // Lett. Appl. Microbiol. 2010. V. 50. P. 352.
Jayaseelan C., Rahuman A.A., Kirthi A.V. et al. // Mol. Biomol. Spectroscopy. 2012. V. 90. P. 78.
Swain P., Nayak S.K., Sasmal A. et al. // World J. Microbiol. Biotechnol. 2014. V. 30. P. 2491.
Shaalan M., Saleh M., El-Mahdy M., El-Matbouli M. // Nanomedicine: Nanotechnology, Biology and Medicine. 2016. V. 12. P. 701.
De Marchi L., Coppola F., Soares A.M.V.M. et al. // Environ. Res. 2019. V. 178. Art. № 108683.
Maurer-Jones M.A., Gunsolus I.L., Murphy C.J., Haynes C.L. // Anal. Chem. 2013. V. 85. P. 3036.
Sun T.Y., Gottschalk F., Hungerbühler K., Nowack B. // Environ. Pollut. 2014. V. 185. P. 69.
Gottschalk F., Lassen C., Kjoelholt J. et al. // Int. J. Environ. Res. Public Health. 2015. V. 12. P. 5581.
Giese B., Klaessig F., Park B. et al. // Sci. Rep. 2018. V. 8. P. 1565.
Tortella G.R., Rubilar O., Durán N. et al. // J. Hazardous Mater. 2020. V. 390. Art. № 121974.
He X., Deng H., Hwang H.-m. // J. Food Drug Analysis. 2019. V. 27. P. 1.
Xu Y., Li S., Yue X., Lu W. // BioResources. 2018. V. 13. P. 2150.
Das C.G., Kumar G., Dhas S. et al. // Biocatalysis Agricultural Biotechnology. 2020. Art. № 101593.
Mehrbod P., Motamed N., Tabatabaian M. et al. // DARU. 2015. V. 17. P. 88.
Kim K-.J., Sung W.S., Suh B.K. et al. // BioMetals. 2009. V. 22. P. 235.
Raut R.W., Mendhulkar V.D., Kashid S.B. // J. Photochem. Photobiol. B. 2014. V. 132. P. 45.
Drogat N., Granet R., Sol V. et al. // J. Nanopart. Res. 2011. V. 13. P. 1557.
Kumar S.S.D., Rajendran N.K., Houreld N.N., Abrahamse H. // Int. J. Biol.l Macromol. 2018. V. 115. P. 165.
Choudhury H., Pandey M., Lim Y.Q. et al. // Mater. Sci. Eng. C. 2020. V. 112. Art. № 110925.
Ma Y., Cai F., Li Y. et al. // Bioactive Mater. 2020. V. 5. P. 732.
Zhang Y., Chu W., Foroushani A.D. et al. // Materials (Basel). 2014. V. 7. P. 5169.
Zhang Y., Qian J., Wang D. et al. // Angewandte Chemie (International ed in English). 2013. V. 52. P. 1148.
Zhang Z., Wang J., Nie X. et al. // J. Am. Chem. Soc. 2014. V. 136. P. 7317.
Zhang L., Mazouzi Y., Salmain M. et al. // Biosensors Bioelectronics. 2020. V. 165. Art. № 112370.
Xiao T., Huang J., Wang D. et al. // Talanta. 2020. V. 206. Art. № 120210.
Si A., Pal K., Kralj S. et al. // Mater. Today Chem. 2020. V. 17. Art. № 100327.
Yin D., Li X., Ma Y., Liu Z. // Chem. Commun. 2017. V. 53. P. 6716.
Youssef A.M., Abdel-Aziz M.S., El-Sayed S.M. // Int. J. Biol. Macromol. 2014. V. 69. P. 185.
Elahi N., Kamali M., Baghersad M.H. // Talanta. 2018. V. 184. P. 537.
Yeo E.L.L., Cheah J.U.J., Neo D.J.H. et al. // J. Mater. Chem. B. 2017. V. 5. P. 254.
Szymański P., Frączek T., Markowicz M., Mikiciuk-Olasik E. // Biometals. 2012. V. 25. P. 1089.
Yang Q., Wang Y., Yang Q. et al. // Biomaterials. 2017. V. 146. P. 72.
Wu N., Zhang C., Wang C. et al. // Nanomedicine (Lond). 2018. V. 13. P. 1303.
Meghana S., Kabra P., Chakraborty S., Padmavathy N. // RSC Adv. 2015. V. 5. P. 12293.
Vaidehi D., Bhuvaneshwari V., Bharathi D., Sheetal B.P. // Mater. Res. Express. 2018. V. 5. Art. № 085403.
Wu Y., Guan C.-Y., Griswold N. et al. // J. Cleaner Production. 2020. V. 277. Art. № 123478.
Wang W., Zhao P., Hu Y., Zan R. // J. Cleaner Production. 2020. V. 262. Art. № 121341.
Tosco T., Papini M., Cruz Viggi C., Sethi R. // J. Cleaner Production. 2014. V. 77. P. 10.
Liu W., Tian S., Zhao X. et al. // Curr. Pollut. Rep. 2015. V. 1. P. 280.
Cuervo Lumbaque E., Lopes Tiburtius E.R., Barreto-Rodrigues M., Sirtori C. // Trends Environ. Anal. Chem. 2019. V. 24. P. e00069.
Su L., Shi X., Guo G. et al. // J. Mater. Cycles Waste Management. 2013. V. 15. P. 461.
Sekoai P.T., Ouma C.N.M., du Preez S.P. et al. // Fuel. 2019. V. 237. P. 380.
Baek G., Kim J., Lee C. // Renewable Sustainable Energy Reviews. 2019. V. 113. P. 109282.
Wu Y., Chen L., Chen F. et al. // Ecotoxicol. Environ. Safety. 2020. V. 202. P. 110911.
Guseva C.I., Fraize-Frontier S., Michel C., Charles S. // J. Exposure Sci. Environ. Epidemiol. 2019. V. 30. P. 430.
Weir A., Westerhoff P., Fabricius L. et al. // Environ. Sci. Technol. 2012. V. 46. P. 2242.
Shetti N.P., Bukkitgar S.D., Reddy K.R. et al. // Biosensors Bioelectronics. 2019. V. 141. P. 111417.
Tang K.S. // Life Sci. 2019. V. 239. Art. № 117011.
Weldegebrieal G.K. // Inorgan. Chem. Commun. 2020. V. 120. Art. № 108140.
El-saied H.A.-a., Ibrahim A.M. // J. Environ. Chem. Eng. 2020. V. 8. Art. № 103949.
Mahamuni-Badiger P.P., Patil P.M., Badiger M.V. et al. // Mater. Sci. Eng. C. 2020. V. 108. Art. № 110319.
Sruthi S., Ashtami J., Mohanan P.V. // Mater. Today Chem. 2018. V. 10. P. 175.
Mohammadpour R., Dobrovolskaia M.A., Cheney D.L. et al. // Adv. Drug Delivery Rev. 2019. V. 144. P. 112.
Verma N., Kumar N. // ACS Biomater. Sci. Eng. 2019. V. 5. P. 1170.
Gawande M.B., Goswami A., Felpin F.-X. et al. // Chem. Rev. 2016. V. 116. P. 3722.
Kaur R., Pal B. // Appl. Catalysis A: General. 2015. V. 491. P. 28.
Yin G., Nishikawa M., Nosaka Y. et al. // ACS Nano. 2015. V. 9. P. 2111.
Bhanushali S., Ghosh P., Ganesh A., Cheng W. // Small. 2014. V. 11. P. 1232.
Su Z., Li J., Zhang D. et al. // Sci. Total Environ. 2019. V. 647. P. 587.
Momeni S., Sedaghati F. // Microchem. J. 2018. V. 143. P. 64.
Alizadeh T., Mirzagholipur S. // Sensors Actuators B: Chemical. 2014. V. 198. P. 438.
Annanouch F.E., Haddi Z., Vallejos S. // ACS Appl. Mater. Interfaces. 2015. V. 7. P. 6842.
Nguyen T.T., Huy B.T., Hwang S.Y. et al. // Nanotechnology. 2018. V. 29. P. 205501.
Wang Y., Fan D., Wu D. et al. // Sensors Actuators B: Chemical. 2016. V. 236. P. 241.
Li F., Li Y., Feng J. et al. // Biosensors Bioelectronics. 2017. V. 87. P. 630.
Abiraman T., Ramanathan E., Kavitha G. et al. // Ultrasonics Sonochemistry. 2017. V. 34. P. 781.
Zhao C., Lv J., Xu X. et al. // J. Colloid Interface Sci. 2017. V. 505. P. 341.
Dong G., Wang H., Yan Z. et al. // Sci. Total Environ. 2020. V. 740. P. 140080.
Lee G.-J., Wu J.J. // Powder Technol. 2017. V. 318. P. 8.
Tada H., Naya S.-i., Fujishima M. // Electrochem. Commun. 2018. V. 97. P. 22.
Sendra M., Moreno-Garrido I., Yeste M.P. et al. // Environ. Pollut. 2017. V. 227. P. 39.
Hu J., Wang J., Liu S. et al. // J. Environ. Sci. 2018. V. 66. P. 208.
Matouke M.M., Elewa D.T., Abdullahi K. // Aquatic Toxicol. 2018. V. 198. P. 40.
Wu D., Yang S., Du W. et al. // J. Hazardous Mater. 2019. V. 377. P. 1.
Miller R.J., Lenihan H.S., Muller E.B. et al. // Environ. Sci. Technol. 2010. V. 44. P. 7329.
Heinlaan M., Ivask A., Blinova I. et al. // Chemosphere. 2008. V. 71. P. 1308.
Dwivedi A.D., Dubey S.P., Sillanpää M. et al. // Coord. Chem. Rev. 2015. V. 287. P. 64.
Libralato G., Minetto D., Totaro S. et al. // Mar. Environ. Res. 2013. V. 92. P. 71.
Girardello F., Custódio Leite C., Vianna V.I. et al. // Aquat. Toxicol. 2016. V. 170. P. 223.
Girardello F., Leite C.C., Branco C.S. et al. // Aquatic Toxicol. 2016. V. 176. P. 190.
Pikula K., Chaika V., Zakharenko A. et al. // Animals. 2020. V. 10. P. 827.
Hu M., Lin D., Shang Y. et al. // Sci. Rep. 2017. V. 7. Art. № 40015.
Huang X., Lin D., Ning K. et al. // Aquatic Toxicol. 2016. V. 180. P. 1.
Kong H., Wu F., Jiang X. et al. // Chemosphere. 2019. V. 237. Art. № 124561.
Shang Y., Wu F., Wei S. et al. // Chemosphere. 2020. V. 241. Art. № 125104.
Shi W., Han Y., Guo C. et al. // Sci. Rep. 2019. V. 9. Art. № 3516.
Huang X., Liu Z., Xie Z. et al. // Mar. Environ. Res. 2018. V. 137. P. 49.
Suman T.Y., Radhika Rajasree S.R., Kirubagaran R. // Ecotoxicol. Environ. Safety. 2015. V. 113. P. 23.
Manzo S., Miglietta M.L., Rametta G. et al. // Sci. Total Environ. 2013. V. 445–446. P. 371.
Peng X., Palma S., Fisher N.S., Wong S.S. // Aquatic Toxicol. 2011. V. 102. P. 186.
Manzo S., Miglietta M.L., Rametta G. et al. // J. Hazardous Mater. 2013. V. 254–255. P. 1.
Buffet P.-E., Amiard-Triquet C., Dybowska A. et al. // Ecotoxicol. Environ. Safety. 2012. V. 84. P. 191.
Trevisan R., Delapedra G., Mello D.F. et al. // Aquatic Toxicol. 2014. V. 153. P. 27.
Duran N., Durán M., Souza C. // J. Brazilian Chem. Soc. 2017. V. 28. P. 927.
Akter M., Sikder M.T., Rahman M.M. et al. // J. Adv. Res. 2018. V. 9. P. 1.
Lekamge S., Miranda A.F., Abraham A. et al. // Front. Environ. Sci. 2018. V. 6. P. 152.
Oukarroum A., Bras S., Perreault F., Popovic R. // Ecotoxicol. Environ. Saf. 2012. V. 78. P. 80.
Chan C.Y., Chiu J.M. // PLoS One. 2015. V. 10. P. e0132457.
Sendra M., Yeste M.P., Gatica J.M. et al. // Chemosphere. 2017. V. 179. P. 279.
Zheng S., Zhou Q., Chen C. et al. // Sci. Total Environ. 2019. V. 660. P. 1182.
Burić P., Jakšić Ž., Štajner L. et al. // Mar. Environ. Res. 2015. V. 111. P. 50.
García-Alonso J., Rodriguez-Sanchez N., Misra S. et al. // Sci. Total Environ. 2014. V. 476–477. P. 688.
Zuykov M., Pelletier E., Belzile C., Demers S. // Chemosphere. 2011. V. 84. P. 701.
Ringwood A.H., McCarthy M., Bates T.C., Carroll D.L. // Mar. Environ. Res. 2010. V. 69. P. S49.
Bacchetta C., Ale A., Simoniello M.F. et al. // Ecological Indicators. 2017. V. 76. P. 230.
Miao A.J., Schwehr K.A., Xu C. et al. // Environ. Pollut. 2009. V. 157. P. 3034.
Stevenson L.M., Dickson H., Klanjscek T. et al. // PLoS One. 2013. V. 8. P. e74456.
An H.J., Sarkheil M., Park H.S. et al. // Comparative Biochem. Physiol. C. 2019. V. 218. P. 62.
Becaro A.A., Jonsson C.M., Puti F.C. et al. // Environ. Nanotechnology, Monitoring Management. 2015. V. 3. P. 22.
Wang J., Wang W.-X. // Environ. Sci. Technol. 2014. V. 48. P. 8152.
Liao C., Li Y., Tjong S.C. // Int. J. Mol. Sci. 2019. V. 20. P. 449.
Tripathi D.K., Tripathi A., Shweta et al. // Front. Microbiol. 2017. V. 8. P. 7.
Durán N., Durán M., de Jesus M.B. et al. // Nanomed. Nanotechnol. Biol. Med. 2016. V. 12. P. 789.
McShan D., Ray P.C., Yu H. // J. Food Drug Anal. 2014. V. 22. P. 116.
Auffan M., Rose J., Wiesner M., Bottero J.-Y. // Environ. Pollut. 2009. V. 157. P. 1127.
Perreault F., Bogdan N., Morin M. et al. // Nanotoxicology. 2012. V. 6. P. 109.
Hou W.-C., Moghadam B.Y., Corredor C. et al. // Environ. Sci. Technol. 2012. V. 46. P. 1869.
Tatur S., Maccarini M., Barker R. et al. // Langmuir: the ACS journal of surfaces and colloids. 2013. V. 29. P. 6606.
Caballero-Díaz E., Valcárcel M. Ch. 5 - Toxicity of Gold Nanoparticles // Comprehensive Analytical Chemistry / Eds. Valcárcel M., López-Lorente Á.I. Elsevier. 2014. V. 66. P. 207.
Tedesco S., Doyle H., Redmond G., Sheehan D. // Mar. Environ. Res. 2008. V. 66. P. 131.
Tedesco S., Doyle H., Blasco J. et al. // Aquatic Toxicol. (Amsterdam, Netherlands) 2010. V. 100. P. 178.
Tedesco S., Doyle H., Blasco J. et al. // Aquatic Toxicol. 2010. V. 100. P. 178.
Sellami B., Mezni A., Khazri A. et al. // Aquatic Toxicol. 2017. V. 188. P. 10.
Shi W.-Z., Liang Y.-S., Lu B. et al. // Química Nova. 2019. V. 42. P. 638.
Zhu X., Zhao W., Chen X. et al. // Mar. Environ. Res. 2020. V. 158. P. 105005.
Hanna S.K., Miller R.J., Lenihan H.S. // Nanomaterials. 2014. V. 4. P. 535.
Buffet P.-E., Tankoua O.F., Pan J.-F. et al. // Chemosphere. 2011. V. 84. P. 166.
Xu L., Wang Z., Zhao J. et al. // Environ. Pollut. 2020. V. 260. P. 114043.
Gallo A., Manfra L., Boni R. et al. // Environ. Int. 2018. V. 118. P. 325.
Giannetto A., Cappello T., Oliva S. et al. // Aquatic Toxicol. 2018. V. 201. P. 187.
Keller A.A., Garner K., Miller R.J., Lenihan H.S. // PLoS One. 2012. V. 7. P. e43983.
Pikula K., Mintcheva N., Kulinich S.A. et al. // Environ. Res. 2020. V. 186. P. 109513.
Falugi C., Aluigi M.G., Chiantore M.C. et al. // Mar. Environ. Res. 2012. V. 76. P. 114.
Gonçalves J.M., Rocha T., Mestre N.C. et al. // Mar. Environ. Res. 2020. V. 156. P. 104904.
Yan K., Liu Y., Yang Q. et al. // Ecotoxicol. Environ. Safety. 2019. V. 171. P. 728.
Chen X., Zhang C., Tan L., Wang J. // Environ. Pollut. 2018. V. 236. P. 454.
Gong N., Shao K., Che C., Sun Y. // Mar. Pollut. Bulletin. 2019. V. 149. P. 110532.
Crisponi G., Nurchi V.M., Lachowicz J.I. et al. Ch. 18 - Toxicity of Nanoparticles: Etiology and Mechanisms // Antimicrobial Nanoarchitectonics / Ed. Grumezescu A.M. Elsevier, 2017. P. 511.
Hou J., Wang L., Wang C. et al. // J. Environ. Sci. 2019. V. 75. P. 40.
Johari S.A., Sarkheil M., Behzadi T.M., Veisi S. // Chemosphere. 2018. V. 209. P. 156.
Salari J.H., Kalbassi M.R., Johari S.A. // Iranian J. Health Environ. 2012. V. 5. P. 121.
Rotini A., Tornambè A., Cossi R. et al. // Front. Microbiol. 2017. V. 8. P. 2076.
Lai R.W.S., Yung M.M.N., Zhou G.-J. et al. // Environ. Sci. Nano. 2020. V. 7. P. 2995.
van Hoof L., Fabi G., Johansen V. et al. // Mar. Policy. 2019. V. 105. P. 44.
Roma J., Matos A.R., Vinagre C., Duarte B. // Mar. Environ. Res. 2020. V. 161. P. 105110.
Ramakrishnan B., Megharaj M., Venkateswarlu K. et al. // Critical Rev. Environ. Sci. Technol. 2010. V. 40. P. 699.
Zhang C., Chen X., Tan L., Wang J. // Environ. Sci. Pollut. Res. 2018. V. 25. P. 13127.
Buffet P.E., Amiard-Triquet C., Dybowska A. et al. // Ecotoxicol. Environ. Saf. 2012. V. 84. P. 191.
Nogueira V., Lopes I., Rocha-Santos T.A.P. et al. // Environ. Sci. Pollut. Res. 2015. V. 22. P. 13212.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии