Российские нанотехнологии, 2021, T. 16, № 4, стр. 553-557
Биодеградируемые микрочастицы для регенерации костной ткани на основе полилактида и наночастиц гидроксиапатита
Т. В. Черненок 1, Л. А. Киляшова 1, Н. Н. Исраилова 1, Т. Н. Попырина 2, Т. С. Демина 1, 2, 3, *
1 Московский авиационный институт (Национальный исследовательский университет)
Москва, Россия
2 Институт синтетических полимерных материалов им. Н.С. Ениколопова РАН
Москва, Россия
3 Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский университет)
Москва, Россия
* E-mail: detans@gmail.com
Поступила в редакцию 07.09.2020
После доработки 26.11.2020
Принята к публикации 26.01.2021
Аннотация
Исследован процесс формования гибридных микрочастиц из биодеградируемого сложного полиэфира – полилактида – и наночастиц гидроксиапатита, которые могут быть перспективны в качестве клеточных микроносителей или исходных материалов для получения трехмерных матриксов для регенерации костной ткани. Разработан метод формования гибридных микрочастиц методом испарения растворителей из эмульсий масло/вода без применения дополнительных эмульгаторов в дисперсионной среде. Показано, что наночастицы гидроксиапатита могут эффективно стабилизировать границу раздела фаз в процессе получения микрочастиц. Оценено влияние концентрации наночастиц гидроксиапатита и их предварительного диспергирования с помощью ультразвуковой обработки на выход микрочастиц, их распределение по размерам и морфологию.
ВВЕДЕНИЕ
Одной из наиболее острых тематик современного материаловедения является разработка материалов для биомедицины. Среди огромного количества используемых в биомедицине форм материалов выделяются нано/микрочастицы, имеющие широкий диапазон применения: от систем адресной доставки до мультифункциональных материалов. При этом, если наночастицы в основном используют только для доставки биоактивных/лекарственных соединений, то микрочастицы (МЧ) обладают более широким функционалом, который напрямую зависит от степени контроля над их структурой/свойствами. МЧ традиционно используют в качестве подложек с большой площадью поверхности для культивирования субстрат-зависимых клеток in vitro, но в рамках современной концепции регенеративной медицины МЧ рассматриваются и в качестве биорезорбируемых матриксов для тканевой инженерии, которые могут быть наполнены биологически активными компонентами/лекарствами [1–4]. В этом случае МЧ можно применять как инжектируемые матриксы или как исходные материалы для создания изделий заданной архитектуры [4–6].
Состав и структура МЧ для применения в тканевой инженерии должны соответствовать типу ткани, которую они будут временно замещать. В качестве основного полимерного компонента в подавляющем большинстве случаев используют биодеградируемые сложные полиэфиры (полилактид, поликапролактон и их сополимеры), имеющие долгую историю успешного применения в медицине [7–10]. Наиболее популярным дополнительным компонентом при получении МЧ является гидроксиапатит (ГА) – основной неорганический компонент костных структур в организме человека, – используемый для придания МЧ или материалам на их основе остеокондуктивных свойств и биоактивности в отношении остеобластов [11–13]. В процессе деградации полимерной матрицы ГА высвобождается и используется как строительный материал для формирования костной ткани in vivo. В зависимости от желаемого профиля высвобождения, количества и специфики применения для регенерации костной ткани существуют различные типы структур гибридных полимер/гидроксиапатитных МЧ, различающиеся, в том числе, методикой получения. Для формирования покрытия из ГА на полимерных МЧ используют различные методы активации поверхности и ее последующую биоминерализацию [14, 15]. Однако большинство методик основано на получении гибридных МЧ in situ в процессе их формирования методом испарения растворителя из эмульсий. В качестве дисперсной фазы используют дисперсию наночастиц гидроксиапатита (нГА) в растворе полимера, а дисперсионная “водная” среда содержит традиционный синтетический эмульгатор [5, 16–18]. Возможность получения гибридных МЧ без использования дополнительного эмульгатора описана в цикле работ [19–21], где обе фазы дисперсии содержали прекурсоры ГА и его синтез осуществлялся в процессе формования МЧ. В связи с увеличивающимся интересом к биодеградируемым гибридным МЧ со стороны регенеративной медицины необходимо разработать более простые методы получения полимер/керамических МЧ с контролируемой структурой и морфологией.
Целью работы являлось исследование возможности получения методом испарения из эмульсий масло/вода гибридных микрочастиц на основе полилактида и наночастиц гидроксиапатита без применения дополнительных эмульгаторов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали полилактид с молекулярной массой 100 кДа марки Natureworks 4043D (США) и наночастицы гидроксиапатита (Sigma-Aldrich) размером ≤200 нм. Растворители марки ХЧ производства “Химмед” (Россия) использовали без дополнительной очистки.
Гибридные МЧ формовали методом испарения растворителя из эмульсий масло/вода [22]. МЧ из полилактида, поверхность которых обогащена нГА, получали с использованием дисперсии нГА в дистиллированной воде в качестве дисперсионной среды, а дисперсной фазой выступал раствор полилактида (6 мас. %) в смеси растворителей дихлорметан/ацетон. В рамках исследования варьировали концентрацию нГА (0.1–1 мас. %) в дисперсионной среде и методику ее подготовки. Наночастицы гидроксиапатита диспергировали в дистиллированной воде, перемешивая на магнитной мешалке или дополнительно обрабатывая ультразвуком (УЗ) на установке И-10/0.63 (Россия) при частоте 23 кГц в течение 3 мин. Влияние УЗ-обработки на размер диспергированных в воде нГА оценивали методом динамического лазерного рассеяния света (ДЛРС) с помощью Zetatrac (Microtrac, США) с использованием программы Microtrac V 10.5.3. Процесс формирования всех типов гибридных МЧ состоял в эмульгировании дисперсной фазы в дисперсионной среде в соотношении 9/1 об./об. с использованием верхнеприводной мешалки, оснащенной четырехлопастным мешальником с диаметром лопастей 25 мм, при контролируемой температуре до полного испарения растворителей из дисперсной фазы [23]. Вследствие этого эмульсия переходила в суспензию твердых МЧ, которые фракционировали по размерам на наборе сит с размером пор 100, 200, 315 и 400 мкм и промывали дистиллированной водой. Полученные МЧ сушили лиофильно.
Выход МЧ и вклад каждой фракции оценивали гравиметрически по формуле: M = (Mф/Mдф) × × 100%, где М – процент выхода фракции МЧ определенного типа с целевым диаметром, Mф – масса МЧ в данной фракции, Mдф – масса полимера, растворенного в дисперсной фазе. Общий выход МЧ определенного типа рассчитывали суммированием выхода всех фракций.
Морфологию поверхности МЧ и ее элементный состав исследовали методами сканирующей электронной микроскопии (СЭМ) и энергодисперсионной спектроскопии с использованием Phenom ProX (США).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Учитывая широкое применение именно наноформ ГА, для получения гибридных МЧ использовали коммерчески доступные нГА размером до 200 нм. В настоящее время наночастицы различной природы получили широкое распространение в качестве эмульгаторов для стабилизации границы раздела фаз в так называемых эмульсиях Пикеринга [24–26]. В отличие от эмульсий, стабилизируемых традиционными молекулярными/макромолекулярными эмульгаторами, эмульсии Пикеринга более устойчивы к коалесценции и требуют меньшей концентрации наночастиц для стабилизации границы раздела фаз. Современные работы по эмульсиям Пикеринга во многом направлены на поиск и исследование биосовместимых/биодеградируемых наночастиц, способных выступать в качестве эмульгаторов, в том числе, в процессе получения полимерных МЧ для пищевой промышленности и биомедицины [27–30]. В настоящей работе оценивали возможность применения нГА в качестве эмульгаторов в дисперсионной среде без введения дополнительных молекулярных эмульгаторов.
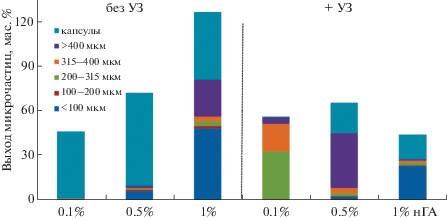
Использование в качестве дисперсионной среды дисперсий нГА в дистиллированной воде позволило получить МЧ из полилактида с выходом от 44 до 126 мас. % в зависимости от концентрации нГА (0.1–1 мас. %) и условий подготовки дисперсионной среды (с/без УЗ-обработки) (рис. 1). Без использования предварительной УЗ-обработки выход МЧ увеличивался при увеличении концентрации нГА в дисперсионной среде. Также с увеличением содержания нГА наблюдается уменьшение среднего размера МЧ, что видно на рис. 1 из распределения вклада фракций МЧ с разными диаметрами. Средний размер МЧ, стабилизированных 0.1 мас. % дисперсией нГА, составлял ∼250 мкм, а при увеличении концентрации нГА в дисперсионной среде до 1 мас. % средний размер МЧ уменьшался до ∼100 мкм. Достижение общего выхода МЧ 126 мас. % при использовании 1 мас. % связано, вероятно, с частичной иммобилизацией и “захватом” нГА из дисперсионной среды. Для подтверждения присутствия ГА на поверхности сформованных МЧ использовали энергодисперсионную спектроскопию, которая показала значительную концентрацию атомов кальция (13.1 ± 0.3 ат. %) и фосфора (5.3 ± 0.2 ат. %), характерных для ГА. Предварительная УЗ-обработка дисперсионной среды, направленная на диспергирование нГА в воде, привела к снижению эффективности стабилизации границы раздела фаз масло/вода в процессе получения МЧ. Выход МЧ в этом случае варьировался от 44 до 66 мас. % и прямой его зависимости от концентрации нГА в дисперсионной среде не наблюдалось. Интересным эффектом УЗ-обработки водных дисперсий нГА на структуру и свойства стабилизируемых ими наночастиц является снижение относительного вклада “капсул” – полых МЧ размером более 400 мкм. Видимо, УЗ-обработка нГА в воде позволяет не только их диспергировать, но и убрать воздух из их агрегатов.
Рис. 1.
Гистограмма выхода и распределения по размерам гибридных микрочастиц, полученных с использованием различных концентраций нГА в дисперсионной среде.
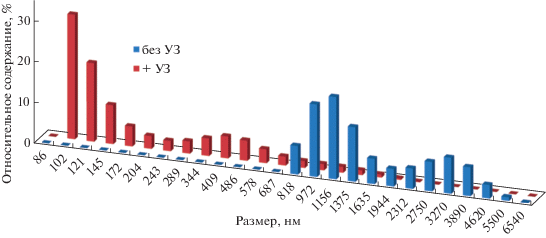
Исследование влияния предварительной УЗ-обработки водных дисперсий нГА на размер наночастиц и их агрегатов проводили с помощью ДЛРС. Как видно из рис. 2, без дополнительного диспергирования нГА в воде они образуют крупные агрегаты, размер которых увеличивается при увеличении концентрации и достигает микронного размера (∼1.2 мкм). Обработка УЗ позволяет снизить средний размер частиц до ∼100 нм. Следовательно, УЗ-обработка обеспечила диспергирование нГА в воде, что, тем не менее, негативно сказалось на выходе гибридных МЧ.
Исследование морфологии МЧ показало, что их форма также существенно зависит от подготовки дисперсионной среды. Без предварительной УЗ-обработки форма получаемых МЧ сферическая, а диспергирование нГА приводит к образованию частиц неправильной морфологии (рис. 3). Вероятно, такая морфология связана с образованием жесткой границы раздела фаз из нГА и затруднением в уменьшении ее площади при испарении растворителей из дисперсной фазы (раствор полилактида). Без предварительной УЗ-обработки границу раздела фаз стабилизируют агрегаты нГА, которые могут разрушаться и таким образом обеспечивать ее перестройку с сохранением сферической формы МЧ. Подобный результат наблюдался в случае использования нанокристаллического хитина с разной степенью анизотропии [29].
Рис. 3.
Микрочастицы из полилактида, полученные при использовании в качестве дисперсионной среды дисперсий нГА (1 мас. %): а – без УЗ-обработки, б – с предварительной УЗ-обработкой дисперсионной среды. Масштабная линейка 100 мкм.

Таким образом, для получения гибридных МЧ оптимально использовать дисперсии нГА без предварительной УЗ-обработки в качестве дисперсионной среды, что приводит к получению МЧ сферической формы с высоким выходом.
ЗАКЛЮЧЕНИЕ
Наночастицы гидроксиапатита способны эффективно стабилизировать границу раздела фаз масло/вода в процессе получения биодеградируемых микрочастиц из полилактида методом испарения растворителей из эмульсий. Использование дисперсии нГА в воде в качестве дисперсионной среды позволяет получать сферические гибридные МЧ с выходом, сопоставимым с выходом, который обеспечивают классические макромолекулярные эмульгаторы. С увеличением концентрации наночастиц в дисперсионной среде увеличивается общий выход МЧ. Предварительная обработка ультразвуком дисперсий наночастиц в воде обеспечивает их диспергирование, но это снижает эффективность применения таких дисперсий в качестве дисперсионной среды при получении МЧ, что выражается в снижении общего выхода МЧ и потере их сферической формы.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации и Russian academic excellence project “5–100”.
Список литературы
Hernández R.M., Orive G., Murua A., Pedraz J.L. // Adv. Drug Deliv. Rev. 2010. V. 62. № 7–8. P. 711. https://doi.org/10.1016/j.addr.2010.02.004
Li B., Wang X., Wang Y. et al. // J. Orthop. Transl. 2015. V. 3. № 2. P. 51. https://doi.org/10.1016/j.jot.2015.02.003
Chen X.Y., Chen J.Y., Tong X.M. et al. // Biotechnol. Lett. 2020. V. 42. № 1. P. 1. https://doi.org/10.1007/s10529-019-02738-7
Neto M.D., Oliveira M.B., Mano J.F. // Trends Biotechnol. 2019. V. 37. № 9. P. 1011. https://doi.org/10.1016/j.tibtech.2019.02.008
Zhou W.Y., Lee S.H., Wang M. et al. // J. Mater. Sci. Mater. Med. 2008. V. 19. № 7. P. 2535. https://doi.org/10.1007/s10856-007-3089-3
Antonov E.N., Krotova L.I., Minaev N.V. et al. // Quantum Electron. 2015. V. 45. № 11. P. 1023. https://doi.org/10.1016/j.tibtech.2019.02.008
Sawalha H., Schroën K., Boom R. // Chem. Eng. J. 2011. V. 169. № 1–3. P. 1. https://doi.org/10.1016/j.cej.2011.02.078
Gritsch L., Conoscenti G., La Carrubba V. et al. // Mater. Sci. Eng. C. 2019. V. 94. P. 1083. https://doi.org/10.1016/j.msec.2018.09.038
Madhavan Nampoothiri K., Nair N.R., John R.P. // Bioresour. Technol. 2010. V. 101. № 22. P. 8493. https://doi.org/10.1016/j.biortech.2010.05.092
Molavi F., Barzegar-Jalali M., Hamishehkar H. // J. Control. Release. 2020. V. 320. P. 265. https://doi.org/10.1016/j.jconrel.2020.01.028
Ramesh N., Moratti S.C., Dias G.J. // J. Biomed. Mater. Res. B. 2018. V. 106. № 5. P. 2046. https://doi.org/10.1002/jbm.b.33950
Haider A., Haider S., Han S.S., Kang I.K. // RSC Adv. Royal Soc. Chem. 2017. V. 7. № 13. P. 7442. https://doi.org/10.1039/C6RA26124H
Venkatesan J., Kim S.-K. // J. Biomed. Nanotechnol. 2014. V. 10. № 10. P. 3124. https://doi.org/10.1166/jbn.2014.1893
Shi X., Jiang J., Sun L., Gan Z. // Colloids Surf. B. 2011. V. 85. № 1. P. 73. https://doi.org/10.1016/j.colsurfb.2010.11.016
Chen S., Guo R., Xie C. et al. // Mater. Sci. Eng. C. 2020. V. 110. P. 110655. https://doi.org/10.1016/j.msec.2020.110655
Della Porta G., Campardelli R., Cricchio V. et al. // J. Pharm. Sci. 2016. V. 105. № 7. P. 2164. https://doi.org/10.1016/j.xphs.2016.05.002
Wijerathne H.M.C.S., Yan D., Zeng B. et al. // SN Appl. Sci. 2020. V. 2. № 4. P. 722. https://doi.org/10.1007/s42452-020-2531-8
Liu R., Chen Y., Liu L. et al. // J. Mater. Chem. B. 2018. V. 6. № 19. P. 3085. https://doi.org/10.1039/C8TB00324F
Nagata F., Miyajima T., Yokogawa Y. // Chem. Lett. 2003. V. 32. № 9. P. 784. https://doi.org/10.1246/cl.2003.784
Nagata F., Miyajima T., Yokogawa Y. // J. Eur. Ceram. Soc. 2006. V. 26. № 4–5. P. 533. https://doi.org/10.1016/j.jeurceramsoc.2005.06.006
Nagata F., Miyajima T., Kato K.P. // Adv. Powder Technol. 2016. V. 27. № 3. P. 903. https://doi.org/0.1016/j.apt.2016.02.007
Campos E., Branquinho J., Carreira A.S. et al. // Eur. Polym. J. 2013. V. 49. № 8. P. 2005. https://doi.org/10.1016/j.eurpolymj.2013.04.033
Demina T.S., Akopova T.A., Vladimirov L.V. et al. // Mater. Sci. Eng. C. 2016. V. 59. P. 333. https://doi.org/10.1016/j.msec.2015.09.094
Chevalier Y., Bolzinger M.A. // Colloids Surf. A. 2013. V. 439. P. 23. https://doi.org/10.1016/j.colsurfa.2013.02
Wu J., Ma G.H. // Small. 2016. V. 12. № 34. P. 4633. https://doi.org/10.1002/smll.201600877
Calabrese V., Courtenay J.C., Edler K.J., Scott J.L. // Curr. Opin. Green Sustain. Chem. 2018. V. 12. P. 83. https://doi.org/10.1016/j.cogsc.2018.07.002
Linke C., Drusch S. // Crit. Rev. Food Sci. Nutr. 2018. V. 58. № 12. P. 1971. https://doi.org/10.1080/10408398.2017.1290578
Wei Z., Wang C., Zou S. et al. // Polymer (Guildf). 2012. V. 53. № 6. P. 1229. https://doi.org/10.1016/j.polymer.2012.02.015
Demina T.S., Sotnikova Y.S., Istomin A.V. et al. // Adv. Mater. Sci. Eng. 2018. V. 2018. P. 1. https://doi.org/10.1155/2018/8518016
Sotnikova Y.S., Demina T.S., Istomin A.V.V. et al. // IOP Conf. Ser. Mater. Sci. Eng. 2018. V. 347. № 1. P. 012006. https://doi.org/10.1088/1757-899X/347/1/012006
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии