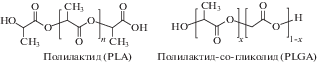Российские нанотехнологии, 2021, T. 16, № 4, стр. 462-481
НАНОСОМАЛЬНЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ НА ОСНОВЕ БИОРАЗЛАГАЕМЫХ СОПОЛИМЕРОВ ЛАКТИДА С РАЗЛИЧНОЙ МОЛЕКУЛЯРНОЙ СТРУКТУРОЙ И АРХИТЕКТУРОЙ
Н. Г. Седуш 1, *, Ю. А. Кадина 1, Е. В. Разуваева 1, А. А. Пучков 1, Е. М. Широкова 1, В. И. Гомзяк 1, К. Т. Калинин 1, А. И. Кулебякина 1, С. Н. Чвалун 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: Sedush_NG@nrcki.ru
Поступила в редакцию 10.10.2020
После доработки 26.01.2021
Принята к публикации 26.01.2021
Аннотация
Современная фармацевтика активно развивается в направлении создания лекарственных средств адресного действия. Разработка селективно действующих лекарственных форм требует создания “умных” систем доставки на основе носителей, которые бы сначала находили целевые клетки и проникали в них, а затем локально высвобождали активное вещество. В качестве таких носителей могут быть эффективно использованы наночастицы биосовместимых и биоразлагаемых полимеров. Гибкое регулирование молекулярной структуры и архитектуры полимеров, а также модификация наночастиц векторными молекулами позволяет конструировать частицы-носители для создания наносомальных форм активных агентов различной природы. В обзоре представлены основные подходы в дизайне наносомальных лекарственных форм адресного действия, описаны методы получения и исследования наночастиц на основе гидрофобных и амфифильных биоразлагаемых полимеров лактида, подробно обсуждается влияние молекулярной структуры и условий получения на характеристики наночастиц. Представлены и отдельные результаты работы в этом направлении Курчатовского комплекса НБИКС-природоподобных технологий.
ОГЛАВЛЕНИЕ
Введение
1. Основные принципы дизайна наносомальных форм
1.1. Активное и пассивное нацеливание для доставки в раковую опухоль
1.2. Время циркулирования наночастиц в кровотоке
1.3. Визуализация наночастиц
1.4. Нанотехнологии для создания вакцин и лекарств против вирусных инфекций
2. Получение, структура и свойства наночастиц на основе поли(лактид-со-гликолида)
2.1. Методы получения PLGA-наночастиц. Механизм наноосаждения
2.2. Малоугловое рентгеновское рассеяние для исследования размера и морфологии
2.3. Загрузка противораковых агентов в наночастицы PLGA
3. Наночастицы на основе амфифильных блок-сополимеров ПЛА-б-ПЭГ
3.1. Влияние стереорегулярности гидрофобного ПЛА-блока на характеристики наночастиц, загрузку и высвобождение активного агента
3.2. Влияние длины гидрофобного ПЛА-блока на размер, морфологию и солюбилизирующую способность наночастиц
3.3. Наночастицы на основе разветвленных амфифильных сополимеров
Заключение
ВВЕДЕНИЕ
Развитие нанотехнологий открыло принципиально новые возможности в разработке систем доставки лекарств [1, 2]. Создание комплексов на основе наночастиц-носителей и биологически активных агентов позволяет решить целый спектр проблем, свойственных традиционным лекарственным формам, и значительно повысить их терапевтическую эффективность. Помимо снижения побочных эффектов, повышения растворимости, стабильности и биодоступности лекарственных соединений технологии наномедицины могут обеспечить селективную (адресную) доставку активного соединения в больной орган или ткань, его пролонгированное высвобождение, преодоление разнообразных биологических барьеров, например гематоэнцефалического [3]. Разработаны подходы для запрограммированного высвобождения лекарства из наночастицы (НЧ) “по запросу” под действием внешнего стимула [4]. Активно развивается область нанотераностики – разработка наноформ, сочетающих в себе одновременно диагностическую и терапевтическую функции [5]. Дороговизна и длительный процесс поиска и синтеза новых биологически активных молекул делают актуальной разработку более эффективных и безопасных лекарственных форм уже существующих фармацевтически активных веществ.
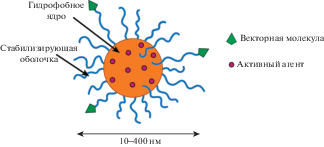
Наночастицы, применяемые в фармацевтике, определяют как коллоидные частицы размером от 10 до 400 нм, в которых активный агент растворен, загружен, сорбирован, инкапсулирован или связан ковалентно. На сегодня разработан большой спектр наночастиц-носителей различной природы и структуры: дендримеры [6], липосомы [7, 8], полимерные НЧ [9–11], неорганические соединения [12] и др. Особый интерес для разработки систем доставки лекарств представляют биоразлагаемые полимеры, носители на основе которых деградируют после выполнения своей функции и не наносят вреда организму. Существуют различные природные и синтетические биодеградируемые полимеры, среди которых широко применяются полимеры на основе лактида. Свойства и сроки деградации этих материалов можно регулировать за счет изменения молекулярной массы, энантиомерного состава (содержание L- и D-лактида в полимерной цепи), сополимеризации с другими циклическими эфирами (гликолид, ε-капролактон и др.), модификации концевых групп и различных видов постобработки. Полилактид и его сополимеры наиболее часто используются для изготовления имплантатов, скаффолдов и систем доставки лекарств благодаря их отличной биосовместимости и гибкости в синтезе, обеспечивающей получение материалов с заранее заданными свойствами и сроками деградации от нескольких недель до нескольких лет. Ввиду хорошей растворимости и достаточно быстрой деградации для получения полимерных микро- и наночастиц наиболее часто применяют сополимеры D,L-лактида с гликолидом (ПЛГА, PLGA) с относительным составом 50:50 и 75:25. На их основе разработаны и выпущены на рынок многие препараты. Эти гидрофобные полимеры являются хорошим резервуаром для загрузки в них гидрофобных активных агентов, высвобождение которых происходит посредством диффузии и дополнительно ускоряется на поздних сроках вследствие деградации полимера. Для стабилизации гидрофобных НЧ на основе PLGA используют различные амфифильные соединения (сополимеры пропиленоксида с этиленоксидом – плюроники, поливиниловый спирт и др.).
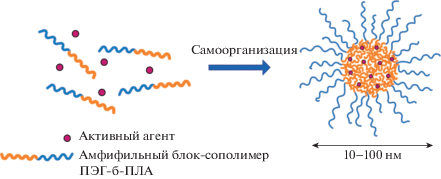
Развитие методов синтеза привело к созданию амфифильных биоразлагаемых полимеров с ковалентно связанными гидрофобным блоком полилактида и гидрофильным блоком полиэтиленоксида. Такие сополимеры способны к самоорганизации в различные наноструктуры (мицеллы, частицы, полимеросомы и др.), морфология и размер которых определяются молекулярной структурой и архитектурой блок-сополимера, а также во многом зависят от метода получения НЧ. Эти же параметры позволяют контролировать эффективность загрузки и кинетику высвобождения лекарственного агента. Широкий набор инструментов позволяет разработчикам очень гибко конструировать наносомальную лекарственную форму для адресной доставки активных молекул различной природы.
1. ОСНОВНЫЕ ПРИНЦИПЫ ДИЗАЙНА НАНОСОМАЛЬНЫХ ФОРМ
Строение наносомальной лекарственной формы представлено гидрофобным ядром и стабилизирующей оболочкой, модифицированной векторными молекулами, распознающими рецепторы на клетках больной ткани (рис. 1). Лекарственный агент может быть загружен внутрь частицы, сорбирован в оболочку или ковалентно связан с одним из элементов системы. Природа материала, составляющего резервуар, и его структура определяют кинетику высвобождения лекарственного агента, которое происходит в результате диффузии, деградации резервуара и/или воздействия на его оболочку внешних факторов (pH, излучение, нагрев). Адресное действие препарата обеспечивается с помощью стратегий активного и пассивного нацеливания.
1.1. Активное и пассивное нацеливание для доставки в раковую опухоль
Доставка противоопухолевых препаратов к целевой ткани – одна из главных задач, требующих решения. Транспорт в организме загруженных лекарством НЧ осуществляется по двум механизмам: пассивного и активного нацеливания. Пассивное нацеливание на твердую опухоль может быть достигнуто с помощью повышенной проницаемости и удерживающего эффекта (EPR-эффект), впервые описанного в 1980-х годах [13, 14]. Патологические, фармакологические и биохимические исследования показывают, что твердая опухоль обычно обладает такими патофизиологическими характеристиками, как гиперваскуляризация, неполная сосудистая архитектура, секреция факторов сосудистой проницаемости, стимулирующих экстравазацию и незрелость лимфатических капилляров [15]. Сосудистая сеть опухоли характеризуется высокой долей пролиферирующих эндотелиальных клеток, повышенной извилистостью, дефицитом перицита и образованием нетипичной мембраны. Все это приводит к быстрой васкуляризации опухоли, необходимой для обеспечения ее кислородом и питательными веществами и дальнейшей пролиферации. Эти характеристики делают опухолевые кровеносные сосуды проницаемыми для макромолекул. Кроме того, система лимфодренажа опухоли функционирует неэффективно из-за незрелых лимфатических капилляров; таким образом, наноносители селективно сохраняются в течение длительного периода в опухолевой интерстициальной ткани [15]. Многочисленные исследования показали, что EPR-эффект вызывает пассивное накопление макромолекул и мицелл в твердой опухоли, усиливая терапевтический эффект при уменьшении побочных эффектов. Также было обнаружено, что в большинстве опухолей человека эффективный размер пор в сосудистой сети колеблется от 200 до 600 нм в диаметре, что позволяет пассивно нацеливаться на опухоли [16]. Было отмечено, что секреция различных факторов, таких как оксид азота, простагландины, брадикинин и основной фактор роста фибробластов в опухолевых тканях и избыточной экспрессии генов (таких как фактор сосудистой проницаемости или фактор роста эндотелия сосудов), вызывают гиперпроницаемость микрососудов опухоли. Однако отметим, что проницаемость сосудов в опухоли изменяется с ее прогрессированием, зависит от типа опухоли и ее анатомического расположения. Для пассивного нацеливания НЧ должны циркулировать в крови в течение достаточно длительного времени, а их размер определяет их биологическую судьбу. Так, полимерные мицеллы менее 10 нм легко удаляются через почечные клубочки [17], тогда как более крупные НЧ размером 50–100 нм циркулируют более длительное время и удаляются печенью и селезенкой.
Активное нацеливание направлено на увеличение доставки лекарственного средства к цели с использованием биологически специфических взаимодействий, таких как связывание антиген–антитело, или локально применяемых воздействий, таких как обработка ультразвуком или нагревание. В этом случае НЧ могут быть модифицированы лигандом (моноклональные антитела, фолиевая кислота, трансферрин, α-фетопротеин, лютеинизирующий гормон, фактор эпидермального роста или α2-гликопротеин) или рН-чувствительным фрагментом в соответствии с биологическими характеристиками опухолевой ткани [18–20]. В активном нацеливании используются характеристики, которые проявляют опухолевые клетки, такие как избыточная экспрессия клеточных поверхностных опухолевых антигенов и опухолеспецифических антигенов, а также относительно более низкий водородный показатель среды опухоли (рН 7.0) по сравнению с нормальной тканью (рН 7.4). Конкретные взаимодействия между векторными компонентами носителя с антигенами, локализованными на тканях-мишенях, вызывают селективное накопление лекарственного средства в этих тканях. Активное нацеливание уменьшает неблагоприятные побочные эффекты, поскольку препарат накапливается только в опухолевых участках и позволяет лекарственным препаратам поглощать клетки через эндоцитоз [21].
1.2. Время циркулирования наночастиц в кровотоке
Любая стратегия нацеливания не будет работоспособной в условиях быстрого вывода НЧ из системы кровообращения. При внутривенном введении гидрофобные частицы очень быстро адсорбируют белки плазмы и распознаются системой мононуклеарных фагоцитов, которые выводят их из кровотока. Этот процесс зависит от физико-химических свойств НЧ и значительно ускоряется при увеличении их размера. Для повышения времени циркулирования применяют технологии стерической стабилизации поверхности, обеспечивающей так называемый “стелс-эффект”. Гидрофильная оболочка полимерных НЧ может быть образована различными типами полимеров. Наиболее часто используемый лиофилизирующий полимер – полиэтиленгликоль (ПЭГ), он является биосовместимым и одобрен FDA. При гидратации ПЭГ образует плотную полимерную щетку, вытянутую по направлению от ядра мицеллы. Благодаря хорошей растворимости в воде, высокой подвижности и большому исключенному объему [22] ПЭГ придает стерическую стабильность, минимизируя межфазную свободную энергию мицеллярного ядра и препятствуя гидрофобным межмицеллярным взаимодействиям [23]. Гидрофильная корона необходима для предотвращения адсорбции опсонина и последующего распознавания мононуклеарной фагоцитарной системой в печени и селезенке [24]. Нейтральная природа короны ПЭГ может эффективно защищать катионный полиэтиленимид и предотвращать его неспецифические взаимодействия с отрицательно заряженными белками плазмы в биологической среде, тем самым обеспечивая длительное время циркуляции [25]. Более того, хотя цепи ПЭГ обычно имеют молекулярную массу от 1 до 15 кДа [26], некоторые данные свидетельствуют, что чем длиннее цепи и чем плотнее гидрофильная щетка, тем сильнее “маскирующий” эффект и больше время циркуляции в крови [22]. В [27] показано, что конформация ПЭГ, привязанного к полимерному ядру, может влиять на адсорбцию белков и комплемент-зависимый фагоцитоз. Действительно, ПЭГ, прикрепленный обоими концами к НЧ, образовывал более компактную конформацию и сильнее препятствовал адсорбции белков крови. Кроме того, концевые группы ПЭГ могут функционализироваться для связывания лигандов, позволяющих изменять свойства короны. В [28] получены ацетальдегид-функционализированные мицеллы на основе блок-сополимера ПЭГ и поли-D,L-лактида, к которым был присоединен анионный пептидил-лиганд (тирозил-глутаминовая кислота), для придания отрицательного поверхностного заряда и улучшения “маскирующих” свойств. До 25% вводимых полимерных мицелл еще циркулировали через 24 ч после внутривенной инъекции, что свидетельствует о том, что период полувыведения носителя был примерно таким же, как у хорошо зарекомендовавших себя пэгилированных липосом.
Перспективным выглядит альтернативный подход для увеличения времени циркулирования – введение одновременно с наносомальной формой антител, специфично связывающихся с эритроцитами [29]. В результате иммунная система начинает активно удалять небольшую часть эритроцитов и “отвлекается” от клиренса НЧ. Описанная стратегия, названная цитоблокадой мононуклеарной фагоцитарной системы, позволяет в десятки раз увеличить время циркулирования НЧ независимо от их природы.
1.3. Визуализация наночастиц
Для визуализации НЧ in vitro и исследования их биораспределения в организме в структуру НЧ вводят метки органической или неорганической природы. Флуоресцентные соединения позволяют проводить оптическую визуализацию и оценку накопления носителей в больной ткани [30], агенты на основе йода и бария обладают высокой контрастностью для исследования методом компьютерной томографии, а для визуализации методом магнитно-резонансной томографии применяют метки на основе хелатных комплексов гадолиния, марганца, оксидов железа. Среди других методов можно выделить позитронно-эмиссионную томографию в сочетании с радиоактивными изотопами 18F, 15O, 13N и 11С, а также однофотонную эмиссионную компьютерную томографию, детектирующую изотопы 99mTc, 123I и др. Перечисленные методы различаются разрешением и глубиной проникновения. Выбор подхода для визуализации определяется задачей разрабатываемой терапевтической или диагностической системы доставки. Подчеркнем, что современные технологии позволяют комбинировать эти две функции в одной системе, что дает возможность одновременно выявлять очаг заболевания и проводить терапию.
1.4. Нанотехнологии для создания вакцин и лекарств против вирусных инфекций
Огромную угрозу несут в себе вирусные респираторные инфекции, которые в условиях высокой взаимосвязанности стран способны в считанные месяцы распространиться по всему миру. Вспышка коронавирусной инфекции SARS-CoV-2, начавшаяся в январе 2020 г. в Китае, была объявлена пандемией 11 марта. Под данным Университета Джонса Хопкинса к июлю 2020 г. было зарегистрировано более 15 млн случаев заражения и более 615 тыс. смертей в 215 странах. Важной задачей для борьбы с любой вирусной инфекцией является разработка вакцин, средств диагностики и лечения. Наноструктурированные носители являются перспективными кандидатами для решения этих задач, поскольку во многом схожи по своей морфологии и размеру с вирусами. Нанотехнологии предлагают эффективные подходы для создания средств диагностики, разработки вакцин против SARS-CoV-2, создания лекарств для лечения COVID-19 [31]. Наночастицы могут нести мультивалентный антиген и адресно его доставлять. Кроме того, наноносители могут выступать в качестве адъюванта, усиливающего иммунный ответ. Нановакцина против SARS-CoV-2 на основе липосом, загруженных мРНК-1273, рассматривается как одна из наиболее перспективных и безопасных. Клинические испытания показали устойчивый иммунный ответ [32]. Что касается терапевтических средств для лечения COVID-19, то на сегодня только несколько молекул продемонстрировали эффективность в клинических испытаниях. Среди них противовоспалительный кортикостероид дексаметазон. Эффективные нанолипосомальные формы этого агента уже были разработаны, в частности для лечения множественной миеломы [33]. В [34] полагали, что наносомальная форма дексаметазона обладает высоким потенциалом и для лечения COVID-19, поскольку может обеспечить нацеливание на альвеолярные макрофаги при доставке в легкие или на фагоциты в зоне воспаления.
Нановакцины положительно себя показали и против других респираторных вирусов. Так, в [35] описана вакцина на основе биоразлагаемых вирусоподобных PLGA-наночастиц против коронавируса ближневосточного респираторного синдрома (MERS-CoV). Поверхность носителей на основе поли(D,L-лактид-со-гликолида) средним диаметром 114 нм была конъюгирована с вирусным антигеном и дополнительно загружена адъювантом для усиления иммунного ответа. Исследования на мышах показали устойчивую выработку специфичных антител и более высокий уровень иммунного ответа по сравнению с введением чистого адъюванта. Во многом именно сочетание сразу двух активных компонентов в нановакцине привело к повышению ее эффективности.
В [36] представлены результаты создания лекарственной формы деффилина на основе НЧ поли(лактид-со-гликолид)-блок-ПЭГ для лечения перитонита, вызванного кошачьим коронавирусом (FIPV). Гидрофобный противовирусный агент был загружен в ядро носителей со средним диаметром 40 нм. Разработанная наносомальная форма продемонстрировала улучшенную безопасность и повышенный ингибиторный эффект против FIPV в экспериментах in vitro.
Пандемия SARS-CoV-2 показала, что мы очень ограниченно можем противостоять респираторным вирусам и главным средством борьбы является иммунная система. Разработка и испытание новых лекарств и вакцин являются сложными процессами, требующими длительных исследований. Первая в мире вакцина от SARS-CoV-2 “Гам-Ковид-Вак” (торговое название “Спутник V”) на основе комбинации рекомбинантных аденовирусных векторов была разработана в НИЦЭМ им. Н.Ф. Гамалеи и зарегистрирована в августе 2020 г. Клинические испытания первой и второй фазы показали безопасность вакцины наряду с выработкой гуморального и клеточного иммунитета [34].
Для быстрой разработки вакцин и новых эффективных лекарственных форм актуальной задачей является создание платформ на основе наноструктурированных носителей различной природы. Базовым элементом платформы является наночастица-носитель с регулируемым размером, которая с помощью заранее известных подходов может быть загружена активным агентом и модифицирована по поверхности таргетными лигандами для адресной доставки. Создание наноструктурированных вакцин и систем доставки лекарств нового поколения требует разработки новых функциональных материалов, методов получения, модификации и загрузки НЧ, подходов для управления их морфологией и физико-химическими свойствами. Решить этот комплекс междисциплинарных задач возможно только при тесном взаимодействии специалистов из разных областей с привлечением современных методов исследования. Одной из перспективных платформ являются биоразлагаемые НЧ на основе сополимеров лактида. В обзоре описаны методы получения, структура и свойства НЧ на основе этих полимеров с различным составом и архитектурой (линейные и разветвленные); приведены примеры разработанных наносомальных лекарственных форм; описаны методы исследования НЧ, в том числе с применением источника синхротронного излучения.
2. ПОЛУЧЕНИЕ, СТРУКТУРА И СВОЙСТВА НАНОЧАСТИЦ НА ОСНОВЕ ПОЛИ(ЛАКТИД-СО-ГЛИКОЛИДА)
Полилактид (PLA, ПЛА) и его сополимеры с гликолидом (PLGA) – это биоразлагаемые полиэфиры (рис. 2), которые благодаря своей отличной биосовместимости, универсальности и относительной доступности нашли широкое применение в биомедицине и фармацевтике.
Биосовместимость этих алифатических полиэфиров подтверждена многолетней историей применения в производстве рассасывающихся шовных нитей Vicryl, разработанных в 1970 г. В настоящее время PLA и PLGA активно применяются для создания биоразлагаемых имплантатов для хирургии и травматологии, скаффолдов для регенеративной медицины, микро- и наносомальных лекарственных форм. Основным механизмом деградации является гидролиз сложноэфирной связи в структуре полимера. Управление свойствами и сроком деградации PLGA-сополимеров достигается путем варьирования относительного состава (соотношения лактид/гликолид), молекулярной массы, а также использованием оптически активного L-лактида или неактивной D,L-формы, от чего зависит возможность кристаллизации PLA-блоков. Этот простой набор инструментов позволяет контролировать время деградации полимера в широком диапазоне – от 1 мес до нескольких лет. Конечными продуктами деградации в организме являются молочная и гликолевая кислота, которые выводятся посредством естественных метаболических циклов.
Сразу после успешной коммерциализации рассасывающихся хирургических нитей на потенциал полимеров лактида обратили внимание разработчики фармацевтических продуктов и начали их использовать для создания систем контролируемого высвобождения лекарств на основе микрочастиц PLGA. Инъекционные депо-формы микрочастиц (вводимые внутримышечно или подкожно) обеспечивают контролируемое высвобождение активных соединений на протяжении недель и даже месяцев, демонстрируя тем самым огромное преимущество перед классическими лекарственными формами, требующими, как правило, ежедневного введения для поддержания терапевтически эффективной концентрации в крови. К настоящему времени в клинике применяются десятки препаратов пролонгированного действия на основе микрочастиц PLGA для лечения алкогольной зависимости, рака, шизофрении и многих других болезней [37]. Отметим, что некоторые из них производятся в России. Концепция микрочастиц сводится именно к созданию пролонгированных форм, они не обеспечивают адресного действия активного вещества.
Субмикронные частицы размером до нескольких сотен нанометров могут быть введены внутривенно и распространяться по капиллярной сети, в итоге проникая в клетки. Это принципиальное отличие от микрочастиц объясняет выделение НЧ в отдельный класс, при этом их размер не ограничивается общепринятым для нанотехнологий порогом в 100 нм. Для адресной доставки в клетки-мишени используют стратегии пассивного (EPR-эффект) и активного нацеливания.
К чистоте и составу PLGA, применяемому в медицинских и фармацевтических приложениях, предъявляются достаточно высокие требования. Стандарты ASTM допускают содержание непрореагировавшего мономера на уровне не более 3 мол. %, максимальную концентрацию олова – 200 ppm, содержание воды – не более 0.5%, содержание растворителей – не более 0.001%. Важно, что фактический относительный состав сополимера (лактид:гликолид) должен отличаться от заявленного не более чем на 3%. Такие полимеры могут быть синтезированы только с применением контролируемых технологий полимеризации, обеспечивающих получение продукта с заданным составом, высокой степенью конверсии и узким молекулярно-массовым распределением. В [38, 39] предложен оригинальный метод исследования кинетики полимеризации лактида и других циклических сложных эфиров с применением дифференциальной сканирующей калориметрии. С его помощью были установлены оптимальные режимы проведения синтеза биоразлагаемых полимеров с различным относительным составом. Примеси олова в этих материалах возникают из-за использования оловосодержащего катализатора, поэтому актуальным направлением является разработка новых катализаторов на основе более легких металлов, таких как цинк [40] или цирконий [41]. PLGA-сополимеры перед использованием для создания наносомальных лекарственных форм должны проходить комплексный контроль качества. Он особенно важен для материалов после хранения, поскольку их гидролитическая деструкция медленно протекает на воздухе даже при комнатной температуре.
2.1. Методы получения PLGA-наночастиц. Механизм наноосаждения
Разработан широкий спектр методов получения НЧ с заданным размером и их нагрузки лекарственными соединениями [42]. Выбор метода определяется преимущественно типом используемого сополимера и природой лекарственного вещества, а также простотой реализации. Известен подход, в котором синтез НЧ полимеризацией лактида в растворе происходит в присутствии лекарственного вещества [43]. Микрофлюидные технологии эффективны для получения НЧ с узким распределением по размерам в непрерывном режиме [44]. В [45] описан метод получения наночастиц PLGA с использованием шаблона – PRINT. Подход интересен тем, что обеспечивает получение НЧ с чрезвычайно узким распределением по размерам и регулируемой морфологией. При этом в НЧ достигается очень высокое содержание доцетаксела (до 40 мас. %). На сегодня наибольшее распространение получили методы эмульгирования и замены растворителя (наноосаждения), в основе которых лежит смешивание органической фазы (раствора полимера) и водной фазы (раствора стабилизатора) [46]. В зависимости от природы загружаемое лекарство может быть растворено как в органической, так и в водной фазе. Классический метод получения простой эмульсии типа “масло-в-воде” включает в себя приготовление раствора полимера и лекарства в органическом растворителе и последующее диспергирование в большем объеме водного раствора стабилизатора при активном перемешивании или воздействии ультразвука. Органический растворитель диффундирует из капель и удаляется выпариванием или экстракцией, что приводит к формированию твердых частиц [47]. Для инкапсулирования водорастворимых лекарств применяют метод двойной эмульсии типа “вода-в-масле-в-воде” [48].
Эффективный одностадийный подход для инкорпорирования липофильных лекарственных соединений – метод наноосаждения, впервые предложенный в 1989 г. [49]. Органическая фаза представляет собой раствор полимера и лекарственного соединения в полярном растворителе, который хорошо смешивается с водой (обычно ацетон, тетрагидрофуран или их смеси с водой или этанолом). Этот раствор приливают к водной фазе (раствору стабилизатора в воде) при перемешивании. Органический растворитель удаляют при слабом нагревании и пониженном давлении [46]. Полученную водную суспензию центрифугируют и промывают несколько раз для удаления остатков органического растворителя, после чего замораживают с добавлением криопротектора и лиофилизуют [50]. Механизм образования НЧ объясняется так называемым “узо”-эффектом [51]. При смешивании греческого алкогольного напитка Узо с большим количеством воды прозрачная жидкость мгновенно превращается в суспензию молочного цвета. Напиток состоит из 55% воды, 45% этилового спирта и примерно 0.2% эфирного масла анетола, экстрагированного из аниса. При добавлении избытка воды масло теряет растворимость, в результате чего образуется интенсивно рассеивающая свет суспензия. Аналогичным образом объясняется формирование НЧ, когда вместо масла используются водонерастворимые полимеры или липиды. На рис. 3 представлена тройная фазовая диаграмма системы органический растворитель/растворенное вещество/вода. Бинодальная кривая соответствует пределу смешиваемости в зависимости от состава и отделяет однофазную область от двухфазной, тогда как спинодальная кривая определяет предел термодинамической стабильности. Спинодаль отделяет область, в которой система развивается за счет нуклеации, от области, где происходит спонтанное разделение фаз (область с желтыми полосами). Между бинодалью и спинодалью располагается область “узо-эффекта” при низких концентрациях полимера и соотношениях органический растворитель/вода. В этой области смесь разделяется на мономодальную дисперсию наноразмерных капель, диспергированных в водном растворе. Частицы могут формироваться и за пределами “узо-эффекта” между спинодалью и бинодалью, но в этой области кроме НЧ появляются их агрегаты с неконтролируемым размером [52]. Образование НЧ из дисперсии капель в области “узо-эффекта” чаще всего объясняется классической теорией нуклеации. Зародыш образуется вследствие статистических флуктуаций плотности, вероятность которых увеличивается с ростом пересыщения раствора полимера. Энергия потенциального барьера образования зародыша радиусом r для случая гомогенной нуклеации выражается уравнением
где γ – поверхностное натяжение на границе твердое вещество–раствор, $\Delta {{g}_{{v}}}$ – разница свободной энергии на единицу объема между термодинамической фазой, в которой происходит зародышеобразование, и фазой, которая зарождается. Поскольку второй член отрицателен, значение ΔG проходит через максимум, определяющий величину критического радиуса ${{r}_{c}} = - 2\gamma {\text{/}}\Delta {{g}_{{v}}}$. Зародыши размером меньше критического исчезают, а зародыши большего радиуса являются стабильными и могут расти дальше. Скорость нуклеации J и критический радиус зародыша связаны с пересыщением раствора S и термодинамическими характеристиками границы частица/раствор через параметр γ. Согласно классической теории зародышеобразования [53]:Рис. 3.
Фазовая диаграмма тройной смеси с областью “узо”-эффекта, ПЭМ-изображение наночастиц PLGA и их схематическое строение.
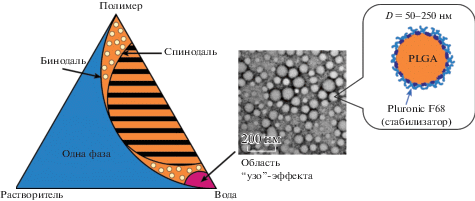
Известно множество статей и обзоров, посвященных влиянию условий получения на средний размер и стабильность образующейся водной суспензии, а также на эффективность загрузки лекарственных агентов [55–58]. Характеристики получаемых НЧ зависят от многих факторов: концентрация полимера в органической фазе, вид и концентрация стабилизатора в водной вазе, соотношение объемов водной и органической фаз, вид используемого органического растворителя, молекулярная масса полимера, скорость перемешивания, температура и др. Среди наиболее важных параметров, определяющих размер НЧ, можно выделить совместимость органического растворителя и воды, выражаемую параметром взаимодействия χ, который рассчитывается на основе параметров растворимости Гильдебранда. В условиях высокой смешиваемости растворителя и воды происходит быстрая гомогенизация смеси, и образующиеся НЧ обладают наименьшим диаметром. В [56] показано, что диаметр PLGA-наночастиц при использовании растворителей с низким значением χ (диметилсульфоксида, диметилформамида (ДМФА) и ацетонитрила) составлял не более 80 нм. При использовании ацетона он возрастал до 100 нм, а наиболее высокое значение наблюдалось для тетрагидрофурана (ТГФ) – около 200 нм. Применение в процессе наноосаждения смесей ДМФА с ТГФ в различных соотношениях позволяло получать частицы с промежуточными размерами, при этом зависимость характеризовалась высокой линейностью, а распределение частиц по размерам оставалось узким.
2.2. Малоугловое рентгеновское рассеяние для исследования размера и морфологии
Малая длина волны рентгеновского излучения по сравнению с длиной волны видимого света, используемого в методе динамического рассеяния света, позволяет проводить более детальное исследование структуры полимерных НЧ в суспензии. Важными задачами являются изучение организации НЧ в водных дисперсиях низкой концентрации и проведение измерений во времени, например в процессе нагревания суспензии или высвобождения лекарственного вещества. Лабораторные рентгеновские установки крайне ограниченно могут быть использованы для таких экспериментов из-за достаточно больших размеров НЧ (100–200 нм), низкого контраста между электронной плотностью полимера и воды, длительного времени накопления сигнала. Необходимыми характеристиками обладает только синхротронное рентгеновское излучение с хорошей коллимацией пучка. Метод малоуглового рентгеновского рассеяния (МУРР) эффективен для исследования формы и морфологии НЧ, тогда как область больших углов характеризует надмолекулярную организацию полимера и фазовое состояние загруженного вещества.
Методом МУРР были исследованы водные суспензии НЧ на основе PLGA, стабилизированные Pluronic F68. Кривые рассеяния образцов водных суспензий НЧ приведены на рис. 4а. На них виден небольшой перегиб, характерный для рассеяния сферических объектов. Применив преобразование Фурье к полученным кривым, можно построить функции парного распределения для “средней” частицы (рис. 4б), т.е. в предположении, что все частицы имеют одинаковый размер. Согласно рис. 4б парно-корреляционная функция имеет колоколообразный вид, характерный для сферических частиц. По ней легко определить диаметр НЧ, который составил 120 нм. Рассчитанный по кривым рассеяния радиус инерции Rg = 44 нм. Оценить форму усредненной НЧ можно, представив ее эллипсоидом, в котором полуоси b и с равны, тогда отношение полуосей b/a можно рассчитать по формуле
Рис. 4.
Кривая МУРР (а), парно-корреляционная функция (б) и восстановленная форма (в) образца наночастиц PLGA, стабилизированного Pluronic F68.

Для сферы b/a = 1, в другом случае одна из осей более вытянута. Расчет показывает, что частицы, стабилизированные Pluronic F68, имеют форму, очень близкую к шару (b/a = 0.92). Ab initio-модель “усредненной” НЧ, построенная на основании парно-корреляционной функции, приведена на рис. 4в. Видно, что ее форма действительно очень близка к сферической.
2.3. Загрузка противораковых агентов в наночастицы PLGA
Наночастицы PLGA применяются для доставки широкого спектра фармацевтически активных агентов при лечении многих видов заболеваний [59]. Активно развивается направление создания наносомальных форм химиотерапевтических агентов. Одной из главных причин выраженных побочных эффектов химиотерапии раковых опухолей является неселективное действие активного агента, поражающего не только больную, но и здоровую ткань. Поэтому создание селективно действующих наносомальных форм на основе частиц PLGA особенно актуально для противораковых препаратов [60]. Для решения этой задачи может быть эффективно использована способность НЧ накапливаться в опухолевых тканях за счет размера и молекул-векторов на поверхности. Отметим, что физико-химические свойства носителей способствуют преодолению другого важного барьера – множественной лекарственной устойчивости [61]. Механизм ее возникновения обусловлен экспрессией в резистентных опухолевых клетках мембранных белков – P-гликопротеина и белка MRP, которые эффективно выводят различные химические соединения из клетки. Показано, что блок-сополимеры этиленоксида и пропиленоксида (торговая марка Pluronic) ингибируют P-гликопротеин и другие аденозинтрифосфат-зависимые системы обратного транспорта лекарственных веществ из клетки [62]. В то же время полимеры Pluronic выступают стабилизаторами наночастиц PLGA, выполняя таким образом двойную функцию.
Можно выделить несколько основных подходов для загрузки активного агента в PLGA-наночастицы: ковалентное связывание, инкапсулирование, сорбция на поверхность и инкорпорирование в гидрофобное ядро. Первый метод был применен, например, для разработки НЧ на основе конъюгатов PLGA с доксорубицином [63]. Однако загрузка действующего вещества в такие НЧ невысока, поскольку линейный полимер PLGA может иметь максимум две функциональных концевых группы для связывания с двумя молекулами активного соединения. В определенной степени решить проблему позволяет использование полимеров с невысокой молекулярной массой, но более действенным подходом является применение разветвленных полимеров, характеризующихся высокой концентрацией функциональных групп. Эти материалы описаны в заключительной части обзора.
Более универсальными и легкими в реализации подходами являются сорбция и загрузка в ядро. С помощью этих методов в состав НЧ могут быть включены многие амфифильные и гидрофобные соединения для терапии рака: доксорубицин, доцетаксел, паклитаксел, цисплатин и др. [60]. Для загрузки гидрофобных молекул их совместно с полимером растворяют в органической фазе. В результате соосаждения лекарство оказывается физически “захваченным” в ядро НЧ. Эффективность загрузки и финальное содержание активного соединения зависят от природы и концентрации лекарства и полимера, вида используемого растворителя, технологических параметров процесса.
В [64] описаны загруженные паклитакселом наночастицы PLGA со средним размером 105 нм. Полученная наносомальная форма проявила высокий противоопухолевый эффект в отношении резистентных опухолей in vitro и in vivo. В эксперименте на клетках Jurkat WT флуоресценцию меченных кумарином-6 НЧ наблюдали не только на поверхности клеток, но и внутри них. Это указывает на захват клетками меченых НЧ. Загруженные паклитакселом НЧ на основе PLGA, дополнительно модифицированные фрагментом рекомбинантного α-феторотеина rAFP3D, демонстрировали селективное действие, повышенную эффективность и преодоление множественной лекарственной устойчивости раковых клеток [65]. Такого эффекта удалось достичь благодаря использованию векторного белка, связывающегося с рецепторами α-фетопротеина, который экспрессируется на поверхности раковых опухолей различного вида.
Отметим, что существует много работ с противоречащими друг другу результатами о влиянии условий процесса получения частиц PLGA методом наноосаждения на их характеристики. Несмотря на то что дискуссия о механизме их формирования все еще ведется, разработчики успешно применяют метод наноосаждения для получения частиц PLGA и создают на их основе эффективные наносомальные лекарственные формы и вакцины.
3. НАНОЧАСТИЦЫ НА ОСНОВЕ АМФИФИЛЬНЫХ БЛОК-СОПОЛИМЕРОВ ПЛА-б-ПЭГ
В свое время открытие метода пэгилирования (модификации гидрофильным полимером ПЭГ) стало прорывом. Этот подход позволил “замаскировать” фармацевтически активные вещества и наноматериалы от клеток иммунной системы и значительно продлить время их циркулирования в кровотоке. ПЭГ представляет собой нетоксичный, хорошо растворимый в воде полимер, его удаление из организма человека происходит посредством клубочковой фильтрации в почках. В 1990 г. FDA одобрило первый пэгилированный белковый продукт – фермент адентозиндеаминазы, направленный на лечение тяжелых форм вируса иммунодефицита. Выпущенный в 1995 г. препарат “Doxil” на основе пэгилированных липосом демонстрировал увеличение биодоступности доксорубицина в течение одной недели после инъекции до 90 раз по сравнению со свободным препаратом, при этом период его полувыведения возрастал до трех дней. ПЭГ встраивается в липидный бислой липосомы, образуя гидратированную оболочку, которая защищает липосомы от агрегации и фагоцитоза, а также способствует снижению адсорбции опсонинов, увеличивая время циркулирования в кровотоке. С тех пор этот подход активно используется исследователями и разработчиками при создании систем доставки лекарств [66, 67]. Биоразлагаемые блок-сополимеры полилактида и полиэтиленгликоля (ПЭГ-б-ПЛА) являются перспективными материалами для разработки наносомальных лекарственных форм и вакцин. Ковалентно связанный с гидрофобным PLA-блоком полиэтиленгликоль придает полимеру амфифильную природу, которая обеспечивает блок-сополимерам возможность самоорганизации.
Линейные амфифильные ПЭГ-б-ПЛА синтезируют методом одностадийной полимеризации лактида с раскрытием цикла в присутствии макроинициатора ПЭГ [68, 69]. Изменение мольного соотношения компонентов реакционной смеси позволяет получать блок-сополимеры различного состава, использование моно- или бифункционального макроинициатора – различного строения. Монофункциональный метиловый эфир ПЭГ применяют для синтеза двойных блок-сополимеров типа А–Б, где А – гидрофильный блок, Б – гидрофобный блок, а бифункциональный ПЭГ – для синтеза тройных блок-сополимеров типа Б–А–Б. Схемы синтеза двойных ПЭГ-б-ПЛА и тройных ПЛА-б-ПЭГ-б-ПЛА блок-сополимеров методом полимеризации с раскрытием цикла приведены на рис. 5а и 5б соответственно. Конверсию, остаточное содержание мономера, состав и среднечисловую молекулярную массу Mn блок-сополимеров определяют методом 1Н ядерно-магнитного резонанса. К блок-сополимерам предъявляются такие же строгие требования, как к полимерам PLA и PLGA.
Рис. 5.
Схема синтеза двойных (а) и тройных (б) блок-сополимеров этиленгликоля и лактида, где n – степень полимеризации ПЛА-блока, m – степень полимеризации ПЭГ-блока.

В водных растворах самоорганизация амфифильных аморфных блок-сополимеров в различные надмолекулярные структуры происходит за счет гидрофобных взаимодействий между цепями нерастворимого блока, которые приводят к их агрегации и формированию гидрофобного ядра наноструктуры. Оболочка из гидратированных цепей водорастворимого блока ПЭГ выступает стабилизатором и предупреждает неограниченный рост формируемых структур и выделение их в отдельную макроскопическую фазу. Амфифильные блок-сополимеры с относительно длинным гидрофильным блоком в водных растворах, как правило, ассоциируют в сферические “звездообразные” (“star-shaped”) мицеллы типа ядро–корона [9, 12] (рис. 6). Блок-сополимеры с длинным гидрофобным блоком могут образовывать не только сферические “стриженые” (“crew-cut”) мицеллы [70, 71], но и цилиндрические мицеллы, бислойные везикулы, ламели [12, 72].
Блок-сополимерные НЧ состоят из гидрофобного ПЛА-ядра, окруженного гидрофильной ПЭГ-короной [73–75]. Благодаря строению “ядро–корона” и способности инкапсулировать различные вещества блок-сополимерные наночастицы ПЭГ-б-ПЛА представляют значительный интерес для создания на их основе систем доставки лекарственных препаратов [76, 77]. Однако для разработки эффективной наносомальной лекарственной формы необходимо учитывать множество факторов, например молекулярный состав блок-сополимера [78], химическое сродство лекарственного вещества и блок-сополимера [76, 79], концентрацию лекарства и блок-сополимера [78, 80], условия получения НЧ [80] и пр. В данном разделе рассмотрим, как молекулярный состав амфифильных линейных сополимеров ПЭГ-б-ПЛА влияет на размер, морфологию формируемых НЧ, их солюбилизирующую способность и скорость высвобождения загруженного вещества. Рассмотрим влияние стереорегулярности и длины гидрофобного ПЛА-блока в составе сополимеров ПЭГ-б-ПЛА на размер, морфологию, солюбилизирующую способность частиц ПЭГ-б-ПЛА в водных растворах, а также на скорость высвобождения солюбилизированных веществ.
3.1. Влияние стереорегулярности гидрофобного ПЛА-блока на характеристики наночастиц, загрузку и высвобождение активного агента
ПЛА обладает тремя стереоизомерами. Изотактические поли-L-лактид (П(L)ЛА) и поли-D-лактид (П(D)ЛА) способны кристаллизоваться, тогда как рацемический поли-D,L-лактид (П(D,L)ЛА) является аморфным [81]. В зависимости от стереорегулярности ПЛА-блока в составе блок-сополимеров ПЭГ/ПЛА на их основе можно получать НЧ как с аморфным, [82], так и с частично кристаллическим ядром [75]. Кроме того, при смешении блок-сополимеров ПЭГ/П(L)ЛА и ПЭГ/П(D)ЛА в эквимольном соотношении получают НЧ, в ядре которых происходит сокристаллизация блоков П(L)ЛА и П(D)ЛА с образованием стереокомплекса [81, 83]. Кроме ПЛА гидрофобный блок может быть представлен поли-ε-капролактоном (ПКЛ). Рассмотрим, как стереохимическая структура ПЛА-блока, формирующего ядро частиц, влияет на их солюбилизирующую способность и скорость высвобождения инкапсулированных веществ.
В [84] на основе сополимеров ПЭГ-б-поли-ε-капролактон-со-D,L-лактид (ПЭГ-б-П(КЛ-(D,L)ЛА) и ПЭГ-б-поли-ε-капролактон-со-L-лактид (ПЭГ-б-П(КЛ-(L)ЛА) методом диализа получали наночастицы с аморфным П(КЛ-со-(D,L)ЛА)- и частично кристаллическим П(КЛ-со-(L)ЛА)-ядром соответственно и исследовали их солюбилизирующую способность. В качестве модельного гидрофобного агента использовали пирен, для которого определяли равновесный коэффициент включения Kv в ядро НЧ. Для частиц на основе сополимеров ПЭГ50-б-П(КЛ-со-(L)ЛА) и ПЭГ50-б-П(КЛ-со-(D,L)ЛА) величина Kv составила 5.72·104 и 2.12·105 соответственно. Меньшую величину Kv в случае частиц ПЭГ50-б-П(КЛ-со-(L)ЛА) объясняют особенностями структуры частично кристаллического ядра, а именно плотной упаковкой П(КЛ-со-(L)ЛА)-цепей, которая препятствует солюбилизации молекул пирена [84]. Однако при исследовании солюбилизирующей способности частиц ПЭГ-б-ПЛА, полученных методом наноосаждения относительно малорастворимого в воде противоракового препарата доксорубицина, было обнаружено, что частицы ПЭГ-б-П(L)ЛА и ПЭГ-б-П(D)ЛА с частично кристаллическим ядром инкапсулируют лекарство эффективнее по сравнению с частицами ПЭГ-б-П(D,L)ЛА с аморфным ядром [75]. Так, содержание загруженного препарата в ПЭГ113-б-П(L)ЛА64 и ПЭГ113-б-П(D)ЛА71 составило 1.66 ± 0.15 и 1.61 ± 0.13 мас. % соответственно, тогда как в ПЭГ113-б-П(D,L)ЛА58 – всего 0.81 ± ± 0.11 мас. % (при исходной загрузке лекарства 10 мас. %). Предполагается, что низкие значения загрузки в случае частиц ПЭГ-б-П(D,L)ЛА могут быть связаны со слабым взаимодействием доксорубицина и цепей П(D,L)ЛА гидрофобного блока в ядре [75]. В лаборатории полимерных материалов ККНБИКСпт НИЦ “Курчатовский институт” на основе сополимеров ПЭГ113-б-П(L)ЛА и ПЭГ113-б-П(D,L)ЛА методом наноосаждения получали НЧ и исследовали влияние стереохимической структуры ПЛА-блока на их солюбилизирующую способность по отношению к слабо растворимому в воде противораковому препарату оксалиплатину [85]. При близких степенях полимеризации гидрофобного ПЛА-блока содержание оксалиплатина в частицах ПЭГ113-б-П(L)ЛА64 и ПЭГ113-б-П(D,L)ЛА62 составило 0.9 и 3.8 мас. % соответственно (при исходной загрузке 5 мас. %). По-видимому, плотная упаковка П(L)ЛА-цепей в частично кристаллическом ядре препятствует эффективному инкапсулированию оксалиплатина.
Скорость высвобождения инкапсулированного вещества из наночастиц ПЭГ-б-ПЛА также зависит от стереохимической природы ПЛА-блока. В [86] исследовали влияние стереорегулярности ПЛА-блока на скорость высвобождения инкорпорированных в ПЛА-б-ПЭГ202-б-ПЛА наночастиц гидрофобных лекарственных препаратов сулиндака и тетракаина. Нагруженные НЧ на основе тройных блок-сополимеров получали с помощью нагревания растворов полимеров до 80°C и их последующего охлаждения. В случае наночастиц П(L)ЛА-б-ПЭГ-б-П(L)ЛА высвобождение загруженного сулиндака наблюдали в течение 4–8 дней, тетракаина – 2–4 дней. Для наночастиц П(D,L)ЛА-б-ПЭГ-б-П(D,L)ЛА обнаружили, что высвобождение сулиндака длится до 18 дней, тетракаина – до 8–9 дней. По-видимому, значительная разница в скоростях высвобождения загруженных лекарств связана с различной структурой ядра наночастиц ПЛА-б-ПЭГ-б-ПЛА. Предполагается, что плотная упаковка П(L)ЛА-цепей в частично кристаллическом ядре может препятствовать равномерному распределению лекарства по всему объему ядра, приводить к его локализации на периферии и, соответственно, более быстрому высвобождению [86]. В [75], напротив, наибольшую скорость высвобождения инкапсулированного лекарственного препарата наблюдали для частиц ПЭГ113-б-П(D,L)ЛА58 с аморфным ядром. В случае частиц ПЭГ113-б-П(D,L)ЛА58 за 5 ч высвобождалось почти 100% загруженного доксорубицина, тогда как в случае частиц мПЭГ113-б-П(L)ЛА64 и мПЭГ113-б-П(D)ЛА71 – порядка 50% за то же время. Возможно, высокая скорость высвобождения из частиц мПЭГ113-б-П(D,L)ЛА58 связана со слабым взаимодействием доксорубицина и П(D,L)ЛА-цепей, что способствует диффузии лекарственных молекул из ядра частицы [75].
3.2. Влияние длины гидрофобного ПЛА-блока на размер, морфологию и солюбилизирующую способность наночастиц
Размер блок-сополимерных наночастиц. Движущей силой самоорганизации амфифильных блок-сополимеров в надмолекулярные структуры в водных растворах являются гидрофобные взаимодействия полимерных цепей нерастворимого блока, тогда как силы отталкивания цепей растворимого блока обеспечивают стерическую стабилизацию частиц и ограничивают их рост [7]. Таким образом, размер блок-сополимерных НЧ определяется длиной как гидрофобного, так и гидрофильного блока, однако степень полимеризации нерастворимого блока в большей степени влияет на размер частиц. Так, в [77] обнаружено, что гидродинамический диаметр Dh частиц ПЭГ-б-П(D,L)ЛА, полученных методом наноосаждения, составляет 26 нм и не изменяется с увеличением длины гидрофильного ПЭГ-блока от 45 до 113 мономерных звеньев. А увеличение степени полимеризации гидрофобного П(D,L)ЛА-блока от 28 до 347 мономерных звеньев приводило к существенному росту величины Dh наночастиц ПЭГ113-б-П(D,L)ЛА от 25 до 71 нм.
На основе синтезированных в лаборатории полимерных материалов НИЦ “Курчатовский институт” сополимеров ПЭГ113-б-П(D,L)ЛАn методом наноосаждения были получены водные суспензии НЧ. Согласно данным динамического рассеяния света (ДРС) гидродинамический радиус Rh полученных частиц возрастает с увеличением длины П(D,L)ЛА-блока (рис. 7а). Так, рост степени полимеризации П(D,L)ЛА-блока n от 70 до 1400 мономерных звеньев приводит к увеличению Rh частиц ПЭГ113-б-П(D,L)ЛАn от 18 ± 7 до 44 ± 14 нм. В некоторых случаях распределения ДРС (ПЭГ113-б-П(D,L)ЛА70 и ПЭГ113-б-П(D,L)ЛА210) носят бимодальный характер (рис. 7а). Это объясняется тем, что в исследуемых суспензиях индивидуальные частицы малого размера (Rh < 100 нм) сосуществуют с небольшим количеством их крупных агрегатов (Rh ≈ 0.1–1 мкм).
Рис. 7.
Распределение наночастиц по гидродинамическим радиусам (а) для образцов на основе двойных блок-сополимеров ПЭГ113-б-П(D,L)ЛА с длиной П(D,L)ЛА-блока 70 (1), 210 (2), 700 (3) и 1400 звеньев (4). Репрезентативное ПЭМ-изображение наночастиц на основе ПЭГ113-б-П(D,L)ЛА700 (с = 0.5 мг/мл) (б).
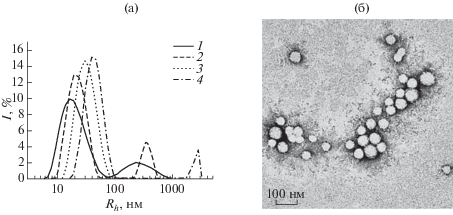
Как правило, увеличение доли гидрофобного блока в сополимере приводит к росту агрегационного числа частицы и, соответственно, к увеличению ее размера [73, 80]. Однако опубликованные данные о влиянии длины кристаллизующегося П(L)ЛА-блока на размер ПЭГ-б-П(L)ЛА блок-сополимерных НЧ носят противоречивый характер. Например, в [87] обнаружено, что гидродинамический диаметр Dh частиц П(L)ЛАx-б-ПЭГ91-б-П(L)ЛАx, полученных методом диализа, возрастает от 64 ± 3 до 211 ± 1 нм с увеличением длины П(L)ЛА-блока x от 61 до 90 звеньев. В [84] не выявили закономерности в изменении величины Dh наночастиц ПЭГ-б-П(КЛ-со-(L)ЛА) с ростом длины кристаллизующегося П(КЛ-со-(L)ЛА)-блока. В [88] с помощью метода малоуглового рассеяния нейтронов установлено, что увеличение длины П(L)ЛА-блока y от 58 до 88 звеньев в ряду тройных блок-сополимеров П(L)ЛАy-б-ПЭГ202-б-П(L)ЛАy приводит к незначительному увеличению диаметра частично кристаллического ядра частиц от 22 до 30 нм. В [89] при исследовании водных суспензий наночастиц ПЭГ113-б-П(L)ЛАx и П(L)ЛАy-б-ПЭГ91-б-П(L)ЛАy было обнаружено, что значительное увеличение длины П(L)ЛА-блока x от 64 до 418 и y от 30 до 120 мономерных звеньев в ряду двойных и тройных блок-сополимеров соответственно практически не влияет на размер формируемых частиц. Так, гидродинамический радиус Rh наночастиц ПЭГ113-б-П(L)ЛАx и П(L)ЛАy-б-ПЭГ91-б-П(L)ЛАy независимо от длины П(L)ЛА-блока составил ~20 и 30 нм соответственно. Методом МУРР было установлено, что радиус R частично кристаллического П(L)ЛА-ядра для всех образцов, кроме ПЭГ113-б-П(L)ЛА418, равен 11 нм. При данных степенях полимеризации П(L)ЛА-блока и при данных условиях получения (концентрация, температура, скорость замены растворителя) размер ПЭГ-б-П(L)ЛА-частиц определяется не только гидрофильно-гидрофобным балансом в сополимере, но и условиями кристаллизации П(L)ЛА-блока [89]. Отметим, что в [88] частицы получали методом нагрева растворов блок-сополимеров в D2O до 80°C и их последующим охлаждением, тогда как в [89] для получения частиц применяли диализ. Таким образом, различные закономерности в изменении размера ПЭГ-б-П(L)ЛА-частиц с ростом длины П(L)ЛА-блока могут быть связаны с параметрами процесса приготовления частиц, которые обычно далеки от термодинамически равновесных условий.
Морфология блок-сополимерных наночастиц. Увеличение длины гидрофобного блока в составе блок-сополимера может приводить к изменению морфологии частиц от сферической к цилиндрической и далее к везикулярной [90, 91]. Однако варьирование в широком диапазоне степени полимеризации П(D,L)ЛА-блока в ряду ПЭГ113-б-П(D,L)ЛА-сополимеров (от 28 до 1528 мономерных звеньев) не влияло на морфологию формируемых частиц, все частицы были сферическими [73, 77]. При исследовании НЧ на основе синтезированных ПЭГ113-б-П(D,L)ЛАn-сополимеров также было обнаружено, что значительное увеличение длины П(D,L)ЛА-блока n от 70 до 1390 мономерных звеньев не приводит к изменению формы частиц. Согласно данным просвечивающей электронной микроскопии (ПЭМ) все ПЭГ113-б-П(D,L)ЛАn-частицы характеризуются сферической морфологией (рис. 3б).
В отличие от частиц на основе ПЭГ-б-П(D,L)ЛА-сополимеров морфологию ПЭГ-б-П(L)ЛА-частиц можно варьировать путем изменения длины кристаллизующегося П(L)ЛА-блока. В [78] при получении методом наноосаждения блок-сополимерных частиц ПЭГ45-б-П(L)ЛА и ПЭГ114-б-П(L)ЛА обнаружили, что увеличение доли П(L)ЛА-блока в ПЭГ-б-П(L)ЛА-сополимерах приводит к изменению морфологии формируемых частиц от сферической к стержневидной. Согласно данным ПЭМ сополимер ПЭГ45-б-П(L)ЛА18 с самым коротким П(L)ЛА-блоком образует сферические частицы, тогда как ПЭГ45-б-П(L)ЛА73 с самым длинным П(L)ЛА-блоком – стержневидные. В случае сополимеров ПЭГ45-б-П(L)ЛА41 и ПЭГ45-б-П(L)ЛА28 со средней длиной П(L)ЛА-блока наблюдали сосуществование частиц обеих морфологий, но с увеличением доли П(L)ЛА-блока в сополимере доля стержневидных частиц возрастала. Для серии ПЭГ114-б-П(L)ЛА-сополимеров образование стержневидных частиц было обнаружено в случае ПЭГ114-б-П(L)ЛА85 с самым длинным П(L)ЛА-блоком. Сосуществование сферических и стержневидных частиц наблюдали для сополимеров ПЭГ114-б-П(L)ЛА63 и ПЭГ114-б-П(L)ЛА54. Аналогичное изменение морфологии с ростом длины П(L)ЛА-блока было обнаружено для ПЭГ-б-П(L)ЛА-частиц, полученных методом диализа [78].
Солюбилизирующая способность ПЭГ-б-ПЛА-частиц. Как правило, с увеличением доли гидрофобного блока растет объем ядра частицы, что приводит к увеличению содержания загруженного вещества и повышению эффективности загрузки [92–94]. Так, в [95] исследовали, как состав ПЭГ113-б-П(D,L)ЛА-сополимеров влияет на способность частиц на их основе инкорпорировать слабо растворимый в воде противораковый препарат метотрексат. С увеличением доли П(D,L)ЛА-блока от 46.6 до 95.0 мас. % в ПЭГ113-б-П(D,L)ЛА-сополимерах наблюдали рост содержания загруженного лекарства в НЧ, полученные методом диализа, от 3.7 до 12.8% и эффективности загрузки от 17.4 до 47.3% (при исходной загрузке лекарства 10 мас. %). В [80] при получении с помощью наноосаждения ПЭГ113-б-П(D,L)ЛА-наночастиц, нагруженных водорастворимым прокаином гидрохлоридом, установили, что содержание лекарства в частицах и эффективность его инкапсулирования не меняются с увеличением длины П(D,L)ЛА-блока и составляют ~0.24 и 8.3% соответственно (при исходной загрузке лекарства 2 мас. %). В [80] предполагалось, что увеличение длины гидрофобного П(D,L)ЛА-блока может приводить к снижению мобильности П(D,L)ЛА-цепей в ядре частиц и, несмотря на рост их размера, уменьшению доступного для включения лекарства объема. Кроме того, с увеличением длины П(D,L)ЛА-блока возрастает его гидрофобность, что также может препятствовать эффективному инкапсулированию гидрофильного лекарства в частицы. В [85] исследовали влияние длины П(D,L)ЛА-блока в составе ПЭГ113-б-П(D,L)ЛАn-сополимеров на содержание противоракового препарата оксалиплатина в наночастицах ПЭГ113-б-П(D,L)ЛАn. С увеличением степени полимеризации П(D,L)ЛА-блока n от 62 до 173 мономерных звеньев содержание оксалиплатина в частицах снижалось от 3.8 до 1.5 мас. % (при исходной загрузке лекарства 5 мас. %). По-видимому, оксалиплатин сорбируется на границе ядра и оболочки, наблюдаемое снижение загрузки можно объяснить уменьшением плотности цепей ПЭГ в стабилизирующей короне. В [82] снижение солюбилизации другого гидрофильного агента (прокаина гидрохлорида) по мере возрастания молекулярной массы П(D,L)ЛА-блока связывали со снижением подвижности П(D,L)ЛА-цепей в ядре частиц [82] и формированием так называемых “замороженных” частиц в случае блок-сополимеров ПЭГ113-б-П(D,L)ЛАn с достаточно длинным П(D,L)ЛА-блоком. Стеклообразное ядро таких частиц затрудняет проникновение лекарства и приводит к снижению его загрузки.
Увеличение длины кристаллизующегося гидрофобного блока в составе блок-сополимера, как правило, негативно отражается на содержании загруженного лекарства и эффективности его инкорпорирования [96]. В [78] наиболее высокие значения содержания загруженного паклитаксела и эффективности его загрузки обнаружили для НЧ на основе ПЭГ45-б-П(L)ЛА41-сополимера с самым длинным П(L)ЛА-блоком. Содержание паклитаксела в частицах ПЭГ45-б-П(L)ЛА41 и ПЭГ45-б-П(L)ЛА22 составило 5.5 ± 0.4 и 4.7 ± ± 0.6%, эффективность загрузки – 57.8 ± 4.3 и 48.3 ± 11.6% соответственно. Однако в случае наночастиц ПЭГ113-б-П(L)ЛА увеличение длины П(L)ЛА-блока от 54 до 85 мономерных звеньев не влияло на содержание лекарства и эффективность его загрузки, которые составили ~6.4 и 69% соответственно. Таким образом, в зависимости от природы лекарства (прежде всего его гидрофобности) длина гидрофобного блока сополимера и его кристаллизация по-разному влияют на загрузку, это необходимо учитывать при разработке наносомальных форм.
Скорость высвобождения вещества, загруженного в блок-сополимерную наночастицу, также зависит от соотношения длин гидрофильного и гидрофобного блоков в сополимере. В [95] исследовали, как молекулярный состав сополимера влияет на скорость высвобождения противоракового препарата метотрексата, инкапсулированного в наночастицы ПЭГ113-б-П(D,L)ЛА. Высвобождение метотрексата носило пролонгированный характер. Увеличение длины гидрофобного П(D,L)ЛА-блока от 56 до 1330 мономерных звеньев приводило к замедлению высвобождения инкапсулированного лекарства. Так, в случае наночастиц на основе ПЭГ113-б-П(D,L)ЛА56 с самым коротким П(D,L)ЛА-блоком наблюдали высвобождение ~50% загруженного метатрексата в течение пяти дней, тогда как в случае наночастиц на основе ПЭГ113-б-П(D,L)ЛА1330 с самым длинным П(D,L)ЛА-блоком высвобождалось ~10% препарата за то же время [95]. В [86] при исследовании кинетики высвобождения гидрофобных лекарственных препаратов тетракаина и сулиндака из наночастиц П(D,L)ЛАх-б-ПЭГ202-б-П(D,L)ЛАх установлено, что даже незначительное изменение длины П(D,L)ЛА-блока влияет на скорость высвобождения лекарств. Все образцы показали медленное и пролонгированное высвобождение обоих препаратов (8–18 дней), однако если в случае тетракаина увеличение длины П(D,L)ЛА-блока x от 66 до 72 звеньев приводило к замедлению высвобождения лекарства, то скорость высвобождения сулиндака, напротив, возрастала с увеличением длины П(D,L)ЛА-блока. Также в [86] исследовали кинетику высвобождения тетракаина и сулиндака из НЧ на основе П(L)ЛАy-б-ПЭГ202-б-П(L)ЛАy-сополимеров с кристаллизующимся гидрофобным П(L)ЛА-блоком и обнаружили, что увеличение степени полимеризации П(L)ЛА-блока y от 77 до 88 мономерных звеньев приводит к росту скорости высвобождения обоих препаратов. В [78] исследовали, как длина П(L)ЛА-блока в составе сополимеров ПЭГ45-б-П(L)ЛА и ПЭГ114-б-П(L)ЛА влияет на скорость высвобождения паклитаксела из НЧ на их основе. Наименьшую скорость высвобождения паклитаксела обнаружили для НЧ на основе сополимеров ПЭГ45-б-П(L)ЛА44 и ПЭГ114-б-П(L)ЛА85 с самым длинным П(L)ЛА-блоком.
Таким образом, амфифильные блок-сополимеры на основе лактонов и ПЭГ представляют собой гибкую систему для создания наносомальных лекарственных форм с регулируемым размером носителя и высоким содержанием активного агента. Структура и характеристики НЧ, а также их солюбилизирующая способность и кинетика высвобождения действующего вещества зависят от условий формирования частиц, химической природы и длины блоков в сополимере. Эти параметры могут быть использованы в качестве эффективных инструментов при разработке новых лекарств адресного действия.
3.3. Наночастицы на основе разветвленных амфифильных сополимеров
В последнее десятилетие возрос интерес к разветвленным полилактидам, обладающим уникальными реологическими, механическими и физико-химическими свойствами [97]. Особенно важно, что разветвленные полимеры характеризуются более высокой концентрацией концевых групп по сравнению с линейными полимерами той же молекулярной массы. Это влияет на их растворимость и открывает возможность для функционализации векторными лигандами, гидрофильными блоками, лекарственными агентами, фотоактивными соединениями.
Звездообразные полимеры содержат в своей структуре одну точку разветвления, из которой исходят три или более линейных лучей. Макромолекулы сверхразветвленных полимеров обладают “гнездообразной” структурой с большим количеством точек разветвлений, при этом каждая из линейных цепей может приводить к образованию как минимум двух других лучей [98–100]. Для получения амфифильных разветвленных полимеров s-ПЛА-б-ПЭГ проводят модификацию концевых групп разветвленных полилактидов блоками ПЭГ (рис. 8). Гидрофильно-гидрофобный баланс разветвленных амфифильных соединений можно регулировать не только за счет молекулярной массы блоков, но и путем изменения числа гидрофильных блоков, приходящихся на молекулу. Описанные структуры при определенном гидрофильно-гидрофобном балансе способны образовывать устойчивые к резкому разбавлению в кровотоке человека мономолекулярные НЧ. Существуют два принципиальных подхода для синтеза разветвленных полимеров – так называемые “arm first” и “core first” методы. Разветвленные полилактиды чаще всего синтезируют, применяя подход “core first”, подразумевающий “наращивание” полимерных лучей на молекуле-ядре. Соединение, содержащее от трех и более OH-групп (ядро), выступает со-инициатором полимеризации лактида в присутствии катализатора 2-этилгексаноата олова (октаноата олова) [101]. Этот метод обладает важным преимуществом, а именно одностадийностью, в отличие от подхода “arm first”, при котором сначала синтезируются линейные или разветвленные лучи с последующим их присоединением к молекуле-ядру. Количество лучей в образующемся в результате реакции полимере равно числу функциональных гидроксильных групп со-инициатора. Например, такие полиолы, как триметилолпропан, пентаэритритол и дипентаэритритол, являются наиболее распространенными мультифункциональными со-инициаторами для синтеза трех-, четырех- и шестилучевых звездообразных полилактидов соответственно. Для синтеза сверхразветвленных полимеров используют молекулы-ядра с большим количеством OH-групп. В качестве такого ядра могут выступать сложные полиэфиры Boltorn™ на основе 2,2-бис(гидроксиметил)пропионовой кислоты, в структуре которых содержится от 16 до 64 гидроксильных групп в зависимости от его псевдогенерации.
Водные суспензии НЧ на основе разветвленных амфифильных блок-сополимеров были изучены с помощью ДРС. Из представленных на рис. 9а распределений по размерам видно, что в случае НЧ на основе звездообразных трех-, четырех- и шестилучевых блок-сополимеров присутствуют две фракции НЧ. Фракция с меньшим гидродинамическим диаметром Dh1 относится к индивидуальным НЧ, в то время как фракция с большим размером Dh2 состоит из их агрегатов. Однако с увеличением количества лучей с трех до шести при аналогичной молекулярной массе гидрофобных ПЛА-блоков существенного различия в гидродинамическом диаметре образующихся на их основе НЧ не наблюдается. Значения среднего диаметра при этом в зависимости от количества лучей варьируются от 14 до 16 нм.
Рис. 9.
Кривые распределения по размерам наночастиц на основе звездообразных блок-сополимеров: а – влияние количества лучей в сополимере s-П(L)ЛА25-б-ПЭГ45: 3 (1), 4 (2), 6 (3), 64 луча (4); б – влияние длины гидрофобного блока: 4s-П(L)ЛА10-б-ПЭГ45 (1), 4s-П(L)ЛА25-б-ПЭГ45 (2), 4s-П(L)ЛА50-б-ПЭГ45 (3).

Для того чтобы изучить влияние длины гидрофобного ПЛА-блока на размер НЧ, была проведена серия экспериментов по получению частиц на основе четырехлучевых П(L)ЛА со степенью полимеризации 10, 25 и 50. Из представленных данных (рис. 9б) видно, что с увеличением длины гидрофобного ПЛЛА-блока четырехлучевых образцов происходит увеличение гидродинамического диаметра НЧ с 15 до 44 нм. Как и в предыдущем случае, при распределении по интенсивности наблюдается бимодальность для всех образцов. При анализе распределений необходимо учитывать, что интенсивность рассеяния света сильно зависит от размера рассеивающего объекта. При построении распределений по количеству частиц становится видно, что преобладающей фракцией являются индивидуальные НЧ.
В [102] описаны НЧ на основе четырех- и шестилучевых блок-сополимеров s-ПЭГ45-б-П(L)ЛА30, которые характеризовались средним диаметром около 22 нм. Однако размер частиц на основе линейного блок-сополимера с аналогичной молекулярной массой гидрофобного и гидрофильного блока составил 30 нм, что может указывать на прогрессирующую тенденцию образования мономолекулярных НЧ с увеличением количества лучей. Интересно, что краевой угол смачивания в случае гомополимеров П(L)ЛАn уменьшался от 90° до 80° с увеличением количества лучей за счет возрастания числа концевых гидроксильных групп. В свою очередь, добавление гидрофильного блока в макромолекулы привело к существенному уменьшению краевого угла, значения которого увеличивались в интервале от 20° до 50° по мере возрастания количества лучей за счет снижения подвижности макромолекул. Данные результаты демонстрируют, что гидрофильность разветвленных блок-сополимеров может зависеть не только от их химического состава, но и от макромолекулярной архитектуры [102]. В [103] при изучении размера и морфологии НЧ на основе сверхразветвленного блок-сополимера ПЭГ45-б-П(L)ЛА29 с помощью ДРС было обнаружено, что водные суспензии (по аналогии с звездообразными образцами) состоят из двух фракций: индивидуальные НЧ размером 11–17 нм и их агрегаты. Это подтверждается и ПЭМ-снимками наночастиц выше и ниже их критической концентрации агрегации.
В [104] показано, что наряду с длиной гидрофобного блока на размер НЧ может оказывать влияние температура окружающей среды, концентрация водной суспензии, а также степень полимеризации гидрофильного сегмента. Было установлено, что при повышении температуры происходит уменьшение диаметра НЧ за счет дегидратации ПЭГ. Помимо этого, в полимерах, в которых гидрофильный блок представлен ПЭГ45, увеличение концентрации суспензии приводило к заметному росту диаметра НЧ из-за протекания вторичной агрегации. Однако в случае более длинного ПЭГ133 такого эффекта не наблюдалось. Изменение молекулярной массы ПЭГ при фиксированной длине блока П(L)ЛА оказывало влияние и на размер НЧ. Диаметр НЧ возрастал по мере ее уменьшения.
Методом наноосаждения в [105] получены НЧ на основе звездообразных блок-сополимеров с гидрофобным поли-D,L-лактид-со-гликолидным и гидрофильным ПЭГ-блоком. При молекулярной массе гидрофобного блока 4500 Да и фиксированной длине блока ПЭГ гидродинамический диаметр образующихся НЧ на основе трех-, четырех- и шестилучевых образцов составил 85, 122 и 208 нм соответственно. Загрузка гидрофобного лекарственного средства доксорубицина – также возрастала в интервале от 6.98 до 7.82% с увеличением числа лучей, а скорость его высвобождения из НЧ независимо от pH среды имела обратную зависимость, вероятно, из-за формирования более компактного ядра по мере возрастания числа лучей. В [105] также были проведены клеточные испытания, которые показали, что наибольшим клеточным поглощением и цитотоксичностью обладали НЧ на основе четырехлучевого блок-сополимера. Трехкратное увеличение клеточного поглощения по сравнению с трех- и шестилучевыми образцами в большей степени связано со средним размером самих НЧ, способствующим проникновению в клетки линии HeLa.
На загрузку и высвобождение лекарственного соединения могут оказывать влияние не только макромолекулярная архитектура и степень полимеризации гидрофобного блока, но и длина гидрофильного сегмента. В [106] на примере четырехлучевых блок-сополимеров s-ПЭГn-б-П(L)ЛА70, различающихся молекулярной массой ПЭГ, показано, что с ее увеличением наблюдается рост загрузки ибупрофена, а также существенно замедляется его высвобождение на поздних стадиях.
Наряду с основными характеристиками НЧ на клеточное поглощение может оказывать существенное влияние наличие активных лигандов в составе блок-сополимеров. Так, в [107] продемонстрировано различие в жизнеспособности клеток линии 4T1 в присутствии НЧ на основе 64-лучевого блок-сополимера ПЭГ-б-П(L)ЛА и его аналога, модифицированного фолиевой кислотой. Цитотоксичность НЧ с солюбилизированным доксорубицином, содержащих 5 мол. % ковалентно связанной фолиевой кислоты, оказалась существенно выше за счет ее взаимодействия с рецепторами раковых клеток. Увеличение содержания фолиевой кислоты от 5 до 10% привело к снижению стабильности НЧ в водной среде и выпадению их в осадок, вероятно, из-за специфического взаимодействия остатков фолиевой кислоты, находящихся на поверхности НЧ.
ЗАКЛЮЧЕНИЕ
Биоразлагаемые полимеры на основе лактида представляют собой перспективную платформу для наномедицины. Во многом это обусловлено их отличной биосовместимостью и широким набором инструментов для регулирования молекулярной структуры и свойств, что в сочетании с современными методами получения наночастиц открывает возможность конструирования эффективных систем доставки для решения самых разных задач. Важными характеристиками, влияющими на размер наночастиц и их способность солюбилизировать активные соединения, являются: относительный состав и молекулярная масса полимера, его молекулярная архитектура (линейная или разветвленная), гидрофобно-гидрофильный баланс, а также способность кристаллизоваться. Только комплекс методов исследования, включающих в себя динамическое рассеяние света, электронную микроскопию и малоугловое рентгеновское рассеяние, может дать полную информацию о морфологии и структуре наносомальной лекарственной формы. Биоразлагаемые наночастицы размером от 10 до 400 нм могут быть использованы для создания не только вакцин и наносомальных форм химиотерапевтических агентов, но и для преодоления различных биологических барьеров, доставки генов, нацеливания в различные воспаленные ткани, а также для многих других применений.
Синтез и исследование наночастиц PLGA, получение и исследование наночастиц на основе сополимеров ПЭГ-б-ПЛА выполнены при финансовой поддержке Российского научного фонда (проект 18-73-10079). Синтез звездообразных полимеров выполнен при частичной финансовой поддержке гранта Президента РФ для поддержки молодых российских ученых – кандидатов наук (проект МК-3658.2019.3). Эксперименты по динамическому рассеянию света проведены в ресурсном центре “ОПТИКА” НИЦ “Курчатовский институт”.
Список литературы
Северин С.Е. // Успехи химии. 2015. Т. 84. № 1. С. 43. https://doi.org/10.1070/RCR4468
Panyam J., Labhasetwar V. // Adv. Drug Deliv. 2012. V. 64. P. 61. https://doi.org/10.1016/j.addr.2012.09.023
Ding S., Khan A.I., Cai X. et al. // Materials Today. 2020. V. 37. P.112. https://doi.org/10.1016/j.mattod.2020.02.001
Davoodi P., Lee L.Y., Xu Q. et al. // Adv. Drug Deliv. 2018. V. 132. P. 104. https://doi.org/10.1016/j.addr.2018.07.002
Головин Ю.И., Клячко Н.Л., Мажуга А.Г. и др. // Российские нанотехнологии. 2018. Т. 13. С. 3.
Nagarajan R., Ganesh K. // J. Chem. Phys. 1989. V. 90. № 10. P. 5843.
Tuzar Z. // Solvents and self-organization of polymers / Eds. Webber S.E. et al. Dordecht: Kluwer Academic Publishers, 1996. P. 309.
Краснопольский Ю.М., Григорьева А.С., Кацай А.Г. и др. // Российские нанотехнологии. 2012. Т. 12. С. 132.
Riess G. // Prog. Polym. Sci. 2003. V. 28. № 7. P. 1107.
Zhulina E.B., Adam M., LaRue I. et al. // Macromolecules. 2005. V. 38. № 12. P. 5330.
Gohy J.F. // Adv. Polym. Sci. 2005. V. 190. P. 65.
Borisov O.V., Zhulina E.B., Frans A.M. et al. // Adv. Polym. Sci. 2011. V. 241. P. 57.
Matsumura Y., Maeda H. // Cancer Res. 1986. V. 46. № 12 (1). P. 6387.
Maeda H. // Adv. Enzyme Regul. 2001. V. 41. P. 189.
Matsumura Y. // Biomedical polymers and polymer therapeutics / Eds. Chiellini E., Sunamato J. Berlin; Heidelberg: Springer Verlag, 2001. P. 37.
Yuan F., Delian M., Fukumura D. et al. // Cancer Res. 1995. V. 55. P. 3752.
Kabanov A.V., Batrakova E.V., Alakhov V.Y. // J. Control Release. 2002. V. 82. P. 189.
Huang C.-K., Lo C.-L., Chen H.-H., Hsiue G.-H. // Adv. Funct. Mater. 2007. V. 17. P. 2291.
Godovannyi A.V., Vorontsov E.A., Gukasova N.V. et al. // Dokl. Biochem. Biophys. 2011. V. 439. P. 158. https://doi.org/10.1134/S160767291104003X
Yoo H.S., Park T.G. // J. Control. Release. 2004. V. 96. P. 273. https://doi.org/10.1016/j.jconrel.2004.02.003
Bae Y., Jang W.D., Nishiyama N. et al. // Mol. Biosyst. 2005. V. 1. P. 241.
Adams M.L., Lavasanifar A., Kwon G.S. // J. Pharm. Sci. 2003. V. 92. P. 1343.
Otsuka H., Nagasaki Y., Kataoka K. // Adv. Drug Deliv. 2003. V. 55. P. 403.
Kwon G.S. // Crit. Rev. Ther. Drug Carr. Syst. 2003. V. 20. P. 357.
Kursa M., Walker G.F., Roessler V. et al. // Bioconjug. Chem. 2003. V. 14. P. 222.
Torchilin V.P. // J. Control. 2001. V. 73. P. 137.
Peracchia M.T., Vauthier C., Passirani C. et al. // Life Sci. 1997. V. 61. P. 749.
Yamamoto Y., Nagasaki Y., Kato Y. et al. // J. Control. Release. 2001. V. 77. P. 27.
Nikitin M.P., Zelepukin I.V., Shipunova V.O. et al. // Nat. Biomed. Eng. 2020. V. 4. P. 717. https://doi.org/10.1038/s41551-020-0581-2
Жирник А.С., Никольская Е.Д., Жунина О.А. и др. // Российские нанотехнологии. 2018. Т. 13. С. 71.
Editorial. Nat. Nanotechnol. 2020. V. 15. P. 617. https://doi.org/10.1038/s41565-020-0757-7
Jackson L.A., Anderson E.J., Rouphael N.G. et al. // N. Engl. J. Med. 2020. https://doi.org/10.1056/nejmoa2022483
Deshantri A.K., Fens M.H., Ruiter R.W.J. et al. // J. Control. Release. 2019. V. 296. P. 232. https://doi.org/10.1016/j.jconrel.2019.01.028
Lammers T., Sofias A.M., van der Meel R. et al. // Nat. Nanotechnol. 2020. V. 15. P. 622. https://doi.org/10.1038/s41565-020-0752-z
Lin L.C., Huang C., Yao B. et al. // Adv. Funct. Mater. 2019. № 1807616. https://doi.org/10.1002/adfm.201807616
Hu C.-M.J., Chang W.-S., Fang Z.-S.et al. // Sci. Rep. 2017. V. 7. № 1. https://doi.org/10.1038/s41598-017-13316-0
Кедик С.А., Жаворонок Е.С., Седишев И.П. и др. // Разработка и регистрация лекарственных препаратов. 2013. Т. 3. № 4. С. 22.
Sedush N.G., Chvalun S.N. // Eur. Polym. J. 2015. V. 62. P. 198. https://doi.org/10.1016/j.eurpolymj.2014.11.038
Седуш Н.Г., Стрелков Ю.Ю., Чвалун С.Н. // Высокомолекулярные соединения. Б. 2014. Т. 56. С. 39. https://doi.org/10.7868/S2308113914010100
Sedush N.G., Izraylit V.V., Mailyan A.K. et al. // Mendeleev Commun. 2017. V. 27. P. 281. https://doi.org/10.1016/j.mencom.2017.05.021
Kalinin K.T., Sedush N.G., Chvalun S.N. // ChemistryOpen. 2020. V. 9. № 10. P.1027.
Fang F., Li M., Zhang J., Lee C.S. // ACS Mater. Lett. 2020. V. 2. P. 531. https://doi.org/10.1021/acsmaterialslett.0c00078
Tong R., Cheng J. // J. Am. Chem. Soc. 2009. V. 131. № 13. P. 4744.
Brzeziński M., Socka M., Kost B. // Polym. Int. 2019. V.68. № 6. P. 997. https://doi.org/10.1002/pi.5753
Enlow E.M., Luft J.C., Napier M.E., Desimone J.M. // Nano Lett. 2011. V. 11. № 2. P. 808. https://doi.org/10.1021/nl104117p
Jain R. // Biomaterials. 2000. V. 21. № 23. P. 2475.
Mundargi R.C., Babu V.R., Rangaswamy V. et al. // J. Control. Release. 2008. V. 125. № 3. P. 193. https://doi.org/10.1016/j.jconrel.2007.09.013
Bilati U., Allémann E., Doelker E. // J. Microencapsul. 2005. V. 22. № 2. P. 205.
Fessi H., Puisieux F., Devissaguet J.Ph. et al. // Int. J. Pharm. 1989. V. 55. № 1. P. R1.
Holzer M., Vogel V., Mäntele W. et al. // Eur. J. Pharm. Biopharm. 2009. V. 72. № 2. P. 428.
Stridsberg K.M., Ryner M., Albertsson A. // Degrad. Aliphatic Polyesters. 2002. V. 157. P. 41.
Tanzi M.C., Verderio P., Lampugnani M.G. et al. // J. Mater. Sci. Mater. Med. 1994. V. 5. № 6–7. P. 393.
Oxtoby D.W. // J. Phys. Condens. Matter. 1992. V. 4. P. 7627. https://doi.org/10.1088/0953-8984/4/38/001
Dalvi S.V., Dave R.N. // Ind. Eng. Chem. Res. 2009. V. 48. P. 7581.
Rao J.P., Geckeler K.E. // Prog. Polym. Sci. 2011. V. 36. P. 887. https://doi.org/10.1016/j.progpolymsci.2011.01.001
D’Oliveira A.M., Jäger E., Jäger A. et al. // Eng. Asp. 2013. V. 436. P. 1092. https://doi.org/10.1016/j.colsurfa.2013.08.056
Mora-Huertas C.E., Fessi H., Elaissari A. // Adv. Colloid Interface Sci. 2011. V. 163. P. 90. https://doi.org/10.1016/j.cis.2011.02.005
Lepeltier E., Bourgaux C., Couvreur P. // Adv. Drug Deliv. Rev. 2014. V. 71. P. 86. https://doi.org/10.1016/j.addr.2013.12.009
Danhier F., Ansorena E., Silva J.M. et al. // J. Control. Release. 2012. V. 161. P. 505. https://doi.org/10.1016/j.jconrel.2012.01.043
Dinarvand R., Sepehri N., Manoochehri S. et al. // Int. J. Nanomedicine. 2011. V. 6. P. 877. https://doi.org/10.2147/IJN.S18905
Safhi M.M., Sivakumar S.M., Jabeen A. et al. // Elsevier Inc. 2017. P. 159. https://doi.org/10.1016/b978-0-323-52725-5.00008-3
Batrakova E.V., Li S., Elmquist W.F. et al. // Br. J. Cancer. 2001. V. 85. P. 1987. https://doi.org/10.1054/bjoc.2001.2165
Yoo H.S., Lee K.H., Oh J.E., Park T.G. // J. Control. Release. 2000. V. 68. P. 419.
Балабаньян В.Ю., Ульянов А.М., Хоменко А.Ю. и др. // Биофармацевтический журнал. 2013. Т. 5. С. 28.
Godovannyi A.V., Vorontsov E.A., Gukasova N.V. et al. // Nanotechnologies in Russia. 2012. V. 7. P. 76. https://doi.org/10.1134/S1995078012010077
Suk J.S., Xu Q., Kim N. et al. // Adv. Drug Deliv. Rev. 2016. V. 99. P. 28. https://doi.org/10.1016/j.addr.2015.09.012
Порфирьева Н.Н., Мустафин Р.И., Хуторянский В.В. // Высокомолекуляр. соединения. С. 2020. Т. 62. № 1. С. 66.
Li S., Vert M. // Macromolecules. 2003. V. 36. № 21. P. 8008.
Li S.M., Rashkov I., Espartero J.L. et al. // Macromolecules. 1996. V. 29. № 1. P. 57.
Cameron N.S., Corbierre M.K., Eisenberg A. // Can. J. Chem. 1999. V. 77. № 8. P. 1311.
Gao Z., Varshney S.E., Wong S., Eisenber A. // Macromolecules. 1994. V. 27. № 26. P. 7923.
Zhang L., Eisenberg A. // Polym. Adv. Technol. 1998. V. 9. P. 677.
Riley T., Stolnik S., Heald C.R. et al. // Langmuir. 2001. V. 17. P. 3168.
Riley T., Heald C.R., Stolnik S. et al. // Langmuir. 2003. V. 19. № 20. P. 8428.
Ma C., Pan P., Shan G. et al. // Langmuir. 2015. V. 31. № 4. P. 1527.
Hagan S.A., Coombes A.G.A., Garnett M.C. et al. // Langmuir. 1996. V. 12. № 9. P. 2153.
Stolnik S., Heald C.R., Neal J. et al. // J. Drug Target. 2001. V. 9. № 5. P. 361.
Jelonek K., Li S., Wu X. et al. // Int. J. Pharm. 2015. V. 485. № 1–2. P. 357.
Theerasilp M., Nasongkla N. // J. Microencapsulation. 2012. V. 30. № 4. P. 390. https://doi.org/10.3109/02652048.2012.746746
Govender T., Riley T., Ehtezazi T. et al. // Int. J. Pharm. 2000. V. 199. № 1. P. 95. https://doi.org/10.1016/s0378-5173(00)00375-6
Kang N., Perron M.-È., Prud’homme R.E. et al. // Nano Lett. 2005. V. 5. № 2. P. 315. https://doi.org/10.1021/nl048037v
Heald C.R., Stolnik S., Kujawinski K.S. et al. // Langmuir. 2002. V. 18. № 9. P. 3669. https://doi.org/10.1021/la011393y
Wu X., El Ghzaoui A., Li S. // Langmuir. 2011. V. 27. № 13. P. 8000. https://doi.org/10.1021/la2014539
Zhang J., Wang L.-Q., Wang H., Tu K. // Biomacromolecules. 2006. V. 7. № 9. P. 2492. https://doi.org/10.1021/bm0601732
Kadina Y.A., Razuvaeva E.V., Streltsov D.R. et al. // Molecules. 2021. V. 26. № 3. P. 602. https://doi.org/10.3390/molecules26030602
Agrawal S.K., Sanabria-DeLong N., Coburn J.M. et al. // J. Control. Release. 2006. V. 112. № 1. P. 64. https://doi.org/10.1016/j.jconrel.2005.12.024
Venkatraman S.S., Jie P., Min F. et al. // Int. J. Pharm. 2005. V. 298. № 1. P. 219. https://doi.org/10.1016/j.ijpharm.2005.03.023
Agrawal S.K., Sanabria-DeLong N., Tew G.N., Bhatia S.R. // Macromolecules. 2008. V. 41. № 5. P. 1774. https://doi.org/10.1021/ma070634r
Razuvaeva E.V., Kulebyakina A.I. et al. // Langmuir. 2018. V. 34. № 50. P. 15470. https://doi.org/10.1021/acs.langmuir.8b03379
Blanazs A., Armes S.P., Ryan A.J. // Macromol. Rapid. Commun. 2009. V. 30. P. 267.
Mai Y., Eisenberg A. // Chem. Soc. Rev. 2012. V. 41. P. 5969.
Shuai X., Merdan T., Schaper A.K. et al. // Bioconjug. Chem. 2004. V. 15. № 3. P. 441. https://doi.org/10.1021/bc034113u
Shuai X., Ai H., Nasongkla N. et al. // J. Control. Release. 2004. 98. № 3. P. 415. https://doi.org/10.1016/j.jconrel.2004.06.003
Elhasi S., Astaneh R., Lavasanifar A. // Eur. J. Pharm. Biopharm. 2007. V. 65. № 3. P. 406. https://doi.org/10.1016/j.ejpb.2006.12.022
Zhang Y., Jin T., Zhuo R.-X. // Colloids Surf. B. 2005. V. 44. № 2–3. P. 104. https://doi.org/10.1016/j.colsurfb.2005.06.004
Tyrrell Z.L., Shen Y., Radosz M. // Prog. Polym. Sci. 2010. V. 35. № 9. P. 1128. https://doi.org/10.1016/j.progpolymsci.2010.06.003
Michalski A., Brzezinski M., Lapienis G., Biela T. // Prog. Polym. Sci. 2018. V. 89. P. 159. https://doi.org/10.1016/j.progpolymsci.2018.10.004
D’Arcy R., Burke J., Tirelli N. // Adv. Drug Deliv. Rev. 2016. V. 107. P. 60.
Jones R.G., Kahovec J., Stepto R.F.T. et al. // Compendium of polymer terminology and nomenclature – IUPAC recommendations 2008. Cambridge. Royal Society of Chemistry, 2009.
Baron M., Hellwich K.H., Hess M. et al. // Pure Appl. Chem. 2009. V. 81. P. 1131.
Korhonen H., Helminen A., Seppälä J.V. // Polymer. 2001. V. 42 № 18. P. 7541. https://doi.org/10.1016/s0032-3861(01)00150
Liu Q., Cai C., Dong C.-M. // J. Biomed. Mater. Res. 2009. V. 88A. № 4. P. 990. https://doi.org/10.1002/jbm.a.31945
Prabaharan M., Grailer J.J., Pilla S. et al. // Macromol. Biosci. 2009. V. 9. № 5. P. 515. https://doi.org/10.1002/mabi.200800269
Park S.Y., Han B.R., Na K.M. et al. // Macromolecules. 2003. V. 36. № 11. P. 4115. https://doi.org/10.1021/ma021639l
Ma G., Zhang C., Zhang L. et al. // J. Mater. Sci.: Mater. Med. 2015. V. 27. № 1. https://doi.org/10.1007/s10856-015-5610-4
Ding A., Zhou Y., Chen P., Nie W. // Colloid Polymer Sci. 2017. V. 295. № 9. P. 1609. https://doi.org/10.1007/s00396-017-4141-6
Prabaharan M., Grailer J.J., Pilla S. et al. // Biomaterials. 2009. V. 30. № 16. P. 3009. https://doi.org/10.1016/j.biomaterials.2009.02.011
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии