Российские нанотехнологии, 2021, T. 16, № 4, стр. 482-493
ВОЗМОЖНОСТИ МОДИФИКАЦИИ ЧАСТИЦ НА ОСНОВЕ СОПОЛИМЕРОВ ЛАКТИДА С ГЛИКОЛИДОМ ПОСЛОЙНОЙ АДСОРБЦИЕЙ ПОЛИЭЛЕКТРОЛИТОВ ДЛЯ СОЗДАНИЯ СРЕДСТВ АДРЕСНОЙ ДОСТАВКИ ЛЕКАРСТВ
Т. В. Букреева 1, 2, *, И. В. Марченко 1, 2, О. И. Тимаева 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
* E-mail: bukreeva@crys.ras.ru
Поступила в редакцию 09.11.2020
После доработки 18.02.2021
Принята к публикации 21.02.2021
Аннотация
В обзоре рассмотрены возможности метода послойной адсорбции полиэлектролитов на коллоидных частицах для создания средств доставки лекарств и исследования последних лет в области разработки носителей на основе частиц из сополимеров лактида с гликолидом и полиэлектролитной оболочки для адресной доставки лекарств. Показаны примеры включения функциональных веществ в ядро или многослойную оболочку носителей, а также формирования комплексных систем, содержащих разные целевые агенты в ядре и оболочке. Рассмотрено влияние состава полиэлектролитной оболочки на свойства получаемых частиц. Продемонстрирована перспективность модификации частиц из сополимеров лактида с гликолидом методом послойной адсорбции полиэлектролитов для разработки новых средств адресной доставки лекарств.
ОГЛАВЛЕНИЕ
Введение
1. Возможности послойной адсорбции полиэлектролитов для создания средств доставки лекарств
2. Влияние полиэлектролитной оболочки на свойства частиц поли(лактид-со-гликолида), загруженных лекарством
3. Включение целевых веществ в полиэлектролитную оболочку частиц
4. Комплексные частицы, включающие функциональные вещества в ядро из сополимеров лактида с гликолидом и в полиэлектролитную оболочку
5. Применение метода послойной адсорбции для создания систем адресной доставки лекарств на основе частиц поли(лактид-со-гликолида)
6. Модификации методики послойной адсорбции для создания оболочек на частицах поли(лактид-со-гликолида)
Заключение
ВВЕДЕНИЕ
Одним из направлений Стратегии научно-технического развития Российской Федерации является переход к персонализированной медицине, высокотехнологичному здравоохранению и технологиям здоровьесбережения, в том числе за счет рационального применения лекарственных препаратов [1]. Разработка инновационных лекарственных препаратов и повышение эффективности уже существующих требуют обеспечения селективности действия биологически активных веществ и снижения их побочных эффектов, что может быть реализовано за счет создания новых систем направленной доставки [2]. Перспективным подходом является наноинкапсулирование препарата, позволяющее, с одной стороны, изолировать целевое соединение от окружающей среды и повысить его биоабсорбцию, а с другой стороны, обеспечить пролонгированное действие, а также накопление и контролируемое высвобождение лекарства в определенном месте организма или компартменте клетки [3].
В настоящее время в качестве наноконтейнеров адресной доставки лекарств рассматривается целый ряд органических наночастиц и капсул – липосомы, липидные частицы, дендримеры, частицы геля, полимерные мицеллы и другие [4]. Особое место занимают частицы из сополимеров лактида с гликолидом. Поли(лактид-со-гликолид) (ПЛГ) является одним из наиболее часто используемых синтетических материалов для медицины в качестве скаффолдов для тканевой инженерии благодаря его биобезопасности, биоразлагаемости и биосовместимости [5, 6]. При гидролизе ПЛГ разлагается до мономеров, легко метаболизирующихся в цикле Кребса [7].
ПЛГ-частицы широко исследуются с точки зрения их применения в качестве наноконтейнеров доставки лекарств [8]. Интерес представляет модификация поверхности частиц полимерными слоями, что может регулировать их поверхностные свойства, обеспечивать пролонгированный выход и способствовать созданию комплексных систем, включающих в ядро и оболочку контейнера лекарственные вещества различной природы.
Универсальным способом создания оболочек на поверхности органических и неорганических частиц является последовательная адсорбция противоположно заряженных полиэлектролитов (ПАПЭ) – так называемый метод “layer-by-layer” [9, 10]. Преимущество этого подхода заключается в способности полиэлектролитных (ПЭ) слоев легко и равномерно покрывать субстрат, не повреждая его [11, 12]. Для формирования оболочки может быть использован широкий ряд веществ с различными физико-химическими свойствами. Межслоевое взаимодействие зависит от силы электростатической связи между выбранными поликатионами и полианионами. Структуры, полученные методом ПАПЭ для медицинских применений, представляют собой платформу из последовательно нанесенных противоположно заряженных биосовместимых полимеров с возможностью загрузки лекарственными веществами. При этом скорость высвобождения лекарства можно контролировать путем варьирования взаимодействия между слоями [13]. Кроме того, функциональность оболочки может быть расширена с помощью включения в ее состав различных органических и неорганических наночастиц и молекул. Способы такой модификации были разработаны для создания нанокомпозитных ПЭ-капсул, чувствительных к внешним физическим воздействиям с целью регулируемого вскрытия оболочек [14, 15].
Одним из компонентов оболочек, полученных методом ПАПЭ, могут быть белки, предназначенные для инкапсулирования. Модификация частиц ПЛГ послойной адсорбцией позволяет осуществить связывание белковых молекул в многослойной структуре оболочки, что приводит к снижению их диффузии через слои, а также защищает от деструкции, продлевая срок сохранения биологической активности [16–18]. Такой подход позволяет контролировать высвобождение биомолекул и поверхностные механические свойства. Профили высвобождения можно регулировать, варьируя количество слоев оболочки и концентрацию молекул белка.
В последних работах по модификации частиц ПЛГ методом ПАПЭ для получения ядер использовали сополимеры лактида с гликолидом молекулярной массой от 7–17 [19, 20] до 530 кДа [17]. Однако чаще всего эта величина составляла порядка десятков килодальтон [16, 21–30]. При этом соотношение мономерных звеньев лактида и гликолида было в основном 50:50 [17, 19–21, 23, 25–28, 30, 31], но также использовали соотношения 65:35 [29], 75:25 [16, 22, 24], 90:10 [32, 33]. Ранее показано, что это соотношение влияет на стабильность частиц ПЛГ [34, 35]. Помимо ядер с “гладкой” поверхностью адсорбцию полиэлектролитов проводили на пористых микросферах ПЛГ [16, 17, 31], загрузка которых функциональным веществом существенно выше. Однако использование пористых частиц приводит к меньшему “взрывному” высвобождению лекарства (“burst release”) [36].
Для формирования оболочек на поверхность частиц ПЛГ наносили такие синтетические и натуральные полиэлектролиты, как гиалуроновая кислота [13, 17, 37], хитозан [17, 24], поли-L-гистидин [20], полиэтиленгликоль-блок-поли-L-глутаминовая кислота [20], альгинат натрия [24], полиаллиламин гидрохлорид (ПАГ) [38], бычий сывороточный альбумин (БСА) [38], полистиролсульфонат натрия (ПСС) [38], поли-L-лизин (ПЛЛ) [38, 39] и другие. Было показано, что адсорбция сильно скрученных полимерных цепей приводит к образованию толстого слоя с развитой поверхностью [21]. В ряде работ перед нанесением многослойной оболочки частицы ПЛГ предварительно стабилизировали полиэтиленимином (ПЭИ) [22, 25, 37] для образования положительно заряженной поверхности. ПЭИ является высокоэффективным агентом для трансфекции и способствует использованию наночастиц в качестве средств доставки генов.
Частицы ПЛГ с многослойными ПЭ-оболочками предложено применять для доставки противоопухолевых препаратов [19, 21, 27], лечения диабета [31], стимуляции адаптивного иммунитета [22], сосудистой терапии [13, 23], тканевой инженерии [25, 40]. В качестве лекарственных средств в такие системы включали цисплатин [19], иматиниб [20], тетрандрин [23], паклитаксел [24], инсулин [31], фукоидан [41] и другие.
Таким образом, объединение ПЛГ-частицы и ПЭ-оболочки в одной системе является перспективной стратегией разработки новых средств доставки лекарств. В обзоре рассмотрены возможности метода ПАПЭ на коллоидных частицах для создания средств доставки лекарств и научные работы последних лет по получению и исследованию систем на основе ПЛГ-частиц с ПЭ-оболочкой.
1. ВОЗМОЖНОСТИ ПОСЛОЙНОЙ АДСОРБЦИИ ПОЛИЭЛЕКТРОЛИТОВ ДЛЯ СОЗДАНИЯ СРЕДСТВ ДОСТАВКИ ЛЕКАРСТВ
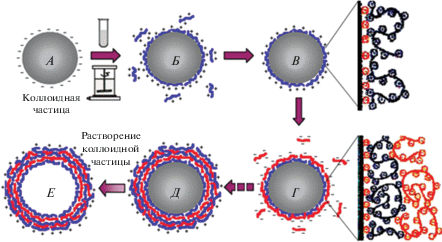
Впервые применить метод ПАПЭ для формирования многослойных оболочек на коллоидных частицах предложили в 1998 г. Е. Донас, Г. Сухоруков и их коллеги по Институту коллоидов и межфазных границ Общества Макса Планка (Германия) [42]. Суть методики заключается в следующем (рис. 1) [43]: частицы, обладающие поверхностным зарядом (например, отрицательным) (рис. 1, А), адсорбируют из раствора противоположно заряженный полимерный ион полиэлектролита (поликатион) в виде петель, благодаря чему поверхность коллоидной частицы перезаряжается (рис. 1, Б). После отмывки частиц с полимерным слоем от несвязанного полиэлектролита (рис. 1, В) их можно снова поместить в раствор с противоположно заряженным полиионом (теперь – полианионом), что опять приведет к перезарядке поверхности (рис. 1, Г). При этом частицы отделяют от растворов с помощью центрифугирования или фильтрования. Многократное повторение описанной выше процедуры приводит к формированию многослойной полимерной оболочки (рис. 1, Д), проницаемой на наноуровне. В условиях нерастворимости комплекса полианион/поликатион можно удалить частицу-ядро и получить полую капсулу (рис. 1, Е).
Рис. 1.
Схема формирования оболочки на поверхности заряженной коллоидной частицы методом последовательной адсорбции полиэлектролитов (“layer-by-layer”).
Модификация коллоидных частиц методом ПАПЭ позволяет управлять их поверхностными свойствами, что имеет большое значение при конструировании носителей для доставки лекарств. Например, показано [44–46], что ПЭ-покрытие контейнеров с масляным ядром позволяет регулировать их взаимодействие с клеточной мембраной. Контейнеры на основе комплекса хитозана и ксантановой камеди, дополнительно заполимеризованного под действием низкочастотного ультразвука на границе раздела вода/масло прямой эмульсии, обладали достаточно высоким отрицательным зарядом поверхности (ζ-потенциал около –50 мВ), и присутствие тимохинона (липофильного лекарственного вещества, обладающего противовоспалительным и противоопухолевым эффектами) в соевом масле ядра не оказывало существенного влияния на поверхностный заряд капсул [44]. Однако отрицательный заряд может препятствовать накоплению капсул в опухолевых клетках, так как известно, что эти клетки имеют более высокий отрицательный поверхностный заряд по сравнению с нормальными клетками из-за экспрессии сиаловой кислоты [47] и присутствия большого количества сульфата гепарина [48]. В связи с этим поверхность капсул покрывали слоем ПЛЛ с помощью методики ПАПЭ [44]. ПЛЛ широко используют для модификации носителей, в том числе для адресной доставки лекарств [49]. В результате адсорбции поверхность контейнера перезарядилась и ζ-потенциал составил около +20 мВ. В экспериментах in vitro было показано, что модификация ПЛЛ примерно вдвое увеличивает накопление полученных контейнеров в клетках мышиной меланомы M3 [44].
В [45] с использованием ультразвуковой обработки получены субмикрокапсулы из диэтиламиноэтилдекстрана и ксантановой камеди на ядре из соевого масла и путем электростатической адсорбции проведена модификация таких капсул ПЛЛ. Исходные капсулы имели средний размер 720 ± 40 нм и ζ-потенциал –40 мВ. В результате покрытия капсул ПЛЛ их поверхность приобретает положительный заряд (ζ = +25 мВ). Изучено взаимодействие исходных и модифицированных капсул с ленгмюровским монослоем 1,2-димиристоил-sn-глицеро-3-фосфохолина в качестве модельной клеточной мембраны [45, 46]. Изображения, полученные с помощью брюстеровского микроскопа, показали существенное различие взаимодействия капсул с монослоем (рис. 2). Если для образца исходных капсул на границе раздела фаз визуализируются только едва заметные ньютоновские кольца, означающие присутствие капсул в приповерхностном слое (рис. 2а), то на снимках, полученных на субфазе с капсулами, покрытыми ПЛЛ, присутствуют большие яркие пятна – агрегаты капсул (рис. 2б). Это означает, что электростатическое взаимодействие с противоположно заряженными молекулами фосфолипида обеспечивает концентрирование капсул под монослоем.
Рис. 2.
Изображения в брюстеровском микроскопе конденсированных монослоев липида (модельной клеточной мембраны) через 50 мин после добавления в субфазу капсул из диэтиламиноэтилдекстрана и ксантановой камеди (а) и капсул, покрытых поли-L-лизином (б). Размер изображений – 311 × 418 мкм.

В [50] показано, что для пористых частиц карбоната кальция структурной модификации ватерита (потенциальных носителей лекарственных веществ) покрытия одним ПЭ-слоем недостаточно для регулировки сильного взаимодействия ядра с монослоем стеариновой кислоты, моделирующим клеточную мембрану.
Помимо управления поверхностными свойствами метод ПАПЭ позволяет создавать на коллоидных частицах оболочку с дополнительными функциональными элементами. Например, в ПЭ-оболочку могут быть включены плазмонно-резонансные [51, 52] или магнитные [53, 54] наночастицы. В [55, 56] нанокомпозитные ПЭ-капсулы, легко перемещающиеся под действием внешнего магнитного поля, получены с использованием in situ-синтеза наночастиц оксида железа. Также методом ПАПЭ были созданы капсулы, включающие в себя наноалмазы – уникальный нанообъект, обладающий собственной флуоресценцией, и апконвертирующие наночастицы, использованные в качестве локальных термодатчиков [57]. Широкие возможности визуализации носителей доставки лекарств дает включение в ПЭ-оболочку различных флуоресцентных красителей [58]. Кроме того, продемонстрировано, что модификация ПЭ-оболочки некоторыми красителями, например природным порфирином гематином, приводит к снижению ее проницаемости и способствует инкапсуляции водорастворимого низкомолекулярного лекарственного вещества [59].
При создании носителей лекарственных веществ из коллоидных частиц и полимерной оболочки использование метода ПАПЭ может обеспечить эффективную загрузку препаратом за счет его включения в ПЭ-оболочку. Например, при получении системы интраназальной доставки на основе пористых частиц CaCO3 было продемонстрировано, что содержание снотворного препарата золпидема в результате его адсорбции на частицах составляет 5.7 мас. %, а добавление золпидема в раствор при нанесении на частицы четырех ПЭ-слоев позволяет повысить загрузку до 13.4 мас. % [60].
Важную роль при разработке средств доставки лекарств играет возможность биоразложения системы. Биодеградация обеспечивает безопасность выведения носителя из организма после осуществления его функции и может быть применена для высвобождения лекарства. Методом ПАПЭ можно получать оболочки из широкого ряда биодеградируемых полимеров, таких как полисахариды (например, декстран-сульфат (ДС), хитозан) и полипептиды (поли-L-аргинин (ПАрг), ПЛЛ и другие). В [61] впервые продемонстрирована возможность ферментативного разложения ПЭ-капсул. Было показано, что капсулы с оболочкой из четырех бислоев ДС и ПАрг деградируют за 2 ч в растворе проназы с концентрацией 1 мг/мл и полностью исчезают в результате их инкубации с клетками почки африканской зеленой мартышки в течение 60 ч. Оболочки, состоящие из ДС и хитозана, были успешно разрушены при добавлении хитозаназы [62]. В [63] осуществлено постепенное расщепление оболочки капсул из полипептидов ПАрг и поли-L-аспарагиновой кислоты под действием проназы, помещенной внутрь оболочки, в результате чего происходило высвобождение инкапсулированной ДНК. При проведении экспериментов in vivo на лабораторных грызунах [64] было обнаружено, что через 16 дней после подкожного введения большинство микрокапсул проникает в клетки и происходит их постепенная деградация. С увеличением числа ПЭ-слоев повышалась стабильность микрокапсул после их поглощения клетками.
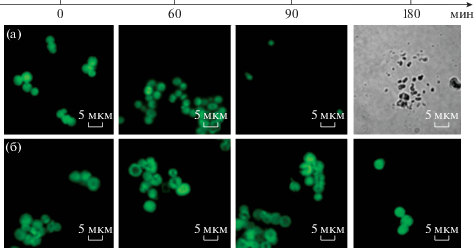
С участием авторов обзора было проведено изучение воздействия проназы на оболочки, состоящие из разного числа слоев полиэлектролитов [65]. На ядрах карбоната кальция были получены капсулы из ПАрг и поли-L-глутаминовой кислоты (ПГлу), содержащие внутри декстран, меченый флуоресцеинизотиоцианатом. Оболочки капсул состояли из 8 и 16 ПЭ-слоев – (ПАрг/ПГлу)4 и (ПАрг/ПГлу)8. Изображения, полученные методом конфокальной флуоресцентной лазерной сканирующей микроскопии, показали, что уже после 60 мин инкубации основная часть инкапсулированного соединения выходит из капсул (рис. 3). В результате ферментативной реакции средний диаметр капсул уменьшался более чем на 3 мкм для 8-слойных капсул (рис. 3а–3в) и менее чем на 2 мкм для 16-слойных капсул (рис. 3г–3е). Это происходит благодаря перестройке полимерной оболочки в результате разрушения некоторой части полипептидов. В качестве контроля капсулы выдерживали без фермента при температуре 37°С в течение 60 мин, в результате чего их размер не изменился.
Рис. 3.
Изображения, полученные методом конфокальной флуоресцентной лазерной сканирующей микроскопии, полиэлектролитных капсул (ПАрг/ПГлу)4 до (а) и после 60 (б) и 90 мин (в) воздействия проназы и (ПАрг/ПГлу)8 до (г) и после 60 (д) и 90 мин (е) воздействия проназы.

Таким образом, замедлить процесс биодеградации ПЭ-оболочки можно, увеличив количество биополимерных слоев. Также регулировать скорость ферментативного разложения мультислойной капсулы можно путем включения слоев недеградируемых полимеров в состав оболочки из биоразлагаемых полиэлектролитов [65]. Методом ПАПЭ на кальцийкарбонатных частицах с последующим растворением ядра были получены полые капсулы из ПАрг/ПГлу с бислоем ПАГ/ПСС в составе оболочки. Было показано, что при замене двух внутренних слоев оболочки (общий состав оболочки ПАГ/ПСС/(ПАрг/ПГлу)3) (рис. 4а) биодеградация несколько замедляется по сравнению с оболочкой (ПАрг/ПГлу)4 (рис. 3б) (с 60 до 90 мин). Оболочки состава (ПАрг/ПГлу)3/ПАГ/ПСС демонстрируют существенное снижение биодеградируемости (рис. 4б). Это можно объяснить тем, что проназа сначала взаимодействует с синтетическими полиэлектролитами, которые препятствуют ее доступу к биоразлагаемой части оболочки и тем самым затрудняют реакцию ферментативного разложения.
Рис. 4.
Изображения в конфокальном флуоресцентном лазерном сканирующем микроскопе капсул ПАГ/ПСС/(ПАрг/ПГлу)3 (а) и (ПАрг/ПГлу)3ПАГ/ПСС (б) до и после 60, 90 и 180 мин ферментативного разложения.
Таким образом, модификация ПЛГ-частиц методом ПАПЭ может существенно расширить возможности этих носителей. Далее приведен обзор научных статей последних лет, в которых получены и исследованы такие системы.
2. ВЛИЯНИЕ ПОЛИЭЛЕКТРОЛИТНОЙ ОБОЛОЧКИ НА СВОЙСТВА ЧАСТИЦ ПОЛИ(ЛАКТИД-СО-ГЛИКОЛИДА), ЗАГРУЖЕННЫХ ЛЕКАРСТВОМ
Инкапсуляция плохо растворимого лекарственного препарата в полимерные наночастицы улучшает его фармакодинамику и терапевтические свойства, уменьшает побочные эффекты лекарства. Именно для этих целей перспективно использовать частицы ПЛГ. Однако сами такие частицы обладают слабоотрицательным поверхностным зарядом [19, 24], снижающим эффективность взаимодействия с отрицательно заряженными клеточными мембранами. Для придания поверхности ПЛГ положительного заряда может быть использована оболочка из поликатиона, например хитозана. В [19] получены ПЛГ-частицы с загруженным в них противораковым средством цисплатином (средний размер частиц 126 нм, ζ = –12.7 мВ), на их поверхность адсорбировали слой хитозана из растворов с разной концентрацией. В результате адсорбции размер частиц увеличился до 165 нм при концентрации хитозана 2 × 10–6 М, а поверхность приобрела положительный заряд – ζ-потенциал составил 19.6 мВ. При изучении цитотоксичности структур (ПЛГ-цисплатин)/хитозан в сопоставлении со свободным цисплатином по отношению к клеткам рака яичников SKOV-3 установлено, что для частиц характерно высокое первоначальное высвобождение цисплатина. Значение концентрации, вызывающее 50%-ное ингибирование роста популяции клеток (IC50), в случае частиц (ПЛГ-цисплатин)/хитозан ~16 мкМ для 24 ч и 5 мкМ для 48 ч, в то время как для свободного препарата ~11 мкМ для 24 ч и 16 мкМ для 48 ч [19].
Управление взаимодействием частиц ПЛГ с клетками за счет формирования многослойных ПЭ-оболочек показано в [22]. Изучали цитотоксичность частиц, покрытых оболочками состава (ПЭИ/ДС)3/ПЭИ и (ПЭИ/ДС)4, по отношению к макрофагам J774A. Капсулы с положительно заряженным внешним слоем обладали большей цитотоксичностью при концентрациях ~5 × 107/мл. Увеличение молекулярной массы ПЭИ, образующего верхний слой оболочки, с 2 до 750 кДа способствовало увеличению цитотоксичности частиц.
Частицы ПЛГ характеризуются способностью к длительному устойчивому выходу лекарства, а также, как правило, демонстрируют первоначальное “взрывное” высвобождение. Формирование ПЭ-структур на поверхности ПЛГ-частиц позволяет управлять скоростью высвобождения инкапсулированного вещества. Например, оболочку из хитозана и альгината использовали для регулировки высвобождения противоопухолевого препарата доксорубицина [21]. Доксорубицин загружали в ПЛГ-ядра при их получении методом двойной эмульсии. В ходе работы установлены оптимальные условия формирования многослойных структур на ПЛГ-частицах методом ПАПЭ. Средний размер исходных частиц ПЛГ, загруженных доксорубицином, составил 172 нм, а частиц с оболочкой состава (хитозан/альгинат)3 – 196 нм (по данным динамического рассеяния света (ДРС)). Скорость высвобождения и количество вышедшего доксорубицина снижались с увеличением количества нанесенных ПЭ-слоев. Для исходных ПЛГ-частиц с доксорубицином и этих частиц с шестислойной ПЭ-оболочкой первоначальное “взрывное” высвобождение лекарства составило 55 и 6%, а полупериод высвобождения – менее 1 ч и более 61 ч соответственно. Наночастицы с шестислойной оболочкой обладали высокой противоопухолевой активностью – массовый процент ингибирования роста опухоли (саркомы мыши) составил 83% для загруженных частиц “ядро-оболочка”, 61% для ПЛГ-частиц и 24% для раствора доксорубицина [21].
Похожую систему использовали для инкапсуляции гидрофобного противоракового препарата паклитаксела [24]. На загруженные ПЛГ-частицы наносили слои хитозана и альгината натрия, что приводило к существенному увеличению размеров частиц по данным сканирующей электронной микроскопии (табл. 1). Частицы ПЛГ/хитозан/альгинат по сравнению с частицами ПЛГ и ПЛГ/хитозан имели наивысшие эффективности инкапсуляции и загрузки и самую низкую скорость высвобождения паклитаксела (табл. 1). Частицы с оболочкой из хитозана и альгината натрия показали также лучшую способность к ингибированию раковых клеток гепатоцеллюлярной карциномы HepG 2, при этом не нанося вред здоровым клеткам.
Таблица 1.
Влияние полиэлектролитной оболочки на параметры ПЛГ-частиц с паклитакселом [24]
| Частицы | Средний размер, нм | ζ-потен-циал, мВ | Эффективность, % | Высвобождение лекарства за 12 ч, % | |
|---|---|---|---|---|---|
| инкапсуляции | загрузки | ||||
| ПЛГ | 228 | –2.7 | 13.4 | 7.6 | >50 |
| ПЛГ/ хитозан | 573 | +17.4 | 29.9 | 22.3 | 43 |
| ПЛГ/ хитозан/ альгинат | 895 | –10.6 | 69.3 | 45.6 | 23 |
Влиянию ПЭ-оболочки на скорость высвобождения лекарства и взаимодействию с клетками также посвящена работа [23]. Продемонстрировано, что присутствие четырех ПЭ-бислоев (ПСС/ПАГ)4 на ПЛГ-частицах (средний размер частиц 141 нм по данным ДРС), предварительно загруженных тетрандрином, уменьшает скорость высвобождения лекарственного вещества по сравнению с трехслойными структурами (ПАГ/ПСС/ПАГ). Адсорбция в качестве последнего слоя положительно заряженного полиэлектролита (трехслойная структура) обеспечивает лучшее взаимодействие с отрицательно заряженными клеточными мембранами карциномы легкого человека А549, увеличивая вероятность захвата частиц раковыми клетками.
В [31] пористые микросферы ПЛГ, предварительно загруженные инсулином, с помощью методики ПАПЭ покрывали оболочкой из поливинилового спирта и чувствительного к глюкозе сополимера акриламидфенилбороновой кислоты и N-винилкапролактама. Было показано, что после адсорбции восьми слоев частицы остаются сферическими, но при этом почти все поры в ПЛГ закрыты. Первоначальный быстрый выход инсулина из загруженных пористых частиц составил 55%, а из частиц с многослойной оболочкой ~20%. Микросферы ПЛГ продемонстрировали способность высвобождать инсулин в течение 15 дней, многослойное покрытие продлевало высвобождение до 25 дней, причем скорость высвобождения инсулина из частиц с оболочкой заметно увеличивалась с повышением концентрации глюкозы в среде. Разработанные многослойные структуры эффективно регулировали уровень глюкозы в крови у мышей с диабетом в течение, как минимум, 18 дней при том, что в случае непокрытых ПЛГ-частиц через 7 дней после инъекции концентрация глюкозы в крови увеличивалась.
Интерес представляет работа [40], в которой ПЭ-оболочкой покрывали не сферические ПЛГ-частицы, а пористые макрочастицы скаффолда цилиндрической формы (диаметр 0.9 см, высота 0.3 см, размер пор 200–300 нм). Адсорбция окисленного сульфата хондроитина и коллагена типа I позволила стабилизировать структуру скаффолдов и таким образом улучшить их термическую стабильность. Минерализация многослойной структуры осаждением наногидроксиапатита привела к улучшению поверхностных и механических свойств скаффолда по сравнению с минерализацией исходного ПЛГ-скаффолда. Было продемонстрировано, что полученный композитный каркас усиливает остеогенную дифференцировку мезенхимальных стволовых клеток костного мозга крыс.
3. ВКЛЮЧЕНИЕ ЦЕЛЕВЫХ ВЕЩЕСТВ В ПОЛИЭЛЕКТРОЛИТНУЮ ОБОЛОЧКУ ЧАСТИЦ
При использовании метода ПАПЭ лекарственное вещество может быть компонентом оболочки ПЛГ-частиц за счет его стабильного связывания либо непосредственно с поверхностью полимерных частиц, либо с молекулами одного из слоев оболочки. Такое включение может обеспечить замедленное высвобождение лекарства. Например, на ПЛГ-частицах была сформирована многослойная оболочка, содержащая антиоксидант глутатион и антикоагулянт гепарин [13]. Для этого сначала ПЛГ-частицы модифицировали стеариламином для придания их поверхности положительного заряда. Благодаря аминным группам ζ-потенциал частиц составил +30.3 мВ. Такие ядра использовали для нанесения оболочки методом ПАПЭ – адсорбировали слой гепарина, затем слой конъюгата ПЭИ с глутатионом и внешний слой – гиалуроновую кислоту. Полученные комплексные частицы имели гидродинамический размер 255 нм и ζ-потенциал –17.6 мВ. Хотя гепарин и является эффективным ингибитором свертывания крови, он проявляет нежелательные побочные эффекты, такие как геморрагические осложнения, тромбоцитопения и низкая биодоступность. Короткий период циркуляции гепарина из-за его отрицательного заряда и плохой проницаемости вызывает необходимость повторного введения. Из созданных в рассматриваемой работе комплексных частиц благодаря включению гепарина в ПЭ-оболочку в течение 96 ч высвободилось только ~10% антикоагулянта.
ПЛГ-частицы с ПЭ-оболочкой предложено использовать для доставки генного материала, а именно микроРНК, включая их в состав многослойной оболочки [37, 39]. В [39] отрицательно заряженная микроРНК miR-34a была адсорбирована между слоями поликатиона ПЛЛ. Конечные частицы имели гидродинамический диаметр 122 ± 8 нм и ζ-потенциал 32 ± 3 мВ. При помещении частиц с ПЭ-оболочкой в буфер с pH 7.4, имитирующий условия хранения и плазму крови, наблюдалось минимальное высвобождение микроРНК. В течение 5 дней при рН 5.5 (лизосомальные условия) высвободилось ~45% miR-34a. Разработанные частицы в отличие от просто комплекса ПЛЛ/miR-34a продемонстрировали превосходную интернализацию в раковые клетки TNA MDA-MB-231. Также была показана способность разработанных частиц эффективно доставлять ген-подавитель опухоли miR-34a в цитозоль клеток тройного негативного рака молочной железы, что приводило к ингибированию пролиферации клеток и остановке клеточного цикла.
В [37] предложена система для доставки микроРНК на основе ПЛГ-частиц с помощью включения методом ПАПЭ. На ПЛГ-ядра сначала наносили ПЭИ для образования положительно заряженной поверхности, на которую затем адсорбировали отрицательно заряженный слой микроРНК. Для защиты микроРНК от деградации поверх ее слоя снова наносили ПЭИ. Для формирования внешнего слоя была выбрана гиалуроновая кислота. Размер полученных частиц составил 229 нм.
В [30, 41] созданы частицы ПЛГ с ПЭ-оболочкой, содержащей в качестве полианиона полисахарид фукоидан – потенциальный препарат для лечения рака толстой кишки и молочной железы [66]. При этом в качестве поликатиона использовали поли-L-орнитин. В экспериментах in vitro и in vivo наночастицы с многослойной оболочкой демонстрировали лучшую биосовместимость по сравнению с исходными частицами ПЛГ.
4. КОМПЛЕКСНЫЕ ЧАСТИЦЫ, ВКЛЮЧАЮЩИЕ ФУНКЦИОНАЛЬНЫЕ ВЕЩЕСТВА В ЯДРО ИЗ СОПОЛИМЕРОВ ЛАКТИДА С ГЛИКОЛИДОМ И В ПОЛИЭЛЕКТРОЛИТНУЮ ОБОЛОЧКУ
Одним из преимуществ использования в качестве средств доставки лекарств частиц ПЛГ, покрытых с помощью метода ПАПЭ, является возможность инкапсулирования двух различных препаратов в ядро и оболочку носителя. В литературе за последние годы появился ряд работ, посвященных созданию таких систем.
Для комплексного лечения рака были предложены частицы с ядром из ПЛГ, загруженным гидрофобным лекарством иматинибом для иммунотерапии, и ПЭ-оболочкой, содержащей краситель йодид IR-780 для фототермического и фотодинамического воздействия на клетки опухоли [20]. В качестве полиэлектролитов использовали противоположно заряженные полимеры поли-L-гистидин и полиэтиленгликоль-блок-поли-L-глутаминовую кислоту. Полученные в результате ПАПЭ гибридные частицы усиливали фототермический и фотодинамический эффекты при облучении в ближнем ИК-диапазоне по сравнению с действием свободного красителя. Оболочка из четырех или шести полимерных слоев успешно предотвращала деградацию IR-780 под воздействием облучения в течение всего периода исследования.
В [30] ПЛГ-частицы при получении загружали доксорубицином, а затем на их поверхности формировали оболочку из поли-L-орнитина и фукоидана. И доксорубицин, и фукоидан являются противораковыми средствами. Было показано длительное высвобождение доксорубицина из частиц с многослойной оболочкой. С помощью конфокальной флуоресцентной лазерной сканирующей микроскопии in vitro установлено, что многослойные частицы успешно интернализируются клетками опухоли молочной железы (клеточная линия MCF-7) и присутствуют в цитоплазме после 4 ч инкубации. Частицы демонстрировали высокую способность убивать раковые клетки.
Интересно проведенное в [27] сопоставление включения одного и того же вещества, Бенгальского розового, в ПЛГ-ядро и в ПЭ-оболочку частиц. При получении коллоидных частиц ПЛГ с инкапсулированным красителем методом двойной эмульсии размер частиц был больше примерно в 3 раза (774 нм) по сравнению с покрытыми частицами (249 нм). При этом загрузка Бенгальским розовым составляла ~45% против 7.5%, полученных при включении целевого вещества в оболочку частиц с использованием метода ПАПЭ (адсорбция на слое хитозана). Контейнеры с загруженной оболочкой демонстрировали достаточно быстрое высвобождение красителя ~50% вещества за 90 мин, в то время как частицы с Бенгальским розовым в ядре показали более подходящие для медицинского использования сроки – до 60% в течение двух дней. Однако оба типа контейнеров эффективно ингибировали жизнеспособность раковых клеток линии HCC70 (тройной негативный рак молочной железы, карцинома 3-й степени), что делает их перспективным объектом дальнейших разработок.
Особое внимание привлекают возможности создания комплексных систем доставки лекарств на основе пористых частиц ПЛГ. При этом одно функциональное вещество может быть загружено в поры ядра, а другое – включено в состав ПЭ-оболочки. Так, например, были созданы микроконтейнеры с противовоспалительным средством α-меланоцит-стимулирующим гормоном и основным фактором роста фибробластов [16]. Сначала в макропористые ПЛГ-частицы адсорбцией включали гормон, затем на их поверхность наносили оболочку, адсорбируя вещества в следующем порядке: после α-меланоцит-стимулирующего гормона несколько слоев гиалуроновой кислоты и хитозана, затем гепарин, фактор роста фибробластов, гепарин и в заключение несколько слоев хитозана и гиалуроновой кислоты. Количество слоев из гиалуроновой кислоты и хитозана варьировали. Многослойная структура, сконструированная поверх α-меланоцит-стимулирующего гормона, служила барьером для его быстрого высвобождения благодаря замедлению диффузии из пористых ПЛГ-микросфер. Было показано, что трех ПЭ-слоев достаточно, чтобы предотвратить высвобождение гормона из многослойной структуры во время обработки. Оболочка, сформированная с помощью метода ПАПЭ, позволила контролировать высвобождение основного фактора роста фибробластов путем изменения количества и условий нанесения ПЭ-слоев. Увеличение количества покрывающих слоев до 11 привело к значительному снижению скорости высвобождения по сравнению с исходными ПЛГ-частицами. В экспериментах in vitro на клетках макрофагов было показано сохранение биологической активности α-меланоцит-стимулирующего гормона. При подкожном введении микроконтейнеров крысам наблюдалось снижение стимулированной воспалительной реакции после имплантации по сравнению с ПЛГ-частицами без противовоспалительного препарата и фактора роста.
Похожая многослойная структура была создана на основе пористых ПЛГ-микросфер, предварительно загруженных пептидом остеогенного роста, с включением костного морфогенетического белка-2 в состав ПЭ-оболочки: (хитозан/гиалуроновая кислота)2/гепарин/белок/гепарин/ (гиалуроновая кислота/хитозан)2 [17]. Добавление гепарина повышает эффективность связывания костного белка с ПЭ-слоями, повышая загрузку. Результаты исследований показали, что в течение первых 15 дней высвобождение пептида остеогенного роста минимально (<17%), затем оно значительно ускоряется, в то время как за тот же период высвобождается примерно 60% костного белка, после чего наблюдается очень медленный его выход. Микроконтейнеры с пептидом остеогенного роста и костным морфогенетическим белком-2 оказали больший эффект на пролиферацию мезенхимальных стволовых клеток костного мозга и остеогенную дифференцировку по сравнению с использованными биоактивными веществами в отдельности, что указывает на потенциальную синергетическую выгоду от последовательного скоординированного высвобождения нескольких пептидных биофакторов.
5. ПРИМЕНЕНИЕ МЕТОДА ПОСЛОЙНОЙ АДСОРБЦИИ ДЛЯ СОЗДАНИЯ СИСТЕМ АДРЕСНОЙ ДОСТАВКИ ЛЕКАРСТВ НА ОСНОВЕ ЧАСТИЦ ПОЛИ(ЛАКТИД-СО-ГЛИКОЛИДА)
При разработке систем адресной доставки лекарств необходимо обеспечить целевую направленность носителя. Высвобождение лекарства непосредственно в мишенях повышает его фармацевтическую эффективность и снижает побочные эффекты. Направленная доставка носителей лекарственных средств осуществляется, как правило, за счет модификации частиц специфическими соединениями, распознающими определенные рецепторы клеток. Например, мицеллы из ПЛГ и полиэтиленгликоля с привитой фолиевой кислотой использовали для специфического нацеливания на опухолевые ткани [67], так как раковые клетки сверхэкспрессируют рецепторы фолата. Химическая модификация фолиевой кислотой (непосредственная или через полиэтиленгликоль) наночастиц ПЛГ с адсорбированными полиакриловой кислотой и ПЭИ [32] или хитозаном и альгинатом [33] привела к увеличению захвата частиц раковыми клетками печени человека HepG2. Кроме этого, использование полисахаридов (хитозана и альгината) для покрытия ПЛГ-частиц позволяет избежать формирования так называемой “белковой короны” – адсорбции белков при контакте с кровью или другими жидкостями организма [33]. Для адресного нацеливания на Т-регуляторные клетки комплексные системы на основе ПЛГ-частиц модифицировали антителами [20]. В [13] предлагалось использовать внешний слой ПЭ-оболочки из гиалуроновой кислоты для специфического взаимодействия контейнеров с мезенхимальными стволовыми клетками костного мозга человека, содержащими многочисленные поверхностные маркеры CD44. Таким образом, поверхностная модификация ПЛГ-частиц методом ПАПЭ открывает широкие возможности реализации стратегии адресной доставки лекарственных средств.
6. МОДИФИКАЦИИ МЕТОДИКИ ПОСЛОЙНОЙ АДСОРБЦИИ ДЛЯ СОЗДАНИЯ ОБОЛОЧЕК НА ЧАСТИЦАХ ПОЛИ(ЛАКТИД-СО-ГЛИКОЛИДА)
Кроме традиционного способа получения оболочек на ПЛГ-частицах за счет послойной электростатической адсорбции полиэлектролитов в нескольких работах применяли модифицированные методики. Например, проводили химическую сшивку нанесенных ПЭ-слоев [28, 29, 38]. В основном в качестве сшивающего агента использовали глутаровый альдегид, который, однако, является токсичным [68] и может быть заменен на генипин [69]. Химической сшивкой модифицировали полученные на ПЛГ-частицах оболочки из бислоев ПАГ/БСА и ПЛЛ/БСА [38], ПАГ/фиброин шелка [28], ПАГ/ПСС [29]. Предложенный подход позволяет повысить механическую прочность оболочки до такой степени, что ядро может быть растворено с образованием стабильных гомогенных капсул. При этом размер образца снижался с микронного уровня до субмикронного, например при использовании тетрагидрофурана для удаления ядер из частиц ПЛГ/(ПАГ/БСА)3 диаметр полых капсул составил ~205 нм, а растворение ПЛГ смесью ацетона и 1-метил-2-пирролидона позволило снизить размер до 159 нм [38]. Методику химической сшивки ПЭ-оболочки из ПАГ и ПСС на поверхности частиц ПЛГ использовали для иммобилизации ферментов кислая фосфотаза и β-галактозидаза [29]. Такой способ авторы считают универсальным для инкапсулирования ферментов с целью повышения их стабильности в кровотоке с сохранением биологической активности.
Метод ПАПЭ также позволил получить капсулы на основе ПЛГ-частиц с нанесенными слоями только фиброина шелка [70]. Для формирования оболочки был использован способ послойной десольватации, перед адсорбцией каждого нового слоя частицы суспендировали в метаноле. Для химической сшивки слоев использовали глутаровый альдегид. Предложенная методика потребовала всего лишь семь слоев шелкового фиброина (общая толщина ~6 нм), чтобы при растворении ПЛГ-ядер смесью ацетона и 1-метил-2-пирролидинона (1:1) образовались достаточно жесткие устойчивые микрокапсулы. Оболочку на поверхности ядер ПЛГ модифицировали наночастицами Au для осуществления возможности комбинационной терапии химическими и фототермическими методами [70].
Оригинальный подход для инкапсулирования трансформирующего фактора роста TGF-β 3 был предложен в [25]. Сначала получали наночастицы из гепарина и ПЛЛ, загружая их фактором роста TGF-β 3 (по данным ДРС размер частиц составил 82 нм). Затем микросферы ПЛГ с предварительно адсорбированным ПЭИ на их поверхности погружали в раствор наночастиц на 24 ч. Было показано, что в результате адсорбции наночастицы из гепарина и ПЛЛ покрывали >60% поверхности микросфер. Разработанные комплексные частицы обладали лучшими характеристиками регенерации хрящевых тканей in vivo из мезенхимальных стволовых клеток костного мозга кролика по сравнению с исходными ПЛГ-частицами.
ЗАКЛЮЧЕНИЕ
Таким образом, частицы из сополимеров лактида с гликолидом с оболочкой, сформированной послойной адсорбцией полиэлектролитов, являются перспективной платформой для создания адресных средств доставки лекарств. Основные преимущества такой системы заключаются в возможности гибкой регулировки, во-первых, поверхностных свойств носителя для управления взаимодействием с клетками, включая использование нацеливающих фрагментов и молекул, во-вторых, высвобождения инкапсулированного вещества для обеспечения пролонгированного выхода или скоординированного воздействия нескольких препаратов. В связи с последним широкие перспективы открывает создание комплексных систем с включением разных по природе и/или биологическому действию веществ в ПЛГ-ядро и ПЭ-оболочку. Приведенные в обзоре результаты исследований подтверждают, с одной стороны, универсальность рассмотренного подхода формирования средств доставки лекарств как с точки зрения материалов носителя, так и инкапсулированных веществ, с другой стороны, возможности его модификаций для изменения свойств или функциональности наноконтейнера. ПЛГ-частицы с многослойными полиэлектролитными оболочками могут стать основой создания новых инновационных препаратов для применения в различных областях биомедицины будущего.
Работа выполнена при финансовой поддержке Национального исследовательского центра “Курчатовский институт”, приказ № 1058 от 02.07.2020 г.
Список литературы
Указ Президента Российской Федерации от 01.12.2016 г. № 642 “О Cтратегии научно-технического развития Российский Федерации” http://www.kremlin.ru/acts/bank/41449
Dilnawaz F., Acharya S., Sahoo S.K. // Int. J. Pharm. 2018. V. 538. P. 263. https://doi.org/10.1016/j.ijpharm.2018.01.016
Kutova O.M., Guryev E.L., Sokolova E.A. et al. // Cancers. 2019. V. 11. P. 68. https://doi.org/10.3390/cancers11010068
Aftab S., Shah A., Nadhman A. et al. // Int. J. Pharm. 2018. V. 540. P. 132. https://doi.org/10.1016/j.ijpharm.2018.02.007
Kim S.S., Sun Park M., Jeon O. et al. // Biomaterials. 2006. V. 27. № 8. P. 1399. https://doi.org/10.1016/j.biomaterials.2005.08.016
Karp J.M., Shoichet M.S., Davies J.E. // J. Biomed. Mater. Res. A. 2003. V. 64. № 2. P. 388. https://doi.org/10.1002/jbm.a.10420
Lü J.M., Wang X., Marin-Muller C. et al. // Expert Rev. Mol. Diagn. 2009. V. 9. № 4. P. 325. https://doi.org/10.1586/erm.09.15
Danhier F., Ansorena E., Silva J.M. et al. // J. Control. Release. 2012. V. 161. № 2. P. 505. https://doi.org/10.1016/j.jconrel.2012.01.043
Ariga K., Hill J.P., Ji Q. // Phys. Chem. Chem. Phys. 2007. V. 9. P. 2319.
Sukhishvili S.A. // Curr. Opin. Colloid Interface Sci. 2005. V. 10. P. 37. https://doi.org/10.1016/j.cocis.2005.05.001
Saurer E.M., Jewel S.M., Roenneburg D.A. et al. // Biomacromolecules. 2013. V. 14. № 5. P. 1696. https://doi.org/10.1021/bm4005222
Shukla A., Fang J.C., Puranam S., Hammond P.T. // J. Control. Release. 2012. V. 157. № 1. P. 64. https://doi.org/10.1016/j.jconrel.2011.09.062
Lee P.C., Zan B.S., Chen L.T., Chung T.W. // Int. J. Nanomed. 2019. V. 14. P. 1533. https://doi.org/10.2147/IJN.S174962
Bédard M.F., De Geest B.G., Skirtach A.G. et al. // Adv. Colloid Interface Sci. 2010. V. 158. P. 2. https://doi.org/10.1016/j.cis.2009.07.007
Timin A.S., Gao H., Voronin D.V. et al. // Adv. Mater. Interfaces. 2017. V. 4. P. 1600338. https://doi.org/10.1002/admi.201600338
Go D.P., Palmer J.A., Mitchell G.M. et al. // J. Biomed. Mater. Res. A. 2015. V. 103. № 5. P. 1849. https://doi.org/10.1002/jbm.a.35319
Zhang B.J., Han Z.W., Duan K. et al. // J. Biomed. Mater. Res. A. 2018. V. 106. № 1. P. 95. https://doi.org/10.1002/jbm.a.36210
Zuo Q., Guo R., Hona A. et al. // Biomed. Mater. 2015. V. 10. № 3. P. 35008.
Domínguez-Ríos R., Sanchez-Ramirez D.R., Ruiz-Saray K. et al. // Colloids Surf. B. 2019. V. 178. P. 199. https://doi.org/10.1016/j.colsurfb.2019.03.011
Ou W., Jiang L., Thapa R.K. et al. // Theranostics. 2018. V. 8. № 17. P. 4574. https://doi.org/10.7150/thno.26758
Chai F., Sun L., He X. et al. // Int. J. Nanomed. 2017. V. 12. P. 1791. https://doi.org/10.2147/IJN.S130404
Yang Y.W., Hsu P.Y.J. // Biomaterials. 2008. V. 29. № 16. P. 2516. https://doi.org/10.1016/j.biomaterials.2008.02.015
Meng R., Li K., Chen Z., Shi C. // J. Huazhong Univ. Sci. Technol. Med. Sci. 2016. V. 36. № 1. P. 14.
Wang F., Yuan J., Zhang Q. et al. // J. Biomater. Sci. Polym. Ed. 2018. V. 29. № 13. P. 1566. https://doi.org/10.1080/09205063.2018.1475941
Park J.S., Park K., Woo D.G. et al. // Biomacromolecules. 2008. V. 9. № 8. P. 2162. https://doi.org/10.1021/bm800251x
Na K., Kim S., Park K. et al. // J. Am. Chem. Soc. 2007. V. 129. № 18. P. 5788. https://doi.org/10.1021/ja067707r
Loya-Castro M.F., Sanchez-Mejia M., Sanchez-Ramirez D.R. et al. // J. Colloid Interface Sci. 2018. V. 518. P. 122. https://doi.org/10.1016/j.jcis.2018.02.013
Wang H., Du B., Li M. et al. // Mater. Lett. 2019. V. 237. P. 109. https://doi.org/10.1016/j.matlet.2018.11.082
Sieber S., Siegrist S., Schwarz S. et al. // Macromol. Biosci. 2017. V. 17. № 8. P. 110. https://doi.org/10.1002/mabi.201700015
Fan J., Liu Y., Wang S. et al. // RSC Adv. 2017. V. 7. № 52. P. 32786. https://doi.org/10.1039/C7RA04908K
Wu J.Z., Williams G.R., Li H.Y. et al. // Drug Deliv. 2017. V. 24. № 1. P. 1513. https://doi.org/10.1080/10717544.2017.1381200
Zhou J., Romero G., Rojas E. et al. // Macromol. Chem. Phys. 2010. V. 211. № 4. P. 404. https://doi.org/10.1002/macp.200900514
Zhou J., Romero G., Rojas E. et al. // J. Colloid Interface Sci. 2010. V. 345. № 2. P. 241. https://doi.org/10.1016/j.jcis.2010.02.004
Danhier F., Ansorena E., Silva J.M. et al. // J. Control. Release. 2012. V. 161. № 2. P. 505. https://doi.org/10.1016/j.jconrel.2012.01.043
Park T.G. // Biomaterials. 1995. V. 16. № 15. P. 1123. https://doi.org/10.1016/0142-9612(95)93575-X
Zhang Z., Bi X., Li H., Huang G. // Drug Deliv. 2011. V. 18. № 7. P. 536. https://doi.org/10.3109/10717544.2011.596584
Guter M., Breunig M. // Methods Mol. Biol. 2019. V. 1943. P. 153.
Zhao Q., Fang Zh.X., Chen M.M. et al. // Micro Nano Lett. 2018. V. 13. № 6. P. 835.
Kapadia C.H., Ioele S.A., Day E.S. // J. Biomed. Mater. Res. A. 2020. V. 108. № 3. P. 601. https://doi.org/10.1002/jbm.a.36840
Kong J., Wei B., Groth T. et al. // J. Biomed. Mater. Res. A. 2018. V. 106. № 10. P. 2714. https://doi.org/10.1002/jbm.a.36487
Cai D., Fan J., Wang S. et al. // R. Soc. Open Sci. 2018. V. 5. № 7. P. 180320. https://doi.org/10.1098/rsos.180320
Donath E., Sukhorukov G.B., Caruso F. et al. // Angew. Chem. Int. Ed. 1998. V. 37. P. 2201. https://doi.org/10.1002/(SICI)1521-3773(19980904)37:16<2201::AID-ANIE2201>3.0.CO;2-E
Букреева Т.В., Фейгин Л.А. // Природа. 2013. № 12. С. 78.
Akasov R., Borodina T., Zaytseva E. et al. // ACS Appl. Mater. Interfaces. 2015. V. 7. P. 16581. https://doi.org/10.1021/acsami.5b04141
Миронов Е.П., Бородина Т.Н., Букреева Т.В. // Коллоидный журнал. 2017. Т. 79. № 4. С. 461. https://doi.org/10.7868/S0023291217040097
Mironov E.P., Borodina T.N., Yurina D.G. et al. // Colloids Surf. B. 2019. V. 184. 110464. https://doi.org/10.1016/j.colsurfb.2019.110464
Marquez M., Nilsson S., Lennartsson L. et al. // Anticancer Res. 2004. V. 24. P. 1347.
Ang I.L., Poon T.C.W., Lai P.B.S. et al. // J. Proteome Res. 2006. V. 5. P. 2691. https://doi.org/10.1021/pr060109r
Tian H., Lin L., Jiao Z. et al. // J. Control. Release. 2013. V. 172. P. 410. https://doi.org/10.1016/j.jconrel.2013.06.026
Миронов Е.П., Марченко И.В., Артемов В.В., Букреева Т.В. // Коллоидный журнал. 2017. Т. 79. № 3. С. 304. https://doi.org/10.7868/S0023291217030107
Букреева Т.В., Парахонский Б.В., Скиртач А.Г. и др. // Кристаллография. 2006. Т. 51. № 5. С. 920.
Parakhonsky B.V., Bedard M., Bukreeva T.V. et al. // J. Phys. Chem. C. 2010. V. 114. P. 1996. https://doi.org/10.1021/jp904564v
Трушина Д.Б., Бурова А.С., Бородина Т.Н. и др. // Коллоидный журнал. 2018. Т. 80. № 6. С. 738. https://doi.org/10.1134/S0023291218060186
Palamarchuk K.V., Vantsyan M.A., Kamyshinsky R.A. et al. // Int. J. Nanotechnol. 2019. V. 16. № 6–10. P. 510. https://doi.org/10.1504/IJNT.2019.106622
Lyubutin I.S., Starchikov S.S., Bukreeva T.V. et al. // Mater. Sci. Eng. C. 2014. V. 45. P. 225. https://doi.org/10.1016/j.msec.2014.09.017
Букреева Т.В., Орлова О.А., Сульянов С.Н. и др. // Кристаллография. 2011. Т. 56. № 5. С. 940.
Borodina T., Yurina D., Sokovikov A. et al. // Polymer. 2021. V. 212. P. 123299. https://doi.org/10.1016/j.polymer.2020.123299
Марченко И.В., Плотников Г.С., Баранов А.Н. и др. // Коллоидный журнал. 2016. Т. 78. № 2. С. 163. https://doi.org/10.7868/S0023291216020087
Румянцева С.С., Букреева Т.В. // Коллоидный журнал. 2019. Т. 81. № 4. С. 508. https://doi.org/10.1134/S0023291219040141
Borodina T., Marchenko I., Trushina D. et al. // J. Pharm. Pharmacol. 2018. V. 70. P. 1164. https://doi.org/10.1111/jphp.12958
De Geest B.G., Vandenbroucke R.E., Guenther A.M. et al. // Adv. Mater. 2006. V. 18. P. 1005. https://doi.org/10.1002/adma.200502128
Itoh Y., Matsusaki M., Kida T., Akashi M. // Biomacromolecules. 2006. V. 7. P. 2715. https://doi.org/10.1021/bm060289y
Borodina T., Markvicheva E., Kunizhev S. et al. // Macromol. Rapid Commun. 2007. V. 28. P. 1894. https://doi.org/10.1002/marc.200700409
De Koker S., De Geest B.G., Cuvelier C. et al. // Adv. Funct. Mater. 2007. V. 17. P. 3754. https://doi.org/10.1002/adfm.200700416
Marchenko I., Yashchenok A., Borodina T. et al. // J. Control. Release. 2012. V. 162. P. 599. https://doi.org/10.1016/j.jconrel.2012.08.006
Atashrazm F., Lowenthal R.M., Woods G.M. et al. // Mar. Drugs. 2015. V. 13. № 4. P. 2327. https://doi.org/10.3390/md13042327
Zhao H., Yung L.Y.L. // Int. J. Pharm. 2008. V. 349. № 1–2. P. 256. https://doi.org/10.1016/j.ijpharm.2007.07.040
Takigawa T., Endo Y. // J. Occup. Health. 2006. V. 48. № 2. P. 75. https://doi.org/10.1539/joh.48.75
Manickam B., Sreedharan R., Elumalai M. // Curr. Drug Deliv. 2014. V. 11. № 1. P. 139.
Du B., Wang H., Tang H. et al. // Mater. Lett. 2017. V. 187. P. 106. https://doi.org/10.1016/j.matlet.2016.08.155
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


