Российские нанотехнологии, 2021, T. 16, № 4, стр. 578-584
АНАЛИЗ ТОКСИЧНОСТИ НАНОКОМПОЗИТА Cu2O, ИНКАПСУЛИРОВАННОГО В ПОЛИМЕРНУЮ МАТРИЦУ АРАБИНОГАЛАКТАНА
Е. А. Титов 1, *, Л. М. Соседова 1, Е. А. Капустина 1, Н. Л. Якимова 1, М. А. Новиков 1, Л. Г. Лисецкая 1, А. В. Лизарев 1
1 Восточно-Сибирский институт медико-экологических исследований
Ангарск, Россия
* E-mail: G57097@yandex.ru
Поступила в редакцию 14.12.2020
После доработки 14.12.2020
Принята к публикации 07.02.2021
Аннотация
Представлен анализ острой и подострой токсичности нанокомпозита (НК) оксида меди, инкапсулированного в природную полимерную матрицу арабиногалактана. Исследование проводили в два этапа. На первом изучали острую токсичность НК. Для этого белым мышам однократно перорально вводили водный раствор НК в дозе 2000 мг/кг. Исследование показало, что по данному параметру НК относится к малотоксичным веществам 5-го класса опасности. На втором этапе оценивали биологический ответ организма белых крыс при подостром внутрижелудочном воздействии НК Cu2ОАГ в дозе 500 мкг/кг (в пересчете по Cu) массы тела в течение 10 дней. Исследование показало увеличение содержания меди в ткани головного мозга, печени и почках по сравнению с контрольной группой. Выявлены морфологические и нейрофизиологические изменения в организме белых крыс при воздействии данного НК. В ткани печени отмечена выраженная макрофагальная реакция, заключающаяся в увеличении числа клеток Купфера в синусоидах органа. В ткани сенсомоторной коры головного мозга выявлено резкое снижение числа клеток астроглии, что указывает на избирательную цитотоксичность данного НК. При исследовании биоэлектрической активности сенсомоторной коры головного мозга животных отмечено снижение β-2-ритма фоновой электроэнцефалограммы, а также уменьшение амплитуды пиков P2 и N2-P3 зрительно вызванных потенциалов. Генотоксических эффектов при воздействии НК не выявлено.
ВВЕДЕНИЕ
Нанокомпозиты (НК) металлов являются одними из наиболее перспективных материалов для использования в медико-биологических целях. Благодаря малым размерам они легче транспортируются через биологические мембраны и проникают сквозь различные барьеры организма. Наночастицы (НЧ) меди и оксида меди широко применяются в биомедицинских целях, а также в промышленности при производстве полупроводников, теплоносителей, катализаторов [1, 2].
Благодаря антимикробным свойствам НК Cu являются перспективными материалами для разработки антимикробных препаратов (мази, капли), асептической упаковки и материалов с бактерицидными и фунгицидными свойствами [3, 4]. Одним из перспективных направлений использования НК Cu является регенеративная медицина [5]. Согласно литературным данным НЧ Cu способны модулировать клетки, цитокины и факторы роста, участвующие в механизме репарации поврежденной ткани, причем эффективнее, чем ионы меди [5, 6]. Гистологическая оценка способности НЧ Cu стимулировать репаративные функции ткани показала активную пролиферацию фибробластов, отложение коллагена и реэпителизацию поврежденного участка [6].
Нанотехнологии предлагают много новых возможностей в различных отраслях народного хозяйства. Вместе с тем остается актуальным вопрос о безопасности НК металлов для человека. Проведенные в [7, 8] исследования токсичности НК серебра, железа и гадолиния, инкапсулированных в полимерную матрицу арабиногалактана, показали, что данные НК способны оказывать токсическое действие на организм. При подостром воздействии в дозе 500 мкг/кг они способны вызывать гибель нейронов сенсомоторной коры головного мозга, в том числе развитие апоптоза в нейронах, а также нарушение нормальной реологии крови в органах и развитие белковой дистрофии гепатоцитов в печени.
Цель настоящей работы – исследование токсичности нанокомпозита оксида меди (Cu2OАГ), инкапсулированного в природную полимерную матрицу арабиногалактана, с оценкой морфологических, нейрофизиологических и генотоксических изменений в организме белых крыс.
МЕТОДЫ
Содержание меди в препарате Cu2OАГ составляло 7%. Исследование осуществляли в два этапа. На первом проводили оценку острой токсичности исследуемого НК. Исследование проводили согласно ГОСТу 32419-2013 [9]. Ввиду наличия малого количества исследуемого НК, вследствие высокой цены компонентов его синтеза, исследование острой токсичности проводили на белых мышах. Для этого десяти половозрелым мышам-самцам массой 20–25 г внутрижелудочно с помощью зонда вводили 0.5 мл водного раствора Cu2OАГ в дозе 2000 мг/кг массы тела животного. Животным контрольной группы в таком же режиме давали дистиллированную воду. Наблюдение за животными длилось 14 дней, после чего белых мышей декапитировали под легким эфирным наркозом и при вскрытии оценивали макроскопические изменения внутренних органов.
На втором этапе изучали подострое воздействие Cu2OАГ. Исследование осуществляли на 60 половозрелых беспородных белых крысах-самцах массой 200–220 г. Животные были разделены на две группы: опытную (n = 30) и контрольную (n = 30). Животным опытной группы внутрижелудочно с помощью зонда вводили 2 мл водного раствора Cu2OАГ в дозе 500 мкг/кг массы тела (в пересчете по Cu) в течение 10 дней. Животные контрольной группы в аналогичном режиме получали дистиллированную воду. Выбор дозы обусловлен ранее проведенными исследованиями НК серебра и гадолиния [7, 8], в которых при данной дозе наблюдались наиболее выраженные изменения морфологии ткани сенсомоторной коры головного мозга и печени.
Сразу после окончания воздействия крыс усыпляли путем декапитации под легким эфирным наркозом. Для исследования изымали головной мозг, печень и почки. Органы фиксировали в 10%-ном нейтральном формалине, рН 7.4 (BioVitrum, Россия), далее проводили по спиртам восходящей концентрации и заливали парафином. Из парафиновых блоков с помощью санного микротома МС-1 (Россия) готовили срезы толщиной 3–5 мк, которые окрашивали гематоксилином и эозином по методике [10]. В окрашенных срезах с помощью микроскопа Olympus BX 51 подсчитывали общее число нейронов на единицу площади, общее число клеток астроглии, общее число дегенеративно измененных нейронов (дегенеративно измененными считались темно-окрашенные нейроны без четко различимого ядра и цитоплазмы) и число актов нейронофагии.
Для определения биоэлектрической активности коры головного мозга при подостром воздействии Cu2OАГ части животных опытной (n = 8) и контрольной групп (n = 8) на следующий день после окончания введения вживляли нихромовые электроды. Вживление электродов проводили с помощью стереотаксической установки под анестезией (кетамин из расчета 0.15 мл/100 г и ксила (рометар) в дозе 0.075 мл/100 г массы тела внутрибрюшинно в смеси в одном шприце). Определение координат выполняли с помощью стереотаксического атласа мозга взрослой крысы. Координаты для вживления электродов в сенсомоторную зону коры головного мозга крыс: координата точки С 3: 1.5 мм от брегмы, 2 мм в сторону от сагиттального шва и 2 мм вглубь [11]. Индифферентный электрод вживляли в носовую пазуху. Для оценки функционального состояния центральной нервной системы животным проводили электроэнцефалографию (ЭЭГ). Регистрацию ЭЭГ-активности у крыс выполняли в условиях свободного поведения через 3–5 дней после вживления электродов в кору головного мозга [12]. Запись и обработку ЭЭГ проводили с помощью электроэнцефалографа и специальной компьютерной нейрофизиологической программы “Нейроспектр” (г. Иваново, Россия). Анализировали изменения следующих показателей ЭЭГ: распределение в процентах основных ритмов (δ, θ, α, β1, β2) ЭЭГ; амплитуду при проведении пробы со зрительными вызванными потенциалами (ЗВП) [11, 13].
Для оценки генотоксических эффектов исследуемого НК часть ткани печени и головного мозга исследовали методом “ДНК-комет” по протоколу [15]. Для этого образцы тканей лабораторных животных помещали в стеклянные пробирки с охлажденным до 4°С фосфатно-солевым буфером (ФСБ), содержащим 20 мM EDTA-Na2 и 10% DMSO (рН 7.5), и гомогенизировали стеклянным пестиком. Пробирки выдерживали 5 мин при комнатной температуре для осаждения крупных фрагментов тканей. Суспензии клеток в объеме 60 мкл вносили в пробирки с 240 мкл 1%-ного раствора легкоплавкой агарозы в ФСБ, подогретом до 42°С (микротермостат “Термит”, Россия), и ресуспендировали. Затем 60 мкл раствора агарозы с клетками наносили на предварительно покрытые 1%-ной универсальной агарозой предметные стекла, покрывали покровным стеклом и помещали на лед. Далее все операции проводили в затемненном помещении при желтом свете. После затвердевания агарозы (~5–10 мин) покровные стекла осторожно удаляли, микропрепараты помещали в стеклянную кювету (тип Шиффендекер), заливали предварительно охлажденным до 4°С лизирующим буфером (10 мM Tris-HCl (pH 10), 2.5 M NaCl, 100 мM EDTA-Na 2.1% TritonX-100, 10% DMSO) и инкубировали 1 ч. После микропрепараты переносили в электрофорезную камеру с охлажденным до 4°С буфером для электрофореза (300 мM NaOH, 1 мM EDTA-Na2 (pH > > 13)) и инкубировали в течение 20 мин для реализации щелочнолабильных сайтов и щелочной денатурации ДНК. После проводили электрофорез в течение 20 мин при напряженности поля 1 В/см и силе тока ~300 мA (20 В/см и 300 мA). По окончании электрофореза микропрепараты переносили в стеклянную кювету и фиксировали в 70%-ном растворе этилового спирта в течение 10 мин. После фиксации микропрепараты высушивали и хранили до анализа при комнатной температуре. Окраску препаратов осуществляли SYBR Green I, регистрацию проводили на микроскопе Olympus ВХ-51 (Япония), совмещенном с цифровой камерой Olympus Е-420 (Япония) при увеличении ×100. Изображения ДНК-комет (по 100 клеток от каждого животного) анализировали с помощью программы “CASP 1.2.2”. В качестве показателя поврежденности ДНК использовали процентное содержание фрагментов ДНК в хвосте комет (процент ДНК в хвосте).
Часть органов подопытных животных (головной мозг, печень и почки) забирали для определения содержания в них меди. После взятия навески минерализацию проб проводили концентрированной азотной кислотой в индивидуальных автоклавах из тефлона, помещенных в микроволновую печь. Для определения концентрации меди использовали атомно-абсорбционный метод. Измерения проводили на приборе ААС-240DUO фирмы “Agilent Technologies” (США).
Все животные, полученные в виварии ФГБНУ ВСИМЭИ, содержались на стандартном рационе вивария, со свободным доступом к воде и пище. Манипуляции с животными проводили согласно правилам, принятым Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных целей (Страсбург, 1986). Опытные и контрольные группы подбирались в соответствии с методическими рекомендациями “Оценка безопасности наноматериалов”, утвержденными приказом № 280 от 12 октября 2007 г.
Для статистической обработки результатов применяли пакет прикладных программ “Statistica 6.0” (StatSoft, лицензия № AXXR004E642326FA). Результаты приведены в виде медианы и интерквартильного диапазона, Me (Q25–Q75). Для сравнений достоверности различий полученных результатов между группами использовали непараметрический U-критерий Манна–Уитни. Нулевые гипотезы об отсутствии различий между группами отвергали при достигнутом уровне значимости соответствующего статистического критерия р ≤ 0.05.
РЕЗУЛЬТАТЫ
Однократное внутрижелудочное введение Cu2ОАГ в дозе 2000 мг/кг не приводило к гибели белых мышей в течение всего срока наблюдений. Поведение, внешний вид животных опытной группы, потребление ими корма и воды не имело отличий от животных контрольной группы. Макроскопическое обследование внутренних органов через 14 дней после введения НК также не показало отличий от контроля. Согласно ГОСТу 32419-2013 при отсутствии за период наблюдения гибели животных и видимых макроскопических изменений DL50 данного НК больше 2000 мг/кг, следовательно, исследуемое вещество может быть отнесено к 5-му классу опасности.
При подостром внутрижелудочном воздействии Cu2OАГ в дозе 500 мкг/кг анализ содержания меди в ткани головного мозга, печени (орган детоксикации) и почек (орган выведения) белых крыс показал, что ее уровень в данных органах значительно выше показателей контрольной группы.
Изучение морфологической структуры ткани головного мозга при подостром воздействии Cu2OАГ в дозе 500 мкг/кг показало, что кровенаполнение сосудов вещества мозга в норме, сосудистые стенки без изменений. Данные морфометрической оценки клеточных популяций сенсомоторной коры головного мозга белых крыс представлены в табл. 1.
Таблица 1.
Морфометрические показатели ткани сенсомоторной коры головного мозга белых крыс при подостром воздействии Cu2OАГ в дозе 500 мкг/кг, Me (Q25–Q75) (0.2 мм2)
| Опытная группа (n = 10) |
Контрольная группа (n = 10) |
|
|---|---|---|
| Число нормальных нейронов на единицу площади | 229.0 (206.0–263.0) | 244.0 (242.0–254.0) |
| Число клеток астроглии на единицу площади | 214.0 (169.0–226.0)* | 243.0 (233.0–263.0) |
| Число дегенеративно измененных нейронов на единицу площади | 5.5 (4.0–7.0) | 2.0 (2.0–4.0) |
| Число актов нейронофагии | 1.0 (0.0–4.0) | 2.0 (2.0–3.0) |
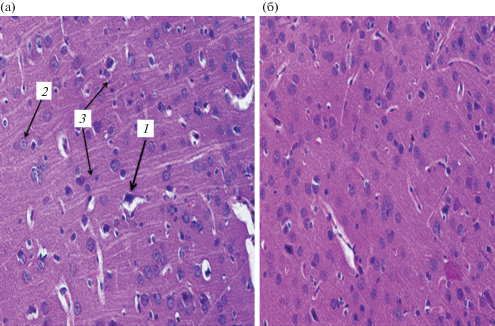
Установлено, что число нормальных нейронов на единицу площади не имело статистически значимого отличия от контроля (р = 0.5). При этом число клеток астроглии в опытной группе значительно ниже показателей контрольной группы (р = 0.02). Число дегенеративно измененных нейронов не имело статистически значимого отличия (р = 0.06). Число актов нейронофагии также не имело статистически значимого отличия от контрольной группы (р = 0.3) (рис. 1, табл. 1).
Рис. 1.
Ткань головного мозга белых крыс при подостром воздействии Cu2OАГ в дозе 500 мкг/кг: а – опытная группа, б – контрольная группа; 1 – дегенеративно измененный нейрон, 2 – нормальный нейрон, 3 – клетки астроглии. Окраска гематоксилин-эозин. Увеличение ×400.
В ткани печени кровенаполнение синусоидных капилляров, центральных вен и вен портальных трактов было без изменений. Портальные тракты не расширены, признаков склероза и воспаления не наблюдалось. Центральные вены расширены. Балочно-радиарное строение печеночных долек сохранено. Данные морфометрической оценки числа звездчатых макрофагов Купфера и полиядерных гепатоцитов печени белых крыс представлены в табл. 2.
Таблица 2.
Морфометрические показатели ткани печени белых крыс при подостром воздействии Cu2OАГ в дозе 500 мкг/кг, Me (Q25–Q75) (0.2 мм2)
| Опытная группа (n = 10) | Контрольная группа (n = 10) | |
|---|---|---|
| Число звездчатых макрофагов Купфера | 164.0 (155.0–167.0)* | 86.0 (70.0–102.0) |
| Число полиядерных гепатоцитов | 48.5 (40.5–52.5) | 38.5 (33.0–46.0) |
Число звездчатых макрофагов Купфера в синусоидных капиллярах было статистически значимо выше по сравнению с контрольными показателями (р = 0.04). Число полиядерных гепатоцитов не имело статистически значимого отличия от контрольной группы (р = 0.1) (рис. 2, табл. 2).
Рис. 2.
Ткань печени белых крыс при подостром воздействии Cu2OАГ в дозе 500 мкг/кг: а – опытная группа, б – контрольная группа; 1 – звездчатые макрофаги Купфера, 2 – полиядерные гепатоциты. Окраска гематоксилин-эозин. Увеличение ×400.

В ткани почек не выявлено изменений кровенаполнения коркового и мозгового вещества органа. Нарушения реологии крови в органе не отмечено. Состояние стенок почечных артерий и артериол в норме, как и интерстициального пространства. Строение почечных клубочков сохранено. Очагов воспаления или некроза почечной ткани не отмечено. Эпителий дистальных и проксимальных почечных канальцев в норме. Площадь капсулы Шумлянского–Боумена не имела статистически значимого отличия от контрольных показателей.
Подострое воздействие НК Cu2OАГ в дозе 500 мкг/кг вызывало изменения некоторых показателей биоэлектрической активности сенсомоторной коры головного мозга животных. Результаты распределения основных ритмов фоновой ЭЭГ крыс представлены в табл. 3.
Таблица 3.
Распределение ритмов фоновой записи ЭЭГ крыс при подостром воздействии Cu2OАГ в дозе 500 мкг/г, Me (Q25–Q75)
| Индекс ритмов, % | Контрольная группа (n = 8) |
Опытная группа (n = 8) |
|---|---|---|
| α | 4.45(3.15–5.10) | 2.65(1.50–3.10) |
| β1 | 1.50(1.20–1.65) | 0.95(0.40–1.40) |
| β2 | 1.60(1.45–1.80) | 0.75(0.30–1.20)* |
| θ | 12.60(10.60–15.40) | 10.25(9.40–12.70) |
| δ | 79.45(76.35–83.05) | 85.30(81.50–88.30) |
При анализе фоновой записи ЭЭГ крыс после подострого воздействия Cu2OАГ отмечено значительное снижение доли индекса β-2-ритма по сравнению с показателем контрольной группы при уровне значимости различий р = 0.014.
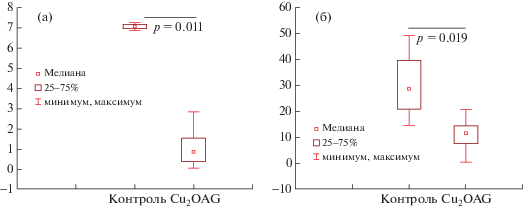
У крыс после подострого воздействия НК при проведении пробы с ЗВП отмечено уменьшение амплитуды пика P2 ЗВП по сравнению с таковым у интактных животных при р = 0.011. Кроме того, воздействие Cu2OАГ вызывало снижение амплитуды пика N2-P3 ЗВП относительно значения контрольных особей (р = 0.019) (рис. 3).
Рис. 3.
Амплитуда Р2 (а) и N2-P3 (б) ЗВП, мкВ при подостром воздействии Cu2OАГ в дозе 500 мкг/г. Различия статистически значимы по сравнению с контролем по критерию Манна–Уитни, p < 0.05.
Установленные нейрофизиологические изменения подтверждают неблагоприятные эффекты при подостром внутрижелудочном пути поступления НК Cu2OАГ в дозе 500 мкг/кг массы тела.
Анализ результатов исследования показал, что процентное содержание ДНК в хвостах комет в исследованных тканях не имело различий в опытной и контрольной группах экспериментальных животных.
ЗАКЛЮЧЕНИЕ
По оценке результатов исследования острой токсичности нанокомпозит Cu2OАГ относится к 5-му классу опасности (2000 < DL50 ≤ 5000 мг/кг). Следовательно, данный НК обладает относительно низкой опасностью по острой токсичности.
При подостром воздействии Cu2OАГ в дозе 500 мкг/кг (в пересчете по Cu) отмечается увеличение содержания меди в ткани головного мозга, печени и почек, что свидетельствует о биодоступности данного НК для органов и тканей. В ткани печени выявлена выраженная макрофагальная реакция, заключающаяся в увеличении числа звездчатых макрофагов Купфера в синусоидах органа. Данный показатель свидетельствует о возникновении в печени компенсаторных процессов вследствие подострого воздействия исследуемого НК. В ткани сенсомоторной коры головного мозга подопытных животных отмечается снижение общего числа клеток астроглии на единицу площади, что может указывать на избирательную цитотоксичность нанокомпозита Cu2OАГ. Учитывая важную роль астроглиальных клеток в формировании нормального гомеостаза нервной ткани [19], выявленная избирательная цитотоксичность способна привести к усугублению нейротоксического эффекта в ткани головного мозга в отдаленном периоде. В распределении ритмов фоновой записи ЭЭГ установлено уменьшение доли спектра β-2-ритма. При проведении пробы с ЗВП выявлено уменьшение амплитудных значений пика P2 и N2-P3 ЗВП, что свидетельствует о дестабилизирующих изменениях в биоэлектрической активности. Во многих исследованиях при патологическом состоянии, в частности развитии гипоксии, у крыс установлено нарушение распределения и снижение амплитуды ритмов ЭЭГ [15–18]. Выявленные изменения показателей нейрофизиологической активности, возможно, обусловлены снижением числа клеток астроглии в ткани головного мозга. Поскольку одна из основных функций астроглиальных клеток трофическая [19], вероятно, снижение их числа при подостром воздействии Cu2OАГ приводит к нарушению данной функции и, соответственно, возникновению изменений в функциональном состоянии нейронов, которое проявляется в результатах ЭЭГ.
Согласно литературным данным, многие металлические наночастицы, включая оксид меди, железо, серебро, оксид титана и никель, способны повреждать ДНК клеток. В результате прямого воздействия металлических наночастиц увеличивается содержание активных форм кислорода, что, вероятно, обусловливает токсическое действие веществ на генетический материал клеток [20]. В [21] продемонстрирована генотоксичность наночастиц оксида меди в культуре кератиноцитов человека. Результаты показали, что воздействие на клетки культуры наночастиц Cu2O приводило к дозозависимому увеличению “хвоста комет”, что позволило авторам сделать вывод о генотоксических свойствах наночастиц оксида меди. Однако результаты настоящего исследования, направленного на изучение генотоксических свойств нанокомпозита Cu2OАГ при подостром воздействии в дозе 500 мкг/кг, не выявили генотоксического эффекта препарата. Возможно, это связано с активацией комплекса адаптивных механизмов организма, отсутствующих в культуре клеток.
Таким образом, подострое внутрижелудочное введение нанокомпозита оксида меди Cu2OАГ в дозе 500 мкг/кг белым крысам вызывает проявление неблагоприятных биологических эффектов со стороны нервной системы и печени. Остается открытым вопрос о сохранности выявленных нарушений в отдаленном постконтактном периоде и влиянии их на функциональное состояние организма.
Список литературы
Aruoja V., Dubourguier Hi-Ch., Kasemets K. et al. // Sci. Total Environment. 2009. V. 407. № 4. P. 1461. https://doi.org/10.1016/j.scitotenv.2008.10.053
Fu X. // J. Cancer Ther. 2015. № 6. P. 889. https://doi.org/10.4236/jct.2015.610097
Богатырев М.А., Оранская Е.И., Галабурда М.В. и др. // Хiмiя, фiзика та технологiя поверхнi. 2016. Т. 7. № 1. С. 44. https://doi.org/10.15407/hftp07.01.044
Худякова А.В., Леконцева Т.Г., Федоров А.В. // Поволжский экологический журнал. 2018. № 3. С. 340. https://doi.org/10.18500/1684-7318-2018-3-340-348
Шурыгина И.А., Шурыгин М.Г. // Сибирское медицинское обозрение. 2018. № 4. С. 31.
Gopal A., Kant V., Gopalakrishnan A. et al. // Eur. J. Pharmacol. 2014. № 731. P. 8. https://doi.org/10.1016/j.ejphar.2014.02.033
Титов Е.А., Соседова Л.М., Новиков М.А. // Патологическая физиология и экспериментальная терапия. 2015. Т. 59. № 4. С. 41.
Titov E.A., Sosedova L.M., Novikov M.A. // Nanotechnologies in Russia. 2019. V. 14. № 3–4. P. 144. https://doi.org/10.1134/S1995078019020137
ГОСТ 32419-2013 Межгосударственный стандарт. Классификация опасности химической продукции. Общие требования. М: Росстандарт. 2013. 16 с.
Коржевский Д.Э. Краткое изложение основ гистологической техники для врачей и лаборантов-гистологов. СПб.: Кроф, 2005. 48 с.
Bures J., Petran M., Zachar J. // Electrophysiological Methods in Biological Research. New York: Academic Press, 1967. P. 653.
Авалиани Т.В., Серякова О.Р., Чабек-Гарбач Р. и др. // Журнал высшей нервной деятельности. 2002. Т. 52. № 5. С. 628.
Мурик С.Э. // Бюллетень ВСНЦ СО РАМН. 2004. Т. 3. № 1. С. 188.
MP 4.2.0014-10. Применение метода щелочного гель-электрофореза изолированных клеток для оценки генотоксических свойств природных и синтетических соединений: Метод. рекомендации. М. 2006.
Jensen F., Applegate C., Holtzman D. et al. // Ann Neurol.1991. № 29. P. 629.
Yang S., Jing S., Chen S. et al. // Exp. Brain. Res. 1994. №. 99. P. 431.
Zagrean L., Vatasescu R., Oprica M. et al. // Rom J. Physiol. 1995. № 32. P. 39.
Budzinska K., Ilasz R. // J. Physiol. Pharmacol. 2007. № 58. P. 85.
Афанасев Ю.И., Кузнецов С.Л., Юрина Н.А. Гистология, цитология и эмбриология. М: Медицина, 2006. 768 с.
Elespuru R., Pfuhler S., Aardema M. et al. // Toxicol. Sci. 2018. V. 164. № 2. P. 391. https://doi.org/10.1093/toxsci/kfy100
Alarifi S., Ali D., Verma A. // Int. J. Toxicol. 2013. № 32. P. 296. https://doi.org/10.1177/1091581813487563
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


