Российские нанотехнологии, 2021, T. 16, № 4, стр. 572-577
ВЫЖИВАЕМОСТЬ ИНФУЗОРИЙ Paramecium caudatum В ПРИСУТСТВИИ НАНОЧАСТИЦ ОКСИДА АЛЮМИНИЯ
М. А. Крючкова 1, *, Ф. С. Ахатова 1, Р. Ф. Фахруллин 1
1 Казанский (Приволжский) федеральный университет
Казань, Россия
* E-mail: maricshka80@gmail.com
Поступила в редакцию 04.09.2020
После доработки 09.10.2020
Принята к публикации 10.10.2020
Аннотация
Острая токсичность наночастиц оксида алюминия (Al2O3) размером 13–16 нм исследована методом биотестирования с использованием инфузорий Paramecium caudatum в диапазоне концентраций 10–100 мкг/мл. Оксид алюминия оказывает острое токсичное действие на парамеций в концентрациях 20–100 мкг/мл. В качестве критерия токсичности использовали значение средняя летальная доза (LD50), равное концентрации наночастиц, при которой смертность инфузорий по отношению к контролю достигала 50%. Значение LD50 для наночастиц Al2O3 составляет 23 мкг/мл при 24-часовой экспозиции. Согласно опубликованным данным токсическое действие наночастиц Al2O3 является специфическим и зависит от размера и поверхностного заряда частиц, от межфазного взаимодействия наночастиц с клеточной поверхностью, а также от концентрации и времени экспозиции.
ВВЕДЕНИЕ
Исключительные свойства наноматериалов обусловливают перспективы их широкого применения в промышленности [1]. Наночастицы (НЧ) оксидов металлов широко используются в производствах конструкционных материалов, катализаторов, накопителей энергии, красок, люминофоров, косметических и медицинских препаратов [2, 3]. Одним из важных направлений развития нанотехнологий является получение нанопорошков, 80% которых составляют порошки оксидов металлов, причем наиболее популярными и востребованными для производств являются НЧ оксида алюминия (Al2O3) [4]. Оксид алюминия используется для изготовления оптически прозрачной и конструкционной керамики, теплозащитных покрытий и лакокрасочных материалов, выступает в роли катализатора в ряде процессов органического синтеза [5, 6]. Вследствие больших объемов производства Al2O3 и незамкнутого характера многих технологических циклов, в которых он используется, данный наноматериал может быть значимым загрязнителем и представлять серьезную угрозу для окружающей среды [7]. Отметим, что токсический эффект от частиц нанодиапазона значительно больше, чем от аналогичных по составу частиц микронных размеров [8, 9].
Несмотря на распространенность, алюминий и его соединения относятся к токсичным элементам [10]. НЧ Al2O3 легко поглощаются различными клеточными культурами [11, 12], оказывая при этом цитотоксическое действие [12, 13] и обладая способностью к каталитической генерации свободных радикалов [14]. Пыль глинозема (~33 г/м3 за пять часов в день) вызывает сильное повреждение эпителия дыхательных путей крыс [15].
В природные воды алюминий и его соединения попадают естественным путем при частичном растворении глин и алюмосиликатов, а также в результате вредных выбросов промышленных предприятий и со сточными водами [15]. С каждым годом таких выбросов в окружающую среду становится все больше, а контроль за степенью загрязнения ими все ниже. Поскольку НЧ Al2O3 нерастворимы в воде и практически не способны к биологической деградации, они могут накапливаться в составе компонентов природных экосистем и оказывать губительное влияние на большинство живых организмов, обитающих в природных водоемах [16]. Установлено вредное действие водных дисперсий Al2O3 на дафний [17], пресноводных улиток [18], рыб [19], почвенных нематод [20] и насекомых [21].
Основными методами контроля экологического состояния водоемов продолжают оставаться физико-химические методы. Однако наряду с аналитическими методами все чаще применяются методы биологического тестирования, позволяющие оценить всю совокупность свойств исследуемой среды по ответным реакциям живых организмов. Такими организмами являются пресноводные инфузории, они широко распространены в водоемах и играют заметную роль в самоочистке воды. Являясь одноклеточными организмами, инфузории одновременно демонстрируют реакции на организменном и клеточном уровне, тем самым расширяя диапазон критериев оценки токсичности. К сожалению, вопросы реакции инфузорий на частицы Al2O3 изучены недостаточно.
Основная цель данного исследования – определение токсического эффекта наночастиц оксида алюминия в эксперименте на инфузориях Paramecium caudatum (P. caudatum).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для оценки токсичности НЧ Al2O3 использовали коммерческий препарат фирмы Sigma-Aldrich, представляющий собой нанодисперсный порошок белого цвета с диаметром частиц 16.4 ± ± 10.0 нм и ζ-потенциалом 44.3 ± 1.8. Измерение ζ-потенциала и гидродинамического диаметра частиц проводили с использованием прибора Zetasizer Nano ZS (Malvern).
НЧ Al2O3 были охарактеризованы с помощью темнопольной электронной микроскопии (ТЭМ) и атомно-силовой микроскопии (АСМ). АСМ-изображения получены с помощью микроскопа Dimension Icon (Bruker), работающего в режиме PeakForce Tapping, с использованием зонда ScanAsyst-Air (Bruker) (номинальная длина 115 мкм, наконечник радиусом 2 нм, жесткость пружины 0.4 Н м–1). Полученные данные обработаны с использованием программного обеспечения Nanoscope Analysis v.1.7. (Bruker). НЧ Al2O3 визуализировали при помощи высококонтрастной ТЭМ CytoViva®. ТЭМ-изображения получены с помощью конденсора CytoViva®, присоединенного к микроскопу Olympus BX51, оснащенному флюоритным объективом (×100) и CCD-камерой.
Для биотестирования водную суспензию НЧ Al2O3 готовили непосредственно перед исследованием. Для устранения агрегации суспензию обрабатывали ультразвуком (в течение 2 мин при 44 кГц и 40 Вт). Острую токсичность НЧ Al2O3 исследовали в концентрациях 100, 50, 40, 30, 25, 20, 15 и 10 мкг/мл при различных экспозициях (0.16, 0.5, 1, 3, 5 и 24 ч).
В качестве модельных организмов использовали равноресничных инфузорий P. caudatum. Оценку устойчивости инфузорий к воздействию НЧ Al2O3 проводили по методике [22], основанной на определении выживаемости инфузорий. P. caudatum культивировали в десятикратном разведении среды Лозина-Лозинского, приготовленной растворением следующих навесок солей в 1 л дистиллированной воды: NaCl (1.0 г), KCl (0.1 г), NaHCO3 (0.2 г), MgSO4 (0.1 г), CaCl2 (0.1 г) с добавлением водной суспензии дрожжей Saccharomyces cerevisiae (3 мл) при температуре 22–24°С. Для проведения экспериментов инфузорий отбирали вручную, используя микропипетку. Для наблюдения за парамециями использовали стереоскопический микроскоп Carl Zeiss Stemi 2000C. Для проведения биотестирования применяли культуральный планшет с лунками. Микропипеткой отбирали по 10–12 особей в минимальном количестве среды и переносили в лунки планшета. После помещения инфузорий в планшеты в контрольные лунки приливали по 0.2 мл культуральной среды, а в опытные – по 0.2 мл тестируемой пробы. Отмечали время начала биотестирования. В процессе экспозиции ни в контрольных, ни в опытных лунках кормление инфузорий не осуществлялось. Критерием токсичности служила гибель инфузорий. Неподвижные и изменившие форму клетки считали погибшими. Кроме того, оценивали изменение характера движения инфузорий.
Выживаемость инфузорий (N, %) определяли по формуле
где N2, N1– среднеарифметическое значение количества инфузорий в конце и начале опыта, шт.В качестве критерия токсичности использовали показатель средняя летальная доза (LD50), определяемый графически как концентрация исследуемого раствора, при которой токсичность составляет 50%.
Все эксперименты проводили в трех повторностях. При этом каждая серия опытов была выполнена не менeе трех раз. При статистической обработке полученных результатов использовали t-критерий Стьюдента. Достоверными считали различия при p ≤ 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Данное исследование направлено на изучение потенциально токсических эффектов, вызванных НЧ Al2O3, которые в настоящее время широко используются в промышленности. Типичные АСМ-изображения демонстрируют геометрию и размер частиц Al2O3, имеющих форму эллипсоидов и диаметр, равный 13–16 нм. Данные изображения максимально характеризуют топографию поверхности. Для визуализации частиц Al2O3 использовали ТЭМ (рис. 1).
Для оценки токсичности Al2O3 в качестве модели in vivo использовали P. caudatum – подвижные одноклеточные микроскопические организмы, питающиеся дрожжами и захватывающие другие частицы, суспендированные в водной среде. Парамеции имеют типичную форму эллипсоида, сами клетки прозрачные, что позволяет визуализировать органеллы, например пищеварительные вакуоли, заполненные дрожжевыми клетками (рис. 2а). С помощью усиленной ТЭМ можно наблюдать поглощение частиц Al2O3. Из рис. 2б видно, как частицы Al2O3 попадают в клетку P. caudatum из водной среды. Оксид алюминия ингибирует фагоцитарную активность у P. caudatum, при этом нарушается процесс образования пищеварительных вакуолей во всем диапазоне изученных концентраций. При более низких концентрациях НЧ Al2O3 были диффузно распределены в цитоплазме (рис. 2б). Например, оксид кремния в концентрации 5 мг/мл оказывает слаботоксичное действие [23], но при этом не препятствует образованию пищеварительных вакуолей даже при больших концентрациях. После попадания внутрь НЧ оксида кремния переносятся в пищеварительные вакуоли, визуализированные с помощью ТЭМ (рис. 2в).
Рис. 2.
ТЭМ-изображения инфузорий P. caudatum: а – контроль (стрелкой указаны пищеварительные вакуоли, заполненные дрожжевыми клетками), б –поглощение наночастиц оксида алюминия P. caudatum (обозначено стрелкой); визуализация распределения НЧ Al2O3 в цитоплазме P. caudatum (обозначено стрелками), в – визуализация заполненных частицами оксида кремния пищеварительных вакуолей (обозначено стрелками).

Высококонтрастные ТЭМ-изображения позволяют быстро, просто и эффективно наблюдать НЧ Al2O3 внутри прозрачных тел парамеций, так же как и в предыдущих исследованиях с микроскопическими червями Caenorhabditis elegans [24] и инфузориями P. caudatum [23].
В типичном эксперименте оценивали острую токсичность НЧ Al2O3 в диапазоне концентраций от 10 до 100 мкг/мл. При этом исследовали выживаемость инфузорий при различных экспозициях (табл. 1).
Таблица 1.
Выживаемость инфузорий P. caudatum (%) в зависимости от концентрации оксида алюминия
| C, мкг/мл | 0.16 ч | 0.5 ч | 1 ч | 3 ч | 5 ч | 24 ч |
|---|---|---|---|---|---|---|
| 100 | 34.2 ± 3.2 | 0 | 0 | 0 | 0 | 0 |
| 50 | 52.2 ± 3.6 | 29.2 ± 4.4 | 29.2 ± 4.2 | 21.9 ± 4.9 | 14.6 ± 4.9 | 14.6 ± 4.8 |
| 40 | 64.3 ± 3.4 | 42.9 ± 4.6 | 35.7 ± 4.3 | 28.6 ± 4.3 | 28.6 ± 4.2 | 21.4 ± 3.5 |
| 30 | 81.8 ± 4.4 | 63.6 ± 4.5 | 45.7 ± 4.5 | 45.4 ± 4.8 | 45.4 ± 4.3 | 42.4 ± 4.5 |
| 25 | 81.4 ± 3.8 | 70.8 ± 3.6 | 61.9 ± 3.6 | 53.0 ± 4.2 | 52.3 ± 4.7 | 44.2 ± 4.7 |
| 20 | 81.8 ± 3.7 | 81.8 ± 4.1 | 72.7 ± 3.9 | 64.5 ± 2.8 | 63.0 ± 2.9 | 60.5 ± 3.2 |
| 15 | 90.4 ± 2.3 | 86.7 ± 2.6 | 86.2 ± 2.8 | 78.3 ± 2.5 | 76.9 ± 2.9 | 75.9 ± 2.9 |
| 10 | 95.2 ± 2.0 | 92.6 ± 2.2 | 90.4 ± 2.3 | 88.3 ± 2.7 | 87.2 ± 2.7 | 85.6 ± 2.5 |
Для оценки выживаемости учитывали число мертвых особей. Показателями гибели инфузорий служат деформация тела, разрыв оболочки, лизис клетки, а также сохранение неподвижности. Через 0.16 ч эксперимента при концентрациях 100 и 50 мкг/мл отмечали отсутствие двигательной активности у 50% клеток. Через 0.5 ч при концентрации 100 мкг/мл наблюдали разрыв клеточной оболочки и лизис клеток, а при концентрации 50 мкг/мл около 30% клеток сохраняли двигательную активность. В остальных концентрациях большая часть клеток сохраняла нормальную двигательную активность. Показатели выживаемости инфузорий после 24 ч инкубации с Al2O3 представлены на рис. 3а. Наибольшее снижение выживаемости наблюдалось при концентрациях 20–100 мкг/мл, при которых Al2O3 оказывает острое токсичное действие на инфузории. Концентрации 10 и 15 мкг/мл оказывают слаботоксичное действие на парамеций.
Рис. 3.
Токсичность оксида алюминия на инфузориях P. caudatum: а – выживаемость инфузорий после 24 ч инкубации с оксидом алюминия, б – LD50 летальная доза оксида алюминия, вызывающая гибель 50% инфузорий за 24 ч.
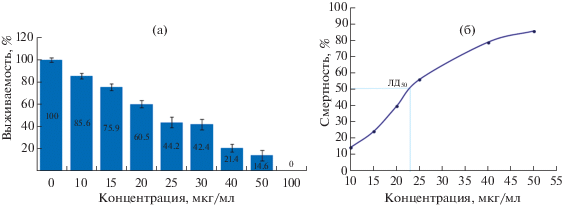
В качестве критерия токсичности использовали LD50 – летальная доза Al2O3, вызывающая гибель половины (50%) организмов за определенный промежуток времени (24 ч). В результате проведенных исследований параметры токсичности Al2O3 в остром опыте составили: LD50 = = 23 мкг/мл (рис. 3б).
В других исследованиях НЧ Al2O3 оказались менее токсичными. В [25] установлено, что концентрация Al2O3 (размер частиц 83 нм), при которой происходит гибель 50% инфузорий Paramecium multimicronucleatum в 48-часовой экспозиции, составляет 9269 мг/л. Токсичность НЧ Al2O3 (с размером частиц Δ50 7 и 70 нм) изучали по хемотоксическому ответу инфузорий P. caudatum [26]. Согласно проведенным исследованиям НЧ Al2O3 (Δ50 = 70 нм) оказались наиболее токсичными (LD50 = 1.22 мг/л), чем НЧ (Δ50 = 7 нм), которые не оказывали токсичного действия.
Несоответствие данных о зависимости токсичности НЧ Al2O3 от размера частиц может быть вызвано использованием авторами различных методов оценки токсичности.
Токсичность Al2O3 зависит от межфазного взаимодействия НЧ с клеточной поверхностью, а также от физико-химических свойств НЧ (размер и поверхностный заряд) [25]. С уменьшением размеров НЧ площадь поверхности увеличивается, что вызывает дозозависимое увеличение окислительного стресса [27]. Окислительный стресс является одним из основных механизмов токсического действия НЧ Al2O3, возникающий в условиях воздействия НЧ на водные организмы [26]. Также значимым фактором является заряд частиц. Наибольшую опасность представляют положительно заряженные частицы, обладающие высоким сродством к макромолекулам ДНК и, следовательно, несущие генотоксический потенциал [27].
Токсичность НЧ Al2O3 различна для разных тест-организмов. Было выявлено ингибирующeе влияние Al2O3 с размером частиц 70 нм на рост микроводорослей Сhlorella vulgaris (LD50 = 15 мг/л), а для Daphnia magna Al2O3 оказался менее токсичным, LD50 составляет более 100 мг/л [26]. Оксид алюминия (с размером частиц 16 нм) в концентрации 4 мг/л индуцирует необратимые гистопатологические поражения жаберных, печеночных и мозговых тканей пресноводных рыб Oreochromis mossambicus после 96 ч воздействия [19]. При сравнении среднелетальной дозы Al2O3 у разных видов выявлено, что инфузории P. caudatum являются более чувствительными организмами для оценки токсичности Al2O3 в водных средах (LD50 = 23 мкг/мл).
При анализе литературных данных можно сделать вывод, что токсическое действие НЧ Al2O3 является специфическим и зависит от размера и поверхностного заряда частиц, а также от концентрации и времени экспозиции.
Таким образом, высокая токсичность НЧ Al2O3 может быть вызвана небольшими размерами частиц (13–16 нм) и высокой проникающей способностью, что облегчает их перераспределение внутри клетки. Оксид алюминия, используемый в этом исследовании, демонстрирует положительный поверхностный потенциал (44 мВ), что также может способствовать увеличению токсичности. Известно, что НЧ Al2O3 способны генерировать активные формы кислорода, повреждать ДНК, нарушать экспрессию белков, деполяризовывать клеточную мембрану, вызывать морфологические изменения и гибель клеток [12, 28]. Оксид алюминия оказывает вредное воздействие на низшие водные организмы, участвующие в самоочищении водоемов и представляющие собой кормовые ресурсы для рыб. Следовательно, контаминация водной среды НЧ Al2O3 может оказывать негативное влияние на живые организмы и представлять опасность для водных экосистем.
Несмотря на то что инфузории как модельный объект широко используются для оценки токсичности, механизмы токсических эффектов НЧ Al2O3 на P. caudatum практически не изучены. Это свидетельствует о необходимости проведения дополнительных токсикологических исследований.
ЗАКЛЮЧЕНИЕ
Опасность наночастиц оксида алюминия оценивали по выживаемости инфузорий P. caudatum. НЧ Al2O3 оказывают острое токсическое воздействие на парамеций. При концентрации 100 мкг/мл (экспозиция 0.5 ч) наблюдается 100%-ная гибель инфузорий. Значение LD50 составляет 23 мкг/мл при 24-часовой экспозиции. Сравнительно высокая токсичность НЧ Al2O3 может быть вызвана небольшими размерами (13–16 нм) и положительным зарядом частиц, а также высокой проникающей способностью, что облегчает их перераспределение внутри клетки.
Работа выполнена за счет средств субсидии, выделенной Казанскому федеральному университету для выполнения государственного задания № 0671-2020-0058 в сфере научной деятельности. Работа выполнена в рамках программы повышения конкурентоспособности Казанского федерального университета за счет гранта президента Российской Федерации (МД-2153.2020.3).
Список литературы
Chatterjee R. // Environ. Sci. Technol. 2008. V. 2. P. 339. https://doi.org/10.1021/eS0870909
Gangwar J., Gupta B.K., Srivastava A.K. // Defense Sci. J. 2016. V. 66. № 4. P. 323. https://doi.org/10.14429/dsj.66.10206
Годымчук А.Ю., Савельев Г.Г., Зыкова А.П. Экология наноматериалов: учебное пособие. М.: БИНОМ. Лаборатория знаний, 2012. 272 с.
Зейналов О.А., Комбарова С.П., Багров Д.В. и др. // Обзоры по клинической фармакологии и лекарственной терапии. 2016. Т. 14. № 3. С. 24. https://doi.org/10.17816/RCF14324-33
Roussel N., Lallemant L., Chane-Ching J.Y. et al. // J. Am. Ceram. Soc. 2013. V. 96. № 4. P. 1039. https://doi.org/10.1111/jace.12255
Иванов В.В., Кайгородов А.С., Хрустов В.Р. и др. // Российские нанотехнологии. 2006. Т. 1. № 1–2. С. 201.
Шумакова А.А., Тананова О.Н., Арианова Е.А. и др. // Вопросы питания. 2012. Т. 81. № 6. С. 54.
Ma H., Williams P.L., Diamond S.A. // Environ. Pollut. 2013. V. 172. P. 76. https://doi.org/10.1016/j.envpol.2012.08.011
Моргалев Ю.Н., Гостева И.А., Моргалева Т.Г. и др. // Российские нанотехнологии. 2018. Т. 13. № 5–6. С. 97.
Parka E.J., Leeb G.H., Yoonc C. et al. // J. Appl. Toxicol. 2016. V. 36. P. 424. https://doi.org/10.1002/jat.3233
Di Virgilio A.L., Reigosa M., de Mele M.F. // J. Biomed. Mater. Res. A. 2010. V. 92. № 1. P. 80. https://doi.org/10.1002/jbm.a.32339
Radziun E., Dudkiewicz-Wilczynska J., Ksiaek I. et al. // Toxicol. In Vitro. 2011. V. 25. № 8. P. 1694.
Song Z.M., Tang H., Deng X. et al. // J. Nanosci. Nanotechnol. 2017. V. 17. № 5. P. 2881. https://doi.org/10.1166/jnn.2017.13056
Dong E., Wang Y., Yang S.T. et al. // J. Nanosci. Nanotechnol. 2011. V. 11. № 9. P. 7848. https://doi.org/10.1166/jnn.2011.4748
Шугалей И.В., Гарабаджиу А.В., Илюшин М.А., Судариков А.М. // Экологическая химия. 2012. Т. 21. № 3. С. 172.
Cardwell A.S., Adams W.J., Gensemer R.W. et al. // Environ. Toxicol. Chem. 2018. V. 37. P. 36. https://doi.org/10.1002/etc.3901
Pakrashi S., Dalai S., Humayun A. et al. // PLOS One. 2013. V. 8. № 9. P. e74003. https://doi.org/10.1371/journal.pone.0074003
Musee N., Oberholster P.J., Sikhwivhilu L., Botha A.M. // Chemosphere. 2010. V. 81. № 10. P. 1196. https://doi.org/10.1016/j.chemosphere.2010.09.040
Vidya P.V., Chitra K.C. // Int. J. Fisheries Aquatic Studies. 2018. V. 3. P. 13.
Coleman J.G., Johnson D.R., Stanley J.K. et al. // Environ. Toxicol. Chem. 2010. V. 29. № 7. P. 1575. https://doi.org/10.1002/etc.196
Stadler T., Buteler M., Weaver D.K., Sofie S. // J. Stored Prod. Res. 2012. V. 48. P. 81. https://doi.org/10.1016/j.jspr.2011.09.004
ГОСТ 31674-2012. Межгосударственный стандарт. Корма, комбикорма, комбикормовое сырье. Методы определения общей токсичности. Введен в действие приказом Федерального агентства по техническому регулированию и метрологии от 29.11. 2012 г. N 1477-ст (с изменениями на 15.11.2016 г). 30 с.
Kryuchkova M., Danilushkina A., Lvov Y., Fakhrullin R. // Environ. Sci.: Nano. 2016. V. 3. P. 442. https://doi.org/10.1039/c5en00201j
Fakhrullina G.I., Akhatova F.S., Lvov Y.M., Fakhru-llin R.F. // Environ. Sci.: Nano. 2015. V. 2. P. 54. https://doi.org/10.1039/C4EN00135D
Li K., Chen Y., Zhang W. et al. // Chem. Res. Toxicol. 2012. V. 25. P. 1675. https://doi.org/10.1021/tx300151y
Gosteva I., Morgalev Yu., Morgaleva T., Morgalev S. // IOP Conf. Ser.: Mater. Sci. Eng. 2015. V. 98. P. 012007. https://doi.org/10.1088/1757-899X/98/1/012007
Gatoo M.A., Naseem S., Arfat M.Y. et al. // BioMed Res. Int. 2014. V. 8. P. 498420. https://doi.org/10.1155/2014/498420
Зайцева Н.В., Землянова М.А., Степанков М.С., Игнатова А.М. // Экология человека. 2018. № 5. С. 9. https://doi.org/10.33396/1728-0869-2018-5-9-15
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии



