Российские нанотехнологии, 2022, T. 17, № 1, стр. 14-28
МОДИФИКАЦИЯ ПОВЕРХНОСТИ ПЛАСТИКОВ
А. Ю. Нокель 1, 2, Н. В. Бовин 1, *, Н. В. Шилова 1, 2
1 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Москва, Россия
2 Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии
им. академика В.И. Кулакова Минздрава РФ
Москва, Россия
* E-mail: professorbovin@yandex.ru
Поступила в редакцию 26.11.2020
После доработки 26.11.2020
Принята к публикации 20.12.2020
Аннотация
Рассмотрены основные методы модификации пластика как функционального материала для изготовления биочипов – изделий XXI века, позволяющих проводить мультиплексные анализы и организовывать так называемые лаборатории на чипе (lab-on-chip). Рассмотрены физические, химические и физико-химические способы введения функциональных групп на поверхность различных полимерных материалов для придания им заданных физико-химических свойств (особенно, уменьшения на них неспецифической сорбции) и для эффективной иммобилизации биомолекул и их фрагментов. Обсуждаются достоинства и недостатки существующих подходов и их применимость к различным задачам.
ОГЛАВЛЕНИЕ
Введение
1. Нанесение тонких пленок
1.1. Осаждение из газовой фазы
1.1.1. Физическое осаждение из газовой фазы
1.1.2. Химическое осаждение из газовой фазы
1.2. Нанесение тонких пленок методом центрифугирования
1.3. Нанесение покрытий распылением
1.4. Нанесение пленок ракелем
1.5. Нанесение пленок с помощью щелевой головки
1.6. Нанесение пленок окунанием
2. Химическая и физико-химическая модификация поверхности пластика
2.1. Аминирование поверхности пластиков
2.2. Окисление поверхности пластиков
2.3. Галогенирование поверхности пластиков
2.4. Другие методы
Заключение
ВВЕДЕНИЕ
Первое время после изобретения полимерные материалы рассматривали лишь как подходящие заменители традиционных материалов. С этих позиций наиболее ценными и важными свойствами последних являлись прочность, стабильность и надежность, т.е. показатели, которыми обладают классические конструкционные материалы, такие как дерево и металл. Поэтому основные усилия были направлены на получение высокомолекулярных соединений, обладающих термостойкостью, механической и термомеханической прочностью и другими свойствами. При этом создавались новые пластмассы, волокна, каучуки. Этот этап развития химии и технологии полимеров привел к созданию в мире мощной промышленности с выпуском десятков миллионов тонн полимеров.
Термин “полимерные материалы” является обобщающим. Он объединяет три обширных группы синтетических пластиков, а именно: полимеры, пластмассы и их морфологическую разновидность – полимерные композиционные материалы. Общим для перечисленных групп является то, что их обязательной частью является полимерная составляющая, которая и определяет основные свойства материала.
Пластмассы (пластики) обычно состоят из нескольких взаимно совмещающихся и несовмещающихся компонентов. При этом помимо полимера в состав пластмассы могут входить наполнители полимерных материалов, пластификаторы, понижающие температуру текучести и вязкость полимера, стабилизаторы полимерных материалов, замедляющие его старение, красители и др. Пластмассы могут быть однофазными (гомогенными) или многофазными (гетерогенными) материалами. В гомогенных пластиках полимер является основным компонентом, определяющим свойства материала. Остальные компоненты растворены в полимере и способны улучшать те или иные его свойства. В гетерогенных пластмассах полимер выполняет функцию дисперсионной среды (связующего) по отношению к диспергированным в нем компонентам, составляющим самостоятельные фазы [1].
Современные полимерные материалы могут не только успешно конкурировать с традиционными материалами, но и во многом значительно превосходить их. Пластики стали широко применять для решения задач химической технологии, энергетики, биологии и медицины, экологии, процессов регистрации изображения и др.
Выражение “функциональные полимеры” фактически не имеет точно определенного значения, которое обычно используется в научных терминах. Во избежание путаницы, в данном обзоре под функциональностью подразумевается общая способность полимеров выполнять ту или иную функцию. Для улучшения эксплуатационных свойств изделий полимеры модифицируют. Как правило, полимерные материалы характеризуются низкими значениями поверхностной энергии: плохо смачиваются растворителями, плохо склеиваются, имеют низкую адгезию к напыленным слоям металлов и т.п. Поэтому часто модификации подвергают не сам полимерный материал, а уже готовое изделие, изменяя не объемные свойства материала, а поверхностные.
Модифицированные пластмассы широко используются в различных областях, но в данном обзоре рассмотрим их только как функциональный материал для изготовления биочипов.
Биологический микрочип или биочип (матрица с нанесенными биомолекулами или их фрагментами (часто синтетическими)) обычно используется для двух целей: или одновременного проведения большого числа одинаковых анализов большого числа образцов, или для проведения одного так называемого мультиплексного анализа одного образца, который взаимодействует на чипе с разнообразными биомолекулами. Именно вторая цель, реализуемая благодаря мультиплексности микрочипа, придает ему вполне заслуженный ореол символа изделий XXI века. В основе действия биочипов лежит хорошо известное молекулярное распознавание, которое построено либо на взаимодействии рецепторов с лигандами (например, антител с антигенами), либо на гибридизации комплементарных цепей ДНК, т.е. те же принципы, что и в предшествующих поколениях биоаналитических систем. Однако мультиплексность придает им новое качество – способность выявлять болезнь не по одному ее маркеру, а по сигнатуре нескольких маркеров, что особо важно при диагностике таких сложных системных заболеваний, как онкологические [2]. Помимо этого, они позволяют определять широкий спектр лекарственных веществ и их метаболитов, гормонов, наркотиков, ядов, пестицидов практически в любом анализируемом материале – крови, слюне, поте, воде, пище, воздухе или образце почвы. На сегодня биочип – это небольшая (от нескольких миллиметров) пластинка из стекла, пластика или кремния, вмещающая до нескольких десятков тысяч упорядоченно нанесенных лигандов для проведения мультиплексного биохимического анализа. Вкупе с прибором-анализатором – это мини-лаборатория, позволяющая быстро получать точные результаты. Особую популярность приобретают микрогидродинамические биочипы. Микрогидродинамика (также известная как микрофлюидика) – междисциплинарная наука, описывающая поведение малых (порядка микро- и нанолитра) объемов и потоков жидкостей. На основе таких микрогидродинамических биочипов разрабатываются и проходят испытания “интеллектуальные” образцы так называемых лабораторий на одной подложке (lab–on–chip) размером не больше монеты [3]. В таких конструкциях специфически модифицированные пластики особенно востребованы, так как они интегрируются в это устройство легче, чем стекло, кремний или другой материал.
Модификация поверхности пластика для биочипов применяется для создания поверхности с заданными физико-химическими свойствами для эффективной иммобилизации лигандов – различных молекул или клеток, либо, наоборот, для уменьшения их нежелательной сорбции. Для этого используют следующие подходы: создание новой поверхности добавлением другого вещества, химическая и физико-химическая модификация поверхности. Рассмотрим все эти виды по порядку.
1. НАНЕСЕНИЕ ТОНКИХ ПЛЕНОК
Создание новой поверхности добавлением другого вещества подразумевает, как правило, нанесение тонких пленок на поверхность пластика.
Тонкие пленки – это слои материала, толщина которых находится в диапазоне от долей нанометра до сотен микрон. Рассмотрим основные методы создания тонких пленок.
1.1. Осаждение из газовой фазы
Широкое распространение, особенно в микроэлектронике, получил метод нанесения тонких пленок осаждением из газовой фазы (vapor deposition). Этот метод можно определить как конденсацию газообразных веществ с образованием твердых осадков. Газовая фаза может иметь тот же состав, что и осадок. Это обычный случай физического осаждения из газовой фазы (PVD – Physical Vapour Deposition), при котором покрытия получаются за счет конденсации вещества.
При химическом осаждении из газовой фазы (CVD – Chemical Vapor Deposition) состав газовой фазы и состав осадка существенно различаются. Летучее соединение подается к подложке, где подвергается разложению (пиролизу) или вступает в химические реакции с другими веществами; при этом нелетучие продукты реакции осаждаются на подложке. Осадки образуются в результате большого количества химических реакций, протекающих в газовой фазе вблизи поверхности подложки и на самой поверхности подложки, что в значительной мере усложняет процесс осаждения, но делает его гораздо более универсальным и гибким. Процессы CVD иногда называют реактивным осаждением из газовой фазы (Reactive Deposition).
1.1.1. Физическое осаждение из газовой фазы
Физическое осаждение из газовой фазы – технология нанесения покрытий (тонких пленок) в вакууме из паровой (газовой) фазы, при которой покрытие получается путем прямой конденсации пара наносимого материала.
Этот метод в основном используется для нанесения тонких пленок металлов [4] и неорганических материалов в полупроводниковой индустрии [5].
Методы физического осаждения из газовой фазы можно разделить на две группы: термическое испарение и ионно-плазменное распыление. При термическом испарении напыляемый материал нагревают до достаточно высокой температуры, при которой некоторые атомы или их группы приобретают достаточно энергии для того, чтобы разорвать химические связи материнской большой молекулы. При этом жидкости испаряются, а твердые вещества сублимируются.
Ионно-плазменное распыление основано на распылении вещества до атомарного состояния в результате соударения с ускоренными в электромагнитном поле ионами и последующей конденсации этих атомов на подложку. Для бомбардировки, как правило, используют ионы благородных газов, так как их легко разгонять до нужной энергии в электрическом поле, и они химически инертны [6].
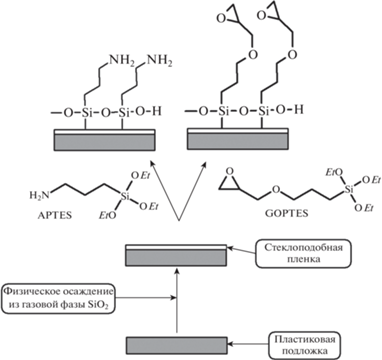
Примером использования PVD для модификации поверхности при изготовлении биочипов может служить подход, разработанный фирмой Sony. На поверхность пластиковых подложек на первой стадии наносят тонкую пленку из оксида кремния с помощью физического осаждения из газовой фазы [7], а затем получившуюся стеклоподобную поверхность модифицируют известными химическими методами, например обработкой (3-аминопропил)-триэтоксисиланом (APTES) или (3-глицидилоксипропил)-триэтоксисиланом (GOPTES) [8] (рис. 1). Полученные поверхности с амино- и эпоксигруппами могут быть использованы для иммобилизации биомолекул на поверхности [9, 10].
Метод PVD имеет ограничения по составу наносимых пленок, так как многие химические соединения частично или полностью разлагаются при переводе в газовую фазу. А химическое осаждение из газовой фазы лишено этого недостатка.
1.1.2. Химическое осаждение из газовой фазы
На современном этапе развития технологии CVD используемые процессы делятся в основном по четырем параметрам: давлению, способу активации, типу осаждаемого материала и способу подачи реагентов (рис. 2) [11].
Метод химического осаждения из газовой фазы наиболее широко используется в полупроводниковой промышленности, в частности при производстве интегральных микросхем. Таким способом, например, наносят негативные фоторезисты на основе полиглицидилметакрилата или его сополимеров в процессе электронно-лучевой литографии [12–14]. В качестве инициатора реакции полимеризации на поверхности используется ди-трет-бутилпероксид.
В последнее время в микроэлектронике увеличивается спрос на полупроводниковые материалы на основе алмаза. Благодаря своим уникальным свойствам алмаз перспективен для применения в качестве теплоотводящих пластин в СВЧ-транзисторах, мощных мультичиповых модулях и линейках полупроводниковых лазеров. Сейчас CVD-метод позволяет получать достаточно чистые поликристаллические алмазные пленки и пластины диаметром более 100 мм и толщиной от единиц микрометров до 1–3 мм. Таким образом, алмазные пластины приобрели форму, привычную для принятых в электронике технологий [15].
CVD-процесс получения алмазных пленок основан на разложении углеводородов (как правило – метана) в смеси с водородом и последующем осаждении алмаза на подложку. Компоненты рабочей смеси диссоциируют в вакуумной камере под действием электрического разряда, СВЧ-плазмы или лазерного излучения. Возможна также диссоциация на горячей нити или в пламени газовой горелки (в этом случае используют смесь ацетилен–кислород). Как правило, осаждение алмазной пленки происходит при довольно высокой температуре, что неприемлемо для пластиковых подложек [16], но уже появились публикации по нанесению алмазной пленки на пластиковую подложку при рабочей температуре ниже 100°С [17].
Пластики, покрытые алмазоподобными пленками, находят применение в микрогидродинамических биочипах. В последних часто используют стекла, но сделать в них микроканалы непросто. А в случае необработанных пластиков возникает также проблема нежелательной адсорбции биомолекул. Для решения этих проблем решено использовать алмазные пленки. Так, на предварительно обработанный плазмой полициклоолефин наносят алмазную пленку, которую обрабатывают плазмой в присутствии кислорода, азота или гексафторэтана для придания гидрофильности или гидрофобности поверхности [18].
Существуют подходы по химической иммобилизации биологических молекул на алмазной пленке. Например, в случае ДНК предлагается окислять поверхность алмаза смесью серной и азотной кислот, а затем образовавшиеся карбоксильные группы переводить в хлорангидриды, которые будут взаимодействовать с карбоксильными группами нуклеотида [19]. Для этих же целей CVD-методом наносят слой нитрида кремния (Si3N4), который, в свою очередь, модифицируют APTES [20, 21] или (3-глицидоксипропил)-диметилэтоксисиланом (GOPES) [22, 23] аналогично модификации стеклоподобной пленки на пластиковых подложках. Перед модификацией APTES поверхность, покрытую нитридом кремния, обрабатывают кислородной плазмой [24]. Обычно для иммобилизации молекул нитрид кремния наносят на кремниевую подложку, но есть сообщения о нанесении его на пластики, например на сополимер циклоолефина [25].
Для иммобилизации белков, содержащих сульфгидрильные группы, предлагают использовать фотохимическое присоединение к поверхности с винильными функциональными группами [26]. Для этого используют химическое осаждение из газовой фазы тонкой пленки поли(2,4,6,8-тетравинил-2,4,6,8-тетраметилциклотетрасилоксана) на пластиковую или бумажную подложку [27].
Химическое осаждение из газовой фазы полиглицидилметакрилата используется также для склеивания устройств в микрогидродинамике. Для этого на одну поверхность осаждают из газовой фазы полиглицидилметакрилат, а на другой – полимеризуют в плазме полиаллиламин. При соединении этих двух поверхностей и нагревании до 70°С происходит склеивание за счет образования ковалентных связей [26].
Нанесение в вакууме хорошо подходит для исследовательских работ и модификации небольших объектов. При масштабировании этих процессов меняется много параметров: геометрия установки, скорость осаждения вещества, источник вещества, скорость подведения тепла и т.д. Поэтому в производстве все большее внимание уделяют нанесению тонких пленок из растворов.
1.2. Нанесение тонких пленок методом центрифугирования
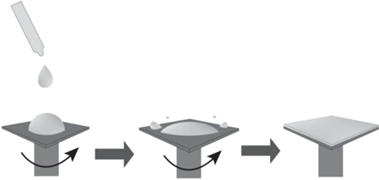
Получение покрытия центрифугированием (Spin coating) широко используется для создания равномерно распределенных тонких пленок различных материалов (в основном полимеров) на поверхностях с помощью центробежной силы. Данный метод характеризуется простотой, безопасностью и доступностью. Он также используется в тех случаях, когда необходимо получить слой высокого качества. Центрифугирование обеспечивает высокую однородность толщины пленки.
Обычно несколько миллилитров раствора наливается на поверхность подложки, закрепленной на центрифуге. Центрифуга вращается с числом оборотов 1–6 тысяч в минуту. Через 10–30 с на подложке формируется пленка (рис. 3) [28].
К недостаткам метода Spin coating относятся:
– требование симметричности подложки к вращению. Несимметричность подложки приводит к возникновению на краях подложки бортиков – утолщений пленки вещества;
– поверхность подложки должна иметь высокую степень гладкости. Если подложка имеет развитую текстуру, то подъемы на текстуре могут оказаться непокрытыми веществом;
– большие потери наносимого вещества. Для формирования пленки используется всего несколько процентов, остальное количество вещества отбрасывается центрифугой на боковые стенки.
Хотя метод центрифугирования широко используется в микроэлектронике, процесс образования и качество получаемой пленки требуют постоянного контроля. Опубликовано много работ по изучению влияния параметров, таких как давление пара, растворимость, вязкость, концентрация, на толщину и качество пленки.
Чаще всего этот метод используется для нанесения фоторезистов в микроэлектронике. Например, так обычно наносится негативный фоторезист SU-8 [29], который получается на основе Бисфенола А и содержит восемь эпоксидных групп. Тонкие пленки фоторезиста SU-8 используют для иммобилизации биомолекул, например, антител на поверхности стекла и кремниевой подложки в каналах микрогидродинамического биочипа [30].
Метод центрифугирования применяется для получения многослойных покрытий. Например, в [31] на кремниевую подложку наносили сначала тонкую пленку полиметилметакрилата, а затем полистирола. Для получения полистирольной пленки использовали редко применяемый растворитель 1-хлорпентан, который не растворяет первый нанесенный слой. В данной работе была получена и изучена модельная двухслойная пленка полимеров; считается, что двух- и многослойные пленки могут найти применение в различных научных и технологических областях.
1.3. Нанесение покрытий распылением
Раствор активирующего вещества может наноситься на подложку путем распыления тончайших капель через форсунку или ультразвуковую головку.
Преимуществом аэрозольного распыления является возможность покрытия поверхности произвольного размера и формы. Аэрозольное распыление позволяет покрыть поверхность практически с любой текстурой [32]. Распыление под углом дает лучший результат в случае с подложкой с развитой поверхностью, как показано на рис. 4 [33]. Такое нанесение может быть использовано при изготовлении чипов для микрогидродинамики.
Рис. 4.
Нанесение пленки распылением под углом: схема установки (а), нанесение центрифугированием (б), вертикальным распылением (в), распылением под углом (г).

Главным недостатком аэрозольного распыления является относительно высокая неоднородность пленки вещества по толщине слоя. Если при центрифугировании отклонение по толщине пленки не превышает 10 нм, то при распылении оно достигает 1 мкм. Однако для многих процессов это приемлемо, например для изготовления печатных плат [34]. Положительной стороной этого метода является возможность нанесения суспензий.
Метод распыления может быть использован для нанесения пленки красителей при изготовлении гибких солнечных батарей. На пленку полиэтиленнафталата, например, наносят слой красителя (полипиридиниевый комплекс рутения) вместе с оксидом титана [35].
Информации об использовании этого метода нанесения пленок для изготовления биочипов в литературе пока не встречается, вероятно, из-за относительно высокой неоднородности толщины получаемых пленок.
1.4. Нанесение пленок ракелем
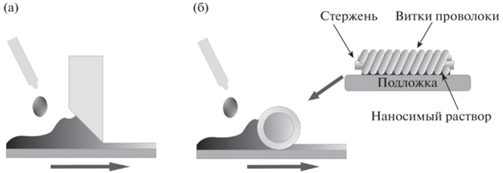
При производстве жидкокристаллических дисплеев нашли применение оптически анизотропные пленки, получаемые из растворов органических красителей. Такие пленки представляют собой тонкие слои молекулярно упорядоченных органических веществ [36]. Кроме оптических пленок существует большой спрос на нанесение прозрачных проводящих пленок этим методом [28]. Нанесение раствора осуществляют с помощью ракеля, который может быть ножевого или цилиндрического типа (рис. 5). Ножевой ракель представляет собой тонкую пластину в виде ножа или скребка. При нанесении с его помощью толщина пленки регулируется зазором между ракелем и подложкой. Ракель Майера устроен сложнее – это стальной стержень с намотанной на него проволокой. Стандартные ракели Майера хорошо подходят для маловязких жидкостей, легко заполняющих пространство между витками проволоки. Толщина получаемой пленки зависит от диаметра проволоки, скорости нанесения, вязкости раствора и других факторов. Было установлено экспериментальное соотношение между диаметром проволоки и толщиной мокрой пленки 10:1. Поэтому легко подобрать ракель для нужной толщины пленки. Имеющиеся в продаже ракели позволяют наносить мокрую пленку от 3.8 (ракель 1) до 228.6 (ракель 90) микрон [37].
Фирма 3М запатентовала изготовление подложек для иммобилизации соединений, содержащих аминогруппы [38], где с помощью ракеля Майера № 12 на стеклянные подложки сначала наносят раствор полиэтиленимина, а затем раствор мономера с инициатором. После полимеризации на поверхности подложки оказываются N-сульфониламинокарбонильные группы, способные реагировать с аминогруппами аминокислот, нуклеиновых кислот, пептидов, клеток и т.д. Преимуществом подхода 3М является то, что при использовании ракеля получается не очень тонкая жидкая пленка, пригодная для проведения реакции полимеризации, в результате чего образуется необходимый для модификации полимер, который нельзя нанести из раствора.
1.5. Нанесение пленок с помощью щелевой головки
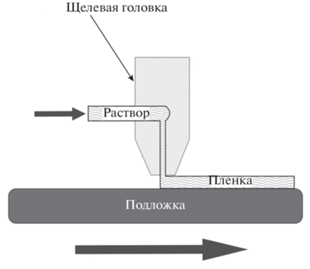
Метод нанесения тонких пленок щелевой головкой (Slot die coating) был разработан для ускорения нанесения покрытий и для улучшения качества последних [39] (рис. 6).
Этот метод используется для производства фотографических пленок и бумаг. В ходе обычного нанесения жидкость подается через фиксированную щель в головке на движущуюся подложку, заполняя зазор между ними. После испарения растворителя получается однородная тонкая пленка на подложке. Основное преимущество этого метода заключается в том, что можно задать множество параметров процесса: скорость подачи раствора наносимого вещества, скорость перемещения подложки, высота головки над подложкой, размеры и форма головки, температура, влажность и т.д. [40].
Обычно нанесение раствора щелевой головкой используется для производства фотографических пленок, магнитных пленок, оптических пленок, солнечных батарей и литий-ионных аккумуляторов. Фирма Кодак запатентовала производство подложек для белковых микрочипов с использованием этой технологии. На стекло, пластик или металл с помощью щелевой головки сначала наносится слой адгезива (в зависимости от типа подложки это могут быть производные желатина, поливиниловый спирт, акриламидные полимеры, полиамиды и т.д.), а затем слой модифицированного желатина. Такие чипы могут использоваться в твердофазном иммуноферментном анализе (ELISA) [41].
Метод нанесения тонких пленок щелевой головкой обладает следующими характеристиками:
– быстрая скорость нанесения пленки (≤10 м/с);
– толщина получаемой пленки (1–1200 мкм);
– высокая точность (± 2%);
– возможность нанесения многослойных пленок;
– возможность поддерживания заданной температуры [42].
1.6. Нанесение пленок окунанием
При использовании этого метода подложку вытягивают с определенной скоростью из резервуара, наполненного раствором. Чем ниже скорость вытягивания, тем меньше толщина пленки. Этот метод является основным в производстве офсетных пластин для полиграфии [43]. Очевидным преимуществом метода окунания является возможность покрытия веществом поверхностей произвольного размера. Образующаяся пленка является очень гладкой, хотя толщина пленки может меняться существенно по поверхности подложки.
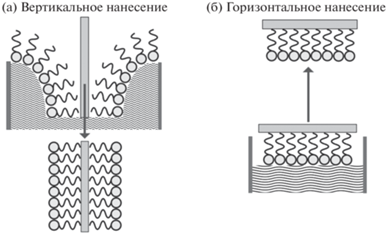
Метод окунания используется и в технологии Ленгмюра–Блоджетт для создания монослоя или последовательности монослоев вещества, нанесенных на подложку. В 30-х годах прошлого столетия Ирвинг Ленгмюр и Катарина Блоджетт использовали так называемую ленгмюровскую ванну (она имеет подвижные барьеры, позволяющие менять площадь ванны), дистиллированную воду, поверхностно-активное вещество (ПАВ) в органическом растворителе и твердую подложку. Благодаря своей амфифильной (бифильной) природе молекулы ПАВ в воде ориентируются единообразно относительно поверхности – гидрофобными “хвостами” вверх. Используя подвижные барьеры, можно уменьшать площадь водной поверхности ванны, сжимая молекулы на поверхности воды и создавая таким образом тонкую пленку самособирающегося монослоя. Для переноса плавающей мономолекулярной пленки на твердую подложку она вертикально погружается в воду через монослой и затем поднимается (метод Ленгмюра–Блоджетт) или горизонтально касается поверхности (метод Ленгмюра–Шеффера) (рис. 7) [44].
При каждом прохождении подложки через слой ПАВ (окунании или вытягивании) наносится мономолекулярный слой. Если поверхность подложки имеет химическое сродство к гидрофобным “хвостам” амфифильных молекул, последние присоединяются к поверхности подложки гидрофильными головками наружу; есть возможность реализовать и обратную конфигурацию. Если после погружения подложки нанести на поверхность воды новую пленку и вертикально вытянуть подложку, то к первому мономолекулярному слою на ней присоединяется второй. После вытягивания на поверхности подложки образуется покрытие ровно из двух молекулярных слоев. Процесс нанесения можно повторять многократно, получая пленки калиброванной толщины [45]. Важно, чтобы ванна была установлена в чистой комнате и надежно защищена от вибраций. Во время нанесения пленок на поверхности воды не должно быть даже наименьшей ряби. Система термостабилизации должна поддерживать постоянную температуру.
Однако многим исследователям не удавалось получить липидные би- и многослойные пленки по этой технологии. При попытках получить липидный бислой первый монослой отставал от подложки. Поэтому был предложен способ слияния (fusion) липосом на поверхности подложки. Механизм образования липидного бислоя был предложен на основании изучения поверхности подложки с помощью атомно-силовой микроскопии, который заключается в превращении адсорбированных на подложке липосом в бислой [46].
Технологию Ленгмюра–Блоджетт можно использовать при изготовлении биочипов. Сначала получают монослои жирных фосфоновых кислот, кислотные остатки предварительно превращают в соли поливалентных металлов, способных образовывать координационные соединения, предпочтительно с цирконием. Затем иммобилизуют биомолекулы, содержащие фосфаты, например, олигонуклеотиды [47]. Компания Sumitomo Bakelite запатентовала модификацию полициклоолефиновых подложек окунанием последних в растворы акриловых полимеров и сополимеров, содержащих различные функциональные группы (например, нитрофениловые эфиры) [48].
Выше были рассмотрены методы нанесения тонких пленок на поверхность пластика, когда формирующиеся пленки не образуют химической связи с подложкой. Далее рассмотрим методы модификации пластика с образованием химических связей.
2. ХИМИЧЕСКАЯ И ФИЗИКО-ХИМИЧЕСКАЯ МОДИФИКАЦИЯ ПОВЕРХНОСТИ ПЛАСТИКА
Один из возможных путей получения пластиков, содержащих в своей структуре функциональные группы, – это химическая или физико-химическая модификация полимеров.
Существует множество полимеров, содержащих группы, которые можно в достаточно мягких условиях модифицировать, такие как поливинилхлорид, полиметилметакрилат, полиэтилентерефталат, полиэфирэфиркетон и другие. Также существуют методы введения функциональных групп в молекулы полимеров, не имеющих изначально функциональных групп. Рассмотрим примеры таких способов модификации поверхности пластиков.
2.1. Аминирование поверхности пластиков
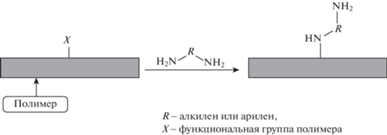
Для проведения реакции аминирования чаще всего используют диамины, такие как этиленди-амин, гексаметилендиамин, фенилендиамин и другие. Схема этого процесса в общем виде приведена на рис. 8.
Поливинилхлорид (ПВХ) – один из самых распространенных пластиков, используемых в различных областях, поэтому необходимость модификации его поверхности возникла давно. При изготовлении медицинских изделий поверхность ПВХ делают более гидрофильной для лучшей биологической совместимости. В качестве первой стадии модификации поверхности, как правило, используют аминирование. Далее через диальдегид или диэпоксид присоединяют полиэтиленгликоль [49, 50]. На аминированный ПВХ иммобилизуют ферменты [51, 52] или используют его в качестве химического катализатора, например, в реакции Кневенагеля [53]. Опубликовано множество работ по аминированию ПВХ как на поверхности, так и в объеме. Атомы хлора достаточно легко замещаются на аминогруппы. Для такой модификации чаще всего используют этилендиамин [49–57] и гексаметилендиамин [52, 57], реже диаминобутан [57], диаминопропан [58] и диаминододекан [52, 57]. Обычно такие реакции проводят при нагревании в водном или спиртовом растворе, иногда с добавлением основного катализатора, например метилата натрия [52].
Не менее популярным пластиком является полиметилметакрилат (ПММА). Его аминируют почти также, как ПВХ, с целью уменьшить гидрофобность его поверхности, иммобилизовать на поверхность различные молекулы и/или улучшить биологическую совместимость. Для аминирования ПММА используют гидразин [59], этилендиамин [60], диаминопропан [61, 62], гексаметилендиамин [61–65], диаминополиэтиленгликоль [66], полиэтиленимины [61–63, 67] и полиаллиламин [61, 62]. Модификацию ПММА проводят как прямым амидированием сложноэфирной группы, так и в две стадии через получение карбоксильных групп на поверхности. Чаще используется одностадийный процесс. Для количественной оценки аминирования поверхности ПММА используют обработку изотиоцианатом флуоресцеина с последующим измерением флуоресценции поверхности [65].
Во многих работах было показано более эффективное использование разветвленных полиэтилениминов для аминирования поверхности ПММА [61–63, 67], так как, присоединяя к поверхности одну аминогруппу, в результате получают много первичных, вторичных и третичных аминогрупп. Разветвленный полиэтиленимин с доступными аминогруппами получают обычной катионной полимеризацией этиленимина [63].
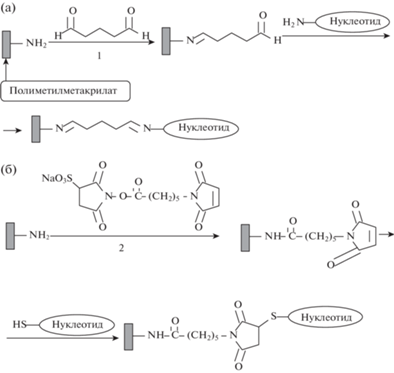
Аминированный ПММА может использоваться для иммобилизации, например, модифицированных олигонуклеотидов через спейсеры с различными функциональными группами (рис. 9) [64, 65]. Кроме получения биочипов такой полимер может использоваться для иммобилизации ферментов в ELISA [61–63] и при изготовлении протезов роговицы глаза. В последнем случае для улучшения биологической совместимости ПММА сначала аминируют диаминополиэтиленгликолем, а затем присоединяют RGD-пептид, который является лигандом клеточных интегринов, приводя к увеличению адгезии клеток на поверхность полимера [66].
Рис. 9.
Варианты иммобилизации нуклеотидов на аминированном ПММА: а – глутаровый альдегид, б – натриевая соль сульфо-N-сукцинимидил малеинимидкапроата.
Следующий популярный полимер – полиэтилентерефталат (ПЭТ). Он, как правило, аминируется при более мягких условиях, например, при обработке 10%-ным водным раствором гексаметилендиамина при комнатной температуре, хотя в данном случае происходит разрыв полимерной цепи на поверхности пластика [68]. Для аминирования ПЭТ используют гидразин [69], этилендиамин [70], гексаметилендиамин [68, 71], полиаллиламин [70], диэтилентриамин, триэтилентетрамин и тетраэтиленпентамин [72–74]. Используется аминированный ПЭТ в тех же областях, что и описанные выше полимеры: для иммобилизации биомолекул, для улучшения биологической совместимости [69, 72, 73, 75], при изготовлении сосудистых трансплантатов [74] и биочипов [68, 71].
При изготовлении ПЭТ-биочипов используют трехстадийный процесс: подложку аминируют гексаметилендиамином, вводят полученные на поверхности аминогруппы в реакцию с глицидилметакрилатом, а затем проводят полимеризацию с раствором глицидилметакрилата, получая слой полиглицидилметакрилата, который используется для иммобилизации белков [68].
В последнее время широко используются поли-арилэфиркетоны. Это семейство полимеров характеризуется наличием фениленовых колец, соединенных кислородными и кетоновыми мостиками. Оно включает в себя такие полимеры, как полиэфиркетон (PEK), полиэфирэфиркетон (PEEK), полиэфиркетонкетон (PEKK), полиэфирэфиркетонкетон (PEEKK), полиэфиркетонэфиркетонкетон (PEKEKK), которые обладают температурной, механической и химической стойкостью. Среди них наиболее распространен PEEK, широко использующийся как конструктивный материал, а в медицине – для протезирования костей и зубов [76]. Для улучшения биологической совместимости протезов поверхность PEEK подвергают химической модификации, первой стадией которой является аминирование, например, этилендиамином [77] (рис. 10). Благодаря перечисленным свойствам этот полимер имеет хороший потенциал для создания биочипов.
Похожим химическим модификациям может быть подвержен алифатический поликетон, который формально является сополимером этилена и моноксида углерода. Обычно используют терполимер, получаемый из этилена, пропилена и моноксида углерода. Метильные группы пропилена уменьшают кристалличность полимера, а следовательно, и его хрупкость. Кетоновые группы реагируют с аминами, образуя основания Шиффа [78] (рис. 11). Аминирование поликетонов диаминами используется для связывания с эпоксидными смолами в композиционных материалах [79].
Немодифицированные поликетоны хорошо сорбируют пептиды за счет множественных водородных связей. Это свойство поликетона предлагают использовать для иммобилизации ферментов в мягких условиях без какой-либо дополнительной обработки пластика [80]. Множество водородных связей обеспечивает прочную иммобилизацию ферментов. В таком виде они используются в каталитических реакциях.
Аминогруппу можно также ввести в полимеры, содержащие ароматические соединения, например в поликарбонат, с помощью нитрования и восстановления. Подобную модификацию поликарбоната предлагают использовать для иммобилизации нуклеиновых кислот и белков при изготовлении биочипов [81].
Кроме химического аминирования пластиков используется аминирование поверхности при помощи плазмы. Самый простой метод – использование плазмы с аммиаком, смесью аммиака и водорода, смесью аммиака с аргоном, смесью азота и водорода, смесью азота и этилена или азотом. Его ограничением является многообразие получаемых на поверхности пластика функциональных групп, не только аминов. Кроме того, образующиеся активные группы со временем могут повернуться внутрь полимера, частично возвращая поверхность в исходное состояние [82]. Такие же процессы могут проходить после химической модификации поверхности пластика, однако в литературе об этом не сообщается. Основным недостатком плазменной обработки поверхности считается зависимость результата от конструкции установки, т.е. оптимальные условия должны подбираться для каждой установки. Тем не менее такой способ обработки находит свое применение для иммобилизации различных молекул и даже клеток [83–85].
2.2. Окисление поверхности пластиков
Следует выделить два вида окисления поверхности пластика: химическое и физико-химическое (воздействие плазмой или УФ-облучением).
Наиболее часто используется окисление поверхности пластика плазмой на воздухе [86], основными продуктами которого являются гидроксилы, перекиси и гидроперекиси. Его обычно проводят для увеличения гидрофильности поверхности и усиления адгезии. Такого же эффекта можно добиться при воздействии озона и УФ-облучения [87]. Однако такая модификация, как правило, недолговечна. Уже через ~24 ч свойства поверхности возвращаются почти к исходному состоянию за счет перемещения образовавшихся функциональных групп внутрь пластика [86].
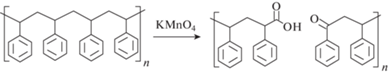
Существуют методы окисления поверхности пластика и химическими реагентами. Так, при окислении полистирола перманганатом калия на поверхности образуются карбоксильные группы, за которые можно иммобилизовать нуклеотиды [88] (рис. 12). Однако окисление поверхности полистирола перманганатом калия – неселективный процесс, и на рисунке приведен только один из возможных продуктов реакции.
Для окисления поверхности пластиков используют и другие неорганические окислители, такие как пероксодисульфат калия, пероксомоносульфат калия, перхлорат натрия, периодат натрия и перборат натрия [89]. На поверхность окисленного таким методом полистирола прививается полиакриламид с помощью солей церия [89, 90]. Инициаторами полимеризации в данном случае выступают радикалы, образующиеся на поверхности. Амидные группы частично омыляются, и по образовавшимся кислотам иммобилизуют антикоагулянт Гирудин. Для биочипов подобные методики пока не применяются, по-видимому, из-за того, что процесс окисления сложно контролировать, а неселективность окисления может привести к нежелательному увеличению неспецифического сигнала.
2.3. Галогенирование поверхности пластиков
Заслуживает внимания еще один метод модификации поверхности – галогенирование [91].
Фторирование поверхности проводят для повышения инертности и увеличения барьерных свойств пластиков. Например, емкости из фторированного полиэтилена используют для хранения бензина, гербицидов, пестицидов и других веществ, проникающих через полиэтилен. Для этого используют прямое и непрямое фторирование. При прямом фторировании, как правило, используют фтор, фтористый водород или четырехфтористую серу, для непрямого фторирования применяют фторуглероды, хлорфторуглероды и шестифтористую серу. В последнем случае для инициирования реакции используют плазму или гамма-излучение.
Хлорирование поверхности проводят обычно газообразным хлором при воздействии света, однако такие пластики не находят широкого применения.
Бромирование пластиков проводят в условиях, аналогичных условиям хлорирования. Эту модификацию используют, как правило, для введения других функциональных групп путем реакций нуклеофильного замещения атомов брома. Однако реакция бромирования обычно сопровождается дегидробромированием с образованием сопряженных двойных связей. Это приводит к изменению оптических свойств полимера, поэтому такие пластики тоже не нашли широкого применения.
2.4. Другие методы
Существует еще несколько способов получения подложек с реакционноспособными группами на поверхности: прямая сополимеризация, концевая функционализация и графтинг (процесс прививки).
Примерами прямой сополимерзации могут служить сополимеры малеинового ангидрида с этиленом, изобутиленом, октадеценом, метиловым эфиром винилового спирта или стиролом. Такие сополимеры используются для иммобилизации углеводов, пептидов и олигонуклеотидов [92–94]. Обычно для этих целей используются тонкие пленки сополимеров, которые часто наносятся на подложки рассмотренными выше методами.
Концевая функционализация полимеров, т.е. введение функциональных групп по концам полимерных молекул, как правило, не используется для иммобилизации биомолекул из-за низкой концентрации реакционноспособных групп на поверхности.
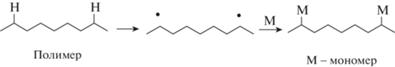
Графтинг (процесс прививки) заключается в реакции полимера с мономером, когда в ходе процесса генерируются растущие цепи с образованием разветвленных структур или реакции полимера с модификатором (мономером, олигомером или полимером). В этом случае мономеры или полимеры присоединяются к реакционным центрам на поверхности пластика, которые чаще всего получаются отщеплением атомов водорода от основной полимерной цепи за счет гамма- или УФ-облучения, обработки электронным пучком или плазмой в присутствии или в отсутствие инициаторов [95] (рис. 13).
Процесс прививки может останавливаться на присоединении мономера, олигомера или полимера к исходному пластику. Так, глицидилиметакрилат прививается к поверхности полипропиленовой мембраны в газовой фазе при УФ-облучении и в присутствии бензофенона в качестве инициатора. Такие мембраны используются для выделения γ-глобулинов [96].
Подобным образом прививают к полимерам малеиновый ангидрид и тетрагидрофталевый ангидрид. В случае с малеиновым ангидридом, как правило, прививается только мономер [97], так как малеиновый ангидрид дает гомополимер только в особых условиях. Более высокую реакционную способность в таких превращениях проявляет тетрагидрофталевый ангидрид [98]. Модификации полимеров малеиновым и тетрагидрофталевым ангидридами обычно проводят для повышения адгезии других полимеров к модифицированному пластику. Такие пластики могут использоваться для изготовления биочипов, но сообщений на эту тему пока нет.
Полимеры, используемые в медицине, тоже модифицируют методом графтинга. Например, на поверхность поливинилхлорида прививают полиглицидилметакрилат. Последний используется для иммобилизации антикоагулянта гепарина, препятствующего тромбообразованию [99].
ЗАКЛЮЧЕНИЕ
Область биочипов постоянно развивается – расширяется спектр решаемых задач, разнообразие иммобилизуемых биомолекул и исследуемых аналитов, способов детектирования сигнала и т.д. И хотя стекло11 как материал подложек сдает позиции медленно, очевидна тенденция на его замену пластиком, обладающим неограниченным потенциалом. Постепенно, шаг за шагом, решается задача придания поверхности пластика специфических свойств – от полной биологической инертности до максимально возможной емкости химической или физической адсорбции. Еще один принципиальный ракурс рассмотрения технологии биочипов – это масштабирование их производства; как только удастся перейти от пилотных к промышленным (десятки и сотни миллионов) масштабам диагностики (и сопровождающей диагностики – при терапии и вакцинации), произойдет настоящая революция в сфере диагностики сложных системных заболеваний, когда только мультиплексный, многопараметрический анализ дает надежный результат. Очевидно, что такого уровня масштабирование реализуемо только с пластиковыми подложками.
Работа выполнена при финансовой поддержке Российского научного фонда, грант № 20-63-47110.
Список литературы
Кабанов В.А., Акутин М.С., Бакеев Н.Ф. и др. // Энциклопедия полимеров. Т. 2. М.: Советская энциклопедия, 1974. Cтб. 634.
Шилова Н.В., Хасбиуллина Н.Р., Полякова С.М. и др. // Российский аллергологический журнал. 2017. Т. 14. № 1. С. 202.
Зимина Т., Лучинин В. // Наноиндустрия. 2013. Т. 7. С. 38.
Brown D.J. // Thin Solid Films. 1987. V. 149. P. 105.
Selvakumar N., Barshilia H.C. // Solar Energy Mater. Solar Cells. 2012. V. 98. P. 1.
Оура К., Лифшиц В.Г., Саранин А.А. и др. // Введение в физику поверхности. М.: Наука, 2006. С. 56.
Fuhrmann G., Nelles G., Roselli S. et al. // PCT/WO 2012/013361. Int. Cl. C08J 7/04. 79 P.
Nan G., Yan H., Yang G. et al. // Curr. Pharm. Biotechnol. 2009. V. 10. P. 138.
Trevisiol E., Berre-Anton V., Leclaire J. et al. // New J. Chem. 2003. V. 27. P. 1713.
Preininger C., Sauer U. // Sensors and Actuators B. 2003. V. 90. P. 98.
Киреев В., Столяров А. // Технологии микроэлектроники. Химическое осаждение из газовой фазы. М.: Техносфера, 2006. С. 25.
Mao Y., Gleason K.K. // Langmuir. 2004. V. 20. P. 2484.
Gupta M., Gleason K.K. // Thin Solid Films. 2006. V. 515. P. 1579.
Lou Q., Shipp D.A. // ACS Symposium Series. 2012. V. 1101. P. 115.
Ральченко В., Конов В. // Электроника: Наука, Технология, Бизнес. 2007. Т. 4. С. 58.
Schwander M., Partes K. // Diam. Relat. Mater. 2011. V. 20. P. 1287.
Tsugawa K., Ishihara M., Kim J. et al. // Phys. Rev. B. 2010. V. 82. P. 125460-1.
Murata S., Ito S., Mizuno J. et al. // Phys. Status Solidi. C. 2012. V. 9 (6). P. 1439.
Ushizawa K., Sato Y., Mitsumori T. et al. // Chem. Phys. Lett. 2002. V. 351. P. 105.
Buhl M., Vonhören B., Ravoo B. // Bioconjugate Chem. 2015. V. 26. P. 1017.
Jeong G.M., Seong H., Kim Y.S. et al. // Polym. Chem. 2014. V. 5. P. 4459.
Manning M., Redmond G. // Langmuir. 2005. V. 21. P. 395.
Terry J., Campbell C., Ross A. et al. // Langmuir. 2006. V. 22. P. 11400.
To T.D., Nguyen A.T., Phan K.N.T. et al. // Adv. Natur. Sci: Nanosci. Nanotechnol. 2015. V. 6. P. 1.
Psaroulia A., Bourkoula A., Petrou P. // Proc. Eng. 2011. V. 25. P. 350.
Im S.G., Ki Bong K.W., Lee C.-H. et al. // Lab on a Chip. 2009. V. 9. P. 411.
Kim K.H., Kim W., Hong J.C. et al. // NSTI-Nanotech. 2010. V. 3. P. 91.
Pasquarelli R., Ginleyb D., O’Hayre R. // Chem. Soc. Rev. 2011. V. 40. P. 5406.
Chen R.-H., Cheng C.-M. // Advances in Resist Technology and Processing XVIII. Proceedings of SPIE. 2001. V. 4345. P. 494.
Garcia C., Schomacker A., Klarholz I. et al. // SENSOR+TEST Conference 2009 – SENSOR 2009 Proceedings I, V. 1. P. 193.
Ennis D., Betz H., Ade H. // J. Polym. Sci. B: Polym. Phys. 2006. V. 44. P. 3234.
Atthi N., Saejok K., Supadech J. et al. // J. Microscopy Society of Thailand. 2010. V. 24 (1). P. 42.
Eun D.-S., Kim D.-W., Chang-Seo C.-T. // J. Korean Phys. Soc. 2007. V. 50. № 6. P. 1947.
Печатные платы. Основные параметры конструкции. ГОСТ Р 53429-2009.
Han H.-G., Weerasinghe H.C., Kim K.M. et al. // Sci. Rep. 2015. V. 5 (1). P. 1.
Лазарев П., Паукшто М. // Патент России. B29D7/01. № 2222429. 2004.
MacLeod D.M. // Coatings technology: fundamentals, testing, and processing techniques. Boca Raton: Taylor & Francis Group. LLC. 2006. Ch. 18.
Leir C., Moore G., Shah R., Benson K. // US Patent 7544554. Int. Cl. C08F 26/06. 2009. 19 P.
Lippert H.G. // Coatings technology: fundamentals, testing, and processing techniques. Boca Raton: Taylor & Francis Group, LLC, 2006, Ch. 19.
Burkitt D., Searle J., Watson T. // Royal Society Open Science. 2018 V. 5 (5). P. 1.
Qiao T., Penner T., Chou H., Roth G. // PCT/WO 2005/010530. Int. Cl. G01N 33/543. 29 P.
Ding X., Liu J., Harris T. // American Institute of Chemical Engineers Journal. 2016. V. 62. № 7. P. 2508.
Shizuoka O.C.H. // EP 1973000. C03F 7/30. 2008. 31 P.
Oliveira R., Barros A., Ferreira M. // Nanostructures. Elsevier Inc., 2017. Ch. 4. P. 105.
Ковальчук М.В., Клечковская В.В., Фейгин Л.А. // Природа. 2003. № 12. С. 11.
Jass J., Tjarnhage T., Puu G. // Biophys. J. 2000. V. 79. P. 3153.
Tellier C., Pipelier M., Dubreuil D. et al. // US Patent. 134717. Int. Cl. C12Q 1/42. 2006. 9 P.
Matsumoto M., Shibahara S., Matsumoto T. et al. // US Patent. 70474. Int. Cl. A61K 31/711. 2012, 12 P.
Balakrishnan B., Jayakrishnan A. // Trends Biomater. Artif. Organs. 2005. V. 18 (2). P. 230.
Gabriel M., Strand D., Vahl C.-F. // Artif. Organs. 2012. V. 36(9). P. 839.
Mohy Eldin M., Elaassar M., Elzatahry A. // J. Appl. Polym. Sci. 2012. V. 125. P. 1724.
Chang R.-C., Shaw J.-F. // Bot. Bull. Acad. Sin. 1987. V. 28. P. 33.
Krishnan G., Niveditha K., Sreekumar K. // Indian J. Chem. B. 2013. V. 52. P. 428.
Lazaroaie C., Rusen E., Marculesku B. et al. // University Politehnica of Bucharest Scientific Bulletin. B. 2010. V. 72. № 2. P. 127.
Ahamed I., Ghonaim A., Abdel Hakim A. et al. // J. Appl. Sci. Res. 2008. V. 4 (12). P. 1946.
Mohy Eldin M., Abu-Saied M., Elzatahry A. et al. // Int. J. Electrochem. Sci. 2001. V. 6. P. 5417.
Ma S.-C., Meyerhoff M.E. // Mikrochim. Acta. 1990. V. 1. P. 197.
Oztuna A., Nazir H., Baysallar M. // J. Coat. 2014. V. 2014. P. 1.
Holrnberg K., Hyden H. // Prep. Biochem. 1985. V. 15 (5). P. 309.
Brown L., Koerner T., Horton J., Oleschuk R. // Lab on a Chip. 2006. V. 6. P. 66.
Bai Y., Koh C.G., Boreman M. et al. // Langmuir. 2006. V. 22. P. 9458.
Yang S.-T., Bai Y. // US Patent. 8652564. 2014. U.S. Cl. 427/2.13. 29 P.
Hosseini S., Ibrahim F., Djordjevic I., Koole L. // Analyst. 2014. V. 139. P. 2933.
Fixe F., Dufva M., Telleman P., Christensen C. // Nucl. Acids Res. 2004. V. 32. № 1. P. 1.
Fixe F., Dufva M., Telleman P., Christensen C. // Lab on a Chip. 2004. V. 4. P. 191.
Patela S., Thakara R., Wongd J. et al. // Biomater. 2006. V. 27. P. 2890.
Kitagawa F., Kubota K., Sueyoshi K., Otsuka K. // Sci. Technol. Adv. Mater. 2006. V. 7. P. 558.
Liu Y., Li C.M., Hu W., Lu Z. // Talanta. 2009. V. 77. P. 1165.
Bui L.N., Thompson M., McKeown N. et al. // Analyst. 1993. V. 118. P. 463.
Noel S., Liberelle B., Yogi A. et al. // J. Mater. Chem. B. 2013. V. 1. P. 230.
Chernov B., Golova J., Chandler D. // PCT/WO 2007/018760. Int. Cl. B01J 19/00, 25 P.
Drobota M., Gradinaru L., Ciobanu C., Vasilescu D. // Universitatea Politehnica din Bucuresti Scientific Bulletin. B. 2015. V. 77. № 3. P. 131.
Nissen K., Stuart B., Stevens M., Baker A. // J. Appl. Polym. Sci. 2008. V. 107. P. 2394.
Avny Y., Rebenfeld L. // J. Appl. Polym. Sci. 1986. V. 32. P. 4009.
Drobota M., Aflori M., Stoica I., Doroftei F. // Revue Roumaine de Chimie. 2013. V. 58 (2–3). P. 203.
Zhi-Ye Qiu Z.-Y., Chen C., Xiu-Mei Wang X.-M., Lee I.-S. // Regen. Biomater. 2014. V. 1 (1). P. 67.
Becker M., Lorenz S., Strand D. et al. // Sci. World J. 2013. V. 2013. P. 1.
Ash C., Kelsey D. // US Patent. 5955562. U.S. Cl. 528/220. 1999. 9 P.
Weinkauf D., Ash C. // US Patent. 5405700. U.S. Cl. 428/413. 1995. 4 P.
Agostinelli E., Belli F., Tempera G. et al. // J. Biotechnol. 2007. V. 127. P. 670.
Banuls M.-J., Morais S., Tortajada-Genaro L., Maquieira Á. // Microarray Technology: Methods and Applications, Series: Methods in Molecular Biology. 2016. V. 1368. P. 37.
Siow K.S., Britcher L., Kumar S., Griesser H. // Plasma Process. Polym. 2006. V. 3. P. 392.
Motrescu I., Nagatsu M. // ACS Appl. Mater. Interfaces. 2016. V. 8 (19). P. 12528.
Sipehia R., Chawla A., Daka J., Chang T. // J. Biomed. Mater. Res. 1988. V. 22. P. 417.
Kleinhans C., Barz J., Wurster S. et al. // Biotechnol. J. 2013. V. 8. P. 327.
Asadinezhad A., Lehocky M., Saha P., Mozetic M. // Materials. 2012. V. 5. P. 2937.
Mathieson I., Bradley R. // Int. J. Adhes. Adhes. 1996. V. 16. P. 29.
Zammatteo N., Girardeaux C., Delforge D. // Anal. Biochem. 1996. V. 236. P. 85.
Bamfordt C., AI-Lamee K. // Pollymer. 1994. V. 35. № 13. P. 2844.
Mino G., Kaizerman S. // J. Polym. Sci. 1958. V. 31. № 122. P. 242.
Abdel-Bary E. // Modifications of Plastic Films, Handbook of Plastic Films. 2003. Ch. 8. P. 215.
Isosaki K., Seno N., Matsumoto I. // J. Chromatogr. 1992. V. 591. P. 123.
Satoh A., Kojima K., Koyama T. et al. // Anal. Biochem. 1998. V. 26. P. 96.
Ivanova E., Pham D., Demyashev G., Nicolau D. // Biomedical Applications of Micro- and Nanoengineering. Proceedings of SPIE. 2002. V. 4937. P. 23.
Bonilla-Cruz J., Dehonor M., Saldıvar-Guerra E., Gonzalez-Montiel A. // Handbook of Polymer Synthesis, Characterization and Processing. First Edition. 2013. John Wiley & Sons Inc. P. 205.
Hwang T.-S., Park J.-W. // Macromol. Res. 2003. V. 11. № 6. P. 495.
Montanheiro T., Passador F., Oliveira M. et al. // Mater. Res. 2016. V. 19 (1). P. 229.
Campos P., Fantini M., Petri D. // J. Brazilian Chem. Soc. 2004. V. 15. № 4. P. 532.
Xie Y., Yang Q. // J. Appl. Polym. Sci. 2002. V. 85. P. 1013.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии