Российские нанотехнологии, 2022, T. 17, № 2, стр. 275-288
Действие водного раствора наночастиц серебра на поведение крыс
Е. М. Егорова 1, *, Н. А. Крупина 1, С. И. Каба 1, Н. Н. Хлебникова 1, С. Д. Ширенова 1, Н. Б. Свиридкина 1, А. А. Пальцын 1
1 Научно-исследовательский институт общей патологии и патофизиологии
Москва, Россия
* E-mail: emenano@mail.ru
Поступила в редакцию 09.07.2021
После доработки 01.10.2021
Принята к публикации 25.10.2021
Аннотация
Известно, что наночастицы серебра (AgNP) проникают в головной мозг и могут быть причиной патологических изменений функций ЦНС, но пока остается неясным, является ли употребление растворов AgNP в качестве антимикробного средства безопасным для человека. Предпринята попытка оценить степень опасности имеющихся в продаже препаратов наночастиц серебра для ЦНС, используя в качестве модели организм крысы и создавая условия, максимально приближенные к приему человеком водных растворов AgNP. Использовали наночастицы, полученные с природным стабилизатором, низкую дозу (51 мкг/кг), прием с питьевой водой и длительный курс введения. Определяли влияние раствора AgNP на ряд показателей поведения животных – двигательную активность, тревожность и кратковременное привыкание (неассоциативное обучение) – через 1 и 2 мес после начала потребления и через 3 мес после отмены AgNP. После окончания двухмесячного курса у крыс обнаружено (1) увеличение двигательной активности и снижение тревожно-фобического уровня в стрессогенной обстановке классического “открытого поля”, (2) нарушение кратковременного привыкания по показателям акустического стартл-ответа и (3) присутствие наночастиц в гиппокампе, фронтальной коре и стриатуме методом просвечивающей электронной микроскопии. Эти признаки исчезали через 3 мес после окончания курса приема раствора AgNP. Результаты позволяют предположить, что в условиях эксперимента, приближенных к реальному потреблению человеком, наночастицы серебра не оказывают длительного негативного воздействия на функции ЦНС.
ВВЕДЕНИЕ
Интенсивное развитие нанотехнологий поставило на повестку дня задачу выяснения степени токсичности наночастиц и наноматериалов для живых организмов, прежде всего для организма человека, и определения условий их безопасного применения. Как известно, такие исследования образуют отдельное направление в токсикологии, именуемое нанотоксикологией; за последние 20 лет обсуждению результатов и проблем в этой области посвящено значительное количество публикаций, в том числе ряд обзоров [1–9]. Как отмечают многие исследователи, до настоящего времени главной проблемой здесь является несоответствие между бурным ростом производства с расширением областей практического применения наноматериалов и недостаточным уровнем знаний о закономерностях и возможных негативных последствиях их взаимодействия с организмом человека и окружающей средой (напр., [1, 3, 6, 8]). Особенно остро эта проблема стоит в промышленно развитых странах, где производство и потребление продукции нанотехнологий во многих областях опережает накопление достоверных данных о токсических свойствах этой продукции. Существенным препятствием для накопления данных является отсутствие координации действий разных групп исследователей, в результате нередки случаи появления противоречивых выводов, сделанных при решении одной и той же задачи. Как выразился автор обзора [6], выводы исследователей, работающих в этой области, “не созвучны” (букв. “are not univocal”), что не позволяет достаточно надежно определить условия безопасного применения наноматериалов.
Серьезные опасения в этом отношении вызывают наиболее быстро развивающиеся направления производства и внедрения наноматериалов. Здесь одно из первых мест занимают наночастицы серебра (AgNP) и модифицированные ими материалы. Это обусловлено прежде всего их выраженными антибактериальными свойствами, которые находят применение в производстве товаров широкого потребления (моющих и дезинфицирующих средств, косметики, игрушек, бытовых приборов, упаковок для пищевых продуктов), строительных материалов и продукции для медицины [7, 10–12]. В медицине помимо известных препаратов коллоидного серебра (протаргол, колларгол и др.) AgNP используются для получения лекарственных средств (в том числе дезинфицирующих растворов), при изготовлении различных инструментов, перевязочных материалов, протезов, катетеров и др. [1, 6, 13]. Широкое распространение в аптечной сети получили водные растворы AgNP (под разными названиями) для употребления внутрь в качестве антимикробного средства. Как неоднократно отмечалось в литературе (обзоры [6, 7, 14] и ссылки в них), помимо побочных эффектов при целенаправленном применении наночастиц серебра в медицине широкое промышленное производство AgNP и наноматериалов для других целей может приводить к заметному повышению концентрации этих наночастиц и ионов серебра в окружающей среде – в воздухе, воде (в том числе в грунтовых водах), почве, в организме рыб, растений и животных (т.е. в продуктах питания) – и, соответственно, к их токсическим эффектам при неконтролируемом воздействии на человека. Ясно, однако, что в настоящее время распространение наночастиц серебра в окружающей среде не поддается количественным оценкам, поэтому токсикологические исследования, позволяющие выявить негативные последствия проникновения AgNP в организм человека и определить их безопасные концентрации, реально можно осуществить лишь путем моделирования различных способов воздействия наночастиц при их производстве или потреблении.
Результаты многочисленных экспериментов на животных показали, что AgNP, введенные в организм через дыхательные пути, пищеварительный тракт, подкожные или внутрибрюшинные инъекции, попадают в кровоток и аккумулируются во внутренних органах, таких как легкие, печень, селезенка, почки [7, 14–17]. Показано также, что AgNP способны проникать через внутренние барьеры организма – гематоэнцефалический барьер (ГЭБ) и барьеры между кровью и репродуктивными органами [5, 18–20], причем последние оказались более проницаемыми для AgNP. Высказывалось даже предположение, что причиной заметного увеличения патологий в половой сфере в последние десятилетия наряду с другими факторами может быть неконтролируемое проникновение AgNP из окружающей среды [5]. Исследования распределения наночастиц по органам и динамике их выведения из животного организма показали, что, хотя разные органы способны освобождаться от наночастиц серебра, но эти наночастицы могут задерживаться в органах на длительное время; наиболее существенное их накопление отмечено в печени и головном мозге, причем из последнего они выводятся наиболее медленно [15, 16, 18, 20–22]. Так, по данным [21], “при субхронических временах приема наночастиц, порядка двух месяцев, период полувыведения, а значит, и время полного освобождения головного мозга от наносеребра весьма велики: для мыши составляет 12 месяцев, что примерно сопоставимо с длительностью ее жизни при благоприятных условиях”.
Исследования механизмов проникновения AgNP через ГЭБ на модельных системах in vitro показали, что наночастицы не только проникают через слой эндотелия, выстилающий кровеносные сосуды головного мозга, но и нарушают его целостность путем изменения проницаемости мембран эндотелиальных клеток [18, 23–27]. Наблюдались также патологические изменения структуры и функций клеток нервных тканей головного мозга при действии AgNP в экспериментах на культурах первичных нейронов, комбинированных культурах эндотелия ГЭБ и астроцитов, а также нейронов и глиальных клеток [28, 29].
Из совокупности полученных результатов вытекает опасность патологий высшей нервной деятельности у человека при накоплении и длительном воздействии AgNP. Однако насколько можно судить по известной литературе [1, 6, 9], систематических медицинских исследований в этом направлении на человеке не проводилось ни среди потребителей, ни среди производителей наночастиц. Как отмечалось в этих обзорах, в медицинской практике известны отдельные факты изменений психики у пациентов, подвергавшихся длительному воздействию наночастиц серебра, но имеющиеся данные не позволяли сделать однозначный вывод о том, что причиной наблюдаемой патологии было действие именно AgNP.
Что касается персонала, занятого в производстве AgNP, то в обзоре [9], где представлены результаты анализа обширного материала (баз данных) по исследованиям профпатологий за последние 20 лет среди производителей девяти видов наиболее широко используемых наночастиц, упомянуты всего три источника данных по AgNP. Два из них сообщают об отсутствии негативных эффектов у двух человек, подвергавшихся воздействию AgNP размером 20 и 30 нм при их концентрации в воздухе соответственно 0.1 и 0.4 мкг/м3 в течение семи лет. И лишь в одном исследовании шести человек сообщается о существенном увеличении концентрации в крови биомаркеров сердечно-сосудистых заболеваний и уменьшении частоты сердечных сокращений. Очевидно, что этих данных, мягко говоря, недостаточно. Как резюмирует автор в [9]: “The lack of human data relative to this widespread ENM (engineered nano materials – прим. наше) requires further investigation on potential health effects in exposed workers and on the selection of possible biomarkers. Animal preliminary findings may be helpful to guide the verification of possible biological changes in humans” ([9] с. 228).
В исследованиях влияния AgNP на функции ЦНС у животных (крыс и мышей) определялось изменение известных параметров поведения при использовании разных препаратов наночастиц, разных способах введения, дозах и продолжительности эксперимента [30–39]. В некоторых работах определялись также изменения морфологии клеток ГЭБ и головного мозга [30–32, 34, 36] и изменения содержания серебра в крови и головном мозге в процессе длительного приема наночастиц и после его отмены [37, 38]. Главной задачей этих исследований было выяснение степени токсичности наночастиц серебра для ЦНС, что помогло бы определить безопасные для нервной системы условия потребления человеком AgNP или материалов с наносеребром при их различных применениях в лечебных целях, а также при контакте с ними человека в процессе их производства. Из полученных данных следует, что наночастицы серебра могут быть причиной патологических изменений функций ЦНС, что определяет ценность таких исследований для выяснения рисков, связанных с воздействием наночастиц на ЦНС человека.
Вместе с тем, несмотря на значительный объем проведенных исследований, из упомянутых выше публикаций сегодня невозможно сделать определенный практический вывод об условиях, обеспечивающих безопасное (для ЦНС человека) употребление хотя бы одного препарата наночастиц из применяемых в медицине в качестве антимикробного средства. Причины этого видим в том, что (1) большинство исследователей использует слишком большие дозы, а также способы и режим введения, заведомо нереальные для потребления человеком, (2) некоторые авторы не определяют или некорректно определяют такой важный параметр, как размер наночастиц [30–32, 35], (3) в ряде работ отсутствует контроль действия стабилизатора, образующего оболочку наночастиц [34, 36–39], что имеет существенное значение для оценки достоверности выводов. Это лишний раз подчеркивает необходимость уделять большее внимание вопросам методологии, что уже отмечалось ранее в учебном пособии, посвященном актуальным проблемам методологии исследования действия наночастиц металлов на биологические объекты [40]. В этом отношении представляется перспективным стремление отечественных исследователей уменьшить дозы наночастиц и приблизить способ их введения и длительность приема к реальным условиям потребления человеком [37–39].
В настоящей работе предпринята попытка оценить степень опасности препаратов наночастиц серебра для ЦНС, используя в качестве модели организм крысы и создавая условия, максимально приближенные к наиболее широко распространенному варианту потребления растворов наночастиц человеком – приему водных растворов AgNP (коллоидного серебра), имеющихся в аптечной сети. Это касалось способа введения (прием с питьевой водой), дозы и режима потребления. При расчете дозы ориентировались на доступные в Интернете инструкции к предлагаемым потребителю растворам наночастиц, в которых указывается рекомендуемое суточное потребление серебра (разд. Материалы и методы). Длительность приема зависит от цели применения; так, “для повышения неспецифических факторов защиты организма” рекомендуется курс 3–4 нед [41]; имеются также сведения о длительном приеме пациентами подобных растворов курсами по несколько месяцев [1, 6, 18].
В работе использовали AgNP, полученные с природным стабилизатором, которые в принципе могут быть использованы в медицинской практике. Растворы наночастиц для опытов с животными, а также контрольные растворы стабилизатора готовили на бутилированной воде, приемлемой по содержанию солей. Влияние наночастиц на функции ЦНС у крыс определяли по изменениям показателей их двигательной активности, эмоционального поведения и привыкания. Исследовали влияние AgNP на ряд параметров поведения животных через 1 и 2 мес после начала эксперимента, а также через 3 мес после окончания курса приема раствора AgNP для выявления возможного отсроченного действия наночастиц. Сразу после окончания курса и через 3 мес после отмены препарата определяли присутствие AgNP в нескольких отделах головного мозга методом просвечивающей электронной микроскопии (ПЭМ). Предполагалось, что обнаружение присутствия AgNP в структурах головного мозга, вовлеченных в изменение исследуемых показателей поведения животных, позволит получить дополнительные сведения о роли наночастиц в возможных побочных эффектах при введении коллоидных растворов наночастиц серебра в организм человека в лечебных или профилактических целях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение и характеристики AgNP. Синтез наночастиц проводили по общей схеме, описанной в монографии ([42], глава 4, п. 4.3.2) и патенте [43]. В качестве стабилизатора использовали природное крахмалоподобное вещество из группы циклодекстринов – бета-циклодекстрин (ЦД), предоставленный ВНИИ крахмалопродуктов (Россия). Выбор был обусловлен известными свойствами веществ этой группы, в частности хорошей растворимостью в воде, устойчивостью в широком диапазоне рН и нетоксичностью для человека. Благодаря этим свойствам, а также способности образовывать “комплексы включения” с различными субстратами циклодекстрины применяются в пищевой промышленности, производстве лекарственных препаратов и в последнее время в современных нанотехнологиях, в том числе для стабилизации наночастиц металлов [44, 45].
Вначале готовили раствор ЦД в дистиллированной воде, затем в него вводили последовательно раствор кверцетина (“Carl Roth GmBH”, Германия) в этаноле и раствор диамминнитрата серебра. Контроль изменения концентрации и стабильности наночастиц в растворе осуществляли по измерениям спектров поглощения в течение не менее двух недель. Концентрацию наночастиц определяли методом спектрофотометрии с использованием коэффициента экстинкции ε, найденного в отдельной серии экспериментов. Для AgNP, стабилизированных ЦД, ε = 1.45 × 104 л/(моль ⋅ см); в данной работе концентрация наночастиц в растворе СAgNP = 1 мМ (0.108 мг/мл), концентрация ЦД – 1 мМ (1.135 мг/мл). Размеры и распределение наночастиц по размерам в растворе, а также их ζ-потенциал определяли методом фотонной корреляционной спектроскопии (ФКС) на приборе “ZetaPALS” (“Brookhaven Instruments”, США). После получения желаемых результатов по концентрации, стабильности и размерам наночастиц в растворе проводили исследования препаратов растворов наночастиц методом ПЭМ на электронном микроскопе “LEO912 AB OMEGA” (“Carl Zeiss”, Германия) при ускоряющем напряжении 100 кВ. На основании результатов этих исследований делали окончательный вывод о размерах частиц и их распределении по размерам.
Обоснование дозы наночастиц. При расчете дозы ориентировались на обычно рекомендуемый интервал доз для взрослых в растворах, продающихся в аптеках: 30–70 мкг или 1–5 мкг/кг веса в сутки [41, 46]. Использовали дозу примерно в 10 раз больше максимальной. Для этого исходный раствор наночастиц разбавляли в 650 раз до концентрации 0.17 мкг/мл. Тогда суточная доза для крысы с начальным весом в среднем 166 г, которая выпивала 50 мл раствора в сутки, была равна: 0.17 мкг × 50 мл = 8.5 мкг Ag. В расчете на килограмм веса: (1000/166) × 8.5 = 51.2 мкг AgNP/кг. Если учесть, что в токсикологических исследованиях используются коэффициенты пересчета дозы, применяемой в опытах на животных, на эквивалентную дозу для человека [47], и взять приведенный в этой публикации коэффициент пересчета для крыс, равный 5.9, используемая расчетная доза эквивалентна 51.2/5.9 = 8.68 мкг/кг веса в сутки. Поскольку в течение эксперимента вес животных увеличивался, суточная доза уменьшалась. В конце первого этапа (2 мес питья растворов, разд. Результаты) вес животных составлял в среднем 395 г, суточная доза была равна (1000/395) × 8.5 = = 21.52 мкг/кг; тогда эквивалентная доза для человека составляла 21.52/5.9 = 3.65 мкг/кг в сутки, т.е. лежала внутри рекомендуемого интервала доз.
Отметим, что такая оценка эквивалентной дозы для человека может считаться лишь весьма приблизительной, поскольку коэффициенты, приведенные в [47], действительны для токсикологических исследований препаратов, вводимых в виде молекулярных растворов, но не для растворов наночастиц. Известно, что биологическая активность растворов наночастиц существенно отличается от таковой для тех же веществ в молекулярных растворах; это убедительно показано, в частности, в исследованиях действия на биологические объекты растворов солей серебра и растворов наночастиц того же металла (напр., [29, 36, 42]). Поэтому приведенная оценка лишь указывает на возможность определения эквивалентных доз для человека и ставит вопрос о необходимости проведения работ по определению соответствующих коэффициентов для растворов наночастиц, в том числе для AgNP.
Приготовление растворов. Для экспериментов с животными готовили три раствора: раствор AgNP, разбавленный в указанное число раз, контрольный раствор стабилизатора (ЦД) в конечной концентрации 0.0018 мг/л, соответствующей разбавлению раствора AgNP, и контрольную питьевую воду. Разбавление растворов AgNP и ЦД проводили бутилированной питьевой водой марки “Черноголовская” (ООО “Меркатус Нова Компани”, Россия); ту же воду использовали в качестве контрольной в группе “ВОДА” (см. ниже). Выбор этой воды обусловлен тем, что в привычной для крыс водопроводной воде AgNP нестабильны в силу значительной концентрации в ней солей, катионы которых вызывают агрегацию и осаждение наночастиц, а разбавление их дистиллированной водой, как это обычно делается в подобных экспериментах, при длительном употреблении могло неблагоприятно сказаться на состоянии животных, поскольку в дистилляте резко снижена концентрация солей. Вода марки “Черноголовская” явилась приемлемым компромиссом, поскольку по результатам измерений проводимости в ней солей было достаточно мало для обеспечения стабильности AgNP, но в то же время существенно больше, чем в дистилляте, что обеспечивало лучшее усвоение ее животными. Для иллюстрации приводим значения проводимости (мкСм/см), измеренные при 23°С: водопроводная вода – 420, дистиллированная вода – 4.7–5.0, “Черноголовская” вода – 83.
Общий план исследований на животных
Работа проведена на 30 крысах-самцах популяции Wistar (виварий ФГБНУ “НИИОПП”, система “Меркурий”, номер в реестре RU 1 487 336). Животных содержали в стандартных условиях вивария с естественной сменой освещенности, свободным доступом к пище и воде.
В начале эксперимента возраст крыс составлял 2 мес. После первичного обследования, которое длилось 2 недели, были сформированы три группы крыс так, чтобы они не различались по средним показателям двигательной активности и уровня тревожности:
– “AgNP” (n = 10) – крысы, получавшие раствор AgNP в питьевой воде;
– “ЦД” (n = 10) – крысы, получавшие раствор ЦД в питьевой воде;
– “ВОДА” (n = 10) – контрольные крысы, получавшие чистую питьевую воду.
Все три группы получали растворы и питьевую воду в режиме неограниченного доступа. Животные на время длительного эксперимента были размещены в клетках по две особи, чтобы исключить возможное влияние длительного одиночного содержания на поведение.
Эксперимент разделили на два этапа. На первом этапе (этап приема растворов AgNP и ЦД с питьевой водой) все животные получали растворы, как описано выше. Поведение крыс по описанным ниже тестам оценивали через 1 и 2 мес питья растворов. После окончания двухмесячного курса приема растворов, по завершении тестирования поведения, половину животных в каждой группе умерщвляли под эфирным наркозом с последующим гильотинированием и отбирали пробы из нескольких структур мозга (фронтальной коры, стриатума и гиппокампа), опосредующих эмоционально-мотивационное поведение, для последующего электронно-микроскопического исследования. Оценивали вес органов-маркеров стресса тимуса, селезенки и надпочечников – абсолютную (в граммах) и относительную (по отношению к весу тела, %). В конце первого этапа, сразу по окончании приема растворов, оставшихся животных всех групп переводили на питье водопроводной воды с привычным содержанием солей.
На втором этапе (этап отмены) крысы всех групп в течение 3 мес после окончания курса приема растворов пили водопроводную воду. В конце данного этапа оценивали поведение животных, после чего крыс умерщвляли так, как описано выше и так же, как на первом этапе, брали образцы тканей головного мозга и оценивали вес органов-маркеров стресса. Задачей исследования на втором этапе было выяснить, сохраняется ли действие наночастиц серебра после прекращения введения их в организм животных.
Оценка параметров поведения
Оценку двигательной активности проводили в двух тестах:
– в автоматизированном “открытом поле” (система “Opto-Varimex”, “Columbus Instruments”, США), представлявшем собой арену с прозрачными стенками (48 × 48 × 21 см), в условиях комнатной освещенности (42 лк) определяли длину пройденного пути в сантиметрах (горизонтальная активность) за 10 мин наблюдения в динамике. Такой подход позволяет не только оценить психомоторную активность по показателям суммарной двигательной активности за время наблюдения, но и провести первичную оценку когнитивной деятельности по характеру кратковременного привыкания (неассоциативного обучения, негативного обучения) в “открытом поле” по показателям снижения двигательной активности в динамике тестирования;
– в классическом “открытом поле”, представлявшем собой круглую белую арену с непрозрачными стенками (диаметр – 120 см, высота бортов – 28 см, поле разделено на 20 квадратов со стороной 20 см), при ярком освещении (в центре 500–510 лк, у бортов – 400–410 лк) оценивали двигательную активность животных по числу пересеченных квадратов (горизонтальная активность) суммарно за 3 мин наблюдения.
Оценка двигательной активности в автоматизированном и классическом “открытом поле” ситуативно различается: в классическом “открытом поле” в отличие от автоматизированного крысы находятся на большом открытом ярко освещенном пространстве, т.е. в стрессогенной обстановке.
Оценку поведения в данных тестах проводили до начала употребления растворов, через 1 и через 2 мес после начала питья растворов, а также через 3 мес после их отмены.
Оценку тревожно-подобного поведения проводили с использованием двух методов – с помощью многопараметрового метода комплексной оценки тревожно-фобических состояний у крыс [48] и в тесте “Приподнятый крестообразный лабиринт” [49].
Многопараметровый метод комплексной оценки тревожно-фобических состояний у крыс (в баллах) основан на количественной оценке изменения поведенческих ответов у животных в серии этологически адекватных тест-стимулов, моделирующих мягкое стрессогенное воздействие, провоцирующее проявление у животных состояний страха и тревожности. В девяти экспериментальных ситуациях в условиях классического “открытого поля” оценивали (в баллах от 0 до 3) выраженность двигательных реакций, связанных с преодолением страха и тревожности. Баллы суммировали по всем показателям. Крыс обследовали через 2 мес питья растворов и спустя 3 мес после их отмены.
Приподнятый крестообразный лабиринт (ПКЛ) имеет четыре крестообразно расположенных рукава: два закрытых рукава (ЗР) с боковыми стенками и закрытым торцом (длина × ширина × высота: 43 × 14 × 22 см) и два открытых рукава (ОР), не имеющих стенок (длина × ширина: 43 × 14 см). ОР и ЗР расположены перпендикулярно друг другу. ПКЛ находится на высоте 70 см от пола. Центральная зона ПКЛ имеет размеры 14 × 14 см. Освещенность над центральной зоной составляла 24 лк. Регистрацию поведения осуществляли с помощью автоматизированной видеосистемы “VideoMot2” (“TSE System”, Германия). Определяли следующие параметры: число заходов в ОР и ЗР, время, проведенное в ОР и ЗР, общее число заходов в рукава ПКЛ, предпочтение ОР как отношение числа заходов в ОР к общему числу заходов в рукава. Кроме того, оценивали пробег в центре лабиринта, суммарное число посещений отделов ПКЛ и общий пробег в ПКЛ. Длительность тестирования составляла 5 мин. Оценку поведения в данном тесте проводили до начала предъявления растворов, через 1 и 2 мес после начала питья растворов, а также через 3 мес после их отмены.
Оценку привыкания по показателям акустического стартл-ответа (АСО) проводили автоматизированным методом в модульной установке “Coulbourn Instruments” (США), как описано ранее [50]. Животных в пеналах помещали в свето- и звукоизолированную вентилируемую камеру на откалиброванные в граммах чувствительные к колебаниям платформы с тензометрическими датчиками, сопряженные с аналого-цифровым преобразователем. Звуковые сигналы, представлявшие собой краткие вспышки белого шума, подавали через вмонтированный в пол камеры громкоговоритель на фоне постоянного белого шума (70 дБ) (генератор белого шума WNG 023, Россия), интенсивность которого контролировали с помощью шумомера 8922 (“AZ Instruments”, Тайвань). Амплитуду (максимальную величину) АСО определяли как максимальное напряжение, пропорциональное изменению силы, приложенной к платформе, при вздрагивании животного, в течение 200 мс после подачи сверхпорогового стимула (120 дБ, 20 мс) и оценивали в условных единицах АСО (усл. граммы).
Оценку кратковременного привыкания проводили в течение одной сессии на фоне постоянного белого шума по специальной программе, включавшей последовательно 121 сигнал (вспышки белого шума с уровнем звука 120 дБ, длительностью 20 мс каждая, с фиксированным 10-секундным интервалом) в соответствии с методическими рекомендациями [51].
О привыкании судили по динамике снижения амплитуды АСО в сессии в ответ на 120 сигналов (исключая сильно варьирующий АСО на первый сигнал). Для анализа данных ответы группировали в 12 блоков по 10 ответов в каждом. Для каждого животного рассчитывали среднюю амплитуду ответа по каждому блоку Аср, затем рассчитывали средние величины показателей по группе в целом. Использовали оценку динамики снижения относительной величины амплитуды АСО от первого блока к последнему. Рассчитывали отношение величины АСО в каждом последующем блоке Аср(блокn) к величине амплитуды в первом блоке Аср(блок1), в процентах. Из полученного значения величины амплитуды в блокеn вычитали величину амплитуды в блоке1, принятую за 100%, разница служила характеристикой относительного снижения: [Аср(блокn)/Аср(блок1) × 100%] – 100%, где n – номер блока. В соответствии с формулой расчета 0% означает отсутствие различий между Аср(блок1) и Аср(блокn), т.е. отсутствие привыкания; отрицательные значения характеризуют выраженность привыкания, положительные значения или отсутствие статистически значимого относительного снижения амплитуды АСО свидетельствуют о выраженном срыве привыкания.
Тестирование проводили однократно у крыс после двух месяцев питья растворов.
Статистическую обработку данных проводили по алгоритмам программы “STATISTICA For Windows 8.0”. По итогам проверки гипотезы о нормальном характере распределения данных по тестам Колмогорова–Смирнова и Лиллиефорса для анализа результатов применяли либо параметрические, либо непараметрические критерии. В работе использовали двухфакторный дисперсионный анализ Two-Way ANOVA с повторными измерениями (оценивали влияние факторов “Группа”, “Минута тестирования”, “Срок наблюдения”, “Блок”) с последующим post hoc анализом по Newman–Keuls- или Fisher LSD-тесту, однофакторный дисперсионный анализ One-Way ANOVA с последующим сравнением средних по Newman–Keuls-тесту, непараметрический однофакторный Kruskal–Wallis ANOVA с апостериорным множественным сравнением средних рангов для всех групп по Z´-критерию. Принятый уровень значимости составлял 5%. Данные анализа результатов, полученные с помощью параметрических критериев, представлены в виде M ± SEM, с помощью непараметрических критериев – в виде точечных диаграмм с медианами.
Приготовление препаратов мозга. Крыс, участвовавших в эксперименте, наркотизировали в парах диэтилового эфира в эксикаторе. Далее проводили транскардиальную перфузию 2.5%-ным раствором глутарового альдегида (“Carl Roth”) в фосфатно-солевом буфере с рН 7.4 и декапитацию гильотиной. Из головного мозга на исследование в качестве образцов отбирали фронтальную кору, стриатум и гиппокамп. Из каждого отдела мозга каждой особи брали не менее пяти кусочков ткани объемом 2–3 мм3. Кусочки нарезали в капле раствора глутарового альдегида и фиксировали в этом же растворе не менее 24 ч при 4°С. Затем образцы дополнительно фиксировали 2.5 ч в 2%-ном растворе тетраоксида осмия в фосфатно-солевом буфере при 4°С, обезвоживали в растворах этанола возрастающих концентраций и заключали в блоки из смеси (1 : 1) смолы “Araldite M” и отвердителя “Araldite HY964” (“Serva”, Германия). Блоки инкубировали 48 ч при 60°С.
Электронно-микроскопическое исследование препаратов мозга. Ультратонкие срезы толщиной 60 нм готовили из полученных блоков на ультрамикротоме “EM UC6” (“Leica”, Германия), размещали на покрытых формваровой пленкой медных сетках для ПЭМ и контрастировали цитратом свинца (“Serva”) и уранилацетатом (“Leica”). Исследование проводили на том же микроскопе, который использовали для получения микрофотографий наночастиц. Анализировали наличие AgNP во внутриклеточном пространстве путем обнаружения скоплений частиц в полях зрения (не менее трех на сетку). Для доказательства присутствия в этих скоплениях кристаллов серебра дополнительно получали картину дифракции электронов на исследуемых участках срезов.
РЕЗУЛЬТАТЫ
Характеристики наночастиц серебра
На рис. 1 показаны электронная микрофотография раствора AgNP и гистограмма размеров частиц. Анализ гистограммы по Гауссу дает средний размер частиц 16.7 ± 5.8 нм (здесь: среднее ± полуширина пика распределения). Размер частиц, определенный методом ФКС, составил 42.22 ± 1.56 нм. Завышение размера по сравнению с данными ПЭМ есть следствие известных особенностей метода динамического светорассеяния – высокой чувствительности к присутствию малых примесей частиц большего размера и других факторов ([42], разд. 2.4.2. и [52]). ζ-потенциал частиц: –27.43 мВ. Отрицательный заряд поверхности в данном случае обусловлен диссоциацией гидроксильных групп ЦД, образующего стабилизирующую оболочку наночастиц.
Влияние потребления наночастиц серебра на поведение животных
Динамика двигательной активности
Тест автоматизированное “открытое поле”. На первом этапе в период потребления растворов на двигательную активность крыс не оказывал влияния фактор “Группа”, но влиял фактор “Срок наблюдения”: (Two-Way ANOVA, F(2.52) = 10.049, p < 0.001). В группе “ВОДА” через 1 мес после начала питья двигательная активность была статистически значимо ниже исходного значения, в группе “ЦД” снижение двигательной активности было выявлено через 2 мес потребления раствора, однако в группе “AgNP” двигательная активность статистически значимо не снижалась. На втором этапе эксперимента двигательная активность крыс в группах статистически значимо не различалась: F(2.10) = 0.309, NS. Результаты post hoc анализа двигательной активности крыс в сумме за 10 мин наблюдения для двух этапов приведены на рис. 2.
Рис. 2.
Динамика двигательной активности крыс суммарно за 10 мин наблюдения в тесте автоматизированного “открытого поля” . ВОДА – группа крыс, получавших питьевую воду; ЦД – группа крыс, получавших раствор стабилизатора β-циклодекстрина в питьевой воде, AgNP – группа крыс, получавших раствор наночастиц серебра в питьевой воде. *p < 0.05 – относительно значения показателя в той же группе крыс до начала приема растворов (Two-Way ANOVA, post hoc LSD-тест).
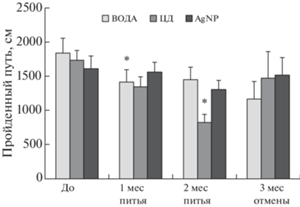
У крыс всех групп на всех сроках обследования наблюдалось привыкание к обстановке “открытого поля” во время тестирования: влияние фактора “Минута тестирования” было статистически значимым до начала питья растворов, через 1 и 2 мес после питья растворов (соответственно F(9.243) = 60.811, F(9.243) = 24.106, F(9.234) = = 32.679, во всех случаях p < 0.001). Взаимодействия факторов “Группа” и “Минута тестирования” ни на одном из сроков не выявлено. Влияние фактора “Группа” обнаружено через 2 мес питья растворов: F(2.26) = 4.933, p = 0.015. Двигательная активность крыс была статистически значимо ниже в группе “ЦД” по сравнению с другими группами (в обоих случаях p < 0.05) и составила (в среднем за минуту) в группе “ВОДА” – 144.9 ± 14.7 см, в группе “ЦД” – 82.3 ± 14.7 см, в группе “AgNP” – 130.7 ± 15.5 см.
Тест классического “открытого поля”. Через 2 мес питья растворов обнаружено различие в двигательной активности крыс в группах: F(2.24) = = 5.105, p = 0.014. Анализ post hoc показал, что в стрессогенной обстановке классического “открытого поля” в сумме за 3 мин наблюдения у крыс в группе “AgNP” двигательная активность была выше, чем в других группах (рис. 3). Спустя 3 мес отмены потребления растворов межгрупповых различий по данному показателю не наблюдали: F(2.9) = 1.290, p = 0.322.
Динамика уровня тревожности
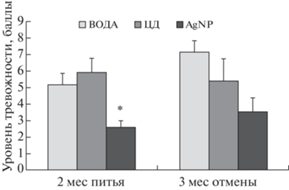
Многопараметровый метод комплексной оценки тревожно-фобических состояний. На первом этапе через 2 мес питья растворов тревожно-фобический уровень у крыс в группах различался (F(2.25) = 6.540, p = 0.005): у крыс, потреблявших раствор, содержащий AgNP, тревожно-фобический уровень был ниже, чем в других группах (рис. 4). На втором этапе спустя 3 мес после отмены потребления растворов статистически значимых различий между группами по данному показателю не выявлено (F(2.9) = 4.097, p = 0.089), однако даже при уменьшенном вдвое числе животных в группах просматривалась тенденция к сохранению более низкого тревожно-фобического уровня у крыс в группе “AgNP”.
Рис. 3.
Динамика двигательной активности крыс суммарно за 3 мин наблюдения в стрессогенной обстановке классического “открытого поля”. Обозначения групп как на рис. 2. *p < 0.005 – относительно значения показателя на том же сроке наблюдения в группах “ВОДА” и “ЦД” (One-Way ANOVA, post hoc Newman–Keuls-тест).

Рис. 4.
Динамика тревожно-фобического уровня по результатам обследования с помощью специализированной ранжированной шкалы для оценки тревожно-фобических состояний у крыс. Обозначения групп как на рис. 2. *p < 0.05 – относительно значения показателя на том же сроке наблюдения в группах “ВОДА” и “ЦД” (One-Way ANOVA, post hoc Newman–Keuls-тест).
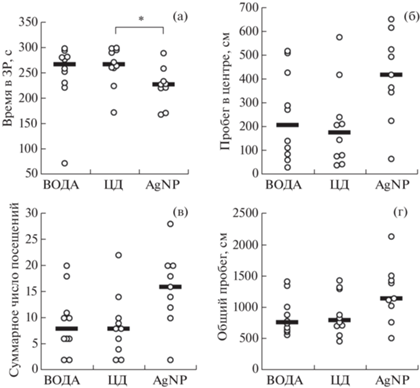
Тест “приподнятый крестообразный лабиринт”. На первом этапе эксперимента через 1 мес питья растворов межгрупповых различий по всем изученным показателям тревожности выявлено не было. Через 2 мес питья растворов по-прежнему не было различий между группами по специфическим показателям тревожности (предпочтение ОР, Kruskal–Wallis test: H (2, N = 29) = 1.600, p = = 0.450), однако было показано, что крысы из группы “AgNP” проводили в ЗР лабиринта меньше абсолютного времени, чем крысы из группы “ЦД” (Kruskal–Wallis ANOVA: H (2, N = 29) = = 6.022, p = 0.049) (рис. 5а). У крыс, потреблявших раствор с наночастицами серебра, просматривались тенденции к увеличению пробега в центре ПКЛ (Kruskal–Wallis ANOVA: H (2, N = 29) = 5.396, p = 0.067) (рис. 5б) и увеличению числа посещений отделов ПКЛ (Kruskal–Wallis ANOVA: H (2, N = 29) = 5.572, p = 0.062) (рис. 5в). Статистически значимых различий в величине общего пробега в группах не выявлено (Kruskal–Wallis ANOVA: H (2, N = 29) = 3.944, p = 0.139) (рис. 5г).
Рис. 5.
Показатели поведения крыс в тесте “Приподнятый крестообразный лабиринт” через 2 мес после начала приема растворов: а – время, проведенное в закрытых рукавах лабиринта, с; б – пробег в центре лабиринта, см; в – суммарное число посещений отделов лабиринта; г – общий пробег в лабиринте, см. Обозначения групп как на рис. 2. *p < 0.05 – относительно значения показателя в группе “ЦД” (по результатам post hoc анализа методом множественного сравнения средних рангов после Kruskal–Wallis ANOVA).
На втором этапе в этом тесте различий между группами ни по одному из показателей не обнаружено.
Оценка привыкания по показателям акустического стартл-ответа
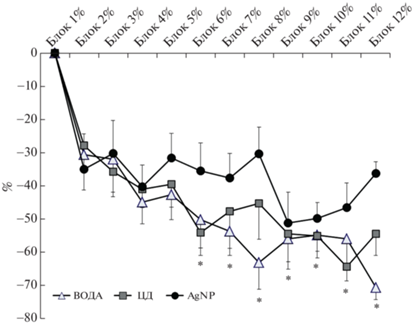
Анализ привыкания по снижению амплитуды АСО в процессе предъявления 120 последовательных сверхпороговых звуковых сигналов с помощью Two-Way ANOVA по факторам “Группа” и “Блок” выявил влияние только фактора “Блок”: F(10,200) = 5.875; p < < 0.001, что свидетельствовало о наличии привыкания во всех группах крыс. Однако внутригрупповой post hoc анализ показал, что в группах “ВОДА” и “ЦД”, начиная с Блока 6%, наблюдается статистически значимое снижение относительного значения амплитуды по сравнению со значением в Блоке 2% (рис. 6), тогда как в группе “AgNP” статистически значимого снижения относительного значения амплитуды в процессе тестирования не выявлено. Результаты свидетельствуют о нарушении неассоциативного негативного обучения (привыкания) у крыс, потреблявших раствор наночастиц серебра.
Оценка веса органов-маркеров стресса
Рис. 6.
Динамика снижения относительной величины амплитуды акустического стартл-ответа (%) (привыкание) в процессе последовательного предъявления 120 сверхпороговых акустических сигналов крысам групп “ВОДА”, “ЦД” и “AgNP”. Для каждого блока представлена средняя величина снижения относительной амплитуды в ответ на 10 последовательных сигналов по сравнению с первым блоком. *р < 0.05 – для каждой из групп “ВОДА” и “ЦД” по сравнению с величиной снижения амплитуды в Блоке 2% (Two-Way ANOVA, post hoc LSD тест).
На первом этапе (через 2 мес питья растворов) выявлены различия между группами по показателям абсолютного (F(2,12) = 5.140, p = 0.024) и относительного (F(2.12) = 4.897, p = 0.028) веса тимуса: в группе “ЦД” абсолютный и относительный вес тимуса был статистически значимо больше, чем в группе “ВОДА”, а в группе “AgNP” наблюдали только тенденцию к превышению абсолютного веса тимуса над контрольным уровнем. При этом вес крыс в группах на данном сроке обследования статистически значимо не различался (F(2.12) = 2.156, p = 0.159). Изменений абсолютного и относительного веса селезенки и надпочечников не обнаружено. На втором этапе эксперимента межгрупповых различий в весе органов-маркеров стресса не выявлено.
Электронно-микроскопическое исследование тканей мозга крыс
В ходе исследования срезов под микроскопом искали плотные скопления частиц с четкими границами (морфологическое доказательство наличия металлических частиц). С поля зрения, включавшего такие образования, дополнительно получали дифракционную картину для подтверждения кристаллической природы скоплений, характерных для серебра. При обнаружении дифракции дополнительно проводили съемку интересующего участка в режиме темного поля, чтобы обнаружить источники дифракции.
Исследованы срезы образцов ткани гиппокампа, фронтальной коры и стриатума крыс через 2 мес потребления растворов наночастиц и контрольных животных, пивших воду. На рис. 7а показана микрофотография участка ткани гиппокампа. На дифрактограмме этого участка (рис. 7б) видны рефлексы, специфичные для кристаллического серебра, что говорит о присутствии AgNP и (или) их агрегатов.
Рис. 7.
Микрофотография участка ткани гиппокампа из мозга крысы, получавшей наночастицы серебра, увеличение: 10 000× (а), электронная дифрактограмма этого участка (б).

Дифракционные доказательства присутствия кристаллов серебра получены также для образцов фронтальной коры мозга крыс, потреблявших раствор наночастиц. На рис. 8 приведено изображение участка при разном увеличении, где не видно собственно кристаллов серебра, но в данной области среза обнаружена дифракция, схожая с дифракционной картиной от кристаллов серебра. Однако таких четких рефлексов (дифракционных колец), которые наблюдались при исследовании срезов гиппокампа, здесь получить не удалось вследствие недостаточно высокой концентрации кристаллов. Тем не менее можно констатировать наличие кристаллов металлического серебра, поскольку при исследовании этой же области в режиме темного поля наблюдаются светящиеся точки различной яркости – источники наблюдавшейся дифракции (рис. 8б). Это дает основания полагать, что в образце фронтальной коры мозга крысы присутствуют наночастицы серебра.
Рис. 8.
ПЭМ-изображение среза фронтальной коры мозга крысы. Микрофотография участка образца ткани при увеличении 25 000× (а); в представляющей интерес области при фотографировании в темном поле видны светящиеся точки (некоторые примеры отмечены стрелками с указанием диаметра этих точек) (б). Размеры точек позволяют предположить, что они отвечают наночастицам серебра.

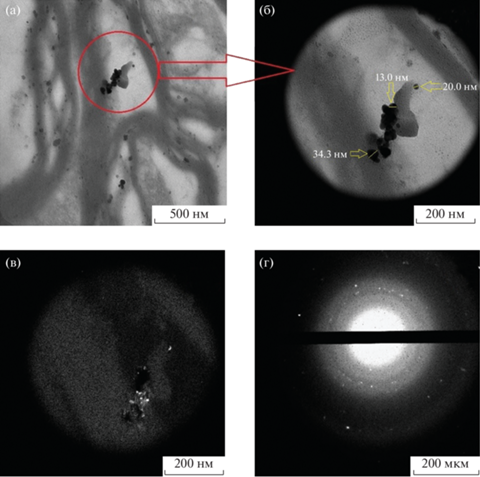
В срезах стриатума мозга крыс из опытной группы были обнаружены изображения агломератов наночастиц, что подтверждалось как морфологическими признаками, типичными для данных частиц, так и дифракционной картиной (рис. 9). В соответствующих контрольных образцах подобные образования не наблюдались.
Рис. 9.
Микрофотография участка ткани стриатума мозга крысы, получавшей AgNP. В режиме светлого поля при увеличении 10 000× можно наблюдать заметное скопление наночастиц (а). Часть этого поля зрения показана при бόльшем увеличении (25 000×) с указанием диаметра некоторых частиц (б). На этой же части изображения в режиме темного поля видны источники дифракции в виде ярко светящихся точек (в). Дифракционная картина с этого изображения (г) соответствует картине, характерной для кристаллов серебра.
ВЫВОДЫ
Подводя итоги проведенных исследований, отметим наиболее существенные следствия, вытекающие из полученных результатов.
1. Тот факт, что увеличение двигательной активности и снижение тревожно-фобического уровня у крыс в условиях потребления ими раствора наночастиц серебра проявлялись только в стрессогенной обстановке классического “открытого поля”, позволяет предполагать повышение у потребителей чувствительности к стрессирующим воздействиям. Это предположение следует проверить в будущих исследованиях.
2. Длительное потребление раствора наночастиц серебра нарушало кратковременное привыкание по показателям акустического стартл-ответа, что дает основание для продолжения изучения влияния наночастиц серебра на когнитивные функции.
3. Потребление раствора ЦД (без наночастиц) приводило к снижению двигательной активности на пике потребления (2 мес) в нестрессогенной обстановке автоматизированного “открытого поля”, а также к увеличению массы тимуса. Эти данные свидетельствуют о необходимости контроля эффектов стабилизаторов наночастиц серебра в растворе и ставят вопрос о механизмах их действия [7, 19, 40, 42].
4. Результаты электронно-микроскопических исследований мозга крыс, потреблявших раствор AgNP в течение двух месяцев, позволяют сделать вывод о присутствии наночастиц в трех отделах мозга – в гиппокампе, фронтальной коре и стриатуме, вовлеченных в реализацию эмоциональной деятельности, моторного контроля и его когнитивной составляющей (привыкание), формирование памяти и др. [53, 54]. Выявление присутствия наночастиц серебра в мозге дает основания полагать, что проникновение AgNP в головной мозг при длительном пероральном введении возможно, даже если концентрация наночастиц в потребляемом лекарственном препарате сравнительно невелика, что наблюдалось и в некоторых токсикологических исследованиях [55, 56].
В исследованиях срезов мозга крыс через 3 мес после отмены потребления AgNP присутствия наночастиц не обнаружено, что согласуется с отсутствием различий между группами по показателям поведения. Такое согласие можно считать указанием на то, что при выбранных нами суточной дозе наночастиц и условиях эксперимента, приближенных к реальному потреблению их человеком, наночастицы серебра не оказывают длительного негативного воздействия на функции ЦНС, связанные с изменением исследованных показателей поведения. Однако учитывая низкую вероятность обнаружения наночастиц в исследованных срезах мозга опытных животных (в одном из 18–20 образцов), это можно рассматривать лишь как предположение, требующее проверки. Для окончательного вывода необходимы исследования большего количества образцов тканей мозга соответствующей группы животных.
Сопоставление полученных нами данных с результатами подобных исследований, известных из литературы [30–39], представляет весьма сложную задачу вследствие большого разброса условий, при которых проводятся исследования влияния этих наночастиц на поведение животных. На наш взгляд, главная проблема здесь не в различиях методик тестирования поведения, но в различиях значимых параметров в части методологии, касающейся требований к методам получения, определения основных параметров наночастиц и учета особенностей растворов наночастиц при исследованиях их биологической активности.
В случае наночастиц серебра значимыми параметрами в этой части являются: (1) способ получения наночастиц, который определяет состав их раствора, природу стабилизатора (если таковой присутствует) и поверхностный заряд; (2) размер наночастиц; (3) используемая доза (в мкг/кг); (4) способ введения; (5) длительность экспозиции. Для корректного сопоставления результатов тестов показателей поведения требуется, очевидно, определение влияния отличий названных параметров в наших экспериментах от используемых в литературе. Например, во всех указанных выше публикациях, кроме [30], используются дозы, значительно более высокие, чем в настоящей работе, что, несомненно, должно отражаться на общем состоянии организма, включая показатели функций ЦНС. Но как влияет увеличение дозы на показатели в аналогичном тесте, остается неясным. В то же время в работе [30], хотя крысам той же линии вводились весьма низкие суточные дозы (5 и 10 мкг/кг), имеются существенные отличия по другим параметрам (способу получения наночастиц, способу и длительности введения), а также неудовлетворительно охарактеризованы размеры наночастиц. Все это затрудняет интерпретацию отличий в изменениях поведения, выявленных в работах разных авторов, от наблюдений в данной работе.
Заслуживает внимания сопоставление результатов при разных способах получения наночастиц. По нашему мнению, в исследованиях действия на ЦНС разумно ограничить круг способов получения наночастиц, используя растворы, которые уже потребляются (или могут потребляться) человеком и имеют известные характеристики. Тогда при одинаковых параметрах (2–5) в независимых лабораториях можно получить сведения о воспроизводимости результатов по изменениям поведения, а при одинаковых параметрах (3–5) можно определить влияние размера наночастиц. В принципе ясно, что исследования действия растворов AgNP на поведение животных весьма актуальны для определения критериев их безопасного потребления человеком. Для дальнейшего продвижения в этом направлении важно учитывать специфику токсического действия наночастиц и приближать, насколько возможно, условия эксперимента к практике их применения в медицине. Более подробное обсуждение соответствующего круга вопросов может быть предметом отдельной публикации.
В работе соблюдены все применимые международные и национальные руководящие принципы по уходу и использованию животных. Все процедуры, проводимые в исследованиях с участием животных, соответствовали этическим стандартам учреждения и были одобрены Этическим комитетом ФГБНУ “НИИОПП”.
Список литературы
Lansdown A.B.G. // Crit. Rev. Toxicol. 2007. V. 37. № 3. P. 237. https://doi.org/10.1080/10408440601177665
Oberdorster G. // J. Int. Med. 2010. V. 267. № 1. P. 89. https://doi.org/10.1111/j.1365-2796.2009.02187.x
Johnston H.J., Hutchison G., Christensen F.M. // Crit. Rev. Toxicol. 2010. V. 40. № 4. P. 328. https://doi.org/10.3109/10408440903453074
Arora S., Radjwade J.M., Paknikar K.M. // Toxicol. Appl. Pharmacol. 2012. V. 258. № 2. P. 151. https://doi.org/10.1016/j.taap.2011.11.010
Lan Z., Yang W.-X. // Nanomedicine. 2012. V. 7. № 4. P. 579. https://doi.org/10.2217/nnm.12.20
Pietroiusti A. // Nanoscale. 2012. V. 4. P. 1231. https://doi.org/10.1039/C2NR11688J
Pulit-Prociak J., Stokłosa K., Banach M. // Environ. Chem. Lett. 2014. V. 15. P. 59. https://doi.org/10.1007/s10311-014-0490-2
Kumar V., Sharma N., Maitra S.S. // Int. Nano Lett. 2017. V. 7. P. 243. https://doi.org/10.1007/s40089-017-0221-3
Schulte P.A., Leso V., Niang M., Iavicoli I. // Scand. J. Work. Environ. Health. 2019. V. 45. № 3. P. 217. https://doi.org/10.5271/sjweh.3800
Rai M., Yadav A., Gade A. // Biotechnol. Adv. 2009. V. 27. № 1. P. 76. https://doi.org/10.1016/j.biotechadv.2008.09.002
Monteiro D.R., Gorup L.F., Takamiya A.S. et al. // Int. J. Antimicrob. Agents. 2009. V. 34. № 2. P. 103. https://doi.org/10.1016/j.ijantimicag.2009.01.017
Lara H.H., Garza-Treviño E.N., Ixtepan-Turrent L. et al. // J. Nanobiotechnol. 2011. V. 9. P. 30. https://doi.org/10.1186/1477-3155-9-30
Кричевский Г.Е. Использование наночастиц металлов в медицине. Нанотехнологическое общество России. 2020. http://www.rusnor.org/pubs/articles/15479.htm
Korani M., Ghazizadeh E., Korani S. et al. // Eur. J. Nanomed. 2015. V. 7. № 1. P. 51. https://doi.org/10.1515/ejnm-2014-0032
Kim Y.S., Song M.Y., Park J.D. et al. // Part. Fibre Toxicol. 2010. V. 7. P. 20. https://doi.org/10.1186/1743-8977-7-20
Park E.-J., Bae E., Yi J. et al. // Environ. Toxicol. Pharmacol. 2010. V. 30. № 2. P. 162. https://doi.org/10.1016/j.etap.2010.05.004
Гмошинский И.В., Шумакова А.А., Шипелин В.А. и др. // Российские нанотехнологии. 2016. Т. 11. № 9–10. С. 102.
Pietroiusti A., Campagnolo L., Fadeel B. // Small. 2012. V. 9 № 9–10. P. 1557. https://doi.org/10.1002/smll.201201463
Ema M., Okuda H., Gamo M. et al. // Reprod. Toxicol. 2017. V. 67. P. 149. https://doi.org/10.1016/j.reprotox.2017.01.005
Анциферова А.А., Бузулуков Ю.П., Демин В.А. и др. // Российские нанотехнологии. 2015. Т. 10. № 1–2. С. 84.
Анциферова А.А., Бузулуков Ю.П., Кашкаров П.К., Ковальчук М.В. // Кристаллография. 2016. Т. 61. № 6. С. 988.
Dziendzikowska K., Gromadzka-Ostrowska J., Lankoff A. et al. // J. Appl. Toxicol. 2012. V. 32. № 11. P. 920. https://doi.org/10.1002/jat.2758
Sharma H.S. // Nanomedicine. 2007. V. 2. № 6. P. 753. https://doi.org/10.2217/17435889.2.6.753
Tang J., Xiong L., Zhou G. et al. // J. Nanosci. Nanotechnol. 2010. V. 10. № 10. P. 6313. https://doi.org/10.1166/jnn.2010.2625
Sharma A., Muresanu D.F., Patnaik R. et al. // Mol. Neurobiol. 2013. V. 48. P. 386. https://doi.org/10.1007/s12035-013-8500-0
Trickler W.J., Lantz S.M., Murdock R.C. et al. // Toxicol. Sci. 2010. V. 118. № 1. P. 160. https://doi.org/10.1093/toxsci/kfq244
Khan A.M., Korzeniowska B., Gorshkov V. et al. // Nanotoxicology. 2019. V. 13. № 2. P. 221. https://doi.org/10.1080/17435390.2018.1540728
Safari M., Bidgoli S.A., Rezayat S.M. // Nanomed. J. 2016. V. 3. № 2. P. 83. https://doi.org/10.7508/nmj.2016.02.002
Zhang B., Na Liua N., Liua Q.S. et al. // Ecotoxicol. Environ. Saf. 2020. V. 198. P. 110674. https://doi.org/10.1016/j.ecoenv.2020.110674
Hritcu L., Stefan M., Ursu L. et al. // Cent. Eur. J. Biol. 2011. V. 6. № 4. P. 497. https://doi.org/10.2478/s11535-011-0022-z
Liu Y., Guan W., Ren G. et al. // Toxicol. Lett. 2012. V. 209. № 3. P. 227. https://doi.org/10.1016/j.toxlet.2012.01.001
Liu P., Huang Z., Gu N. // Ecotoxicol. Environ. Saf. 2013. V. 87. P. 124. https://doi.org/10.1016/j.ecoenv.2012.10.014
Zhang Y., Ferguson S.A., Watanabe F. et al. // Small. 2013. V. 9. № 9–10. https://doi.org/10.1002/smll.201201548
Yin N., Zhang Y., Yun Z. et al. // Toxicol. Lett. 2015. V. 237. № 2. P. 112. https://doi.org/10.1016/j.toxlet.2015.06.007
Зейналов О.А., Комбарова С.П., Багров Д.В. и др. // Обзоры по клинической фармакологии и лекарственной терапии. 2016. Т. 14. № 4. С. 42. https://doi.org/10.17816/RCF14442-51
Dąbrowska-Bouta B., Zięba M., Orzelska-Górka J. et al. // Toxicology. 2016. V. 363–364. P. 29. http://dx.doi.org/doi:10.1016/j.tox.2016.07.007
Antsiferova A., Kopaeva M., Kashkarov P. // Materials. 2018. V. 11. № 4. P. 558. https://doi.org/10.3390/ma11040558
Antsiferova A., Kopaeva M., Kochkin V.N. et al. // Toxics. 2021. V. 9. P. 30. https://doi.org/10.3390/toxics9020030
Ivlieva A.N., Petritskaya E.N., Rogatkin D.A. et al. // Phys. Part. Nucl. Lett. 2021. V. 18. № 2. P. 250.
Егорова Е.М., Кубатиев А.А. // Нанотехнологии: методология исследований действия наночастиц металлов на биологические объекты. М.: Юрайт, 2020. 188 с.
Препарат “Витаргол”. ООО НПЦ “ЭЛЮСАН”. 2021. https://vitargol.ru/nanosilver
Егорова Е.М., Кубатиев А.А., Швец В.И. // Биологические эффекты наночастиц металлов. М.: Наука, 2014. С. 172.
Егорова Е.М., Сосенкова Л.С. Способ получения водных растворов наночастиц серебра с природным восстановителем. Патент РФ № 2618270, приоритет от 01.06.2016 г.
Кедик С.А., Панов А.В., Тюкова В.С., Золотарева М.С. // Разработка и регистрация лекарственных средств. 2016. Т. 16. № 3. С. 68.
dos Passos Menezesa P., de Araújo Andradea T., Frank L.A. et al. // Int. J. Pharm. 2019. V. 559. P. 312. https://doi.org/10.1016/j.ijpharm.2019.01.041
“Коллоидное серебро форте” // Nature Sunshine Products, Inс. 2021. https://natr.ru/catalog/bad/kolloidnoe-serebro-forte
Гуськова Т.А. // Токсикологический вестник. 2010. № 5. С. 2.
Родина В.И., Крупина Н.А., Крыжановский Г.Н., Окнина Н.Б. // Журн. высш. нерв. деят. 1993. Т. 43. № 5. С. 1006.
Walf A.A., Frye Ch.A. // Nat. Protoc. 2007. V. 2. P. 322. https://doi.org/10.1038/nprot.2007.44
Крупина Н.А., Хлебникова Н.Н., Орлова И.Н. // Патол. физиол. эксперимент. тер. 2015. Т. 59. № 4. С. 4.
Valsamis B., Schmid S. // J. Vis. Exp. 2011. № 55. P. e3446. https://doi.org/10.3791/3446
Wilcoxon J.P., Williamson R.L., Baughman R. // J. Chem. Phys. 1993. V. 98. P. 9933. https://doi.org/10.1063/1.464320
Kovner R., Oler J.A., Kalin N.H. // Am. J. Psych. 2019. V. 176. № 12. P. 987. https://doi.org/10.1176/appi.ajp.2019.19101064
Florio T.M., Scarnati E., Rosa I. et al. // CNS Neurosci. Ther. 2018. V. 24. № 8. P. 677. https://doi.org/10.1111/cns.12987
Skalska J., Struzyńska L. // Folia Neuropathol. 2015. V. 53. № 4. P. 281.
Buzulukov Y.P., Gmoshinski I.V., Ansiferova A.A. et al. // Nano Hybrids Compos. 2017. V. 13. P. 199.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии



