Российские нанотехнологии, 2022, T. 17, № 2, стр. 270-274
Изучение цитотоксичности иммуномагнитолипосом на примере культуры микроводоросли Chlorella vulgaris
И. А. Колтаков 1, Е. В. Шилова 1, *, В. Г. Артюхов 1
1 Воронежский государственный университет
Воронеж, Россия
* E-mail: zinkovae@list.ru
Поступила в редакцию 01.06.2021
После доработки 30.10.2021
Принята к публикации 12.11.2021
Аннотация
Получены иммуномагнитолипосомы состава фосфатидилхолин–холестерин–дистероилфосфоэтаноламин–полиэтиленгликоль (2000)–магнетит–антитела к гистону H3. Изучены их размерные характеристики методом динамического рассеяния света. Выявлено, что липосомальные наночастицы имеют размеры 176.4 ± 12.9 нм. Получены данные о токсичности синтезированных наночастиц по отношению к культуре микроводорослей Chlorella vulgaris: липосомы при соотношениях клеток к липосомам от 1/1 до 1/1000 не оказывают токсического воздействия на выбранный объект, а в соотношении 1/1000 наблюдается стимуляция роста численности клеток изучаемой микроводоросли.
ВВЕДЕНИЕ
Адресная доставка лекарственных препаратов является быстроразвивающимся направлением медицины. Исследователи ведут активный поиск новых способов адресной доставки и усовершенствования имеющихся технологий. Липосомы занимают особое место среди таких средств в силу того, что с их помощью возможно нивелировать токсические эффекты лекарственных препаратов на здоровые ткани [1–4]. Также ведутся исследования по созданию и возможному практическому применению липосом, содержащих в своем составе магнитовосприимчивые наночастицы (НЧ). Например, липосомы с включенными НЧ оксида железа показали свою эффективность при лечении железодефицитной анемии у крыс линии Wistar [5]. Перспективным представляется использование магнитоуправляемых липосом для адресной доставки лекарственных препаратов, при этом оксид железа может выступать в качестве МРТ-контрастирущего вещества.
Одним из возможных путей доставки противоопухолевых препаратов может быть их доставка к опухолевым клеткам посредством нейтрофильных внеклеточных ловушек (НВЛ). Исследование [6] показало, что при стимуляции форболмеристацетатом нейтрофилы формируют ретикулярную структуру ДНК вокруг клеток рака легких A549. Согласно [7] опухолевые клетки взаимодействуют со структурами НВЛ, адсорбируясь на них с помощью молекулы β1-интегрина. Эти данные позволяют рассматривать НВЛ в качестве возможного средства доставки противоопухолевых препаратов. Местом взаимодействия липосом с НВЛ могут служить молекулы гистона H3, которые являются неотъемлемой частью внеклеточных сетей, но в свободном виде в кровеносном русле не циркулируют [8]. В связи с этим разработаны иммунолипосомы, функционализированные антителами к гистону H3 в качестве вектора.
Тем не менее одной из главных проблем при применении липосомальных НЧ является возможное токсическое воздействие на здоровые клетки и ткани в силу разрушения со временем липосомальных структур и “утечки” их содержимого. Поэтому оценка токсического воздействия используемых средств доставки лекарственных препаратов является необходимой частью исследований при их создании. Микроводоросль Chlorella vulgaris является удобным объектом для токсикологических исследований, так как у нее достаточно короткий цикл развития, составляющий 22 ч.
Цель исследования заключалась в изучении токсических свойств иммуномагнитолипосом, синтезированных в настоящей работе, по отношению к культуре микроводорослей Chlorella vulgaris. В качестве магнитовосприимчивого вещества использовали НЧ магнетита, покрытые цетилтриметиламмония бромидом, в качестве вектора присоединяли антитела к гистону H3.
МАТЕРИАЛЫ И МЕТОДЫ
Синтез наночастиц магнетита, стабилизированных цетилтриметиламмония бромидом. НЧ магнетита получали модифицированным методом Массарта путем соосаждения солей железа(II) и железа(III) в щелочной среде [9]. В качестве осаждающего реагента использовали 1%‑ный раствор аммиака (Вектон, Россия), от которого НЧ магнетита отмывали 3 раза дистиллированной водой. Поверхность полученных НЧ магнетита модифицировали цетилтриметиламмония бромидом (Sigma, США) в концентрации 0.06 М, после чего трижды отмывали НЧ дистиллированной водой и высушивали в лиофильной сушилке Labconco (США) в течение 3ч.
Получение иммуномагнитолипосом. Липосомы синтезировали методом гидратации/регидратации [10, 11]. Раствор фосфатидилхолина (0.5%) (Sigma, США), холестерина (0.5%) (Sigma, США) и дистероилфосфоэтаноламин–полиэтиленгликоля (2000) (0.1%) (Avanti Polar lipids, США) в этиловом спирте испаряли в роторном испарителе RV10 control (IKA, Германия) при температуре водяной бани 60°С. К полученной липидной пленке добавляли 0.1 М натрий-фосфатного буфера с НЧ магнетита (1 мг/мл) и перемешивали в течение одной минуты. При получении липосом, содержащих азид натрия (Sigma, США), последний в концентрации 0.03% также вносили в натрий-фосфатный буфер. Антитела к гистону H3 (Cloud-Clone corp., США) инкубировали с реагентом Траута (Sigma, США) 1 ч. Тиолированное антитело добавляли к синтезированным липосомам и инкубировали в течение 12 ч при t = 4°С. Следующим этапом стала диспергация получаемых липосом, для чего растворы подвергали воздействию ультразвука. Облучение проводили в ультразвуком дезинтеграторе Qsonica Sonicators (США) в течение 15 мин (20 кГц, 10-секундный импульс с перерывом 3 с) [12].
Изучение размеров синтезированных наночастиц методом динамического рассеяния света (ДРС). Размер полученных липосом определяли с помощью спектрометра ДРС Zetasizer Nano ZSP (Malvern, Великобритания). Измерения проводили в кювете с длиной оптического пути 1 см при температуре 37°С.
Расчет количества липосом. Для оценки токсичности получаемых липосом необходимо контролировать их содержание в системе. Количество добавляемых к микроводорослям липосомальных НЧ рассчитывали согласно [13].
Количество молекул липидов на одну липосому рассчитывали по формуле
(1)
${{N}_{{{\text{tot}}}}} = \frac{{\left[ {4\pi {{{\left( {\frac{d}{2}} \right)}}^{2}} + 4\pi {{{\left( {\frac{d}{2} - h} \right)}}^{2}}} \right]}}{a},$Количество липосом в растворе вычисляли с учетом молярной массы липидов, входящих в состав липосомы, и их концентрации по формуле
(2)
${{N}_{{{\text{lipo}}}}} = \frac{{({{n}_{1}} + {{n}_{2}} + {{n}_{3}}){{N}_{{\text{A}}}}}}{{{{N}_{{{\text{tot}}}}}}},$Определение токсических свойств наночастиц на примере водоросли Chlorella vulgaris. Методика основана на регистрации различий в оптической плотности тест-культуры водоросли хлорелла, выращенной в водной среде, не содержащей искусственных НЧ (контроль), и в водных дисперсных системах, содержащих тестируемые НЧ (опыт). Критерием токсичности НЧ является снижение на 20% и более величины оптической плотности культуры водоросли, выращиваемой в течение 22 ч (при 37°С) в дисперсной системе НЧ, по сравнению с ее ростом на контрольной среде, приготовленной на дистиллированной воде. Количественная характеристика токсичности при этом определяется общепринятым показателем: индексом токсичности (I) – относительной (процент) величиной прироста оптической плотности для дисперсионной среды по сравнению с контролем:
Статистическую обработку данных проводили с помощью пакетов прикладных программ Microsoft Excel 2010. Достоверность различий контрольных и опытных величин устанавливали с использованием t-критерия Стьюдента. В процедурах статистического анализа рассчитывали достигнутый уровень значимости (p), при этом критический уровень значимости в данном исследовании принимали равным 0.05. Полученные данные были представлены в виде среднего арифметического и его стандартного отклонения (M ± Sd).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
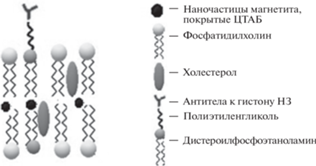
Структура полученных липосомальных НЧ представлена на рис. 1. Липидный бислой состоит из молекул фосфатидилхолина, холестерина и дистероилфосфоэтаноламин–полиэтиленгликоля (2000), к которому присоединены антитела к гистону H3. НЧ магнетита, покрытые цетилтриметиламмония бромидом ([С16Н33N(CH3)3]Br), встраиваются преимущественно в липидный бислой за счет взаимодействия поверхностно-активного вещества с используемыми липидами [16, 17].
Рис. 1.
Схематичное строение мембраны синтезированных магнитоиммунолипосом. ЦТАБ – цетилтриметиламмония бромид.
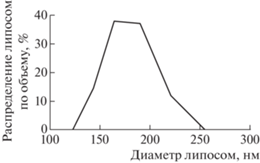
Размер липосом контролировали методом ДРС. Исследование размера полученных липосом показало, что липосомальные НЧ имеют размеры 176.4 ± 12.9 нм (рис. 2). Данный размер позволяет рассматривать полученные липосомы в качестве возможного средства адресной доставки лекарственных препаратов.
Рис. 2.
Распределение по размерам липосом из соевого лецитина с включенными наночастицами магнетита.
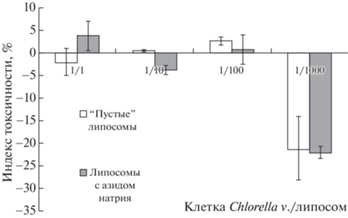
Токсическое действие липосом оценивали, добавляя синтезированные НЧ в соотношениях клеток хлореллы/липосом от 1/1 до 1/1000. Исследовали влияние “пустых” липосом и липосом, содержащих в своем составе азид натрия в концентрации 0.03%. Данное вещество использовали в качестве модельной системы, позволяющей оценить стабильность липосом и выход лекарственного препарата из них. Азид натрия – токсичное химическое вещество, накапливаясь в митохондриях, вызывает разобщение окислительного фосфорилирования [18]. Исследование индекса токсичности полученных липосом по отношению к водорослям показало, что при соотношении клетка/липосома от 1/1 до 1/100 статистически значимых различий в индексе токсичности не наблюдается (табл. 1).
Таблица 1.
Индекс токсичности влияния синтезированных липосом на микроводоросли Chlorella vulgaris
| Клеток/липосом | 1/1 | 1/10 | 1/100 | 1/1000 |
|---|---|---|---|---|
| “Пустые” липосомы | –2.16 ± 3.06 | 0.51 ± 0.11 | 2.61 ± 0.99 | –21.03 ± 7.11 |
| Липосомы с азидом натрия | 3.83 ± 3.28 | –3.81 ± 1.04 | 0.78 ± 3.25 | –22.14 ± 1.32 |
При увеличении числа липосом до соотношения клетка/липосома = 1/1000 наблюдается снижение индекса токсичности (рис. 3), что говорит об увеличении содержания хлорофилла в суспензии микроводорослей Chlorella vulgaris.
Рис. 3.
Определение индекса токсичности синтезированных иммуномагнитолипосом по отношению к микроводорослям Chlorella vulgaris.
Подсчет концентрации клеток показал, что после инкубации в течение 22 ч в соотношении клетка/липосома = 1/1000 происходит статистически значимое увеличение количества клеток (рис. 4).
Рис. 4.
Концентрация клеток микроводоросли Chlorella vulgaris после инкубации с магнитоиммунолипосомами.

Стимуляция роста клеток микроводоросли хлорелла, по-видимому, связана с эффектами оксидов железа, входящих в состав полученных липосом. Железо необходимо для образования хлорофилла. При этом железо катализирует образование предшественников хлорофилла: 5-аминолевулиновой кислоты и протопорфиринов. При недостатке железа нет условий для образования таких важнейших компонентов хлоропластов, как цитохромы, ферредоксин и некоторые другие. Кроме того, целый ряд ферментов содержит железо в негемовой форме. В хлоропластах железо в негемовой форме входит в состав реакционных центров фотосистем I и II [19, 20].
ЗАКЛЮЧЕНИЕ
Изучено влияние синтезированных иммуномагнитолипосом на клетки микроводорослей Chlorella vulgaris. Установлено, что полученные НЧ в исследуемом диапазоне концентраций (соотношения клеток к липосомам от 1/1 до 1/1000) не оказывают токсического эффекта на клетки микроводорослей. Таким образом, результаты имеют практическое значение для оценки биобезопасности липосом, а также для планирования доклинических оценок потенциала их использования в качестве средства адресной доставки лекарственных веществ.
Работа выполнена при поддержке Министерства науки и высшего образования РФ в рамках государственного задания вузам в сфере научной деятельности на 2020–2022 гг., проект № FZGU-2020-0044.
Список литературы
Балоян Б.М., Колмаков А.Г., Алымов М.И. и др. Наноматериалы. Классификация, особенности свойств, применение и технологии получения. Учебное пособие. М.: Международный университет природы, общества и человека “Дубна”, Филиал “Угреша”, 2007. 125 с.
Барышников А.Ю. // Вестн. РАМН. 2012. № 3. С. 23.
Краснопольский Ю.М., Балабаньян В.Ю., Шоболов Д.Л. и др. // Рос. хим. журн. 2012. Т. 56. № 3–4. С. 11.
Наквасина М.А., Артюхов В.Г. // Бионанотехнологии: достижения, проблемы, перспективы развития: учеб. пособие. Воронеж: Издательский дом ВГУ, 2015. С. 146.
Fathy M.M., Fahmy H.M., Balah A.M.M. et al. // Life Sci. 2019. V. 1. № 234. P. 116787. https://doi.org/10.1016/j.lfs.2019.116787
Cools-Lartigue J., Spicer J., Najmeh S. // Cell. Mol. Life Sci. 2014. V. 71. № 21. P. 4179. https://doi.org/10.1172/jci67484
Najmeh S., Cools-Lartigue J., Rayes R.F. et al. // Int. J. Cancer. 2017. V. 140. P. 2321.
Коротина О.Л., Генералов И.И. // Иммунопатология, аллергология, инфектология. 2012. № 4. С. 23.
Massart R. // IEEE Trans. Magn. 1981. V. 17. № 2. P. 1247.
Шилова Е.В., Колтаков И.А., Артюхов В.Г. // Сб. науч. Тр. VI Съезда биофизиков России: в 2 т., Т. 2. Сочи. 16–21 сентября 2019. Краснодар: Полиграфическое объединение “Плехановец”, 2019. С. 273.
Шилова Е.В., Артюхов В.Г., Скорбач Е.Д. и др. // Нанотехнологии: разработка, применение: XXI век. 2018. № 4. С. 9.
Артюхов В.Г., Колтаков И.А., Шилова Е.В. Способ получения липосом. Пат. 2621145. Россия. 2017.
Huang C.H., Mason J.T. // Proc. Nat. Acad. Sci. 1978. V. 75. № 1. P. 308.
Методика определения индекса токсичности нанопорошков, изделий из наноматериалов, нанопокрытий, отходов и осадков сточных вод, содержащих наночастицы, по изменению оптической плотности культуры водоросли хлорелла (Сhlorella vulgaris Beijer) (ФР.1.39.2010.09103). 2010 г.
Путинцева О.В., Артюхов В.Г., Колтаков И.А. // Иммунология. Практикум. Ч. II. Воронеж: Издательский дом ВГУ, 2008. 44 с.
Hwan T.-L., Hsu C.-Y., Aljuffali I.A. et al. // Colloids Surf. B. 2015. V. 128. P. 119. https://doi.org/10.1016/j.colsurfb.2015.02.02
Cano-Sarabia M., Angelova A., Ventosa N. et al. // J. Colloid Interface Sci. 2010. V. 350 (1). P. 10. https://doi.org/10.1016/j.jcis.2010.04.069
Chang S., Lamm S.H. // Int. J. Toxicol. 2003. V. 22. № 3. P. 175. https://doi.org/10.1080/10915810305109
Venkatesan S., Murugesan S., Senthur-Pandian V.K. et al. // Food Chem. 2005. V. 90. P. 535. https://doi.org/10.7831/ras.3.1
Иванищев В.В. // Изв. Тул. гос. ун-та. Естественные науки. 2019. № 3. С. 149.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


