Российские нанотехнологии, 2022, T. 17, № 2, стр. 261-269
Исследование антимикробной активности субмикронных частиц оксидов металлов на основе вольфрама в условиях воздействия света и темноты
В. Ф. Смирнов 1, *, О. Н. Смирнова 1, А. Ю. Шишкин 1, Д. Г. Фукина 1, А. В. Корягин 1, Е. В. Сулейманов 1
1 Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
* E-mail: biodeg@mail.ru
Поступила в редакцию 01.02.2021
После доработки 26.10.2021
Принята к публикации 26.10.2021
Аннотация
Исследована антимикробная активность мелкодисперсных частиц субмикронного размера WO3 и RbTe1.5W0.5O6 по отношению к бактериям Escherichia coli и Staphylococcus aureus. Установлено, что все исследуемые соединения вызывают снижение выживаемости бактерий как в условиях темноты, так и в условиях света. Показано, что уменьшение размеров частиц RbTe1.5W0.5O6 усиливает их антимикробный эффект. Действие света (мощность источников 30 и 50 Вт) усиливает антимикробную активность исследуемых соединений, особенно для RbTe1.5W0.5O6 с меньшим размером частиц, что говорит об их фотокаталической активности. С увеличением длительности экспозиции антимикробный эффект исследуемых соединений усиливается. Отмечена неоднозначность действия источников освещения разной мощности на бактерии, что может быть связано с их физиолого-биохимическими особенностями.
ВВЕДЕНИЕ
Оксиды некоторых металлов (ZnО, TiО2, CuО) находят широкое применение в качестве антимикробных препаратов в медицине, ветеринарии и сельском хозяйстве, а также в качестве средств защиты промышленных материалов от микробиологических повреждений [1]. В настоящее время среди таких антимикробных препаратов нового поколения все больше внимания уделяется мелкодисперсным микро- и наноразмерным частицам оксидов металлов, в частности оксидам цинка и титана. Для данных соединений отмечена фотокаталитическая активность, т.е. при воздействии на них света в областях спектра, соответствующих их ширине запрещенной зоны, имеет место возрастание антимикробного эффекта. Известно, что фотокаталитический эффект указанных выше оксидов металлов и их антимикробное действие зависят от целого ряда факторов: размера и формы частиц, их концентрации, светового спектра, мощности освещения и др. [2–5]. В последнее время фотокаталитическому эффекту оксидов металлов уделяется большое внимание в связи с возможностью использования данных материалов для получения экологичного топлива – водорода [6–8]. Исследование фотокаталитического усиления антимикробной активности мелкодисперсных частиц оксидов металлов весьма интересно и для обеззараживания воды и воздуха [9].
Согласно [7, 10–13] TiO2, ZnO, другие простые оксиды металлов и их модификации фотокаталитически активны только в УФ-диапазоне или близком к УФ-области видимом свете, который составляет лишь небольшую часть спектра солнечного излучения. УФ-диапазон составляет всего около 5–9% в спектре солнечного света (100–400 нм), при этом распределение интенсивности между этими длинами волн не одинаково, основная часть приходится на 350–400 нм. Соединения, поглощающие свет с длиной волны менее 400 нм, работают под действием солнечного света малоэффективно и требуют отдельный источник излучения на длине волны поглощения. Например, большое количество работ посвящено модификации оксида титана с целью смещения его края фундаментального поглощения с 3.2 эВ (387 нм) в область менее 3 эВ (400 нм) [14, 15]. В связи с этим актуальным является поиск новых соединений, которые поглощают свет в видимом диапазоне, т.е. проявляют фотокаталитическую активность.
Цель данной работы – исследование и сравнение антимикробной активности соединений на основе оксидов металлов по отношению к бактериям Escherichia coli и Staphylococcus aureus в условиях темноты и действия света.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объектов исследований использовали: оксид вольфрама(III) (WO3) (1); сложный оксид RbTe1.5W0.5O6 со структурой β-пирохлора, средним диаметром частиц 4658 нм (2) и 736 нм (3).
Среди простых оксидов наиболее привлекательным является оксид вольфрама (1) с относительно небольшой шириной запрещенной зоны (~2.8 эВ), что приводит к поглощению синего света (462 нм) [16]. Известно, что WO3 способен к фотокаталитическому окислению органических соединений под действием видимого света [17]. В качестве образца мелкодисперсного оксида вольфрама WO3 использовали химически чистый реактив, который предварительно перетирали в агатовой ступке в этиловом спирте. Средний размер частиц использованного в эксперименте соединения составляет 674 нм.
Соединения 2 и 3 (RbTe1.5W0.5O6) получали методом твердофазного синтеза. В качестве исходных реактивов использовали нитрат рубидия (RbNO3) (х. ч.), оксиды теллура (TeO2) и вольфрама (WO3) с мольным соотношением Rb : Te : W = 1: 1.5 : 0.5. Реактивы перетирали и прокаливали в платиновом тигле 2 ч на воздухе при 400°С для удаления оксидов азота, после чего полученный образец снова диспергировали и выдерживали в течение 10 ч при 700°С. Далее температуру поднимали до 750°С до образования расплава, который выдерживали в течение 1–2 ч. После этого образец резко охлаждали до комнатной температуры. Для получения поликристаллических образцов соединений 2 и 3 (RbTe1.5W0.5O6) с разным размером частиц использовали различные способы измельчения полученного соединения: диспергирование в агатовой ступке в течение 30 мин (2) и в планетарной мельнице в течение 18 ч в этиловом спирте (3).
Фазовую однородность полученного образца и использованного реактива проверяли методом рентгенофазового анализа. Исследование порошкового образца проводили на дифрактометре Shimadzu XRD-6100 (Shimadzu, Япония) с использованием Ni-фильтра (CuKα, λ = 1.5418 Å) в интервале углов 2θ 10°–60° со скоростью 1°/мин.
Фотографии частиц порошковых образцов были получены методом растровой электронной микроскопии (РЭМ) на микроскопе JSM-IT300LV (JEOL, Япония) с диаметром электронного зонда до 5 нм (рабочее напряжение 20 кВ). Исследование поверхности образцов проводили с использованием низкоэнергетичных вторичных электронов.
Исследование элементного состава образца проводили с помощью рентгеновского микрозондового анализа с детектором X-MaxN 20 (OxfordInstruments) Kα(O) и Lα(Rb, Te, W).
Объемное и количественное распределение частиц по размерам в полученном порошковом образце определяли методом лазерной дифракции при помощи анализатора SALD-2300 (SHIMADZU, Япония).
Соединение RbTe1.5W0.5O6 представляет практический интерес в качестве фотокаталитического материала, способного проявлять эффект при воздействии видимого спектра [18], кроме того, это вещество поглощает свет в более длинноволновой области, чем оксид вольфрама. Поэтому в данной работе проведено сравнительное исследование антибактериальных свойств WO3 и RbTe1.5W0.5O6 как в темноте, так и при воздействии света, который поглощается образцом, что инициирует процесс фотоокисления органических соединений.
Соединения 1–3 стерилизовали сухим жаром при температуре 180°С в течение двух часов.
В качестве источника света использовали светодиодные прожекторы JAZZWAY PFL-C3 мощностью 30 и 50 Вт, пылевлагозащищенные.
В качестве тест-культур микроорганизмов использовали штаммы бактерий E. coli АТСС 25922 (грамотрицательные) и S. aureus АТСС 6538 Р (грамположительные) (Американская коллекция типовых культур, США). Данные штаммы используются для оценки антимикробной активности различных химических соединений.
Для экспериментов использовали суточные культуры бактерий, которые ресуспендировали в стерильной воде. Исходный титр культур составлял 1 × 106 кл/мл. В опытные варианты вносили исследуемые вещества в концентрации 2 мг/мл. Экспозиция (время действия соединений на бактерии) составляла 30 и 120 мин. Часть образцов подвергалась действию источников света (30 и 50 Вт), другие варианты оставались в темноте. И те и другие варианты помещали на шейкеры (150 об./мин). В качестве контроля служили варианты с культурами бактерий при действии на них света и темноты, но без присутствия исследуемых соединений.
После этого определяли изменение титра культур бактерий чашечным методом (принцип Коха) путем посева бактерий на агаризованную среду с последующим учетом количества выросших колоний. Чашки Петри с культурами бактерий помещали в термостат при 37°С на 24 ч.
Антимикробное действие препаратов оценивали по степени выживаемости микроорганизмов, которую рассчитывали на основе изменения титра культур бактерий.
Все результаты, полученные в трех независимых экспериментах, в трех–пяти повторностях, обрабатывали с помощью программ Statistica 10.0 и Microsoft Excel 365. Оценку достоверности различий средних значений проводили по критерию Стьюдента для уровня вероятности не менее 95%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Соединение RbTe1.5W0.5O6 было получено и описано в [18–20]. Исследование его кристаллической структуры, термических свойств и электронного строения показало, что оно принадлежит структурному типу β-пирохлора и имеет линии поглощения при ~2.51 эВ, что соответствует видимому диапазону света с длиной волны 493 нм. Из полученной зонной диаграммы для RbTe1.5W0.5O6 следует, что при поглощении фотонов с энергией ~2.51 эВ происходит образование электронно-дырочных пар, которые могут участвовать в реакциях окисления органических веществ, что мы подтвердили на примере фоторазложения метиленового синего [18, 20].
На рис. 1а показана рентгенограмма полученного образца RbTe1.5W0.5O6, которую можно проиндицировать в кубической сингонии с пр. гр. $Fd\bar {3}m~$ [19]. Сравнение полученной рентгенограммы с теоретической, рассчитанной из данных рентгеноструктурного анализа для этого соединения, говорит о монофазной природе порошка. Примесные фазы не были обнаружены в пределах чувствительности метода. Рентгенограмма реактива оксида вольфрама также соответствует теоретической (ромбическая сингония, пр. гр. Pnmb) (рис. 1б) [21, 22].
Результаты измерения элементного состава показывают равномерное распределение элементов Rb, Te, W, O по порошку соединения RbTe1.5W0.5O6 и отвечают стехиометрическому соотношению 12.09 ат. % (Lα, Rb), 15.99 ат. % (Lα, Te), 5.64 ат. % (Lα, W) и 66.28 ат. % (Kα, O) в пределах чувствительности метода (~0.1 ат. %). Состав реактива WO3 также соответствует стехиометрическому 25.19 ат. % (Lα, W) и 74.81 ат. % (Kα, O).
Распределение по размерам частиц рассчитывали по теории Фраунгофера (рис. 2д, 2е). Из рисунков видно, что максимум распределения частиц для соединения 2 приходится на 7 мкм, а для соединения 3 – на 400 нм. Однако распределение для обоих образцов не является одномодальным, и для порошка образца RbTe1.5W0.5O6, диспергированного в агатовой ступке (2), можно отметить значительный вклад частиц с размерами в диапазоне от десятков нанометров до нескольких микрон, что приводит к определению среднего размера частиц 4658 нм. Для измельченного в планетарной мельнице соединения 3 видно наличие частиц в области до 10 мкм, которые представляют собой неразрушенные устойчивые агломераты, поэтому средний размер частиц оказывается больше, чем максимум распределения –736 нм (рис. 2д). Исследование морфологии образцов показывает, что более длительное перетирание приводит к уменьшению количества агломератов и общему усреднению частиц по размерам и форме (рис. 2а, 2б).
Рис. 2.
Микрофотографии и объемное распределение частиц по размерам порошка RbTe1.5W0.5O6 (а, б, д) и WO3 (в, г, е).
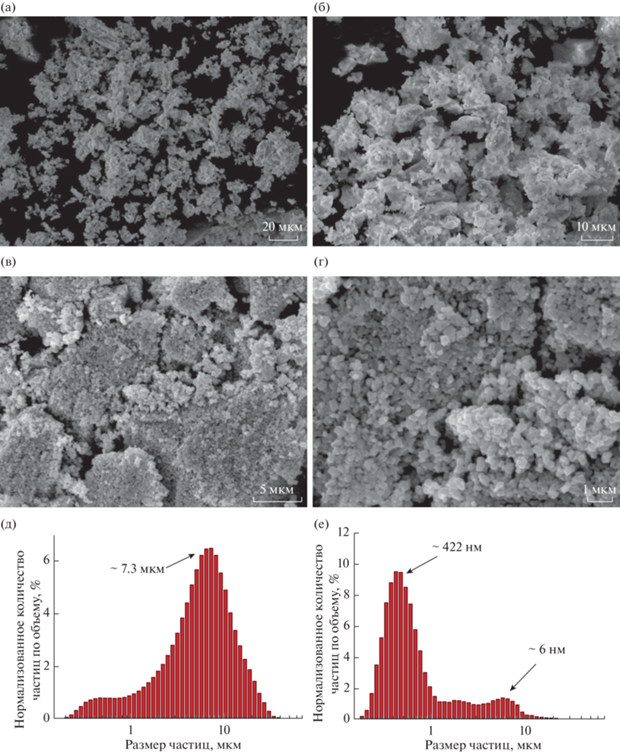
Из данных РЭМ видно, что WO3 представляет собой мелкодисперсный порошок (рис. 2в, 2г), средний размер частиц которого по объему немного меньше, чем для соединения 3, и составляет 674 нм. Из распределения частиц по размерам (рис. 2е) видно, что помимо максимума, соответствующего 422 нм, присутствует небольшой максимум около 6 мкм. Это, вероятно, связано с тем, что микрочастицы образуют достаточно устойчивые агломераты, которые сложно разбить используемым методом.
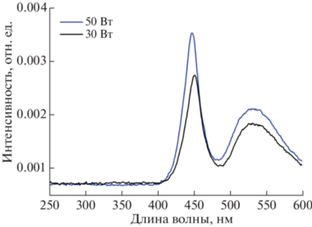
Источники света – светодиодные прожекторы LED 30W и 50W – характеризуются спектрами, представленными на рис. 3. Они имеют одинаковый волновой спектр и различаются только по интенсивности. Поверхностная плотность потока излучения светодиодных прожекторов, воздействующая на исследуемые культуры бактерий, составляла 325.5 Вт/м2 (для источника 30 Вт) и 524 Вт/м2 (для источника 50 Вт). В спектре обеих ламп представлены энергии, отвечающие межзонным поглощениям соединений, исследуемых в данной работе, поэтому наблюдаемые биоцидные эффекты однозначно связаны с их фотокаталитической активностью.
МИКРОБИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
На рис. 4 и 5 представлены результаты исследований антибактериальной активности мелкодисперсных частиц WO3 и RbTe1.5W0.5O6 при использовании источников освещения мощностью 30 и 50 Вт.
Рис. 4.
Антимикробная активность соединения 1 в условиях действия темноты и света (50 и 30 Вт): а – E. coli, б – S. aureus.
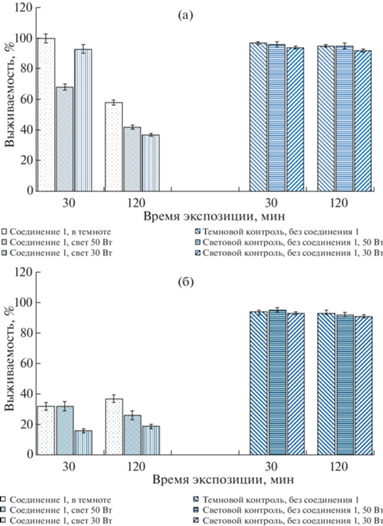
Рис. 5.
Антимикробная активность соединения 2 в условиях темноты и света (50 и 30 Вт): а – E. coli, б – S. aureus.

В аналогичных микробиологических исследованиях ресуспендировались бактериальные тест-культуры или в дистиллированной воде, или в физиологическом растворе. В [2] указано, что более стабильные результаты получаются при ресуспендировании в воде. Это отмечено и в проведенных исследованиях, представлены экспериментальные данные при ресуспендировании культур E. coli и S. aureus в воде (рис. 4, 5). Отмечено, что действие света и темноты на бактерии в отсутствие исследуемых соединений как при экспозиции 30 мин, так и 120 мин практически не влияло на выживаемость бактерий. Изменение их выживаемости в этих случаях колебалось в пределах 93–100%. Результаты выживаемости бактериальных культур под действием света и темноты (без исследуемых соединений) представлены только на рис. 4.
Как отмечалось выше, мелкодисперсные частицы оксидов металлов способны подавлять жизнедеятельность микроорганизмов (грибов и бактерий) [2–5]. Однако об антимикробном эффекте оксида вольфрама данные практически отсутствуют. Установлено, что частицы оксида вольфрама в исследуемых концентрациях обладают способностью подавлять жизнедеятельность E. coli и S. aureus. Причем антимикробный эффект по отношению к S. aureus был более ярко выражен, так как он проявлялся уже через 30 мин экспозиции и являлся более значимым, тогда как в случае с E. coli снижение выживаемости наблюдалось лишь через 120 мин экспозиции.
Действие света 30 и 50 Вт усиливало активность оксида вольфрама по отношению к обеим культурам бактерий. Для E. coli выживаемость снижалась при экспозиции 30 и 120 мин, а для S. aureus – 120 мин. Отмечено, что использование источника света мощностью 30 Вт в большей степени снижало выживаемость тест-культур бактерий (по сравнению с 50 Вт), что позволяет говорить о большей антимикробной активности в данном варианте эксперимента.
При исследовании соединения 2 обнаружен более сильный антимикробный эффект по отношению к E. coli и S. aureus по сравнению с WO3, который проявлялся во всех вариантах экспозиции (рис. 5). Так же как в соединении 1, более сильное подавление выживаемости культур имеет место для S. aureus. Действие света усиливало ингибирующий эффект данного соединения, особенно при экспозиции 120 мин (выживаемость составляла 1–5%), в этом случае можно говорить о наличии бактерицидной активности данного соединения (рис. 5), тогда как в других случаях выживаемость исследуемых культур бактерий в присутствии WO3 и RbTe1.5W0.5O6 можно рассматривать как бактериостатическое действие. Так же как в экспериментах с WO3, отмечалось более сильное влияние источника света мощностью 30 Вт по сравнению с источником мощностью 50 Вт.
Согласно [2–4] существенное значение для проявления антимикробной активности оксидов металлов (как в темноте, так и при действии света) имеет размер частиц. В связи с этим в следующей серии экспериментов сравнивали антимикробную активность соединений 2 и 3 со средним размером частиц 4658 и 736 нм соответственно. Результаты исследований представлены на рис. 6.
Рис. 6.
Антимикробная активность соединения 3 в условиях темноты и света (50 и 30 Вт): а – E. coli, б – S. aureus.
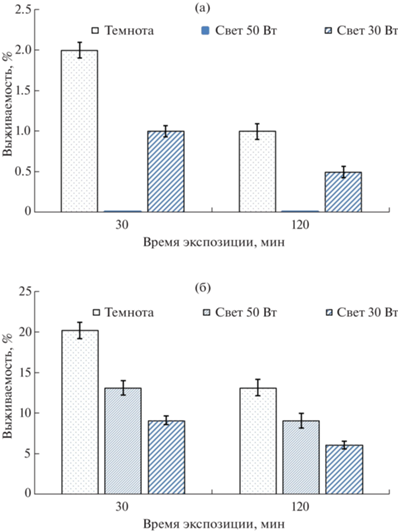
Установлено, что соединение 3 проявляет более сильное антимикробное действие на исследуемые тест-культуры бактерий как в условиях темноты, так и при действии света по сравнению с другими соединениями. Причем действие света существенно усиливало этот эффект для соединения 3 по сравнению с соединением 2. Также наблюдалось, что с увеличением времени экспозиции усиливался антимикробный эффект соединений 2 и 3 в условиях темноты и света. Установлено, что соединение 3 оказывает более сильное снижение выживаемости E. coli по сравнению с S aureus. Выживаемость E. coli составляла 1.0–2.0% в темноте и 0.1–1.0% на свету. Это говорит о том, что данный оксид металла проявляет бактерицидную активность, усиливающуюся в условиях воздействия света, тогда как бактерицидность соединения 2 с большим размером частиц для S. aureus проявляется только при экспозиции 120 мин, а на E. coli соединение 2 бактерицидного действия не оказывает. При сравнении действия на выживаемость бактерий источников света различной мощности (30 и 50 Вт) в присутствии соединения 3 имели противоположный эффект по сравнению с действием света на бактерии в присутствии соединения 2 микронного размера. В данном случае соединение 3 с меньшим размером частиц при использовании источника освещенности 30 Вт вызывало более сильное снижение выживаемости S. aureus, тогда как при действии этого же источника (30 Вт) в присутствии соединения 2 имело место большее снижение выживаемости для E. coli.
Известно, что биоцидное действие мелкодисперсных оксидов металлов (в основном наночастиц оксидов цинка, титана и др.) связано с тем, что эти вещества разрушают мембраны, легко проникают в микробную клетку и связываются с SH-группами в активных центрах ряда ферментов, вызывая инактивацию последних. В результате чего нарушается проницаемость мембран и процесс дыхания живых организмов [2].
Один из основных механизмов усиления биоцидной активности оксидов металлов под действием света связывают с образованием активных форм кислорода (АФК): пероксида водорода (Н2О2), гидроксильного радикала (·ОН) и супероксидного анион-радикала (·О$_{2}^{ - }$), оказывающих токсическое действие на жизнедеятельность микроорганизмов (окисление белков, липидов и нуклеиновых кислот) [20, 21].
При облучении соединения длиной волны, соответствующей ширине запрещенной зоны, происходит переход его электронов из валентной зоны в зону проводимости. В результате в зоне проводимости оказываются электроны (e–), а в валентной зоне – дырки (h+), которые могут вступать в реакции окисления органических соединений напрямую или приводить к образованию активных радикалов [22].
Как отмечалось ранее, в исследованиях по фотокаталитической активности оксидов металлов большое внимание уделяется выбору источника освещения не только по характеристикам волнового спектра, но и по его мощности [2].
Неоднозначность действия источников света разной мощности на выживаемость микроорганизмов может быть связана с их физиолого-биохимическими особенностями, а именно, с активностью функционирования у них механизмов устойчивости к действию АФК. При действии света на различные оксиды металлов последние в неодинаковой степени как в количественном, так и в качественном плане могут образовывать различные формы АФК. В ряде случаев источник света мощностью 30 Вт может приводить к образованию АФК, достаточных для подавления жизнедеятельности организмов в результате недостаточного функционирования у них адаптивных механизмов к действию этих факторов. Другие организмы, обладающие высокими адаптационными возможностями, способны противостоять более сильному воздействию на них АФК в условиях использования мощных источников света, в частности 50 Вт [23]. Возможно, данное явление могло иметь место и в проведенных экспериментах.
ЗАКЛЮЧЕНИЕ
Соединения 1, 2 и 3 способны проявлять антимикробную активность по отношению к бактериям E. coli и S. aureus, что выражается в снижении выживаемости данных тест-культур как в условиях темноты, так и при воздействии света.
Отмечено, что максимальное снижение выживаемости бактерий происходит при действии соединения 3, т.е. RbTe1.5W0.5O6 со средним размером частиц 736 нм. В этом случае имеет место проявление бактерицидного эффекта (снижение выживаемости ≥95%). С увеличением времени экспозиции происходит усиление антимикробной активности во всех вариантах экспериментов. Действие света приводит к усилению антимикробной активности всех исследуемых соединений. Это может быть связано с тем, что данные вещества обладают фотокаталитической активностью, в результате чего образуются АФК, имеющие токсическое действие на живые организмы, что и усиливает антимикробный эффект исследуемых соединений [20, 21].
Отмечено неоднозначное действие разных источников света (30 и 50 Вт) на антимикробную активность исследуемых соединений. В одном случае большее снижение выживаемости тест-культур наблюдалось при использовании источника света мощностью 30 Вт, в другом – мощностью 50 Вт.
Сравнение антимикробной активности RbTe1.5W0.5O6 (2, 3) выявило, что размер частиц оказывает существенное влияние на выживаемость тест-культур бактерий как в условиях темноты, так и в условиях действия света. Отмечено, что бактерицидное влияние на микроорганизмы становится более заметным для соединения 3 с размером частиц 736 нм по сравнению с соединением 2 со средним размером частиц 4658 нм.
Проведенные исследования вносят существенный вклад в изучение биологической активности мелкодисперсных частиц оксидов металлов с учетом использования их фотокаталитической активности. Полученные результаты предопределяют проведение новых исследований, связанных с изучением образования АФК в зависимости от размера наночастиц соединений, мощности источников освещения и характеристик их волнового спектра. Весьма перспективным будет проведение указанных выше исследований на других группах живых организмов.
Полученные результаты имеют и практическое значение, так как данные соединения могут быть использованы в качестве биоцидов в медицине, ветеринарии, сельском хозяйстве, а также для защиты промышленных материалов от биоповреждений. Наличие фотокаталитической активности усилит антимикробный эффект исследуемых соединений в условиях действия света, что позволит существенно пролонгировать их биозащитную активность. Возможность использования фотокатализаторов на основе оксидов металлов для получения водорода поможет решить и такую задачу, как обеззараживание технологических сред и оборудования этого процесса от негативного воздействия микроорганизмов.
Работа выполнена при финансовой поддержке Минобрнауки РФ (базовая часть Госзадания, проект 0729-2020-0053) с использованием оборудования ЦКП “Новые материалы и ресурсосберегающие технологии” (ННГУ им. Н.И. Лобачевского).
Список литературы
Ильичев В.Д., Бочаров Б.В., Горленко М.В. Экологические основы защиты от биоповреждений. М.: Наука, 1985. 261 с.
Захарова О.В., Гусева А.А. // Российские нанотехнологии. 2019. Т. 14. № 9–10. С. 3. https://doi.org/10.21517/1992-7223-2019-9-10-3-17
Zakharova O., Kolesnikov E., Vishnyakova E. et al. // IOP. Ser.: Earth Environ. Sci. 2019. V. 226. P. 012062. https://doi.org/10.1088/1755-1315/226/1/012062
Yamamoto O. // Int. J. Inorg. Mater. 2001. V. 3. P. 643. https://doi.org/10.1016/S1466-6049(01)00197-0
Adams L.K., Lyon D.Y., Alvarez P.J. // Water Res. 2006. V. 40. № 19. P. 27. https://doi.org/10.1016/j.watres.2006.08.004
Galdámez-Martínez A., Yang Bai, Santana G. et al. // Int. J. Hydrogen Energy. 2020. V. 45. № 56. P. 31942. https://doi.org/10.1016/j.ijhydene
Zhang B., Li Q., Wang D. et al. // Nanomaterials. 2020. V. 10. № 11. P. 2096. https://doi.org/10.3390/nano10112096
Chiarello G.L., Dozzi M.V., Selli E. // J. Energy Chem. 2017. V. 26. № 2. P. 250. https://doi.org/10.1016/j.jechem.2017.02.005
Kudo A., Miseki Y. // Chem. Soc. Rev. 2009. V. 38. P. 253. https://doi.org/10.1039/B800489G
Liu J., Wang Y., Ma J. et al. // J. Alloys Compd. 2019. V. 783. P. 898. https://doi.org/10.1016/j.jallcom.2018.12.330
Pan H., Xie H., Chen G. et al. // Int. J. Biol. Macromol. 2020. V. 148. P. 608.
Prakash J., Sun Sh., Swart H. et al. // Appl. Mater. Today. 2018. V. 11. P. 82. https://doi.org/10.1016/j.apmt.2018.02.002
Zhao M., Fu C., Wang K. et al. // J. Alloys Compd. 2021 V. 852. P. 156698. https://doi.org/10.1016/j.jallcom.2020.156698
Kang X., Liu S., Dai Z. et al. // Catalysts. 2019. V. 9. P. 191. https://doi.org/10.3390/catal9020191
Ohno T., Sarukawa K., Tokieda K., Matsumura M. // J. Catalysis. V. 203. № 1. 2001. P. 82. https://doi.org/10.1006/jcat.2001.3316
Marzouqi F., Al-Balushia N., Kuvarega A. et al. // Mater. Sci. Eng. B. 2020. V. 264. P. 114991. https://doi.org/10.1016/j.mseb.2020.114991
Greiner M.T., Helander M.G., Tang W.M. et al. // Nature Mater. 2012. V. 11. P. 76. https://doi.org/10.1038/nmat3159
Fukina D.G., Koryagin A.V., Koroleva A.V. et al. // J. Solid State Chem. 2021. V. 300. P. 122235. https://doi.org/10.1016/j.jssc.2021.122235
Fukina D.G., Suleimanov E.V., Fukin G.K. et al. // J. Solid State Chem. 2020. V. 286. P. 121276. https://doi.org/10.1016/j.jssc.2020.121267
Fukina D.G., Suleimanov E.V., Boryakov A.V. et al. // J. Solid State Chem. 2020. V. 293. P. 121787. https://doi.org/10.1016/j.jssc.2020.121787
Salje E. // Acta Cryst. B. 1977. V. 33. P. 574. https://doi.org/10.1016/j.jssc.2020.121787Get20
Kudo A., Miseki Y. // Chem. Soc. Rev. 2009. V. 38. P. 253. https://doi.org/10.1039/b800489g
Дубинина Е.Е. Продукты метаболизма кислорода в функциональной активности клеток: (жизнь и смерть, созидание и разрушение): физиологические и клинико-биохимические аспекты. С.-Пб.: Медпресса, 2006. 397 с.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии