Российские нанотехнологии, 2022, T. 17, № 3, стр. 424-432
Действие наноэмульсий, содержащих астаксантин или его эфиры, на пространственное поведение мышей 5XFAD
Н. Ю. Лотош 1, *, А. В. Крючкова 2, Е. А. Куликов 1, И. С. Куликова 1, А. А. Селищева 1, 2, Д. П. Огурцов 1, С. А. Крынский 1, И. К. Малашенкова 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: natalotosh@gmail.com
Поступила в редакцию 04.07.2021
После доработки 21.07.2021
Принята к публикации 06.09.2021
Аннотация
Изучено действие наноэмульсий (НЭ) из фосфолипидов, содержащих астаксантин (АСТ) или его эфиры, на пространственное поведение трансгенных мышей с болезнью Альцгеймера 5XFAD в возрасте 4–6 мес в приподнятом крестообразном лабиринте и тесте “открытое поле”. Наноэмульсии, полученные методом инжекции, имели диаметр 70–100 нм и индекс полидисперсности <0.3. Животные получали препараты с кормом 5 раз в неделю в течение двух месяцев. Доза АСТ и эфиров составляла 2 мг/кг веса. Раз в неделю животные получали двойную дозу препаратов. Контрольные животные получали НЭ, не содержащие каротиноидов. Поведенческие тесты показали, что мыши, получавшие АСТ, проводят достоверно меньше времени в открытых рукавах приподнятого крестообразного лабиринта по сравнению с мышами из контрольной группы. В случае с эфирами достоверной значимости не выявлено. В тесте “открытое поле” эфиры АСТ оказывали положительное влияние на животных, замедляя нарушения тигмотаксиса у мышей 5XFAD. При этом введение каких-либо НЭ не оказывало влияния на снижение двигательной активности. Следовательно, у мышей с болезнью Альцгеймера, получавших как АСТ, так и эфиры, параметры поведения в приподнятом крестообразном лабиринте и тесте “открытое поле” имели тенденцию к улучшению.
ВВЕДЕНИЕ
В настоящее время основной теорией развития болезни Альцгеймера (БА), которая характеризуется прогрессирующей гибелью нейронов, снижением когнитивных способностей и развитием деменции, является образование амилоидных бляшек и гиперфосфорилирование τ-белка. Однако причины развития таких нарушений остаются неясными до сих пор. Рассматриваются различные гипотезы возникновения и развития БА, в том числе дисфункция митохондрий в нейронах, при которой происходит избыточное образование активных форм кислорода, что обусловливает развитие окислительного стресса [1]. Большое значение в развитии БА играет воспаление – прежде всего как вторичный фактор, возникающий в ответ на патофизиологические процессы в нервной ткани, но которое также рассматривается в качестве этиологического фактора, предшествующего отложению амилоида [2–4]. Большое количество недавних исследований посвящено изучению действия антиоксидантных и противовоспалительных препаратов для превентивной терапии БА. Было установлено, что у трансгенных мышей 5XFAD с семейной БА, получавших тетракурмин, обладающий антиоксидантным действием, наблюдалось значительное улучшение показателей теста на распознавание объектов и пространственной памяти. Также отмечено улучшение показателей окислительного стресса в тканях мозга: активности супероксиддисмутазы и уровней малонового диальдегида и глутатиона [5]. Еще одним известным природным антиоксидантом является каротиноид астаксантин (АСТ), присутствующий в микроводорослях, дрожжах, а также в ракообразных, криле и лососевых видах рыб. АСТ является основным каротиноидом в Haematococcus и существует главным образом в виде моноэфиров (70%) и диэфиров (15–20%). В свободной форме находится 4–5% АСТ [6]. Структурная формула АСТ приведена на рис. 1. В многочисленных исследованиях АСТ успешно применяли в случаях экспериментального диабета [7], при окислительном стрессе, вызванном возрастными изменениями [8], на крысах с хирургической моделью БА [9]. В последнее время установлено нейропротекторное действие этого каротиноида при его применении на моделях БА как хирургических [9], так и трансгенных [10, 11]. Распространенной мышиной моделью БА является линия трансгенных мышей 5XFAD (семейная БА), у которых пять мутаций находятся в гене АРР – предшественнике амилоидного пептида, и в гене PS1, кодирующем белок пресенилин 1.
Рис. 1.
Структурные формулы свободной формы АСТ (R1 = H, R2 = H), его моно- (R1 – остаток жирной кислоты, R2 = H) и диэфиров (R1 и R2 – остатки жирной кислоты).
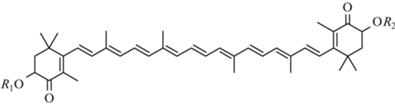
Поскольку каротиноид – гидрофобное соединение, оно не растворимо в воде, поэтому применение в качестве пищевой добавки животным возможно в виде жирорастворимой формы. В [12] была разработана наноэмульсионная форма эфиров АСТ на основе фосфолипидов. Цель настоящего исследования – изучение действия наноформ АСТ и его эфиров на поведение трансгенных мышей 5ХFAD с помощью поведенческих тестов.
МАТЕРИАЛЫ И МЕТОДЫ
Реактивы. Астаксантин из Blakeslea trispora, эфиры АСТ (смесь моно- и диэфиров) из Haematococcus pluvialis (Sigma-Aldrich, Германия); фосфатидилхолин Lipoid S75 (в составе 75.3% фосфатидилхолина и 8% фосфатидилэтаноламина) (Lipoid GMBH, Германия); изопропанол (Химмед, Россия).
Наноэмульсии (НЭ) готовили методом инжекции раствора фосфатидилхолина в изопропаноле в воду [12, 13]. Получены НЭ следующего состава: S75:АСТ (2:0.2 мг/мл), S75:эфиры (2:0.2 мг/мл) и S75 (2 мг/мл). Гидродинамический диаметр (d, нм) частиц определяли на приборе Zetasizer Nano (Malvern, Великобритания).
Животные. Все манипуляции с животными проводили в соответствии с приказом Минздрава РФ № 267 от 19.06.2003 и согласно протоколу, утвержденному комиссией по биоэтике НИЦ “Курчатовский институт” № НГ-1/01.13пр от 11.03.2021. Самцы трансгенных мышей 5XFAD (B6SJL) поступили в возрасте 4 мес (далее “5XFAD фон”) (46 особей) и в возрасте одного года (далее “5XFAD 12 мес”) (18 особей). Самцы C57Bl/6 поступили в возрасте 4 мес (далее C57Bl) (14 особей). До транспортировки в НИЦ “Курчатовский институт” все животные содержались в одинаковых условиях.
Животные получены из Центра доклинических испытаний Института физиологически активных веществ РАН, г. Черноголовка. Перед началом тестирования животные прошли двухнедельный карантин. Животные содержались в индивидуально вентилируемых клетках со свободным доступом к воде и пище при 12-часовом цикле день/ночь.
Поведенческие тесты. Использовали тесты приподнятый крестообразный лабиринт (ПКЛ) и “открытое поле” (ОП) с использованием системы оценки пространственного поведения животных Noldus. За час до начала эксперимента мышей помещали в комнату, где располагался тест. Для устранения запаха предыдущего животного все поверхности протирали 70%-ным раствором спирта. Тест ОП представлял собой круглую арену диаметром 120 см с высокими бортиками. Арена виртуально была разделена на три зоны: центральная, медиальная и периферическая. Животных помещали в центр арены. Трек записывали в течение 5 мин. Учитывали следующие параметры: общее пройденное расстояние и среднюю скорость, время, проведенное в центральной, медиальной и периферической зонах, количество заходов в эти зоны, а также латентный период выхода из центральной зоны для оценки свободного поведения, двигательной и исследовательской активности.
ПКЛ представлял собой скрещенные посередине перпендикулярно друг другу открытые и закрытые прозрачными стенками рукава высотой 30 см, длиной 62 см каждый. Лабиринт был приподнят над землей на высоту 80 см. Мышей помещали в центр, они свободно перемещались между рукавами. Трек записывали в течение 5 мин. Учитывали время, проведенное в открытых рукавах, количество заходов в открытые рукава и латентный период выхода из центра в открытые рукава для оценки тревожности, вызванной открытым пространством и высотой.
Анализ результатов поведенческих тестов проводили с помощью программного обеспечения Noldus Ethovision.
Протокол исследования. После двухнедельного карантина до получения НЭ изучали поведение мышей в группах “5XFAD фон”, “5XFAD 12 мес” и C57Bl в тестах ПКЛ и ОП. Данные группы “5XFAD фон” использовали как контроль в динамике: далее эту группу разделили на три группы, которые получали следующие НЭ: S75:АСТ (группа “АСТ”, 15 особей), S75:эфиры (группа “эфиры”, 16 особей) и S75 (группа “S75”, 14 особей). НЭ давали в течение двух месяцев перорально вместе с кормом 5 раз в неделю (4 раза однократно, а 1 раз животные получали двойную дозу: 300 мкл НЭ наносили на кусочек корма так, чтобы доза АСТ или его эфиров составляла 2 мг/кг веса (доза липидов при этом была 20 мг/кг). Группу “5XFAD 12 мес” использовали в качестве контроля глубокого развития БА, группу С57Bl – в качестве здорового контроля. По прошествии двух месяцев поведенческие тесты повторили для каждой группы. Данные о весе животных представлены в табл. 1.
Таблица 1.
Вес животных. Представлены средние значения ± SEM
| Группа | Количество особей | Вес, г | |
|---|---|---|---|
| 4.5 мес | 6.5 мес | ||
| С57Bl | 14 | 27.6 ± 1.14 | 32.54 ± 1.81 |
| 5XFAD 12 мес | 18 | 35.9 ± 1.25* | 36.7 ± 1.70** |
| 5XFAD фон | 46 | 31.7 ± 0.48 | |
| Получение НЭ в течение двух месяцев | |||
| 5XFAD “АСТ” | 15 | 45.0 ± 1.79 | |
| 5XFAD “эфиры” | 16 | 44.9 ± 1.91 | |
| 5XFAD “S75” (контроль) | 15 | 47.7 ± 2.54 | |
Статистическую обработку данных выполняли с помощью пакета программ Stat Soft Statistica 10.0. Межгрупповые различия считали по следующим непараметрическим критериям: для независимых групп применяли U-критерий Манна–Уитни, для зависимых (при оценке действия препаратов по сравнению с фоном) – критерий Вилкоксона. Достоверными различия считали при p < 0.05. Все значения представлены как среднее ± стандартная ошибка среднего (SEM).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В качестве модели для БА использовали самцов трансгенных мышей 5XFAD в возрасте 4.5 мес и 1 года. В качестве контроля выступали мыши C57Black (4.5 мес). До начала эксперимента всем мышам проводили поведенческие тесты ОП и ПКЛ. Тест ОП измеряет двигательную и исследовательскую активность мышей, а также может служить для предварительной оценки тревожности [14]. Тест ПКЛ используется для оценки тревожности и основан на естественном страхе мышей перед открытыми участками и высотой, а также на их естественном исследовательском поведении в новой среде [15]. В нормальном состоянии мышам свойственен тигмотаксис: они стремятся оказаться в периферийной (пристеночной) зоне ОП и меньше времени проводят на открытых участках ПКЛ [14].
Результаты теста ОП
В табл. 2 приведены результаты теста ОП. В левой половине таблицы указаны результаты для контрольной группы и группы “5XFAD фон”, т.е. до того, как мыши начали получать НЭ. В правой половине – результаты молодых 5XFAD после получения НЭ в течение двух месяцев.
Таблица 2.
Результаты теста ОП для всех групп мышей. Представлены средние значения ± SEM
| C57Bl | 5XFAD мес | 5XFAD фон | 5XFAD “АСТ” | 5XFAD “эфиры” | 5XFAD “S75” (контроль) | |
|---|---|---|---|---|---|---|
| Получение НЭ | нет | В течение двух месяцев | ||||
| Возраст, мес | 4.5 | 12 | 4.5 | 6.5 | 6.5 | 6.5 |
| Количество особей | 14 | 18 | 46 | 15 | 16 | 15 |
| Общая дистанция, м | 52.07 ± 2.13 | 36.86 ± 2.52* | 40.91 ± 1.41* | 35.26 ± 2.91 | 39.06 ± 2.71 | 35.66 ± 3.95 |
| Средняя скорость, м/с | 0.21 ± 0.01 | 0.14 ± 0.01* | 0.16 ± 0.00*# | 0.13 ± 0.01** | 0.14 ± 0.01** | 0.14 ± 0.99** |
| Время в центральной зоне, с | 21.7 ± 2.89 | 36.6 ± 9.30 | 34.6 ± 2.5* | 35.1 ± 4.44^ | 35.9 ± 4.43^ | 25.8 ± 5.44 |
| Количество заходов в центральную зону | 11.8 ± 1.35 | 7.4 ± 0.71* | 11.8 ± 0.84# | 8.5 ± 1.00 | 10.4 ± 0.79^ | 8.0 ± 1.24 |
| ЛП выхода из центральной зоны, с | 4.57 ± 0.73 | 9.4 ± 1.08* | 6.02 ± 0.74# | 8.0 ± 2.77 | 5.4 ± 1.58** | 4.3 ± 0.46** |
| Время в медиальной зоне, с | 57.9 ± 4.60 | 52.1 ± 4.65 | 74.7 ± 3.22*# | 70.9 ± 5.82 | 85.7 ± 6.48 | 76.2 ± 8.49 |
| Количество заходов в медиальную зону | 42.9 ± 3.29 | 23.9 ± 2.09* | 38.0 ± 1.66# | 29.4 ± 2.86 | 35.2 ± 1.90 | 29.6 ± 3.26 |
| Время в периферической зоне, с | 218.8 ± 6.72 | 211.0 ± 9.34 | 189.9 ± 4.57*# | 194.1 ± 7.60 | 178.1 ± 8.76 | 197.9 ± 12.80 |
| Количество заходов в периферическую зону | 36.4 ± 2.70 | 18.3 ± 1.37* | 29.6 ± 1.22*# | 21.8 ± 2.13** | 26.3 ± 1.40 | 23.0 ± 0.97 |
* Достоверные отличия от группы C57Bl (p < 0.05 по U-критерию Манна–Уитни для независимых групп). # Достоверные различия групп “5XFAD фон” и “5XFAD 12 мес” (p < 0.05 по U-критерию Манна–Уитни для независимых групп). ^ Достоверные различия групп “АСТ” и “эфиры” с “S75” (p < 0.05 по U-критерию Манна–Уитни для независимых групп). ** Достоверные различия групп “АСТ”, “эфиры” и “S75” с “5XFAD фон” (p < 0.05 по критерию Вилкоксона для зависимых групп).
Результаты теста ОП до получения НЭ. Чтобы оценить влияние развития БА на двигательную активность мышей, сравнивали показатели данной активности: общая пройденная дистанция и средняя скорость. Наибольшие дистанцию и скорость показали мыши C57Bl, а наименьшие значения были у группы “5XFAD 12 мес” (старые мыши с БА). Данные молодых мышей с БА (“5XFAD фон”) статистически не отличалась от данных “5XFAD 12 мес” по дистанции, но средняя скорость у них была выше (p = 0.016) (табл. 2). В норме животные с возрастом снижают двигательную активность, ее снижение у мышей 5XFAD по сравнению с равновозрастными C57Bl показательно для патологических процессов БА [16].
Из табл. 2 также следует, что мыши с БА обеих групп проводили больше времени в центральной зоне, чем контрольные животные (p = 0.013 для молодых мышей с БА). При этом мыши группы “5XFAD 12 мес” – статистически незначимо – показывали только тенденцию к увеличению (p = = 0.11), но только они заходили в центральную зону достоверно реже, чем C57Bl (p = 0.008). В медиальной зоне достоверно большее количество времени проводили только молодые мыши с БА (p = 0.007), при этом старые животные с БА заходили туда достоверно реже обеих групп (p ≤ ≤ 0.00007). Показаны и достоверные различия между тремя группами без введения НЭ по числу заходов мышей в периферическую зону (максимальное – у здоровых животных, минимальное – у старых животных с БА; p = 0.033 и p = 0.00001 по сравнению C57Bl с “5XFAD фон” и “5XFAD 12 мес” соответственно). Время, проведенное в периферической зоне, достоверно снижалось у группы “5XFAD фон” относительно здоровых мышей (p = 0.0027) и старых (p = 0.0061). У группы “5XFAD 12 мес” достоверной разницы с C57Bl не обнаружено. По данным [17] у мышей с БА той же генетической линии наблюдалась схожая разнонаправленная тенденция по этому параметру для мышей возрастом 4 и 12 мес.
Латентный период (ЛП) выхода из центральной зоны (табл. 2) у молодых мышей с БА не отличается статистически от такового у контрольной группы, тогда как у “5XFAD 12 мес” он достоверно выше, чем у здоровых животных (p = 0.0031) и у молодых мышей с БА (p = 0.017): мыши с поздней стадией развития БА выходят из центральной зоны существенно позже животных других групп.
Таким образом, здоровые животные выходят из центральной зоны быстрее всех других групп, они проводят в центральной и медиальной зонах минимальное время и реже других групп повторно заходят в них в течение эксперимента, проводят максимальное время в периферийной зоне и чаще всего заходят в нее. Открытое пространство является некомфортным для здоровых грызунов, они стремятся держаться ближе к стенкам (явление тигмотаксиса).
Молодые мыши с БА выходят из центральной зоны за время, сравнимое с таковым у контрольной группы, заходят в центральную и медиальную зоны с той же частотой, что и контрольные, но проводят в них достоверно больше времени. Они реже здоровых животных заходят в периферическую зону и проводят там меньше времени. Можно сделать вывод, что на ранней стадии развития болезни у мышей двигательная активность снижается не намного, но уже нарушается тигмотаксис (стремление к безопасности).
Старые мыши с БА выходят из центра достоверно значительно позже, чем мыши остальных групп (ЛП почти в 2 раза больше, чем у здоровых животных), заходят во все зоны достоверно реже контрольных и молодых животных с БА. Во всех зонах они проводят сравнимое с контролем время и показывают тенденцию к увеличению времени, проведенного в центральной зоне. Их двигательная активность настолько сильно снижена, что отчасти маскирует нарушения тигмотаксиса.
Следовательно, при развитии БА (как таковом и в сочетании с возрастными изменениями) у мышей последовательно снижается двигательная активность. На ранних стадиях развития БА мыши показывают нарушение естественной тревожности, а двигательной активности – лишь в малой степени, на поздних – нарушения двигательной активности значительно выражены и превалируют над нарушениями тревожности.
Результаты теста ОП после получения НЭ. Далее молодые животные 5XFAD были разделены на три группы, которые получали НЭ, содержащие АСТ (15 особей), эфиры (16 особей) и не содержащие каротиноидов – S75 (контроль, 15 особей). Спустя 2 мес после приема НЭ повторно исследовали поведение мышей в тесте ОП, чтобы оценить влияние АСТ и его эфиров на развитие БА.
Рассмотрим поведение мышей 5XFAD в тесте ОП после двухмесячного получения НЭ. Из табл. 2 (правая половина) видно, что средняя скорость получавших НЭ мышей из всех трех групп значимо снижается относительно фона, приближаясь к параметрам “5XFAD 12 мес”, а общая пройденная дистанция хоть аналогично снижается, но достоверно от фона не отличается. Так как динамика у всех трех групп одинакова и наблюдаемая картина укладывается в нормальное снижение двигательной активности с возрастом и угасание ориентировочной реакции при повторном предъявлении ОП животным, полученные данные не позволяют утверждать, что НЭ как-либо влияют на двигательную активность мышей с БА. Согласно [18] наиболее яркое проявление памяти животного на обстановку происходит в течение первой недели, но памятный след у грызунов сохраняется не менее чем на 8 нед [18]. Что касается стремления к безопасности, группы, получающие НЭ, различаются между собой.
Исходя из табл. 2, несмотря на общую тенденцию увеличения времени, проведенного в центральной зоне, и увеличение ЛП с развитием БА, группа “S75”, получавшая пустые НЭ, показывает парадоксальное уменьшение времени, проведенного в центральной зоне, относительно фона (тенденция p = 0.096) и относительно групп, получавших АСТ и эфиры (достоверное отличие p = = 0.033 и p = 0.031 соответственно). ЛП выхода из центральной зоны у нее также наименьшее, но достоверно от фона не отличающееся.
Так как сравнение с контролем из-за упомянутого выше эффекта затруднено, рассмотрим различие групп “АСТ” и “эфиры” между собой. Группа, получающая АСТ, отличается от группы, получающей эфиры, по числу заходов в центральную и периферическую зоны, по ЛП выхода из центральной зоны.
Число заходов в центральную зону с развитием БА снижается, но у группы, получающей эфиры, этого снижения не происходит (она остается на уровне фона, показывая достоверные различия со сниженным параметром у группы “S75”, p = 0.038), тогда как группа, получающая АСТ, показывает тенденцию к этому снижению (нет различий с “S75”).
Число заходов в периферическую зону с развитием БА также снижается. У группы “эфиры” этого снижения также не происходит в отличие от группы “АСТ” (достоверное отличие от фона, p = 0.041).
ЛП с развитием БА увеличивается, но группа “эфиры” показывает его достоверное снижение относительно фона (p = 0.026), а “АСТ” – тенденцию к его увеличению (p = 0.12), его средняя длительность приближена к таковой у группы “5XFAD 12 мес”.
Таким образом, введение эфиров, но не АСТ, оказывает благотворное влияние на животных, замедляя нарушения тигмотаксиса при БА. При этом введение каких-либо НЭ не оказывало влияния на снижение двигательной активности.
РЕЗУЛЬТАТЫ ТЕСТА ПКЛ
Результаты ПКЛ до получения НЭ. Оценивали ЛП захода в открытые рукава, число заходов и время, проведенное в них (рис. 2).
Рис. 2.
Результаты теста ПКЛ. Возраст животных на момент проведения теста: “5XFAD фон” – 4.5 мес, “5XFAD 12 мес” – 12 мес, С57Bl – 4.5 мес. Представлены средние значения ± SEM; а – время, проведенное в открытых рукавах; б – число заходов в открытые рукава; в – латентный период выхода в открытые рукава. * – достоверные отличия от группы C57Bl (p < < 0.05 по U-критерию Манна–Уитни для независимых групп).

Время в открытых рукавах зависит от возраста мышей с БА (т.е. в том числе от выраженности болезни): группа “5XFAD 12 мес” находится в открытых рукавах дольше всего, хотя заходит туда не чаще и не быстрее, чем остальные группы. Можно сделать вывод, что БА у мышей приводит к уменьшению двигательной активности и снижению тигмотаксиса. Эти данные соответствуют данным теста ОП. Статистически незначимая тенденция к увеличению ЛП у группы “5XFAD фон” не является показательной, так как параметр иллюстрирует большой разброс данных (стандартное отклонение – 78.8, тогда как у групп С57Bl и “5XFAD 12 мес” – 41.3 и 24.0 соответственно).
Результаты теста ПКЛ после получения НЭ. Оценивали ЛП захода в открытые рукава, число заходов и время, проведенное в них (рис. 3). Все группы, получавшие НЭ, впервые заходили в открытые рукава достоверно быстрее, чем “5XFAD фон” (p = 0.028, 0.013 и 0.0015 для “АСТ”, “эфиры” и “S75” соответственно). Возможно, это следствие того, что установка предъявляется животным во второй раз и является для них знакомой, так как различий по ЛП у групп, не получавших НЭ, не наблюдалось (рис. 2). Различий по числу заходов туда при этом не наблюдалось у всех рассматриваемых групп. Все группы 6.5-месячных мышей – “АСТ”, “эфиры” и “S75” – проводили в открытом рукаве достоверно больше времени, чем 4.5-месячные “5XFAD фон” (p = = 0.011, 0.00094 и 0.0019 соответственно), но только у группы “АСТ” наблюдалось достоверное снижение количества времени по сравнению с контрольной “S75” (p = 0.026). В случае группы “эфиры” достоверных различий с контрольной группой не выявлено, хотя тенденция к улучшению, т.е. снижению времени есть (p = 0.077).
Рис. 3.
Влияние АСТ и его эфиров на поведение в тесте ПКЛ. Группы “АСТ”, “эфиры” и “S75” в течение двух месяцев получали соответствующие НЭ, возраст мышей 6.5 мес. Представлены средние значения ± ± SEM; а – время, проведенное в открытых рукавах; б – число заходов в открытые рукава; в – латентный период выхода в открытые рукава; ^ – достоверные различия групп “АСТ” и “S75” (p < 0.05 по U-критерию Манна–Уитни для независимых групп); ** – достоверные отличия по критерию Вилкоксона для зависимых групп (p < 0.05): группы “АСТ”, “эфиры” и “S75” по сравнению с их фоном.

Отметим, что параметр времени пребывания в открытом рукаве группы “S75” приближается к таковому у группы “5XFAD 12 мес” (176.5 ± 11.2 с), при том что мыши этой группы почти вдвое старше, что может свидетельствовать о достаточном развитии БА у трансгенных мышей к возрасту 6.5 мес.
Учитывая изложенные выше данные и принимая, что БА у мышей приводит к уменьшению двигательной активности и снижению тигмотаксиса, можно сделать предположение, что АСТ снижает развитие БА у трансгенных мышей, так как приближает параметры к норме.
Обобщая данные обоих тестов, можно сделать вывод, что компенсация развития БА проявляется как при получении животными эфиров, так и АСТ: в тесте ОП лучше себя проявили эфиры, а в ПКЛ – АСТ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
БА развивается, как правило, в пожилом возрасте, для которого характерны снижение активности иммунной и нейрональной систем и развитие так называемого старческого стерильного воспаления, которое сопровождается окислительным стрессом. При развитии БА активируется провоспалительный путь передачи внутриклеточного сигнала через транскрипционный фактор NF-κB и увеличивается секреция провоспалительных цитокинов [19], развивается окислительный стресс, при котором усиливается перекисное окисление липидов, белков и низкомолекулярных антиоксидантов, в первую очередь глутатиона, и снижается активность ферментов противооксидантной защиты. В условиях развивающейся нейродегенерации введение антиоксиданта АСТ оказывает многофакторное воздействие: не только уменьшается содержание продуктов перекисного окисления липидов, но и повышается активность ферментов супероксиддисмутазы и каталазы, а также восстанавливается нормальное соотношение пары окисленный/восстановленный глутатион [9]. Помимо антиоксидантного действия АСТ оказывает противовоспалительный эффект: понижает активацию глии и выброс противовоспалительных цитокинов, что является важным фактором защиты нейронов [20]. Противовоспалительный эффект может быть обусловлен ингибирующим действием АСТ на активность NF-κB и уменьшением экспрессии провоспалительных медиаторов в стимулированных липополисахаридом клетках RAW264.7 и в первичных макрофагах [21]. В [22] было показано, что АСТ активирует образование комплексов транскрипционного фактора Nrf2 и увеличивает высвобождение гемоксигеназы-1. В [11] предложен еще один механизм действия АСТ, согласно которому каротиноид опосредованно влияет на процесс слияния и деления митохондрий, нарушенный в синапсах при БА. АСТ способен преодолевать гематоэнцефалический барьер [23]. Как показали исследования на Сасо-2 клетках, проникновение АСТ через мембрану клетки может происходить с помощью специального белка, выполняющего функции транспортера [24].
При исследовании влияния АСТ на поведение мышей APP/PS1 [11] и крыс с хирургической БА [9, 25] отмечалось улучшение когнитивных способностей, обучения и памяти по результатам водного лабиринта Морриса, теста на распознавания нового объекта и других тестов, а также снижение содержания амилоида в гиппокампе.
В экспериментальных работах на животных обращает на себя внимание тот факт, что, как правило, сведения о природе и чистоте используемого препарата, а также о форме, в которой его получали животные, недостаточны. В некоторых случаях используется коммерческий АСТ, в некоторых – экстракт из микроводорослей или криля, в которых основным компонентом являются моноэфиры АСТ. Однако при сравнении действия свободной формы АСТ и его синтетического диэфира было установлено, что именно эфиры АСТ эффективнее [10].
Целью исследования было продемонстрировать на примере поведенческих тестов ОП и ПКЛ изменения в поведении и тревожности мышей 5XFAD с ранним и поздним развитием БА (молодые и старые мыши) и изучить влияние АСТ и его эфиров, включенных в НЭ из фосфатидилхолина, на поведение молодых мышей 5XFAD. Для этого проводили тесты с мышами 5XFAD в возрасте 4.5 мес (фон), одного года (“5XFAD 12 мес”), а также 4.5 мес (С57Black). Далее молодые мыши c БА в течение двух месяцев получали НЭ, содержащие АСТ или его эфиры (дозировка 2 мг/кг), или НЭ, не содержащие каротиноидов (S75). По истечении этого срока тесты повторяли.
С помощью этих тестов исследуют реакцию мышей на незнакомую среду, попав в которую, животное начинает перемещаться и исследовать пространство. С другой стороны, мыши стремятся избегать ярко освещенных и открытых мест [26]. Литературные данные по двигательной активности в тестах ОП у мышей с генетической моделью БА и относительно здоровых мышей противоречивы. Не было обнаружено различий между мышами генотипа B6C3 и мышами дикого типа (возраст 8–9 мес) [27], а также между мышами генотипа B6SJL и дикого типа (возраст 9–12 мес) [28]. Не было показано и различий по двигательной активности (и по времени нахождения в различных зонах) у мышей 5XFAD (Tg6799) и мышей линии CD-1 (возраст 3–6 мес) [29]. В [30] хотя и не было показано отличий мышей 5XFAD от здоровых (без указания линии) животных, но наблюдалась, во всяком случае, тенденция к уменьшению пройденной в тесте ОП дистанции у мышей с другой генетической моделью БА – TauP301S. В [16] показано снижение двигательной активности у мышей 5XFAD (B6SJL-Tg) в сравнении с мышами дикого типа в возрасте 12–13 мес, но не ранее. Снижение двигательной активности в молодом возрасте (3–6 мес) с прогрессированием к 9 мес было продемонстрировано в [31]. В настоящем исследовании выявлено, что двигательная активность у мышей 5XFAD снижается уже к 4.5 мес. В целом уменьшение двигательной активности в тесте ОП при развитии БА установлено в разных работах, но не является ярким и несомненным признаком.
В [17] при оценке уровня тревожности и исследовательского интереса в тесте ОП наблюдали аналогичную наблюдаемой в настоящей работе картину по времени нахождения в периферической зоне у мышей 5XFAD относительно С57Black. Снижение времени, проведенного в периферической зоне, у молодых мышей с БА относительно здоровых животных не объяснялось, а увеличение этого параметра у старых связывали с повышенной тревожностью. В [17] не рассматривали параметр времени, проведенного в периферической зоне, в совокупности с числом заходов в зоны и другими параметрами. Объяснение, полученное в настоящей работе, представляется более полным: на ранней стадии развития болезни у мышей двигательная активность снижается не намного, но уже нарушается тигмотаксис, а у старых мышей двигательная активность настолько сильно снижена, что отчасти маскирует нарушения тигмотаксиса. Схожие результаты были получены в [27]: мыши 5XFAD показали возрастную зависимость по времени, проведенному в центральной зоне теста ОП, по сравнению с мышами дикого типа. Это явление объясняют снижением тревожности по мере развития БА [27]. Учитывая литературные и полученные в исследовании данные, можно сделать вывод о чувствительности использованной методики к линейным различиям животных.
При анализе поведения мышей в тесте ПКЛ исследователями неоднократно отмечалось, что с возрастом у мышей 5XFAD увеличивается время, проведенное в открытых рукавах, однако трактовка этого явления разнится. Так, в [17] отмечают, что увеличение времени происходило за счет замирания, и объясняют такой результат повышением уровня тревожности при развитии БА. В [27, 30], напротив, возрастную зависимость объясняли снижением уровня тревожности по мере развития заболевания. Эти данные согласуются с полученными результатами по тестам ПКЛ и ОП. В первом тесте лучше себя проявил АСТ, а во втором – его эфиры. Возможно, обе формы действуют по-разному, так как эфиры АСТ имеют в своем составе один (моноэфиры) или два остатка (диэфиры) жирной кислоты в отличие от АСТ, в молекуле которого две незамещенные гидроксильные группы (рис. 1). В связи с этим эфиры АСТ являются более гидрофобными соединениями по сравнению со свободной формой. Можно предположить, что благодаря различию в гидрофобности эфиры легче проникают через мембрану нейрональных клеток.
Многие исследователи показывают положительное влияние АСТ в экспериментах in vivo, обходя при этом вниманием эфиры АСТ. Проведенная работа показала, что последние также эффективны в отношении терапии БА.
Авторы выражают благодарность сотруднику Биологического факультета МГУ им. М.В. Ломоносова А.В. Крючковой за большой вклад в оценку результатов и текст этой статьи, М.Ю. Копаевой (Ресурсный центр нейрокогнитивных исследований НИЦ КИ) за помощь в работе с лабораторными животными, Ресурсный центр нейрокогнитивных исследований НИЦ КИ за обеспечение оборудованием, А.В. Сымона (Представительство Lipoid AG в Москве) за предоставление фосфолипидов
Работа выполнена при поддержке НИЦ “Курчатовский институт” (НИР “Биомедицинские технологии”, подтема 2, приказ № 1059 от 2 июля 2020).
Список литературы
Reynolds A., Laurie C., Mosley R.L. et al. // Int. Rev. Neurobiol. 2007. V. 82. P. 297.
Akiyama H., Barger S., Barnum S. et al. // Neurobiol. Aging. 2000. V. 21 (3). P. 383.
Holmes C. // Neuropathol. Appl. Neurobiol. 2013. V. 39 (1). P. 1.
Heppner F.L., Ransohoff R.M., Becher B. // Nat. Rev. Neurosci. 2015. V. 16 (6). P. 358.
Kim J., Kim Z., Huang Z.I. et al. // Biomol. Ther. 2019. V. 27 (3). P. 327.
Rao R., Sarada A.R., Baskaran V. et al. // J. Microbiol. Biotechnol. 2009. V. 19 (11). P. 1333.
Chen Q., Tao J., Li G. et al. // Eur. J. Pharmacol. 2018. V. 840. P. 33.
Alam M.N., Hossain M.M., Rahman M.M. et al. // J. Diet. Suppl. 2018. V. 15 (1). P. 42.
Rahman S.O., Panda B.P., Parvez S. et al. // Biomed. Pharmacother. 2019. V. 110. P. 47.
Che H., Li Q., Zhang T. et al. // J. Agric. Food Chem. 2018. V. 66 (19). P. 4948.
Huang C., Wen C., Yang M. et al. // J. Neuroimmune Pharmacol. 2021. V. 16 (3). P. 609. https://doi.org/10.1007/s11481-020-09953-4
Куликова И.С., Лотош Н.Ю., Туранова В.А., Селищева А.А. // Химико-фармацевтический журн. 2020. № 8 (54). С. 18.
Gentine P., Bubel A., Crucifix C. et al. // J. Liposome Res. 2012. V. 22 (1). P. 18.
Gould T.D. Mood and anxiety related phenotypes in mice. Baltimore, MD: Humana Press, 2009. 333 p.
Komada M., Takao K., Miyakawa T.J. // Vis Exp. 2008. V. 22 (22). P. 1088.
O'Leary T.P., Mantolino H.M., Stover K.R. et al. // Genes Brain Behav. 2020. V. 19 (3). P. 2.
Горина Я.В., Комлева Ю.К., Лопатина О.Л. и др. // Биомедицина. 2017. № 3. С. 47.
Воронина Т.А., Островская Р.У., Гарибова Т.Л. Методические рекомендации по доклиническому изучению лекарственных средств с ноотропным типом действия. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1 / Под ред. Миронова А.Н. М.: Гриф и К, 2012. 944 с.
Горина Я.В., Салмина А.Б., Кувачева Н.В. и др. // Сибирское медицинское обозрение. 2014. № 4. С. 11.
Satoh A., Tsuji S., Okada Y. et al. // J. Clin. Biochem. Nutr. 2009. V. 44. P. 280.
Wojsiat J., Zoltowska K.M., Laskowska-Kaszub K., Wojda U. // Oxid. Med. Cell. Longev. 2018. V. 2018. P. 1. https://doi.org/10.1155/2018/6435861
Lee S.J., Bai S.K., Lee K.S. et al. // Mol. Cells. 2003. V. 16 (1). P. 97.
Fanaee-Danesh E., Gali C.C., Tadic J. et al. // Biochim. Biophys. Acta Mol. Basis Dis. 2019. V. 1865 (9). P. 2224.
Sangsuriyawong A., Limpawattana M.D., Siriwan Klaypradit W. // Food Sci Biotechnol. 2019. V. 28 (2). P. 529.
Taksima T., Chonpathompikunlert P., Sroyraya M. et al. // Mar. Drugs. 2019. V. 17 (11). P. 3.
Yao Y., Jia M., Wu J.G. et al. // Pharm. Biol. 2010. V. 48 (7). P. 801.
Петухова Е.О., Мухамедшина Я.О., Ризванов А.А. и др. // Гены и клетки. 2014. № 3 (9). С. 234.
Jawhar S., Trawicka A., Jenneckensa C. et al. // Neurobiol. Aging. 2012. V. 33 (1). 2012. P. 196.
Николаева Н.С., Мальцев А.В., Овчинников Р.К. и др. // Изв. РАН. Сер. Биол. 2019. № 3. С. 284.
Чичева М.М., Мальцев А.В., Кохан В.С., Бачурин С.О. // Докл. РАН. Науки о жизни. 2020. № 494. С. 468.
Schneider F., Baldauf K., Wetzel W., Reymann K.G. // Physiol. Behav. 2014. V. 135. P. 25.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


