Российские нанотехнологии, 2022, T. 17, № 3, стр. 415-423
Наночастицы золото/кобальтовый феррит, легированный цинком, в исследовании цитотоксического эффекта на клетки Т-лимфобластной лейкемии
А. В. Моторжина 1, *, В. К. Беляев 1, В. Г. Колесникова 1, С. Йованович 1, 2, Л. В. Панина 1, 3, Е. В. Левада 1
1 Балтийский федеральный университет им. И. Канта
Калининград, Россия
2 Институт ядерной физики “Винча” – Национальный институт Республики Сербия, Университет Белграда
Белград, Сербия
3 Национальный исследовательский технический университет “МИСиС”
Москва, Россия
* E-mail: Amotorzhina@kantiana.ru
Поступила в редакцию 03.12.2021
После доработки 27.12.2021
Принята к публикации 27.12.2021
Аннотация
Быстрое развитие областей применения наноматериалов в биомедицине связано с расширенными возможностями комбинации их свойств в композитных материалах. Использование нанокомпозитов позволяет применять их в различных видах терапии или тераностики. Предложен новый подход к изготовлению нанокомпозита типа золото/феррит, который состоит из золотых частиц диаметром до 10 нм, окруженных небольшими наночастицами феррита кобальта (~5 нм), легированного цинком. Золотое ядро покрыто аргинином, в то время как частицы феррита имеют оболочку, состоящую из слоя дигидрокафеиновой кислоты. Изготовленный нанокомпозит обладает оптическими и магнитными свойствами, обусловленными возбуждением локализованного плазмонного резонанса в частицах золота и суперпарамагнитным состоянием частиц феррита. Результаты исследования структурных, магнитных и оптических свойств, а также цитотоксичности полученного нанокомпозита позволяют сделать вывод о возможности его использования в проведении комбинированной фото- и магнитной гипертермической терапии.
ВВЕДЕНИЕ
В настоящее время в биомедицине значительное внимание уделяется поиску новых эффективных инструментов для диагностики и лечения онкологических заболеваний. Одним из таких подходов является фототермическая терапия с применением золотых наночастиц (НЧ) [1].
НЧ золота обладают высокой биосовместимостью в широком диапазоне размеров и концентраций [2] и за счет возбуждения локализованного плазмонного резонанса излучают тепло при поглощении света определенных длин волн. Для эффективного преобразования оптической энергии в тепло НЧ золота должны обладать определенным значением эффективного сечения экстинкции. Оно должно быть достаточным для преобладания поглощательных процессов над процессами рассеяния и оптимальным с точки зрения спектрального положения резонанса, совпадающим с окнами прозрачности для биологических тканей. На длинах волн от 700 до 900 нм ткани тела человека являются менее оптически плотными, а толщина скин-слоя оптического излучения достигает нескольких сантиметров [3]. При диаметрах менее 30 нм НЧ золота представляют собой идеальные плазмонные поглотители оптического излучения, в которых длина волны, где наблюдается возбуждение плазмонного резонанса, составляет около 520 нм. Спектральный сдвиг пика плазмонного резонанса в сторону больших длин волн может быть достигнут за счет изменения формы НЧ или состава окружающей их среды. К примеру, смещения спектрального положения плазмонного резонанса в красную область можно достичь за счет увеличения диэлектрической проницаемости окружающей среды εex [4]. Добиться увеличения εex можно, покрывая НЧ золота оптически более плотным ферромагнитным материалом [5–10], в роли которого может выступить феррит кобальта, формируя нанокомпозитный материал.
Кобальтовый феррит (CoFe2O4 или CFO) обладает свойствами, позволяющими использовать его в биомедицине: высокая магнитокристаллическая анизотропия (~200 кДж/м3), температура Кюри TC ~ 793 K, относительно высокая намагниченность насыщения (до 90 А м2/кг), а также высокая термическая стабильность [11]. CFO принадлежит семейству шпинелевых ферритов типа M2+Fe$_{2}^{{3 + }}$O4, где M2+ – двухвалентный металл. Магнитными свойствами CFO можно управлять, контролируя его химический состав. Например, использование НЧ легированного цинком кобальтового феррита (CFO_Zn) позволяет увеличить магнитную анизотропию [12, 13]. Также НЧ CFO оказывают слабый цитотоксический эффект при условии, что они синтезированы с биосовместимым покрытием и используются в невысоких концентрациях [14–16].
Благодаря сочетанию плазмонных и магнитных свойств нанокомпозиты из НЧ золота и CFO могут быть использованы, например, для усиления контраста при магнитно-резонансной томографии, детектирования специфических химических процессов и адресной доставки лекарственных препаратов [17–19]. Как терапевтический агент нанокомпозиты могут применяться для лечения раковых заболеваний [20, 21], чему способствует их высокая фотостабильность [22, 23]. В частности, с учетом свойств обоих компонентов нанокомпозитов их можно использовать для комбинированной фототермической терапии [24, 25] и магнитной гипертермии [26, 27].
Цитотоксичность и влияние отдельных составляющих нанокомпозита и самого нанокомпозита на биологические объекты могут различаться при их использовании с разными видами клеточных культур. Так, при тестировании НЧ CFO, покрытых диоксидом кремния, на клеточной линии Jurkat было выявлено незначительное кратковременное снижение пролиферативной активности культуры, что может свидетельствовать о цитотоксичности применяемого материала [28]. С другой стороны, легирование НЧ CFO цинком не оказывало влияния на пролиферативную активность фибробластов [29]. Отметим, что при небольших концентрациях НЧ CFO диаметром менее 10 нм практически не влияют на пролиферативную активность клеток рака поджелудочной железы и рака яичников, хотя продолжают в них накапливаться [30]. Однако при увеличении диаметра НЧ CFO оказывает на них токсическое действие [30]. Для потенциального применения наноматериалов в биомедицинских приложениях необходимо исследовать их эффект на клетки не только в патологическом состоянии (например, клетки Jurkat – клетки Т-лимфобластной лейкемии), но и в их нормальном, физиологическом состоянии (клетки МНК – мононуклеарные клетки крови человека). Такой подход помогает оптимально подобрать необходимые материалы для изготовления НЧ и концентрации введения в клеточную среду для их эффективного применения. Формирование нанокомпозитных структур из НЧ золота и CFO может быть выполнено в виде структуры ядра/оболочки [31–34] или в виде кластерной структуры [34, 35]. Основными подходами к формированию нанокомпозитов являются:
– осаждение золота на НЧ CFO путем его восстановления из раствора тетрахлороаурата водорода (HAuCl4) с образованием структуры ядро/оболочка [36];
– адсорбция затравок или НЧ золота на поверхности CFO с последующим образованием кластеров НЧ золота на поверхности магнитных НЧ [35, 37].
Однако данные методы синтеза сложны и требуют точного контроля роста НЧ золота. Так, раздельный синтез НЧ CFO и наночастиц золота с дальнейшим объединением их в композитную структуру с помощью органических покрытий является более простым и оптимальным способом синтеза таких наноматериалов [35, 38, 39].
В данной работе предложен протокол синтеза нанокомпозитной структуры, которая может быть использована для проведения фототермической терапии. Нанокомпозит представляет собой НЧ золота диаметром ~10 нм, покрытые аргинином, окруженные НЧ CFO, допированного цинком, диаметром ~5 нм, покрытыми дигидрокафеиновой кислотой. Результаты исследования структурных, магнитных и оптических свойств полученного композита, а также его влияния на пролиферативную активность клеточных культур показывают возможность его применения в биомедицине.
МЕТОДЫ
Синтез нанокомпозита. Для создания магнитной составляющей нанокомпозита – наночастиц кобальтового феррита, легированного цинком в соотношении 1 : 1 (СFO_Zn), 0.5 ммоль нитрата цинка, 0.5 ммоль нитрата кобальта и 2 ммоль нитрата железа были растворены в 2 мл дистиллированной воды, а затем подвергнуты автоклавированию. Дальнейший синтез нанокомпозита Au/CFO_Zn был проведен согласно методике [40]. Покрытие наночастиц СFO_Zn дигидрокафеиновой кислотой придает поверхности гидрофильные свойства [41], что позволяет коллоидной суспензии оставаться стабильной в водных средах, что необходимо при использовании в биомедицине. Поверхность частиц, покрытых дигидрокафеиновой кислотой, обладает отрицательным поверхностным зарядом, в то время как покрытие аргинином придает поверхности частиц положительный заряд [24]. Наличие частиц с отрицательным и положительным зарядами поверхностей приводит к их взаимодействию между собой и объединению в нанокомпозит. Полученный нанокомпозит, состоящий из НЧ золота, покрытых аргинином, и окружающих их CFO_Zn, покрытых дигидрокафеиновой кислотой, в дальнейшем обозначается как Au/CFO_Zn.
Методики исследования. Форма и размер НЧ в синтезированном нанокомпозите Au/CFO_Zn были изучены с помощью просвечивающего электронного микроскопа (ПЭМ) JEM-2100 (фирма JEOL) с ускоряющим напряжением 200 кВ. Для этого порошок композитных НЧ разбавляли в н-гексане и обрабатывали ультразвуком в течение 10 мин для предотвращения агломерации. Затем суспензию НЧ наносили на покрытую углеродом медную сетку и сушили на воздухе. Распределение НЧ по размерам выполнено с использованием программного обеспечения (ПО) ImageJ.
Элементный состав наночастиц CFO_Zn исследовали методом масс-спектрометрии с индуктивно-связанной плазмой (ИСП-МС) с помощью спектрометра iCAP 6300 DUP ICP-OES от Thermo Scientific, а элементный состав нанокомпозита Au/CFO_Zn – методом энергодисперсионной рентгеновской спектроскопии (ЭДС) на приборе EDX Bruker Quantax 75. Анализ результатов ЭДС проведен с использованием ПО ESPRIT Compact.
Структуру наночастиц CFO_Zn и нанокомпозита Au/CFO_Zn исследовали методом рентгеноструктурного анализа (РСА) на настольном порошковом рентгеновском дифрактометре AXRD (PROTO Manufacturing). Данные РСА были записаны в диапазоне 2θ от 30° до 90° с шагом 0.015 и временем вычисления 5 с/шаг на излучении CuKα с длиной волны 1.54184 Å. Результаты проанализированы с помощью ПО QualX.
Магнитные свойства нанокомпозита Au/CFO_Zn исследовали с помощью вибрационного магнитометра LakeShore VSM 7400. Петли гистерезиса НЧ измеряли при комнатной температуре в поле до 1 Тл. Уровень шума вибрационного магнитометра составил 10–6 э.м.е. при усреднении сигнала 3 с на точку.
Оптические свойства нанокомпозита Au/CFO_Zn изучали в диапазоне длин волн от 370 до 850 нм методом спектроскопии поглощения видимого света. Экспериментальная установка состояла из галогенной лампы и монохроматора MS5204i в качестве источника света, оптомеханического чоппера с частотой 423 Гц, квадратной кварцевой кюветы емкостью 3500 мкл с длиной оптического пути 10 мм и фотоумножительной трубки PMM02 с синхронным усилителем SR830 в качестве системы детектирования. Нанокомпозит Au/CFO_Zn диспергировали в дистиллированной воде до получения трех концентраций: 10, 50 и 100 мкг/мл. По закону Бугера–Ламберта–Бера рассчитаны спектры поглощения полученных суспензий наночастиц:
где А – поглощенная интенсивность, I0 – интенсивность падающего света, I – интенсивность света, прошедшего через кювету с водной суспензией нанокомпозита. Для получения спектра поглощения нанокомпозита из полученных данных вычитали спектр поглощения кварцевой кюветы с водой.Моделирование спектральных зависимостей сечений поглощения частиц золота и синтезированного нанокомпозита было выполнено численным методом конечных разностей во временной области. Данный алгоритм основан на дискретизации уравнений Максвелла, записанных в дифференциальной форме, и относится к общему классу сеточных методов решения дифференциальных уравнений. Модель построена на основе размеров НЧ золота и CFO, определенных из ПЭМ-изображений нанокомпозита. Расчеты сечений поглощения представлены в виде спектральных зависимостей поглощенной мощности нормированной на площадь поверхности отдельной составляющей нанокомпозита. Моделирование проводили с помощью ПО Lumerical FDTD Solutions (v.8.26.2834, Lumerical Inc.).
Исследование цитотоксичности. Исследовали влияние нанокомпозита на жизнеспособность двух клеточных культур: Т-лимфобластного лейкоза человека (Jurkat) и мононуклеарных клеток крови человека (МНК). Четвертый и пятый пассажи клеток культуры Jurkat, полученной из Российской коллекции клеточных культур (Институт цитологии РАН, Санкт-Петербург, Россия), использовали для проведения эксперимента. МНК были выделены из цельной гепаринизированной крови здоровых доноров (разрешение № 5 от 16 мая 2016 г.; Местный этический комитет, Инновационный парк “Фабрика”, Балтийский федеральный университет им. Иммануила Канта). Цельная гепаринизированная кровь объемом 5 мл была разбавлена в 15 мл фосфатно-солевого буферного раствора, а затем добавлена отдельным слоем на 15 мл фиколла (Диакол, Диаэм, Россия) в конической пробирке объемом 50 мл. Образец центрифугировали в течение 40 мин при 400 g без резкого торможения. Слой МНК был аккуратно собран в новую пробирку и дважды промыт в фосфатно-солевом буферном растворе. Обе клеточные культуры культивировали в питательной среде RPMI 1640 с добавлением 10% фетальной бычьей сыворотки, 0.3 мг/мл L-глутамина (все Sigma, США), 1% пенициллина и стрептомицина в атмосфере с 5% CO2 при 37°С.
Влияние трех концентраций Au/CFO_Zn (10, 50 и 100 мкг/мл) в клеточной среде на жизнеспособность клеточных линий определяли с помощью теста WST-1 (Roche Diagnostics GmbH, Германия) через 2, 4, 8, 24 и 48 ч. Данный тест основан на реакции восстановления соли тетразолия WST-1 до формазана, концентрация которого прямо пропорциональна концентрации живых клеток. При этом цвет раствора меняется от светло-красного до ярко-желтого, что влияет на изменение его оптической плотности.
Для проведения эксперимента использовали 96-луночные микропланшеты. В контрольные лунки высевали 5 × 105 клеток в 100 мкл (Control). В экспериментальные лунки c клетками добавляли нанокомпозит (Experiment). Чтобы исключить влияние НЧ и клеточной среды на результат исследования, вместе с экспериментальными и контрольными лунками дополнительно использовали лунки с клеточной средой (Control blank) и суспензиями нанокомпозита в клеточной среде (Experimental blank). Каждый эксперимент проводили с шестикратной повторяемостью. В течение последних двух часов выдержки каждого эксперимента было проведено окрашивание WST-1. Оптическую плотность среды измеряли при 450 нм в планшетном спектрофотометре Bio-Rad 680. Результаты эксперимента получены вычитанием оптической плотности Experimental blank из оптической плотности Experiment, результаты контрольных измерений – вычитанием оптической плотности Control blank из оптической плотности Control.
Статистический анализ. Все результаты исследования жизнеспособности клеточных культур Jurkat и МНК относительно контрольных измерений представлены в виде среднего значения с указанием стандартного отклонения. Тест Краскела–Уоллиса с последующим тестом Данна использовали для статистического анализа каждой экспериментальной группы с контрольной с помощью ПО GraphPadPrism v.7.04.
РЕЗУЛЬТАТЫ
Физические и физико-химические свойства нанокомпозита. На начальном этапе синтеза нанокомпозита Au/CFO_Zn были получены наночастицы CFO_Zn, покрытые дигидрокафеиновой кислотой. Методом ИСП-МС проведен анализ их состава. Результаты показали соотношение кобальта : железа : цинка в пропорции 0.52 : 1.93 : 0.55.
Спектр ЭДС нанокомпозита Au/CFO_Zn показал наличие пиков железа, кобальта, кислорода, углерода, алюминия и натрия. Пик натрия связан с гидроксидом натрия, используемого в качестве одного из прекурсоров синтеза магнитной фазы, а пики алюминия и углерода вызваны алюминиевым держателем образца и углеродной ленты, на которых проводилось измерение. Результаты исследований нанокомпозита Au/CFO_Zn с помощью ПЭМ, вибрационного магнитометра и рентгеновского дифрактометра показаны на рис. 1.
Рис. 1.
ПЭМ-изображения композита Au/CFO_Zn (а, б). Спектры РСА наночастиц CFO_Zn [12] и композита Au/CFO_Zn (в). Данные о спектрах для титана, золота и шпинели обозначены как Ti, Au и S соответственно. Петля гистерезиса композита Au/CFO_Zn (г).
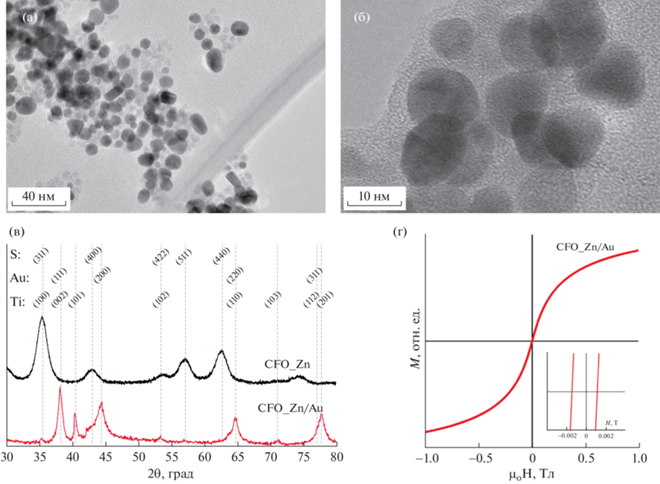
На ПЭМ-изображении образца Au/CFO_Zn показаны наночастицы CFO_Zn (светло-серые сфероиды) со средним размером 5.7 ± 1.2 нм. Магнитные НЧ находятся в тесном контакте с НЧ золота (темные сфероиды), средний диаметр которых 9.6 ± 2.3 нм. Фазовый состав нанокомпозита, полученный методом РСА, показал наличие пиков золота на 2θ = 38.2°, 44.4°, 64.7°, 77.6° и пиков титана при 2θ = 35.5°, 40.4°, 53.4°, 71.2°, 81.9°. Титан является стандартной примесью при сонохимическом синтезе НЧ, получаемой при разрушении ультразвуковой обработкой титанового наконечника. Пики дифрактограммы титана были получены на тех же углах, что и пики шпинели – фазы, характерной для CFO.
Наличие ферромагнитной фазы в нанокомпозите Au/CFO_Zn было также подтверждено результатами исследования магнитных свойств методом вибрационной магнитометрии. Полученная зависимость магнитного момента от напряженности приложенного поля для нанокомпозита является практически безгистерезисной (суперпарамагнитной) петлей с коэрцитивной силой менее 1 мТл. Эти данные согласуются с данными [12] для однодоменных НЧ CFO диаметром ~5 нм. НЧ с подобными магнитными свойствами могут быть использованы, например, для магнитной гипертермии [42, 43].
Спектральное положение и интенсивность пика локализованного плазмонного резонанса, обеспечивающего возможность фототермического преобразования, выявлены методом спектроскопии поглощения света оптического диапазона длин волн. Экспериментальные спектры поглощения (рис. 2а) для трех различных концентраций композитных наночастиц Au/CFO_Zn имеют характерный пик локализованного поверхностного плазмонного резонанса на длине волны ~600 нм. Интенсивность пика уменьшается при снижении концентрации НЧ в суспензии. В сравнении с характеристическими спектрами поглощения для НЧ золота диаметром менее 20 нм наблюдаемый пик стал шире и сдвинулся в красную область спектра [20, 44, 45]. Подобное уширение и сдвиг пика могут быть объяснены изменением диэлектрической проницаемости среды, окружающей НЧ золота. Для проверки данного предположения было выполнено моделирование спектральных зависимостей сечения поглощения для частицы золота и частицы золота, окруженной ферромагнитными НЧ в водной среде (рис. 2б). Наличие ферромагнитных частиц в окружении частицы золота приводит к сильному изменению формы и интенсивности пика поглощения, а также сдвигает его в область красных длин волн, что согласуется с представленными экспериментальными данными. Сдвиг пика поглощения в область красных длин волн происходит за счет увеличения действительной части диэлектрической проницаемости вокруг частиц золота и согласуется с данными [5–10]. В то же время увеличение абсолютного значения мнимой части диэлектрической проницаемости приводит к уширению и уменьшению интенсивности пика локализованного плазмонного резонанса за счет добавления канала туннелирования электронов зон проводимости между золотыми и ферромагнитными НЧ [46].
Рис. 2.
Экспериментальные спектры поглощения для трех различных концентраций композитных наночастиц Au/CFO_Zn (а). Эффективное сечение рассеяния НЧ золота и композита Au/CFO_Zn в воде (б). Вставки на панели (б) схематически показывают объект моделирования.

Для фототермических эффектов важно как увеличение сечения поглощения, так и смещение локализованного плазмонного резонанса в красную область. Увеличение поглощения влияет на тепловыделение, в то время как смещение в красную область может использоваться для перемещения спектрального положения резонанса ближе к окнам биологической прозрачности. Полученные магнитные и оптические свойства делают нанокомпозит Au/CFO_Zn подходящим для фототермической терапии.
Биосовместимость Au/CFO_Zn. НЧ золота – ядра нанокомпозита – активно применяются в различных областях биомедицины [47]. Более того, НЧ золота были утверждены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в качестве агента для фототермической терапии [48].
Цитотоксичность CFO, замещенного цинком, была исследована на фибробластах [29]. Результаты показали снижение жизнеспособности клеток с увеличением концентрации НЧ. Существенно снизить цитотоксичность CFO помогает использование различных биосовместимых покрытий [49–52], поэтому от Au/CFO_Zn можно ожидать как цитотоксичного, так и нетоксичного эффекта. В [53] показано, что токсичность CFO зависит и от чувствительности клеток различных клеточных культур. Так, наиболее чувствительными к воздействию НЧ CFO оказались лейкоциты культуры TK6 [53].
Базовые исследования цитотоксичности различных материалов in vitro обычно проводятся на лейкоцитах и других иммуномодулирующих клеточных культурах, что связано с их естественной способностью к фагоцитозу [54]. В настоящей работе цитотоксичность нанокомпозита Au/CFO_Zn исследовали на двух различных типах культур лейкоцитов: Jurkat (лейкемия) и МНК (лейкоциты здоровых доноров). Нанокомпозиты Au/CFO_Zn в трех концентрациях (10, 50, 100 мкг/мл) инкубировали с клетками Jurkat в течение 2, 4, 8, 24 и 48 ч. Первичные результаты (рис. 3а) показали тенденцию к снижению жизнеспособности с увеличением концентрации Au/CFO_Zn. Статистически достоверный цитотоксический эффект был виден при воздействии 50 мкг/мл нанокомпозита Au/CFO_Zn на Jurkat при инкубации клеток в течение 8, 24 и 48 ч. Среди всех проведенных экспериментов с различным временем выдержки суспензии Au/CFO_Zn с клеточной культурой Jurkat эксперименты длительностью 24 ч дают наиболее статистически значимые результаты (p < 0.0021). Поэтому все последующие исследования проводили с этим временем выдержки.
Рис. 3.
Жизнеспособность клеточных культур Jurkat (а, б) и МНК (в) после инкубирования с наночастицами Au/CFO_Zn в концентрациях 10, 50 и 100 мкг/мл: а – в течение 2, 4, 8, 24 и 48 ч; б, в – в течение 24 ч, в процентах в сравнении с контрольными данными. Результаты представляют собой среднее значение ± стандартное отклонение. Столбцы, отмеченные звездочками, указывают на результаты, которые статистически отличались от контроля: * р < 0.0332, ** р < 0.0021.
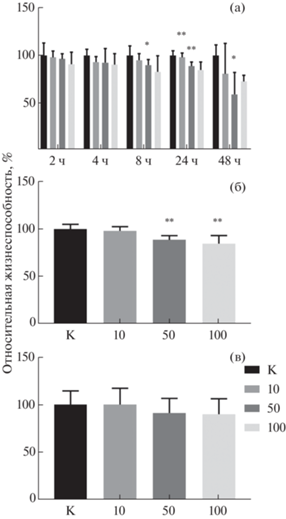
Зависимости относительной жизнеспособности клеточных линий Jurkat и МНК от концентрации нанокомпозита представлены на рис. 3б и 3в соответственно. Жизнеспособность клеток лейкемии Jurkat снижается с увеличением концентрации нанокомпозита, причем концентрации 50 и 100 мкг/мл показывают статистически достоверные значения цитотоксичности в 88 и 84% соответственно. Однако при исследовании Au/CFO_Zn на клеточной культуре МНК (рис. 3в) результаты не показывают достоверного изменения жизнеспособности, что позволяет сделать вывод о том, что данный вид клеток менее чувствителен к воздействию нанокомпозита. Таким образом, можно предположить, что цитотоксичность Au/CFO_Zn будет усиливать эффект от фототермальной терапии на клетки Jurkat, в меньшей степени воздействуя на здоровые мононуклеарные клетки крови.
ЗАКЛЮЧЕНИЕ
Предложен новый подход к изготовлению композитных НЧ золота, окруженных наночастицами CFO, легированного цинком. Синтезированный нанокомпозит Au/CFO_Zn характеризуется узким распределением частиц по размерам, а также структурной и морфологической стабильностью во времени, что было подтверждено комплексом исследований (ПЭМ, РСА, ЭДС). Магнитные свойства обусловлены суперпарамагнитным состоянием наночастиц CFO_Zn, а оптические – локализованным плазмонным резонансом НЧ золота. Au/CFO_Zn в концентрациях 50 и 100 мкг/мл показал значительное снижение пролиферативной активности клеток раковой культуры Jurkat. Предполагается, что цитотоксический эффект на раковые клетки усилится, не оказывая значительного влияния на здоровые моноциты крови, при комбинировании фототермической и других видов терапии на основе магнитных эффектов, таких как лечение адресно доставленными лекарственными средствами или магнитная гипертермия.
Авторы выражают благодарность Н.Д. Газатовой и Л.С. Литвиновой (БФУ им. И. Канта, Российская Федерация) за предоставленную донорскую кровь для выделения мононуклеарных клеток периферической крови (Разрешение № 5 от 16 мая 2016 г.; Местный этический комитет, Инновационный парк, Балтийский федеральный университет им. Иммануила Канта), А.С. Омельянчику за консультативную поддержку и помощь в анализе полученных результатов, С.Е. Пшеничникову за помощь в проведении анализа на цитотоксичность, а также Д.В. Мурзину за помощь в анализе литературы и общей концептуализации статьи.
При финансовой поддержке Российского научного фонда (грант № 21-72-20158) выполнены моделирование и экспериментальные исследования оптических свойств; магнитные измерения; частичная характеризация образцов (рентгеноструктурный анализ); биологические исследования. Работа С. Йованович выполнена при финансовой поддержке Министерства высшего образования, науки и технологий Республики Словения (грант № P2-0091) и Словенского исследовательского агентства (грант № J2-8169) в части синтеза нанокомпозитов и характеризации образцов (получение ПЭМ-изображений).
Список литературы
Vines J.B., Yoon J.-H., Ryu N.-E. et al. // Front. Chem. 2019. V. 7. P. 167. https://doi.org/10.3389/fchem.2019.00167
Курапов П.Б., Бахтенко Е.Ю. // Вестн. РГМУ. 2019. № 6. С. 86. https://doi.org/10.24075/vrgmu.2018.090
Weissleder R. // Nat. Biotechnol. 2001. V. 19. № 4. P. 316. https://doi.org/10.1038/86684
Maier S. // Physics. 2004. V. 677. № 1. P. 10.
Zhang Y., Zhao Y., Yang Y. et al. // Sensors Actuators B Chem. 2015. V. 220. P. 622. https://doi.org/10.1016/j.snb.2015.05.126
Omelyanchik A., Efremova M., Myslitskaya N. et al. // J. Nanosci. Nanotechnol. 2019. V. 19. № 8. P. 4987. https://doi.org/10.1166/jnn.2019.16797
Wei Y., Klajn R., Pinchuk A.O. et al. // Small. 2008. V. 4. № 10. P. 1635 https://doi.org/10.1002/smll.200800511
Schick I., Gehrig D., Montigny M. et al. // Chem. Mater. 2015. V. 27. № 13. P. 4877. https://doi.org/10.1021/acs.chemmater.5b01968
Umut E., Pineider F., Arosio P. et al. // J. Magn. Magn. Mater. 2012. V. 324. № 15. P. 2373. https://doi.org/10.1016/j.jmmm.2012.03.005
Zeng H., Sun S. // Adv. Funct. Mater. 2008. V. 18. № 3. P. 391. https://doi.org/10.1002/adfm.200701211
Sharifi I., Shokrollahi H., Doroodmand M.M., Safi R. // J. Magn. Magn. Mater. 2012. V. 324. № 10. P. 1854. https://doi.org/10.1016/j.jmmm.2012.01.015
Muscas G., Jovanović S., Vukomanović M. et al. // J. Alloys Compd. 2019. V. 796. P. 203. https://doi.org/10.1016/j.jallcom.2019.04.308
Andhare D.D., Jadhav S.A., Khedkar M.V. et al. // J. Phys. Conf. Ser. 2020. V. 1644. № 1. P. 012014. https://doi.org/10.1088/1742-6596/1644/1/012014
Abudayyak M., Altinçekiç Gürkaynak T., Özhan G. // Turkish J. Pharm. Sci. 2017. V. 14. № 2. P. 169. https://doi.org/10.4274/tjps.99609
Aşık E., Akpınar Y., Güray N.T. et al. // Toxicol. Res. (Camb). 2016. V. 5. № 6. P. 1649. https://doi.org/10.1039/C6TX00211K
Finetti F., Terzuoli E., Donnini S. et al. // PLoS One / ed. Santos H.A. 2016. V. 11. № 12. P. e0168727. https://doi.org/10.1371/journal.pone.0168727
Murphy C.J., Gole A.M., Stone J.W. et al. // Acc. Chem. Res. 2008. V. 41. № 12. P. 1721. https://doi.org/10.1021/ar800035u
Ghosh P., Han G., De M. et al. // Adv. Drug Deliv. Rev. 2008. V. 60. № 11. P. 1307. https://doi.org/10.1016/j.addr.2008.03.016
Abadeer N.S., Murphy C.J.R. // J. Phys. Chem. C. 2016. V. 120. № 9. P. 4691. https://doi.org/10.1021/acs.jpcc.5b11232
Sztandera K., Gorzkiewicz M., Klajnert-Maculewicz B. // Mol. Pharm. 2019. V. 16. № 1. P. 1. https://doi.org/10.1021/acs.molpharmaceut.8b00810
Jain S., Hirst D.G., O’Sullivan J.M.G. // Br. J. Radiol. 2012. V. 85. № 1010. P. 101. https://doi.org/10.1259/bjr/59448833
Daniel M.-C., Astruc D. // ChemInform. 2004. V. 35. № 16. P. 293. https://doi.org/10.1002/chin.200416213
Dreaden E.C., Alkilany A.M., Huang X. et al. // Chem. Soc. Rev. 2012. V. 41. № 7. P. 2740. https://doi.org/10.1039/C1CS15237H
Gabbani A., Fantechi E., Petrucci G. et al. // ACS Appl. Nano Mater. 2021. V. 4. № 2. P. 1057. https://doi.org/10.1021/acsanm.0c02588
Yao C., Zhang L., Wang J. et al. // J. Nanomater. 2016. V. 2016. P. 1. https://doi.org/10.1155/2016/5497136
Fayazzadeh S., Khodaei M., Arani M. et al. // J. Supercond. Nov. Magn. 2020. V. 33. № 7. P. 2227. https://doi.org/10.1007/s10948-020-05490-6
Verde E.L., Landi G.T., Gomes et al. // J. Appl. Phys. 2012. V. 111. № 12. P. 123902. https://doi.org/10.1063/1.4729271
Lucht N., Friedrich R.P., Draack S. et al. // Nanomaterials. 2019. V. 9. № 12. P. 1713. https://doi.org/10.3390/nano9121713
Darwish M.S.A., Kim H., Lee H. et al. // Nanomaterials. 2019. V. 9. № 8. P. 1176. https://doi.org/10.3390/nano9081176
Pašukonienė V., Mlynska A., Steponkienė S. et al. // Medicina (B. Aires). 2014. V. 50. № 4. P. 237. https://doi.org/10.1016/j.medici.2014.09.009
Gupta R., Sharma D. // ACS Appl. Nano Mater. 2020. V. 3. № 2. P. 2026. https://doi.org/10.1021/acsanm.0c00121
Espinosa A., Di Corato R., Kolosnjaj-Tabi J. et al. // ACS Nano 2016. V. 10. № 2. P. 2436. https://doi.org/10.1021/acsnano.5b07249
Saykova D., Saikova S., Mikhlin Y. et al. // Metals (Basel). 2020. V. 10. № 8. P. 1075. https://doi.org/10.3390/met10081075
Jagminas A., Mažeika K., Kondrotas R. et al. // Nanomater. Nanotechnol. 2014. V. 4. P. 11. https://doi.org/10.5772/58453
Saikova S., Pavlikov A., Trofimova T. et al. // Metals (Basel). 2021. V. 11. № 5. P. 705. https://doi.org/10.3390/met11050705
Mikalauskaitė A., Kondrotas R., Niaura G., Jagminas A. // J. Phys. Chem. C. 2015. V. 119. № 30. P. 17398. https://doi.org/10.1021/acs.jpcc.5b03528
Smith M., McKeague M., DeRosa M.C. // MethodsX 2019. V. 6. P. 333. https://doi.org/10.1016/j.mex.2019.02.006
Rio I.S.R., Rodrigues A.R.O., Rodrigues C.P. et al. // Materials (Basel). 2020. V. 13. № 4. P. 815. https://doi.org/10.3390/ma13040815
Zhang H., Wang J., Zeng Y. et al. // Phys. Lett. A. 2020. V. 384. № 24. P. 126600. https://doi.org/10.1016/j.physleta.2020.126600
Motorzhina A., Jovanović S., Belyaev V.K. et al. // Processes. 2021. V. 9. № 12. P. 2264. https://doi.org/10.3390/pr9122264
Kostevšek N., Hudoklin S., Kreft M.E. et al. // RSC Adv. 2018. V. 8. № 26. P. 14694. https://doi.org/10.1039/C8RA00047F
Suriyanto Ng E.Y.K., Kumar S.D. // Biomed. Eng. Online. 2017. V. 8. № 26. P. 14694. https://doi.org/10.1186/s12938-017-0327-x
Carrey J., Mehdaoui B., Respaud M. // J. Appl. Phys. 2011. V. 109. № 8. P. 083921. https://doi.org/10.1063/1.3551582
Kush P., Kumar P., Singh R., Kaushik A. // Asian J. Pharm. Sci. 2021. V. 16. P. 704. https://doi.org/10.1016/j.ajps.2021.05.005
Yeshchenko O.A., Pinchuk A.O. // Ukr. J. Phys. 2021. V. 66. P. 112. https://doi.org/10.15407/ujpe66.2.112
Pinchuk A., Kreibig U. // New J. Phys. 2003. V. 5. P. 151. https://doi.org/10.1088/1367-2630/5/1/151
Wang H.-H., Su C.-H., Wu Y.-J. et al. // Int. J. Gerontol. 2012. V. 6. P. 1. https://doi.org/10.1016/j.ijge.2011.09.015
Singh P., Pandit S., Mokkapati V.R.S.S. et al. // Int. J. Mol. Sci. 2018. V. 19. P. 1979. https://doi.org/10.3390/ijms19071979
Mmelesi O.K., Masunga N., Kuvarega A. et al. // Mater. Sci. Semicond. Process. 2021. V. 123. P. 105523. https://doi.org/10.1016/j.mssp.2020.105523
Nam P.H., Phuc N.X., Manh D.H. et al. // Phys. E. Low-dimensional Syst. Nanostructures. 2021. V. 134. P. 114862. https://doi.org/10.1016/j.physe.2021.114862
Wang G., Zhou F., Li X. et al. // Ceram. Int. 2018. V. 44. P. 13588. https://doi.org/10.1016/j.ceramint.2018.04.193
Hatamie S., Parseh B., Ahadian M.M. et al. // J. Magn. Magn. Mater. 2018. V. 44. P. 13588. https://doi.org/10.1016/j.jmmm.2018.05.020
Horev-Azaria L., Kirkpatrick C.J., Korenstein R. et al. // Toxicol. Sci. 2011. V. 462. P. 185. https://doi.org/10.1093/toxsci/kfr124
Jones C.F., Grainger D.W. // Adv. Drug Deliv. Rev. 2009. V. 61. P. 438. https://doi.org/10.1016/j.addr.2009.03.005
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


