Российские нанотехнологии, 2022, T. 17, № 6, стр. 765-776
ЭЛЕКТРОКИНЕТИЧЕСКИЕ СВОЙСТВА ГИДРОГЕЛЯ НА ОСНОВЕ ПВС, КСАНТАНА И ПЭДОТ ПСС
Д. С. Большин 1, 2, *, П. М. Готовцев 2, 3, П. К. Кашкаров 1, 2
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
3 Московский физико-технический институт (Национальный исследовательский университет)
Долгопрудный, Россия
* E-mail: ds.boljshin@physics.msu.ru
Поступила в редакцию 22.07.2022
После доработки 16.08.2022
Принята к публикации 23.08.2022
Аннотация
Предложен прототип электрокинетического генератора, основой которого является гидрогель на основе поливинилового спирта, ксантана и поли(3,4-этилендиокситиофен)полистирен сульфоната. Доказана перспективность данного типа генерации электроэнергии для имплантируемых устройств. Изучены свойства поверхности рассматриваемого гидрогеля и его объема. Продемонстрирован и описан механизм формирования градиента проводимости в гидрогеле под действием электростатического поля
ВВЕДЕНИЕ
Первый полностью имплантируемый кардиостимулятор был создан в 1958 г. В настоящий момент в медицине применяется целый спектр устройств, обеспечивающих полноценное функционирование человеческого организма [1–10]. Одной из главных технических задач разработки имплантируемых устройств является продление максимального срока их службы, если источником энергии служит имплантированный вместе с ним аккумулятор. Идея постоянного источника энергии для систем поддержания физиологических функций лежит в основе направления научных работ по созданию всевозможных маломощных конвертеров механической, биохимической энергии, энергии света, звука и тепла [11–24]. Основной проблемой этих технологий является непостоянство источников исходной энергии, которая конвертируется в электрическую. Помимо наиболее широко используемых литий-ионных батарей батареи-генераторы, использующие энергию ядерного распада, наиболее близки к практическому применению, однако малая мощность этих устройств [25–28] делает невозможным их применение в ряде реальных имплантируемых систем.
На данный момент электрокинетические генераторы, электродвижущая сила в которых возникает из-за движения электролита по заряженной поверхности, рассматривают с точки зрения “экологически чистых” источников электроэнергии [29, 30], работающих благодаря природным и техногенным водным потокам (сточные трубы, дождь, приливные течения и др.). Однако ранее не высказывалось предложение использовать их в качестве источников электроэнергии для имплантируемых устройств с указанием на то, что все физиологические жидкости, в частности кровь, спинномозговая жидкость, слезы или слюна, являются электролитами [31–35]. Представленное в данной работе исследование является попыткой сделать шаг в сторону создания подобной технологии.
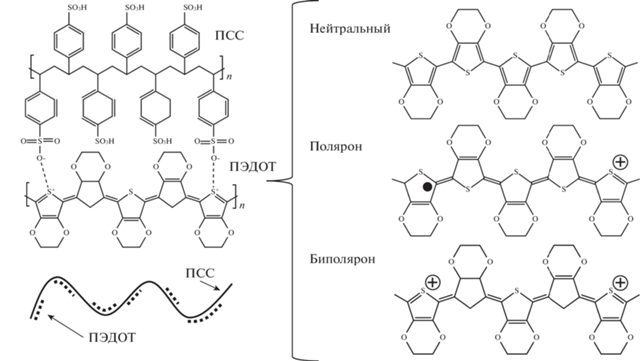
Поли(3,4-этилендиокситиофен)полистирен сульфонат (ПЭДОТ ПСС) – это композит из двух полимеров, в котором более короткие цепи ПЭДОТ образуют комплекс тиофеновых колец с ионами сульфогрупп более длинной цепи ПСС. Цепь ПСС играет роль каркаса и допирующего ПЭДОТ элемента. Как известно, носителями заряда в цепи ПЭДОТ являются электронные вакансии (дырки) [36]. Возникновение дырочной проводимости в ПЭДОТ происходит в два этапа. Нейтральный (восстановленная фаза) ПЭДОТ сначала переходит в слабоокисленное состояние, когда в цепи возникают квазичастицы поляроны (поляронная фаза), а далее в окисленное состояние, при котором в цепи полимера появляются вакантные места, сопряженные с локальной деформацией электронной структуры полимера, называемые биполяронами (биполяронная фаза) (рис. 1) [36–40]. В объеме чистого полимера и в материалах с добавлением ПЭДОТ ПСС могут одновременно присутствовать все три фазы ПЭДОТ. Увеличение биполяронной фазы приводит к росту проводимости материала. Вдобавок к полупроводниковым свойствам полимера низкий редокс-потенциал, биосовместимость, термо- и химическая стабильность определяют его популярность в качестве компонента мягкой электроники, электробиоинтерфейсов и суперконденсаторов [41].
Рис. 1.
Схема соединения проводящего полимера (композита) ПЭДОТ ПСС, различные степени окисления цепи ПЭДОТ.
Удобными и простыми в изготовлении средами-носителями для ПЭДОТ ПСС являются гидрогели. Помимо способности иммобилизировать в себе объекты с сохранением их свойств они могут обладать волокнистой поверхностью и пористой структурой, что делает их перспективными для разработки электрокинетических генераторов [42, 43]. В данном исследовании использовали гидрогель на основе ксантан-поливиниловый спирт (ПВС) матрицы с добавлением ПЭДОТ ПСС, приготовленный по методике [44]. Компоненты матрицы выбирали таким образом, чтобы сохранить окисленное состояние ПЭДОТ. Сульфогруппы ПСС соединены с ПВС водородными связями [45], что, предположительно, не должно способствовать сильному восстановлению ПЭДОТ. Ксантан, напротив, является таким же акцептором электронов для ПЭДОТ, как и ПСС [46].
В настоящей работе представлены результаты исследования электрофизических свойств проводящего гидрогеля, а также предложен прототип устройства для генерации электроэнергии в потоке электролита по поверхности данного гидрогеля. В качестве электролита использовали солевой раствор с концентрацией NaCl, соответствующей концентрации в крови человека [31].
МАТЕРИАЛЫ И МЕТОДЫ
Синтез и подготовка образцов гидрогеля. Гидрогель синтезировали в полном соответствии с методикой, описанной в [44]. Полученный сухой гидрогель набухал в двух разных средах: в физиологическом растворе NaCl (8.4 г/л) и дистиллированной воде. Для измерений в потоке электролита необходимо было удалить с поверхности набухшего гидрогеля слабосвязанные полимеры, иными словами, “отмыть” его. Образцы гидрогеля заливали средами в чашках Петри и ставили на 1 ч в шейкер-инкубатор Certomay BS-1 (Sartorius AG, Финляндия) при температуре 30°С, при 90 об./мин. После одного часа среду в чашках обновляли, и образец помещали в те же условия уже на сутки. Несколько образцов были направлены на длительное хранение в тех же средах.
Спектрофотометрия. Для того чтобы проанализировать состав остатков синтеза, вымываемых из сухого геля, измеряли спектры поглощения исходных и вымываемых компонентов гидрогеля. Для экспериментов среды из двух стадий отмывки смешивали. Далее с частью полученной смеси сразу проводили измерения, а часть предварительно пропускали через фильтровальную бумагу с размером пор 3–5 мкм. Растворы ПВС и ксантана готовили так же, как при синтезе гидрогеля. Полный состав подготовленных и проанализированных образцов приведен в табл. 1.
Таблица 1.
Описание образцов для измерения спектров поглощения
| Образец | Состав | Описание |
|---|---|---|
| 1 | ПВС | Взвесь в дистиллированной воде |
| 2 | Взвесь в растворе NaCl | |
| 3 | Водный раствор | |
| 4 | В водный раствор добавлен NaCl в пропорции 8.4 г/л | |
| 5 | Ксантан | Взвесь в дистиллированной воде |
| 6 | Взвесь в растворе NaCl | |
| 7 | Водный раствор | |
| 8 | В водный раствор добавлен NaCl в пропорции 8.4 г/л | |
| 9 | ПЭДОТ ПСС | В дистиллированной воде |
| 10 | В растворе NaCl | |
| 11 | Остатки гидрогеля | Смесь сред (дистиллированной воды), в которых отмывался гидрогель |
| 12 | Фильтрованная смесь сред (дистиллированной воды), в которых отмывался гидрогель | |
| 13 | Смесь сред (раствор NaCl), в которых отмывался гидрогель | |
| 14 | Фильтрованная смесь сред (раствор NaCl), в которых отмывался гидрогель |
В эксперименте использовали спектрофотометр Thermo Genesys 10s Uv-Vis (Thermo Fisher Scientific, США) с ртутной лампой в качестве источника возбуждающего излучения. Поглощение измеряли в диапазоне длин волн от 190 до 1000 нм с разрешением 1 нм в кварцевой кювете толщиной 10 мм.
В качестве одного из инструментов анализа использовали поиск наиболее близких комбинаций спектров к целевому через минимизацию квадратичной функции ошибки. Для большей достоверности применяли два типа линейных моделей: одна допускала константное смещение, вторая – нет. В обоих моделях коэффициенты могли принимать только положительные значения. В каждом эксперименте выбранный набор базисных спектров и целевой спектр разбивали на срезы по шкале длины волны от 200 до 1000 нм с шагом 50 нм, т.е. на срезы 190–200, 190–250, …, 190–1000 нм. На каждом срезе вычисляли коэффициенты линейной модели и значение функции ошибки. Достоверность результатов оценивали по совокупности полученных значений.
Потенциометрия. Фиксацию электрофизических и электрохимических изменений, происходящих в гидрогеле под действием приложенного напряжения, проводили с помощью потенциостата/гальваностата AutoLab PGSTAT204 (Metrohm AG, Швейцария) в воздушной среде при нормальных условиях. Набухший гидрогель помещали в тефлоновую ванну с нихромовыми (никель 80%, хром 20%) электродами (рис. 2). На электроды подавали постоянное напряжение в течение 30 с, далее цепь размыкали и после окончания релаксации разомкнутой системы проводили замер разности потенциалов. Напряжение варьировалось от –0.3 до +0.3 В. На этом же приборе оценивали скорость установления постоянного тока при ступенчатом включении напряжения, при этом подаваемое напряжение случайным образом варьировалось в диапазоне от –0.3 до +0.3 В.
Спектроскопия комбинационного рассеяния света. В следующем эксперименте в тефлоновой камере на электроды подавали напряжение 0.3 В в течение 30, 90 и 300 с. После каждого из указанных временных периодов вдоль образца в трех точках измеряли спектры комбинационного рассеяния света (КРС). Далее вместо периода будем использовать понятие “этап” с нулевого по третий, где нулевой этап будет означать набор спектров гидрогеля в исходном состоянии до включения напряжения. Первая точка измерения находилась на расстоянии 1 мм от катода (–), вторая точка – в центре гидрогеля и третья точка – на расстоянии 1 мм от анода (+). Измерения КРС-спектров проводили на установке Horiba HR800 (Horiba, Франция) в воздушной среде при нормальных условиях. Возбуждающая длина волны He–Ne-лазера составляла 632.8 нм. Возбуждающее излучение фокусировалось на образце объективом с 10-кратным увеличением и с числовой апертурой NA = 0.25. Рассеянное излучение регистрировали с помощью охлаждаемой CCD-камеры. Спектральное разрешение при указанной длине волны возбуждающего излучения – 0.025 нм (<0.55 см–1).
Сглаживание, фильтрацию фона и исключение артефактов в полученных спектрах КРС проводили с использованием методики [44]. Для анализа фазовых пропорций ПЭДОТ при разных степенях окисления в области волновых чисел от 1000 до 1600 нм–1 полученные спектры декомпозировали на 16 линий в четыре итерации. Схожие с работой [44] формы полученных спектров позволили на первой итерации выбрать начальные значения ширин и центров линий КРС с широкими областями оптимизационного поиска. Предполагая, что ширина и тип линий для одного и того же образца на разных этапах изменяются незначительно, на следующих итерациях границы допустимых значений сужались. Линии с 9 по 16 принадлежат Сα=Сβ-колебаниям цепи ПЭДОТ. Для них вычисляли интенсивности, нормированные на суммарную интенсивность всех Сα=Сβ-колебаний.
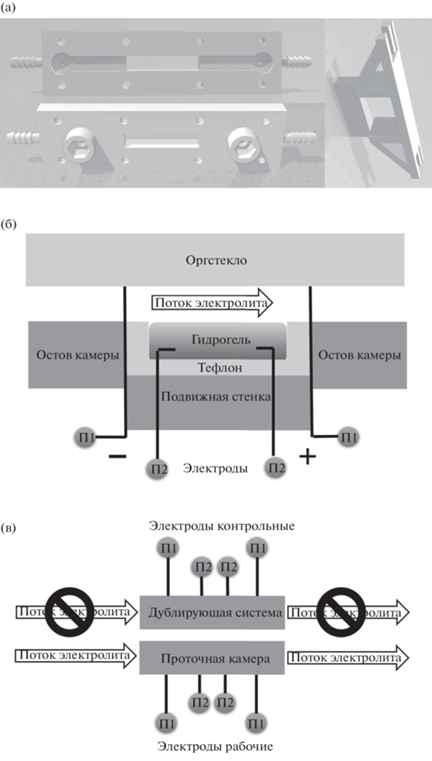
Измерение электрокинетических эффектов. Электрокинетические явления, вызываемые потоком электролита по поверхности гидрогеля, измеряли в созданной проточной камере. Камера напечатана на 3D-принтере методом лазерного спекания из фотополимерной смолы Somos GP Plus. В камере располагался канал шириной 8 мм и толщиной 2 мм. В канале часть стенки длиной 34 мм заменяли на гидрогель, верхнюю часть канала накрывали оргстеклом (рис. 3). В канал были введены две пары измерительных электродов из нихромовой проволоки диаметром 240 мкм. Одна пара электродов выводилась в центр потока до и после гидрогеля, изолированная от него (П1). Вторая пара электродов входила в концы гидрогеля (П2). Первый электрод вдоль потока в П1 и П2 определяли как отрицательный полюс (–). Еще одну конфигурацию (П3) использовали для измерения токов и напряжений между закороченными парами электродов П1 и П2, при этом положительным полюсом (+) была определена П2. Из-за малых значений величин необходимо было точно выделять реальный отклик системы из наводимых шумов и электрохимических процессов, не связанных с включением–выключением потока. Для этого вплотную к проточной камере устанавливали дублирующую систему, в которой отсутствовал поток, а запись показаний проводили одновременно с рабочей камерой. В итоге в одном эксперименте осуществляли одновременную запись с рабочей и контрольной пары электродов, измеряли только ток или только напряжения, измерения вели только в одной конфигурации. Запись показаний вели через плату PCI-6221 (National Instruments, США) с клеммной системой BNC-2111. Чтобы удостовериться в отсутствии вклада от самой камеры, были проведены предварительные эксперименты с цельным каналом и с тефлоновой вставкой на месте гидрогеля.
Рис. 3.
3D-модель проточной камеры (вид сверху и снизу) и элемента подвижной стенки (а); схема измерения электрокинетических эффектов в канале проточной камеры, показаны конфигурации электродов П1 и П2 (б); схема всей экспериментальной установки (в).
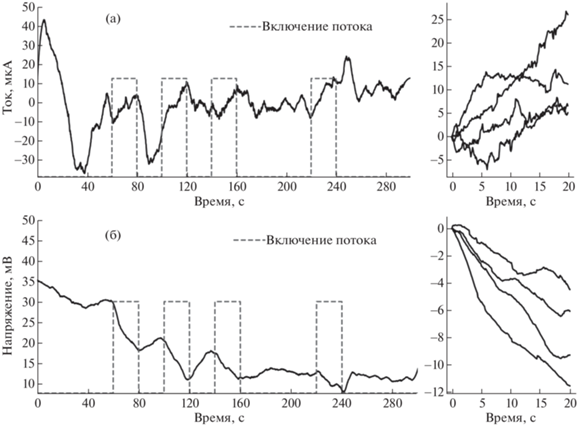
Для того чтобы уловить как можно больше закономерностей, применяли импульсное включение потока со сменой частоты включений. Минимальный период измерений показан на рис. 4. Физраствор прокачивали через камеру шприцевым инфузионным насосом (Dixion, Россия) со скоростью 1800 мл/ч.
Рис. 4.
Примеры одного периода измерений электрокинетических эффектов: а – рост тока через П1, вызванный включением потока электролита; б – падение разности потенциалов на П3, вызванное включением потока электролита; справа от каждого графика изображены скорректированные отрезки величин из периодов включения потока.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Поверхность гидрогеля. Для образцов, находящихся в течение года в отмывочных средах при нормальных условиях, разрушения основного объема зафиксировано не было. Это говорит о том, что в процессе отмывания геля незначительная доля вещества удаляется исключительно с его поверхности.
Главной компонентой спектров поглощения образцов 11 и 12 является спектр поглощения ПСС–, для образцов 13 и 14 – смесь ПСС– и Na‑ПСС с превалирующей второй компонентой [47]. Интенсивность вымывания с поверхности акцепторной цепи ПСС по крайней мере на порядок превышает интенсивность вымывания донорной цепи ПЭДОТ, так как линии ПЭДОТ в области от 400 нм [36, 38, 39, 48, 49] не выходят за пределы приборной погрешности (рис. 5г). Скорее всего ПЭДОТ, связь которого с ПВС была разорвана ионами Na+, образовал более устойчивые комплексы с ксантаном.
Рис. 5.
Графики спектров поглощения исходных и вымытых компонент гидрогеля; график (г) является продолжением графика (в) с увеличением по оси OY в 18 раз.
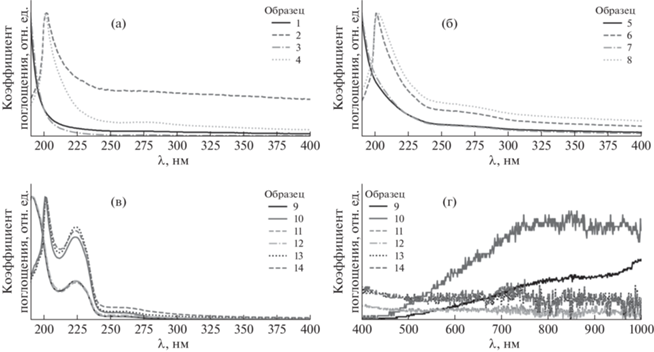
Спектры образцов 12 и 14 наилучшим образом аппроксимируются суммами спектров 7 + 9 и 8 + + 10 соответственно. До уровня приборной погрешности спектры 11 и 13 идеально описываются суммами спектров 3 + 9 + 12 и 10 + 14 соответственно. При этом наблюдалось строгое согласование моделей. Из полученных результатов можно сделать вывод, что как в воде, так и в физрастворе с поверхности гидрогеля вымываются незначительные массы ксантана, ПВС и ПСС, причем основную часть составляет ПСС. Компонент, имеющих спектры образцов 1 и 5, найдено не было, что говорит о растворенном состоянии ПВС и ксантана в составе гидрогеля без образования агрегатов, однако эта гипотеза требует отдельной проверки на наличие нано- или микрочастиц в отмывочных средах.
Спектры КРС и неравномерная дырочная проводимость. В экспериментах с приложенным напряжением к гидрогелю потенциал на электродах перестает изменяться после размыкания цепи через 100 с. После релаксации в гидрогеле наблюдалась остаточная разность потенциалов. Величина остаточного напряжения монотонно изменялась вслед за изменением величины приложенного напряжения, результаты приведены на рис. 6. Предположение об изменении состояния ПЭДОТ ПСС подтверждается КРС-спектрами, однако изменения эти более сложные, чем прямое окисление-восстановление ПЭДОТ на электродах. Важным результатом также стало то, что отличия в спектрах наблюдались только для гидрогеля, набухшего в физрастворе. Результаты декомпозиции спектров представлены в табл. 2, в ней указаны положения вычисленных линий Сα=Сβ-колебаний, виды колебаний и каким степеням окисления цепи ПЭДОТ они соответствуют.
Рис. 6.
Зависимость остаточного напряжения на концах гидрогеля от величины приложенного в течение 30 с напряжения.
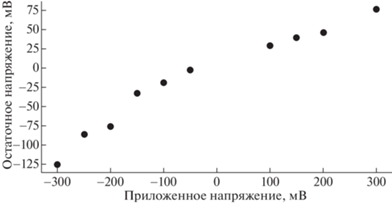
Таблица 2.
Вычисленные компоненты КРС-спектров гидрогелей
| Центр линии, см–1 | Сα=Сβ-растяжение | Состояние цепи ПЭДОТ | Литература |
|---|---|---|---|
| 1400.1 | Симметричное | Полярон | [38, 40] |
| 1424.1 | Нейтральное | [65–67] | |
| 1452.3 | Биполярон | [38, 48, 66] | |
| 1493.8 | Асимметричное | Нейтральное | [38, 65, 66, 68, 69] |
| 1517.3 | Нейтральное | [38, 40, 48, 66–68, 70, 71] | |
| 1537.3 | Биполярон | [40, 66, 72] | |
| 1566.2 | Нейтральное | [66, 67, 70, 72] |
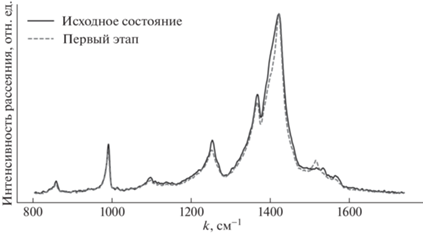
Приложенное напряжение к гидрогелю привело к проявлению линии антисимметричных Сα=Сβ-колебаний восстановленного ПЭДОТ при 1517.3 см–1 и снижению интенсивности линии при 1400.1 см–1, соответствующей ПЭДОТ в состоянии полярона (рис. 7, табл. 2). Описанное качественное изменение спектров гидрогеля сохраняется на втором и третьем этапе. Дальнейший анализ подтвердил, что часть слабо окисленного полиэлектролитным окружением ПЭДОТ при включении напряжения восстанавливается до нейтрального состояния.
Рис. 7.
Усредненные по трем точкам КРС-спектры набухшего в физрастворе гидрогеля в исходном состоянии и после первых 30 с приложенного напряжения (первый этап).
Интенсивности полученных линий в соответствии с табл. 2 разбили на три группы состояния ПЭДОТ, эти группы назовем фазами. Соотношение суммарных интенсивностей фаз не эквивалентно численному соотношению фаз, однако таким методом можно зафиксировать качественные изменения, происходящие в гидрогеле под действием приложенного напряжения. Фазовые соотношения гидрогеля в воде и физрастворе различались. В физрастворе нейтральной фазы ПЭДОТ больше за счет уменьшения фазы биполярона (рис. 8а) из-за связывания ионов Na+ c акцепторной цепью ПСС и ксантаном. В области, близкой к катоду, значительных изменений фазовых соотношений обнаружено не было. В центре геля происходили активные переходы ПЭДОТ от нейтральной к биполяронной фазе и обратно (рис. 8б): увеличение биполяронной фазы после первого этапа, уменьшение после второго, рост после третьего. Хотя после третьего этапа поляронная фаза увеличилась в пределах погрешности, далее будет показано, что это не случайное отклонение. В области, близкой к аноду, при включении напряжения часть поляронов перешла в нейтральную фазу, а после третьего этапа наблюдались значительное уменьшение нейтральной фазы и рост концентраций поляронов и биполяронов (рис. 8в). Более того, рост фазы поляронов и биполяронов от катода к аноду имел монотонный характер (рис. 8г).
Рис. 8.
Усредненный фазовый состав гидрогеля, набухшего в дистиллированной воде и в физиологическом растворе (а); эволюция фазового состава центральной области гидрогеля в физиологическом растворе (б); эволюция фазового состава близкой к аноду области гидрогеля в физиологическом растворе (в); фазовый состав гидрогеля в физиологическом растворе на третьем этапе с образованным градиентом биполяронной фазы ПЭДОТ вдоль образца (г).
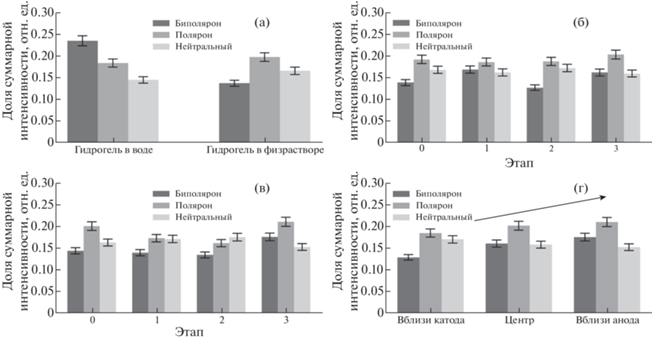
Неизменное состояние проводящего полимера в гидрогеле, набухшего в дистиллированной воде, указывает на ключевую роль подвижных ионов Na+Cl- в наблюдаемых явлениях. Под действием напряжения распределение ионов внутри гидрогеля изменялось. Избыток ионов Na+, формирующийся ближе к катоду, при текущих концентрациях не был способен значительно повлиять на состояние цепи ПЭДОТ. Ионное обеднение в центральной части геля создало условия, наиболее приближенные к водному раствору ПЭДОТ ПСС, для которого характерна более окисленная форма, чем в физрастворе. Преобладание ионов Cl– в области анода частично нивелировало эффект связывания ионов Na+ с акцепторной цепью ПСС, вызывая окисление ПЭДОТ. После выключения внешнего источника концентрации ионов выровнялись, а фазовый состав ПЭДОТ ПСС остался измененным. В итоге в гидрогеле остался градиент биполяронной фазы от катода к аноду, т.е. в геле присутствовал градиент носителей заряда (дырок). Это неравномерное распределение дырочной проводимости и было источником остаточного напряжения, наблюдаемого в эксперименте на потенциостате/гальваностате.
Электрокинетический эффект. Измерения в конфигурации П2 осложнялись внешними шумами и разнообразными электрофизическими процессами, происходящими в гидрогеле, поэтому выделить какую-либо тенденцию прямым измерением не удалось. Измерения на П1 и П3, напротив, дали согласованные результаты. Включение потока в обеих конфигурациях вызывало монотонный рос токов и напряжений (рис. 4).
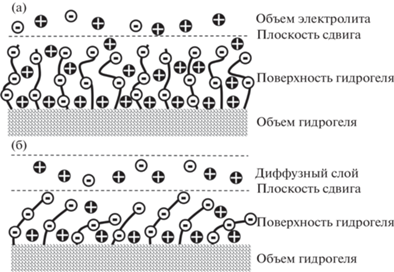
Полученный эффект примечателен тем, что в системах с твердой поверхностью потенциал потока возникает практически мгновенно [30, 43, 50, 51]. При этом экспериментально определенное время переходных процессов при подаче на гидрогель ступенчатой нагрузки не превысило пяти секунд, а периоды импульсов в эксперименте c потоком варьировались от 20 до 1000 с. Поверхность гидрогеля представляет собой “лес” из концов входящих в состав полимеров (рис. 9), а именно ПВС, ксантана и ПСС. На данный момент точно не известно, из каких полимеров состоит этот “лес” [37, 52–54], но нет сомнений в том, что полимерные хвосты в нем заряжены отрицательно и имеют отрицательный ζ-потенциал [47, 55–60] за счет диссоциации ионогенных групп. Судя по полученным данным, в момент включения потока ζ-потенциал поверхности гидрогеля близок к нулю. Далее поток начинал “прижимать” хвосты к поверхности, т.е. поверхность стремилась приблизиться по структуре к основному объему. Таким образом постепенно формировалась отрицательно заряженная плоская поверхность, вследствие чего нарастал потенциал потока на П1. Полярность наблюдаемого потенциала потока соответствовала этой теории. По мере того как формировалась указанная отрицательная поверхность, в объеме гидрогеля должны были перераспределяться положительные заряды для экранирования этого слоя. Положительными зарядами могли выступать как ионы Na+, так и биполяроны ПЭДОТ. Оба этих варианта согласуются с обратными знаками растущих токов и напряжений на П3. В дальнейших работах планируется с помощью описанного метода КРС-спектроскопии точно установить участие окислительно-восстановительных процессов цепи ПЭДОТ в наблюдаемых эффектах на П3.
Рис. 9.
Схематичное изображение структуры нейтральной поверхности гидрогеля (а) и заряженной отрицательно поверхности в присутствии потока (б).
Практическая значимость наблюдаемого эффекта выражается в единицах мощности, которые способна вырабатывать такая установка. Оценка средней мощности за период проводилась с допущением, что условия, в которых измерялись генерируемые ток и напряжение, были одинаковы. Таким образом, с учетом корректировок и поправок на шум за 20 с П1 выдавала в среднем 1–12 нВт, П3 – 30–10 нВт. Наибольшая длительность импульса, которую допускало оборудование, составляла 1000 с, на этом интервале П3 выдавала в среднем 184–100 нВт. Этим мощностям не хватает еще одного порядка до возможности быть единственным источником для каких-либо реальных имплантируемых устройств, однако уже ясна перспективность такого варианта генерации. Во-первых, во время самого длительного импульса предел роста токов/напряжений не наблюдался, т.е. полученные цифры не являются предельными для представленной установки. Во-вторых, эффективность можно значительно повысить, если использовать более физиологичную форму, т.е. цилиндрический канал или, как минимум, плоский канал из двух гелевых стенок. В-третьих, в реальных кровеносных каналах, сравнимых по площади сечения с каналом в установке, средняя скорость потока может быть больше на порядок [61–64]. Кроме того, если удастся доказать влияние электрокинетического эффекта на степень окисления ПЭДОТ, то гидрогель в нем будет играть роль не только генерирующего элемента, но и аккумулятора.
ЗАКЛЮЧЕНИЕ
С поверхности набухшего гидрогеля во время первого набухания в воде или физрастворе вымываются слабо связанные волокна ПСС, а также незначительные доли ксантана и ПВС. Разность потенциалов, приложенная к набухшему в физрастворе гидрогелю, может формировать градиент дырочной проводимости вдоль приложенного поля. Под действием электрического поля перераспределение подвижных ионов в объеме вызывает неравномерное окисление цепей ПЭДОТ.
Продемонстрировано наличие электрокинетического эффекта в потоке электролита по поверхности гидрогеля и предложено объяснение наблюдаемых особенностей этого эффекта. Из трех возможных конфигураций электродов две подходят для прямой конвертации электроэнергии в представленном прототипе устройства. Показана перспективность предложенного подхода генерации электроэнергии для имплантируемых устройств.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 20-32-90221, “Аспиранты”).
Список литературы
Arabía F.A. // Cardiol. Rev. 2020. V. 28. № 6. P. 275. https://doi.org/10.1097/CRD.0000000000000322
Fitzpatrick D. Implantable electronic medical devices. San Diego: Academic Press, 2015. 183 p. https://doi.org/10.1016/c2012-0-07670-3
Guerci B., Bourgeois C., Bresler L. et al. // Diabetes Metab. J. 2012. V. 38. № 5. P. 393. https://doi.org/10.1016/j.diabet.2012.05.001
Sterman J., Cunqueiro A., Dym J.R. et al. // RadioGraphics. 2019. V. 39. № 4. P. 1056. https://doi.org/10.1148/rg.2019180088
Van Caenegem O., Jacquet L.M. // Regenerative Medicine Applications in Organ Transplantation / Eds. Orlando G. et al. London: Academic Press, 2014. P. 425. https://doi.org/10.1016/B978-0-12-398523-1.00029-X
Malchesky P.S. // Artif. Organs. 2020. V. 44. № 3. P. 314. https://doi.org/10.1111/aor.13650
Mitchell-Innes A., Saeed S.R., Irving R. // Adv. Otorhinolaryngol. 2018. V. 81. P. 105. https://doi.org/10.1159/000485540
Edwards C.A., Kouzani A., Lee K.H., Ross E.K. // Mayo Clin. Proc. 2017. V. 92. № 9. P. 1427. https://doi.org/10.1016/j.mayocp.2017.05.005
Patel S.H., Halpern C.H., Shepherd T.M., Timpone V.M. // J. Neuroradiol. 2017. V. 44. № 3. P. 175. https://doi.org/10.1016/j.neurad.2016.12.005
Rhodes R.M., Tsai Do B.S. // Otolaryngol. Clin. North Am. 2019. V. 52. № 2. P. 363. https://doi.org/10.1016/j.otc.2018.11.017
Yoon H.J., Kim S.W. // Joule. 2020. V. 4. № 7. P. 1398. https://doi.org/10.1016/j.joule.2020.05.003
Dagdeviren C., Li Z., Wang Z.L. // Annu. Rev. Biomed. Eng. 2017. V. 19. № 1. P. 85. https://doi.org/10.1146/annurev-bioeng-071516-044517
Nasiri A., Zabalawi S.A., Jeutter D.C. // IEEE Trans. Power Electron. 2011. V. 26. № 1. P. 192. https://doi.org/10.1109/TPEL.2010.2055891
Meninger S., Mur-Miranda J.O., Amirtharajah R. et al. // IEEE Trans. Very Large Scale Integr. Syst. 2001. V. 9. № 1. P. 64. https://doi.org/10.1109/92.920820
Marioli D., Sardini E., Serpelloni M. // IEEE International Symposium on Medical Measurements and Applications. 2015. P. 462. https://doi.org/10.1109/MeMeA.2015.7145248
Boisseau S., Despesse G., Seddik B.A. // Small-Scale Energy Harvesting / Eds. Lallart M. London: IntechOpen, 2012. P. 92. https://doi.org/10.5772/51360 1
Wang Y., Wang H., Xuan J. et al. // Biosens. Bioelectron. 2020. V. 166. № 112410. P. 1. https://doi.org/10.1016/j.bios.2020.112410
Kwon C.H., Ko Y., Shin D. et al. // Nat. Commun. 2018. V. 9. № 4479. P. 1. https://doi.org/10.1038/s41467-018-06994-5
Sharma A., Singh G., Kumar Arya S. // Int. J. Hydrogen Energy. 2021. V. 46. № 4. P. 3270. https://doi.org/10.1016/j.ijhydene.2020.02.164
Pankratov D., Ohlsson L., Gudmundsson P. et al. // RSC Adv. 2016. V. 6. № 74. P. 70215. https://doi.org/10.1039/c6ra17122b
Mercier P.P., Lysaght A.C., Bandyopadhyay S. et al. // Nat. Biotechnol. 2012. V. 30. № 12. P. 1240. https://doi.org/10.1038/nbt.2394
Kumar P.M., Babu V.J., Subramanian A. et al. // Designs. 2019. V. 3. № 22. P. 1. https://doi.org/10.3390/designs3020022
Yan J., Liao X., Yan D. et al. // J. Microelectromech. Syst. 2018. V. 27. № 1. P. 1. https://doi.org/10.1109/JMEMS.2017.2782748
Zhang M., Tian Y., Xie H. et al. // Int. J. Heat Mass Transf. 2019. V. 137. P. 1183. https://doi.org/10.1016/j.ijheatmasstransfer.2019.03.155
Xue S., Tan C., Kandlakunta P. et al. // Nucl. Instrum. Methods Phys. Res. A. 2019. V. 927. P. 133. https://doi.org/10.1016/j.nima.2019.01.097
Bormashov V.S., Troschiev S.Y., Tarelkin S.A. et al. // Diam. Relat. Mater. 2018. V. 84. № 2017. P. 41. https://doi.org/10.1016/j.diamond.2018.03.006
Parsonnet V., Driller J., Cook D. et al. // Pacing Clin. Electrophysiol. 2006. V. 29. № 2. P. 195. https://doi.org/10.1111/j.1540-8159.2006.00317.x
Prelas M.A., Weaver C.L., Watermann M.L. et al. // Prog. Nucl. Energy. 2014. V. 75. P. 117. https://doi.org/10.1016/j.pnucene.2014.04.007
Xu W., Zheng H., Liu Y. et al. // Nature. 2020. V. 578. № 7795. P. 392. https://doi.org/10.1038/s41586-020-1985-6
Fan B., Bhattacharya A., Bandaru P.R. // Nat. Commun. 2018. V. 9. № 4050. P. 1. https://doi.org/10.1038/s41467-018-06297-9
Caro C.G., Pedley T.G., Schroter R.C., Seed W.A. The mechanics of the circulation. Oxford: Oxford University Press, 1978. 527 p.
Hladky S.B., Barrand M.A. // Fluids Barriers CNS. 2014. V. 11. № 26. P. 1. https://doi.org/10.1186/2045-8118-11-26
Kumar B., Kashyap N., Avinash A. et al. // Int. J. Contemp. Dent. Med. Rev. 2017. https://doi.org/10.15713/ins.ijcdmr.121
Chang-Tseng R., Chen C.-C., Hsu S.-M. et al. // Sensors. 2018. V. 18. № 8. P. 2651. https://doi.org/10.3390/s18082651
Guerreiro P.M., Bataille A.M., Parker S.L. et al. // Am. J. Physiol. 2014. V. 306. № 11. P. 1275. https://doi.org/10.1152/ajprenal.00458.2013
Yuk H., Lu B., Zhao X. // Chem. Soc. Rev. 2019. V. 48. № 6. P. 1642. https://doi.org/10.1039/c8cs00595h
Yemata T.A., Zheng Y., Ko A. et al. // Mater. Adv. 2020. V. 1. № 9. P. 3233. https://doi.org/10.1039/D0MA00522C
Garreau S., Louarn G., Buisson J.P. et al. // Macromolecules. 1999. V. 32. № 20. P. 6807. https://doi.org/10.1021/ma9905674
Zozoulenko I.V., Singh A., Singh S.K. et al. // ACS Appl. Polym. Mater. 2019. V. 1. № 1. P. 83. https://doi.org/10.1021/acsapm.8b00061
Garreau S., Duvail J.L., Louarn G. // Synth. Met. 2002. V. 125. № 3. P. 325. https://doi.org/10.1016/S0379-6779(01)00397-6
Sun K., Zhang S., Li P. et al. // J. Mater. Sci. Mater. Electron. 2015. V. 26. P. 4438. https://doi.org/10.1007/s10854-015-2895-5
Fiumefreddo A., Utz M. // Macromolecules. 2010. V. 43. № 13. P. 5814. https://doi.org/10.1021/ma100565s
Liu K., Ding T., Mo X. et al. // Nano Energy. 2016. V. 30. P. 684. https://doi.org/10.1016/j.nanoen.2016.10.058
Bolshin D.S., Kashkarov P.K. // Nanobiotechnology Reports. 2022. V. 17. № 3. P. 380.
Wang X., Feng G., Li M. et al. // Polym. Bull. 2019. V. 76. P. 2097. https://doi.org/10.1007/s00289-018-2459-y
Agua I., Marina S., Pitsalidis C. et al. // ACS Omega. 2018. V. 3. № 7. P. 7424. https://doi.org/10.1021/acsomega.8b00458
Mehrdad A., Parvini E. // J. Solution Chem. 2017. V. 46. P. 908. https://doi.org/10.1007/s10953-017-0608-9
Łapkowski M., Proń A. // Synth. Met. 2000. V. 110. № 1. P. 79. https://doi.org/10.1016/S0379-6779(99)00271-4
Zhao Q., Jamal R., Zhang L. et al. // Nanoscale Res. Lett. 2014. V. 9. № 1. P. 557. https://doi.org/10.1186/1556-276X-9-557
Cheedarala R.K., Shahriar M., Ahn J.H. et al. // Nano Energy. 2019. V. 65. № 104017. P. 1. https://doi.org/10.1016/j.nanoen.2019.104017
Yin J., Li X., Yu J. et al. // Nat. Nanotechnol. 2014. V. 9. P. 378. https://doi.org/10.1038/nnano.2014.56
Lowry G.V., Hill R.J., Harper S. et al. // Environ. Sci. Nano. 2016. V. 3. № 5. P. 953. https://doi.org/10.1039/C6EN00136J
Gombert Y., Simic R., Roncoroni F. et al. // Adv. Mater. 2019. V. 6. № 1901320. P. 1. https://doi.org/10.1002/admi.201901320
Shoaib T., Espinosa-Marzal R.M. // Colloids Interfaces. 2020. V. 4. № 4. P. 54. https://doi.org/10.3390/colloids4040054
Drechsler A., Frenzel R., Caspari A. et al. // Colloid Polym. Sci. 2019. V. 297. P. 1079. https://doi.org/10.1007/s00396-019-04528-z
Wisniewska M., Ostolska I., Szewczuk-Karpisz K. et al. // J. Nanoparticle Res. 2015. V. 17. № 12. P. 1. https://doi.org/10.1007/s11051-014-2831-2
Takahashi D., Ikeda J., Nihara J. et al. // Acta Sci. Microbiol. 2019. V. 2. № 7. P. 36. https://doi.org/10.31080/ASMI.2019.02.0269
Fan X., Niu L., Xia Z. // Colloid Polym. Sci. 2014. V. 292. P. 3251. https://doi.org/10.1007/s00396-014-3377-7
Harris C.M., Miller S.G., Andresen K. et al. // J. Colloid Interface Sci. 2018. V. 510. P. 39. https://doi.org/10.1016/j.jcis.2017.08.085
De la Cruz E.F., Zheng Y., Torres E. et al. // Int. J. Electrochem. Sci. 2012. V. 7. № 4. P. 3577.
Rogers K. The Cardiovascular System. New York: Britannica Educational Publishing, 2010. 248 p.
Hill E.C., Housh T.J., Smith C.M. et al. // J. Med. Ultrasound. 2018. V. 26. № 4. P. 186. https://doi.org/10.4103/JMU.JMU_20_18
Scheel P., Ruge C., Schöning M. // Ultrasound Med. Biol. 2000. V. 26. № 8. P. 1261. https://doi.org/10.1016/S0301-5629(00)00293-3
Mohammadkarim A., Mokhtari-Dizaji M., Kazemian A. et al. // Ultrasonography. 2018. V. 37. № 1. P. 43. https://doi.org/10.14366/usg.17016
Louarn G., Buisson J.P., Lefrant S. et al. // J. Phys. Chem. 1995. V. 99. № 29. P. 11399. https://doi.org/10.1021/j100029a016
Almeida P.V., Izumi C.M.S., Dos Santos H.F. et al. // Quim. Nova. 2019. V. 42. № 9. P. 1073. https://doi.org/10.21577/0100-4042.20170417
Tran-Van F., Garreau S., Louarn G. et al. // J. Mater. Chem. 2001. V. 11. № 5. P. 1378. https://doi.org/10.1039/b100033k
Garreau S., Louam G., Lefrant S. et al. // Synth. Met. 1999. V. 101. № 1. P. 312. https://doi.org/10.1016/S0379-6779(98)01146-1
Duvail J.L., Rétho P., Garreau S. et al. // Synth. Met. 2002. V. 131. № 1. P. 123. https://doi.org/10.1016/S0379-6779(02)00195-9
Tamburri E., Orlanducci S., Toschi F. et al. // Synth. Met. 2009. V. 159. № 5–6. P. 406. https://doi.org/10.1016/j.synthmet.2008.10.014
Chiu W.W., Travaš-Sejdić J., Cooney R.P. et al. // J. Raman Spectrosc. 2006. V. 37. № 12. P. 1354. https://doi.org/10.1002/jrs.1545
Ely F., Matsumoto A., Zoetebier B. et al. // Org. Electron. 2014. V. 15. № 5. P. 1062. https://doi.org/10.1016/j.orgel.2014.02.022
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии