Российские нанотехнологии, 2022, T. 17, № 6, стр. 811-822
ХАРАКТЕРИСТИКИ БЕЛКОВОГО ПОКРЫТИЯ И ФУНКЦИОНАЛЬНЫЕ СВОЙСТВА НАНОЧАСТИЦ СУЛЬФИДА КАДМИЯ, ПОЛУЧЕННЫХ МИКРОБНЫМ СИНТЕЗОМ
Т. А. Воейкова 1, *, О. А. Журавлева 1, Н. В. Булушова 1, В. С. Кулигин 1, С. Н. Малахов 1, В. Г. Дебабов 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: voeikova.tatyana@yandex.ru
Поступила в редакцию 11.04.2022
После доработки 11.04.2022
Принята к публикации 27.04.2022
Аннотация
Представлены данные о решающем влиянии бактериальных штаммов Shewanella oneidensis MR-1 (грам–) и Bacillus subtilis 168 (грам+), использованных для биосинтеза NPsCdS, на количественный и качественный состав белкового покрытия и функциональные характеристики наноматериала, такие как биоцидная и фотокаталитическая активности. Новизной исследования является количественная оценка белков, адсорбированных на поверхности NPsCdS/Shewanella, NPsCdS/Bacillus. Показано, что содержание белка на поверхности NPsCdS/Shewanella и NPsCdS/Bacillus существенно различается и составляет 34 и 5% от общего массы наночастиц соответственно. Подтверждено принципиальное отличие в качественном составе “белковой короны” NPsCdS/Shewanella, NPsCdS/Bacillus. Наличие азотсодержащих органических соединений белковой природы на поверхности наночастиц подтверждено методом ИК-фурье-спектроскопии. Доказана возможность использования биогенных NPsCdS в отношении широкого круга микроорганизмов в качестве биоцидных агентов нового поколения, а также фотонанокатализаторов для обесцвечивания синтетических красителей. Установлено различие в уровне функциональной активности NPsCdS в зависимости от использованного для их биосинтеза штамма, показана более высокая биоцидная и фотокаталитическая активность NPsCdS/Bacillus по сравнению с NPsCdS/Shewanella. Продемонстрирована необходимость отбора бактериальных штаммов для получения наночастиц с высокой функциональностью.
ВВЕДЕНИЕ
Наночастицы (НЧ) сульфида кадмия (NPsCdS) относятся к полупроводниковым наноматериалам с уникальными свойствами и активно применяются в различных областях промышленности [1, 2].
Существуют различные физические и химические методы получения NPsCdS, которые зачастую трудоемки и энергозатратны, негативно влияют на состояние окружающей среды и здоровье человека [3, 4]. Дополнением и альтернативой физико-химическим методам может стать “зеленый” синтез NPsCdS – экологически чистый, масштабируемый, дешевый, не требующий сложных условий синтеза [5–7]. В случае биосинтеза NPsCdS взаимодействие солей-прекурсоров химических соединений приводит к образованию наноразмерных структур с последующей стабилизацией бактериальными биополимерами – белками, полисахаридами, фосфорсодержащими молекулами, адсорбирующимися на их поверхности. Рассматривается возможность использования биогенных NPsCdS в качестве антибактериальных и противоопухолевых [8, 9], противогрибковых [10] средств, а также фотонанокатализаторов для обесцвечивания различных синтетических красителей [11, 12]. Биогенные НЧ во многом сопоставимы по своим характеристикам и свойствам с наноматериалами, полученными физико-химическими методами, а в ряде случаев и превосходят таковые [13, 14].
Состав биополимеров, адсорбированных на поверхности биогенных НЧ, и его количественная характеристика во многом определяют свойства наноматериала, их функциональную значимость, возможность совместимости с биологическими объектами. При бактериальном синтезе НЧ формирование стабилизирующего слоя происходит за счет адсорбции молекул, продуцируемых микроорганизмами и называемых “внеклеточным полимерным веществом” (extracellular polymer substance, EPS), на поверхность НЧ. Белковые молекулы, входящие в состав EPS, могут служить сайтами связывания для различных ионов металлов, способствовать ассоциации НЧ с другими биомолекулами и формировать “белковую корону” НЧ [15].
В публикациях редко встречается качественный и количественный состав “белковой короны” НЧ, синтезированных с использованием бактерий разных видов [16, 17]. Недавно был представлен протеомный анализ белков с поверхности NPsAg, полученных c использованием гриба Macrophomina. Были идентифицированы сигнальные пептиды секреции ферментов амилазы, пептидазы, хитиназы, лакказы [18]. Интересное развитие приобретают исследования по изучению состава “белковой короны” при взаимодействии NPsAu и NPsAg с плазмой крови человека [19]. Показано, что существует селективность связывания определенных белковых молекул плазмы крови с поверхностью НЧ. Механизм избирательного связывания биомолекул с наноматериалом не ясен и требует изучения. Эти результаты нашли применение в медицинских приложениях по использованию наноматериала для ранней диагностики рака и других заболеваний. Среди недавних открытий представлена концепция, согласно которой состав “белковой короны”, окружающей наноматериал в жидкостях организма, является персонализированным. То есть НЧ, инкубированные с белками плазмы крови индивидуумов с различными физиологическими состояниями, адсорбируют на своей поверхности различные наборы белковых молекул. В частности, “белковая корона” больных раком значительно отличается от таковой у здоровых людей [20, 21]. Разработка и применение НЧ в качестве инструментов для диагностики заболеваний имеют важное научное и практическое значение.
Изменения в составе белков “короны”, их количественная характеристика могут значительно влиять на функции наноматериала. В связи с чем в настоящем исследовании сделан акцент на анализ качественного и количественного состава белков на поверхности НЧ сульфидов металлов, полученных с использованием различных штаммов бактерий, и оценку его влияния на характеристики и функциональные свойства наноматериала, такие как биоцидная и фотокаталитическая активности.
Был исследован состав “белковой короны” NPsCdS и NPsAg2S, полученных с использованием грам(–) бактерий Shewanella oneidensis MR-1 и грам(+) Bacillus subtilis 168 (NPsCdS/Shewanella и NPsAg2S/Shewanella; NPsCdS/Bacillus и NPsAg2S/Bacillus). Показано, что набор белковых молекул на поверхности НЧ уникален и определяется бактериальным штаммом, использованным в биосинтезе. Так, на поверхности NPsCdS/Shewanella и NPsAg2S/Shewanella было обнаружено более 10 видов белков, принадлежащих к белкам внешней или цитоплазматической мембраны бактерии, тогда как NPsCdS/Bacillus и NPsAg2S/Bacillus содержали на поверхности единственный белок флагеллин, входящий в состав жгутиков бактерии [22, 23]. Установлено, что NPsCdS/Shewanella и NPsCdS/Bacillus различаются по физико-химическим и оптическим характеристикам, таким как гидродинамический диаметр, величина ζ-потенциала, интенсивность флуоресценции [23].
Цель настоящей работы – получение количественных и подтверждение качественных характеристик белкового покрытия NPsCdS/Shewanella и NPsCdS/Bacillus и определение соотношения белков в обоих типах NPsCdS. Определение элементного состава NPsCdS для установления доли CdS и органического компонента в зависимости от бактериального штамма. Исследование функциональных свойств NPsCdS/Shewanella и NPsCdS/Bacillus, таких как биоцидная и фотокаталитическая активность. Оценка влияния штаммов микроорганизмов на свойства НЧ с целью получения наноматериала с высокой функциональной активностью. Практическая значимость исследования заключается в возможности применения биогенных NPsCdS в качестве противомикробных агентов нового поколения в отношении широкого спектра микроорганизмов, а также фотонанокатализаторов для обесцвечивания синтетических органических красителей.
МЕТОДЫ
Материалы
Штаммы грамотрицательной Shewanella oneidensis МР-1 (В-9861) и грамположительной Bacillus subtilis 168 (В-7360) бактерий, использованные для биосинтеза NPsCdS, и тест-культуры грам(+) бактерий Bacillus licheniformis (B-10956), Enterococcus faecalis (B-12629), грам(–) Escherichia coli K‑12 (B-3345), Pseudomonas putida (B-4492), дрожжей Saccharomyces cerevisiae (Y-3251) и Candida albicans (Y-3108) для определения биоцидной активности NPsCdS были предоставлены Национальным биоресурсным центром Всероссийской коллекции промышленных микроорганизмов НИЦ “Курчатовский институт”.
Питательная среда Luria-Bertani в агаризованной (LBΑ) и жидкой (LB) формах для культивирования S. oneidensis, B. subtilis, B. licheniformis, E. coli, P. putida: агар (Sigma-Aldrich, США), триптон, дрожжевой экстракт, хлорид натрия (Panreac, Испания). Для выращивания E. faecalis использовали готовую среду Brain Heart Infusion (Fluka, Индия). Дрожжевые культуры S. cerevisiae, C. albicans культивировали на среде, г/л: глюкоза, 20 (Реахим, Россия), пептон, 10 (Becton Dickinson, США), дрожжевой экстракт, 5 (Panreac, Испания). Агаризованные среды содержали (г/л): агар, 20 (Panreac, Испания). Все среды готовили в соответствии с [24].
Соли сульфида натрия, Na2S⋅9H2O и хлорида кадмия, CdCl2⋅2.5H2O (Panreac, Испания, ч.д.а.).
Водные растворы красителей метиленового синего (MС), ч.д.а (Реахим, Россия) и бриллиантового зеленого (БЗ), 90% (Sigma-Aldrich, США) готовили в концентрации 25 мг/л (25 ppm).
Питательные среды, водные растворы реакционных солей и красителей готовили на деионизированной воде Milli Q (Millipore, США).
Бактериальный синтез NPsCdS
Биосинтез NPsCdS/Shewanella и NPsCdS/Bacillus проводили по оптимизированной методике [25]. Для биосинтеза NPsCdS использовали клетки штаммов S. oneidensis и B. subtilis в стационарной фазе роста (20–24 ч) в соответствии с разработанным протоколом [26].
Характеристики биогенных NPsCdS
Просвечивающая электронная микроскопия (ПЭМ). Форму и размер NPsCdS/Shewanella и NPsCdS/Bacillus определяли с помощью просвечивающего электронного микроскопа JEM-2100 (JEOL Ltd., Япония) при ускоряющем напряжении 200 кВ. Диаметр биогенных NPsCdS оценивали с использованием программного обеспечения (ПО) ImageJ, измеряя наименьший и наибольший линейный размер 80–100 NPs на ПЭМ-изображениях. Гистограммы распределения NPsCdS/Shewanella и NPsCdS/Bacillus по размерам были построены в Microsoft Office Excel 2016 с применением программного пакета статистического анализа.
ИК-спектроскопию выполняли при помощи ИК-фурье-спектрометра (FTIR) ThermoFisher Scientific Nicolet iS50 с использованием встроенного модуля нарушенного полного внутреннего отражения (НПВО). Съемку проводили в области 550–4000 см–1, число сканов – 64. При этом водную суспензию образцов NPsCdS наносили непосредственно на поверхность алмазного НПВО-кристалла, высушивали на воздухе, после чего проводили регистрацию FTIR-спектра.
Энергодисперсионная рентгеновская спектроскопия (EDX). Определение элементного состава образцов NPsCdS выполняли с использованием растрового электронного микроскопа Phenom XL при ускоряющем напряжении 15 кВ и давлении в рабочей камере 0.1 Па.
Гравиметрический метод определения концентрации NPsCdS. Водную суспензию каждого образца NPsCdS наносили на пять покровных стекол, высушенных до постоянной массы в лабораторном эксикаторе с гранулированным хлористым кальцием, по 200 мкл на стекло. Стекла с нанесенными суспензиями NPsCdS подсушивали на воздухе и переносили в эксикатор. После установления постоянной массы стекол рассчитывали разницу между усредненными значениями масс стекол с НЧ и массой исходных стекол, определяли общую массу NPsCdS в перерасчете на 1 мл водной суспензии. Оптическую плотность (ОП) исходных образцов измеряли с учетом разбавления суспензий с помощью фотоколориметра КФК-3КМ (Юнико-Сис, Россия) при длине волны 440 нм. Для установления корреляции между значениями OП и концентрациями NPsCdS в водных суспензиях были построены соответствующие калибровочные кривые.
Методы анализа состава “белковой короны” NPsCdS
Денатурирующее электрофоретическое разделение белков в 12.5%-ном полиакриламидном геле (SDS-ПААГ) использовали для анализа молекулярной массы (ММ) белковых молекул, присутствующих в культуральной жидкости (КЖ) и адсорбированных на поверхности NPsCdS/Shewanella, NPsCdS/Bacillus [27]. Образцы КЖ или водных суспензий NPsCdS (20 мкл) смешивали с равным объемом двукратного буфера Sample Buffer, кипятили на водяной бане в течение 5 мин и в объеме 4 мкл вводили в лунки геля. В качестве стандартов ММ белков использовали предокрашенные белковые маркеры № 26612 (Thermo Fisher Scientific, США). Заливку геля, нанесение образцов, проведение электрофореза, фиксирование, окрашивание и отмывку геля проводили в соответствии с руководствами Bio-Rad и Fermentas по проведению гель-электрофореза (Mini-PROTEAN Tetra Cell Instruction Manual).
Метод денситометрического анализа электрофореграмм с помощью ПО TotalLabPhoretix 1D применяли для количественной характеристики содержания белка, адсорбированного на поверхности биогенных NPsCdS. Для этого предварительно проводили электрофоретическое разделение белков методом SDS-ПААГ. В качестве белка-стандарта с известной концентрацией использовали рибонуклеазу с ММ 14 кДа. Для получения электрофореграммы окрашенный гель фотографировали на цифровую фотокамеру и, используя программный пакет просмотра, редактирования и конвертирования изображений FSViewer, фотографию электрофореграммы переводили в 8-битный формат, совместимый с ПО для денситометрического анализа. Полученные для рибонуклеазы данные денситометрического анализа применяли для подбора уравнения, описывающего зависимость интенсивности прокрашивания полос в контрольных пробах от количества нанесенного белка, после чего определяли интенсивность окрашивания всех полос в образцах NPsCdS/Shewanella, NPsCdS/Bacillus. Данные сохраняли в виде изображения с выделенными полосами и расчетной электронной таблицы Microsoft Excel 2016, включающей в себя числовые данные интенсивности всех полос в пробах образцов в условных единицах (у.е.). Используя полученное для калибровочной кривой уравнение и значения интенсивности окрашенных полос электрофореграммы, рассчитывали содержание белка в каждой выявленной полосе и определяли суммарную величину содержания белка в треке электрофореграммы.
Метод Бредфорда с использованием набора Bio-Rad Protein Assay (Bio-Rad Laboratories GmbH, Германия) [28] применяли для определения концентрации белка в КЖ и на поверхности NPsCdS/Shewanella, NPsCdS/Bacillus. В качестве стандарта использовали бычий сывороточный альбумин (Sigma-Aldrich, США). Для экстрагирования белка с поверхности NPsCdS и последующего измерения его количества к раствору НЧ добавляли 8 М мочевины, содержащей 5% меркаптоэтанола. Пробу инкубировали при 100°С в течение 5 мин, центрифугировали (16 400 об./мин), надосадочную жидкость отбирали для измерения концентрации белка. Полноту экстракции белка с поверхности NPsCdS проверяли электрофоретически методом SDS-ПААГ.
Методы оценки биоцидной активности NPsCdS
Метод диффузии НЧ в агар, содержащий клетки тест-культур микроорганизмов, проводили, основываясь на [29]. Предварительно тест-культуры микроорганизмов B. licheniformis, E. faecalis, E. coli, P. putida, S. cerevisiae, C. albicans выращивали при оптимальной температуре роста в течение 24 ч в чашках Петри с соответствующими питательными средами (разд. “Материалы”), эти же среды, но с уменьшенным содержанием агара использовали для оценки биоцидной активности NPsCdS. Биомассу каждой тест-культуры из чашки Петри переносили микробиологической петлей в пробирку со стерильной деионизированной водой (титр клеток ~1 × 109 кл/мл), суспензировали и затем 1 мл клеточной суспензии вносили в 40 мл расплавленной полуостывшей питательной среды, содержащей 8 г/л агара. Смесь равномерно разливали по чашкам Петри, затем в толще агара стерильным металлическим пробойником делали лунки (диаметр 8 мм). В каждую лунку вносили по 50 мкл суспензии NPsCdS/Shewanella и NPsCdS/Bacillus в исходной концентрации 3 мг/мл и разведенной в 2 раза (1.5 мг/мл), после чего инкубировали 24 ч при оптимальной температуре роста тест-культуры. В качестве контроля использовали стерильную деионизированную воду (50 мкл).
Минимальная ингибирующая концентрация (МИК) NPsCdS/Shewanella и NPsCdS/Bacillus была определена в отношении тест-культуры B. licheniformis методом серийных разведений на LBA-среде описанным выше методом диффузии в агар. Исходные суспензии NPsCdS в одинаковой концентрации (5.8 мг/мл) разводили водой Milli Q в диапазоне 1:10, 1:50, 1:100 раз. Биоцидную активность NPsCdS оценивали по величине зоны подавления роста тест-культур, эксперименты повторяли трехкратно. Статистическую обработку данных проводили с помощью MS Excel 2016 для малой выборки, результаты представляли в виде среднего значения ± стандартное отклонение.
Фотокаталитическая активность NPsCdS/Shewanella и NPsCdS/Bacillus
Фотокаталитическую активность NPsCdS изучали по динамике обесцвечивания красителей MС и БЗ при УФ-излучении. Реакционные растворы готовили путем смешивания 15 мл раствора красителя (25 ppm) с 1 мл NPsCdS в чашках Петри (диаметр 90 мм) для получения конечной концентрации НЧ 0.5 мг/мл. Смесь диспергировали и помещали под ртутную лампу черного света HSBW 160W (SYLVANIA, Китай) мощностью 160 Вт и длиной волны излучения 365 нм. Расстояние от лампы до объекта составляло 30 см. Облучение проводили в течение 3 ч. В контрольных экспериментах облучали смеси 15 мл раствора красителей (25 ppm) и 1 мл воды в отсутствие NPsCdS. Эффективность фотодеколоризации МС и БЗ определяли по изменению ОП реакционных растворов до (С0) и каждый час в течение УФ-облучения (С) на фотоколориметре КФК‑3КМ при длине волны поглощения для МС 665 нм и БЗ 625 нм [30]. Эксперимент проводили в трех независимых повторах, результаты представляли в виде среднего значения ± стандартное отклонение.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Бактериальный синтез биогенных NPsCdS провели с использованием методики, разработанной нами на основе анализа представленных в литературе протоколов биосинтеза НЧ. Новизной данного метода стало исключение стадии отмывки бактериальных клеток от КЖ, содержащей белки и другие биомолекулы, секретируемые микроорганизмами во время культивирования. Это привело к увеличению выхода НЧ за счет повышения количества белка в реакционной смеси и возможности использования более концентрированных растворов солей Na2S и CdCl2 [25]. Кроме того, был проведен анализ эффективности биосинтеза НЧ в зависимости от фазы роста клеток и показано, что клетки, находящиеся в стационарной фазе, обеспечивают максимальный выход NPsCdS [26]. Концентрация NPsCdS/Shewanella, NPsCdS/Bacillus в образцах составляла 3–6 мг/мл.
Характеристика NPsCdS/Shewanella и NPsCdS/Bacillus
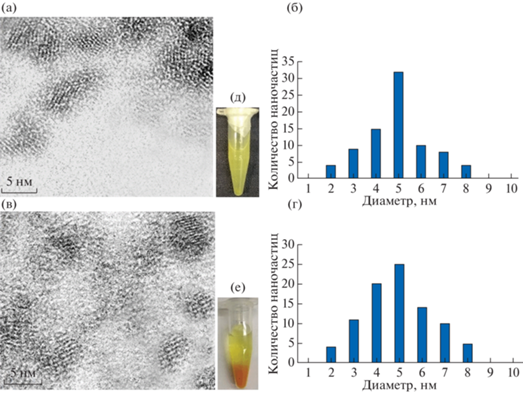
Форма, размер и элементный состав NPsCdS. На рис. 1 представлены ПЭМ-изображения NPsCdS/Shewanella (а) и NPsCdS/Bacillus (в) с формой, близкой к сферической, и четко различимыми кристаллическими решетками. Приведенные гистограммы распределения размеров NPsCdS позволили оценить их средний диаметр как 5 ± 1 нм (б, г). На рис. 1 представлены фотографии микропробирок “Eppendorf”, содержащих однородную коллоидную суспензию биогенных NPsCdS желтого цвета, полученных в присутствии бактерий (д), и контрольного раствора, содержащего плотный хлопьевидный осадок ярко-желтого цвета после химической реакции между Na2S и CdCl2 в среде LB без бактерий (е). Эти результаты доказывают возможность использования биологической субстанции, в данном случае микроорганизмов, для биосинтеза НЧ, устойчивых к агломерации в водной суспензии.
Рис. 1.
ПЭМ-изображение биогенных NPsCdS/Shewanella (а) и NPsCdS/Bacillus (в). Гистограмма распределения по размерам NPsCdS/Shewanella (б) и NPsCdS/Bacillus (г). Фотография водной суспензии биогенных NPsCdS (д) и агломерированных частиц CdS из контрольного эксперимента (е).
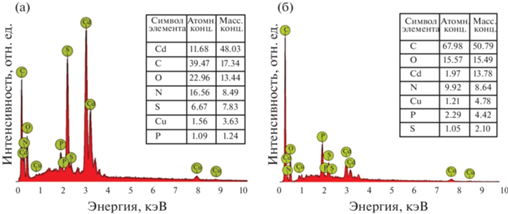
EDX-спектры NPsCdS/Bacillus и NPsCdS/Shewanella (рис. 2) показали наличие пиков кадмия и серы, что позволяет идентифицировать биосинтезированные нанокристаллы как NPsCdS. Углерод входит в состав биоорганического покрытия НЧ, как и кислород, что также подтверждает наличие биослоя, связанного с поверхностью биогенных NPsCdS. Пик меди относится к материалу медной подложки, использованной для проведения анализа.
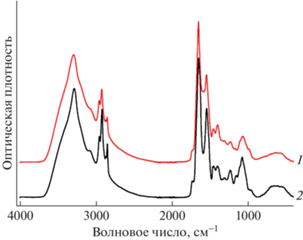
НЧ исследовали методом ИК-фурье-спектроскопии, что позволило получить информацию о функциональных группах в образцах. Как видно из рис. 3, образцы NPsCdS/Bacillus (1) и NPsCdS/Shewanella (2) имеют весьма схожие FTIR-спектры, на которых наблюдается ряд характеристических полос, типичных для азотсодержащих органических соединений белковой природы [31–34]. Так, широкая полоса поглощения в области 3600–3000 см–1 с максимумом при 3290 см–1 и плечом в области бóльших волновых чисел соответствует наложению полос валентных колебаний –O–H- и –N–H-связей (иногда эту полосу называют Амид А). Интенсивные полосы поглощения при 1652 и 1549 см–1 называют Амид I (валентное колебание С=О) и Амид II (деформационные колебания N–H и валентные C–N) соответственно, при этом полоса в области 3075 см–1 является обертоном полосы Амид II, полоса при 1313 см–1 – Амид III. Кроме того, присутствует дополнительная полоса поглощения при 1735 см–1, относящаяся к валентным колебаниям карбонильной группы в сложных эфирах. Пики в области 3000–2800 см–1 относятся к антисимметричным и симметричным валентным колебаниям связей С–Н в метиленовых (2922 и 2822 см–1) и метильных (2956 и 2872 см–1) группах, а в области 1470–1400 см–1 – к деформационным колебаниям связей С–Н. Пики в области 1150–1000 см–1 относятся к валентным колебаниям С–О- и С–О–С-фрагментов, на которые могут накладываться полосы валентных колебаний C–N алифатических аминов. Отметим, что в области ~720 см–1 полоса маятниковых колебаний метиленовых групп не наблюдается, что может свидетельствовать об отсутствии в образцах длинных линейных углеродных цепочек, а отсутствие полос поглощения в области 2200–2100 см–1 – об отсутствии в структуре синтезированных образцов связей C≡C и C≡N.
Анализ “белковой короны” NPsCdS
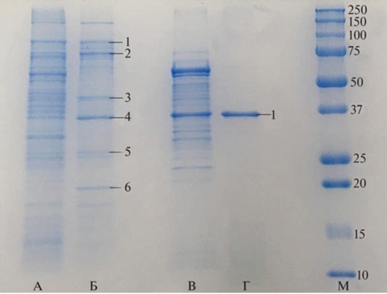
Анализ ММ белковых молекул, адсорбированных на поверхности NPsCdS/Shewanella и NPsCdS/Bacillus (метод SDS-ПААГ), показал принципиальное различие состава белковых слоев в зависимости от бактериального штамма (рис. 4). На электрофореграмме белков, выделенных из КЖ (треки A, В), и белков, экстрагированных с поверхности NPsCdS/Shewanella, NPsCdS/Bacillus (треки Б, Г), видно, что некоторые белки, присутствующие в КЖ, не были обнаружены в треках NPsCdS, т.е. существует селективность адсорбции белков из КЖ на наночастицах. Так, в КЖ S. oneidensis MR‑1 и B. subtilis 168 содержится большое количество белков в диапазоне ММ от 20 до 150 кДа (треки А, В). Однако на поверхности NPsCdS/Shewanella адсорбируется более 10 видов белковых молекул различной ММ (трек Б), а на NPsCdS/Bacillus адсорбируется только один белок, 35 кДа (трек Г). Ряд белков из интенсивно окрашенных полос электрофореграмм NPsCdS/Shewanella, NPsCdS/Bacillus идентифицировали методом MALDI/TOF/TOF, наименования белков представлены в подписи к рис. 4 [23]. Таким образом, состав белкового покрытия NPsCdS/Shewanella, NPsCdS/Bacillus индивидуален и определяется штаммом, используемым для их получения.
Рис. 4.
Электрофореграммы белков, выделенных из КЖ штаммов S. oneidensis MR-1 (трек A), B. subtilis 168 (трек В), и белков, экстрагированных с поверхности NPsCdS/Shewanella (трек Б), NPsCdS/Bacillus (трек Г). Трек М – маркеры ММ белка (кДа). Цифрами обозначены полосы с белками, идентифицированными методом MALDI-TOF/TOF. Трек Б: 1 – Arg R-регулируемый TonB-зависимый рецептор, 2 – TonB-зависимый рецептор сидерофора, 3 – порин внешней мембраны, 4 – порин внешней мембраны Omp35, 5 – флагеллин FliC, 6 – TonB-зависимый гем/гемоглобин рецептор; Трек Г: 1 – флагеллин.
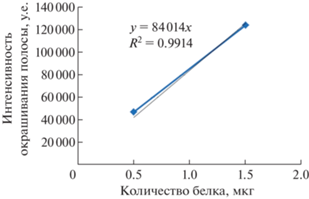
Количественная характеристика содержания белка, адсорбированного на поверхности биогенных NPsCdS. Для количественной оценки содержания белка в составе “белковой короны” NPsCdS/Shewanella, NPsCdS/Bacillus был применен метод денситометрического анализа электрофореграмм с помощью TotalLabPhoretix 1D. Наночастицы обоих типов, использованные в эксперименте, были уравнены по концентрации до 3.1 мг/мл. Белки с поверхности NPsCdS предварительно разделяли электрофоретически SDS-ПААГ-методом. Для подбора уравнения зависимости интенсивности прокрашивания полос белка в образцах от количества нанесенного белка использовали данные денситометрического анализа рибонуклеазы (рис. 5). Содержание белка в каждой выявленной полосе и суммарную величину содержания белка в треке электрофореграммы определяли, используя уравнение для калибровочной кривой и значения интенсивности окрашенных полос электрофореграммы (рис. 6, табл. 1).
Рис. 5.
Электрофореграмма белков, экстрагированных с поверхности NPsCdS/Shewanella, NPsCdS/Bacillus, для их количественного определения. Треки 1 и 2 – объемы суспензии NPsCdS/Bacillus 5 и 2.5 мкл соответственно, 3 и 4 – NPsCdS/Shewanella 5 и 2.5 мкл соответственно, 5 и 6 – объемы белка-стандарта рибонуклеазы 1.5 и 0.5 мкг соответственно; М – предокрашенные белковые маркеры (Fermentas, #SM0671).

Таблица 1.
Содержание белка, экстрагированного с поверхности NPsCdS/Bacillus, NPsCdS/Shewanella, в треках электрофореграммы
| Виды образцов | ||||||
|---|---|---|---|---|---|---|
| NPsCdS/Bacillus, мкл | NPsCdS/Shewanella, мкл | Белок-стандарт, мкг | ||||
| 5 | 2.5 | 5 | 2.5 | 1.5 | 0.5 | |
| Трек | 1 | 2 | 3 | 4 | 5 | 6 |
| Полоса | Интенсивность окрашивания полос в треках, у.е. | |||||
| 1 | 64 488.96 | 27 731.23 | 25 628.70 | 15 619.50 | 124 411.44 | 46 833.22 |
| 2 | 20 504.70 | 13 679.63 | ||||
| 3 | 35 002.74 | 20 896.70 | ||||
| 4 | 26 386.84 | 18 579.13 | ||||
| 5 | 97 442.50 | 61 267.70 | ||||
| 6 | 39 110.74 | 19 649.83 | ||||
| 7 | 12 124.50 | 4100.89 | ||||
| 8 | 32 495.25 | 14 155.08 | ||||
| 9 | 7412.71 | 4611.86 | ||||
| 10 | 33 852.25 | 18 219.35 | ||||
| 11 | 36 532.00 | 17 138.16 | ||||
| 12 | 28 318.20 | 13 235.48 | ||||
| 13 | 20 406.80 | 9643.25 | ||||
| 14 | 6776.38 | 7652.50 | ||||
| 15 | 17 754.42 | |||||
| Ʃ | 64 488.96 | 27 731.23 | 439 748.73 | 238 449.06 | 124 411.44 | 46 833.22 |
| Расчетное количество белка в треке, мкг | Количество белка в треке, мкг | |||||
| 0.77 | 0.33 | 5.23 | 2.84 | 1.5 | 0.5 | |
Установлено, что NPsCdS/Bacillus содержат 0.05 мг белка на 1 мг НЧ или 0.15 мг белка на 1 мл НЧ (табл. 1). В случае NPsCdS/Shewanella содержание белка составляет 0.34 мг белка на 1 мг НЧ или 1.05 мг белка на 1 мл НЧ. Определение количества белка на НЧ по Бредфорду коррелирует с данными денситометрического анализа электрофореграмм и составляет 0.046 мг/мл для NPsCdS/Bacillus и 0.31 мг/мл для NPsCdS/Shewanella.
Таким образом, содержание белка на поверхности NPsCdS/Shewanella составляет ~34% от общей массы НЧ, тогда как для NPsCdS/Bacillus ~5%. Соответственно, содержание CdS в 1 мг NPsCdS/Shewanella снижено на ~30% по сравнению с NPsCdS/Bacillus. Полученные данные хорошо согласуются с результатами EDX-исследования образцов суспензий NPsCdS/Bacillus и NPsCdS/Shewanella (рис. 2). Как видно из представленных EDX-спектров, содержание Cd значительно выше в образце NPsCdS/Bacillus (при одинаковой концентрации НЧ).
Биоцидная активность NPsCdS
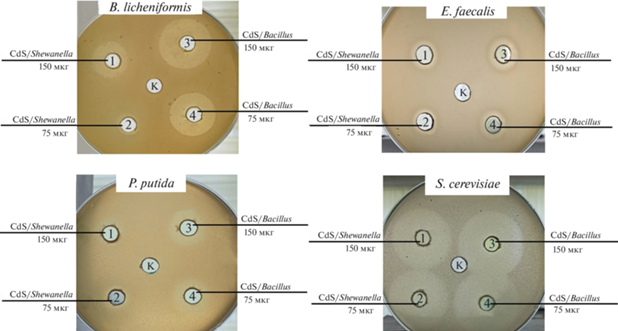
В качестве тест-штаммов использовали микроорганизмы, принадлежащие к различным таксономическим группам – бактерии грам(+) и грам(–) и дрожжевые культуры, которые различаются по строению клеточной стенки. В табл. 2 приведены результаты биоцидной активности образцов NPsCdS. Использовали НЧ обоих типов в концентрациях 3 и 1.5 мг/мл, т.е. количество NPsCdS, вносимых в лунку, соответствовало 150 и 75 мкг для каждого типа НЧ.
Таблица 2.
Биоцидная активность NPsCdS/Bacillus и NPsCdS/Shewanella
| Тест-культуры | NPsCdS и зоны ингибирования тест-культур (мм) | |||
|---|---|---|---|---|
| CdS/Bac. 150 мкг | CdS/Bac. 75 мкг | CdS/Shew. 150 мкг | CdS/Shew. 75 мкг | |
| Грам(+) бактерии | ||||
| B. licheniformis | 28 ± 1.5 | 24 ± 1.0 | 18 ± 1.0 | 12 ± 0.5 |
| E. faecalis | 15 ± 0.7 | 14 ± 0.7 | 12 ± 0.5 | 11 ± 0.5 |
| Грам(–) бактерии | ||||
| E. coli | 0 | 0 | 0 | 0 |
| P. putida | 16 ± 0.7 | 15 ± 0.5 | 12 ± 0.5 | 12 ± 0.5 |
| Дрожжи | ||||
| C. albicans | 11 ± 1.0 | 10 ± 1.0 | 0 | 0 |
| S. cerevisiae | 33 ± 1.5 | 31 ± 1.5 | 29 ± 1.5 | 27 ± 1.5 |
Показано, что все грам(+) бактерии были в разной степени чувствительны к действию НЧ обоих типов, тогда как среди грам(–) бактерий восприимчивой к ингибирующему воздействию NPsCdS оказалась только P. putida. При этом NPsCdS/Bacillus более эффективны как биоцидные агенты, чем NPsCdS/Shewanella. Максимальное ингибирование роста было показано в отношении дрожжей S. cerevisiae: зоны 33 ± 1.5 мм для NPsCdS/Bacillus и 29 ± 1.5 мм для NPsCdS/Shewanella (рис. 7, табл. 2). Интересный результат получен для условно-патогенного микроорганизма C. albicans, устойчивого к действию многих антибиотиков. Штамм оказался чувствителен к NPsCdS/Bacillus: 11 ± 1.0 мм, но устойчив к NPsCdS/Shewanella.
Механизмы ингибирующего действия NPsCdS на микроорганизмы различных таксономических групп связывают, как правило, с высвобождением из NPsCdS положительно заряженных токсичных ионов Cd2+. Грам(+) бактерии имеют в составе клеточных стенок слой пептидогликана, ковалентно связанного с отрицательно заряженными функциональными группами белка, которые электростатически взаимодействуют с Cd2+, что приводит к образованию активных форм кислорода (АФК) и разрушению клеток за счет окисления липидной мембраны [35–37]. Клеточная стенка грам(–) бактерий содержит слой липополисахаридов во внешней мембране, предотвращающий контакт клеток с различными объектами окружающей среды, что делает эту группу бактерий менее чувствительной к действию биоцидных агентов. Ингибирующее воздействие NPsCdS на грам(–) бактерии можно объяснить механизмом внутриклеточной генерации АФК, опосредованной высвобождаемыми из НЧ ионами Cd2+, которые нарушают проницаемость мембран и вызывают утечку белка, что приводит к гибели клеток [38]. Механизм биоцидной активности НЧ против дрожжевых культур обычно связывают с образованием АФК и свободных радикалов, генерируемых НЧ, что вызывает апоптоз, предотвращающий репликацию клеток и приводящий к их гибели.
Полученные EDX-методом результаты по содержанию CdS в наночастицах NPsCdS/Bacillus и NPsCdS/Shewanella показали значительное увеличение его доли в образцах NPsCdS/Bacillus (рис. 2а). Определение массовой доли белковой компоненты с помощью денситометрического анализа электрофореграмм показало, что NPsCdS/Shewanella содержат значительно больше белка в своем составе (до 30%) и за счет этого сниженное количество CdS. Можно предположить, что уменьшение доли CdS у NPsCdS/Shewanella приводит к снижению количества высвобождающихся активных ионов Cd2+, что в свою очередь снижает уровень антибактериальной активности NPsCdS/Shewanella за счет уменьшения образования АФК.
Определение МИК NPsCdS/Bacillus и NPsCdS/Shewanella проводили для B. licheniformis в более широком диапазоне концентраций НЧ (табл. 3). Исходные концентрации обоих типов NPsCdS составляли 5.8 мг/мл, т.е. с учетом объема вносимых образцов в лунки (50 мкл) количество вносимых NPsCdS составляло 290 мкг.
Таблица 3.
Минимальная ингибирующая концентрация NPsCdS/Bacillus и NPsCdS/Shewanella для роста тест-культуры B. licheniformis
| Разведение NPsCdS | Исходная суспензия | 1:10 | 1:50 | 1:100 |
|---|---|---|---|---|
| Количество NPsCdS в лунке, мкг | 290 | 29 | 5.8 | 2.9 |
| Наночастицы | Зоны ингибирования, мм | |||
| CdS/Bacillus | 32 ± 1.5 | 24 ± 1.0 | 12 ± 1.0 | 10 ± 0.5 |
| CdS/Shewanella | 31 ± 1.0 | 21 ± 1.5 | 11 ± 0.5 | нет |
Результаты, приведенные в табл. 3 и на рис. 8, показывают различие в эффективности ингибирования тест-культур биогенными NPsCdS, полученными с использованием различных штаммов бактерий. Так, МИК для NPsCdS/Bacillus составляет 2.9 мкг НЧ, тогда как для NPsCdS/Shewanella МИК составляет 5.8 мкг. Таким образом, МИК показывают различие между уровнями биоцидной активности NPsCdS, полученными с использованием разных штаммов и содержащих различные количества CdS.
Рис. 8.
Минимальная ингибирующая концентрация NPsCdS/Shewanella и NPsCdS/Bacillus, подавляющая рост тест-культуры B. licheniformis в LBA-среде.

Полученные результаты антимикробных свойств биогенных NPsCdS открывают возможность для их дальнейшего исследования в качестве бактерицидных средств нового поколения.
Фотокаталитическая активность NPsCdS/Shewanella, NPsCdS/Bacillus
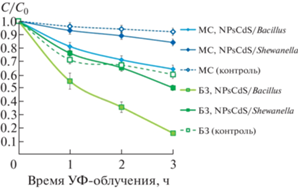
Фотокаталитические свойства биогенных NPsCdS исследовали на примере обесцвечивания органических красителей МС и БЗ, принадлежащих к тиазиновому и трифенилметановому семействам соответственно. В отсутствие NPsCdS деградация MС и БЗ при УФ-облучении составляла 8 и 40% соответственно, что указывает на различную устойчивость красителей к фотообесцвечиванию. Наличие биогенных NPsCdS в реакционных растворах вносило существенный вклад в эффективность фотообесцвечивания красителей. Присутствие NPsCdS/Shewanella привело к обесцвечиванию красителей MС и БЗ на 16 и 50% соответственно, а NPsCdS/Bacillus – на 36 и 84% (рис. 9). Следовательно, непосредственный вклад NPsCdS/Shewanella в обесцвечивание составляет 8% для МС и 10% для БЗ. Для NPsCdS/Bacillus этот параметр составляет 28% для МС и 44% для БЗ. Таким образом, NPsCdS/Bacillus оказались более эффективными биогенными фотонанокатализаторами, чем NPsCdS/Shewanella.
Рис. 9.
Эффективность фотообесцвечивания красителей метиленового синего (МС) и бриллиантового зеленого (БЗ) в присутствии NPsCdS/Shewanella и NPsCdS/Bacillus.
Установлено, что биогенные NPsCdS, полученные простым и малозатратным методом микробного синтеза, могут использоваться в экологических приложениях для деколоризации сточных вод промышленных предприятий.
ЗАКЛЮЧЕНИЕ
Биогенные NPsCdS обладают высоким потенциалом для применения во многих областях нано- и биотехнологии. NPsCdS были получены путем введения солей Na2S и CdCl2 в культуральные жидкости, содержащие бактериальные клетки S. oneidensis MR-1 и B. subtilis 168 в стационарной фазе роста. Биогенные NPsCdS/Shewanella и NPsCdS/Bacillus имели сферическую форму и средний размер 5 ± 1 нм. Показано наличие азотсодержащих органических соединений белковой природы на поверхности НЧ методом FTIR. Установлено влияние бактериальных штаммов на количественный и качественный состав белкового покрытия, а также на функциональную активность биогенного наноматериала в качестве биоцидных агентов и фотонанокатализаторов. Впервые проведена количественная оценка белков, адсорбированных на поверхности NPsCdS/Shewanella, NPsCdS/Bacillus. Установлено существенное различие концентрации белков в составе НЧ и показано, что содержание белка на поверхности NPsCdS/Shewanella примерно на 30% превышает этот показатель для NPsCdS/Bacillus. Определено содержание CdS в образцах с одинаковой концентрацией НЧ и показано, что в составе NPsCdS/Bacillus доля CdS значительно увеличена за счет снижения количества белка. Доказано принципиальное отличие в качественном составе “белковой короны”, сформированной на поверхности НЧ. Показано, что ингибирующее действие NPsCdS/Bacillus на рост широкого круга микроорганизмов, а также фотокаталитическое обесцвечивание синтетических красителей эффективнее, чем при использовании NPsCdS/Shewanella. Таким образом, установлено различие в уровне биоцидной и фотокаталитической активности NPsCdS в зависимости от использованного для их биосинтеза штамма. С целью получения НЧ с высокой функциональной активностью требуется выбор бактериальных штаммов, определяющих основные параметры биогенного наноматериала.
Авторы выражают благодарность Национальному биоресурсному центру Всероссийской коллекции промышленных микроорганизмов НИЦ “Курчатовский институт” за предоставление бактериальных и дрожжевых культур. Работа выполнена при частичном использовании оборудования Ресурсного центра оптической микроскопии и спектроскопии НИЦ “Курчатовский институт”.
Исследование выполнено в рамках государственного задания НИЦ “Курчатовский институт” № АААА-А20-120093090016-9.
Список литературы
Mahdi M.A., Hassan Z., Ng S.S. et al. // Thin Solid Films. 2012. V. 520. № 9. P. 3477. https://doi.org/10.1016/j.tsf.2011.12.059
Chandan H.R., Schiffman J.D., Balakrishna R.G. // SNB. 2018. V. 258. P. 1191. https://doi.org/10.1016/j.snb.2017.11.189
Senasu T., Hemavibool K., Nanan S. // RSC Adv. 2018. V. 8. № 40. P. 22592. https://doi.org/10.1039/C8RA02061B
Xaba T., Masinga B.W., Moloto M.J. // J. Nanomat. Biostr. 2016. V. 11. № 4. P. 1231.
Tripathi R.M., Gupta R.K., Shrivastav A. et al. // Adv. Nat. Sci: Nanosci. Nanotechnol. 2013. V. 4. № 3. P. 1. https://doi.org/10.1088/2043-6262/4/3/035005
Prasad R. Nanotechnology in the Life Sciences. Switzerland: Springer Nature Switzerland AG, 2019. 332 p. https://doi.org/10.1007/978-3-030-16383-9_3
Gour A., Jain N.K. // Artific. Cells. Nanomed. Biotech. 2019. V. 47. № 1. P. 844. https://doi.org/10.1080/21691401.2019.1577878
Dabhane H., Suresh G., Tambade P. et al. // Environ. Chem. Ecotoxic. 2021. V. 3. P. 209. https://doi.org/10.1016/j.enceco.2021.06.002
Alsaggaf M.S., Elbaz A.F., Badawy E.S. et al. // Adv. Polym. Tech. 2020. P. 1. https://doi.org/10.1155/2020/4909054
Durga B., Raziya S., Rajamahanti S.G. et al. // Der Pharma Chemica. 2017. V. 9. № 14. P. 157.
Munyai S., Hintsho-Mbita N.C. // Curr. Res. Green Sustainable Chem. 2021. V. 4. P. 1. https://doi.org/10.1016/j.crgsc.2021.100163
Fang X., Wang Y., Wang Z. et al. // Energies. 2019. V. 12. № 1. P. 190. https://doi.org/10.3390/en12010190
Feng Y., Marusak K.E., You L. et al. // COCIS. 2018. V. 38. P. 190. https://doi.org/10.1016/j.cocis.2018.11.002
Elsalam Abd S.S., Taha R.H., Tawfeik A.M. et al. // EJHM. 2018. V. 70. № 9. P. 1494. https://doi.org/10.12816/004467511
Raj R., Dalei K., Chakraborty J. et al. // J. Colloid. Inter. Sci. 2016. V. 462. P. 166. https://doi.org/10.1016/j.jcis.2015.10.004
Suresh A.K., Doktycz M.J., Wang W. et al. // Acta Biomat. 2011. V. 7. P. 4253. https://doi.org/10.1016/j.actbio.2011.07.007
Lin Z., Wu J., Xue R. et al. // Spectrochim. Acta. A. 2005. V. 61. № 4. P. 761. https://doi.org/10.1016/j.saa.2004.03.029
Spagnoletti F.N., Kronberg F., Spedalieri C. et al. // J. Environ. Manage. 2021. V. 297. 113434. https://doi.org/10.1016/j.jenvman.2021.113434
Lai W., Wang Q., Li L. et al. // Colloids Surf. B. 2017. V. 152. P. 317. https://doi.org/10.1016/j.colsurfb.2017.01.037
Quagliarini E., Santo Di R., Pozzi D. et al. // J. Sens. Int. 2020. V. 1. 100025. https://doi.org/10.1016/j.sintl.2020.100025
Digiacomo L., Giulimondi F., Pozzi D. et al. // J. Nanotheranostics. 2021. V. 2. № 2. P. 82. https://doi.org/10.3390/jnt2020006
Воейкова Т.А., Журавлева О.А., Булушова Н. В. и др. // Молекулярная генетика, микробиология и вирусология. 2017. Т. 35. № 4. С. 151. https://doi.org/10.18821/0208-0613-2017-35-4-151-156
Воейкова Т.А., Кожухова Е.И., Журавлева О.А. и др. // Российские нанотехнологии. 2020. Т. 15. № 2. С. 194. https://doi.org/10.1134/S199272232002020X
Маниатис Т.И., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. М.: Мир, 1984. 480 с.
Воейкова Т.А., Журавлева О.А., Грачева Т.С. и др. // Биотехнология. 2017. Т. 33. № 3. С. 38. https://doi.org/10.21519/0234-2758-2017-33-3-38-46
Журавлева О.А., Воейкова Т.А., Кулигин В.С. и др. // Журнал микробиологии, эпидемиологии и иммунобиологии. 2021. Т. 98. № 4. С. 416. https://doi.org/10.36233/0372-9311-89
Laemmli U.K. // Nature. 1970. V. 227. P. 680.
Bradford M.M. // Anal. Biochem. 1976. V. 72. P. 248.
Определение антимикробной активности антибиотиков методом диффузии в агар ОФС. 1.2.4.0010.18. М., 2018. 32 с.
Bhadwal A.S., Tripathi R.M., Gupta R.K. et al. // RSC Adv. 2014. V. 4. P. 9484. https://doi.org/10.1039/c3ra46221h
Sanghi R., Verma P.A. // Chem. Eng. J. 2009. V. 155. № 3. P. 886. https://doi.org/10.1016/j.cej.2009.08.006
Bai H.J., Zhang Z.M., Guo Y., Yang G.E. // Colloids Surf. B. 2009. V. 70. № 1. P. 142. https://doi.org/10.1016/j.colsurfb.2008.12.025
Tripathi R.M., Bhadwal A.S., Singh P. et al. // Adv. Nat. Sci. Nanosci. 2014. V. 5. № 2. 025006. https://doi.org/10.1088/2043-6262/5/2/025006
Chen G., Yi B., Zeng G. et al. // Colloids Surf. B. 2014. V. 117. P. 199. https://doi.org/10.1016/j.colsurfb.2014.02.027
Shivashankarappa A., Sanjay K.R. // Braz. J. Microbiol. 2020. V. 51. P. 939. https://doi.org/10.1007/s42770-020-00238-9
Nasrin T., Patra M., Escudey M. et al. // Microbial. Path. 2019. V. 135. P. 1. https://doi.org/10.1016/j.micpath.2019.103639
Hossain Sk.T., Mukherjee S.K. // J. Haz. Mat. 2013. V. 260. P. 1073. https://doi.org/10.1016/j.jhazmat.2013.07.005
Gahlawat G., Choudhury A.R. // RCS Adv. 2019. V. 9. P. 12944. https://doi.org/10.1039/C8RA10483B
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии